¿ Introducción
Los modelos animales para síndrome de intestino irritable (SII) son útiles para contrastar hipótesis de mecanismos fisiopatológicos subyacentes de dicha enfermedad en humanos1 y aunque la causa exacta del SII continúa siendo desconocida, la teoría que prevalece es que existen alteraciones del eje cerebro-intestino.2 Recientemente se han logrado avances significativos en la comprensión de dichos mecanismos fisiopatológicos.3 A través de los modelos animales, se pueden simular ciertas características clínicas, fisiopatológicas y de respuesta al tratamiento claves del SII,1 estudiarse bajo condiciones controladas e incluso generar nuevas hipótesis.4 Durante el proceso de construcción y desarrollo de un modelo experimental para SII deben tomarse en cuenta primordialmente los objetivos que se desean responder.1, 4 Por ejemplo, si el factor de estrés es agudo vs. crónico, psicológico vs. físico, nacimiento vs. vida adulta.5 Anteriormente, los estudios en roedores sólo se habían enfocado en los cambios transitorios durante las respuestas nociceptivas al estrés agudo experimental,6,7 demostrándose que la capacidad de un factor de estrés agudo para producir hiperalgesia visceral es dependiente del factor de estrés así como de la susceptibilidad individual, incluyendo aspectos genéticos y ambientales.1 Un factor de estrés agudo de tipo físico produce una respuesta inmediata pero transitoria7 mientras que un factor de estrés agudo de tipo psicológico produce una respuesta retardada hasta por 24 horas.8 Sin embargo, es bien conocido que el estrés crónico desencadena y exacerba los síntomas del SII9 e induce hiperalgesia visceral, componente fisiopatológico importante en los síntomas cardinales de este trastorno,10 por lo cual se requieren modelos animales que reproduzcan los procesos fisiopatológicos.
En cuanto a la evaluación de un modelo animal para SII, esta sigue una metodología rigurosa.1 No se valida el modelo animal como tal, sino la interpretación de la información que surge a partir del mismo.4 Los tipos de validez que deben cumplir los modelos animales para SII son los siguientes: 1. Validez de apariencia que es la similitud entre la sintomatología que presenta el modelo animal y el del SII en humanos; si bien el modelo no expresa el cuadro clínico completo, solo manifestará los síntomas cardinales;1,4 2. Validez predictiva, que evalúa la similitud farmacológica entre los medicamentos empleados, particularmente la habilidad para actuar sobre el síntoma cardinal, encontrando una respuesta en el modelo similar a los retos farmacológicos presentes en humanos;3,4 y 3. Validez de constructo, que es la similitud entre los mecanismos fisiopatológicos del modelo animal y del SII.1,4 Por su parte la validez interna es la replicación del modelo bajo las mismas condiciones iniciales y la validez externa es la generalización del modelo donde cambia alguna o varias de las variables independientes originales como ontogenia, cepa, lugar, condiciones de alojamiento, etc.4 Ningún modelo animal durante su evaluación cumplirá todas las validaciones descritas.1,4 Su validez se restringe al objetivo general para el cual se diseñó específicamente.4 Mayer y Collins1 revisaron los principales modelos animales para SII descritos en la literatura hasta el año 2002, los cuales fueron divididos con base en aquellos cuya base fisiopatológica primaria radicaba en el sistema nervioso central (estrés-memoria) o en el intestino (dolor y memoria inmunológica) y de acuerdo a la etapa perinatal o adulta. Con base en esta clasificación e incluyendo los más recientes modelos que han sido descritos, podemos enumerarlos de la siguiente forma: 1. Base fisiopatológica en el sistema nervioso central perinatal, como el estrés neonatal psicológico por separación materna;11 o de la vida adulta, tales como el trastorno por estrés post-traumático luego de choques eléctricos en las extremidades12, psicosocial13,14, evitación al agua;5 estrés crónico-agudizado.15 2. Base fisiopatológica intestinal perinatal por medio de hipersensibilidad visceral inducida por irritación mecánica o química del colon;16 de la vida adulta por medio de hipersensibilidad visceral mediante colitis inducida por ácido acético17 y el modelo de enteritis post-infecciosa por Trichinella spiralis.18-20 Se destaca el modelo de estrés por evitación al agua -Water Avoidance- (WA), que ha sido validado en ratas mediante el desarrollo de alteraciones tales como hipersensibilidad visceral y somática, motilidad del colon (número de evacuaciones), ansiedad y activación inmune del colon,5 en concordancia con lo observado en el SII y se ha utilizado para evaluar mecanismos de acción de nuevos medicamentos en este trastorno.5,21,22 Estudios en ratas han demostrado que inyecciones intraperitoneales del factor liberador de la corticotropina (CRF) actúan periféricamente estimulando la motilidad colónica a través de su receptor CRF-R1 y que la exposición al estrés por WA, produce un aumento significativo de la respuesta motora colónica distal.23 Este modelo presenta excelente validez de apariencia y de constructo para el SII5 y los hallazgos concuerdan con los estudios clínicos que reportan la aparición y exacerbación de la sintomatología gastrointestinal durante eventos de estrés crónico sostenido a lo largo de la vida cotidiana de los seres humanos.9
Un requisito indispensable para poder utilizar el modelo de WA en nuestro laboratorio, es determinar su validez externa. Por lo anterior, nuestros objetivos fueron generalizar el modelo de WA para SII determinando la validez externa sobre la motilidad colónica en ratas Wistar, así como comprobar la robustez de los resultados en cuanto al número de bolos fecales excretados en las ratas sometidas a WA y comparadas con controles. El protocolo fue aprobado por las Comisiones de Investigación y Etica de la División de Investigación de la Facultad de Medicina de la Universidad Nacional Autónoma de México (UNAM).
¿ Métodos
Animales: Veinte ratas-machos Wistar adultas maduras (11 meses) de 251 a 289 g de peso, provenientes del Bioterio del Departamento de Medicina Experimental de la Facultad de Medicina de la UNAM con cede en el Hospital General de México, fueron mantenidas durante diez días con ciclos de luz-oscuridad invertidos (12 horas c/u), agua y alimento ad libitum y fueron manipulados por un solo investigador (VRM). Para su bienestar se siguió la Norma Oficial Mexicana 062-ZOO-1999 para animales de laboratorio. Previo a cada experimento, se registró el peso de las ratas para detectar variaciones durante los 10 días de la intervención.5
Protocolo de estrés por WA: Posteriormente, diez ratas fueron expuestas a estrés crónico por WA, el cual consistió en colocar al animal en una plataforma elevada en el centro de un tanque lleno con agua (25°C), por una hora al día durante 10 días (Figura 1). Estas fueron comparadas con diez ratas expuestas al mismo procedimiento pero sin llenar el tanque con agua (controles). Inmediatamente al final de cada sesión (WA, controles), se contó el número de bolos fecales excretados como una estimación de la respuesta de la motilidad colónica a la regulación autonómica.23
¿ Figura 1. Fotografía de una rata en la plataforma central de una cubeta llena de agua (WA).
Análisis estadístico: Se realizó un análisis de varianza aplicando el modelo lineal general con medidas repetidas (MLGmr) mediante un diseño de dos factores: un factor fijo de dos niveles: WA y controles; además un factor anidado intra-sujetos correspondientes a los 10 días del experimento. El modelo fue ajustado empleando como covariable la calificación de componentes principales del peso de las ratas. Para el cálculo de la calificación del peso se empleó un análisis de componentes principales, resultando que con sólo el primer componente se explicaba 94% de la varianza de los pesos de las ratas.
La variable dependiente fue el número de bolos fecales excretados. Se estimó el promedio de bolos fecales para cada grupo y día. Los resultados se expresaron en promedio estimado con mínimos cuadrados ordinarios ± error estándar (EE) e intervalos de confianza de 95% (IC 95%). Se consideró estadísticamente significativo un valor de p < 0.05.
¿ Resultados
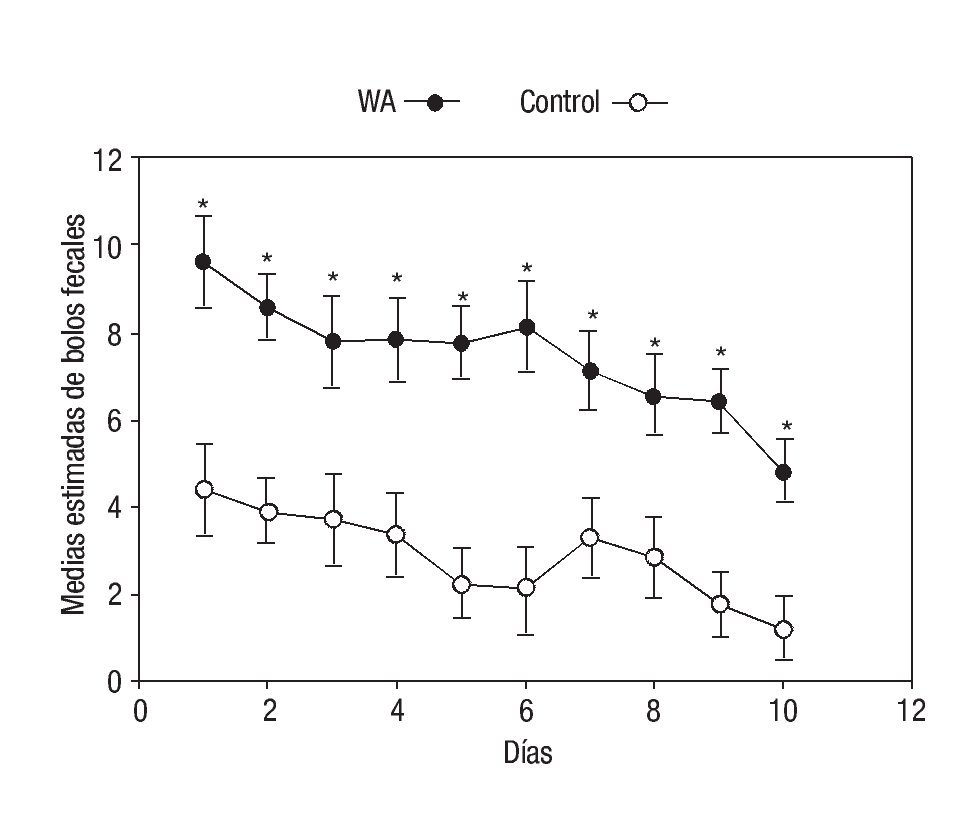
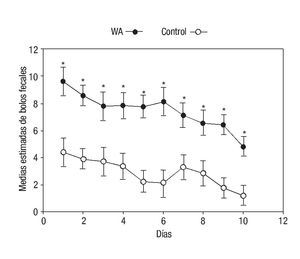
En el análisis de varianza del número de bolos fecales excretados con el MLGmr, las medias estimadas para el factor grupo WA vs. control fueron 7.46 ± 0.45 (6.51- 8.41) vs. 2.88 ± 0.45 (1.93-3.83), p < 0.001. En la Figura 2, se observa la variación diaria en el número de bolos fecales en ambos grupos. Las evacuaciones fueron máximas el primer día de exposición a la intervención, entrando en un periodo de estabilización entre el día tres y seis para luego disminuir progresivamente aproximadamente en un 50% en ambos grupos (Figura 1).
¿ Figura 2. Datos expresados como promedios obtenidos por mínimos cuadrados ordinarios ± error estándar. El modelo fue ajustado por el peso como covariable. (*Diferencias significativas para todos los días; Día 1: p = 0.003, Día 2: p <0.001, Día 3: p = 0.013, Día 4: p = 0.004, Día 5: p <0.001, Día 6: p = 0.001, Día 7: p = 0.008, Día 8: p = 0.011, Día 9: p <0.001, Día 10: p = 0.002).
En el contraste entre grupos WA y control se observó diferencias significativas en la comparación de promedios estimados por mínimos cuadrados de bolos fecales excretados por grupo, la diferencia entre los grupos WA-control fue de 4.59 ± 0.68 (3.25-5.93), p < 0.001.
El peso de las ratas no mostró tener influencia sobre el promedio de los bolos fecales (p = 0.83) por lo que no puede ser considerado una variable confusora en el experimento y no muestra interacción con los cambios de peso en el tiempo.
¿ Discusión
Nuestros resultados han demostrado que las ratas sometidas a estrés crónico por WA presentaron significativamente mayor número de evacuaciones que las ratas controles, resultados que se encuentran en concordancia con lo reportado previamente por Bradesi y colaboradores,5 demostrando así la validez externa del modelo.
El contraste entre grupos fue significativo mostrando que el efecto de las dos condiciones diseñadas, estrés crónico por WA y control, fueron muy diferentes. Deducimos que la diferencia en la excreción de bolos fecales en los dos grupos es debida principalmente al efecto del estrés crónico por WA y que el MLGmr no mostró interacción con la covariable peso, descartando así un efecto probable de la dieta sobre los resultados. Además se cumple validez de apariencia para SII. El modelo es consistente con los estudios clínicos que han mostrado que el estrés psicológico crónico lleva al desarrollo y/o exacerbación de la sintomatología del SII.9,10
Por otra parte, el número de bolos fecales excretados fue mayor durante el primer día en los dos grupos, lo que nos indica que además se encuentran implicados algunos otros factores, como por ejemplo la neofobia.24 En las ratas sometidas a WA el número de evacuaciones mantuvo una meseta bastante constante hasta el sexto día para luego disminuir. Las ratas estresadas tardan en adaptarse25 al estímulo sobre la respuesta motora colónica distal, aproximadamente seis días, pero finalmente terminan haciéndolo. Esto sugiere que además hay otros factores implicados en el desarrollo de la respuesta frente al estrés como puede ser la intensidad e inicio de la exposición al factor de estrés. De hecho, las ratas controles luego de haber superado la neofobia24 también disminuyeron la excreción de bolos fecales progresivamente durante los siguientes días. Sin embargo, está reportado en la literatura que la exposición al WA durante diez días induce hiperalgesia visceral persistente por al menos un mes.5
En nuestro estudio, tenemos ligeras diferencias con lo reportado por Bradesi y colaboradores,5 principalmente en cuanto al número de evacuaciones. Por un lado nosotros encontramos un mayor número de evacuaciones inicialmente y por otra parte la disminución de los bolos fecales entre el primer y último día fue aproximadamente de 30% en el estudio de Bradesi5vs. ~50% en el nuestro. Adicionalmente, en nuestro estudio hemos reportado la variación diaria en las evacuaciones mientras que Bradesi y colaboradores,5 sólo reportaron los datos de los días uno y 10. Estas variaciones se pueden explicar tal vez por las diferentes condiciones ambientales, el tipo de alimentación, la validez interna del modelo con ratas adultas jóvenes mientras que en nuestro estudio utilizamos adultas maduras; además de que el periodo de habituación fue mucho más largo en nuestro estudio, diez vs. tres días.5
Finalmente, el peso de las ratas, se mantuvo estable en la presente investigación independientemente de si fueron sometidas o no a WA, hallazgo similar al reportado por Bradesi y colaboradores,5 lo cual indica que este no es un factor en las diferencias en el número de bolos fecales excretados.
En conclusión, hemos logrado adaptar el modelo de WA a las condiciones ambientales propias de nuestro laboratorio, además de utilizar un modelo de análisis estadístico mucho más estricto26 que el empleado previamente durante la validación de este modelo.5 Nuestros resultados son muy robustos principalmente en lo referente al incremento significativo de los bolos fecales, lo que indica un aumento en la motilidad colónica distal por efecto del estrés crónico. Por lo tanto podemos concluir que la exposición de ratas Wistar a estrés crónico con WA tiene validez externa como modelo experimental para el estudio del SII y nuestros hallazgos en cuanto al número de bolos fecales presentan validez de apariencia ya que concuerdan con el desarrollo de SII inducido por estrés crónico en humanos.9 El modelo es óptimo para estudios de investigación sobre dicho trastorno.
¿ Declaraciones/Reconocimientos
Los datos del presente estudio fueron presentados como Cartel Distinguido durante la Semana Nacional de Gastroenterología en Acapulco, el 15 de Noviembre de 2010. Asimismo fueron publicados en forma de resumen en la Rev. Gastroenterol. Méx. 2010;75(Supl.2):321.
Correspondencia: Max Schmulson, MD.
Profesor Titular de Medicina. Laboratorio de Hígado, Páncreas y Motilidad (HIPAM), Departamento de Medicina Experimental, Facultad de Medicina, Universidad Nacional Autónoma de México (UNAM). Hospital General de México. Dr. Balmis N°148. Col. Doctores C.P.06726. México D.F., México.
Teléfono: 52 55 5623 2673, Fax: 52 55 5623 2669.
Correo electrónico: maxjulio@prodigy.net.mx.
Recibido el 21 de septiembre de 2010;
aceptado el 12 de octubre de 2010.