¿ Introducción
Según la Organización Mundial de la Salud, el adenocarcinoma gástrico (ACG) ocupa el cuarto lugar en cuanto a incidencia de cáncer a nivel mundial y constituye la segunda causa más frecuente de muerte por cáncer en el mundo (10,4%).1 El adenocarcinoma gástrico constituye más de 90% de todos los tumores malignos del estómago2 y presenta una gran variabilidad geográfica, describiéndose las mayores tasas en Oriente, en Centroamérica y Europa del Este.1
La incidencia y mortalidad está disminuyendo, especialmente en la mayoría de los países desarrollados, debido en parte al control de ciertos factores de riesgo dietéticos así como la mejor conservación de los alimentos.3 No obstante, se está observando en los últimos años un aumento en el grupo de menor y mayor edad, siendo más marcado en hombres que en mujeres.4 La proporción de pacientes menores de 36 años diagnosticados de esta entidad varía entre 2% y 6% y se ha relacionado frecuentemente con un peor pronóstico, debido en parte a un retraso en el diagnóstico y a un curso más agresivo de la enfermedad.5
El objetivo de nuestro estudio fue evaluar los factores clínicos, histológicos y pronósticos en pacientes menores de 35 años y compararlo con los rasgos que presentan en pacientes mayores de 75 años.
¿ Métodos
Se recabaron en forma retrospectiva los pacientes con diagnóstico histológico de adenocarcinoma gástrico menores de 35 años y mayores de 75 años en el periodo comprendido entre enero de 1993 y diciembre del 2008, excluyendo aquellos con otro tipo de neoplasia gástrica (linfoma, carcinoide, tumores del estroma) así como los pacientes menores de 18 años. Fueron incluidos en una base de datos donde se analizaron y compararon las características demográficas, clínicas, histológicas y pronósticas.
Definición de las variables:
1. Variables clínicas:
Dispepsia: dolor o malestar predominante en hemiabdomen superior central relacionado o no con la ingesta de alimentos. A menudo hay síntomas que la acompañan que incluyen plenitud, distención o saciedad precoz.
Hemorragia digestiva alta: presencia de hematemesis o melenas.
Disfagia: dificultad para la deglución.
* Síndrome anémico: conjunto de síntomas debido a la disminución de la masa eritrocitaria y de la hemoglobina circulante en el organismo que se puede manifiestar como fatiga, disnea de esfuerzo, cefalea, aturdimiento, tinnitus, síncope, alteración del sueño y disminución de la capacidad de concentración.
Masa abdominal: palpación de elemento de ocupación profunda en abdomen no relacionada con organomegalias.
2. Variables morfológicas:
Tipo macroscópico:
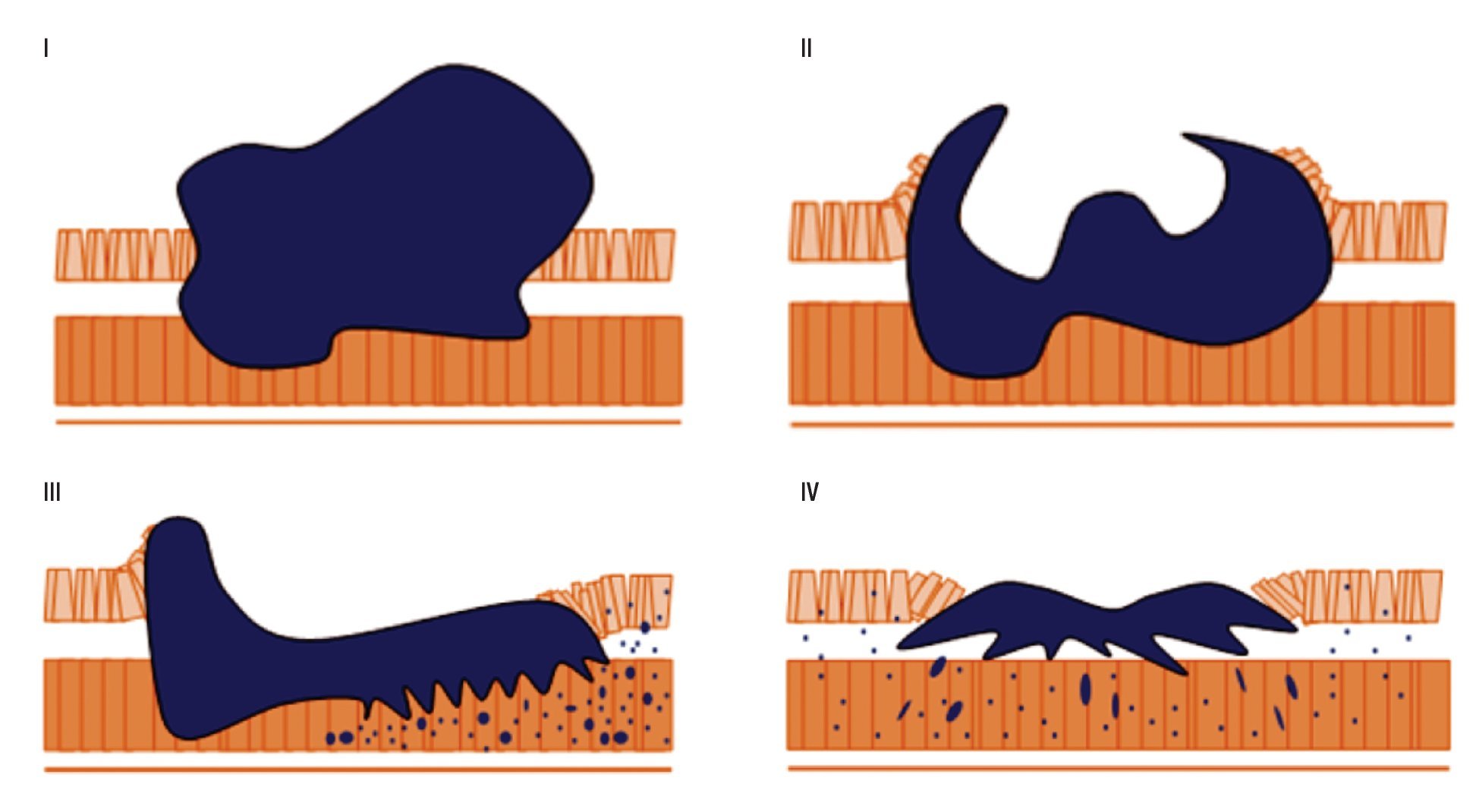
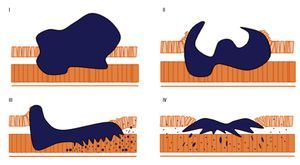
Según la clasificación adaptada a la clásica de Bormann por la Organización Mundial de Endoscopia Digestiva (Figura 1).
¿ Figura 1. Representación de la clasificación macroscópica del Adenocarcinoma Gástrico propuesta por Borrmann.
Tipo I. Cáncer polipoideo: tumores proliferantes exofíticos con morfología polipoide, no ulcerada y, generalmente, de superficie irregular. Tipo II. Cáncer Ulceriforme: lesión en forma de disco, circunscrita, con márgenes netamente definidos y ulceración Tipo III. Cáncer vegetante: generalmente ulcerado, tumores extendidos, irregulares y con los márgenes indefinidos. Presentan ulceraciones abigarradas y la base suele estar infiltrada por el tumor.
Tipo IV. Cáncer infiltrante o linitis plástica: lesión difusa e infiltrante que presenta un crecimiento en profundidad, pudiendo permanecer la mucosa intacta o con los pliegues distorsionados. Esto se traduce en una pared gástrica poco distensible al insuflar aire y con escasa peristalsis durante la exploración.
Tipo V. Cáncer inclasificable: morfología no encasillable en ninguna de las anteriores categorías.
Tipo Histológico:
Según la clasificación de Lauren:
Intestinal: se caracteriza por la formación de estructuras tubulares que recuerdan a las glándulas intestinales.
Difuso: se caracteriza por no formar estructuras tubulares sino nidos de células malignas junto a tejido inflamatorio.
Indiferenciado: no se puede clasificar en ninguno de los tipos anteriores.
3. Estadio tumoral
Se utiliza la clasificación TNM de la American Joint Commitee on Cancer (AJCC), aprobada en Seúl en 1997 y con modificaciones posteriores6 en las que "T" (tumor), define la profundidad de la invasión tumoral en la pared gástrica; "N" el número de ganglios implicados y "M" la presencia de metástasis a distancia.
Análisis estadístico: Se diseñó una base de datos con el programa Microsoft Excel versión 2003, para la recolección de los datos. Dicha base fue depurada convenientemente antes de la realización del análisis. Para el análisis estadístico se empleó el paquete informático SPSS para Windows versión 11.0 en español. Las variables cualitativas se expresaron en porcentajes, y las variables cuantitativas en media y desviación estándar. Se realizó un análisis univariante utilizando la prueba de Ji cuadrada y el prueba exacta de Fisher para comparar variables cualitativas, considerando significativos valores de p < 0.05.
¿ Resultados
En el periodo comprendido en el estudio, se documentó un total de 1536 casos de adenocarcinoma gástrico, de los cuales 30, fueron menores de 35 años y 458 mayores de 75 años.
La media de edad en el grupo de jóvenes fue de 31 años mientras que en el grupo de mayores, fue de 80 años. En los menores de 35 años hubo prácticamente la misma distribución por sexos (53% hombres y 47% mujeres) mientras que entre los mayores de 75 años se observó un predomino de mujeres (61%).
En el análisis descriptivo de pacientes menores de 35 años, seis eran de nacionalidad extranjera (20%), cinco de América del sur y uno de África. Cuatro (13.3%) referían antecedentes familiares de cáncer gástrico y cinco (16.7%) eran fumadores. Entre los que se obtuvo el grupo sanguíneo, predominó el tipo A+ (61.5%), seguido del O+ (13.15%) y B+ (3.3%). El tiempo transcurrido entre el inicio de los síntomas y el diagnóstico fue variable, predominando un periodo menor de tres meses (52.9%).
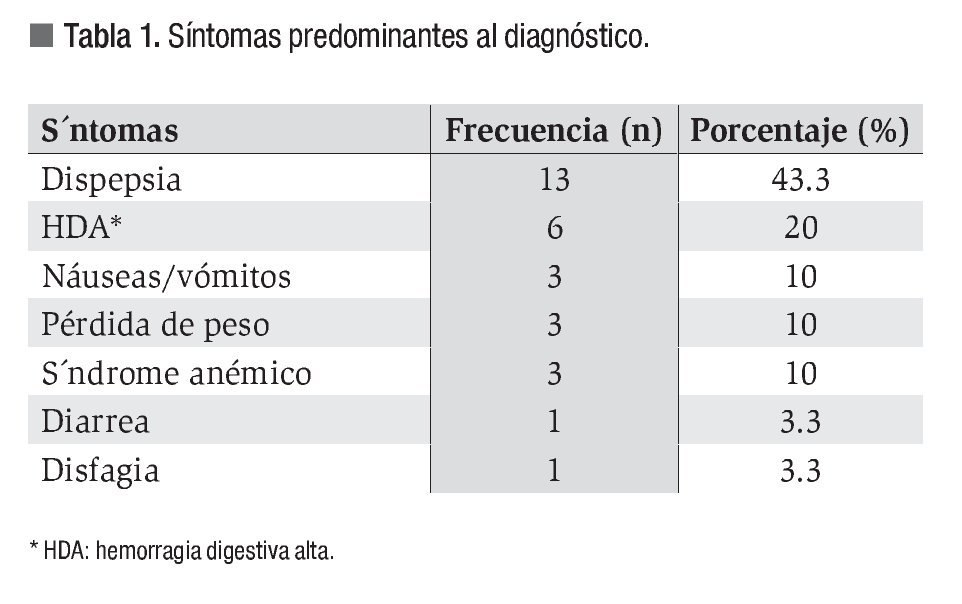
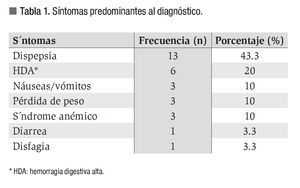
El síntoma más frecuente fue la dispepsia (43.3%), seguido de la presencia de hemorragia digestiva alta (20%). Tres pacientes debutaron con melena, dos con hematemesis y uno de ellos con rectorragia debido a un tránsito rápido (Tabla 1). Lo más frecuente fue una exploración física normal (73.3%), aunque en algunos pacientes se encontraron con palidez y dolor a la palpación (19 y 6.7% respectivamente), así como la palpación de adenopatías, hepatoesplenomegalia o masa abdominal (3.3%). Sólo se determinó la presencia del Helicobacter pylori (Hp) en diez pacientes y fue positiva en cinco.
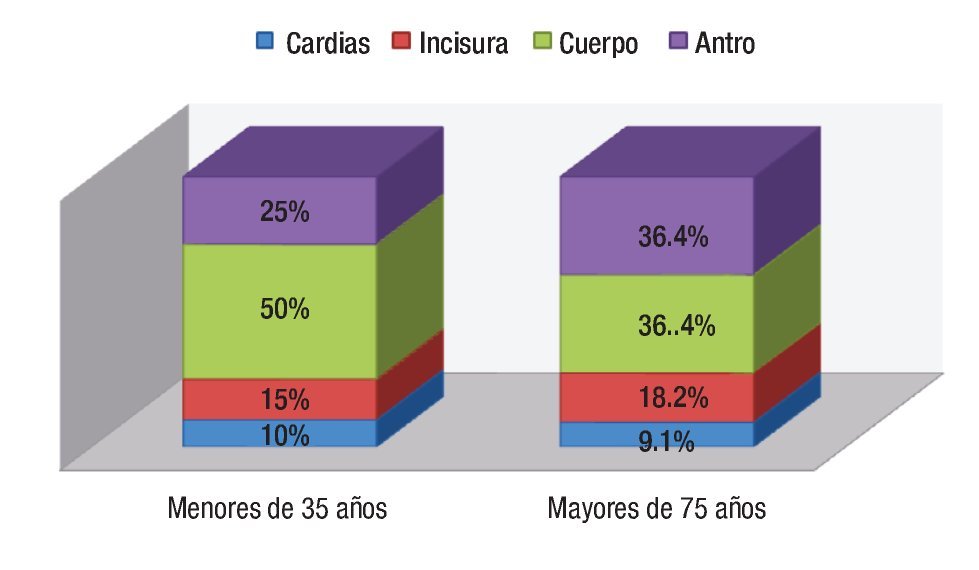
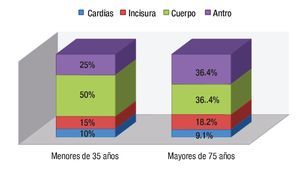
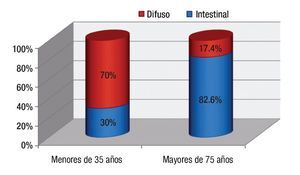
Al comparar los hallazgos endoscópicos en el grupo de jóvenes y mayores, se observó que el cuerpo gástrico fue la localización predominante en ambos (50% y 36.4% respectivamente), mientras que el más infrecuente es el cardias (Figura 2). Cuando se hizo una recodificación de las variables de la localización distinguiendo el antro del resto de localizaciones, se obtuvo que un 25% de los jóvenes y un 36.4% de los mayores, presentó localización antral (p = 0.5). En los dos grupos, el tipo macroscópico mayoritario fue el tipo II o ulceriforme mientras que el menos frecuente es el tipo I o polipoideo. La distribución histológica fue claramente diferente: en menores de 35 años un 70% presentaba el tipo difuso que solo se observó en un 17.4 % de los mayores de 75 años (Figura 3).
¿ Figura 2. Localización del adenocarcinoma gástrico según la edad.
¿ Figura 3. Tipo histológico según la edad.
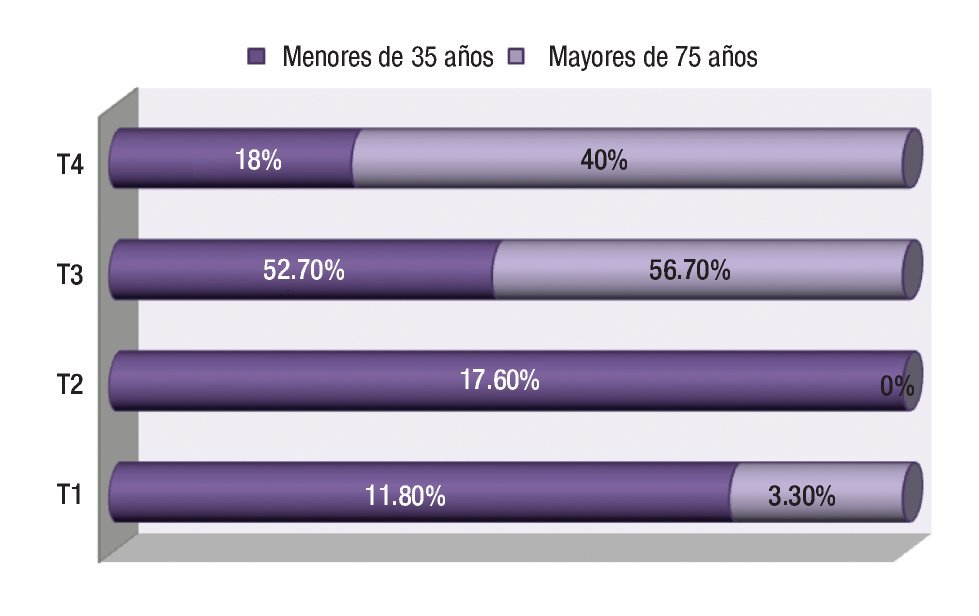
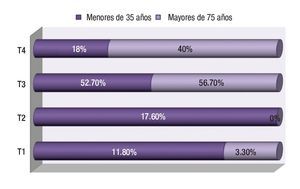
Con respecto a la profundidad de la invasión tumoral al diagnóstico, tanto en el grupo de jóvenes como en el de mayores, el más frecuente fue el T3 (52.9 y 56.7% respectivamente) seguido del T2 y T4 en menores de 35 años y T4 en mayores de 75 años (Figura 4). La afectación ganglionar fue más frecuente en los mayores que en los jóvenes (76.9% vs. 64.7%; p = 0.492).
¿ Figura 4. Estadio tumoral según la edad.
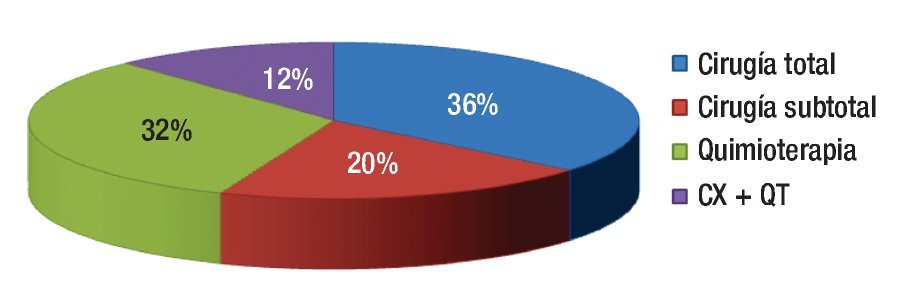
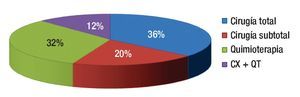
Finalmente, entre los pacientes menores de 35 años, 68% se pudo beneficiar de la cirugía (asociada o no a quimioterapia adyuvante) mientras que el resto de los jóvenes sólo recibió tratamiento quimioterápico (Figura 5).
¿ Figura 5. Tratamiento llevado a cabo en pacientes menores de 35 años. (CX+ QT: cirugía con quimioterapia adyuvante).
¿ Discusión
El adenocarcinoma gástrico en pacientes jóvenes es una entidad rara, descrita por primera vez hace más de 60 años por McNeer.7 Desde entonces ha sido objeto de varias revisiones que han intentado describir diferencias en las características clínicopatológicas así como en el pronóstico entre las edades extremas de la vida.
En nuestro estudio, hemos considerado el umbral por debajo de los 36 años porque el riesgo de metaplasia a displasia y los cambios de la mucosa gástrica comienzan a partir de los 30 o 35 años. Sin embargo, la mayoría de los estudios publicados en la bibliografía considera el grupo de jóvenes como menores de 40 años para aumentar el tamaño de la muestra, pues se estima una proporción de adenocarcinoma gástrico por debajo de esta edad en torno a 6% u 8% del total de adenocarcinomas y sólo 2% a 6% si se define el grupo de jóvenes como menores de 36 años.4
En nuestro estudio, cuando analizamos la variable de género obtenemos una proporción similar de hombres y mujeres en el grupo de jóvenes mientras que hay un ligero predominio de mujeres en el grupo de mayores, a diferencia de otros estudios que recogen un predominio de mujeres en el grupo de menor edad, atribuyendo incluso estas diferencias a factores hormonales.8,9
De la muestra de menores de 35 años, 20 % son de nacionalidad extranjera, lo cual constituye una proporción importante si se toma en cuenta lo pequeño de la muestra; no obstante, hay que tener en cuenta otros factores como el aumento de población inmigrante en el área y su posible repercusión en la prevalencia de esta enfermedad.
Una historia familiar de adenocarcinoma gástrico fue referida en 13.3% sin poder establecer un patrón de herencia específico. Aunque algunos autores han sugerido un patrón de herencia autosómico dominante;10 la mayoría apoyan una etiología multifactorial que implica una interacción entre la predisposición genética y los factores ambientales. En un estudio realizado en gemelos escandinavos se encontró que el riesgo relativo de desarrollar cáncer gástrico es de 9.9 para los gemelos monocigotos y de 6.6 para los gemelos dicigotos, lo que pone de manifiesto la influencia de ambos factores en el desarrollo del cáncer gástrico.11 No obstante, los individuos con un familiar de primer grado con cáncer gástrico, tiene un riesgo de desarrollar el mismo dos o tres veces superior al del resto de la población, presentando mayor tendencia a padecer la forma difusa y en edades más tempranas.12
El síntoma de presentación predominante en los pacientes recopilados fue la dispepsia. Existen evidencias de que la ausencia de signos de alarma en pacientes jóvenes con dispepsia es un indicador fiable de que no existen procesos malignos.13 El valor de estos signos como tamizaje en pacientes asintomáticos, continúa siendo discutido. En países con alta incidencia de cáncer gástrico, como Japón, una búsqueda sistemática ha aumentado la proporción de cáncer gástrico diagnosticado en estadios precoces con un pronóstico excelente; esta detección precoz fue introducida en la década de los 60 para individuos mayores de 40 años y consiste en una mínima historia clínica junto con un estudio baritado, realizando gastroscopia sólo si se evidencia alguna anomalía.14 Sin embargo, en países de baja incidencia, esta estrategia es controvertida15 pues para que un programa de cribado sea efectivo debe cumplir, entre otras características, que la enfermedad sea común y grave en la población.
En el presente trabajo destaca la alta proporción de tumores gástricos que fueron diagnosticados a raíz de una hemorragia digestiva alta. La presencia en nuestro hospital de una unidad específica de hemorragia digestiva, hace que la proporción de pacientes que debutaron con estos síntomas fuera mayor que en otras series. La forma de hemorragia digestiva fue en la mayoría como melenas; sin embargo en un paciente debutó como rectorragia debido a una hemorragia masiva con tránsito rápido. En casi todos ellos se pudo realizar intervención quirúrgica, pues sólo en uno de ellos el tumor estaba en estadio avanzado (T4). La posibilidad de realizar endoscopia de forma precoz (en las primeras 12 a 24 horas) permitió llegar al diagnóstico de forma rápida y la colaboración mediante un equipo multidisciplinar aplicar las medidas terapéuticas necesarias.
En nuestro estudio sólo se constata pérdida de peso importante en 10%, en parte debido a la relativa precocidad del diagnóstico desde el comienzo de los síntomas. Gran parte de la muestra fue diagnosticada en un periodo menor de tres meses, lo que puede ser atribuido al gran volumen de endoscopias que se realizan en nuestro medio (una media en los últimos ocho años de 7652 anuales) y a la derivación para la realización de gastroscopia, cada vez más frecuente, por parte del médico de atención primaria o especialista. Tamura y Curtiss16 encontraron que una duración corta de los síntomas se relacionaba con un pobre pronóstico, sin embargo esta asociación no ha sido demostrada en pacientes mayores17 ni en jóvenes18 por otros autores.
El adenocarcinoma gástrico, en especial el tipo difuso, se ha asociado con el grupo sanguíneo A, en probable relación a la proximidad de los genes implicados.19 Aunque también es el que predomina en nuestra muestra, hay que tener en cuenta que este grupo sanguíneo es el más frecuente en nuestra área de trabajo.
En cuanto al comportamiento endoscópico de estos tumores, macroscópicamente hay un claro predominio del tipo II en el grupo de jóvenes, que, aunque sea también el que predomine en el grupo de mayores, en este último se comportan de forma más dispersa. Si bien la clasificación macroscópica (análoga a la de Borrmann) tiene relevancia clínica en el cáncer gástrico precoz, pues ayuda a decidir sobre la posibilidad de terapéutica endoscópica mediante mucosectomía, en el cáncer gástrico avanzado, esta clasificación sólo tiene valor descriptivo y no orienta sobre el pronóstico ni el tratamiento. La proporción de tumores infiltrativos es ligeramente mayor en los pacientes menores de 35 años. Aunque esta diferencia no llega a ser estadísticamente significativa, es importante pues este tipo de tumores suele tener un crecimiento en profundidad y se asocian con mayor frecuencia a diseminación peritoneal y por lo tanto a peor pronóstico. Más interés tiene evaluar la localización exacta durante la endoscopia del tumor gástrico, pues el esófago o el duodeno pueden afectarse por contigüidad si está localizado en cardias o antro respectivamente. En nuestro estudio no se encontraron diferencias estadísticamente significativas y, cuando se hace una recodificación de las variables se comprueba que la localización antral es ligeramente más frecuente en el grupo de mayores, sin alcanzar tampoco significancia estadística. En algunas series se describe como factor pronóstico favorable la localización distal, principalmente relacionado con la mayor tasa de tumores bien diferenciados. Estos resultados difieren a los obtenidos en otros estudios, donde la localización antral es claramente predominante en mayores.5,20,21 La razón de que predomine en cuerpo, especialmente en jóvenes, puede deberse al mayor predominio del tipo histológico difuso, que tiende a localizarse en cuerpo (sobretodo fundus) a diferencia del intestinal, que suele localizarse en antro.
Este claro predominio del tipo difuso en los pacientes menores de 35 años, que también ha documentado en otras series,5,18,22,23 tiene especial relevancia en cuanto al comportamiento y pronóstico. El tipo difuso de Lauren se caracteriza por ser un tumor menos diferenciado y con un patrón de crecimiento infiltrativo a diferencia del intestinal que crece formando nódulos con amplios frentes cohesivos. Esto hace que la extensión en profundidad del tipo difuso sea mayor y sus tasas de supervivencia a cinco años sean menores (16%) que en el intestinal (26%), lo que podría apoyar el pobre pronóstico el carcinoma gástrico en pacientes jóvenes.
Con respecto a la presencia de Hp, sólo estaba reflejada en 10 muestras histológicas de pacientes menores de 35 años, lo que hace que los resultados no puedan ser valorables. Se ha descrito una asociación entre el desarrollo de cáncer gástrico en jóvenes y la infección por Hp, pudiendo jugar la gastritis un papel importante en la patogenia de estos tumores.24 Así mismo, se ha encontrado en pacientes de familiares con cáncer gástrico alta incidencia de pangastritis y una alta densidad de folículos linfoides asociados con infección por Hp.25 Como la historia familiar de cáncer gástrico se asocia a un mayor riesgo de desarrollar cáncer, la caracterización del patrón histológico de gastritis podría ser aplicable al cribado, especialmente en poblaciones jóvenes con riesgo.
Aunque la presencia de ganglios positivos fue mayor en pacientes mayores de 75 años, esta diferencia no alcanzó significancia estadística. La afectación ganglionar es importante porque constituye un factor pronóstico, de tal forma que algunos autores defienden una disminución de la supervivencia si el número de ganglios invadidos es superior a cuatro. Sin embargo el factor pronóstico más importante es el grado de invasión tumoral así como la posibilidad de resección curativa. Al igual que en estudios previos, la distribución del estadiaje fue bastante similar entre ambos grupos, predominando en ambos el estadio T3, si bien en el grupo de mayores hay mayor porcentaje con estadio T4 y menos con el estadio T1. Algunos estudios han concluido que el mismo estadio en jóvenes y mayores tiene el mismo pronóstico y que lo que realmente va a determinar la supervivencia es la posibilidad de realizar resección curativa.25-29 En nuestro estudio, si bien predomina el grupo de pacientes que se pudieron beneficiar de la cirugía (ya fuera total o subtotal), destaca la alta proporción en los que se administró exclusivamente quimioterapia. Esto es importante, pues a pesar de la aparente precocidad del diagnóstico, poco intervalo entre el inicio de los síntomas y el diagnóstico, muchos llegan en un estadio en el que ya no es posible la resección quirúrgica, lo cual influye directamente en la supervivencia. Esto nos lleva a inferir que muchos de estos tumores cursan de forma asintomática y cuando dan síntomas ya se encuentran en un estadio avanzado que impide tratamiento curativo. En la literatura, la supervivencia tras gastrectomía con intención curativa en pacientes menores de 45 años es mayor que los que superan dicha edad sin embargo no hubo diferencias cuando la resección fue paliativa o no había afectación ganglionar. Así mismo no se encontraron diferencias entre ambos grupos cuando se compara el mismo estadio.30 Otro dato de interés es el bajo porcentaje en el que se aplicó quimioterapia adyuvante pues en un análisis multivariante de un estudio de 83 pacientes menores de 40 años, se consideró a la ausencia de quimioterapia adyuvante como factor de mal pronóstico.31
En conclusión, el adenocarcinoma gástrico en pacientes menores de 35 años constituye una entidad poco frecuente en nuestro medio. El factor pronóstico más importante es el estadio tumoral ya que determina la actitud terapéutica. En estos pacientes la mayoría se encuentran en un estado tumoral avanzado en el momento del diagnóstico, similar al de los mayores, lo que empeora el pronóstico. Esto puede deberse en parte al predominio del tipo histológico difuso, con mayor crecimiento en profundidad, y al retraso en el diagnóstico. Por eso, la realización de una gastroscopia en pacientes con síntomas dispépticos que no mejoran con el tratamiento convencional puede favorecer un diagnóstico precoz que permita un tratamiento con intención curativa y una mejora de la supervivencia.
Correspondencia: Luisa Adán Merino.
Gran vía del Este 80 28031 - Madrid, España.
Correo electrónico: luisaadan@gmail.com
Recibido el 18 de mayo de 2010;
aceptado el 14 de junio de 2010.