¿ Introducción
La Enfermedad de Chagas (ECh), o tripanosomiasis americana, es una zoonosis parasitaria causada por Trypanosoma cruzi que afecta a millones de personas en Latinoamérica.1 La ECh puede adquirirse en edad tempranas y existen descritas zonas endémicas en al menos 21 países de Latinoamérica, principalmente en las áreas rurales con altos índices de pobreza.1-4 Sin embargo, en las últimas décadas, debido a los diversos fenómenos masivos de migración se han registrado casos en áreas urbanas e incluso en países no endémicos.5,6 En nuestro país existen zonas endémicas para esta parasitosis como Chiapas, Oaxaca, Hidalgo y Veracruz.7 Específicamente en este último estado la seroprevalencia reportada en la población general es de 2.8%.8
La historia natural de la ECh se divide en tres etapas: aguda, crónica -asintomática (o indeterminada) y la etapa crónica -determinada (o final).4,9 La etapa crónica asintomática o indeterminada se define como la ausencia de alteraciones cardiacas o digestivas detectadas por electrocardiograma o radiología convencional, con duración estimada de 20 a 30 años. Aunque la mayoría de los sujetos (aproximadamente 70%) con ECh se mantienen asintomáticos, hasta 30% desarrollará complicaciones tardías como afección cardíaca y gastrointestinal.10 El megaesófago y el megacolon son las manifestaciones digestivas más comunes y expresivas de la fase crónica determinada de la EC.11,12 La patogenia de la disfunción y de la dilatación de los segmentos de tracto digestivo se basa en la denervación de las complejas redes de neuronas intramurales.13-15 Los mecanismos determinantes de la lesión degenerativa de las neuronas e incluso la destrucción total en las vísceras del tracto digestivo de los pacientes con EC no están bien conocidas; sin embargo, existen múltiples estudios que han tratado de dilucidar dicho proceso, el cual inicia a partir de la fase aguda y continua durante la fase crónica indeterminada de la enfermedad.1,11,16,17
En la fase tardía, el esófago denervado y parésico no transporta su contenido, lo cual propicia el desarrollo de esofagitis crónica, acantosis, paraqueratosis y leucoplaquia,18,19 incrementando el riesgo en 3% a 8% de desarrollar carcinoma de células escamosas.20 Aún más, la mayoría de las complicaciones crónicas de la ECh requieren tratamientos costosos, que no pueden ser cubiertos con facilidad por la población afectada.21,22 Sin embargo, el diagnóstico y tratamiento sintomático precoz, representa una mejor opción, tanto para las instituciones de salud como para los pacientes, a la vez de mejorar la calidad de vida y prevenir el desarrollo de complicaciones crónicas.23
Debido a la alta prevalencia de esta enfermedad en nuestro medio y a la escasa información que existe, el objetivo de este estudio fue determinar la presencia de alteraciones motoras en esófago de un grupo de sujetos asintomáticos con ECh en fase crónica indeterminada.
¿ Métodos
Se realizó un estudio de tipo descriptivo y transversal en el Laboratorio de Fisiología Digestiva y Motilidad Gastrointestinal del Instituto de Investigaciones Medico Biológicas de la Universidad Veracruzana, en la Ciudad de Veracruz. Previo consentimiento escrito y aceptación de forma voluntaria, se evaluaron 28 sujetos detectados como serpositivos para infección por Trypanosoma cruzi y que al menos tuvieran dos de tres pruebas serológicas positivas: hemato-aglutinación indirecta (HAI), inmunofluorescencia indirecta (FI) o análisis inmunoenzimático (ELISA), realizadas de manera rutinaria durante la donación sanguínea altruista en el Centro Estatal de Trasfusión Sanguínea de Veracruz, en el periodo comprendido de enero de 2005 a diciembre de 2009.
A todos los sujetos se les realizó una evaluación médica integral mediante la elaboración de historia clínica, exploración física, electrocardiograma basal y aplicación del cuestionario de síntomas gastrointestinales modular Roma II, que detecta específicamente la presencia de síntomas sugerentes de alteraciones esofágicas, gastrointestinales y ano-rectales.24 En una segunda visita previo ayuno de 12 horas, se realizó manometría esofágica estacionaria, con catéter de estado sólido con cuatro sensores circunferenciales de 1 cm (KoninsbergÒ), con una distancia de 5 cm entre cada sensor. Se aplicó anestesia local en oro-faringe y se introdujo el catéter lubricado con gel anestésico por vía nasal hasta cavidad gástrica. Posteriormente, utilizando el protocolo de retirada estacionaria del catéter a intervalos de un centímetro y tomando como referencia la presión basal intragástrica, se localizó el esfínter esofágico inferior (EEI) en donde se registró la presión basal, el porcentaje de relajación y presión del EEI posterior a una deglución líquida de 5 mL de agua. Luego se colocó el catéter con los sensores a 3 cm, 8 cm, 13 cm y 18 cm por arriba del borde superior del esfínter esofágico inferior, para valorar la motilidad del cuerpo esofágico mediante 10 degluciones liquidas de 5 mL de agua, con un intervalo mínimo de 30 segundos entre cada bolo. Finalmente, se extrajo el catéter hasta localizar la faringe y el esfínter esofágico superior (EES) evaluando la presión basal y la coordinación faringo-esofágica y, finalmente, se retiró el catéter. Posteriormente, se realizó el análisis y se evaluaron los trazos de acuerdo a la clasificación utilizada por Spechler y Castell en: a). Motilidad esofágica normal si más de 80% de las ondas peristálticas fueron normales; b). Esófago en cascanueces cuando se obtuvieron ondas peristálticas con presión promedio mayor de 180 mmHg; c). Espasmo esofágico difuso cuando presentó más de 20% de ondas peristálticas simultáneas alternadas con ondas peristálticas normales; d). Aperistalsis del cuerpo esofágico cuando presentaron ondas simultáneas en 100% de los tragos; e). Motilidad inefectiva cuando existieron más de 30% de ondas no transmitidas o presiones promedios menores de 30 mmHg en al menos dos de los sitios de registro del cuerpo esofágico; f). Hipertensión del EEI cuando la presión basal fue mayor de 45 mmHg en ausencia de alteración de la motilidad del cuerpo esofágico, y; h). Trastorno motor inespecífico a cualquiera alteración que no cumpliera con los criterios de los alteraciones mencionadas.25
Aunque los pacientes incluidos se autodefinieron como asintomáticos, aquellos en quienes se identificaron síntomas esofágicos durante la aplicación del cuestionario de Roma II, se les realizó también una endoscopia del tracto digestivo superior con toma de biopsia (cuatro muestras) del tercio distal del esófago, utilizando la técnica de biopsia sobre biopsia con un "capuchón" especial para tomar muestra profundas de la mucosa y lamina propia. Las biopsias fueron fijadas en formaldehido, se les realizó tinción de hematoxilinaeosina y fue revisada por dos patólogos expertos. Se analizaron las biopsias para determinar si las alteraciones eran compatibles con esofagitis péptica o existían otros cambios que pudieran asociarse a la infección crónica por Trypanosoma cruzi.
Se analizaron las siguientes características demográficas: género, edad, escolaridad, ocupación, condiciones de vivienda (rural/urbano) y antecedentes clínicos. Para el análisis estadístico se utilizó estadística descriptiva (media, desviación estándar y rangos) para todas las variables continuas y frecuencias para otras variables. Se utilizó prueba de t de student para comparar variables continuas, y prueba de Ji cuadrada para variables ordinales y se consideró significancia estadística con p <0.05. Para el análisis estadístico se utilizó el programa SPSS versión 10.0. Este proyecto de investigación se realizó en apego y de acuerdo a las buenas prácticas clínicas y previa aprobación del Comité de Ética e Investigación del Instituto de Investigaciones Médico Biológicas de la Universidad Veracruzana.
¿ Resultados
Se evaluaron 28 sujetos; 27 (96%) hombres y la edad promedio del grupo fue de 40.39 ± 10.79 años (rango 18 a 61 años). Veintiún sujetos (75%) tenían el antecedente de haber trabajado en el campo en zonas en donde la infección por Trypanosoma cruzi se considera endémica, 15 de ellos (54%) continuaban trabajando como campesinos; sin embargo, 20 sujetos (71%) habitaban en zona urbana y los ocho restantes en viviendas semi-urbanas o rurales (cinco en vivienda de madera con piso de tierra y tres en vivienda de palma con piso de tierra). Seis sujetos (21%) recordaban haber tenido contacto con el vector en algún momento de la vida, de los cuales dos señalaron haber tenido contacto con el vector desde la infancia y otros cuatro en su área de trabajo. Tres de los sujetos refirieron haber visto el vector en la periferia de sus domicilios y otros tres haber sido picados por el vector. Ninguno de los sujetos fue diagnosticado en la fase aguda de la enfermedad ni tenían antecedente de hospitalización previa por síndrome febril.
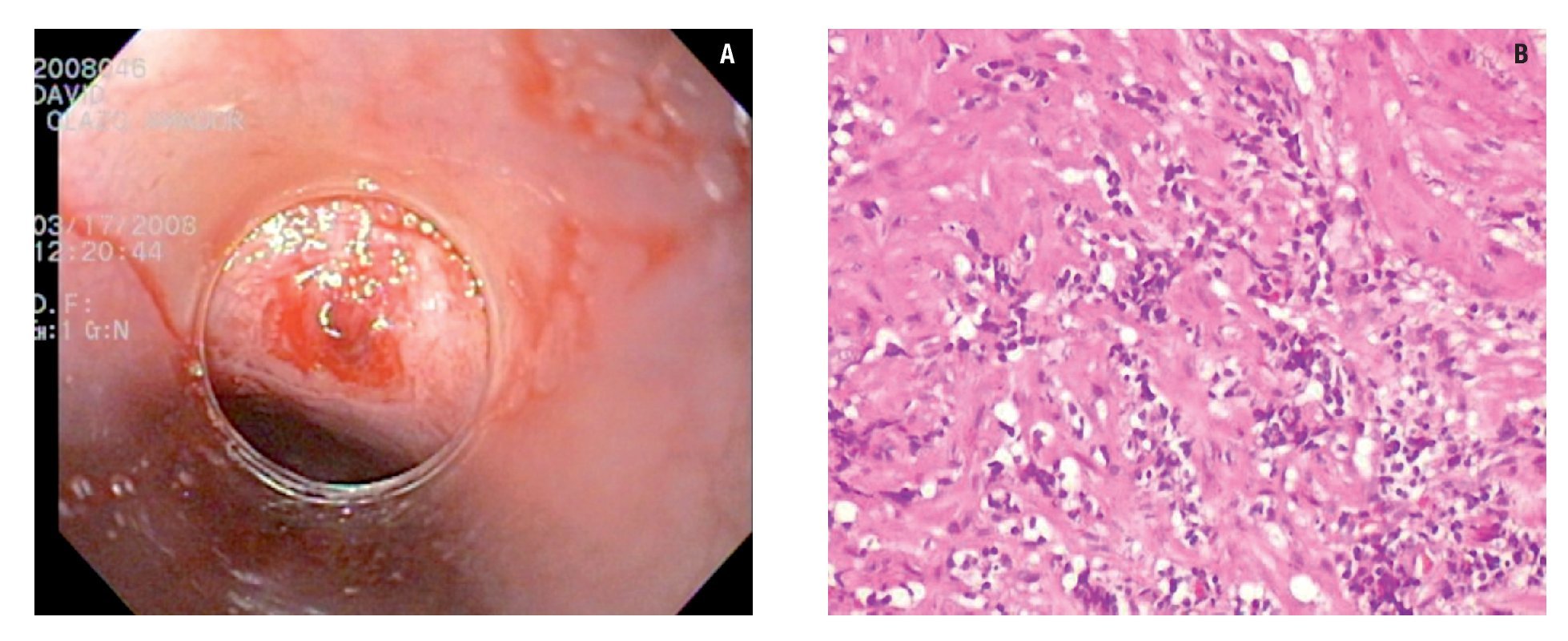
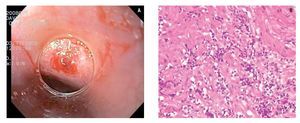
Aunque al inicio del estudio todos los sujetos se refirieron asintomáticos, al aplicar el cuestionario de síntomas digestivos, 10 (36%) tuvieron al menos un síntoma esofágico: cuatro tuvieron sólo pirosis, tres presentaron pirosis y dolor torácico no cardiaco, dos tuvieron disfagia y pirosis ocasional y uno manifestó sólo disfagia. En estos 10 sujetos la endoscopia mostró que en seis (21%) no existía evidencia de erosiones en el tercio distal del esófago, tres (11%) con esofagitis grado A de la Clasificación de Los Angeles y un (4%) sujeto con cambios descritos como acantosis glucogénica del tercio distal del esófago. En los tres casos de enfermedad erosiva, los hallazgos histopatológicos fueron compatibles con cambios relacionados a la exposición ácida de la mucosa esofágica como la presencia de erosiones, infiltrado inflamatorio por polimorfonucleares e hiperplasia de la membrana basal. En los siete restantes, se detectaron alteraciones histológicas compatibles con cambios crónicos no relacionados a reflujo caracterizado por aumento de linfocitos y cambios inespecíficos. En un caso la biopsia fue lo suficientemente profunda para demostrar la presencia de infiltrado inflamatorio linfocitaria en la lámina propria y algunas fibras musculares, que son atribuibles a infección crónica por Trypanosoma cruzi (Figura 1).
¿ Figura 1. A). Biopsia del tercio distal del esófago utilizando dispositivo especial para tomar biopsia sobre biopsia. Sobre la zona en la que se tomó la biopsia se aprecian algunas fibras musculares expuestas. B). Análisis histológico de la biopsia que muestra infiltrado linfocitario en lámina propia e incluso en unas fibrillas musculares.
La manometría esofágica demostró la presión promedio del EEI fue de 41.11 mmHg ± 16 mmHg (rango de 23.10 a 96.30) en el grupo estudiado. Las presiones medias de las amplitudes de las ondas peristálticas del cuerpo esofágico fueron de 91.90 mmHg ± 45.25 mmHg (rango de 23.40 a 196) en el primer tercio; 120.76 mmHg ± 66.13 mmHg (rango 41.60 a 258) en el tercio medio y 105.67 mmHg ± 44.56 mmHg (rango 45 a 215.60) en el tercio distal. La presión media del EES fue de 74.78 mmHg ± 44.20 mmHg (rango 27.80 a 192).
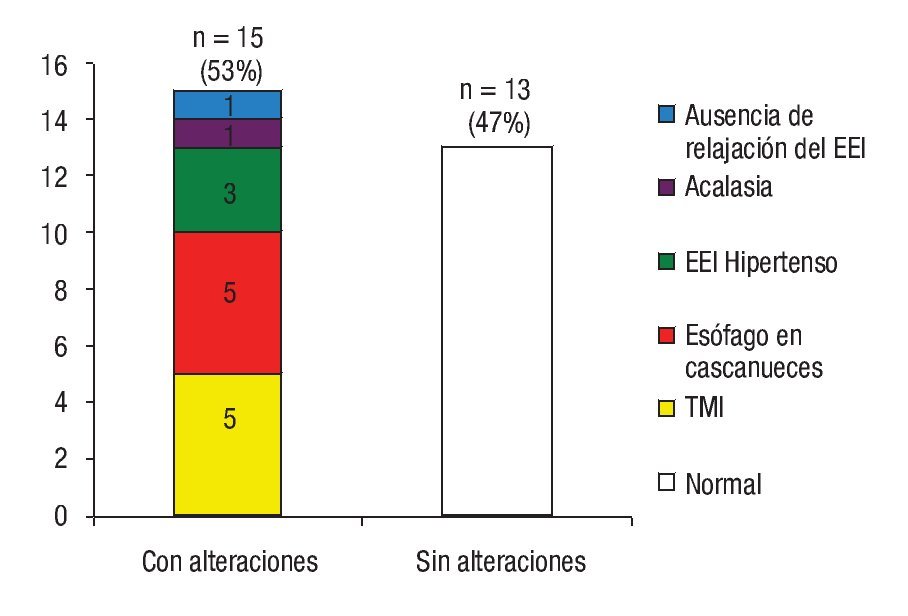
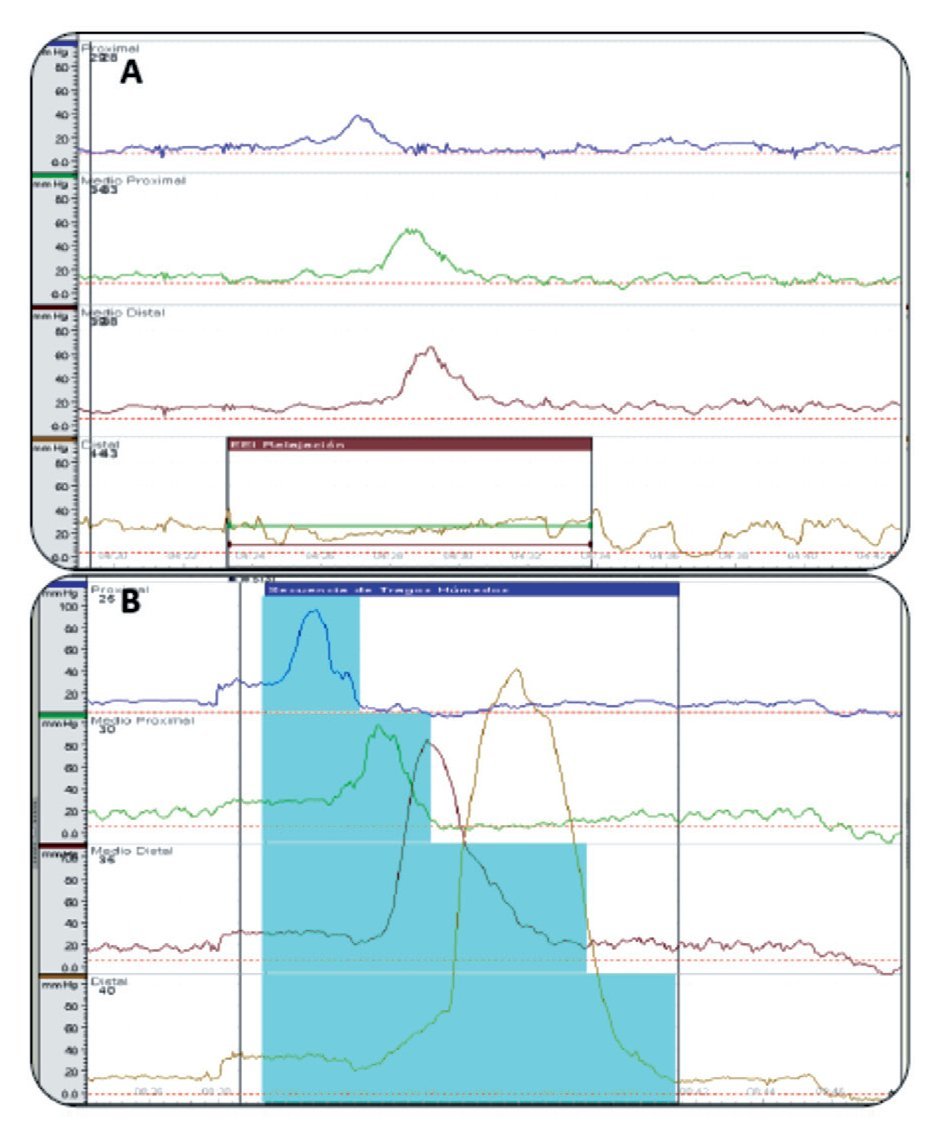
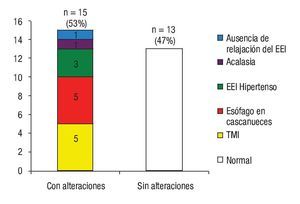
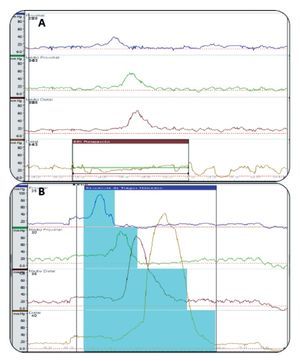
De acuerdo a los hallazgos en la manometría esofágica 15 (54%) presentaron algún trastorno motor esofágico (TME): cinco (18%) cumplieron con los criterios diagnósticos de esófago en cascanueces, cinco (18%) con trastorno motor inespecífico, tres (11%) hipertensión del EEI, uno (4%) relajación incompleta de EII de forma aislada y uno (4%) acalasia chagásica (Figura 2). En la Figura 3 se muestran dos trazos representativos de relajación incompleta del EEI y de esófago hipercontráctil o en cascanueces. En ninguno de los casos se detectaron alteraciones en la coordinación faringo-esofágica.
¿ Figura 2. Trastornos motores del esófago en sujetos con infección crónica indeterminada por Trypanosoma cruzi.
¿ Figura 3. A). Trazo manométrico que demuestra la presencia de una deglución liquida con una relajación incompleta del EEI, B). Trazo manométrico con imagen característica de esófago hipercontráctil o en cascanueces.
La asociación entre las alteraciones manométricas y los síntomas detectados por el cuestionario de Roma II fue la siguiente:
a. De los ocho pacientes que habían manifestado pirosis, tres (37%) tuvieron trastorno motor inespecífico, uno (13%) hipertensión del EEI y cuatro (50%) no tuvieron ninguna alteración.
b. De los tres pacientes con dolor torácico no cardiaco, dos (66%) tuvieron esófago en cascanueces y uno (34%) no tuvo ninguna alteración, y
c. De los tres pacientes con disfagia, dos (66%) tuvieron hipertensión del EEI y uno (34%) no tuvo ninguna alteración.
Cabe destacar que el paciente que tuvo hallazgos compatibles con acalasia chagásica no manifestó ningún síntoma al momento del estudio.
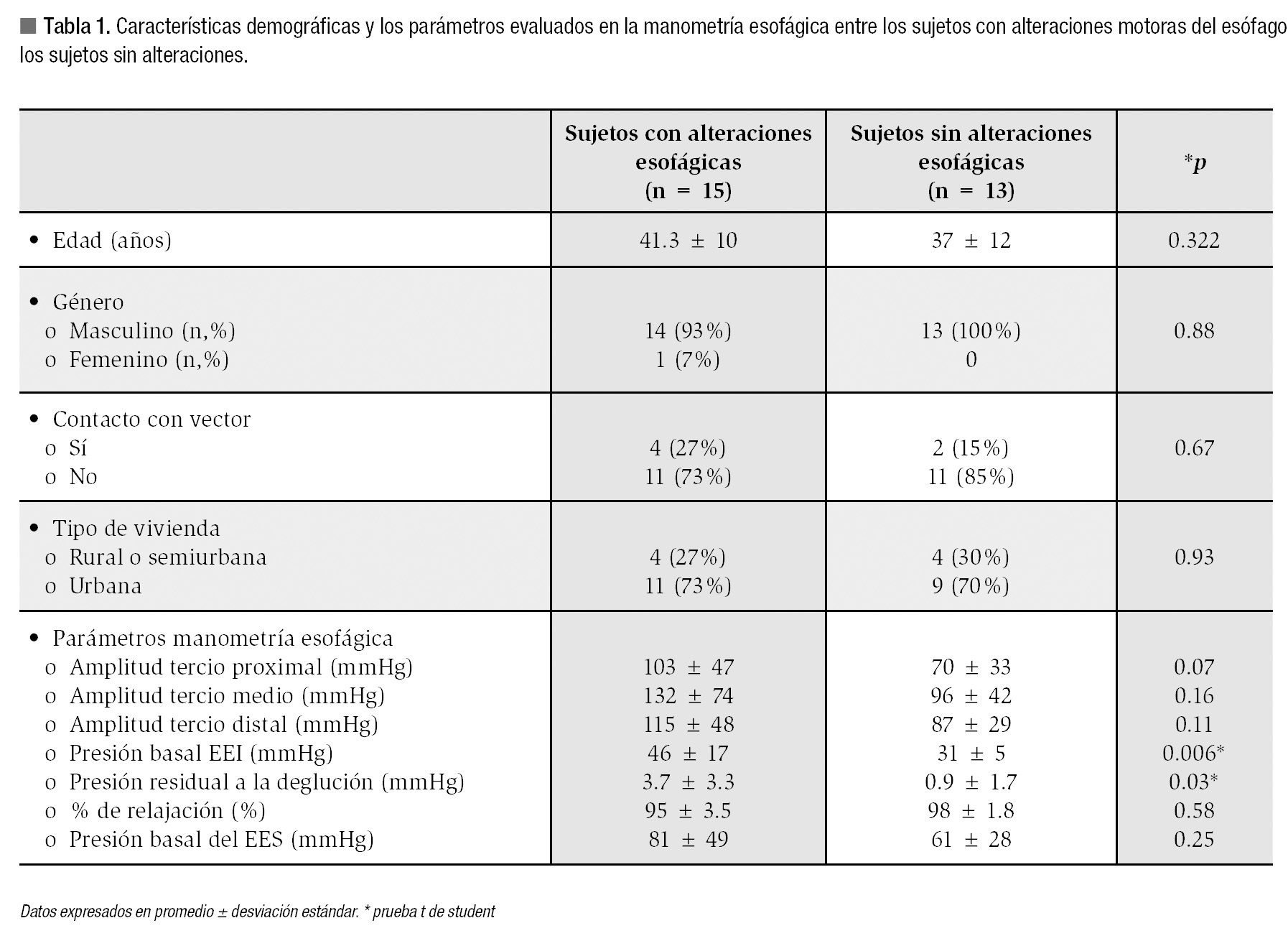
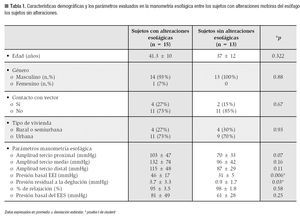
En la Tabla 1 se comparan las características demográficas y los parámetros evaluados en la manometría esofágica entre los sujetos con alteraciones motoras del esófago y los sujetos sin alteraciones. Los pacientes con anormalidades motoras tuvieron un promedio de la presión basal del EEI significativamente mayor que los sujetos sin alteraciones.
¿Discusión
Se estima que hay 28 millones de sujetos infectados por Trypanosoma cruzi en Latinoamérica1,2 y una encuesta sero-epidemiológica en México demostró una positividad media de 1.6%.7 Aún más, se han detectado comunidades hiperendémicas, con seroprevalencia de hasta 45% en niños pequeños26 y un estudio exploratorio realizado entre los años 2005 - 2006 obtuvo una prevalencia de infección asintomática cercana a 1% en la zona conurbada de Veracruz, Boca del Río.27 Estos datos epidemiológicos, además de la escasa información y lo crónico y devastador de esta enfermedad en su etapa crónica nos llevaron a realizar este estudio.
En este estudio detectamos que más de la mitad de sujetos (53%) autodefinidos como asintomáticos, infectados por Trypanosoma cruzi y detectados mediante un programa de escrutinio durante la donación altruista de sangre, presentan alteraciones motoras del esófago. La presencia de estos trastornos no en todos los casos se asoció con la presencia de síntomas detectados mediante el cuestionario de Roma II. Este es quizá el hallazgo más importante de nuestro estudio pues cuatro de los 28 sujetos estudiados tuvieron alteraciones manométricas descritas en el desarrollo temprano de la acalasia chagásica como la presencia de un EII hipertenso y la ausencia de relajación de éste.16 Incluso el paciente que tenía todos los criterios manométricos de acalasia chagásica se seguía refiriendo como asintomático al momento de su evaluación.
La forma gastrointestinal de la EC, involucra invasión inflamatoria del plexo entérico y degeneración de las neuronas entéricas. El desarrollo de megacolon y mega-esófago posterior a infección por Tripanosoma cruzi se asocian con una invasión mantenida de la glía entérica por células T citotóxicas y pérdida de la inervación muscular, aunque la reducción de número de células gliales no se ha asociado con una progresión de la neuropatía entérica.28
En la bibliografía mundial existen poco estudios (la mayoría realizados en Brasil) que evalúan la motilidad esofágica en la forma indeterminada de la enfermedad y los hallazgos informados en el cuerpo esofágico son la disminución de las amplitudes de las ondas peristálticas (las cuales suelen disminuir a mayor edad) y aperistalsis esofágica.29,30 En nuestro estudio no encontramos diferencias en las presiones promedios del cuerpo esofágico entre los sujetos con y sin alteraciones esofágicas, pero si detectamos que las presiones promedios son discretamente mayores con respecto a los estudios brasileños. Una posible explicación para estas diferencias radica en el hecho de que los sujetos de nuestra serie son más jóvenes.
En sujetos normales, la respuesta del cuerpo esofágico a las degluciones líquidas es diferente de la ocasionada por degluciones secas y esto es mediado por la excitación colinérgica. En un estudio realizado en sujetos con ECh y disfagia, con retención esofágica y diámetro esofágico menor de 4 cm, se demostró que esta respuesta adaptativa estaba ausente sin importar la edad del paciente. Sin embargo, se observó que en los sujetos menores de 60 años las contracciones en el esófago distal fueron más intensas que en sujetos mayores de 60 años.31 En otro estudio, Dantas mostró que la disfagia en pacientes con ECh sin dilatación esofágica, con peristalsis esofágica normal y relajación completa del EEI se relaciona a una mayor duración (longitud) de las contracciones en el tercio medio y distal del esófago.32
Es importante destacar que cinco de nuestros pacientes tuvieron el diagnóstico de esófago en cascanueces. Desconocemos si esta condición pudiera asociarse a la infección por Trypanosoma cruzi en etapas tempranas, ya que puede ser el resultado de la afección inicial de las neuronas entéricas por el parásito aunque también podría ser secundaria enfermedad por reflujo gastroesofágico en los sujetos de estudio.33-35 Hubiera sido ideal realizar pH-metría esofágica para ayudar a discernir esta situación. Aunque reconocemos esta limitante, debemos recordar que ese no fue el objetivo de nuestro estudio.
Respecto a las alteraciones del EEI, cinco sujetos tuvieron afección de este en nuestro estudio (EII hipertenso en tres; ausencia de relajación aislada en uno y acalasia en uno). En diversos estudios que han evaluado la fisiopatología de la acalasia, al analizar el EEI se ha demostrado que en la ECh la lesión del plexo mientérico abarca tanto la inervación inhibitoria como la excitatoria, a diferencia de la acalasia clásica donde sólo hay afección de la inervación inhibitoria, y aunque la intensidad de la lesión inhibitoria es mayor que la excitatoria, ésta suele encontrarse en grados variables. Este fenómeno puede explicar porque en algunos casos de ECh la presión basal del EEI se encuentra disminuida, normal o aumentada.36 En condiciones normales, la gastrina estimula la inervación excitatoria al liberar acetilcolina y aumentar la presión del EEI, actuando como una antagonista de la inervación inhibitoria. Sin embargo, en los sujetos con ECh la respuesta a la gastrina se encuentra disminuida ocasionando una subsecuente elevación de los niveles de gastrina y reforzando la teoría de la afección de la inervación excitatoria.37-39 También se ha reportado la existencia de anticuerpos contra receptores muscarínicos M2 de acetilcolina que aumentan el tono de la musculatura del EEI in vitro.40,41 El tiempo de evolución de la afección del EEI es variable y debe considerarse un seguimiento a largo plazo de los sujetos con ECh desde una etapa temprana para poder medir el ritmo de progresión de la afección neural y así tomar decisiones terapéuticas adecuadas y personalizadas.42-44
Respecto al EES, encontramos que en todos casos la coordinación faringo-esofágica fue apropiada y si bien los sujetos con trastornos motores tuvieron una presión mayor que los sujetos sin alteraciones, esta diferencia no fue significativa. Un estudio que evaluó el EES en sujetos con ECh en etapa crónica indeterminada, reportó que aquellos con ondas sincrónicas presentaron presiones medias elevadas al compararlos con los sujetos con ondas peristálticas. Esto tal vez se deba a una respuesta compensatoria del músculo cricofaríngeo a la disminución del peristaltismo esofágico.45,46
Estudios realizados en sujetos con mega-esófago mostraron que hay una intensa reducción de las células intersticiales de Cajal (responsables de coordinar la peristalsis y de mediar los impulsos nerviosos) comparados con sujetos no chagásicos, y en otros estudios se documentaron alteraciones de distribución de estas células. Se ha sugerido que estas células se encuentran involucradas en la génesis del mega-esófago y mega-colon.43,47 Aunque éste no fue el objetivo del trabajo, realizamos endoscopia en 10 sujetos (36%) debido a la presencia de síntomas y de quienes tomamos biopsias esofágicas con la finalidad de determinar la existencia de algún cambio temprano en la mucosa. Interesantemente, en un caso la biopsia fue lo suficiente profunda para demostrar la presencia de infiltrado inflamatorio linfocitaria en la lámina propria y algunas fibras musculares, que son atribuibles a infección crónica por Trypanosoma cruzi.
Aunque se desconocen los efectos de las alteraciones esofágicas y del EEI sobre la función sensitiva y motora del estómago, específicamente en relación a la acomodación gástrica en estos sujetos aún asintomáticos, es probable que la disfunción esofágica condicione disfunción gástrica. Se requieren de estudios futuros de vaciamiento gástrico y con baróstato para evaluar las alteraciones fisiopatológicas y su asociación sintomática en estos sujetos.
Finalmente, existen varias implicaciones desde el punto de vista epidemiológico y terapéutico de nuestro estudio. Estudios longitudinales indican que sólo la mitad de los sujetos infectados presentan manifestaciones clínicas y aproximadamente 25% muere de forma directa o indirecta como resultado de la infección.4,17 La terapia farmacológica puede curar a 60% o más de los sujetos infectados menores de 13 años de edad;48-50 sin embargo, la eficacia del tratamiento aparentemente decrece con la duración de la infección, y los efectos adversos de las drogas anti-tripanosoma se incrementan con la edad.51 Se estima que el rango de curación de la infección en la fase crónica indeterminada varía de 8% a 25%.52-55 La reducción de anticuerpos es lenta y existe la posibilidad de reinfección en las zonas endémicas, lo que dificulta determinar con claridad la eficacia del tratamiento en la fase indeterminada y crónica.54-56 Actualmente, no existe evidencia suficiente para recomendar el tratamiento en los sujetos con infección crónica indeterminada.1,57-59 Se han desarrollado diversos protocolos de tratamiento en los países endémicos para las diversas etapas y formas de la ECh, enfocadas a la erradicación de la infección en la forma aguda y en el tratamiento sintomático, preventivo y paliativo en formas avanzadas de la enfermedad.1,2,5,9,10 La mayoría de las complicaciones en la etapa crónica de la ECh requieren tratamientos costosos que no pueden ser cubiertos facilmente por la población afectada.21,22
¿ Conclusión
Consideramos que el diagnóstico y el tratamiento sintomático precoz de las manifestaciones esofágicas, representan una mejor opción, tanto para las instituciones de salud como para los pacientes, a la vez de mejorar la calidad de vida y prevenir el desarrollo de complicaciones crónicas. Con base en nuestros resultados, recomendamos la realización de manometría esofágica de manera rutinaria en la evaluación de los sujetos con ECh.
¿ Agradecimientos
Este trabajo fue realizado gracias al apoyo otorgado por el Fondo para la investigación FOMIX-CONACYT-VERACRUZ Proyecto 68427 Convocatoria 2007.
Correspondencia: Dr. José María Remes Troche.
Laboratorio de Fisiología Digestiva y Motilidad Gastrointestinal, Instituto de Investigaciones Médico Biológicas. Iturbide SN, Colonia Flores Magón, C.P. 91400. Veracruz, Veracruz.
Correo electrónico: jose.remes.troche@gmail.com, joremes@uv.mx.
Recibido el 4 de marzo de 2011;
aceptado el 15 de mayo de 2011.