La pancreatitis aguda (PA) y la pancreatitis aguda recurrente (PAR) son enfermedades cuya incidencia aparentemente va en incremento. A pesar de la creciente evidencia sobre el manejo de la PA en adultos y niños, aún se siguen teniendo conductas que potencialmente podrían impactar en un pronóstico no tan adecuado de estos pacientes, sobre todo en población pediátrica. Es por esto que la Asociación Mexicana de Gastroenterología convocó a un grupo de 24 gastroenterólogos pediatras expertos, de diferentes instituciones y de diferentes zonas geográficas de México, 2 nutriólogas pediatras, así como 2 especialistas en cirugía pediátrica para discutir sobre diferentes aspectos de la epidemiología, diagnóstico y tratamiento de la PA y PAR en población pediátrica. El objetivo de este documento es presentar los resultados obtenidos de este consenso. Se organizaron 6 mesas de trabajo con diferentes tópicos sobre la PA. Cada mesa de trabajo revisó la información y generó los enunciados/declaraciones que consideraron pertinentes para cada módulo, en tópicos que representaran recomendaciones o puntos de debate sobre cuestiones de abordaje diagnóstico o terapéutico. Se presentaron y discutieron todas las declaraciones. Posteriormente, se sometieron a evaluación mediante un proceso Delphi, de voto anónimo, vía electrónica, para conocer el nivel de acuerdo en los enunciados/declaraciones. Se elaboraron un total de 29 enunciados/declaraciones. Todas las declaraciones tuvieron un porcentaje de consenso mayor del 75% en la primera ronda de votación.
Acute pancreatitis (AP) and recurrent acute pancreatitis (RAP) are conditions, whose incidence is apparently on the rise. Despite the ever-increasing evidence regarding the management of AP in children and adults, therapeutic actions that could potentially affect having a poor prognosis in those patients, especially in the pediatric population, continue to be carried out. Therefore, the Asociación Mexicana de Gastroenterología convened a group of 24 expert pediatric gastroenterologists from different institutions and areas of Mexico, as well as 2 pediatric nutritionists and 2 specialists in pediatric surgery, to discuss different aspects of the epidemiology, diagnosis, and treatment of AP and RAP in the pediatric population. The aim of this document is to present the consensus results. Different AP topics were addressed by 6 working groups, each of which reviewed the information and formulated statements considered pertinent for each module, on themes involving recommendations and points of debate, concerning diagnostic or therapeutic approaches. All the statements were presented and discussed. They were then evaluated through a Delphi process, with electronic and anonymous voting, to determine the level of agreement on the statements. A total of 29 statements were formulated, all of which reached above 75% agreement in the first round of voting.
La pancreatitis aguda (PA) se define por la presencia de cuando menos 2 de los siguientes criterios: dolor abdominal compatible con PA, niveles de amilasa y/o lipasa sérica con valor ≥3 veces por arriba del valor normal superior y hallazgos de imagen de PA. La pancreatitis aguda recurrente (PAR) se define cuando se presentan 2 episodios de PA con resolución de las manifestaciones clínicas y normalización de las enzimas pancreáticas con un intervalo de al menos 4 semanas1. La PA se clasifica en: leve, cuando se resuelve dentro de una semana sin involucro local o sistémico; moderada, asociada a disfunción orgánica no mayor de 48h; y grave, que se manifiesta con falla multiorgánica por más de 48h2.
A pesar de la creciente evidencia sobre el manejo de la PA en adultos y niños, aún se siguen teniendo conductas que potencialmente podrían impactar en un pronóstico no tan adecuado de estos pacientes, sobre todo en población pediátrica. Es por esto que la Asociación Mexicana de Gastroenterología (AMG) convocó a un grupo de expertos para discutir sobre diferentes aspectos de la epidemiología, diagnóstico y tratamiento de la PA y PAR en población pediátrica. El objetivo de este documento es presentar los resultados obtenidos de este consenso.
Material y métodosSe convocó de forma inicial a 24 gastroenterólogos pediatras pertenecientes a la AMG, de diferentes instituciones y de diferentes zonas geográficas de México, 2 nutriólogas pediatras, así como 2 especialistas en cirugía pediátrica. Se organizaron 6 mesas de trabajo con diferentes tópicos sobre la PA. Cada mesa de trabajo estuvo integrada por 3 a 6 expertos, donde uno de ellos fue el coordinador de cada mesa de trabajo. Se realizó una búsqueda inicial de información en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), que comprendió un período entre el 1 de enero de 1990 y el 30 de junio de 2022. Los criterios de búsqueda bibliográfica fueron: «pancreatitis», «children pancreatitis», «acute pancreatitis, «recurrent pancreatitis», «recurrent acute pancreatitis», «severe acute pancreatitis», «acute pancreatitis guidelines», «acute pancreatitis children», «management acute pancreatitis children» y sus equivalentes en español. Se identificaron todas las publicaciones en inglés y español (artículos originales, consensos, guías, revisiones sistemáticas y metaanálisis), y publicaciones que los coordinadores y miembros del grupo del presente consenso consideraron relevantes y se compartieron con todo el grupo. Se tuvo una primera reunión de forma virtual para explicar la dinámica de trabajo. Cada mesa de trabajo revisó la información y generó los enunciados/declaraciones que consideraron pertinentes para cada módulo, en tópicos que representaran recomendaciones o puntos de debate sobre cuestiones de abordaje diagnóstico o terapéutico. Cada uno de los coordinadores envió los enunciados y declaraciones con una breve justificación de cada uno de ellos a los coordinadores generales del consenso (RVF y YRS) quienes las conjuntaron y enviaron a todos los participantes para su lectura. En una segunda reunión virtual se presentaron y discutieron todas las declaraciones. Posteriormente, se sometieron a evaluación mediante un proceso Delphi, de voto anónimo, vía electrónica, para conocer el nivel de acuerdo en los enunciados/declaraciones; cada enunciado o declaración fue evaluado de acuerdo con la escala Likert de 3 puntos: a) de acuerdo, b) en desacuerdo y c) me abstengo. Después de una primera ronda de votación, aquellos enunciados para los que existió consenso (más del 75% de acuerdo) fueron aceptados. Aquellos para los que no existió consenso (menos del 75% de acuerdo) fueron revalorados para su eliminación o bien, para ser reformulados por los miembros de la mesa de trabajo que los elaboró y, posteriormente, fueron presentados en una segunda ronda de presentación, y sometidos a una segunda ronda de votación anónima aplicando los mismos criterios para ser aceptados por consenso.
ResultadosSe elaboraron un total de 29 enunciados/declaraciones. Todas las declaraciones tuvieron un porcentaje de consenso mayor del 75% en la primera ronda de votación. Se presentaron los enunciados y en 3 de ellos se decidió realizar modificaciones en la redacción y contenido del enunciado, por lo que pasaron a una segunda ronda de votación, donde el porcentaje de consenso también fue mayor del 75%. A continuación, se presentan dichos enunciados, con el porcentaje de acuerdo, tomando como denominador el total de 28 votantes; se mencionó además el número de votantes que se abstuvieron de votar de acuerdo o en desacuerdo.
Epidemiología- 1.
La prevalencia de la pancreatitis aguda en Norteamérica se ha reportado en entre 1 a 13 casos/100,000 niños/año en escolares y adolescentes, con un ligero predominio en el sexo femenino. (Porcentaje de acuerdo 100%; 0 abstenciones)
La PA es una entidad poco común en niños; sin embargo, en los últimos años ha aparecido un mayor número de reportes relacionados con su epidemiología y etiología3-5. Se ha estimado que anualmente ocurren de 1 a 13 nuevos casos/100,000 niños con PA1,5. En un metaanálisis que incluyó 589 niños con PA, la edad media fue de 9.2±2.4 (DE) (rango, 1 semana a 21 años) con una relación de 1:2 de sexo masculino/femenino6. En un estudio que incluyó 55,012 niños con PA, se reportó una mayor frecuencia en niños>5 años (edad media 17 años), con un ligero predominio en el sexo femenino7. Otro estudio, con 2,127 casos de PA, encontró una edad media de presentación de 11.91±5.38 años, observando dos picos: uno a los 4-5 años de edad y el otro en adolescentes8.
- 2.
La etiología de la pancreatitis aguda varía según el grupo etario; en población pediátrica mundial el origen más frecuente es biliar e idiopático, similar a lo reportado en nuestro país. (Porcentaje de acuerdo 93%; una abstención)
Los factores asociados que se han considerado como causas posibles de PA son múltiples y varían según el grupo etario. En Estados Unidos, un estudio con 215 niños mostró que las causas más frecuentes de PA fueron las alteraciones del tracto biliar (32.6%) y medicamentos (25.6%)9, mientras que, en otro estudio, con 115 niños, predominaron las causas idiopáticas (31%) y las asociadas a medicamentos (23%)10. En un estudio de la India, en 320 niños, fueron trauma abdominal (21%) y afectación del tracto biliar (10%)11, y en China, en 130 niños, las causas biliares (31.5%), idiopáticas (28.5%) y por trauma (16.2%) fueron las más comunes; los problemas metabólicos (hipertrigliceridemia) fueron los menos frecuentes (9.2%) y rara vez por infección viral que se presentaron en niños pequeños12. En una encuesta realizada en centros de Latinoamérica, la enfermedad biliar, el trauma abdominal y la ingesta de medicamentos fueron las etiologías más frecuentes13. En México, existen pocos reportes de casos con PA en niños y la escasa información muestra que la pancreatitis biliar y la idiopática son las más frecuentes, con predominio en escolares del sexo femenino14-18. La PA de origen biliar es una etiología común y esta condición se ha ligado al incremento de niños con obesidad como factor independiente de riesgo19. La etiología de la PA en niños difiere de la de los pacientes adultos en quienes las causas más frecuentes son la hiperlipidemia, la ingesta de alcohol y patologías asociadas con disfunción orgánica múltiple20.
- 3.
La pancreatitis aguda recurrente se presenta en entre un 10 a 35% de los casos, siendo factores a tomar en cuenta la predisposición genética y las alteraciones anatómicas. (Segunda ronda de votación: Porcentaje de acuerdo 100%; 0 abstenciones)
La PAR en niños se ha estimado que se presenta en entre un 10 a 35% de los casos18,21-23, similar a lo reportado en México, es decir, entre un 24 y 37% de los casos14,16,24. Se ha demostrado la relación de mutaciones en los genes PRSS1,SPINK1, CFTR, y CTRC13 con la presencia de PAR21,23; esto difiere con un estudio realizado en niños mexicanos con PA y PAR en el que se encontró la mutación N34S del gen SPINK1 y N29I en el gen PRSS1 en 4/58 (6.8%) casos con PA y en ninguno de los 34 casos con PAR24. Además de los factores genéticos, las anomalías bilio-pancreáticas obstructivas y estructurales, así como las formas idiopáticas constituyen causas de recurrencia y progresión a la cronicidad20,22. En la cohorte del estudio INSPPIRE se encontró páncreasdivisum en 52 de 359 pacientes (14.5%) como factor de riesgo para PAR. Otras causas poco frecuentes son de origen tóxico, metabólico y autoinmune25.
Manifestaciones clínicas- 4.
El dolor abdominal es el síntoma principal en esta enfermedad, aunque puede estar ausente o no ser claramente identificado, sobre todo en el paciente menor de 5 años. El vómito y la náusea se presentan en más de la mitad de los pacientes pediátricos con pancreatitis aguda. (Porcentaje de acuerdo 97%; una abstención)
- 5.
Las comorbilidades y factores de riesgo deben identificarse siempre en el abordaje clínico de estos pacientes. (Porcentaje de acuerdo 100%; 0 abstenciones)
El dolor abdominal es el síntoma cardinal descrito en niños mayores de 4 años (86%); en los menores se ha referido solo en una tercera parte de los casos26-28. La localización más frecuente es en el epigastrio, pero puede ser en los hipocondrios o generalizada; la clásica irradiación del dolor hacia la espalda solo se presenta en ≤10%28-31. El segundo síntoma más frecuente es el vómito (61%) y en alrededor del 20% de las ocasiones puede ser biliar18,28.
A la exploración física, los niños menores de 5 años tienden a estar hipoactivos, mientras que los mayores adoptan una posición antiálgica. La hipersensibilidad abdominal se presenta en el 75% de los casos6,27,32. La peristalsis puede estar aumentada o puede haber íleo6,18,32,33. Otros hallazgos menos frecuentes son fiebre, ictericia, hipocolia, hiporexia, diarrea, ascitis, masa abdominal o derrame pleural6,26,28,30-34. El signo de Grey Turner, equimosis en flancos, se ha descrito, pero raramente se presenta28.
- 6.
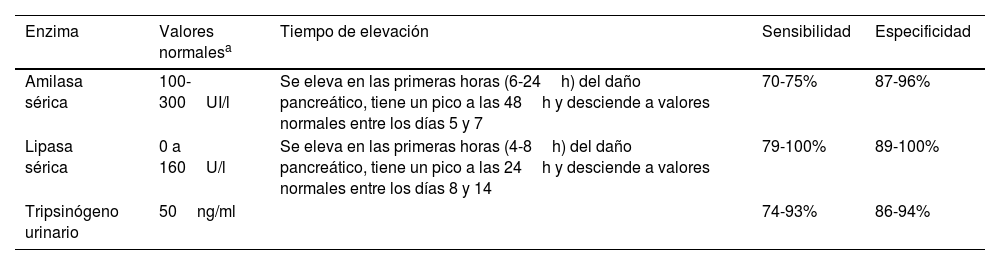
La elevación de la concentración sérica de amilasa y/o lipasa 3 veces por arriba de los valores de referencia es uno de los criterios de diagnóstico de pancreatitis aguda. (Porcentaje de acuerdo 100%; 0 abstenciones)
Se pueden hacer determinaciones en suero u orina y los valores varían con la técnica de laboratorio. En la tabla 1 se describen los valores normales, la evolución de la elevación, sensibilidad y especificidad. Existen otras patologías que cursan con elevación de amilasa o lipasa sérica, como la insuficiencia hepática, insuficiencia renal, inflamación intestinal, apendicitis, colecistitis, enfermedad ulcerosa péptica, desórdenes de las glándulas salivales, enfermedades ginecológicas, traumatismo abdominal, cetoacidosis diabética y traumatismo craneoencefálico35-38. La amilasa puede permanecer en rangos normales hasta en un 19% de los pacientes con PA35.
Enzimas pancreáticas que se pueden determinar para realizar el diagnóstico de pancreatitis aguda
| Enzima | Valores normalesa | Tiempo de elevación | Sensibilidad | Especificidad |
|---|---|---|---|---|
| Amilasa sérica | 100-300UI/l | Se eleva en las primeras horas (6-24h) del daño pancreático, tiene un pico a las 48h y desciende a valores normales entre los días 5 y 7 | 70-75% | 87-96% |
| Lipasa sérica | 0 a 160U/l | Se eleva en las primeras horas (4-8h) del daño pancreático, tiene un pico a las 24h y desciende a valores normales entre los días 8 y 14 | 79-100% | 89-100% |
| Tripsinógeno urinario | 50ng/ml | 74-93% | 86-94% |
Durante el episodio agudo de la pancreatitis, es necesario realizar otros estudios de laboratorio que permiten identificar la etiología, la gravedad y monitorizar la evolución: calcio sérico, nitrógeno ureico, creatinina, albúmina, transaminasas, bilirrubinas, triglicéridos, biometría hemática completa y proteína C reactiva39,40.
- 7.
El ultrasonido abdominal representa la primera opción de estudios de imagen no invasivos en niños con sospecha de pancreatitis aguda o pancreatitis aguda recurrente. La tomografía axial computarizada y la resonancia magnética nuclear cuentan con indicaciones precisas y no se recomienda su uso de forma rutinaria. (Porcentaje de acuerdo 97%; 0 abstenciones)
El hallazgo ultrasonográfico de mayor utilidad es la dilatación del ducto pancreático; el ultrasonido abdominal (UA) se encuentra ampliamente disponible, no requiere sedación ni emite radiaciones. La obtención de imágenes puede verse afectada por la presencia de obesidad y exceso de gas intestinal3,41,42. La tomografía axial computarizada (TAC) está indicada en pacientes con deterioro clínico o gravemente enfermos; el inconveniente es la radiación. Idealmente se debe realizar transcurridas ≥96h del cuadro agudo para evitar subestimar la extensión de la enfermedad; el uso de medio de contraste intravenoso es recomendable. Destaca la capacidad para detectar calcificaciones38,43-45.
La realización de resonancia magnética nuclear (RMN) es conveniente en casos de PAR con aumento de gammaglutamil transferasa (GGT) >2 veces el valor normal o presencia de colestasis con UA sin evidencia de obstrucción de conductos biliares; detecta patologías como páncreas divisum o anormalidades de la unión pancreato-biliar. El uso de secretina mejora la visualización de los ductos biliares y pancreáticos38,41,46,47.
Endoscopia en el diagnóstico y tratamiento de la pancreatitis aguda- 8.
La esófago-gastro-duodenoscopia no es un estudio de primera elección en pancreatitis aguda, su utilidad debe individualizarse. (Porcentaje de acuerdo 97%; 0 abstenciones)
La patología inflamatoria de la mucosa duodenal, como enfermedad celiaca o enfermedad de Crohn, incrementa el riesgo de desarrollar PA. La realización de endoscopia digestiva superior debe ser electiva, una vez resuelto el cuadro agudo, como parte del abordaje etiológico, o en pacientes con sospecha de obstrucción duodenal (tumor, estenosis). Su utilidad debe ser ponderada en cada caso y debe considerarse su utilidad en pacientes con comorbilidades como hematemesis o vómito persistente38.
- 9.
La colangiopancreatografía retrógrada endoscópica en pacientes pediátricos con pancreatitis aguda debe realizarse con fines terapéuticos. (Porcentaje de acuerdo 100%; 0 abstenciones)
El rendimiento actual de los estudios de imagen no invasivos, como la TAC con contraste o la colangiorresonancia, han desplazado a la colangiopancreatografía retrógrada endoscópica (CPRE) con fines diagnósticos en pacientes pediátricos. Se recomienda realizar CPRE en pacientes con PA con sospecha de obstrucción biliar (colédoco dilatado, ictericia obstructiva, datos de colangitis), en la fase temprana y para el tratamiento de las complicaciones como fístula pancreática o drenaje de pseudoquiste, en la fase tardía38,48,49.
- 10.
La pancreatitis biliar secundaria a coledocolitiasis es la principal indicación de la colangiopancreatografía retrógrada endoscópica para descomprimir la vía biliar y pancreática. (Porcentaje de acuerdo 100%; 0 abstenciones)
No hay recomendaciones específicas en pediatría sobre el momento ideal. En un metaanálisis de adultos se recomienda realizarla en las primeras 48h del inicio de los síntomas, en presencia de ictericia obstructiva o colangitis; dejándola de forma electiva a los pacientes con coledocolitiasis no complicada. La liberación del conducto biliar mejora el drenaje del conducto pancreático, disminuyendo la presión intraductal. En México, solo están disponibles videoduodenoscopios terapéuticos de 11mm de diámetro, por lo que solo es posible realizar CPRE en pacientes mayores de 10kg de peso. En caso de no contar con personal con experiencia en CPRE terapéutica, referir a un centro especializado o considerar el tratamiento quirúrgico48,50.
- 11.
El pseudoquiste pancreático se puede desarrollar en pancreatitis aguda; cuando es sintomático o causa complicaciones como obstrucción gástrica, intestinal, biliar o infección, podría requerir intervención endoscópica o quirúrgica. (Segunda ronda de votación: Porcentaje de acuerdo 97%; una abstención)
Los pseudoquistes pancreáticos se desarrollan en el 10-23% de los pacientes pediátricos con PA y pueden generar dolor abdominal, vómito, intolerancia a la vía oral por compresión gástrica, obstrucción intestinal o biliar. Derivado de experiencia en adultos, podría considerarse el drenaje cuando es mayor de 6cm y persiste por más de 6 semanas. El contenido de estos puede infectarse requiriendo drenaje, que puede ser endoscópico, radiológico percutáneo o quirúrgico. Los que comprimen la pared gástrica o duodenal pueden drenarse por vía endoscópica transmural, con colocación de prótesis plásticas. En pacientes con comunicación del conducto pancreático principal al pseudoquiste, la CPRE permite colocar una prótesis transpapilar en el duodeno restableciendo el drenaje del conducto, evitando así la fuga hacia el pseudoquiste51-56.
- 12.
El ultrasonido endoscópico es el ideal para el drenaje de los pseudoquistes que no producen compresión; la visión por ultrasonografía permite evitar estructuras vasculares, define las características de la colección (líquido, sólido) y determina el mejor sitio de acceso. (Porcentaje de acuerdo 90%; una abstención)
Se estima que el 42-48% de los pseudoquistes pancreáticos no producen compresión en la pared digestiva, y no se pueden drenar por endoscopia convencional en forma segura y eficaz. A través del ultrasonido endoscópico se puede realizar punción transmural, colocación de guía, dilatación con balón y colocación de una o varias prótesis plásticas de doble cola de cochino para facilitar el drenaje; si existe material sólido necrótico, permite la colocación de prótesis metálicas autoexpandibles, totalmente cubiertas, de >10mm. Se refiere una tasa de éxito del 91% y resolución del pseudoquiste en el 93%53.
- 13.
En pancreatitis aguda traumática, con fractura del conducto pancreático principal, la colangiopancreatografía retrógrada endoscópica permite localizar la extensión y el tratamiento de la lesión del conducto. (Segunda ronda de votación: Porcentaje de acuerdo 93%; una abstención)
En niños, el trauma pancreático se presenta en <2% de los traumas abdominales, y pueden incluir hemorragia peripancreática/hematoma, laceración pancreática, transección completa de la glándula, asociado a diferentes grados de daño ductal57. La CPRE permite evaluar la integridad anatómica del conducto pancreático principal (siendo el daño ductal el principal predictor de morbimortalidad), con posibilidad terapéutica de colocar una prótesis en caso de fuga. En la mayoría de los casos no se requiere intervención quirúrgica; esta debe individualizarse con base en el grado exacto de lesión, que se reserva para los grados III-V o en presencia de signos de irritación peritoneal o inestabilidad hemodinámica38,58.
- 14.
La pancreatitis posterior a la colangiopancreatografía retrógrada endoscópica tiene una prevalencia del 9-17% en pediatría. Se recomiendan medidas preventivas como indometacina rectal, ketorolaco e hiperhidratación. (Porcentaje de acuerdo 93%; 2 abstenciones)
La indometacina intrarrectal en adultos ha demostrado disminuir la incidencia de pancreatitis posterior a CPRE; en pediatría, su uso se restringe a adolescentes por la imposibilidad de dosificar (supositorios de 50 y 100mg)59-62. En niños pequeños de alto riesgo hay evidencia de éxito con uso de ketorolaco i.v. a 0.5mg/kg/dosis (incidencia de 11% vs. 25%, p=0.035), pero no con otros antiinflamatorios no esteroideos63,64. La hiperhidratación con solución Ringer lactato, a 3ml/kg/h durante el procedimiento y posteriormente a 20ml/kg dosis única, ha demostrado ser útil para la prevención de dicho padecimiento (incidencia de 0% vs. 17%, p=0.016)65,66.
Tratamiento médico- 15.
El tratamiento intravenoso inicial con soluciones glucosadas y cristaloides es recomendado en niños con pancreatitis aguda, así como la hiperhidratación 1.5 a 2 veces por arriba de la ingesta diaria recomendada. Actualmente, no existe suficiente evidencia para recomendar la solución Ringer lactato sobre la solución salina en niños; sin embargo, en adultos sí se recomienda. (Porcentaje de acuerdo 90%; 2 abstenciones)
El tratamiento hídrico inicial con soluciones glucosadas y cristaloides es fundamental en el manejo de PA en niños38,67. En una revisión sistemática en adultos con PA, se encontró que el empleo de solución Ringer lactato comparado con la solución salina tiene mayor efecto antiinflamatorio, mejora los resultados clínicos y disminuye la presentación de eventos adversos68. No existen ensayos clínicos controlados en pediatría sobre el tipo de soluciones intravenosas a utilizar en la PA. En un estudio retrospectivo multicéntrico pediátrico, el empleo de solución Ringer lactato se asocia con la disminución en los costos de admisión y los días de estancia hospitalaria69.
- 16.
Los analgésicos no narcóticos como paracetamol, metamizol, ketorolaco o ibuprofeno pueden ser la primera línea de tratamiento para el dolor en pancreatitis aguda pediátrica; sin embargo, podría hacerse uso de narcóticos en caso de dolor intenso e incontrolable. (Porcentaje de acuerdo 100%; 0 abstenciones)
Existen pocos estudios controlados con respecto al manejo analgésico en PA en edad pediátrica, por lo que la mayoría de la evidencia científica procede de la extrapolación de estudios y recomendaciones en pacientes adultos38.
La analgesia en PA involucra una amplia gama de fármacos, que deberán individualizarse de acuerdo con la presentación del cuadro clínico38,67-70.
Existe controversia sobre la seguridad del uso de opioides, sobre todo con la morfina, pues se les atribuye el riesgo de aumento en el tono del esfínter de Oddi que podría agravar el cuadro clínico, aunque no existen estudios manométricos del esfínter de Oddi con adecuado diseño metodológico, que demuestren tal aseveración71,72. En cambio, diversos ensayos clínicos y un metaanálisis demuestran la seguridad y eficacia analgésica de buprenorfina, petidina (meperidina), pentazocina, fentanilo y morfina71,73,74.
- 17.
No se recomienda el uso de sonda orogástrica o nasogástrica para descomprimir el estómago. Su uso se limitará en aquellos casos de íleo metabólico y vómito incoercible. (Porcentaje de acuerdo 100%; 0 abstenciones)
En años previos se creía que el uso de la sonda estaba indicado para disminuir la actividad enzimática pancreática y de esta manera recuperar más rápidamente la función; sin embargo, actualmente es conocido que esta práctica es obsoleta. Se debe indicar una dieta enteral lo más pronto posible, ya sea por vía oral o con el uso de sondas30,75-77.
- 18.
No existe evidencia publicada que justifique el uso de inhibidores de la bomba de protones de forma rutinaria en pacientes con pancreatitis aguda. (Porcentaje de acuerdo 100%; 0 abstenciones)
Algunos autores recomiendan el uso profiláctico de inhibidores de bomba de protones en caso de PA grave con riesgo de desarrollar úlceras por estrés; sin embargo, solo están indicados cuando existe úlcera péptica o duodenal, enfermedad por reflujo gastroesofágico o sangrado de tubo digestivo alto78-82.
- 19.
No se recomienda el uso de probióticos en pediatría por la falta de evidencia en niños y estudios controversiales en adultos. (Porcentaje de acuerdo 100%; 0 abstenciones)
Los probióticos han sido considerados una promesa para mejorar la disbiosis implicada en la PA y en su severidad; sin embargo, existen reportes con un beneficio potencial en la disminución de los días de estancia hospitalaria y en la gravedad del cuadro. Por otro lado, en otros estudios se ha reportado un incremento en la mortalidad (PROPATRIA study). La falta de estudios controlados y unificados de qué cepa y qué dosis a utilizar hace que sea difícil emitir una recomendación a favor del uso de estos67,83-87.
- 20.
Los antioxidantes no se recomiendan en el tratamiento médico de niños con pancreatitis aguda. (Porcentaje de acuerdo 100%; 0 abstenciones)
El estrés oxidativo participa en la fisiopatología de los cuadros de PA a través de la formación de radicales libres de oxígeno que ocasionan daño a las células del páncreas. La administración de nutrimentos antioxidantes como retinol, ácido ascórbico, tocoferol y nutrimentos inorgánicos como el selenio en pacientes con PA ha mostrado resultados controversiales. No existe evidencia científica relacionada con antioxidantes en PA en pacientes pediátricos38,88-91.
- 21.
El uso profiláctico de antibióticos no está indicado en pancreatitis aguda, independientemente de su gravedad. Los antibióticos que penetran en el tejido necrótico están indicados en el manejo de la necrosis pancreática o colecciones extrapancreáticas infectadas y en pacientes con pancreatitis necrosante que no mejoran clínicamente y que presentan signos, síntomas y datos de laboratorio sugestivos de infección. (Porcentaje de acuerdo 100%; 0 abstenciones)
La PA grave se puede asociar a traslocación bacteriana, bacteriemia, infección pancreática secundaria y sepsis. El empleo profiláctico de antibióticos es controversial y con la evidencia actual solo están indicados en los casos sospechosos o confirmados de infección pancreática o extrapancreática. La evidencia publicada relacionada con el tratamiento con antibióticos en PA es en adultos38,92-95.
Tratamiento nutricional- 22.
La nutrición oral o nutrición enteral en pancreatitis aguda leve debe iniciarse de forma temprana (primeras 72h del ingreso hospitalario) con una dieta normal y progresarse a tolerancia. (Porcentaje de acuerdo 100%; 0 abstenciones)
Se considera que la nutrición oral o la nutrición enteral (NE) es una intervención terapéutica activa que mejora la evolución de los pacientes con PA, asociada con menor costo y menor tasa de morbimortalidad38,67,96-98. Los mecanismos que sustentan el inicio temprano de la alimentación o NE en PA son la modulación de la respuesta inflamatoria sistémica y disminución de secreción de citocinas, además de disminuir la atrofia de vellosidades intestinales, la estasis luminal, la permeabilidad intestinal; todo esto resulta en menor riesgo de traslocación bacteriana y sepsis38. El inicio temprano no afecta la función exocrina del páncreas38,96,97.
Se ha demostrado que es seguro el reinicio de la nutrición oral o NE en PA leve en las primeras 72h del ingreso hospitalario, en presencia de adecuadas condiciones intestinales, y progresar de acuerdo con la tolerancia hasta lograr requerimientos energéticos totales, incluso en presencia de datos de inflamación sistémica. No es necesario que los valores séricos de amilasa y lipasa se normalicen, ni que el dolor haya cedido por completo, aun cuando continúe con analgesia38,67,96,97.
En una pequeña cohorte de 38 niños con PA leve se mostró que la nutrición oral o NE fueron bien toleradas y no se asociaron a dolor abdominal99. Otro estudio realizado por el mismo grupo encontró que el inicio temprano de la alimentación o NE en PA leve se asoció a menor estancia hospitalaria, menor ingreso a terapia intensiva y menor frecuencia de PA grave100. En una serie de 51 episodios de PA en 32 niños mexicanos, donde al 62.7% se les inició NE temprana, se asoció a menor estancia hospitalaria15.
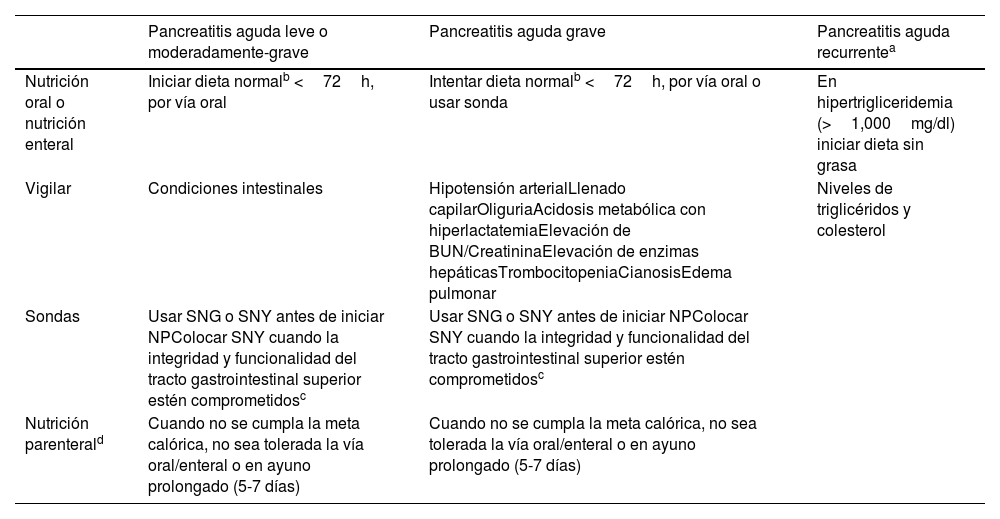
No existe evidencia suficiente de que la nutrición por sonda nasoyeyunal tenga beneficios sobre la nutrición nasogástrica en pacientes pediátricos con PA moderada a grave101. Las recomendaciones dadas por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) en 2019 indican el uso de sonda nasoyeyunal en casos donde la integridad y la funcionalidad del tracto gastrointestinal superior se encuentran comprometidas (tabla 2)102.
Tratamiento nutricional y vigilancia clínica en pancreatitis aguda y pancreatitis aguda recurrente
| Pancreatitis aguda leve o moderadamente-grave | Pancreatitis aguda grave | Pancreatitis aguda recurrentea | |
|---|---|---|---|
| Nutrición oral o nutrición enteral | Iniciar dieta normalb <72h, por vía oral | Intentar dieta normalb <72h, por vía oral o usar sonda | En hipertrigliceridemia (>1,000mg/dl) iniciar dieta sin grasa |
| Vigilar | Condiciones intestinales | Hipotensión arterialLlenado capilarOliguriaAcidosis metabólica con hiperlactatemiaElevación de BUN/CreatininaElevación de enzimas hepáticasTrombocitopeniaCianosisEdema pulmonar | Niveles de triglicéridos y colesterol |
| Sondas | Usar SNG o SNY antes de iniciar NPColocar SNY cuando la integridad y funcionalidad del tracto gastrointestinal superior estén comprometidosc | Usar SNG o SNY antes de iniciar NPColocar SNY cuando la integridad y funcionalidad del tracto gastrointestinal superior estén comprometidosc | |
| Nutrición parenterald | Cuando no se cumpla la meta calórica, no sea tolerada la vía oral/enteral o en ayuno prolongado (5-7 días) | Cuando no se cumpla la meta calórica, no sea tolerada la vía oral/enteral o en ayuno prolongado (5-7 días) |
BUN: nitrógeno ureico; NP: nutrición parenteral; SNG: sonda nasogástrica; SNY: sonda nasoyeyunal.
No hay estudios suficientes en población pediátrica para poder emitir una recomendación absoluta respecto a los diferentes tipos de líquidos con los que se debe iniciar la NE (líquidos claros, leche entera, polimérica, fórmula elemental o semielemental)97,103.
Existe suficiente evidencia del beneficio del inicio de la nutrición oral o NE y debe iniciarse tan pronto como sea posible38.
- 23.
En pancreatitis aguda grave la nutrición oral o nutrición enteral debe intentarse dentro de las primeras 72h del ingreso hospitalario, una vez estabilizado el paciente. (Porcentaje de acuerdo 97%; una abstención)
Existe evidencia en población adulta con PA grave que ha demostrado la eficacia y seguridad de la nutrición oral o NE en las primeras 48h de admisión, con menor proporción de síntomas gastrointestinales, complicaciones locales, infecciones sistémicas, necesidad de cirugía, falla orgánica múltiple, mortalidad y estancia hospitalaria104-108. Esta última aún en presencia de dolor abdominal y elevación de enzimas pancreáticas108. Se ha observado en estudios pediátricos que el inicio de la nutrición oral o NE temprana disminuye complicaciones, estancia hospitalaria y mortalidad en pacientes admitidos a terapia intensiva97,101. En adultos, también se ha demostrado la superioridad sobre la nutrición parenteral (NP) para disminuir mortalidad, complicaciones infecciosas y quirúrgicas, y falla orgánica109,110. Sin embargo, aún hay duda para iniciarla como medida de tratamiento. Un estudio canadiense de 223 niños reportó que suele iniciarse de forma tardía en PA moderadamente-grave o grave (9 días, RIQ 5-15 días), en comparación con aquellos con PA leve (3 días, RIQ 1-3 días), respectivamente (p<0.0001)111.
La finalidad de la nutrición oral o NE en PA grave (confirmada o pronosticada) es mantener la función de barrera intestinal y debe intentarse de forma temprana, excepto en presencia de contraindicaciones directas (íleo, fístula compleja, síndrome abdominal compartimental) o alguna otra contraindicación para el reinicio de la vía oral/enteral, una vez lograda la estabilidad hemodinámica y metabólica del paciente (tabla 2)97,112.
- 24.
No existe evidencia científica que apoye la indicación de una dieta baja en grasa sobre una dieta normal en episodios de pancreatitis aguda. (Porcentaje de acuerdo 97%; una abstención)
Una dieta sólida completa y sin restricción de grasa es segura y bien tolerada en los pacientes que pueden alimentarse por vía oral/enteral, ya que la ingesta de grasa no afecta la evolución en PA leve-moderada97,113. En un estudio que incluyó 33 niños de 2 a 18 años con PA leve-moderada, divididos en 2 grupos: 1) ayuno con líquidos intravenosos y posteriormente una dieta baja en grasa, y 2) alimentación sin restricciones dentro de las 24h posteriores al inicio de los síntomas, se demostró que el comienzo temprano de una dieta sin restricción de grasa es segura y no tiene diferencias en el tiempo de alta, tasas de readmisión y disminución de los niveles de lipasa, en comparación con el subgrupo de ayuno inicial y posteriormente una dieta baja en grasa98. Otro estudio mostró que niños hospitalizados con PA leve, con ingesta media de grasa entre <0.5 y >1g/kg/día (bajo 0-0.5g/kg/día, normal 0.5-1g/kg/día y alto >1g/kg/día), no tuvo impacto significativo en la duración de la estancia hospitalaria y los valores de lipasa. Una mayor ingesta de grasa se asoció con puntuaciones diarias significativamente más bajas de la severidad del dolor (p<0.001)99,113.
El tratamiento de PAR asociada a hipertrigliceridemia requiere de una dieta baja en grasa para tratar este trastorno metabólico103. Sin embargo, de acuerdo con el último consenso de la ESPGHAN de 2018, en la mayoría de los reportes el término «bajo en grasa» no está bien definido. Se hace referencia a una dieta pediátrica «normal en grasa» aquella que contiene 30-40% de lípidos para niños de 1-3 años y 25-35% para niños de 4-18 años97. Se recomienda que el porcentaje de grasa durante los primeros 6 meses sea del 40-60%; posteriormente, se reduce de forma gradual al 35% a los 2 años y después de los 2 años al 25-35%114.
Hasta que se disponga de evidencia en contra de una dieta normal en grasa, se recomienda no restringir grasa en PA113.
- 25.
Se prefiere la nutrición oral/enteral sobre la nutrición parenteral o en combinación. (Porcentaje de acuerdo 100%; 0 abstenciones)
En un metaanálisis con pacientes pediátricos se identificó una tasa de mortalidad para la NE del 7% versus el 20.7% para NP total (NPT). Así mismo, en adultos se demostró que el inicio de la alimentación o NE de forma temprana tiene un descenso en la mortalidad de un 50% al compararse con el uso exclusivo de NPT115,116.
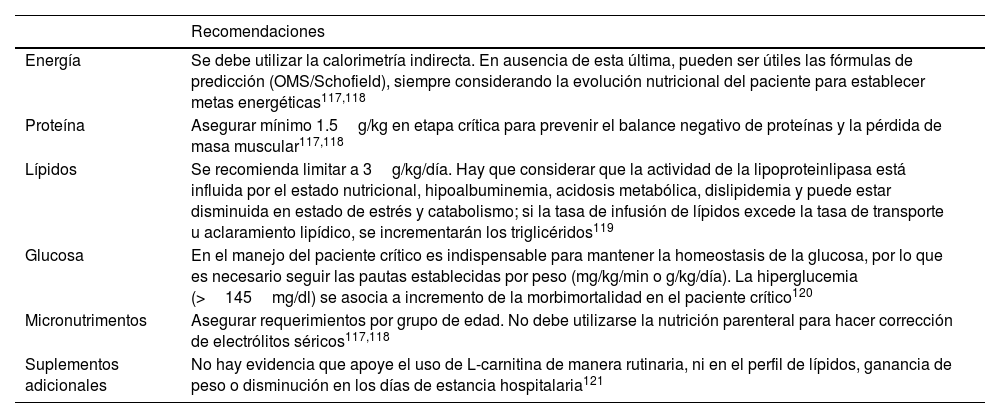
La NPT debe reservarse para casos donde la vía oral/enteral no sea tolerada y considerarse cuando la NE no sea posible en un período prolongado (entre 5-7 días). A la fecha, no existe evidencia sólida del uso de la NP combinada con nutrición oral o NE; no obstante, se recomienda realizar esta intervención, principalmente en pacientes que no cumplan su meta calórica o cuando existan contraindicaciones directas de la vía enteral97,113,116. En casos de contraindicación de la vía oral/enteral, se recomienda seguir las pautas actuales de recomendaciones de NPT para el paciente pediátrico crítico (tabla 3)117-121.
Recomendaciones para el uso de nutrición parenteral en el paciente con pancreatitis aguda
| Recomendaciones | |
|---|---|
| Energía | Se debe utilizar la calorimetría indirecta. En ausencia de esta última, pueden ser útiles las fórmulas de predicción (OMS/Schofield), siempre considerando la evolución nutricional del paciente para establecer metas energéticas117,118 |
| Proteína | Asegurar mínimo 1.5g/kg en etapa crítica para prevenir el balance negativo de proteínas y la pérdida de masa muscular117,118 |
| Lípidos | Se recomienda limitar a 3g/kg/día. Hay que considerar que la actividad de la lipoproteinlipasa está influida por el estado nutricional, hipoalbuminemia, acidosis metabólica, dislipidemia y puede estar disminuida en estado de estrés y catabolismo; si la tasa de infusión de lípidos excede la tasa de transporte u aclaramiento lipídico, se incrementarán los triglicéridos119 |
| Glucosa | En el manejo del paciente crítico es indispensable para mantener la homeostasis de la glucosa, por lo que es necesario seguir las pautas establecidas por peso (mg/kg/min o g/kg/día). La hiperglucemia (>145mg/dl) se asocia a incremento de la morbimortalidad en el paciente crítico120 |
| Micronutrimentos | Asegurar requerimientos por grupo de edad. No debe utilizarse la nutrición parenteral para hacer corrección de electrólitos séricos117,118 |
| Suplementos adicionales | No hay evidencia que apoye el uso de L-carnitina de manera rutinaria, ni en el perfil de lípidos, ganancia de peso o disminución en los días de estancia hospitalaria121 |
- 26.
El tratamiento quirúrgico en pancreatitis aguda necrótica es poco común. (Porcentaje de acuerdo 97%; una abstención)
El tratamiento se recomienda realizarlo en «pasos ascendentes». La indicación de cirugía son pacientes con mala respuesta al tratamiento médico, deterioro progresivo, disfunción multiorgánica y/o colecciones necróticas infectadas, iniciando con los tratamientos menos invasivos122. Entre las modalidades de tratamiento se incluyen las percutáneas, endoscópicas o quirúrgicas. El drenaje percutáneo reduce la necesidad de tratamiento quirúrgico hasta en el 35% de los casos en adultos122. El tratamiento quirúrgico se recomienda entre la tercera o cuarta semana de evolución38,123,124. La necrosectomía se realiza usando la técnica de preservación de órgano con disección roma, para minimizar el riesgo de sangrado, fístula o remoción de tejido vivo125. Las técnicas quirúrgicas incluyen abordaje laparoscópico, necrosectomía retroperitoneal de mínima invasión y necrosectomía retroperitoneal; en adultos, ninguna técnica ha mostrado ser mejor que otra23,125. Adicionalmente, el paciente con PA necrótica puede requerir de valoración quirúrgica por fístulas intestinales, gástricas o pleurales, sangrado y síndrome compartimental126.
- 27.
El pseudoquiste pancreático es una complicación que rara vez puede ameritar tratamiento quirúrgico. (Porcentaje de acuerdo 93%; una abstención)
La gran mayoría de los pseudoquistes se resuelven de manera espontánea entre el tercer y cuarto mes; cuando se requiere de drenaje, el tratamiento de elección es el endoscópico o percutáneo. Sin embargo, el tratamiento quirúrgico puede estar indicado cuando exista una estrechez compleja del conducto pancreático, pseudoquiste en cola de páncreas y contiguo al bazo, compresión severa de la vía biliar y duodeno, pseudoquistes múltiples o recurrentes, complicaciones vasculares no resueltas por angiografía y falla de tratamiento endoscópico o percutáneo127-129. El tratamiento consiste en crear una anastomosis entre el tracto gastrointestinal y el quiste. Se han descrito diferentes técnicas que pueden ser realizadas vía laparoscópica o abiertas: cistogastrostomía, cistoduodenostomía, cistoyeyunostomía, pancreatectomía central y pancreatoyeyunostomía130-133. En una revisión sistemática de 10 años, el drenaje laparoscópico fue exitoso en el 98.3%, 2.5% de recurrencias y complicaciones en <2%132. En un metaanálisis realizado en adultos, el abordaje laparoscópico se asoció con menor hemorragia y duración del procedimiento en comparación con el abordaje abierto133.
- 28.
No existe un marcador de laboratorio o escala validada que pueda predecir con certeza a los pacientes en riesgo de desarrollar pancreatitis grave en pediatría. (Porcentaje de acuerdo 100%; 0 abstenciones)
DeBanto publicó el primer puntaje pediátrico para determinar riesgo de gravedad en pancreatitis. Coffey et al. encontraron que un incremento del valor basal de lipasa sérica >7 veces a su ingreso incrementa el riesgo de pancreatitis grave (RM 7.1, IC 95% 2.5-20.5), VPN 89% y VPP 46%37. El principal inconveniente de estos estudios es que fueron realizados sin un criterio de PA grave en pacientes pediátricos2.
Recientemente, un estudio encontró que niveles séricos de nitrógeno ureico >13mg/dl y albúmina <3.6g/dl tenían una sensibilidad 71%, especificidad 79%, VPP 60% y VPN 86% para determinar PA grave134. El mismo grupo encontró que la elevación de los niveles séricos de IL-6, proteína quimiotáctica de los monocitos (MCP-1) y/o la proteína C reactiva incrementaban el riesgo de PA grave. Estos estudios, en concordancia con los criterios propuestos por la Sociedad Norteamericana de Gastroenterología, Hepatología y Nutrición Pediátrica, son promisorios y abren la posibilidad de realizar estudios prospectivos para corroborar estos hallazgos135.
- 29.
En pacientes con un primer evento de pancreatitis aguda leve con litiasis biliar se sugiere realizar colecistectomía durante el mismo internamiento. (Porcentaje de acuerdo 97%; una abstención)
Hay evidencia científica de que la colecistectomía como tratamiento para la colelitiasis en pancreatitis biliar se puede realizar de manera segura, y que previene la recurrencia de pancreatitis en población pediátrica comparado con colecistectomía rezagada (0-4% vs. 22-36%)136-139. Del mismo modo se ha reportado una reducción de riesgo de reingreso por pancreatitis hasta en el 57% al realizarse dentro de las primeras 2 semanas del primer cuadro de pancreatitis140.
Con respecto a las complicaciones quirúrgicas (sangrado, infección de herida, estancia prolongada y lesión de vía biliar), también existe mayor evidencia en estudios controlados y metaanálisis en adultos, donde no hay diferencia entre los grupos sometidos a colecistectomías tempranas (en el mismo evento internamiento, e incluso el mismo día) contra las realizadas de manera rezagada, con diferencia de riesgo de −0.0016, IC 95% ([−0.04]-0.04); y RM 0.78, 0.38 a 1.62)141-145.
Responsabilidades éticasDebido a que esto es un documento de consenso, basado en la mejor evidencia científica publicada y no se trata de un estudio de investigación sobre pacientes, no aplicó el solicitar a los pacientes el consentimiento informado para recibir el tratamiento para participar en la investigación. No se realizó experimento alguno en animales y/o humanos.
Dada la naturaleza descriptiva del documento y al ser un documento de posición de la asociación, no se requirió de la autorización de ningún comité de ética.
Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes.
FinanciaciónNinguna.
Conflicto de interesesTodos los autores confirman que no tienen ningún conflicto de interés para el desarrollo de este consenso.