¿ Introducción
Desde su descubrimiento por Choo y colaboradores1 en 1989 el virus de la hepatitis C (VHC) se ha convertido en la gran epidemia silente a nivel mundial, dada su creciente prevalencia e incidencia, y la alta frecuencia de portadores asintomáticos que sólo tienen manifestaciones clínicas en estadíos avanzados de la infección.
El VHC es un virus envuelto, con ARN de polaridad positiva, perteneciente a la familia Flaviviridae, género Hepacivirus.2,3 El genoma viral es de aproximadamente 9600 pares de bases, codifica una única poliproteína que es escindida por proteasas celulares y virales en tres péptidos estructurales que conforman el virión maduro (proteína core, E1 y E2) y en siete no estructurales (p7, NS2-NS5B). El genoma contiene secuencias nucleotídicas en ambos extremos que no se traducen (5' y 3' UTRs o NCRs) y que intervienen en la regulación de la replicación y la expresión del genoma viral.3-5
El VHC muestra un alto grado de heterogeneidad genética. Actualmente existen 6 genotipos, clasificados de acuerdo al análisis nucleotídico de un segmento en la región 5' UTR. Algunos de ellos, a su vez, se dividen en subtipos. Las diferencias nucleotídicas entre genotipos son de 31% a 33%, mientras que hay una divergencia de 20% a 25% entre subtipos.2,4,6 Los genotipos 1, 2, y 3 tienen una distribución mundial. Los subtipos 1a y 1b son los más comunes en Estados Unidos y en Europa, mientras que el subtipo 1b es predominante en Japón. Aunque los subtipos 2a y 2b son relativamente frecuentes en América, Europa y Japón, el subtipo 2c es encontrado en el Norte de Italia. El genotipo 3a es altamente frecuente en pacientes que abusan de drogas intravenosas en Europa y en Estados Unidos. El genotipo 4 es el principal en África y en el Medio Este. Los genotipos 5 y 6 están limitados a Sud África y Asia, respectivamente.7,8
La caracterización genotípica del VHC tiene no sólo un interés epidemiológico para conocer la distribución geográfica o posibles rutas de diseminación, sino que existen diferencias de relevancia clínica asociadas al genotipo, entre las que se encuentran la patogénesis de la infección, el desempeño de algunos ensayos diagnósticos, y la respuesta al tratamiento con interferón y ribavirina. De esta forma y según lo establecido por el Consenso Argentino de Hepatitis C, la duración del tratamiento es de 24 semanas para los genotipos 2 o 3 y de 48 semanas para los genotipos 1 o 4.2,3,9 Se recomienda una determinación de carga viral a los seis meses de concluido el tratamiento para establecer la respuesta viral sostenida.
Este estudio tiene como objetivo principal analizar la distribución de genotipos del VHC en pacientes con serología positiva atendidos en un laboratorio de análisis clínicos de la ciudad de Córdoba, República Argentina. A partir de los datos encontrados, se buscó relacionar los genotipos con la actividad de alanina-amino-transferasa (ALT) como marcador de daño hepático, con la carga viral como marcador virológico, y con el sexo, la edad y los antecedentes de riesgo para contraer el VHC del paciente al momento del diagnóstico. Como último objetivo, se analizó una posible asociación entre la respuesta al tratamiento de los genotipos prevalentes con la actividad de ALT y la carga viral seis meses después de finalizada la terapia (respuesta viral sostenida).
¿ Métodos
Se realizó un estudio observacional y retrospectivo, considerando las muestras sanguíneas analizadas durante el período de enero de 2001 al mes de mayo de 2009 en un laboratorio de análisis clínicos especializados de la ciudad de Córdoba, Argentina. Se incluyeron todos los pacientes que concurrieron a nuestro laboratorio y presentaron reactividad en la prueba de ELISA para VHC y tuvieron carga viral cuantificable. Se excluyeron pacientes con valores de ALT causados por otra patología o condición conocida (v gr. receptores de trasplante), pacientes con hepatitis C aguda y aquellos con evidencia serológica de co-infección con virus de la hepatitis B o virus de la inmunodeficiencia humana.
Se incluyeron en el análisis final 71 pacientes con diagnóstico de infección por VHC cuyas historias clínicas fueron extraídas de la base de datos del laboratorio. Se realizó la revisión documentaria de las mismas utilizando una planilla de recolección de datos diseñada especialmente para este estudio con el objetivo de conservar confidencialidad y anonimato en los datos obtenidos en el presente estudio.
Para fines esta investigación, se utilizaron las siguientes definiciones operacionales:
Tiempo de seguimiento: el tiempo transcurrido en años desde la carga viral al momento del diagnóstico hasta la última carga viral control en nuestro laboratorio.
Perfil epidemiológico: Edad (en años), sexo (masculino o femenino) y antecedentes de riesgo (conducta o evento asociado a la infección por VHC como transfusión sanguínea, cirugías, hábito sexual de riesgo, accidente laboral o causa desconocida). Los pacientes de los cuales no poseíamos datos sobre antecedentes de riesgo para contraer el virus se clasificaron como indeterminados.
Perfil de laboratorio: La actividad sérica de alanina-amino-transferasa (ALT) fue determinada por método UV optimizado (Wiener Lab. Rosario, Argentina). La detección de anticuerpos contra el VHC (anti-VHC) se realizó utilizando una técnica de enzimoinmunoensayo (Wiener Lab. Rosario, Argentina). La carga viral se hizo en el Centro de Diagnóstico Molecular (CDM- Biosydus) en Buenos Aires, Argentina, utilizando NASBA HVC cuantitativo (Organon Teknika - Biomeriux) que realiza la amplificación enzimática de ácidos nucleicos con un límite de detección de 280 UI por mililitro y posee un rango activo de medición de 280 a 28 000 000 UI por mililitro (marca aprobada sólo en Argentina). El genotipo del VHC fue determinado mediante técnica de restricción enzimática y análisis del polimorfismo de los fragmentos de restricción. La clasificación de los genotipos fue realizada de acuerdo con Simmonds y colaboradores.2
Análisis estadístico: Las comparaciones cuantitativas se realizaron utilizando prueba t para muestras independientes, prueba de la mediana para dos muestras, prueba F para igualdad de varianzas. Se emplearon tablas de frecuencias y contingencia. Una p < 0.05 fue considerada estadísticamente significativa. Para el análisis de datos se empleó la hoja electrónica de Excel 2003 con su componente analítico y el programa Infostat 2007/2008 versión libre.
¿ Resultados
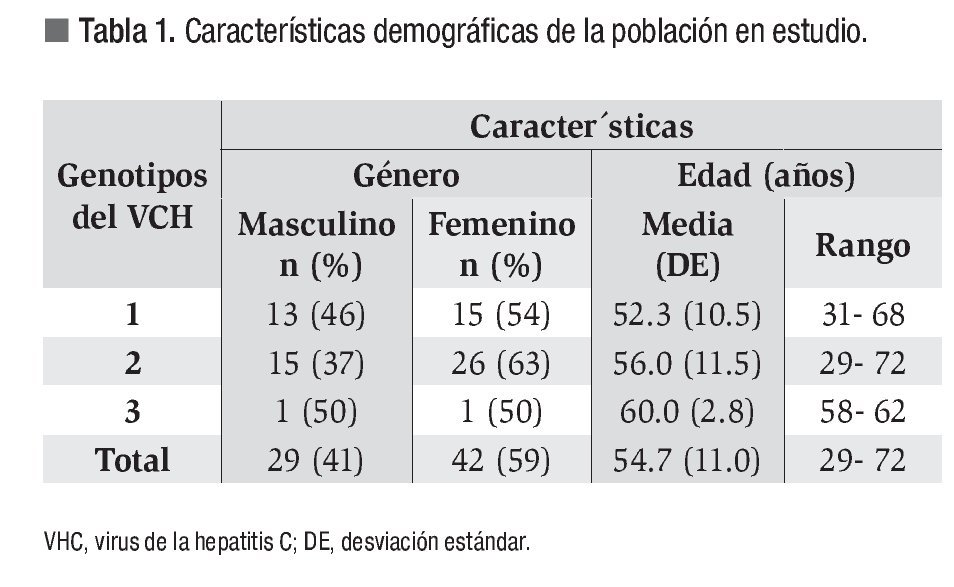
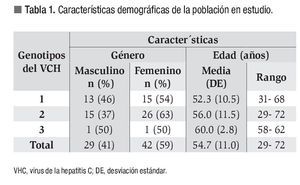
Se recolectaron los datos de 71 pacientes que cumplían con los criterios de selección. El tiempo de seguimiento fue de 1.84 años (rango: 0 a 8 años). La distribución por sexo fue 59% mujeres y 41% de hombres, con una edad promedio de 55 años (rango: 29 a 72 años). Para el análisis estadístico cotejamos la edad con cada uno de los genotipos y no encontramos diferencias significativas (p = 0.23), al igual que la edad con respecto al sexo, p = 0.11 (Tabla 1).
La frecuencias de genotipo del VHC encontradas fue la siguiente: genotipo 1: 39%; genotipo 2: 58% y; genotipo 3: 3%.
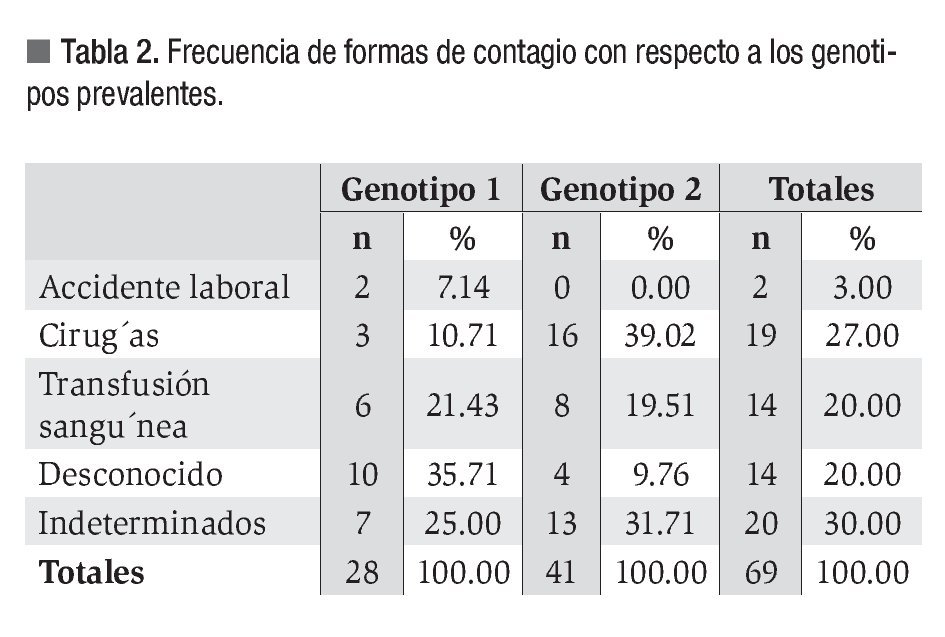
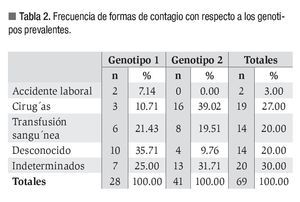
En relación a los antecedentes de riesgo, 22 pacientes (31%) fueron indeterminados. Del resto (n = 49), la mayor proporción manifestó antecedentes de intervención quirúrgica (n = 19, 27%), seguida de transfusión sanguínea (n = 14, 20%) y accidentes de trabajo (n = 2, 3%). Catorce pacientes (20%) no recordaron un antecedente claro de riesgo de infección o lo desconocían. Al relacionar los antecedentes de riesgo con los genotipos encontramos que 35% de pacientes con genotipo 1 que desconocían la causa de contagio del VHC, mientras que 39% de pacientes con genotipo 2 atribuyeron el contagio a una cirugía (Tabla 2).
Para evaluar la relación de los niveles de ALT con los diferentes genotipos de VHC, analizamos esta variable al momento del diagnóstico en 42 muestras de la población estudiada. No se encontró una diferencia estadísticamente significativa al comparar las medias en los dos genotipos de mayor frecuencia. En muestras con genotipo 1, la media fue de 78.86 ± 55.25 (n = 21) y en muestras con el genotipo 2 fue de 48.81 ± 40.71 (n = 21); p = 0.051.
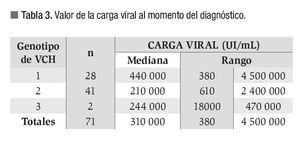
Se analizó la relación de la carga viral al momento del diagnóstico con respecto a los genotipos encontrados en las muestras de los 71 pacientes estudiados. La mediana de la carga viral fue de 310 000 UI/ mL (rango: 380 a 4 500 000). No se encontró un valor de corte de carga viral para identificar los distintos genotipos, pero al comparar las medianas entre los genotipos de mayor frecuencia, las muestras con genotipo 1 (n = 28) contenían un número mayor de copias del VHC que las muestras con genotipo 2 (n = 41), con una diferencia estadísticamente significativa: p < 0.0001 (Tabla 3).
Se analizó la respuesta del paciente seis meses después de finalizado el tratamiento, evaluando los valores de carga viral. De la población en estudio, 42 pacientes concurrieron al laboratorio a realizarse el control. Se encontró que los pacientes con genotipo 2 presentaron una respuesta viral sostenida en 26 de 27 casos evaluados (96%), mientras que en los pacientes con genotipo 1 se obtuvo ese estado en 10 de 15 pacientes (67%). En este estudio la respuesta viral sostenida fue independiente del valor inicial de carga viral en los pacientes con genotipo 2, mientras que en los pacientes de genotipo 1 se observó que niveles de carga viral mayor a las 800 000 UI/mL tuvieron menor respuesta al tratamiento.
Los niveles de ALT post tratamiento no mostraron una diferencia estadísticamente significativa entre los genotipos prevalentes. El genotipo 1 presentó una media de 28.09 ± 21.78 (n = 11) y los pacientes con genotipo 2 una media de 39.46 ± 31.73 (n = 13), p = 0.33. Al comparar las medias de los valores de ALT antes y después del tratamiento, los pacientes con genotipo 2 no mostraron diferencias significativas (p = 0.89) al contrario de los pacientes con genotipo 1 (p = 0.002).
¿ Discusión
En este estudio realizado en un laboratorio de análisis clínicos en la ciudad de Córdoba, Argentina, el genotipo de mayor frecuencia de los casos de infección con VHC fue el dos. El 58% de los pacientes estudiados fueron infectados con VHC tipo 2, 39% con tipo 1 y 3% con tipo 3. Esta frecuencia de genotipos del VHC fue similar a lo descrito en otros estudios realizados en el área central de Argentina y algunos países de Latinoamérica.10,11
En algunos trabajos publicados, la proporción de varones infectados por VHC predomina sobre el género femenino,12,13 en contraste con nuestro estudio y otros más efectuados en esta zona de América10,14 en que se observó predominio de mujeres. La edad promedio de los casos fue similar a la descrita previamente,9,10 y no encontramos ninguna relación entre el género o la edad y algún genotipo en particular.10
En relación con los antecedentes de riesgo manifestados por los pacientes estudiados, la mayor proporción se debió al uso de material médico no descartable y transfusiones sanguíneas antes del año 1994, como ha sido publicado en Sudamérica.8,9,12 La frecuencia por accidentes laborales se encontró dentro de los valores comunicados en nuestro medio.9 Un alto porcentaje de los pacientes con genotipo 1 desconocían la causa de contagio del VHC, en contraste a los pacientes con genotipo 2 que relacionaron el contagio con intervenciones quirúrgicas. Estos datos son los primeros publicados en el área central del país e implican considerar como factor de riesgo a las intervenciones quirúrgicas y realizar un seguimiento a los procedimientos empleados.
En este trabajo analizamos los niveles de ALT al momento del diagnóstico pero no encontramos relación entre el genotipo y esta enzima al igual que en otros estudios realizados en Argentina, Perú y Estados Unidos.12,13,15 Tampoco encontramos diferencia estadística entre los genotipos y los niveles de ALT post- tratamiento, aunque los pacientes con genotipo 1 presentaron mayor descenso de la enzima que los pacientes infectados con genotipo 2. Sin embrago, este parámetro no se considera útil para definir respuesta al tratamiento.16 Los pacientes con ALT normal respondieron al tratamiento antiviral de forma muy similar a los pacientes con ALT elevadas como lo observado por Zeuzem y colaboradores.12,16-18
La media de la carga viral fue similar a la encontrada en otras poblaciones americanas como en México, Perú y Uruguay.12,14,19 Márquez-Rosales y colaboradores14 describieron la relación entre genotipo y carga viral en México, la cual no pudimos encontrar en nuestro estudio y concuerda con lo descrito por Colina y colaboradores en Uruguay.19 Sin embargo, podemos afirmar que las muestras de pacientes con genotipo 1 mostraron cargas virales más altas lo que coincide a lo encontrado por Nainan y colaboradores20 en los Estados Unidos de Norteamérica.
La combinación de interferón pegilado con ribavirina es la terapia de elección para pacientes infectados con VHC según lo recomendado en 2007 por el Consenso Argentino de Hepatitis C.9 Al evaluar la respuesta viral sostenida (RVS) en nuestra población encontramos que 96% de los pacientes con genotipo 2 respondieron al tratamiento, superior a lo informado en Argentina y otros países Latinoamericanos.9,21,22 De los pacientes con genotipo 1, 67% respondieron al tratamiento, lo que también es mayor a lo esperado.9,21-24 Observamos que pacientes infectados con tipo 1 que tuvieron cargas virales mayores a 800 000 UI/mL presentaron menor respuesta al tratamiento. Muir y colaboradores lo describen como una de las causas que disminuye las probabilidades de alcanzar una respuesta viral sostenida.16,19,25
En conclusión, en los pacientes infectados por el VHC que concurrieron a nuestro laboratorio el genotipo 2 es el más prevalente. Se corroboró además, que la detección del genotipo de VHC es una herramienta fundamental para planificar el tratamiento antiviral. Consideramos que lo más relevante de nuestra investigación fue poder determinar a las intervenciones quirúrgicas como antecedente de riesgo para contraer el VHC tipo 2.
Correspondencia: Lic. Rubén Darío Ruiz.
Paraná 537- 2º Piso- Dpto. B. Nueva Córdoba, Córdoba. República Argentina.
Teléfono y fax: (54-351)
4245040.
Correo electrónico: rubendruiz@hotmail.com
Recibido el 5 de mayo de 2010;
aceptado el 14 de julio de 2010.