Introducción
La encefalopatía hepática mínima (EHM) es una condición en la que los pacientes cirróticos sufren una serie de alteraciones neuropsicológicas que afectan a su calidad de vida y capacidad para desarrollar tareas peligrosas, pero que pasan desapercibidas en la práctica clínica habitual, ya que muestran una exploración neurológica normal y se requieren tests psicométricos o estudios neurofisiológicos para su correcto diagnóstico.1
El desarrollo de encefalopatía hepática (EH) condiciona un mal pronóstico a la enfermedad, de forma que se estima que la supervivencia se sitúa en torno al 25% a los 3 años de sufrir un episodio de EH clínica.2 Un reconocimiento precoz de alteraciones neuropsicológicas que puedan predecir el desarrollo de esta complicación sería fundamental en el manejo del paciente cirrótico, y para ello, es muy importante investigar la presencia de EHM.
La EHM es la primera alteración dentro del espectro de manifestaciones clínicas del síndrome de la EH,3,4 de forma que 84% de los cirróticos que desarrollan EH en el seguimiento presentaban EHM en el estudio basal.5 La presencia de EHM provoca un deterioro de la calidad de vida, con mayor alteración en las categorías de tiempo libre, alerta, sueño y descanso, interacción social, gestión del hogar, comportamiento emocional y el trabajo.6 El deterioro en la aptitud laboral es el que genera mayor impacto en la calidad de vida, siendo especialmente importante la afectación en profesiones que requieren destreza manual, ya que el déficit específico se aprecia en la función psicomotora e inteligencia práctica con preservación de la capacidad verbal.7
Se han utilizado numerosos criterios diagnósticos para definir la presencia de EHM, desde la utilización aislada del test de conexión numérica, hasta el empleo de complejas baterías de pruebas psicométricas. Según el último consenso mundial sobre encefalopatía hepática,8 se acepta que la utilización conjunta de más de dos pruebas psicométricas o la combinación de pruebas psicométricas con pruebas neurofisiológicas permiten confirmar o descartar la presencia de EHM.
La prevalencia de EHM en pacientes con cirrosis hepática depende de la selección de pruebas psicométricas empleadas para su diagnóstico, de la existencia de tablas de normalidad que permitan clasificar correctamente a los pacientes y de la función hepática de los pacientes incluidos. Cuando se utilizan pruebas psicométricas validadas, corregidas por los datos obtenidos en población sana controladas por edad y nivel de instrucción, la prevalencia de EHM oscila entre 25 y 33% de los pacientes cirróticos compensados.
Recientemente, se están introduciendo nuevas herramientas para el diagnóstico de la EHM en la práctica clínica, como es la medición de la frecuencia crítica de parpadeo (FCP) mediante el HepatonormTM Analyzer (R&R Medi-Business Freiburg GmbH, Freiburg, Germany). Las ventajas fundamentales del uso de esta nueva herramienta radican en este método simple, exacto y seguro para el diagnóstico de la EHM, no está influenciado por la edad o la educación y podría predecir el desarrollo de episodios de HE.9
Los factores que predisponen para la aparición de encefalopatía hepática son la disfunción hepática y el desarrollo de comunicaciones portosistémicas. Por ello, podemos encontrar pacientes en los que cada uno de estos factores juegue un papel preponderante. En ambos tipos de situaciones el amonio es el principal responsable del desarrollo del cuadro clínico, en un caso por evitar el paso hepático y en el segundo por la incapacidad del hígado de detoxificarlo.
Actividad glutaminasa e hiperamoniemia
El metabolismo del amonio depende básicamente de tres reacciones metabólicas: el ciclo de la urea, que permite la eliminación de amonio mediante la síntesis de urea, la síntesis de glutamina por acción de la glutamina sintetasa y la desaminación de la glutamina por la actividad glutaminasa. Inicialmente se comunicó que la mayor parte del amonio se producía a partir del desdoblamiento de productos nitrogenados llevado a cabo por las bacterias colónicas.10 Estudios recientes demuestran que el amonio se genera básicamente en el intestino delgado y es producido a partir de la deaminación de la glutamina, siendo el colon responsable del 10 al 15% del amonio generado.11 En personas sanas, la mayor actividad glutaminasa a lo largo del tracto gastrointestinal se encuentra en el duodeno, de tal forma que aproximadamente un total del 84% de la actividad glutaminasa está en el intestino delgado.
La enzima fundamental en el desdoblamiento de la glutamina es la glutaminasa mitocondrial fosfato-dependiente tipo renal. Esta enzima está elevada cuatro veces en pacientes con cirrosis hepática en comparación con controles sanos y a su vez, correlaciona con la presencia de encefalopatía hepática mínima, así como con la concentración intracerebral de glutamina.12 Asimismo, la administración oral de glutamina induce un fuerte incremento de la amoniemia venosa en pacientes con cirrosis hepática y EHM, mientras que este aumento no se aprecia en controles sanos o en cirróticos después del trasplante hepático. Los resultados de esta prueba dependen de la función hepática, del grado de comunicaciones portosistémicas y de la actividad glutaminasa intestinal, y por tanto, avalan la importancia de la producción intestinal de amonio, independiente de la acción de las bacterias.13
El amonio producido en el intestino alcanza el hígado por vía portal y es detoxificado mediante el ciclo de la urea, en los hepatocitos periportales. Es la vía metabólica más eficaz, ya que retira más del 80% del amonio portal y no consume energía. En caso necesario, el amonio es metabolizado hacia la síntesis de glutamina mediante la actividad glutamina-sintetasa localizada en los hepatocitos pericentrales. En la cirrosis hepática se ha constatado que la capacidad de síntesis de urea disminuye paralela a la disfunción hepática y resulta insensible a las principales vías de estimulación. En esta situación el músculo juega un papel fundamental en la detoxificación del amonio, representando una vía más eficaz que el propio hígado, basada en una captación neta de amonio para la sintesis de glutamina por la actividad glutamina-sintetasa, sin liberación posterior del aminoácido, de forma que el músculo extrae la mayor parte del amonio arterial y apenas libera glutamina, permaneciendo en el músculo como reserva de amonio no tóxico.14
El riñón posee, al igual que el intestino, actividad glutaminasa, por lo que produce amonio derivado de la deaminación de la glutamina. En condiciones normales un tercio de este amonio es eliminado por la orina y dos tercios pasan a la circulación sistémica. En situaciones de hiperamoniemia o acidosis el cociente se invierte, acentuándose en condiciones de hipopotasemia.15 Así también, el metabolismo del amonio y la glutamina a nivel renal parece estar modulado por el equilibrio ácido-base, el flujo renal y los niveles plasmáticos de angiotensina II.16 Por ello, las alteraciones hemodinámicas del síndrome de hipertensión portal están implicadas en la génesis renal de amonio y por tanto en la patogenia de la EH. La hemorragia digestiva por várices esofagogástricas o una situación simulada se ha asociado a un aumento de la producción renal de amonio y su liberación al torrente circulatorio.17 Asimismo, se ha demostrado que la reposición de volumen en pacientes cirróticos se acompaña de una mayor excreción renal de amonio y un descenso de la amoniemia plasmática,18 lo que avalaría está vía de eliminación como una potencial diana terapéutica.
La SOG es una prueba segura, sin efectos adversos reseñables cuando se utilizan 10 gramos de L-glutamina. Tras la ingesta de glutamina se produce un ascenso de la amoniemia sistémica que alcanza su máximo a los 60 minutos, declinando posteriormente. Durante la prueba de la sobrecarga oral de glutamina, la hiperamoniemia es muy marcada en pacientes con cirrosis hepática con mala función hepática, normalizándose tras la realización del trasplante hepático y la normalización de la función hepática.19 La utilidad clínica de la prueba de la sobrecarga oral de glutamina radica en dos aspectos. En pacientes con EHM y una SOG alteradas modifican el riesgo de sufrir un episodio de encefalopatía hepática al año de seguimiento y presentan menor supervivencia.20 Por tanto, la prueba de la sobrecarga oral de glutamina aporta una utilidad contrastada en la selección de pacientes con EHM que presentan un mayor riesgo de EH clínica y una menor supervivencia que serían candidatos a trasplante hepático.
La ordenación de todos estos datos ha permitido plantear una serie de modificaciones en la fisiopatología de la encefalopatía hepática. Se postula que la principal fuente de amonio es el intestino delgado. Dado que la hiperamoniemia sistémica depende de la producción intestinal de amonio, y ésta a su vez deriva de la desaminación de la glutamina, la glutaminasa intestinal sería la enzima reguladora de la producción intestinal de amonio y por ende de la hiperamoniemia sistémica. En condiciones normales el hígado elimina el amonio a través del ciclo de la urea, pero en la cirrosis hepática, la detoxificación del amonio tiene lugar en el músculo a partir de la síntesis de glutamina por la enzima glutamina-sintetasa, de ahí el relevante papel del músculo, y por tanto, de la nutrición en el paciente cirrótico. Por último, la actividad glutaminasa está elevada en los astrocitos de ratas con derivación porto-cava y podría ser la responsable de la acumulación de glutamina en el astrocito que perpetuaría la producción de amonio y la encefalopatía hepática.21
Se han identificado varios polimorfismos en el promotor del gen de la glutaminasa tipo renal en ratas, que inducen una funcionalidad enzimática de hasta 10 veces más que los esperados con promotores normales.22
Aunque la presencia de EHM condiciona un riesgo aumentado de encefalopatía hepática clínica, no todos los pacientes la desarrollan. En pacientes cirróticos con función hepática similar, sometido a complicaciones asociadas con el desarrollo de encefalopatía hepática, la aparición de esta complicación podría depender de la existencia de factores genéticos que regularan en parte ese riesgo. Planteamos un abordaje de gen candidato, seleccionando el gen de la glutaminasa tipo renal como diana diagnóstica dada la implicación de esta enzima en la patogenia de la encefalopatía hepática.
Identificación de marcadores genéticos en el gen de la glutaminasa
El gen humano de la glutaminasa (GLS) se localiza en el brazo largo del cromosoma 2. En humanos se han descrito tres isoformas para la glutaminasa. Se originan en el mismo locus y representan tres transcritos que se producen por maduración alternativa tejido-específica de un único ácido ribonucleico mensajero (ARNm) original.23
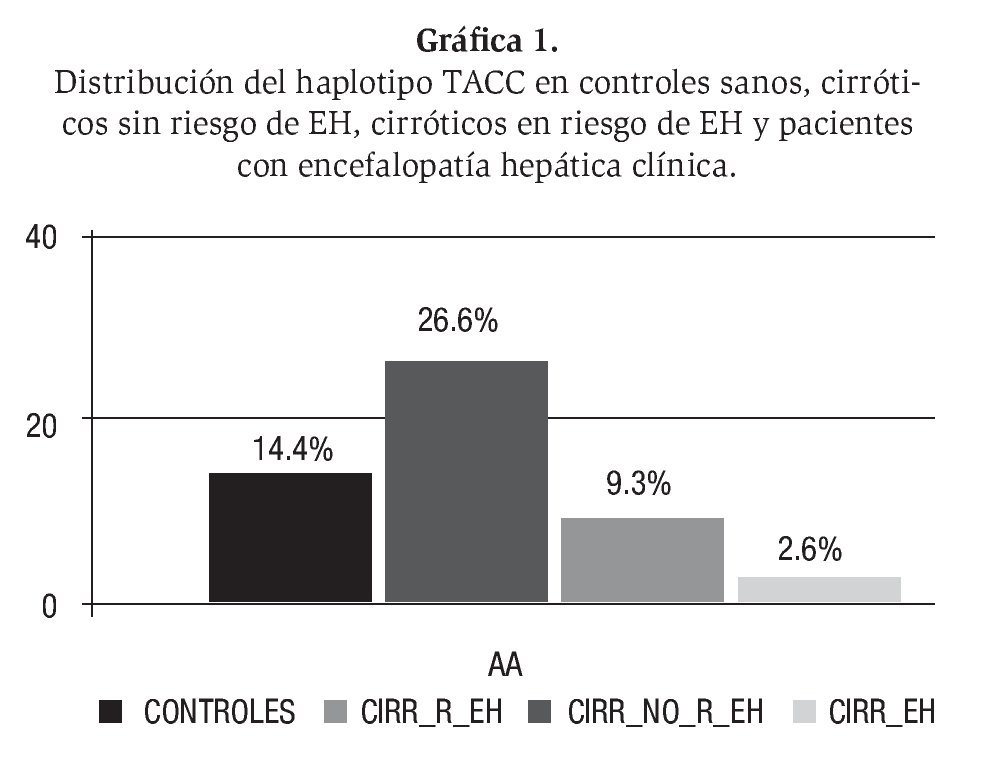
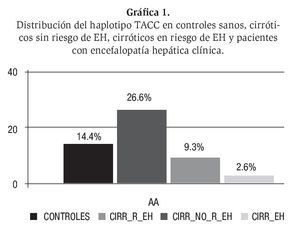
Según los datos disponibles, existe un bloque de ligamiento genético que cubre toda la secuencia genómica del gen GLS en población española. El estudio de cuatro polimorfismos distribuidos a lo largo de todo el gen GLS, ha permitido demostrar la relación entre las alteraciones genéticas y el riesgo de encefalopatía hepática. La combinación de estos 4 polimorfismos genera 16 posibles haplotipos, pero sólo cinco de ellos superan 1% en frecuencia en población caucasiana.24 El haplotipo TACC se ha asociado con una mejor función hepática, menor riesgo de encefalopatía hepática y menor producción intestinal de amonio. La producción intestinal de amonio se puede valorar mediante la prueba de la sobrecarga oral de glutamina. Existe una fuerte asociación entre el haplotipo protector TACC y la función hepática, pero además su presencia se asoció a un menor riesgo de encefalopatía hepática y en pacientes con encefalopatía hepática clínica, este haplotipo protector se encontró casi ausente, mientras que se detectó en una cuarta parte de pacientes sin riesgo de encefalopatía hepática (Gráfica 1). El gen de la glutaminasa y sus alteraciones genéticas están asociados al riesgo de encefalopatía hepática. Es necesario un clonaje posicional para detectar específicamente qué mutaciones en las áreas codificantes pueden estar asociadas a una mayor actividad glutaminasa y un mayor riesgo de encefalopatía hepática. Estos aspectos genéticos avalan el papel de la glutaminasa en la patogenia de la encefalopatía hepática.25 El haplotipo TACC se detecta en 2.6% de los pacientes que se reclutaron en encefalopatía hepática aguda, y en 26% de los pacientes cirróticos sin riesgo de encefalopatía, o sea, con una prueba de la sobrecarga oral de glutamina y pruebas psicométricas (PHES) normales, mientras que se detecta en el 9.3% de los cirróticos en riesgo de EH. Además, estos datos apoyan la hipótesis de la relación entre la actividad glutaminasa y la función hepática. En alcohólicos activos la presencia del genotipo CD14-159TT está elevada (x3) en pacientes cirróticos alcohólicos con ascitis o encefalopatía hepática en comparación con los pacientes con cirrosis hepática alcohólica compensada.26 Por otro lado, el genotipo B1B1 del gen del factor de necrosis tumoral beta se ha encontrado infraexpresado en pacientes con intoxicación por paracetamol que desarrollaron encefalopatía hepática grave.27
Gráfica 1. Distribución del haplotipo TACC en controles sanos, cirróticos sin riesgo de EH, cirróticos en riesgo de EH y pacientes con encefalopatía hepática clínica.
Por tanto, no existen datos en la literatura con qué comparar los hallazgos de este trabajo. La secuenciación del gen, con la definición de las alteraciones genómicas y su relevancia funcional, permitirán conocer mejor el impacto de las mutaciones en el gen de la glutaminasa en la patogenia de la encefalopatía hepática.
En conclusión, el haplotipo TACC del gen de la glutaminasa protege frente al riesgo de encefalopatía hepática. Esto avala la necesidad de investigar en la posibilidad de que la glutaminasa sea una diana terapéutica en el manejo de los pacientes cirróticos y por otro lado, estudios de genómica funcional permitirán diseñar estrategias terapéuticas basadas en los hallazgos comunicados.
Diagnóstico de la encefalopatía hepática mínima
Los métodos más utilizados son combinaciones de pruebas psicométricas asociadas o no a pruebas neurofisiológicas, como el EEG, PE o la medición de la frecuencia crítica de parpadeo, no existiendo una prueba "oro". La aplicación de éstas, permiten comprobar que los pacientes con cirrosis hepática, independientemente de la etiología, muestran alteraciones en la ejecución de estas pruebas cuando se comparan con controles sanos de la misma edad y nivel de instrucción.28 No obstante, estas pruebas psicométricas tienen un fuerte componente subjetivo y están poco estandarizadas, puesto que sólo algunos estudios emplean un grupo-control bien caracterizado con base en la edad, sexo, educación29 y consumo de alcohol, y sufren el efecto aprendizaje con la repetición de las mismas. Por todo ello, a pesar de su accesibilidad no han alcanzado gran predicamento. El uso de técnicas neurofisiológicas aporta una cierta objetividad aunque presenta problemas metodológicos, están poco accesibles, requieren aparataje sofisticado y análisis especializado y aportan una menor sensibilidad diagnóstica que los tests psicométricos. Se ha comunicado que el estudio de la frecuencia crítica de parpadeo (una técnica diagnóstica utilizada en la valoración neuropsicológica de diferentes enfermedades como la esclerosis múltiple o el Alzheimer), permite diagnosticar correctamente la presencia de EHM.30 Por último, la resonancia magnética cerebral (RM) es una técnica objetiva y no invasiva, que aunque útil para conocer la fisiopatología de la EH y probablemente rentable en la valoración de los efectos terapéuticos de nuevos fármacos, no se puede usar en la clínica diaria por su alto costo y baja disponibilidad.
Las pruebas psicométricas (PP) que se han de emplear para un correcto diagnóstico de EHM no están definidas. Las PP que exploran la atención y habilidad motora fina son suficientes para el cribado de EHM. Se ha intentado unificar criterios, diseñando una batería de tests que salvaran todas las carencias descritas, que fueran fáciles de aplicar, realizables en papel y que exploraran las facetas neuropsicológicas habitualmente afectas en pacientes cirróticos.31 El uso del TCNA, TCN-B, CN, test de la línea quebrada y la serie de puntos permite diagnosticar correctamente la existencia de EHM (a esta batería se le conoce con el nombre de PHES). Estas PP han sido validadas en controles sanos, pacientes con enfermedad de Crohn, y cirróticos con y sin encefalopatía hepática. Tras la realización de las pruebas se calculó la desviación de cada resultado, de forma que por cada desviación estándar se le aplica un punto, negativo o positivo según la desviación sea hacia una más correcta o incorrecta realización. Así, cada paciente puede obtener una calificación entre -15 y +3. Todos los pacientes con EH presentaban -5 puntos o menos, mientras que los pacientes con enfermedad de Crohn o los controles sanos presentaban más de -3 puntos. Por tanto, el límite que define la existencia de EH incipiente es -4 puntos. Es por ello que esta propuesta parece un buen acercamiento hacia una definición clara de las PP que se han de utilizar en el diagnóstico de EHM. Recientemente, se han comunicado las tablas de normalidad para pacientes españoles e italianos, demostrando la utilidad de esta batería y la estrecha correlación de resultados entre estos dos países.32 Respecto a las PP por ordenador, han demostrado ser tan efectivas como las PP estándar, aportan información pronóstica33 y exploran campos específicos como "la prueba Posner"34 y la de Sternberg paradigm35 que valoran selectivamente la atención y la memoria, con una buena correlación con el TCN y EEG. Por último, el tiempo de reacción a la luz o el sonido muestra una gran sensibilidad en la detección de alteraciones aunque menor especificidad.36 La limitada experiencia en estas pruebas, unido a que exigen un gran esfuerzo por parte del paciente, material computarizado, una experiencia previa del examinador para su correcta valoración y varias horas para su realización, impide su uso en la consulta médica habitual.
Los PE son señales eléctricas registradas por electrodos extracelulares generadas tras la estimulación adecuada de tejidos excitables. Se han desarrollado tres modos de estimulación exógena, potenciales evocados visuales (PEV), potenciales evocados auditivos de tronco (PEATC) y potenciales evocados somatosensitivos (PES), además de un modo endógeno que permite la detección de potenciales retardados (onda P300) auditivos y visuales. Aunque todas estas técnicas han demostrado por separado su utilidad, queda por confirmar cuál es la más sensible y hasta qué punto se ven influenciadas por las disfunciones cerebrales secundarias al alcoholismo. Debido a las mencionadas desventajas de las PP varios autores han propuesto el uso de métodos neurofisiológicos como métodos más objetivos para la detección de EHM. El electroencefalograma se ha utilizado para valorar el grado de EH. En el análisis del registro se valora el porcentaje de actividad theta dominante. El EEG no ha jugado un claro papel en el diagnóstico de EHM, ya que presenta una escasa sensibilidad, de forma que en un grupo de cirróticos sometidos a una derivación portosistémica se detectaron alteraciones en el EEG en 30% de los pacientes, mientras que 60% presentaba alguna PP alterada.37 Concluyendo que el EEG es menos sensible que las PP e implica mayor alteración de la función cerebral, ya que 80% de los pacientes con EEG anormal presentaban TCN parte B alterado, frente al 50% de pacientes con EEG normal. El análisis espectral del EEG mediante técnicas computarizadas,38 que incluye cuantificación de la frecuencia media dominante y la potencia de un determinado ritmo, reduce la subjetividad del EEG con menor variabilidad interobservador.
De forma global se acepta que los potenciales evocados somatosensoriales (PES) y potenciales endógenos (P300) parecen ser las pruebas neurofisiológicas más objetivas para el diagnóstico de EHM.39 En un estudio prospectivo, donde se incluyen 44 pacientes con cirrosis descompensada, 93% de los pacientes con PES alterados desarrollaron posteriormente EH, frente al 70% de los pacientes con TCN alterado, sugiriendo que los PES son más específicos, con superior valor predictivo positivo, pero menos sensibles.40 Los pacientes con alteración de alguna PP deben ser diagnosticados de EHM, mientras que los que presenten resultados normales es necesario estudiarse mediante pruebas de potenciales evocados somatosensoriales, auditivos o P300.
La medición de la frecuencia crítica de parpadeo
La medición de la frecuencia crítica de parpadeo se ha mostrado útil en el diagnóstico de la EHM. El paciente ha de pulsar un botón cuando nota el parpadeo de un punto luminoso en el interior de unas gafas cerradas. Si la frecuencia es superior a 39 HZ la prueba se considera normal, en cambio, los cirróticos con alteraciones neuropsicológicas muestran registros de la medición de la frecuencia crítica de parpadeo descendidos en comparación con los cirróticos sin EHM.41 La seguridad diagnóstica de la medición de la frecuencia crítica de parpadeo es del 83.3% comparado con los tests psicométricos como criterio diagnóstico. No obstante, la concordancia entre la FCP y los PHES no es absoluta y un tercio de pacientes presentan alteradas sólo una de las pruebas. Además, la FCP alterada predice de forma independiente el riesgo de encefalopatía hepática clínica y junto con la prueba de la sobrecarga oral de glutamina define el pronóstico y supervivencia de los cirróticos. Asimismo, la FCP desciende conforme se agrava la encefalopatía hepática. El resultado no se influye por la edad o el nivel de instrucción y no presenta fenómeno de aprendizaje. Además, su utilización en práctica clínica es simple y no requiere más de 5-10 minutos. Por todo ello, se ha propuesto como método diagnóstico de primera línea en la EHM, pudiéndose utilizar en lugar de los tests psicométricos.42
Resonancia magnética
En pacientes con cirrosis hepática sin evidencia clínica de EH, se detecta una señal hiperintensa bilateral y simétrica a nivel de los ganglios basales en las imágenes potenciadas en T1, oscilando su prevalencia entre 52-100%. Se ha llegado a considerar que podría ser un marcador morfológico de la EH y que su detección en ausencia de trastornos neuropsicológicos indicaría la existencia de EHM.43 Existe una clara correlación entre la señal hiperintensa en globos palidus y el tamaño de las colaterales portosistémicas valoradas por angiorradiología.44-45 Sin embargo, la implicación de la función hepática es menos clara, habiéndose detectado sutiles diferencias entre pacientes en estadio Child A y C46 de Child-Pugh. El depósito anormal de manganeso parece la explicación más probable. Imágenes similares se han descrito en personas expuestas crónicamente a niveles tóxicos de manganeso,47 una condición asociada a signos parkinsonianos. El significado clínico de esta señal permanece sin resolver, se ha demostrado una relación48 entre las alteraciones de la RM y los signos parkinsonianos, lo que podría sugerir el efecto patogénico de la lesión a nivel de los ganglios basales y explicaría una parte del espectro de signos y síntomas de la EH.
Resonancia magnética espectroscópica (RMe)
La RMe permite detectar la concentración cerebral de metabolitos implicados en la alteración de la neurotransmisión que acontece en la encefalopatía hepática. En la modalidad protónica (RMe-1H) las alteraciones más frecuentemente detectadas en pacientes con EH, son niveles elevados de glutamina (o cociente glutamina/glutamato [Glx]) y niveles descendidos de mioinositol (mI) y colina. Los pocos estudios existentes dan resultados conflictivos no conociéndose el significado fisiopatológico de estas alteraciones, por un lado pueden traducir un disturbio en la osmorregulación celular a nivel cerebral, y por otro, un trastorno en el metabolismo energético.
La depleción de mioinositol tiene una sensibilidad del 90% en el diagnóstico de EH.49 Asimismo, se correlaciona inversamente con los niveles de amonio en sangre.50 Por otro lado, el mioinositol puede ejercer un papel fundamental como osmolito activo e implicarse en el desarrollo de edema cerebral.51 El mioinositol y la colina se han identificado como sustancias importantes en la regulación de la osmolaridad intracelular de los astrocitos, por lo que su descenso se interpreta como una alteración de la osmorregulación secundario al acúmulo de glutamina, la cual podría ser debido a un aumento de la actividad glutamina sintetasa astrocitaria (que requiere Mn como cofactor) como un mecanismo de detoxificación cerebral del amonio, contrarrestado por una liberación de mI y colina intracelular. Esto se ve apoyado por la correlación encontrada entre el mI y Glx en pacientes cirróticos, independientemente de la existencia o no de EH, con un coeficiente de correlación del 60%.52 La utilidad de la RMs en el diagnóstico de la EHM ha sido cuestionada por algunos autores, debido a que estas alteraciones se han detectado en pacientes con cirrosis hepática sin EHM, y a pesar de que demuestra una alta sensibilidad tiene una baja especificidad. Por otro lado, a raíz de resultados similares, otros autores sugieren que la RMs permite el diagnóstico precoz de EHM con mayor sensibilidad y especificidad que las PP (>90%), ya que pone de manifiesto alteraciones metabólicas antes de que aparezcan alteraciones en las PP.53
Existe una clara correlación entre las alteraciones de la RMs y las PP, con una concordancia del 94%.54 Además, se considera que la detección del cociente mI/Cr es muy sensible para detectar EHM y puede ser costo-efectiva alternativa a la batería de PP para valorar el grado de la EH.55
En un grupo de pacientes con cirrosis hepática estudiados mediante RMs-1H se comprobó que el descenso de los niveles de mioinositol se relacionaba con la existencia de colaterales portosistémicas y el grado de función hepática, mientras que el descenso de la colina se asoció a la presencia de EHM. Por último, el aumento de la glutaminaglutamato se relacionó con el riesgo de desarrollo de EH a corto plazo.56
En conclusión, no se conoce el significado fisiopatológico de las alteraciones detectadas por RMs, las dos hipótesis más apoyadas son una alteración de la osmorregulación a nivel cerebral, y por otro, un trastorno del metabolismo energético. Aunque existen pocos estudios parece existir correlación con las PP, pero existen discrepancias respecto a su relación con las alteraciones detectadas en fase T1 de la RM. Son necesarios futuros estudios utilizando la RMs para obtener información de la función cerebral y bioquímica, con el propósito de conocer la patogenia de la EH y evaluar el efecto de un tratamiento, ya que en el momento actual sólo disponemos de escasos estudios, con tamaños de muestra pequeños y resultados conflictivos, con pequeños grupos control y sin un criterio diagnóstico claro de EHM.
Importancia clínica de la EHM
La importancia de diagnosticar la EHM radica en dos aspectos fundamentales. Por una parte, su presencia se relaciona con el desarrollo posterior de episodios de encefalopatía hepática,57 lo cual implica una menor supervivencia,2 así como una peor calidad de vida58 y un mayor riesgo de sufrir accidentes de tráfico o laborales.59 Por otro lado, la propia existencia de EHM también se ha asociado con un deterioro en la calidad de vida y una pérdida de la capacidad de conducir vehículos.60
La EHM se asocia con peor calidad de vida y dificultad para el desarrollo de la actividad laboral habitual. Este efecto es independiente del provocado por la enfermedad de base y ha demostrado no estar relacionado con el estadio en el que se encuentre dicha enfermedad. El impacto de la EHM se produce en todo el espectro de actividades básicas de la vida diaria, pero sobre todo en aquellas relacionadas con la atención, la interacción social, el ocio y el trabajo.
Respecto a la vida laboral, el impacto de la EHM va a depender de las habilidades que sean requeridas para el desempeño del puesto de trabajo que ocupe el paciente. Lo que sí está demostrado, es que existe una mayor tasa de bajas laborales entre los pacientes con EHM, comparado con aquellos pacientes cirróticos sin EHM.
Mención aparte merece la evaluación de la capacidad de conducción. En un reciente estudio se realizaba una encuesta anónima sobre su historial de conducción y su comportamiento al volante a 200 pacientes cirróticos.61 En dicho estudio se concluía que los pacientes cirróticos tienen mayores tasas de infracciones de tráfico, así como de accidentes, comparados con un grupo control. En los pacientes con EHM esta tasa era aún mayor, y en el análisis multivariado, la existencia de EHM era el único factor independiente para infracciones de tráfico y accidentes. Esto apoyaría aún más la necesidad de detectar precozmente la EHM, aunque se debe llegar a un consenso sobre en qué casos debe recomendarse al paciente no conducir y sobre las implicaciones legales al respecto.
Tratamiento de la EHM
La primera medida ha de ser identificar y corregir las causas precipitantes de la EHM. Será beneficioso el retirar y evitar fármacos como hipnóticos, sedantes y diuréticos, que pueden influir en el curso de la enfermedad.
Respecto a la restricción de proteínas de la dieta, no hay que olvidar que, para mantener el metabolismo nitrogenado el paciente cirrótico necesita diariamente de 0.8 a 1 g/kg de peso al día, y que recientes estudios han demostrado que las dietas con restricción de proteínas no mejoran el desarrollo del episodio de EHM.
Actualmente, se han publicado estudios62 sobre el beneficio del tratamiento con lactulosa (30-60 L en 2-3 tomas diarias), que, siendo una alternativa segura, mejoraría las capacidades cognitivas y la calidad de vida del paciente con cirrosis y EHM. Sin embargo, un metaanálisis anterior de estudios, daban a la neomicina como una opción superior.
La rifaximina se sitúa como una de las opciones con más posibilidades en el futuro, existiendo en la actualidad varios estudios que valorarán su eficacia.
También se han publicado trabajos en los que se evalúa el uso de probióticos,63 presentes en determinados preparados alimenticios o administrados de forma independiente, como en VSL-3.
En situaciones de disminución del volumen efectivo como hemorragias agudas o de acidosis, la reposición de volumen rápida con 1000 mL de solución mixta, sería una alternativa eficaz.
Por otro lado, y dado que la existencia de encefalopatía hepática se relaciona con el desarrollo de respuesta inflamatoria sistémica, desencadenada sobre todo por infecciones, el tratamiento de ésta se hace necesario.
En conclusión, todavía no disponemos de medidas completamente eficaces en el tratamiento de la EHM y la diana genética sería uno de los abordajes más prometedores en el futuro.
Correspondencia:
Prof. Manuel Romero-Gómez.
UGC Enfermedades Digestivas y Ciberehd. Hospital Universitario de Valme. Ctra. Cádiz s/n. 41014 Sevilla.
Teléfono: 955015761, Fax: 955015899
Correo electrónico:manuel.romero.sspa@juntadeandalucia.es
Fecha de recibido: 24 agosto 2007
* Fecha aprobado: 27 febrero 2009