La enfermedad celiaca (EC) es una enteropatía autoinmune desencadenada por el consumo de gluten en personas genéticamente predispuestas. En México se estima una prevalencia de 0.9%. La variabilidad de manifestaciones clínicas dificulta el diagnóstico1,2.
Se trata de una niña de 18 meses de edad, sin antecedentes familiares de EC o autoinmunes, primera gesta de matrimonio no consanguíneo originario de Tabasco, obtenida a término vía abdominal, pesó 3.5kg, longitud 52cm, primera evacuación a las 24 h de vida. Alimentación mixta desde nacimiento, con fórmula antiestreñimiento, complementaria a los 6 meses, lactancia materna hasta 12 meses e introducción de trigo después del año de edad por decisión materna. Desarrollo psicomotor normal.
Inició a los 15 meses de edad con estreñimiento (ausencia de evacuaciones hasta por 2 semanas), vómito, dolor y distensión abdominal. Recibió procinético, laxantes y enemas sin mejoría. Se encontró pálida, abdomen doloroso y distendido con perímetro de 48cm, hígado a 3-5-5cm debajo del borde costal, coprostasis en todo marco cólico, al tacto rectal tono de esfínter adecuado con materia fecal indurada. Peso 10.6kg, longitud 79cm y perímetro braquial 13cm. Colon por enema con abundante materia fecal en colon descendente, sin zona de transición. Se inició polietilenglicol a 1.5g/kg/día.
Retoma seguimiento a los 22 meses de edad, persiste estreñimiento, dependiente de polietilenglicol hasta 2.5g/kg/día, evacuaciones Bristol 2, pobre adherencia a tratamiento, suspensión intermitente, agudización de distensión y dolor abdominal, vómito gastro-biliar y urticaria generalizada que remitía en 24-48 h, sin asociarse a ingesta de alimentos. Abdomen distendido, hígado a 4-6-6- cm debajo del borde costal, dermatosis diseminada en axilas y región inguinal caracterizada por eritema y eccema. Peso 12.9kg, longitud 85cm y perímetro braquial 15cm. Durante seguimiento, nutricionalmente eutrófica, sin embargo, peso no confiable por hepatomegalia.
Exámenes de laboratorio reportaron elevación de aminotransferasas (ALT 119 U/l, AST 70 U/l) y fosfatasa alcalina (350 U/l). Hemoglobina, plaquetas, bilirrubinas, albúmina, gamma-glutamil transpeptidasa e inmunoglobulinas normales. Coproparasitoscópicos, coprocultivo y antígeno fecal para Giardia lamblia negativos. IgA e IgG antitransglutaminasa tisular (anti-TGA) y antiendomisio (anti-EMA) negativos.
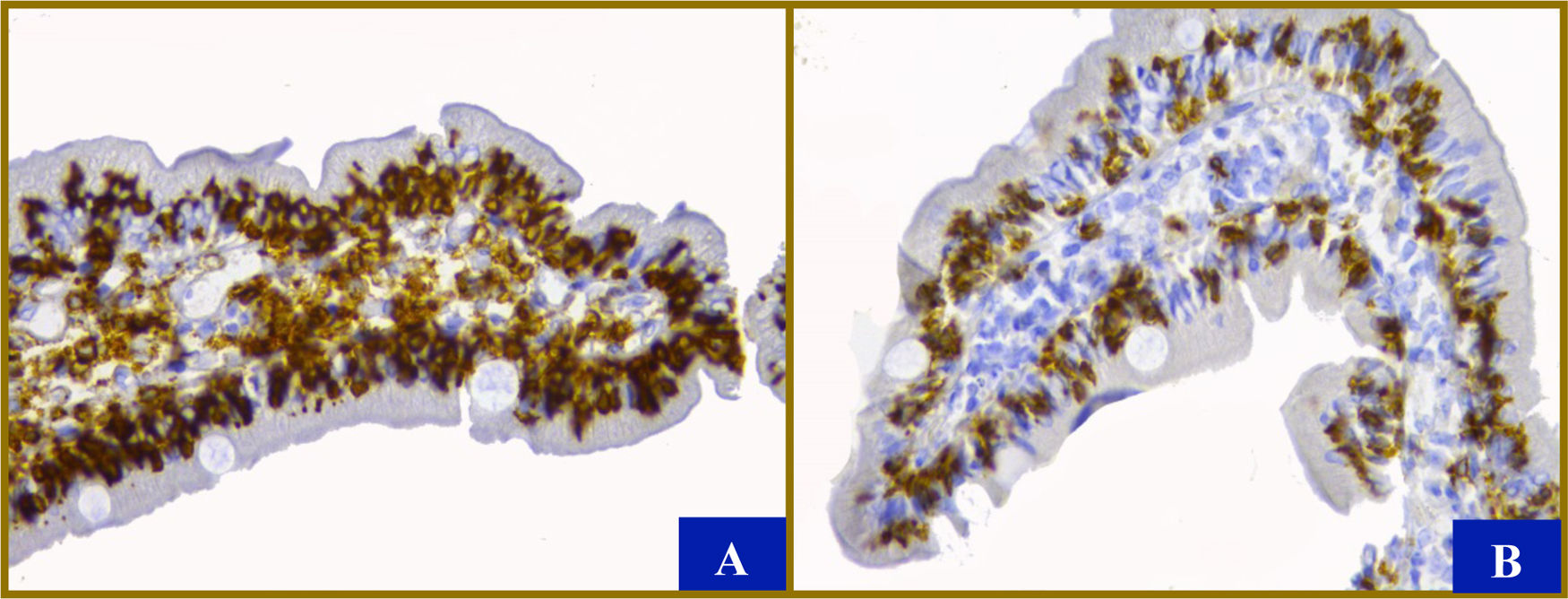
Se realizó endoscopia, tomando tres y cuatro biopsias de bulbo y duodeno distal, respectivamente, que reportó duodeno con arquitectura conservada. Reacciones de inmunohistoquímica con anticuerpos anti-CD 45 y CD 8 positivas en linfocitos intraepiteliales, cambios concordantes con EC (fig. 1). La ausencia de eosinófilos degranulados en lámina propia, agrupados o intraepiteliales aleja diagnóstico de alergia y la ausencia de lesión en células de Paneth descartó una enteropatía autoinmune. Colonoscopia con arquitectura conservada.
Características histológicas. Mostró entre 8 y 12 vellosidades, con relación vellosidad/cripta de 2-3/2. En la lámina propia se encontró infiltrado mononuclear discretamente aumentado con hasta 6 eosinófilos por campo a seco fuerte (40 X). Tanto la inmunohistoquímica con anticuerpos anti-CD 45 A) como anti-CD 8 B) muestran (en color café oscuro) más de 100 linfocitos, principalmente citotóxicos, por cada 100 enterocitos a pesar de que las vellosidades son de tamaño habitual (aumento original 40 X). Sin evidencia de hiperplasia de las criptas ni microorganismos. Los enterocitos, las células caliciformes y las células de Paneth se observaron normales. El color de la figura solo puede apreciarse en la versión electrónica.
Posterior al diagnóstico e inicio de dieta sin gluten el paciente abandonó seguimiento.
Este caso ilustra que serologías negativas no descartan EC y la base para establecer el diagnóstico es tener un alto índice de sospecha.
Menos del 10% de los casos debutan con estreñimiento3. Un estudio de 313 niños con estreñimiento y 990 niños sanos documentó seroprevalencia de EC del 2.5% y 0.6%, respectivamente4.
La guía de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) propone como abordaje la cuantificación de IgA total y anti-TGA IgA. En pacientes con IgA normales para la edad, los anti-TGA IgA deben ser el escrutinio inicial, independientemente de edad; y para pacientes con concentraciones bajas de IgA total, los anticuerpos IgG (PDG, EMA o TGA) deben realizarse como segundo paso5.
La guía clínica para diagnóstico y tratamiento de EC en México propone, para niños con anti-TGA IgA (especialmente menores a 2 años) negativos con síntomas sugerentes, cuantificación de anticuerpos IgG y/o IgA contra el péptido deaminado de gliadina (anti-PDG IgG y/o IgA); no realizada por disponibilidad limitada en nuestro medio6.
La prevalencia de positividad de los anti-TGA varía entre 0-88% y anti-EMA 8.6-79%, de acuerdo a diferentes fabricantes7. Un metaanálisis estimó la precisión de los kits para diagnóstico reportando sensibilidad y especificidad de 94% (IC 89.9-96.5) y 94.4%, respectivamente8, en nuestro caso se utilizó el kit QUANTA LiteTM, con sensibilidad de 92.7% y especificidad de 91.6%.
En este escenario, la confirmación histológica a través de biopsias duodenales fue indispensable para asegurar el diagnóstico y establecer el daño a la mucosa9.
La ESPGHAN describe no necesarios HLA DQ2 y/o DQ8 en pacientes con TGA IgA positivos, de confirmarse diagnóstico por histología o títulos altos de TGA IgA (≥ 10x) y EMA IgA positivos. Además la positividad a estos haplotipos no confirma el diagnóstico, agregando el alto costo y disponibilidad limitada en nuestro entorno5.
El aumento de aminotransferasas con el que debutó la paciente oscila entre el 24–40% de los casos, siendo más común en los recién diagnosticados. En una cohorte retrospectiva de 388 niños (10.1 ± 4.4 años) se reportó una prevalencia de 15.1%; sin embargo, solo 185 (47.7%) pacientes contaban con valores de enzimas hepáticas al diagnóstico. No existen guías que señalen necesidad de evaluación y seguimiento de función hepática, varias revisiones la recomiendan y esta normaliza en la mayoría de los casos dentro del primer año de dieta libre de gluten10.
La EC debe buscarse de forma dirigida en un contexto clínico apropiado, conjuntando historia clínica, serologías y biopsia duodenal.
Responsabilidades éticasLos autores declaran que este artículo no contiene información personal que permita identificar al paciente. Debido a que se realiza revisión de expediente clínico no amerita autorización del Comité de Ética.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.