Presentamos el caso de un paciente varón de 64 años, sin comorbilidades, con un tiempo de enfermedad de 7 días, caracterizado por ictericia, astenia, fiebre, dolor muscular en pantorrillas, dolor abdominal superior de leve intensidad y disminución del flujo urinario. Ingresa a un hospital de Lima, Perú, hemodinámicamente estable con una puntuación en la escala de coma de Glasgow de 15 puntos y el abdomen levemente doloroso en el hipocondrio derecho y el epigastrio. En exámenes auxiliares hallamos hemoglobina en 11.8g/dL, leucocitos en 19,800, plaquetas en 30,000, urea en 206, creatinina en 5.7, amilasa en 684 (valor normal<110U/L), lipasa en 1,283 (valor normal<300U/L) y alteración del perfil hepático (tabla 1). La radiografía de tórax no mostraba alteraciones. En la ecografía abdominal se observaba la vesícula biliar sin cálculos y las vías biliares sin alteraciones.
Perfil hepático
| Día 1 | Día 4 | Día 6 | Día 8 | Día 10 | Día 14 | Día 17 | Día 28 | |
|---|---|---|---|---|---|---|---|---|
| Bilirrubina total (mg/dL) | 22.4 | 40.2 | 49.3 | 43.5 | 36.5 | 24.9 | 6.6 | 3.0 |
| Bilirrubina directa (mg/dL) | 20.9 | 36.8 | 44.8 | 40.3 | 33.6 | 23.6 | 5.6 | 2.4 |
| TGO (U/L) | 263 | 172 | 114 | 101 | 83 | 61 | 62 | 48 |
| TGP (U/L) | 126 | 132 | 95 | 69 | 49 | 33 | 26 | 57 |
| FA (U/L) | 186 | 235 | 325 | 384 | 356 | - | - | 283 |
| GGT (U/L) | 132 | 245 | 308 | 369 | 293 | - | - | 75 |
| Albúmina (g/dL) | 2.7 | - | - | - | 2.4 | - | - | - |
Inicialmente fue enfocado como falla renal aguda secundaria a pancreatitis aguda severa y colangitis severa probable. Se inició tratamiento con hidratación, ceftriaxona y metronidazol intravenoso. Al día siguiente ingresa a la Unidad de Cuidados Intensivos. Se le realiza una tomografía abdominal sin contraste, donde no se evidencian alteraciones significativas en el páncreas ni en el hígado, y se cambia la cobertura antibiótica a meropenem intravenoso por 14 días. Debido a la presencia de fiebre, dolor muscular en pantorrillas, hiperbilirrubinemia directa marcada sin mayores alteraciones en el resto del perfil hepático y estudios de imagen negativos para enfermedad biliar, pancreática o neoplásica, se sospecha de etiología infecciosa y, al ampliar la historia clínica, se sabe que el paciente estuvo expuesto a roedores 2 semanas antes del ingreso, mientras limpiaba la cisterna de agua. Se toma una muestra para la prueba de aglutinación microscópica por alta sospecha de leptospirosis, confirmando finalmente el diagnóstico. La urea y la creatinina siguen aumentando, por lo que el día 3 se inicia terapia dialítica. Asimismo, el compromiso hepático empeora (tabla 1).
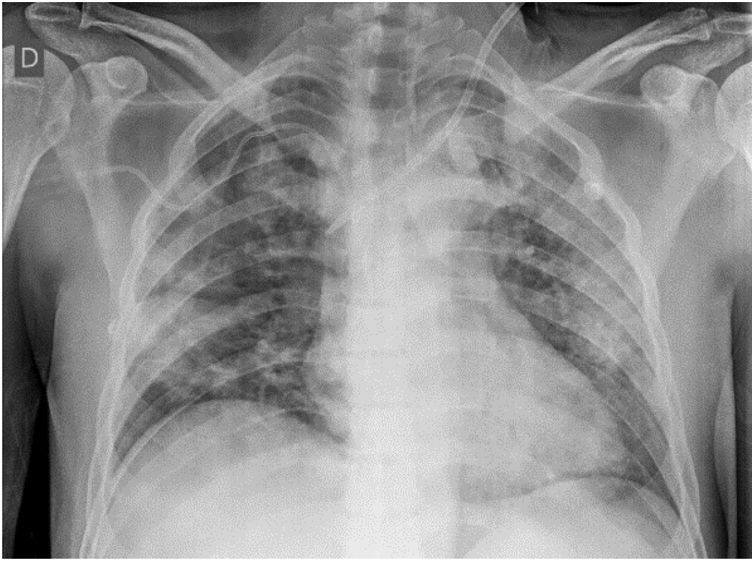
Tras una semana el paciente presenta mejoría del compromiso hepático; sin embargo, continúa con terapia dialítica y desarrolla insuficiencia respiratoria por hemorragia alveolar difusa (fig. 1), con caída de la hemoglobina hasta 5g/dL, por lo que se brinda soporte oxigenatorio a través de máscara de reservorio, sin llegar a necesitar soporte ventilatorio. Finalmente, presenta una evolución favorable y es dado de alta el día 31 de hospitalización, continuando la hemodiálisis de forma ambulatoria.
La leptospirosis es una zoonosis de distribución mundial producida por espiroquetas del género Leptospira. Predomina en regiones tropicales, sobre todo en épocas de lluvia, en zonas de escasos recursos y con presencia de roedores1. En el Perú, del 2017 al 2021 se reportó una incidencia de 1.55 a 7.11 casos por 100,000 habitantes2. Además, en el 2021 se notificaron 513 casos y una defunción; los departamentos de Madre de Dios y Loreto (Selva) notificaron aproximadamente el 80% de los casos, mientras que Lima (Costa) menos del 1.5%2. En el caso presentado el paciente era natural y procedente de Lima.
La Leptospira se mantiene en la naturaleza debido a la infección renal crónica en los portadores domésticos y silvestres (roedores entre otros mamíferos pequeños, además del ganado y los animales domésticos como los perros o los gatos), al colonizar el borde en cepillo del túbulo renal proximal1.
La infección se puede producir por contacto directo o indirecto con la orina o tejidos de animales infectados. Las leptospiras entran al organismo a través de la piel por cortes o abrasiones, a través de las membranas mucosas o por inhalación de aerosoles. Se produce una diseminación hematógena. Esta bacteriemia leptospirémica y la vasculitis asociada explican el amplio espectro de presentación clínica3.
El periodo de incubación es de 10 días (5-14 días). La leptospirosis puede presentarse como una enfermedad subclínica, una enfermedad sistémica autolimitada (90% infecciones) o una enfermedad grave. Puede presentar 2 fases: una fase septicémica inicial, los primeros 5-7 días, caracterizada por la presencia de leptospiras en sangre y líquido cefalorraquídeo, que cursa con fiebre elevada, cefalea, dolores musculares de predominio en pantorrillas y zona lumbar, dolor abdominal, náuseas, vómitos, diarrea, tos y sufusión conjuntival (ojo rojo sin secreciones); posteriormente hay una fase inmunitaria, con una duración de 4-30 días, en la que se producen anticuerpos IgM circulantes y leptospiruria, y se puede presentar ictericia, falla renal, dificultad respiratoria, hemoptisis, meningitis aséptica, arritmias cardíacas y pancreatitis3,4. La forma grave más característica que puede aparecer después de la fase aguda es la enfermedad de Weil, caracterizada por alteración de la función hepática y compromiso pulmonar y renal. La tasa de mortalidad de los pacientes con enfermedad grave no tratada llega hasta el 40%5.
Los pacientes presentan un perfil hepático característico: hiperbilirrubinemia directa marcada (hasta 80mg/dL) asociada a un leve aumento (2-3 veces el valor normal) de otras enzimas que indican colestasis (FA, GGT) y un leve aumento de las transaminasas (<200U/L)6,7. La Leptospira infiltra el espacio de Disse, daña los hepatocitos y altera sus uniones intercelulares causando fuga de bilis desde los canalículos biliares hacia los sinusoides, lo cual explica los niveles tan elevados de bilirrubina directa sin mayor alteración de la FA o la GGT. Además, debido a que no hay necrosis hepatocelular no se elevan las transaminasas1.
El compromiso renal varía en severidad desde un daño renal agudo leve no oligúrico hasta una falla renal aguda establecida. La mayoría de los pacientes que sobreviven recuperan la función renal, sin embargo, algunos quedan con enfermedad renal crónica3.
Algunos pacientes pueden presentar hiperlipasemia e hiperamilasemia multifactorial, generalmente secundaria a la falla renal aguda y al estado crítico de los pacientes. Sin embargo, también se han reportado casos de pancreatitis aguda debido a leptospirosis, incluso con desenlace fatal8. El mecanismo de la pancreatitis no está claramente definido, pero se postula que la vasculitis y el daño isquémico asociado producen la activación de las enzimas proteolíticas y la autodigestión8. En el caso presentado el paciente tenía hiperlipasemia e hiperamilasemia no asociadas a dolor abdominal típico ni a estudios de imagen contributorios, por lo que se descartó el diagnóstico de pancreatitis aguda.
Existen métodos de detección directos e indirectos. Dentro de los métodos de detección directos tenemos la microscopia de campo oscuro y la técnica de reacción en cadena de la polimerasa tanto en sangre como en orina. El método de detección indirecto y de referencia es la prueba de aglutinación microscópica, en la que reaccionan antígenos vivos con los anticuerpos de las muestras de sangre, con una sensibilidad del 77.4% y una especificidad del 97.6%; esta prueba actualmente en el Perú solo se realiza en el Instituto Nacional de Salud y es gratuita9.
El tratamiento antibiótico se debe iniciar ante la sospecha, aunque su eficacia sigue siendo controversial según indica un reciente metaanálisis10. La enfermedad leve se trata con doxiciclina por vía oral y la enfermedad grave con penicilina por vía intravenosa o con ceftriaxona10. El tratamiento de soporte es fundamental. Los pacientes que presentan daño renal agudo deben recibir hidratación intravenosa intensa y si progresan a falla renal oligúrica el inicio precoz de hemodiálisis disminuye la mortalidad11. Además, debido a la vasculitis asociada se ha planteado el uso de corticosteroides en casos severos con compromiso pulmonar o renal, sin embargo, en una revisión sistemática realizada por Rodrigo et al. se concluye que no hay evidencia suficiente para recomendar su uso12.
En pacientes con hiperbilirrubinemia directa marcada de presentación aguda, sin mayor alteración en el resto del perfil hepático, con estudios de imagen negativos para enfermedad biliar obstructiva y con falla renal aguda, se debe ahondar en la exposición a roedores y plantear la leptospirosis como un diagnóstico diferencial, aún en zonas de prevalencia baja o desconocida, para así realizar el estudio, manejo precoz y disminuir la mortalidad como en el caso de nuestro paciente. Asimismo, se debe tener en cuenta que estos pacientes pueden presentar hiperlipasemia e hiperamilasemia secundarias a la falla renal aguda y al estado crítico del paciente.
Responsabilidades éticasEl consentimiento informado no se solicitó para la publicación de este caso, ya que no se publican datos personales que permitan identificar al paciente. Además, el presente trabajo cumple con la normativa vigente de investigación bioética.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.