La colitis ulcerosa crónica idiopática (CUCI) es una enfermedad inflamatoria intestinal crónica caracterizada por inflamación difusa de la mucosa del colon. Hasta el momento, diversos estudios observacionales han implicado una gran variedad de microorganismos patógenos como factores causantes y exacerbantes de la CUCI. La infección por Clostridium difficile (C. difficile) se ha asociado a recaída o falla al tratamiento. La incidencia de esta infección ha aumentado en los últimos años en pacientes con CUCI.
ObjetivoDeterminar la frecuencia de infecciones por diferentes microorganismos en pacientes mexicanos con CUCI.
Pacientes y métodosSe estudiaron 150 pacientes con diagnóstico definitivo de CUCI. Se analizaron todos los coproparasitoscópicos, coprocultivos, toxina A y B para C. difficile, presencia de Citomegalovirus (CMV) en biopsias de segmentos colónicos (inmunohistoquímica). Se registraron otras variables demográficas y clínicas de la enfermedad para su correlación con la frecuencia de infecciones.
ResultadosLa frecuencia de infecciones en pacientes con CUCI fue del 28,00%. La infección por C. difficile se presentó en 0,013%. Se encontraron otros patógenos como Endolimax nana (9,00%), Entamoeba histolytica (3,00%), CMV (2,00%), Salmonella (2,00%), Shigella (0,70%), Toxoplasma gondii (0,70%) e Iodamoeba bütschlii (0,70%).
ConclusionesEn nuestro estudio la frecuencia de infecciones fue del 28,00% y de C. difficile fue de tan sólo 0,013%.
Ulcerative Colitis (UC) is a chronic inflammatory bowel disease characterized by diffuse inflammation of the mucosa of the colon. Up to now, diverse observational studies have implicated a wide variety of pathogenic microorganisms as causal and exacerbating factors in UC. Clostridium difficile (C. difficile) infection has been associated with recurrence and treatment failure and its incidence in patients with UC has been on the rise in the last few years.
AimsTo determine the frequency of infection by different microorganisms in Mexican UC patients.
Patients and methodsA total of 150 patients with definitive UC diagnosis were studied. All the stool tests for parasites and ova, stool cultures, tests for the C. difficile toxins A and B, and immunohistochemistry for Cytomegalovirus in colon segment biopsies were analyzed. Other demographic and clinical variables of the disease were recorded for their correlation with infection frequency.
ResultsInfection frequency in UC patients was 28.00%. C. difficile infection was present in 0.013%. Other pathogens were found, such as Endolimax nana (9.00%), Entamoeba histolytica (3.00%), Cytomegalovirus (2.00%), Salmonella (2.00%), Shigella (0.70%), Toxoplasma gondii (0.70%) and Iodamoeba bütschlii (0.70%).
ConclusionsInfection frequency was 28.00% in our study and C. difficile infection represented only 0.013%.
La enfermedad inflamatoria intestinal (EII) incluye a la enfermedad de Crohn (EC) y a la colitis ulcerosa crónica idiopática (CUCI)1,2. La CUCI es una enfermedad crónica caracterizada por inflamación difusa de la mucosa del colon. Afecta aproximadamente 250.000-500.000 individuos en los Estados Unidos, con una incidencia de 2-7/100.000 habitantes por año3. En ciudades desarrolladas durante los últimos años, la EC ha sobrepasado en incidencia a la CUCI, mientras que en países en desarrollo la CUCI es más común que la EC; por ejemplo, en la India la proporción es de 8:14. En México, en un estudio realizado en el Instituto Nacional de Ciencias Médicas y Nutrición “Salvador Zubirán” se registró la incidencia de CUCI desde 1987 hasta el año 2006, dividiéndose a los pacientes en 2 periodos de tiempo (1987-1996 y 1997-2006), encontrándose que la incidencia promedio en el 1° grupo fue de 28,8 y en el 2° grupo fue de 76,1. La incidencia en el 2° periodo aumentó 2,6 veces en comparación al 1° periodo. La incidencia más alta se encontró en el año 20015.
La patogenia de la EII involucra 4 grandes factores: la susceptibilidad individual, la predisposición genética, la microflora del tracto gastrointestinal y las propiedades inmunológicas de la mucosa del tracto gastrointestinal. Sin embargo, el aspecto microbiano juega un papel importante en la patogenia de estos trastornos6. Se ha evidenciado que la microflora del tracto gastrointestinal se compone de 400 a 500 especies diferentes, correspondiente a 1014 microorganismos que con su propio metabolismo representan un “órgano adicional” en los seres humanos6–9.
Algunas especies de Helicobacter y Bacteroides -bacterias asociadas a la mucosa-, se han implicado en la patogénesis de la CUCI10–12. Un estudio epidemiológico reciente ha demostrado un mayor riesgo de EII en pacientes con un episodio de gastroenteritis por Salmonella o Campylobacter, lo que sugiere que la infección con la bacteria en particular puede desencadenar el proceso que en última instancia conduce a la inflamación crónica de la EII13. Informes recientes sugieren que hasta un 20,00% de las recaídas en pacientes con EII se asocian a infección por Clostridium difficile (C. difficile)14.
Al comparar el grupo de pacientes con EII más enfermedad asociada a C. difficile (EACD) contra aquellos con EII solamente, los pacientes infectados requieren tiempos hospitalarios mayores y tienen aún más probabilidad de muerte que aquellos con EII aislada. Un estudio reportó que los pacientes hospitalizados con EII + EACD tienen 4 veces más probabilidad de morir, que aquellos con EII sola. En aquellos pacientes con EII e infección por C. difficile, la mortalidad es mayor en aquellos con CUCI (RR=3,79) que en aquellos con EC (RR=1,66)14.
El objetivo de este estudio fue evaluar la frecuencia de infecciones por diversos microrganismos en pacientes mexicanos con CUCI.
Pacientes y métodosSe realizó un estudio retrospectivo que comprendió el periodo de enero de 2001 a enero de 2011, en el cual se incluyeron 150 pacientes con diagnóstico de CUCI que presentaron recaída durante el curso de la enfermedad, atendidos en la Clínica de Enfermedad Inflamatoria Intestinal del Instituto Nacional de Ciencias Médicas y Nutrición “Salvador Zubirán”.
Todos los pacientes tenían diagnóstico de CUCI confirmado por histopatología, de raza mestiza y residentes mexicanos, de ambos géneros y mayores de 18 años. Se excluyeron aquellos pacientes con CUCI en remisión, clínica que presentaran otro tipo de colitis (infecciosa, indeterminada, posradiación o medicamentosa) o EC. Se eliminaron del estudio aquellos enfermos con expedientes incompletos y los pacientes cuyo diagnóstico de CUCI no fuera confirmado por patología.
Se revisaron los expedientes clínicos de todos los pacientes que habían presentado recaída de la CUCI durante el periodo de estudio, todos tenían estudios de coproparasitoscópicos, coprocultivos y toxina A y B para C. difficile. En el caso de búsqueda de CMV sólo estuvo enfocada en aquéllos pacientes con recaída por actividad grave, y en todos los casos fue confirmada por inmunohistoquímica. Se consideró como infección por C. difficile a todos aquellos pacientes que tuvieran un ensayo por inmuno-absorción ligado a enzimas (ELISA, por sus siglas en inglés) positivo para las toxinas A y B. Se analizaron otras variables como edad, sexo, extensión, manifestaciones extraintestinales, colectomía, edad al diagnóstico, curso clínico y tratamiento médico.
Análisis estadísticoLos resultados se analizaron mediante estadística descriptiva utilizando frecuencias, promedio y desviación estándar, así como la prueba ji cuadrada para el análisis de variables categóricas; y t de Student para las variables continuas. El análisis de datos estadísticos se realizó con el paquete estadístico SPSS versión 17,0 (Chicago, Illinois, USA). Se tomó un valor de p<0,05 como estadísticamente significativo.
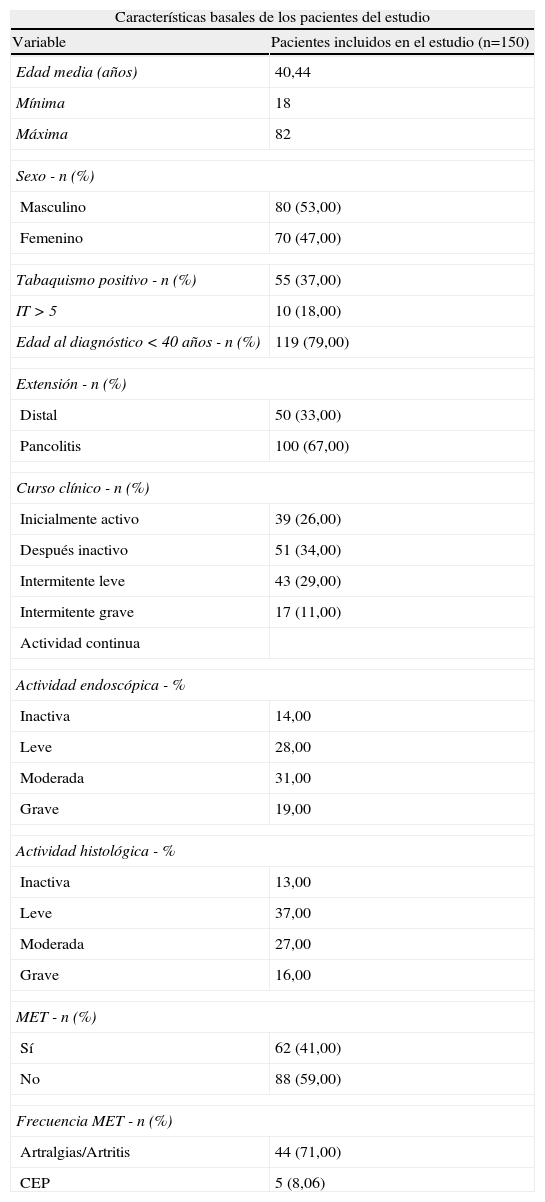
ResultadosSe incluyeron un total de 150 pacientes con diagnóstico de CUCI que presentaron recaída de la enfermedad. La edad media de los pacientes fue de 40,4 años, con edad mínima de 18 años y máxima de 82 años. Setenta pacientes fueron del sexo femenino (47,00%) y 80 pacientes del sexo masculino (53,00%). El tabaquismo fue positivo en el 37,00% (55 pacientes), con índice tabáquico mayor a 5 en el 18,00% (10 pacientes). La presencia de enfermedad autoinmune concomitante se encontró en 14 de los pacientes (9,00%). La edad al momento del diagnóstico de CUCI fue antes de los 40 años en el 79,30% de los casos. La extensión de la enfermedad fue distal en 50 pacientes (33,00%) y pancolitis en 100 pacientes (67,00%). El curso clínico de la enfermedad fue en su mayoría intermitente leve (34,00%), seguido de actividad intermitente grave en un 29,00%, un 26,00% tuvo un curso inactivo y solamente un 11,00% reportaron una actividad continua de la enfermedad. Todos los pacientes presentaron al menos un episodio de recaída clínica de la enfermedad manifestada por actividad leve (49,00%), moderada (34,00%) y grave (17,00%), según los criterios de Truelove-Witts. La actividad endoscópica fue leve en el 28,00%, moderada en el 31,00%, grave en 19,00% y en remisión en el 14,00%. La actividad histológica fue leve en 37,00%, moderada en 27,00%, grave en 16,00% y en remisión del 13,00%.
Sesenta y dos pacientes (41,00%) tenían manifestaciones extraintestinales, de las cuales la presencia de artritis/artralgias fue la más frecuente con un 71,00% del total, seguido de colangitis esclerosante primaria en 5 pacientes, lo que corresponde al 8,00% del total (tabla 1). La mayoría de los pacientes fueron tratados con 5-ASA (49,00%) y un 34,00% en tratamiento con 5-ASA más esteroide y 20,00% con azatioprina o 6 mercaptopurina. En cuanto al tratamiento quirúrgico sólo 21 pacientes habían sido sometidos a una colectomía total, las causas fueron: falta de respuesta al tratamiento 52,00%, sangrado masivo 14,00%, megacolon 10,00% y perforación 19,00%.
Características demográficas y clínicas de los pacientes con CUCI
| Características basales de los pacientes del estudio | |
| Variable | Pacientes incluidos en el estudio (n=150) |
| Edad media (años) | 40,44 |
| Mínima | 18 |
| Máxima | 82 |
| Sexo - n (%) | |
| Masculino | 80 (53,00) |
| Femenino | 70 (47,00) |
| Tabaquismo positivo - n (%) | 55 (37,00) |
| IT > 5 | 10 (18,00) |
| Edad al diagnóstico < 40 años - n (%) | 119 (79,00) |
| Extensión - n (%) | |
| Distal | 50 (33,00) |
| Pancolitis | 100 (67,00) |
| Curso clínico - n (%) | |
| Inicialmente activo | 39 (26,00) |
| Después inactivo | 51 (34,00) |
| Intermitente leve | 43 (29,00) |
| Intermitente grave | 17 (11,00) |
| Actividad continua | |
| Actividad endoscópica - % | |
| Inactiva | 14,00 |
| Leve | 28,00 |
| Moderada | 31,00 |
| Grave | 19,00 |
| Actividad histológica - % | |
| Inactiva | 13,00 |
| Leve | 37,00 |
| Moderada | 27,00 |
| Grave | 16,00 |
| MET - n (%) | |
| Sí | 62 (41,00) |
| No | 88 (59,00) |
| Frecuencia MET - n (%) | |
| Artralgias/Artritis | 44 (71,00) |
| CEP | 5 (8,06) |
IT: índice tabáquico; MET: manifestaciones extraintestinales; CEP: colangitis esclerosante primaria.
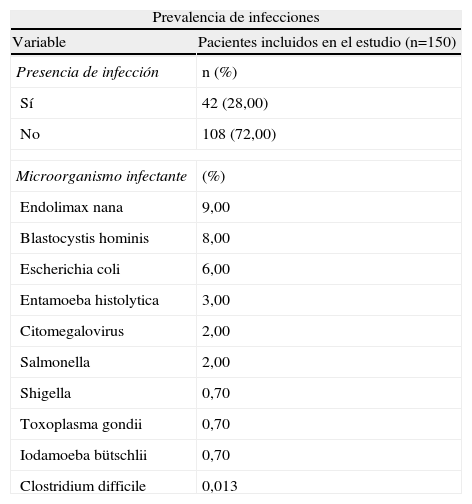
La frecuencia global de infección por diferentes microorganismos en pacientes con CUCI fue del 28,00%. Se encontró una prevalencia de 9,00% para Endolimax nana; 8,00% para Blastocystis hominis; 6,00% para Escherichia coli (E. coli); 3,00% para Entamoeba histolytica; 2,00% para CMV y Salmonella; y finalmente del 0,70% para Shigella, Toxoplasma gondii e Iodamoeba bütschlii. La infección por C. difficile fue la más baja del 0,013%, como se evidencia en la tabla 2.
Prevalencia de infecciones
| Prevalencia de infecciones | |
| Variable | Pacientes incluidos en el estudio (n=150) |
| Presencia de infección | n (%) |
| Sí | 42 (28,00) |
| No | 108 (72,00) |
| Microorganismo infectante | (%) |
| Endolimax nana | 9,00 |
| Blastocystis hominis | 8,00 |
| Escherichia coli | 6,00 |
| Entamoeba histolytica | 3,00 |
| Citomegalovirus | 2,00 |
| Salmonella | 2,00 |
| Shigella | 0,70 |
| Toxoplasma gondii | 0,70 |
| Iodamoeba bütschlii | 0,70 |
| Clostridium difficile | 0,013 |
Cabe destacar que la infección por CMV se confirmó mediante inmunohistoquímica en 3 pacientes, del 19,00% que presentaban actividad grave en la evaluación endoscópica.
A todos los pacientes se les practicó prueba de ensayo por inmuno-absorción ligado a enzimas para toxinas A y B de C. difficile en un cuadro de recaída de la CUCI, resultando positivos en sólo 2 pacientes, mismos que representan el 0,013% de la frecuencia total de infecciones por C. difficile. En aquellos pacientes en los cuales se encontró infección por C. difficile se tenían por lo menos 2 pruebas de toxina positiva, con un intervalo mínimo de 2 días entre ellas.
En los 21 pacientes que habían sido sometidos a una colectomía total, sólo se tomaron en cuenta las pruebas que fueron tomadas antes de la cirugía.
En el análisis de pacientes de acuerdo al tipo de tratamiento recibido, específicamente con esteroides y tiopurinas, no se observó incrementó en la frecuencia de infecciones, siendo del 15,00% en el grupo con esteroides y tiopurinas comparado con el 13,00% de los pacientes que sólo recibieron mesalazina (p=0,854), sin predominio de ningún microorganismo.
De los pacientes estudiados, en sólo 3 pacientes se presentó infección concomitante con 2 microorganismos, en donde 2 ellos tuvieron Endolimax nana y Blastocystis hominis; y el otro paciente presentó E. coli y Endolimax nana.
DiscusiónEn nuestro estudio encontramos una frecuencia global de infección por agentes patógenos del 28,00% del total de la población mexicana con CUCI estudiada.
El microorganismo que se documentó en la mayor parte de los casos (89,00%) fue el protozoario Endolimax nana, seguido de Blastocystis hominis en un 8,00%. Estos resultados muestran similitud a lo descrito en un estudio realizado previamente por Yamamoto-Furusho et al. en donde se incluyeron a 215 pacientes con diagnóstico de CUCI, y analizaron la prevalencia de infección parasitaria; encontrando que el 24,00% de la población estudiada presentó infección parasitaria representada por: Blastocystis hominis (10,00%), Endolimax nana (9,00%) y Entamoeba histolytica (5,00%)15. En nuestro estudio la frecuencia de infección por ésta última fue de 3,00%.
E. coli es la bacteria aeróbica Gram negativa predominante en la flora intestinal normal16. La población intestinal de E. coli es mayor en pacientes con EII, pero la razón de esta elevación, las características particulares de estas bacterias y su papel potencial en la patogénesis de la enfermedad no se conocen17,18. En un estudio realizado en Brasil, se investigaron las habilidades de adhesión y algunas propiedades de virulencia de E. coli 131 aisladas de cultivos de biopsias de recto de 23 pacientes con CUCI, 8 con EC y 23 controles. La capacidad de adherencia de las bacterias se investigó in vitro, utilizando células epiteliales HEp-2 en ensayos de 3 y 6 horas. Los aislamientos fueron analizados mediante PCR con diversos iniciadores de marcadores genéticos de virulencia. Cepas de E. coli entero-agregativa fueron detectadas en células HEp-2, en el ensayo a 3 horas; en 14/23 (60,90%) pacientes con CUCI, 7/8 (87,50%) con EC y en 7/23 (30,40%) de los controles (p=0,011). Los marcadores de virulencia genética fueron detectados en las cepas de 9 pacientes con CUCI (39,10%), pero en ninguno de EC o del grupo control. Estos resultados sugieren que el aumento en la población de E. coli en la mucosa rectal de pacientes con EII, en especial de los pacientes con CUCI está compuesta mayormente por cepas entero-agregativas, algunas de las cuales poseen marcadores clásicos de virulencia de E. coli19. En nuestro estudio la frecuencia fue de 6,00% para este microorganismo.
Los pacientes con EII se encuentran por lo general en un estado de inmunosupresión secundario a terapia farmacológica y a mala alimentación, así como posibles alteraciones de la función inmunológica mediada por células natural killer20–23. Estos factores, así como el tropismo de CMV por los sitios con inflamación, predisponen a los pacientes con EII a un mayor riesgo de infección activa por este microorganismo24. Su prevalencia en colitis grave varía entre un 21,00% hasta un 34,00%, con tasas de remisión de 67,00% a 100% en aquellos casos tratados con ganciclovir16. En nuestro estudio la frecuencia para este microorganismo fue de 2,00%. La infección por CMV puede sospecharse como una recaída que no responde a medicamentos, y la importancia de su detección radica en que la infección conjunta en pacientes con CUCI nos lleva a una tasa elevada de colectomía (67,00%) y mortalidad (33,00%)16. Un número considerable de reportes han demostrado que casos graves y refractarios de EII se han asociado a la presencia de cuerpos de inclusión de CMV y, en algunos de los casos, una tasa de hasta 15,00% con megacolon tóxico, colectomía en 62,00%, y una mortalidad del 44,00%24,25. En un estudio realizado por nuestro equipo de trabajo, encontramos que los pacientes con infección por CMV requieren colectomía antes que aquellos sin la infección (1,9 vs 4,2 años a partir del diagnóstico de CUCI, p=0,06), así como también una mayor prevalencia de CMV en pacientes con enfermedad resistente al tratamiento con esteroides por vía intravenosa en comparación con aquellos con megacolon tóxico. Observamos también una asociación entre la infección por CMV y la necesidad de colectomía temprana26.
Un estudio de cohorte de base poblacional con seguimiento completo, demostró un aumento del riesgo de EII en personas notificadas en los registros de laboratorio con un episodio de gastroenteritis por Salmonella o Campylobacter13. La presencia de Salmonella en nuestra población de estudio fue del 2,00%.
Existen reportes donde se asocia la infección por Toxoplasma gondii y EII27,28. Sin embargo, más que involucrar a este microorganismo con la patogenia de la enfermedad lo asocian a factores que predisponen a complicaciones infecciosas en la EII, tales como: la malnutrición, la edad avanzada, los medicamentos inmunosupresores, biológicos y la cirugía27,28. En nuestro estudio, la presencia de Toxoplasma gondii alcanzó apenas el 0,70%.
Diversos factores ambientales o externos han sido estudiados como causa de recaída o falta de respuesta al tratamiento, e incluso como factores protectores; en algunos ha sido posible encontrar una relación causal (tabaquismo, apendicectomía, anticonceptivos orales), mientras que en otros los resultados han sido menos claros (higiene, dieta, uso de antibióticos, lactancia)29. Dentro de las infecciones asociadas a recaída o falla al tratamiento, la infección por C. difficile ha sido de las más estudiadas. C. difficile es una bacteria anaerobia, Gram positiva, formadora de esporas. Este patógeno se describió por primera vez a finales de 1970, y no mucho tiempo después se reportaron casos en pacientes con EII. Los primeros intentos por demostrar una asociación entre la infección por C. difficile y la EII produjeron resultados controversiales. Evidencia posterior, sin embargo, demostró que C. difficile es uno de los patógenos entéricos que se encuentran más a menudo durante una recaída en los pacientes con EII30. La mayoría de los estudios muestran un aumento en la prevalencia e incidencia de infección por C. difficile, incluso doblándola durante los últimos 5 años en algunos lugares31. La incidencia de infección por C. difficile ha aumentado, tanto en pacientes con EII como en el resto de la población, aunque el aumento es mayor en EII, llegando al doble en EC y triplicándose en CUCI32. Una de las cohortes más grandes reporta que la infección por C. difficile afecta a 2,80% de los pacientes con CUCI, y a 1,00% de los pacientes con EC14. La infección es predominantemente hospitalaria, aunque en el contexto de EII algunas series han reportado que hasta el 79,00% de los casos pueden ser adquiridos en la comunidad; esto definido como una prueba positiva de infección por C. difficile a las 48 horas del ingreso hospitalario o posterior a las 4 semanas del contacto con un servicio de salud29. Los pacientes quirúrgicos también pueden infectarse, con prevalencias reportadas de 2,20% en pacientes con ostomías y en aquellos con anastomosis íleo-anal con prevalencias de hasta 18,30%33. La importancia de identificar este microorganismo es porque en pacientes con CUCI más infección por C. difficile, por lo menos la mitad de éstos requerirán hospitalización y hasta un 20,00% de colectomía31. Los hallazgos en nuestro estudio demostraron una frecuencia muy baja para esta infección (0,013%), contrastado en lo reportado casi en toda la literatura médica donde se menciona que existe un comportamiento a la alza de esta infección en pacientes con EII, particularmente en CUCI, así como su asociación a recaídas o refractariedad a tratamiento médico34.
Un estudio de casos y controles, en el cual se analizaron biopsias de colon, realizado recientemente en Inglaterra muestra una asociación significativa de 2 especies individuales de Campylobacter: concisus y ureolyticus en pacientes con CUCI35.
Chen et al. evaluaron la presencia de Chlamidya pneumoniae (C. pneumoniae) en biopsias colónicas de pacientes con EII (11 pacientes con CUCI y 18 con EC), y en pacientes controles, mediante PCR-EIA para amplificar una porción del gen omp1 específico para C. pneumoniae. Se identificaron biopsias positivas en el 38,90% de los pacientes con CUCI. Sin embargo, las tasas de detección de biopsias positivas para C. pneumoniae fueron similares entre los diferentes grupos de pacientes, concluyendo que la presencia relativamente alta de este microorganismo en las biopsias endoscópicas es probablemente el resultado de una colonización oportunista o la persistencia de una infección latente36.
Recientemente, se ha encontrado Fusobacterium varium (F. varium) en la mucosa colónica de un significativo número de pacientes con CUCI. En el examen inmunoquímico de muestras de biopsias de casos activos de CUCI, se observó que F. varium invadía la mucosa y se alojaba en las criptas37. En un estudio japonés se estimó la prevalencia de infección por F. varium, basada en la serología para evaluar la relación entre la seropositividad a F. varium y la CUCI. Los pacientes seropositivos se determinaron mediante inmunotransferencia con antígeno F. varium ATCC 8501. De los 112 pacientes con CUCI, resultaron positivos 45 (40,20%) y 20 (15,60%) de los 128 controles sanos, respectivamente (p<0,01). En cuanto a la actividad de la enfermedad, los pacientes seropositivos con CUCI fueron más propensos a tener enfermedad clínica severa que los pacientes seronegativos con la enfermedad. La localización de la enfermedad en pacientes seropositivos era más extensa que en los pacientes seronegativos38. La infección por algunos microorganismos como los referidas con anterioridad se han asociado a pacientes con CUCI, y a ciertas características clínicas de la misma, sin embargo, en nuestro estudio no evidenciamos la presencia de estos agentes infecciosos.
En un estudio polaco en el cual se estudiaron 89 pacientes con CUCI, se demostró la colonización por Candida albicans (C. albicans) significativamente más frecuente en la mucosa del colon en pacientes con CUCI en fase activa, y una mayor duración de este periodo en comparación con el grupo control39. El hallazgo de que C. albicans es el hongo más frecuentemente aislado en pacientes con CUCI está en consonancia con la observación de Bougnoux et al.40, que mostró la prevalencia de las especies de C. albicans y Candida glabrata en el 88,00% y 9,00% de los portadores, respectivamente. Se desconoce, sin embargo, si la colonización por Candida es el evento principal, y por lo tanto, si puede ser considerado una causa importante de CUCI, o si la infección se produjo secundaria a la colitis (predispone a la mucosa colónica a la infección) o a tratamiento corticoesteroide o inmunosupresor concomitante. El papel de la colonización por hongos en el tracto gastrointestinal y su influencia en el curso de la EII aún no ha sido explorado del todo, en nuestro estudio no evidenciamos la presencia de hongos en la población estudiada.
Existen reportes de asociación con algunas infecciones virales como sarampión, rubeola e infección por virus de Epstein-Barr16, mismas que no fueron objeto de nuestro estudio.
Nuestros resultados muestran la presencia de otros patógenos para los cuales la asociación con recaídas en la CUCI no está bien definida como Shigella (0,70%) e Iodamoeba bütschlii (0,70%).
ConclusiónLa frecuencia global de infecciones parasitarias, bacteriana y virales en pacientes mexicanos con CUCI fue del 28,00%.
Conflictos de interesesEl Dr. Jesús Kazuo Yamamoto Furusho es miembro del Advisory Board, líder de opinión y ponente para Abbott Laboratories de México, Abbott Internacional y Janssen Cilag de México. Es líder de opinión y ponente para Farmasa y Ferring. Asesor de investigación y ponente para UCB México. Ponente y asesor de Almirall. Investigador principal para el proyecto clínico (IM 129-005) en CUCI para Bristol Myers México, de donde recibe fondos de investigación.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este manuscrito.