La hepatitis autoinmune (HAI) es una enfermedad inflamatoria crónica del hígado con manifestaciones clínicas inespecíficas y mayor daño hepático en niños que en adultos.
ObjetivoAnalizar la evolución clínica, los perfiles bioquímicos, los cambios histopatológicos y la respuesta al tratamiento de 20 niños con HAI.
Material y métodosEstudio retrospectivo de las variables asociadas a evolución clínica, diagnóstico y respuesta al tratamiento en niños atendidos en la UMAE n.° 71 IMSS Torreón, Coahuila, México, en el período comprendido entre 1992 y 2012.
ResultadosSe analizó a 20 pacientes, el 75% con HAI-1 y el 25% con HA1-2. Se observó predominio del sexo femenino 3:1. La edad promedio ± desviación estándar fue de 10.07 ± 6.53 años para HAI-1 y de 6.75 ± 3.77 para HAI-2. La asociación a enfermedades inmunológicas fue del 40%.
Los pacientes del grupo HAI-2 mostraron mayores alteraciones en su perfil bioquímico y deficiencia de IgA. La positividad para anticuerpos antinucleares y anticuerpos antimúsculo liso fue del 100% en los pacientes con HAI-1, anticuerpos antimicrosomales para hígado y riñón tipo 1 en el 100% de HAI-2. Las biopsias hepáticas mostraron hepatitis de interfase en ambos grupos. Los pacientes del grupo HAI-2 respondieron más rápidamente al tratamiento y tuvieron mayor tasa de recaídas.
ConclusionesEs necesario sospechar la HAI en pediatría para poder realizar un diagnóstico temprano y así establecer el tratamiento oportuno. Determinar el tipo de HAI nos permitirá establecer el diagnóstico adecuado y elaborar un mejor pronóstico respecto a tasas de recaídas y complicaciones.
Autoimmune hepatitis (AIH) is a chronic inflammatory disease of the liver with nonspecific clinical manifestations that causes greater liver damage in children than in adults.
AimsTo analyze the clinical progression, biochemical profiles, histopathologic changes, and treatment response in 20 children with AIH.
Material and methodsA retrospective study was carried out on the variables associated with clinical progression, diagnosis, and treatment response in children seen at the the Unidad Médica de Alta Especialidad (UMAE) No. 71 IMSS in Torreón, Coahuila, Mexico, from 1992 to 2012.
ResultsTwenty patients were analyzed, 75% with type 1 AIH (AIH-1) and 25% with type 2 AIH (AIH-2). Girls predominated with a 3:1 ratio of girls to boys. The mean age was 10.07 ± 6.53 years for the AIH-1 cases and 6.75 ± 3.77 years for the AIH-2 cases. There was an association with immunologic diseases in 40% of the patients.
The patients in the AIH-2 group had greater biochemical profile alterations and IgA deficiency. Anti-nuclear antibody and anti-smooth muscle antibody were positive in 100% of the patients with AIH-1, and anti-liver kidney microsomal type 1 antibody was positive in 100% of the AIH-2 patients. Liver biopsy revealed interface hepatitis in both groups. The AIH-2 group responded more quickly to treatment, but had a higher recurrence rate.
ConclusionsAutoimmune hepatitis in the pediatric patient should be suspected in order to make an early diagnosis and thereby establish opportune treatment. Determining the type of AIH is necessary for making adequate diagnosis and for achieving a better outcome in relation to recurrence and complication rates.
La hepatitis autoinmune (HAI) es un proceso inflamatorio de tipo crónico que implica destrucción celular y fibrosis. Afecta predominantemente a las mujeres y se caracteriza por elevación de transaminasas e inmunoglobulinas, principalmente inmunoglobulina G (IgG).
La HAI tiene 2 variantes principales: tipo 1 (HAI-1) y tipo 2 (HAI-2). La HAI-1 es la forma más común, afecta a niños y adultos, se caracteriza por la presencia de anticuerpos séricos antinucleares y antimúsculo liso (ANA, SMA) y la tipo 2 (HAI-2) que afecta a los niños y adultos jóvenes principalmente. Se caracteriza por la presencia de anticuerpos antimicrosomales para hígado y riñón (LKM-1). Los criterios diagnósticos fueron publicados por el Grupo Internacional para los criterios diagnósticos para la HAI revisados en 19931 y 19992, simplificados en 20083,4.
Estos criterios incluyen: la exclusión de procesos infecciosos virales, los perfiles de anticuerpos (ANA, SMA, LKM-1), niveles elevados de IgG mayor a 1.10 veces los límites normales y un patrón histológico de hepatitis de interfase con células plasmáticas y formación de rosetas. En los niños y adultos jóvenes, la HAI se presenta en forma aguda y tiene un curso más agresivo que en adultos mayores5,6.
ObjetivoAnalizar la evolución clínica, los perfiles bioquímicos, los cambios histopatológicos y la la respuesta al tratamiento de 20 niños con HAI.
Material y métodosSe estudió a 20 niños con diagnóstico de HAI en la consulta externa del Departamento de Gastroenterología y Nutrición pediátrica de la Unidad Médica de Alta Especialidad n.° 71 del Instituto Mexicano del Seguro Social, que asistieron entre 1992 y 2012. En cada caso, se clasificó la afección según los criterios de la International Autoimmune Hepatitis Group (IAIHG) y se reclasificaron con los criterios de diagnóstico simplificado del año 2008. En cada caso, se realizó la recolección de las variables: edad, sexo, forma de presentación clínica, asociación con enfermedades inmunológicas, manifestaciones clínicas, pruebas de función hepática, albúmina sérica, INR, inmunoglobulinas séricas, hallazgos de biopsia hepática, tiempo de evolución, tratamiento, recaídas y frecuencia de complicaciones.
Análisis estadístico: los resultados fueron analizados con la prueba de la t de Student y la prueba de Wilcoxon para determinar las diferencias de medias. El valor para significación estadística fue de p ≤ 0,05 (paquete estadístico SPSS versión 17.0, Chicago, EE. UU.).
ResultadosSe analizó a 20 pacientes, 15 (75%) presentaron HAI-1 y 5 correspondieron a HA1-2. La población estuvo formada por 15 mujeres y 5 hombres, proporción 3:1. La edad promedio ± desviación estándar en años fue de 10.07 ± 6.53 en los pacientes de HAI-1 y 6.75 ± 3.77 en los pacientes de HAI-2. El modo de presentación fue principalmente como hepatitis aguda en ambos grupos, aunque con frecuencia levemente mayor en el grupo HAI-1. En el grupo HAI-2, se observó con mayor frecuencia la presencia de otras enfermedades inmunológicas, tales como tiroiditis y enfermedad inflamatoria intestinal (EII) tipo colitis ulcerativa (tabla 1).
Hallazgos clínicos en la presentación de HAI tipo 1 y HAI tipo 2
| HAI tipo 1 (n=15) | HAI tipo 2 (n=5) | Valor de p | |
|---|---|---|---|
| Edad en años (media ± DE) | 10.07 ± 6.53 | 6.75 ± 3.77 | 0.001* |
| Femenino (%) | 73.33 | 80 | 0.095 |
| Modo de presentación | |||
| Hepatitis aguda (%) | 53.33 | 40 | 0.05* |
| Insuficiencia hepática aguda (%) | 6.67 | 20 | 0.03* |
| Inicio insidioso (%) | 20 | 20 | 0.649 |
| Complicación de enfermedad hepática crónica (%) | 13.3 | 20 | 0.05* |
| Asociación a enfermedades inmunológicas (%) | 20 | 40 | 0.043* |
| Enfermedad inflamatoria intestinal (%) | 6.67 | 20 | 0.001* |
| Historia familiar de enfermedades autoinmunes (%) | 13.3 | 40 | 0.001* |
| Colangiograma anormal (%) | 0 | 0 | 0.755 |
χ2 prueba exacta de Fisher.
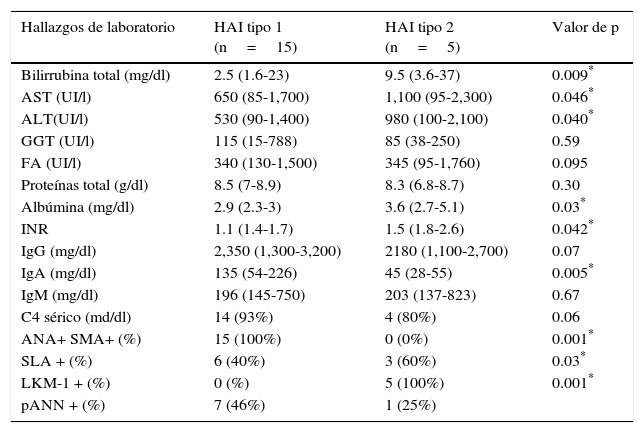
El perfil bioquímico incluyó la determinación de bilirrubinas totales (BT), bilirrubina directa (BD) y bilirrubina indirecta (BI), aminotransferasas (AST, ALT, GGT), fosfatasa alcalina (FA), proteínas totales, albúmina y globulina, pruebas de coagulación: tiempo de protrombina (TP), relación normalizada internacional (INR), y el perfil inmunológico, la determinación de inmunoglobulinas IgG, IgM, IgA, componente 4 del complemento (c4), anticuerpos anticuleares(ana), anticuerpos antimúsculo liso (sma) y anticuerpos microsomales contra hígado y riñón tipo 1 (lkm-1).
Todos los casos de HAI-1 fueron positivos para ANA y/o SMA, y todos los pacientes de HAI-2 fueron positivos para LKM-1. Otros anticuerpos, como los anti-antígeno soluble hepático (SLA) fueron positivos en ambos grupos, con predominio en pacientes con HAI-2, en un 60% (tabla 2).
Hallazgos bioquímicos e inmunológicos en la presentación de HAI tipo 1 y HAI tipo 2
| Hallazgos de laboratorio | HAI tipo 1 (n=15) | HAI tipo 2 (n=5) | Valor de p |
|---|---|---|---|
| Bilirrubina total (mg/dl) | 2.5 (1.6-23) | 9.5 (3.6-37) | 0.009* |
| AST (UI/l) | 650 (85-1,700) | 1,100 (95-2,300) | 0.046* |
| ALT(UI/l) | 530 (90-1,400) | 980 (100-2,100) | 0.040* |
| GGT (UI/l) | 115 (15-788) | 85 (38-250) | 0.59 |
| FA (UI/l) | 340 (130-1,500) | 345 (95-1,760) | 0.095 |
| Proteínas total (g/dl) | 8.5 (7-8.9) | 8.3 (6.8-8.7) | 0.30 |
| Albúmina (mg/dl) | 2.9 (2.3-3) | 3.6 (2.7-5.1) | 0.03* |
| INR | 1.1 (1.4-1.7) | 1.5 (1.8-2.6) | 0.042* |
| IgG (mg/dl) | 2,350 (1,300-3,200) | 2180 (1,100-2,700) | 0.07 |
| IgA (mg/dl) | 135 (54-226) | 45 (28-55) | 0.005* |
| IgM (mg/dl) | 196 (145-750) | 203 (137-823) | 0.67 |
| C4 sérico (md/dl) | 14 (93%) | 4 (80%) | 0.06 |
| ANA+ SMA+ (%) | 15 (100%) | 0 (0%) | 0.001* |
| SLA + (%) | 6 (40%) | 3 (60%) | 0.03* |
| LKM-1 + (%) | 0 (%) | 5 (100%) | 0.001* |
| pANN + (%) | 7 (46%) | 1 (25%) |
χ2 prueba exacta de Fisher.
En todos los casos, se realizó biopsia hepática y se observó hepatitis de interfase con células plasmáticas. La formación de rosetas y la cirrosis fueron observadas con mayor frecuencia en el grupo de HAI-1. No se observaron cambios en los conductos biliares en ninguno de los casos (tabla 3).
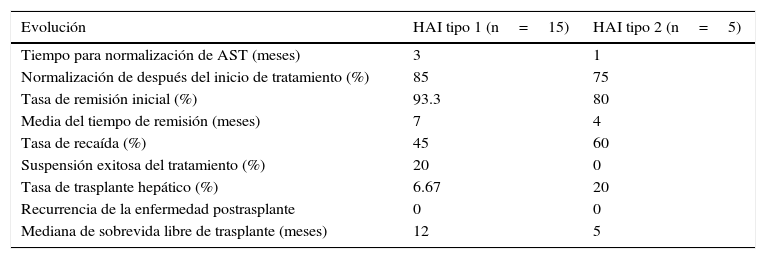
Los pacientes del grupo HAI-2 respondieron más rápidamente al tratamiento; sin embargo, la tasa de recaídas fue mayor. Los pacientes del grupo HAI-1 presentaron mayor tasa de remisión y durante más tiempo que los pacientes con HAI-2 (tabla 4).
Respuesta al tratamiento y evolución en la presentación de HAI tipo 1 y HAI tipo 2
| Evolución | HAI tipo 1 (n=15) | HAI tipo 2 (n=5) |
|---|---|---|
| Tiempo para normalización de AST (meses) | 3 | 1 |
| Normalización de después del inicio de tratamiento (%) | 85 | 75 |
| Tasa de remisión inicial (%) | 93.3 | 80 |
| Media del tiempo de remisión (meses) | 7 | 4 |
| Tasa de recaída (%) | 45 | 60 |
| Suspensión exitosa del tratamiento (%) | 20 | 0 |
| Tasa de trasplante hepático (%) | 6.67 | 20 |
| Recurrencia de la enfermedad postrasplante | 0 | 0 |
| Mediana de sobrevida libre de trasplante (meses) | 12 | 5 |
El tratamiento inicial establecido fue prednisona (PDN) a dosis de 2mg/kg/día, con dosis máxima de 60mg al día. La duración de este tratamiento fue en promedio de 8 semanas, hasta lograr una reducción de los niveles séricos de AST y ALT en, por lo menos, un 80% de su valor inicial.
Posteriormente, se inició reducción progresiva de los esteroides hasta lograr la normalización de las aminotransferasas. Logrado el objetivo, se estableció una dosis de mantenimiento con PDN a dosis de 5mg al día. Cuando no se alcanzó el objetivo, se añadió azatioprina (AZA) en dosis de 0.5-2.5mg/kg/día hasta normalizar la AST. Se continuó con dosis de mantenimiento de la AZA a 0.5mg/kg/día. Cuando existió falla de respuesta o signos de toxicidad, se inició micofenolato de mofetilo a 20mg/kg. Cuando se presentó falta de respuesta o toxicidad, se utilizó ciclosporina o tracolimús, lo cual ocurrió en el 6,67% (n=1) de los casos de HAI-1 y en el 20% (n=1) de los pacientes con HAI-2. Estos 2 pacientes fueron sometidos a trasplante hepático.
DiscusiónEl diagnóstico definitivo de HAI se establece sobre la base de criterios clínicos, de laboratorio e histopatológicos que han sido definidos por la IAIHG.
Algunos de estos criterios están relacionados directamente con el diagnóstico y otros, como la deficiencia parcial de IgA que se observa en los pacientes con HAI-2, se han asociado a un peor pronóstico7.
Aunque los autoanticuerpos son parte esencial del diagnóstico de HAI, entre el 10 y el 15% de los pacientes no se detectan ANA, SMA y LKM-1 en el momento de la presentación clínica, pero posteriormente se vuelven detectables, y solo el 5% permanecen negativos8-10. En estos casos, la presencia de otros criterios, como la elevación de IgG y los cambios histopatológicos observados en las biopsias hepáticas11, son determinantes para establecer el diagnóstico.
En los criterios diagnósticos los títulos de ANA, SMA y LKM-1 se han establecido como positivos de 1:40; esto es aplicable en adultos, pero para los niños con un título de 1:20 es suficiente para ANA y SMA, y de 1:10 para LKM-112. En ambos grupos de HAI encontramos positividad de los SLA, con predominio en el grupo de HAI-2 y esto se relaciona con el curso más severo y con más alta tendencia a las recaídas13, como se presentó con predominio en los pacientes con HAI-2 y en los 2 pacientes que requirieron trasplante hepático. Para realizar el diagnóstico definitivo se requiere realizar biopsia hepática y tomar en cuenta los criterios histopatológicos ya mencionados con alta especificidad del 81-99%, pero baja sensibilidad del 36-57% y con valor predictivo positivo del (VPP) del 62-91%14. En un estudio cegado para los patólogos de Kumari et al.15, se compararon biopsias hepáticas de enfermedad hepática autoinmune contra no autoinmune. Ellos encontraron: hepatitis de interfase, infiltrado portal linfoplasmocitario, emperipolesis y formación de rosetas en el 56% de los casos de enfermedad hepática autoinmune. La formación de rosetas fue el único factor predictor independiente de enfermedad hepática autoinmune. Cuando consideraron 3 de 4 cambios la certeza diagnóstica para HAI fue del 76.9%, con un VP) del 93.3% y un valor predictivo negativo (VPN) del 70.7% La cirrosis hepática estuvo presente en una alta proporción de casos, predominantemente del grupo HAI-1 (60%). Fortes et al.16 nos muestran que los pacientes que presentan el alelo HLADRB1-1301 tuvieron mayor riesgo de presentar cirrosis. La cirrosis se encuentra presente en el 44 al 80% de los casos en el momento del diagnóstico en los niños y permanecen clínicamente estables con baja mortalidad y buena calidad de vida con el tratamiento a largo plazo17.
Los objetivos del tratamiento son mejorar los síntomas, inducir la remisión bioquímica, abatir la inflamación hepática y prolongar la sobrevida18. La remisión clínica y bioquímica no necesariamente refleja la resolución histológica, ya que los cambios histopatológicos son más tardíos19; se menciona que después de un tratamiento de 4 años se llega a observar mejoría en la fibrosis y en la intensidad de la inflamación portal en más de 95% de los casos.
La respuesta adecuada al tratamiento fue más rápida en el grupo de HAI-2. En promedio, se observó dentro del primer mes de tratamiento; sin embargo, una pobre respuesta se presentó en el 20% de los casos correspondientes a este grupo. El pronóstico y la respuesta al tratamiento en los niños se han asociado a marcadores genéticos e inmunológicos como HLA-DRB1*1301 y DRB1*0720-23. En un estudio de Czaja et al.24 concluyeron que los pacientes con HLA -DRB1*03 eran más jóvenes al inicio de la enfermedad y tuvieron peor respuesta al tratamiento con esteroides que los pacientes con HLA -DRB1*04, quienes eran en forma más frecuente mujeres con asociación con otras enfermedades inmunológicas25. El antígeno de histocompatibilidad tipo ii (MHC II) antígeno HLA-DRB1*04 es más común en grupos étnicos en México y Japón26.
Las recaídas son comunes en el curso del tratamiento; en nuestro estudio, un 45% de los casos con HAI-1 y un 60% de los casos de AIH-2 presentaron recaídas, lo que motivó un incremento temporal en la dosis de los esteroides. En un estudio de Van Gerven et al.27, realizado en una cohorte de 131 pacientes, reportaron una tasa de recaída del 47%. El mayor riesgo de recaída se observó en aquellos pacientes muy jóvenes que presentaban también una enfermedad autoinmune concomitante.
Otro factor asociado a las recaídas es la falta de apego al tratamiento. En nuestra población, se presentó en un 20% de los casos en cada grupo, similar a lo reportado por Sotelo y López28 en 2005, en un estudio en niños mexicanos de Hermosillo Sonora con abandono del tratamiento en el 22% de los casos29.
La suspensión exitosa del tratamiento se logró solo en el 20% de los pacientes con HAI-1 y en ningún paciente perteneciente al grupo de HAI-2. Por lo tanto, en la HAI-2 no se recomienda la suspensión del tratamiento, ya que las recaídas son más frecuentes y la falla de la remisión es una condición casi segura30. Deneau et al.31, en un estudio de cohorte retrospectivo basado en la población, encontraron una remisión libre de terapia inmunosupresora sostenida en un 41.6% de pacientes pediátricos dentro de los primeros 5 años del diagnóstico.
Respecto al tipo de tratamiento, es importante resaltar la respuesta favorable de la HAI a los esteroides y a los inmunmosupresores32-34. La respuesta se logra con el uso exclusivo de PDN o en combinación con la AZA. Otra opción es budesonida, que tiene menos efectos colaterales y más rápida eliminación hepática, aunque no se puede usar en pacientes con cirrosis, lo que limita su uso en una gran proporción de pacientes con HAI con esta complicación. Mieli-Vergani et al.35, en una cohorte de pacientes pediátricos, compararon el uso de budesonida con AZA contra PDN con AZA; no encontraron diferencia en la tasa de remisión a los 6 y 12 meses. Cuando existe falla al tratamiento, los medicamentos utilizados son ciclosporina, tracolimús y micofenolato de mofetilo.
La terapia estándar con PDN-AZA es efectiva en un 85% de los casos36, existen otros tratamientos alternativos que deben ser considerados. La infusión de células T regulatorias antígeno-específicas para restituir la regulación inmunológica dañada y restaurar la tolerancia periférica perdida37–42 se ha sugerido para el manejo de la HAI-2, aunque su disponibilidad está restringida.
La duración óptima del tratamiento inmunosupresor es controversial y se considera exitoso solamente si existe resolución histopatológica de la inflamación después de uno o dos años de tratamiento con niveles normales de transaminasas e inmunoglobulinas, así como negatividad para los autoanticuerpos. Aclaración: para considerar la duración óptima del tratamiento debe existir remisión y esta se define como la ausencia de síntomas, normalización de inmunoglobulinas séricas de aminotransferasas ALT/AST y de autoanticuerpos, con demostración histopatológica con mínima inflamación y sin necrosis. Se sugiere no suspender el tratamiento dentro de los primeros 3 años del diagnóstico o inmediatamente antes de la pubertad por la posibilidad de recaídas frecuentes.
A diferencia de los pacientes con colangitis esclerosante autoinmune, los pacientes con HAI tienen mejor respuesta al tratamiento, con mejor tasa de sobrevida, y requieren dosis baja de medicamento para su mantenimiento43.
Ngu et al.44 analizaron los predictores de pobre respuesta al tratamiento, entre los que se encuentran incompleta normalización de ALT a los 6 meses de manejo, la baja concentración de la albúmina y la edad ≤ 20 años y ≥ 60 años. Estas variables fueron predictores independientes de la necesidad de trasplante hepático y/o posibilidad de muerte; sin embargo, la cirrosis no se encontró asociada a mal pronóstico y no influyó en la respuesta al tratamiento inmunosupresor inicial.
ConclusionesEs necesario sospechar la hepatitis autoinmune en pediatría para poder realizar un diagnóstico temprano y así establecer el tratamiento oportuno. El retardo en el diagnóstico resulta en cirrosis e insuficiencia hepática.
La HAI en niños se presenta en forma aguda y tiene un curso más agresivo que en los adultos.
La presencia de cirrosis no modifica la respuesta al tratamiento.
La respuesta óptima al tratamiento se logró más rápidamente en los pacientes con HAI-2, quienes también presentan tasas de recaídas mayores y en menor tiempo.
La presencia de autoanticuerpos SLA está asociada a una menor respuesta al tratamiento y una frecuencia mayor de recaídas.
Las recaídas son comunes en el curso del tratamiento, se presentan en un 45-60% de los casos y se observan más frecuentemente en pacientes con HAI-2.
La combinación de PDN + AZA es el tratamiento de elección inicial.
Se requieren más estudios genéticos y de marcadores inmunológicos que ayuden a determinar la susceptibilidad a presentar HAI, establecer factores pronósticos y respuesta al tratamiento.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio/artículo
Conflicto de interesesLos autores declaran no tener conflicto de intereses.