La enfermedad de hígado graso no alcohólico (EHGNA) es un trastorno metabólico del hígado atribuido al depósito de ácido graso que puede inducir necroinflamación hepática, definida como esteatohepatitis no alcohólica (EHNA). Está asociada de manera importante con la obesidad. La gastrectomía laparoscópica en manga (GLM) es una modalidad quirúrgica favorable para el tratamiento de la obesidad mórbida.
ObjetivoNuestro estudio evaluó el impacto de la GLM en pacientes con EHGNA y obesidad mórbida, 3 meses posterior a la operación, por medio de características clínicas y bioquímicas, índices bioquímicos y parámetros de imagenología.
Pacientes y métodosPacientes con obesidad mórbida con EHGNA con o sin EHNA se sometieron a una GLM. Fueron evaluados clínicamente (peso, IMC y circunferencia de cintura) y bioquímicamente (transaminasas y triglicéridos), al igual que con el índice de hígado graso (IHG), el índice de esteatosis hepática (IEH) y estudios de imagen de elastografía por ultrasonido (medición de rigidez hepática [MRH] y el parámetro de atenuación controlada [PAC]), previo a la GLM y 3 meses posoperatorio.
ResultadosVeintiséis pacientes obesos con EHGNA se sometieron a una GLM que resultó en una reducción significativa de todos los parámetros analizados, excepto por las transaminasas hepáticas.
ConclusiónLa GLM es considerada una modalidad quirúrgica eficiente para el tratamiento de pacientes con obesidad mórbida y EHGNA.
Nonalcoholic fatty liver disease (NAFLD) is a metabolic liver disorder commonly attributed to fatty acid deposition that can induce hepatic necroinflammation, defined as nonalcoholic steatohepatitis (NASH). It is strongly associated with obesity. Laparoscopic sleeve gastrectomy (LSG) is a favorable surgical modality for the treatment of morbid obesity.
AimOur study evaluated the impact of LSG on patients with NAFLD and morbid obesity, 3 months after the operation, through clinical and biochemical characteristics, clinico-biochemical indices, and imaging parameters.
Patients and methodsMorbidly obese patients with NAFLD±NASH underwent LSG. They were thoroughly evaluated clinically (body weight, body mass index, waist circumference) and biochemically (transaminases and triglycerides), as well as through the fatty liver index (FLI), the hepatic steatosis index (HSI), and ultrasound elastography imaging studies (liver stiffness measurement [LSM] and the controlled attenuation parameter [CAP]), before and 3 months after the LSG.
ResultsTwenty-six obese patients with NAFLD underwent LSG that resulted in a significantly high reduction in all the parameters analyzed, except for liver transaminases.
ConclusionLSG is considered an efficient surgical modality for the treatment of morbidly obese patients with NAFLD.
La enfermedad de hígado graso no alcohólico (EHGNA) está incrementando rápidamente y se está convirtiendo en una de las causas más evidentes de enfermedad hepática1. Histopatológicamente, está caracterizado por el depósito de triglicéridos hepáticos y ácidos grasos libres2. Engloba un amplio espectro de lesión hepática, desde esteatohepatitis no alcohólica (EHNA), fibrosis y, en consecuencia, fallo hepatocelular, hasta carcinoma3. La creciente incidencia de la EHGNA está fuertemente asociada con la prevalencia de obesidad y sus subsiguientes trastornos metabólicos4.
El sobrepeso y la obesidad se definen por un valor de IMC de 25-30kg/m2 y >30kg/m2, respectivamente, y debido a su creciente prevalencia en la población, incluidos los niños, representan un importante problema de salud pública4.
En casos de obesidad mórbida, la cirugía bariátrica (CB) es más efectiva que las modalidades convencionales de pérdida de peso5. Resultan en una pérdida de peso más significativa y duradera, mejoran las comorbilidades inducidas por la obesidad, e incrementa la tasa de supervivencia6. La gastrectomía laparoscópica en manga (GLM) es una opción de tratamiento prometedora para pacientes con obesidad mórbida7. Es un procedimiento efectivo que induce una reducción significativa de peso en el seguimiento a mediano plazo8.
El índice de hígado graso (IHG) es un discriminador confiable para diagnosticar la EHGNA, pero la circunferencia de cintura (CC) es más simple y accesible, su aplicación es comparable9 y está correlacionada significativamente con la EHGNA10,11. El índice de esteatosis hepática (IEH) también es una prueba de tamizaje simple y eficiente para la EHGNA que puede ser utilizada para seleccionar individuos para ultrasonografía hepática y determinar la necesidad de modificaciones de estilo de vida12.
La elastografía transitoria (ET) con o sin el parámetro de atenuación controlada (PAC) es un estudio de imagen no invasivo que evalúa con precisión la fibrosis hepática y la esteatosis, por lo que es considerada una alternativa confiable a la biopsia hepática13,14. Sus ventajas son su costo relativamente bajo en comparación con la biopsia de hígado, y su eficiencia diagnóstica, en particular en los grados más elevados de fibrosis hepática15. El PAC es excelente para detectar esteatosis hepática significativa16 debido a su facilidad de medición, independencia del operador, y uso simultáneo con la medición de rigidez del hígado (MRH) para la fibrosis17. Puede incluso detectar grados bajos de esteatosis18.
El objetivo del presente estudio fue evaluar el impacto de la GLM en pacientes con obesidad mórbida con EHGNA, 3 meses posterior a cirugía, por medio de factores clínicos (medidas corporales) y bioquímicos (transaminasas y triglicéridos), índices de grasa hepática (IHG e IEH) y parámetros de imagenología (FibroScan® y PAC).
Materiales y métodosSe realizó un estudio prospectivo en pacientes obesos que se sometieron a una GLM en el Hospital Universitario Kasr AlAiny, de la Facultad de Medicina en la Universidad de El Cairo. La evaluación preoperatoria incluyó una historia clínica médica y quirúrgica completa, pruebas de laboratorio básicas y asesoría nutricional.
Los criterios de inclusión fueron: pacientes adultos (≥18 años), ambos sexos con obesidad mórbida (IMC≥40kg/m2 única, o IMC≥35kg/m2 con comorbilidades tales como hipertensión y diabetes mellitus [DM]).
Los criterios de exclusión fueron enfermedad hepática crónica diferente a la EHGNA, tales como enfermedades infecciosas, enfermedades autoinmunes, trastorno por consumo de alcohol, enfermedades metabólicas, etc. La presencia de gastritis, hernia hiatal y enfermedad por reflujo gastroesofágico fue excluida mediante endoscopía alta con el objetivo de evitar empeoramiento o aparición de cualquiera de estas posterior a la GLM19,20.
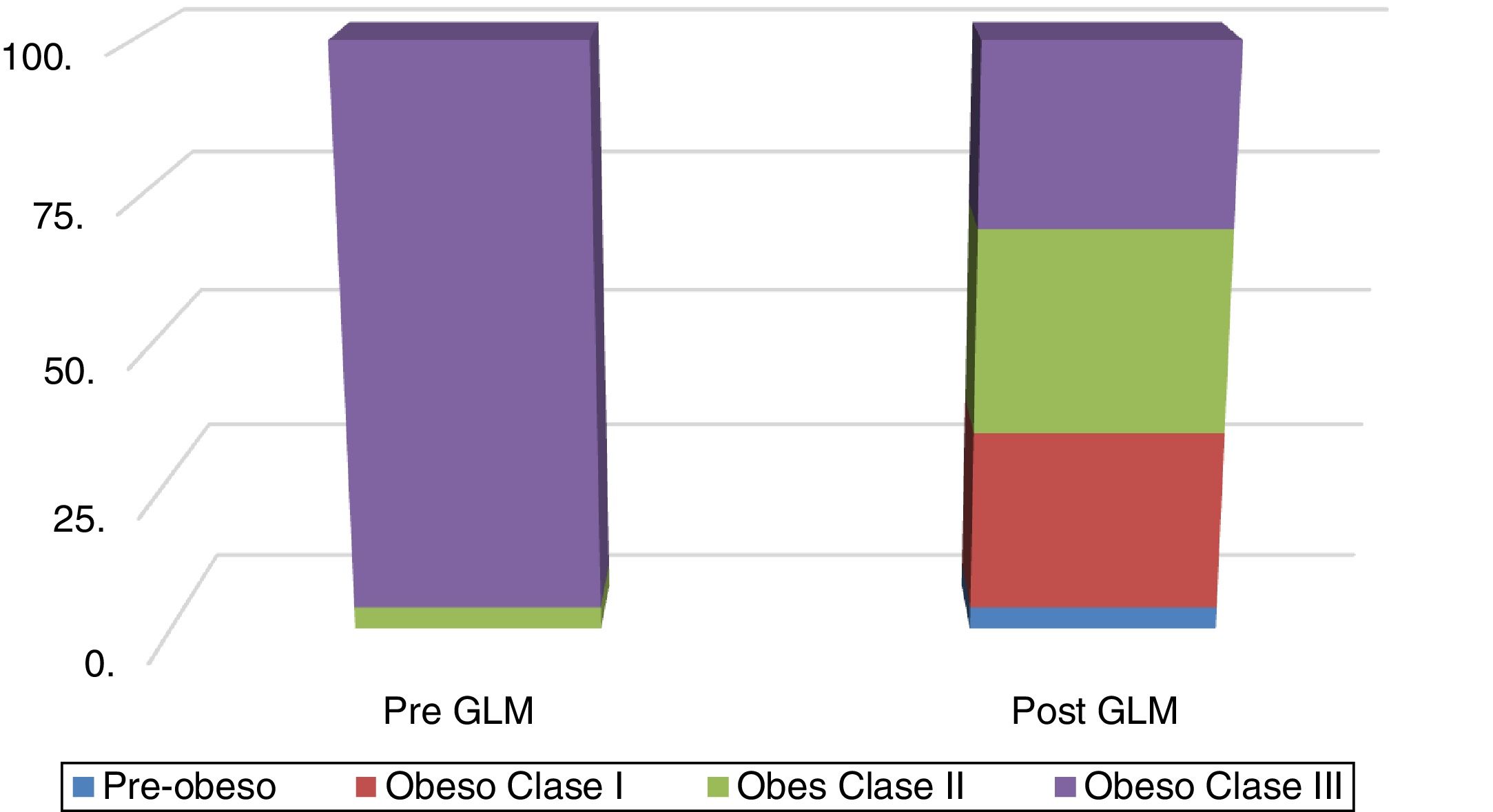
A los pacientes que participaron en el estudio se les realizó: 1) una entrevista para obtener su historia clínica completa e identificar la presencia de cualquier comorbilidad (DM, hipertensión, cardiopatía isquémica, etc.); 2) un examen clínico completo que incluyó la determinación y clasificación del IMC (con las categorías sobrepeso/pre obeso [IMC=25-29.9kg/m2], clase I [IMC=30-34.9kg/m2], clase II [IMC=35-39.9kg/m2] y clase III/obesidad extrema [IMC≥40kg/m2])21 y CC; 3) una semana antes de la GLM y 3 meses posterior al procedimiento a todos los casos se les realizó: a) pruebas bioquímicas (i. perfil bioquímico hepático: aspartato transaminasa [AST], alanina aminotransferasa [ALT] y gamma-glutamil transpeptidasa [γ-GT], ii. triglicéridos); b) índices de grasa hepática (i. IHG22=logística [0.953 * en (TG)+0.139 * IMC+0.718+ln (γ-GT)+0.053+CC- 15.745] * 100, donde logística [×]=1/ [1+e_×] denota la función logística y ln el algoritmo natural. Valores de <30 descartan la esteatosis y valores de ≥60 la confirman, ii. IEH12=8×ALT/AST+IMC+2 [si DM];+2 [si es mujer]; con valores <30 descartando esteatosis y valores ≥36 determinándola); c) pruebas para excluir enfermedad hepática crónica diferentes a la EHGNA (i. marcadores serológicos de hepatitis viral [solo preoperatorio] para hepatitis B y C [HBsAg, HBcAb, HCV Ab], ii. autoanticuerpos, p. ej., ANA, ASMA, AMA); y d) estudios de imagen: ultrasonido abdominal (US), y elastografía transitoria (ET), p. ej., FibroScan®, utilizando el FibroScan 502F01406®: a) medición de rigidez hepática [MRH]: se conduce una onda de 50MHz al hígado por medio de un transductor pequeño colocado en el extremo de una sonda de US, y este puede medir la velocidad de la onda S (en metros por segundo) mientras pasa por el hígado. La velocidad de la onda S se convierte a rigidez hepática, la cual es expresada en kilopascales (kPa), y b) PAC: mide la atenuación ultrasónica en el hígado a 3.5MHz, utilizando señales adquiridas por el FibroScan®, con base en la elastografía transitoria controlada por vibraciones (VCTE™). Se utilizó un transductor XL en casos de pared abdominal engrosada, p. ej., distancia de piel a hígado (DPH)≥45mm, en el resto de los casos se utilizó una sonda X23,24. El PAC fue medido solo en mediciones validadas, de acuerdo con el mismo criterio utilizado para la MRH y con las mismas señales, asegurando que la atenuación ultrasónica del hígado se obtuviera simultáneamente, en el mismo volumen de parénquima hepático que la MRH. El valor final del PAC, el cual tuvo un rango de 100 a 400 decibelios por metro (dB/m), fue la mediana de las mediciones individuales; y 4) se obtuvieron los consentimientos informados por escrito para la GLM, explicando las posibles complicaciones, y no se recabaron datos personales que pudieran identificar a los pacientes incluidos en el estudio.
Análisis estadísticoLos datos fueron codificados y registrados utilizando el programa SPSS® versión 25. Las pruebas estadísticas fueron llevadas a cabo para analizar la utilidad de la ET y los otros parámetros de estudio, al igual que el impacto de la GLM. Los datos fueron resumidos utilizando media, desviación estándar, mediana, valor mínimo y máximo para los datos cuantitativos y frecuencia (conteo) y frecuencia relativa (porcentaje) para los datos categóricos. Se utilizó la prueba no paramétrica de los rangos con signo de Wilcoxon para comparar las mediciones seriales en cada paciente. La prueba de Chi-cuadrado fue utilizada para comparar los datos categóricos, y la prueba exacta de Fisher cuando la frecuencia esperada era menor a 5. La significación estadística fue determinada por un valor de p menor de 0.05.
Consideraciones éticasEl presente estudio fue realizado en humanos y los sujetos evaluados fueron pacientes obesos que presentaban la EHGNA. El estudio fue aprobado por los comités de ética de los Departamentos de Medicina Tropical y Cirugía General de la Facultad de Medicina de la Universidad de El Cairo, y seguimos los principios establecidos en la Declaración de Helsinki. Los consentimientos informados por escrito fueron firmados por los pacientes previo a la GLM.
ResultadosEl presente estudio incluyó a 26 pacientes con EHGNA con obesidad mórbida que se sometieron a GLM en el Departamento de Cirugía General del Hospital Universitario Kasr AlAiny, de la Facultad de Medicina de la Universidad de El Cairo, entre mayo del 2016 y agosto del 2018.
La edad media de los pacientes fue de 33.58 años (rango: 16-63, mediana: 34.5) y hubo una predominancia de mujeres (21 pacientes; 80.8%). La DM fue la única comorbilidad y estuvo presente en 6 pacientes (23.1%).
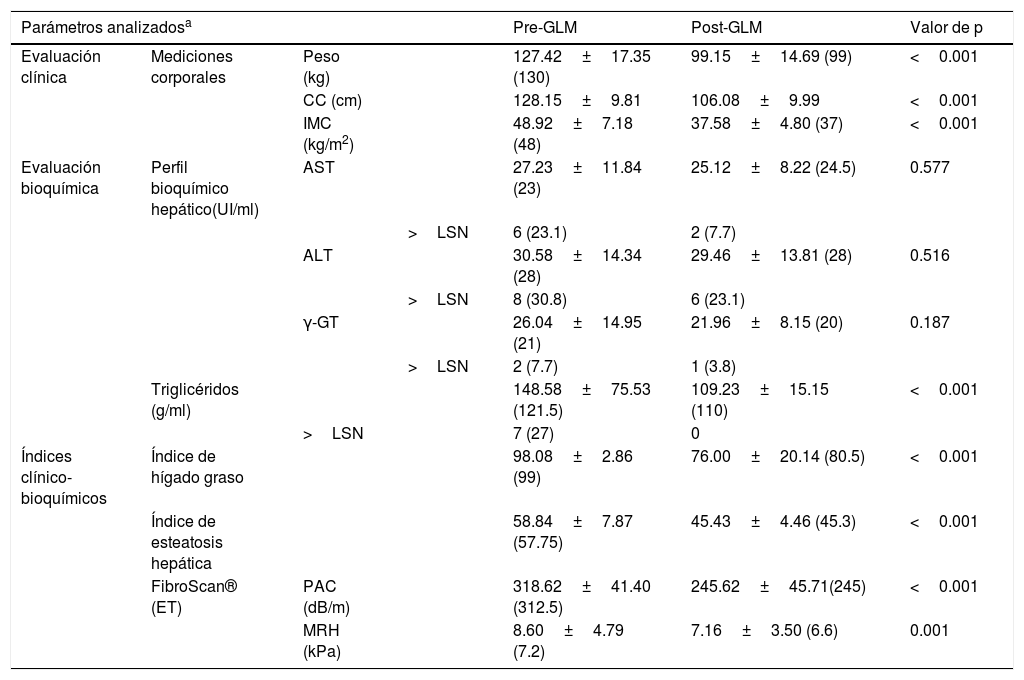
En la tabla 1 se muestran los resultados de la evaluación clínica, de laboratorio y de imagen de los pacientes, antes y 3 meses posterior a la GLM.
Las evaluaciones clínicas, de laboratorio e imagen principales de los pacientes del estudio, previo y 3 meses posterior a la GLM
| Parámetros analizadosa | Pre-GLM | Post-GLM | Valor de p | |||
|---|---|---|---|---|---|---|
| Evaluación clínica | Mediciones corporales | Peso (kg) | 127.42±17.35 (130) | 99.15±14.69 (99) | <0.001 | |
| CC (cm) | 128.15±9.81 | 106.08±9.99 | <0.001 | |||
| IMC (kg/m2) | 48.92±7.18 (48) | 37.58±4.80 (37) | <0.001 | |||
| Evaluación bioquímica | Perfil bioquímico hepático(UI/ml) | AST | 27.23±11.84 (23) | 25.12±8.22 (24.5) | 0.577 | |
| >LSN | 6 (23.1) | 2 (7.7) | ||||
| ALT | 30.58±14.34 (28) | 29.46±13.81 (28) | 0.516 | |||
| >LSN | 8 (30.8) | 6 (23.1) | ||||
| γ-GT | 26.04±14.95 (21) | 21.96±8.15 (20) | 0.187 | |||
| >LSN | 2 (7.7) | 1 (3.8) | ||||
| Triglicéridos (g/ml) | 148.58±75.53 (121.5) | 109.23±15.15 (110) | <0.001 | |||
| >LSN | 7 (27) | 0 | ||||
| Índices clínico-bioquímicos | Índice de hígado graso | 98.08±2.86 (99) | 76.00±20.14 (80.5) | <0.001 | ||
| Índice de esteatosis hepática | 58.84±7.87 (57.75) | 45.43±4.46 (45.3) | <0.001 | |||
| FibroScan® (ET) | PAC (dB/m) | 318.62±41.40 (312.5) | 245.62±45.71(245) | <0.001 | ||
| MRH (kPa) | 8.60±4.79 (7.2) | 7.16±3.50 (6.6) | 0.001 | |||
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CC: circunferencia de cintura; dB/m: decibel por metro; ET: elastografía de transición; GLM: gastrectomía laparoscópica en manga; γ-GT: gamma glutamil transferasa; IMC: índice de masa corporal; kPa: kilopascal; MRH: medición de rigidez hepática; PAC: parámetro de atenuación controlada; LSM: límite superior normal.
En la figura 1 se muestra la distribución por clases de obesidad, antes y después de la GLM. La reducción de peso excesivo medio (RPE) fue del 22.2 y 23.2%, medidas con peso corporal e IMC, respectivamente.
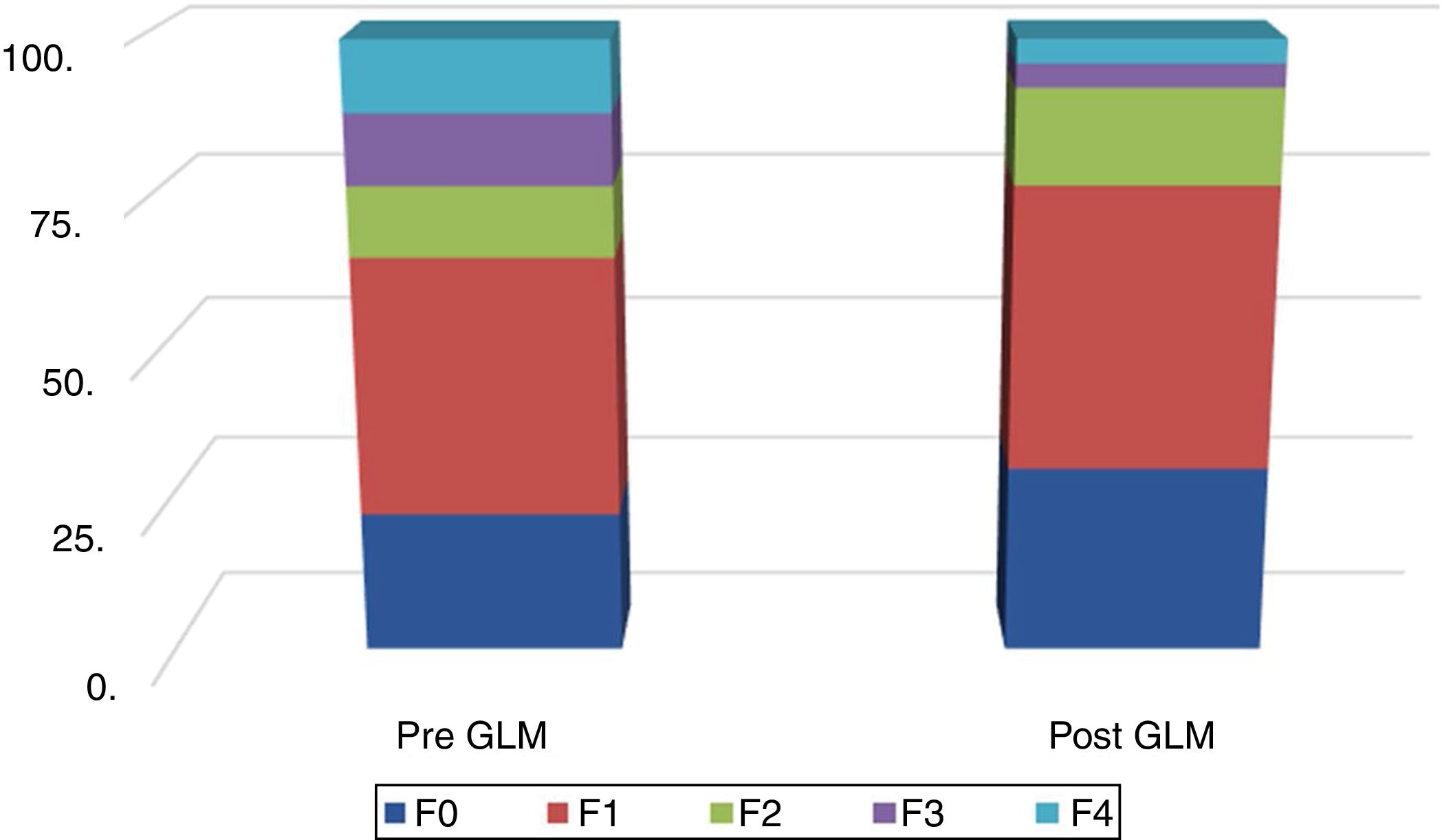
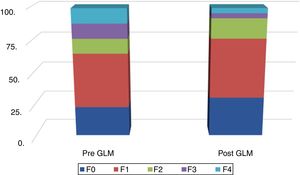
En la figura 2 se muestra la distribución de los resultados de las MRH, antes y después de la GLM.
Se encontró una mejoría amplia y significativa en todos los parámetros analizados, excepto por las enzimas hepáticas. Además, ninguno de los pacientes presentó complicaciones intraoperatorias o posoperatorias.
Discusión y conclusionesLa EHGNA está alcanzando una prevalencia pandémica debido a la obesidad y resistencia a la insulina, y se está convirtiendo en una indicación común para trasplante de hígado2. Constituye más del 75% de las enfermedades hepáticas crónicas25, y se diagnostica por medio de transaminasas o US. Incrementa significativamente el riesgo de DM tipo 2 y de síndrome metabólico en una mediana de 5 años de seguimiento26.
Por otro lado, la obesidad ha sido declarada una epidemia global por la Organización Mundial de la Salud desde 199727. La obesidad está asociada con varias comorbilidades y con mortalidad, pero la relación varía entre diferentes grupos étnicos4.
En el presente estudio, el 23.1% de los pacientes obesos con EHGNA también presentaron DM. Tanto la DM como la obesidad son factores de riesgo independientes para EHGNA12,28.
La GLM, que fue realizada por primera vez en 1988 por Hess y Hess29, está ganando popularidad como un procedimiento bariátrico primario, particularmente por su seguridad y efectividad30. Inicialmente se consideró el procedimiento de primera etapa en la derivación biliopancreática o bypass gástrico en Y de Roux para pacientes de alto riesgo31, y después demostró ser una CB eficiente para la obesidad mórbida32.
Los pacientes obesos con EHGNA fueron evaluados en el presente estudio, utilizando parámetros clínicos, bioquímicos y de imagen, comparando antes de la GLM y 3 meses posterior al procedimiento.
En el presente análisis, la obesidad fue central (media de CC: 128.15±9.81cm, mediana: 128cm, rango: 110-145cm), de acuerdo con todas las definiciones utilizadas; para estadounidenses (>102cm en varones y >88cm en mujeres)33, europeos (≥94cm en varones y ≥80cm mujeres no embarazadas), varones del sur asiático y chinos (>90cm), y varones japoneses (>85cm)34. El rol de la obesidad central/abdominal en el desarrollo de síndrome metabólico y resistencia a la insulina ha sido descrito desde 199135. La CC es un índice simple y accesible, con poder discriminatorio en el diagnóstico de la EHGNA11, y es uno de los factores de riesgo independientes para la EHGNA28.
La EHNA es una enfermedad compleja, se asocia con la obesidad, con la DM y con la hiperlipidemia, pero su presencia está creciendo en sujetos de peso promedio36. Típicamente, los pacientes de EHNA son de mediana edad, obesos, mujeres, y a menudo presentan hiperglucemia (±M establecida) y/o hiperlipidemia, con otras comorbilidades, por las cuales están en tratamiento a largo plazo37. Los pacientes en el presente estudio fueron obesos y predominantemente mujeres (80.8%). La combinación de DM e hipertrigliceridemia se encontró en solo 2 pacientes. Sin embargo, la EHNA estuvo presente en solo el 23.1% de los pacientes, en términos de transaminasas evaluadas, en particular ALT, como marcador de actividad de hepatitis12,38–41. Los niveles de ALT y γ-GT en suero correlacionaron con EHGNA42. El porcentaje de EHNA en nuestro estudio fue similar a la que encontraron Browning et al., 2004, porque los niveles de aminotransferasa tienden a disminuir en el tiempo, incluso con fibrosis en progreso43. De manera importante, el examen histológico hepático por medio de biopsia hepática no fue una de las metodologías en nuestro estudio, lo que limita el número de casos de la EHNA confirmados.
En el presente estudio, el 27% de los pacientes tenían hipertrigliceridemia, uno con un nivel marcadamente alto (451mg/dl). La dislipidemia, tal como la reportan Binobaid et al., 2018, es uno de los factores de riesgo independientes para la EHGNA28.
La media para el IHG en nuestro estudio fue de 98.08±2.86 (mediana: 99). Huang et al., 2015, definieron que el valor de corte óptimo para el IHG para diagnosticar la EHGNA en adultos de edad mediana y adultos mayores chinos es 3044. Sviklāne et al., 2018, confirmaron su fuerte correlación con las transaminasas, con un 90% de sensibilidad y un 74% de especificidad, y un valor ≥60 fue asociado con síndrome metabólico y nefropatía45. De manera similar, Zelber-Sagi et al., 2013, reportaron una fuerte correlación con la SteaoTest™46.
La media para el IEH en nuestros pacientes fue de 58.84±7.87 (mediana: 57.75). El IEH es una herramienta clínica y bioquímica confiable para diagnosticar la EHGNA12. Sviklāne et al., 2018, encontraron una correlación adecuada entre el IEH y CC, con un 86% de sensibilidad y un 66% de especificidad45, mientras que nosotros registramos un valor >36, alcanzando una especificidad del 92.4%12.
En el presente estudio se registraron valores altos de PAC e IRH de 318.62±41.40 (mediana: 312.5) y 8.60±4.79 (mediana: 7.2). La ET fue económicamente más viable en grados avanzados de fibrosis hepática47. Los valores que registramos reflejaron el grado severo de esteatosis, similar a los resultados previos. El PAC, el cual es la modalidad que refleja la utilidad de la ET para la EHGNA, correlacionó significativamente con el porcentaje y grado de esteatosis en EHGNA. La mediana del PAC con esteatosis significativa fue 317 (IQR: 284-339) para el valor de corte confirmado de 283dB/m. El PAC tuvo una sensibilidad del 76%, una especificidad del 79% y unos valores predictivos positivos y negativos del 87 y 64%, respectivamente. Sin embargo, fue más alto en pacientes con fibrosis leve (F0-F1)17, y estuvo asociado con el grado de esteatosis, el IMC y los triglicéridos. Las medianas de PAC para grados de esteatosis S0, S1, S2 y S3 fueron 184, 305, 320 y 324dB/m, respectivamente. Los valores de corte óptimos para estimar los grados de esteatosis S1, S2 y S3 fueron 263, 281 y 283dB/m, respectivamente16.
La GLM es una CB eficiente para una notable pérdida de exceso de peso, tiene una tasa de complicaciones baja y una estancia hospitalaria corta48. La EHGNA que incluye la EHNA podría ser indicación para CB. La pérdida de peso mediante cambios en los hábitos alimenticios y un estilo de vida físicamente activo se considera el método ideal para reducir la esteatosis hepática, la esteatohepatitis y la fibrosis, pero desafortunadamente, no todos los pacientes responden satisfactoriamente a estos cambios. En consecuencia, la CB podría ser considerada la mejor opción, ya que sus beneficios disminuyen los riesgos y ofrecen el mejor curso de acción49. En nuestro estudio, todos los parámetros preoperatorios (clínicos, bioquímicos, índices clínico-biológicos e imagenología), excepto por las transaminasas, mejoraron significativamente 3 meses después de la cirugía, lo cual coincide con estudios previos que reportaron una resolución de la EHGNA en un rango >5050 al 90%51.
Nosotros reportamos una pérdida de peso altamente significativa (p<0.001) 3 meses posterior a la GLM, en términos de CC e IMC, con una pérdida media del 22.2, 17.3 y 23.25%, respectivamente. Estos resultados coinciden con los de muchos estudios. Manco et al., 2016, reportaron el 21.5% de reducción de peso excesivo (%RPE) un año después a la GLM49, mientras que Diamantis et al. reportaron una RPE general de 59.3%≥5 años posoperatorio52. El Hospital Royal Alexandria reportó un %RPE para la GLM que varió entre el 33 y el 90% sostenido, posoperatoriamente por hasta 3 años. Sus ventajas fueron una baja tasa de mortalidad, pocas complicaciones mayores, una duración de cirugía relativamente corta, una estancia hospitalaria reducida y bajo costo7.
Los niveles de transaminasa en nuestros pacientes fueron comparables antes de la GLM y posterior al procedimiento, al contrario de lo reportado por Karcz et al.53, quienes observaron una reducción significativa. Nuestros resultados podrían ser atribuidos a la baja prevalencia de elevación de transaminasas, p. ej., el 23.1%, y el hecho de que pueda ocurrir agravación paradójica de la esteatosis con o sin esteatohepatitis en algunos casos post CB54–56, lo cual se refleja en la reducción altamente significativa de IHG e IEH (22.5 y 22.8% respectivamente), lo cual coincide con lo reportado por Matter et al., 200554.
También encontramos una reducción y normalización altamente significativas (p<0.001) de los triglicéridos en suero (la reducción media fue del 26.5%), similar a lo encontrado por Karcz et al., 2011, quienes registraron una reducción media de triglicéridos del 37.5% un año posterior a la GLM53.
Evaluamos la EHGNA post GLM, incluyendo el examen ET, el cual mostró una regresión altamente significativa, de acuerdo a lo evaluado por medio de PAC y MRH reportado 3 meses posterior al procedimiento. La CB es favorecida por mejorar los cambios metabólicos e histológicos asociados con la EHGNA57. La EHNA se invirtió por completo en todos los pacientes y la F0 desapareció en el 90% de los pacientes49.
Además, ninguno de los pacientes experimentó ninguna de las complicaciones de sangrado, derrame gástrico o estenosis, esofagitis por reflujo o deficiencias nutricionales58. Sin embargo, Sasaki et al., 2014, recomendaron más estudios de largo plazo para confirmar los verdaderos efectos de la CB como un tratamiento potencial para la EHNA59.
Concluimos que la GLM es una CB eficiente para los pacientes con obesidad mórbida y EHGNA.
Limitaciones del estudioEl número de pacientes incluidos en el presente estudio conforma una muestra pequeña para un estudio piloto sobre este tema. El estudio también cubrió un periodo de tiempo corto y existió un bajo número de candidatos a cirugía.
AutoríasMohamed Abdelbary: autor principal, diseñó el estudio, revisó el manuscrito y aprobó la versión final del mismo.
Raghda Marzaban: realizó la investigación de la literatura además del borrador del manuscrito.
Hadeel Eldeen, Marwa Khairy y Ayman Yosry: realizaron el estudio FibroScan® con los pacientes, antes y después de la cirugía. Mohamed Menesy: interpretó y analizó los datos.
Mohamed Fahmy y Amr Ayad: fueron los cirujanos que realizaron la GLM en los pacientes.
Bassem Mouheb: fue el joven cirujano que evaluó a los pacientes que fueran candidatos para la GLM, realizó la recopilación de los datos y asistió en la cirugía.
FinanciaciónNo se recibió apoyo financiero alguno con relación a este artículo.
Conflicto de interesesLos autores declaran que no existió conflicto de intereses.
Este artículo original fue un estudio contributorio entre los Departamentos de Medicina Tropical y de Cirugía General de la Facultad de Medicina de la Universidad de El Cairo, Egipto.