La resistencia a la insulina y la diabetes mellitus están frecuentemente asociadas con la infección por virus de hepatitis C crónica (VHC), y se piensa que la presencia de la resistencia a la insulina agrava la enfermedad hepática. Nuestro objetivo fue evaluar la resistencia a la insulina en pacientes egipcios no diabéticos con infección crónica por el VHC.
Materiales y métodosReclutamos a 60 pacientes no diabéticos con infección por el VHC crónica y a 30 voluntarios no diabéticos sin infección por el VHC. El estudio se dividió en 3 grupos: el grupo 1 incluyó a 30 pacientes con infección por el VHC crónica sin cirrosis, el grupo 2 incluyó a 30 pacientes con infección por el VHC crónica y cirrosis hepática, mientras que el grupo 3 estuvo conformado por los voluntarios sanos como grupo control. Se realizó una detallada historia clínica y examen físico de toda la población del estudio, incluidos peso y altura, pruebas de laboratorio de rutina y determinación de marcadores virales que incluyeron el antígeno de superficie de hepatitis B y anticuerpos de VHC. Se llevó a cabo un análisis PCR en los pacientes con VHC positivo. Se midieron los niveles de glucosa en sangre en ayunas y los niveles de insulina en ayunas de todos los pacientes y se calculó la resistencia a la insulina de acuerdo a la evaluación del modelo homeostático de resistencia a la insulina.
ResultadosLos pacientes con cirrosis hepática (2 pacientes de clase Child A, 12 pacientes de clase Child B y 16 pacientes de clase Child C) presentaron niveles más altos de resistencia a la insulina (2.76±0.97) que los pacientes con infección por el VHC crónica sin cirrosis (2.03±0.743) y que el grupo control (1.22±0.38). El valor de p fue significativamente diferente entre los 3 grupos. Existieron correlaciones directas y significativas entre la resistencia a la insulina, la glucosa en sangre en ayunas y los niveles de insulina en ayunas. Los pacientes con infección por el VHC crónica presentaron niveles de glucosa e insulina en ayunas significativamente más altos que el grupo control.
Conclusiónlos pacientes con infección por el VHC crónica presentaron niveles de resistencia a la insulina significativamente más altos que la población normal, incluso en la ausencia de disfunción hepática y cirrosis.
Insulin resistance and diabetes mellitus are frequently associated with chronic hepatitis C virus (HCV) infection, and it is thought that the presence of insulin resistance aggravates liver disease. We aimed to evaluate insulin resistance in nondiabetic Egyptian patients with chronic HCV infection.
Materials and methodsSixty nondiabetic patients with chronic HCV infection and 30 healthy nondiabetic non-HCV-infected volunteers were enrolled in our study. They were divided into 3 groups: group 1 included 30 patients with chronic HCV infection with no cirrhosis, group 2 included 30 patients with chronic HCV infection and cirrhosis of the liver, and group 3 included 30 healthy volunteers as controls. The entire study population underwent a detailed clinical history and physical examination, weight and height measurement, routine laboratory tests, and viral marker determination that included hepatitis B surface antigen and HCV antibodies. PCR analysis was carried out on the patients with positive HCV antibodies. Fasting blood sugar and fasting insulin levels were measured in all the patients, and insulin resistance was calculated according to the homeostasis model assessment of insulin resistance (HOMA-IR).
ResultsPatients with cirrhosis of the liver (2 patients with Child class A, 12 patients with Child class B, and 16 patients with Child class C) showed higher insulin resistance levels (2.76±0.97) than the patients with chronic HCV infection and no cirrhosis (2.03±0.743) and the control group (1.22±0.38). The p value was significantly different between the 3 groups. There were direct and significant correlations between insulin resistance, fasting blood sugar, and fasting insulin levels. Patients with chronic HCV infection showed significantly higher fasting insulin and glucose levels than the control group.
ConclusionChronic HCV-infected patients showed significantly higher insulin resistance levels than the normal population, even in the absence of hepatic dysfunction and cirrhosis.
El virus de hepatitis C (VHC) es una causa importante de enfermedad hepática y morbimortalidad asociadas. Más de 170 millones de personas están infectadas a nivel mundial1. La mayoría de los pacientes pasan de la etapa aguda a la etapa crónica silenciosamente, lo cual incrementa el riesgo de transmisión viral a otras personas2. El VHC no solo afecta al hígado, sino que también está asociado con muchas manifestaciones extrahepáticas, incluida la resistencia a la insulina (RI)3.
La RI es una condición patológica que aparece cuando es necesaria una mayor concentración de insulina para la respuesta glucémica fisiológica normal y una adecuada utilización de tejido4. Usualmente está asociada con la obesidad y el síndrome metabólico y es un factor de riesgo para el desarrollo de diabetes mellitus tipo 2, enfermedades renales, enfermedades cardiovasculares e infección5. Además, la RI está frecuentemente asociada con la infección por el VHC6,7. El desarrollo de RI en pacientes sin enfermedad hepática está asociado con un estilo de vida sedentario y una dieta alta en calorías, mientras que en pacientes con infección por el VHC, usualmente está asociada con inflamación hepática, incremento en citosinas inflamatorias y afectación de hemostasia de insulina y lípidos. En consecuencia, la RI es más alta en pacientes infectados por el VHC que en la población en general y que en pacientes con enfermedades hepáticas no relacionadas con el VHC8,9. El desarrollo de RI en pacientes infectados por el VHC está asociado con una mayor morbilidad relacionada con el VHC, como esteatosis, fibrosis, carcinoma hepatocelular y resistencia a la terapia antiviral10. La RI ocurre de manera muy temprana en ratones transgénicos infectados por el VHC, e incluso precede la ocurrencia de esteatosis11. Se han observado resultados similares en humanos, lo cual significa que la RI no es una consecuencia de la esteatosis hepática12. La RI en pacientes infectados por el VHC es un blanco terapéutico para disminuir la morbilidad asociada al VHC e incrementar la respuesta antiviral13.
El objetivo del presente estudio fue evaluar la prevalencia de RI en pacientes con infección por el VHC crónica.
Materiales y métodosSe realizó un estudio de casos y controles transversal en el Departamento de Medicina Tropical y Gastroenterología del Hospital de la Universidad de Al-Azhar-Assiut. Se incluyó a 90 sujetos no diabéticos que fueron clasificados en 3 grupos: el grupo 1 estuvo compuesto por 30 pacientes adultos con infección por el VHC crónica sin cirrosis hepática, el grupo 2 se formó de 30 pacientes con cirrosis hepática posterior a infección por el VHC crónica (2 pacientes en etapa Child A, 12 pacientes Child B y 16 pacientes Child C) y el grupo 3 estuvo formado de 30 sujetos sanos como controles.
Criterios de inclusión para los grupos de pacientesEl estudio incluyó a pacientes adultos que presentaban infección por el VHC crónica confirmada por anticuerpos anti VHC positiva y PCR, durante 6 meses o más.
Criterios de exclusión para los grupos de pacientesSe excluyó a niños, diabéticos, sujetos que estuvieran tomando medicamentos anti VHC, pacientes con VHC y coinfección de hepatitis B, pacientes infectados por el virus de la inmunodeficiencia humana, sujetos tomando agentes reductores de lípidos, pacientes con carcinoma hepatocelular, sujetos con presión arterial alta o un IMC>25kg/m2, personas con hiperlipidemia, pacientes con hígado graso no alcohólico, pacientes con enfermedades hepáticas crónicas diferentes a la infección por el VHC, mujeres embarazadas, mujeres en lactancia y sujetos con historia de cirugía bariátrica.
Todos los pacientes y controles se sometieron a una historia clínica detallada y a un examen físico, con énfasis en las manifestaciones de enfermedad hepática crónica. De igual manera se midió el peso y altura de los participantes.
Pruebas de laboratorioSe realizaron las siguientes pruebas de laboratorio: conteo sanguíneo completo (CSC), aspartato aminotransferasa, alanina aminotransferasa, bilirrubina, albúmina, tiempo de protrombina, concentración de protrombina, urea, creatinina, alfafetoproteína, insulina en ayunas, glucosa en ayunas y glucosa posprandial de 2horas.
Ultrasonido abdominalSe realizó un ultrasonido abdominal en todos los pacientes y controles para confirmar la cirrosis en el grupo 2 y para excluir el hígado graso no alcohólico tanto en el grupo 1 como en el grupo control. La imagen se enfocó en el brillo del hígado (hígado graso) y en señas de enfermedad hepática crónica, como ecotextura y homogeneidad del hígado, vena porta o colaterales portosistémicas dilatadas, esplenomegalia y ascitis.
Cálculo de la resistencia a la insulinaLa RI fue calculada utilizando la ecuación de la evaluación del modelo homeostático de resistencia a la insulina (HOMA-IR por sus siglas en inglés): RI=insulina en ayunas (uU/ml)×glucosa en ayunas (mmol/l)/22.5. Se diagnosticó RI si la HOMA-IR era igual o mayor a 2.714–17.
Consideraciones éticasEl estudio fue aprobado por el comité de ética de la Facultad de Medicina de Al-Azhar-Assiut. Se obtuvo el consentimiento informado de cada uno de los participantes del estudio. Los autores declaran que el presente artículo no contiene información personal que podría permitir la identificación de los pacientes.
Apoyo financieroNo se recibió ningún tipo de apoyo financiero en relación con el presente estudio.
Análisis estadísticoEl análisis estadístico se llevó a cabo utilizando el programa SSPS versión 25 (IBM SPSS Inc., Chicago, EE. UU.) en el sistema operativo Windows 10. Los datos categóricos fueron expresados como número y porcentaje y los datos numéricos como media y desviación estándar. Utilizamos ANOVA y pruebas post hoc para comparar los datos numéricos entre grupos y la prueba U de Mann-Whitney y la prueba de Kruskal-Wallis para comparar los datos categóricos. Se realizó un análisis regresivo para predecir los factores que afectaban la RI en pacientes infectados con VHC crónica. La significación estadística se determinó a un valor p de menos o igual a 0.05.
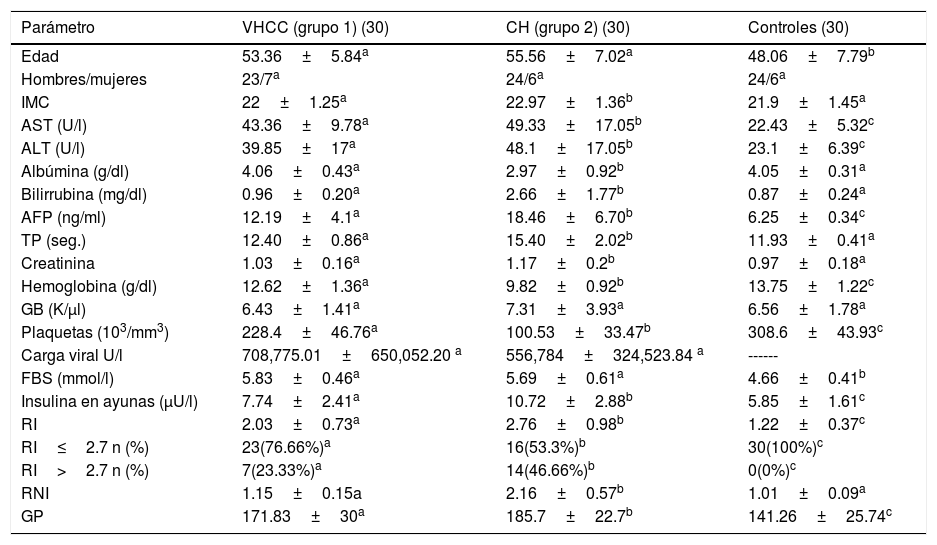
ResultadosCaracterísticas de los pacientesNuestro estudio incluyó a 60 pacientes infectados por el VHC crónica y a 30 voluntarios. Los datos demográficos y de las pruebas de laboratorio de los pacientes se muestran en la tabla 1. Los niveles de insulina y de glucosa en ayunas fueron significativamente más altos en el grupo 2 (grupo con cirrosis hepática: 2 pacientes de clase Child A, 12 pacientes Child B y 16 pacientes Child C) que en el grupo 1 (pacientes infectados por el VHC sin cirrosis) y que en el grupo 3 (controles). Utilizando un punto de corte de 2.7 para la RI, el grupo 2 mostró una prevalencia de RI de hasta el 46.66% contra 23.33% del grupo 1, mientras que en el grupo control fue del 0%.
Características demográficas y de pruebas de laboratorio de la población de estudio
| Parámetro | VHCC (grupo 1) (30) | CH (grupo 2) (30) | Controles (30) |
|---|---|---|---|
| Edad | 53.36±5.84a | 55.56±7.02a | 48.06±7.79b |
| Hombres/mujeres | 23/7a | 24/6a | 24/6a |
| IMC | 22±1.25a | 22.97±1.36b | 21.9±1.45a |
| AST (U/l) | 43.36±9.78a | 49.33±17.05b | 22.43±5.32c |
| ALT (U/l) | 39.85±17a | 48.1±17.05b | 23.1±6.39c |
| Albúmina (g/dl) | 4.06±0.43a | 2.97±0.92b | 4.05±0.31a |
| Bilirrubina (mg/dl) | 0.96±0.20a | 2.66±1.77b | 0.87±0.24a |
| AFP (ng/ml) | 12.19±4.1a | 18.46±6.70b | 6.25±0.34c |
| TP (seg.) | 12.40±0.86a | 15.40±2.02b | 11.93±0.41a |
| Creatinina | 1.03±0.16a | 1.17±0.2b | 0.97±0.18a |
| Hemoglobina (g/dl) | 12.62±1.36a | 9.82±0.92b | 13.75±1.22c |
| GB (K/μl) | 6.43±1.41a | 7.31±3.93a | 6.56±1.78a |
| Plaquetas (103/mm3) | 228.4±46.76a | 100.53±33.47b | 308.6±43.93c |
| Carga viral U/l | 708,775.01±650,052.20 a | 556,784±324,523.84 a | ------ |
| FBS (mmol/l) | 5.83±0.46a | 5.69±0.61a | 4.66±0.41b |
| Insulina en ayunas (μU/l) | 7.74±2.41a | 10.72±2.88b | 5.85±1.61c |
| RI | 2.03±0.73a | 2.76±0.98b | 1.22±0.37c |
| RI≤2.7 n (%) | 23(76.66%)a | 16(53.3%)b | 30(100%)c |
| RI>2.7 n (%) | 7(23.33%)a | 14(46.66%)b | 0(0%)c |
| RNI | 1.15±0.15a | 2.16±0.57b | 1.01±0.09a |
| GP | 171.83±30a | 185.7±22.7b | 141.26±25.74c |
AFP: alfafetoproteína; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CH: cirrosis hepática (grupo 2); FBS: glucosa en ayunas (por sus siglas en inglés); GB: glóbulos blancos; GP: glucosa posprandial; IMC: índice de masa corporal; RI: resistencia a la insulina; RNI: razón normalizada internacional; TP: tiempo de protrombina; VHCC: virus de hepatitis C crónica (grupo 1).
a,b,cExistieron diferencias estadísticamente significativas entre los grupos con diferentes letras, pero no entre los grupos con la misma letra.
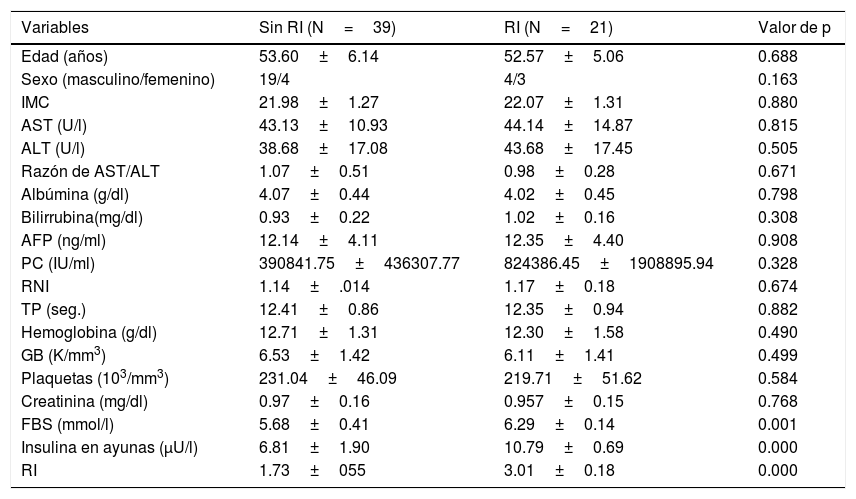
Los pacientes infectados por el VHC crónica que presentaron RI tendieron a tener insulina y glucosa en ayunas altas (10.79±0.69 vs. 6.81±1.90) y (6.29±0.14 vs. 5.68±0.41) respectivamente. Aparte de esto, no existieron diferencias significativas en los datos demográficos y de las pruebas de laboratorio entre los pacientes con y sin RI (tabla 2).
Comparación entre pacientes con infección por el virus de la hepatitis C con y sin resistencia a la insulina en el grupo 2
| Variables | Sin RI (N=39) | RI (N=21) | Valor de p |
|---|---|---|---|
| Edad (años) | 53.60±6.14 | 52.57±5.06 | 0.688 |
| Sexo (masculino/femenino) | 19/4 | 4/3 | 0.163 |
| IMC | 21.98±1.27 | 22.07±1.31 | 0.880 |
| AST (U/l) | 43.13±10.93 | 44.14±14.87 | 0.815 |
| ALT (U/l) | 38.68±17.08 | 43.68±17.45 | 0.505 |
| Razón de AST/ALT | 1.07±0.51 | 0.98±0.28 | 0.671 |
| Albúmina (g/dl) | 4.07±0.44 | 4.02±0.45 | 0.798 |
| Bilirrubina(mg/dl) | 0.93±0.22 | 1.02±0.16 | 0.308 |
| AFP (ng/ml) | 12.14±4.11 | 12.35±4.40 | 0.908 |
| PC (IU/ml) | 390841.75±436307.77 | 824386.45±1908895.94 | 0.328 |
| RNI | 1.14±.014 | 1.17±0.18 | 0.674 |
| TP (seg.) | 12.41±0.86 | 12.35±0.94 | 0.882 |
| Hemoglobina (g/dl) | 12.71±1.31 | 12.30±1.58 | 0.490 |
| GB (K/mm3) | 6.53±1.42 | 6.11±1.41 | 0.499 |
| Plaquetas (103/mm3) | 231.04±46.09 | 219.71±51.62 | 0.584 |
| Creatinina (mg/dl) | 0.97±0.16 | 0.957±0.15 | 0.768 |
| FBS (mmol/l) | 5.68±0.41 | 6.29±0.14 | 0.001 |
| Insulina en ayunas (μU/l) | 6.81±1.90 | 10.79±0.69 | 0.000 |
| RI | 1.73±055 | 3.01±0.18 | 0.000 |
AFP: alfafetoproteína; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; FBS: glucosa en ayunas; GB: glóbulos blancos; IMC: índice de masa corporal; PC: polimerización en cadena; RI: resistencia a la insulina; RNI: razón normalizada internacional; TP: tiempo de protrombina.
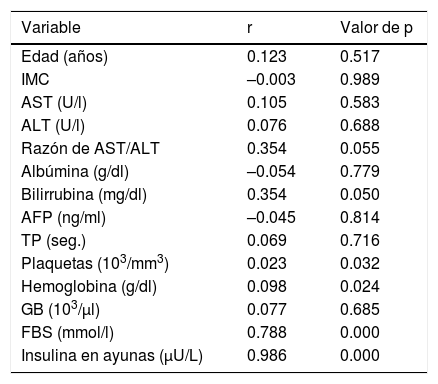
Los niveles de insulina en ayunas, glucosa en ayunas, bilirrubina, plaquetas y hemoglobina tuvieron correlación positiva significativa con la RI. Ningún otro dato demográfico o de laboratorio tuvo correlación significativa con la RI (tabla 3).
Correlaciones de las variables demográficas y de pruebas de laboratorio con resistencia a la insulina
| Variable | r | Valor de p |
|---|---|---|
| Edad (años) | 0.123 | 0.517 |
| IMC | –0.003 | 0.989 |
| AST (U/l) | 0.105 | 0.583 |
| ALT (U/l) | 0.076 | 0.688 |
| Razón de AST/ALT | 0.354 | 0.055 |
| Albúmina (g/dl) | –0.054 | 0.779 |
| Bilirrubina (mg/dl) | 0.354 | 0.050 |
| AFP (ng/ml) | –0.045 | 0.814 |
| TP (seg.) | 0.069 | 0.716 |
| Plaquetas (103/mm3) | 0.023 | 0.032 |
| Hemoglobina (g/dl) | 0.098 | 0.024 |
| GB (103/μl) | 0.077 | 0.685 |
| FBS (mmol/l) | 0.788 | 0.000 |
| Insulina en ayunas (μU/L) | 0.986 | 0.000 |
AFP: alfafetoproteína; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; FBS: glucosa en ayunas; GB: glóbulos blancos; IMC: índice de masa corporal; TP: tiempo de protrombina.
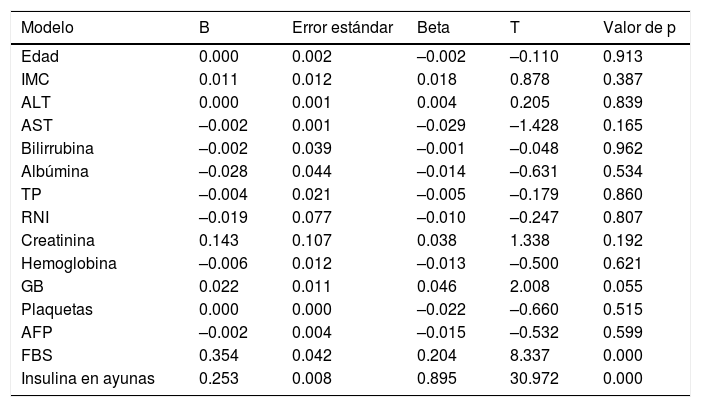
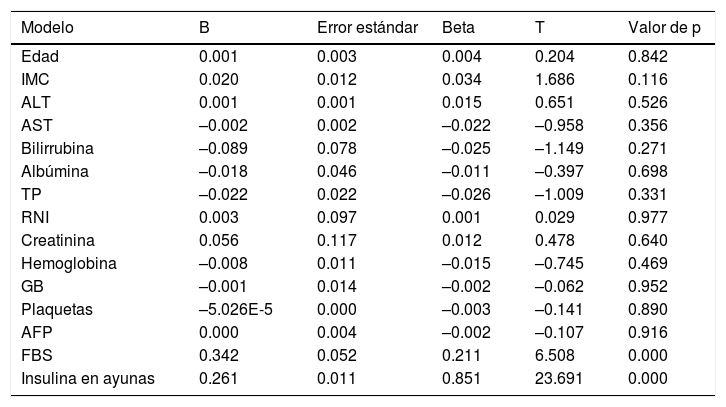
No se encontraron factores que predijeran significativamente la RI, excepto los niveles de insulina y glucosa en ayunas (tablas 4 y 5).
Análisis de regresión lineal múltiple de factores que afectan a la resistencia a la insulina
| Modelo | B | Error estándar | Beta | T | Valor de p |
|---|---|---|---|---|---|
| Edad | 0.000 | 0.002 | –0.002 | –0.110 | 0.913 |
| IMC | 0.011 | 0.012 | 0.018 | 0.878 | 0.387 |
| ALT | 0.000 | 0.001 | 0.004 | 0.205 | 0.839 |
| AST | –0.002 | 0.001 | –0.029 | –1.428 | 0.165 |
| Bilirrubina | –0.002 | 0.039 | –0.001 | –0.048 | 0.962 |
| Albúmina | –0.028 | 0.044 | –0.014 | –0.631 | 0.534 |
| TP | –0.004 | 0.021 | –0.005 | –0.179 | 0.860 |
| RNI | –0.019 | 0.077 | –0.010 | –0.247 | 0.807 |
| Creatinina | 0.143 | 0.107 | 0.038 | 1.338 | 0.192 |
| Hemoglobina | –0.006 | 0.012 | –0.013 | –0.500 | 0.621 |
| GB | 0.022 | 0.011 | 0.046 | 2.008 | 0.055 |
| Plaquetas | 0.000 | 0.000 | –0.022 | –0.660 | 0.515 |
| AFP | –0.002 | 0.004 | –0.015 | –0.532 | 0.599 |
| FBS | 0.354 | 0.042 | 0.204 | 8.337 | 0.000 |
| Insulina en ayunas | 0.253 | 0.008 | 0.895 | 30.972 | 0.000 |
Variable dependiente: resistencia a la insulina.
AFP: alfafetoproteína; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; FBS: glucosa en ayunas; GB: glóbulos blancos; IMC: índice de masa corporal; RNI: razón normalizada internacional; TP: tiempo de protrombina.
Análisis de regresión lineal múltiple de factores que afectan a la resistencia a la insulina en el grupo 2
| Modelo | B | Error estándar | Beta | T | Valor de p |
|---|---|---|---|---|---|
| Edad | 0.001 | 0.003 | 0.004 | 0.204 | 0.842 |
| IMC | 0.020 | 0.012 | 0.034 | 1.686 | 0.116 |
| ALT | 0.001 | 0.001 | 0.015 | 0.651 | 0.526 |
| AST | –0.002 | 0.002 | –0.022 | –0.958 | 0.356 |
| Bilirrubina | –0.089 | 0.078 | –0.025 | –1.149 | 0.271 |
| Albúmina | –0.018 | 0.046 | –0.011 | –0.397 | 0.698 |
| TP | –0.022 | 0.022 | –0.026 | –1.009 | 0.331 |
| RNI | 0.003 | 0.097 | 0.001 | 0.029 | 0.977 |
| Creatinina | 0.056 | 0.117 | 0.012 | 0.478 | 0.640 |
| Hemoglobina | –0.008 | 0.011 | –0.015 | –0.745 | 0.469 |
| GB | –0.001 | 0.014 | –0.002 | –0.062 | 0.952 |
| Plaquetas | –5.026E-5 | 0.000 | –0.003 | –0.141 | 0.890 |
| AFP | 0.000 | 0.004 | –0.002 | –0.107 | 0.916 |
| FBS | 0.342 | 0.052 | 0.211 | 6.508 | 0.000 |
| Insulina en ayunas | 0.261 | 0.011 | 0.851 | 23.691 | 0.000 |
AFP: alfafetoproteína; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; FBS: glucosa en ayunas; GB: glóbulos blancos; IMC: índice de masa corporal; RNI: razón normalizada internacional; TP: tiempo de protrombina.
La RI en pacientes infectados por el VHC es más alta que en la población general y que en pacientes con otras enfermedades hepáticas crónicas8,9. La RI está asociada con la progresión de la enfermedad hepática, el carcinoma hepatocelular18–20 y el cáncer gástrico21,22. El objetivo de nuestro estudio fue evaluar la prevalencia y los determinantes de la RI en pacientes infectados con VHC crónica no diabéticos.
La prevalencia de la RI en la población general es de entre el 10% y 25%23, mientras que se estima que varía del 30-70% en los pacientes infectados por el VHC crónica24,25. Los mecanismos para el desarrollo de RI en pacientes infectados por el VHC crónica son complejos. El VHC afecta marcadamente la fosforilación de la tirosina del receptor de sustrato de insulina y la activación de la fosfoinositol 3-quinasa26. El VHC estimula la producción de TNF-α, lo cual activa la proteólisis de los receptores de sustrato de insulina tipo 1 y 2, con el consecuente desarrollo de RI10. La RI en pacientes infectados por el VHC también puede causar esteatosis hepática27. Además, el VHC puede incrementar los niveles de IL-1, IL-6 y leptina y disminuir los niveles de adinoponectina, lo cual puede conducir a RI24.
En nuestro estudio encontramos RI (HOMA-IR>2.7) en el 23.3% de los pacientes del grupo 1 contra el 46.6% en el grupo 2, con una prevalencia general del 35%. En 2018 Alsebaey et al.28 reclutaron a 150 pacientes egipcios con infección por el VHC que presentaban enfermedad crónica o cirrosis compensada, y encontraron RI en 87.3% (el punto de corte en su estudio fue 2). Si en nuestro estudio hubiéramos tomado 2 como punto de corte la prevalencia general de RI habría sido del 71% en los grupos 2 y 3 en conjunto. En 2018 El-Sagheer et al.29 incluyeron a 80 pacientes con infección por el VHC crónica y 40 controles saludables, encontrando RI en 47 pacientes (58.75%) con un punto de corte de 3. En 2008 Imazeki et al.30 estudiaron la prevalencia de RI en 232 pacientes infectados por el VHC crónica y encontraron RI en el 54.3% (con punto de corte de 2). En 2008 Moucari et al.31 evaluaron a 462 pacientes no diabéticos infectados por el VHC crónica y encontraron RI en el 32.4% de los pacientes.
En nuestro estudio existieron diferencias estadísticamente significativas en los niveles de insulina y glucosa en ayunas entre los pacientes infectados por el VHC crónica con RI y sin RI. No existieron diferencias significativas entre pacientes con y sin RI en ningún otro de los datos demográficos o de prueba de laboratorio. En 2015 Pais et al.14 estudiaron a 111 pacientes con infección por el VHC crónica y encontraron RI (HOMA-IR>2.7) en 41 (36.9%) de los pacientes. Estos autores encontraron que los pacientes con RI tenían IMC significativamente más alto, al igual que niveles de aspartato aminotransferasa y alanina aminotransferasa significativamente más altos que los pacientes sin RI.
En nuestro estudio la RI correlacionó solo con la glucosa y la insulina en ayunas. Utilizando un análisis de regresión lineal múltiple para evaluar los predictores de RI, solo la glucosa y la insulina en ayunas predijeron significativamente la RI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.