Se presenta el caso de un varón de 68 años de edad con antecedente de cardiopatía isquémica, portador de endoprótesis vascular de 3 años de evolución y diagnóstico desde hace 4 años de cáncer renal etapa clínica IV con metástasis a lóbulo pulmonar inferior izquierdo tratado mediante nefrectomía total izquierda con lobectomía pulmonar y quimioterapia a base de sorafenib, habiéndose mantenido en remisión. Sin embargo, trae consigo el reporte de una tomografía computarizada (TC) con emisión de positrones de 4 meses previos a nuestra intervención, con evidencia de 2 nuevas masas hepáticas hipermetabólicas, sugerentes de actividad metastásica, sin evidencia de tumoraciones en otros órganos.
Inicia su padecimiento hace 10 meses, manifestando malestar abdominal, acompañado de evacuaciones con características melénicas alternantes con hematoquecias, al menos una vez por semana; sin embargo, se reporta hemoglobina de 14g/l durante este período sin repercusión hemodinámica. Acude a consulta de cardiología, donde se decide modificar esquema anticoagulante iniciando tratamiento con rivaroxabán 15mg diarios, 2 semanas posteriores a este tratamiento, el paciente refiere epigastralgia, con sensación de plenitud posprandial inmediata, limitando su mecánica ventilatoria, presentando melena y hematoquecia de 2 a 3 veces por semana agregándose astenia y adinamia.
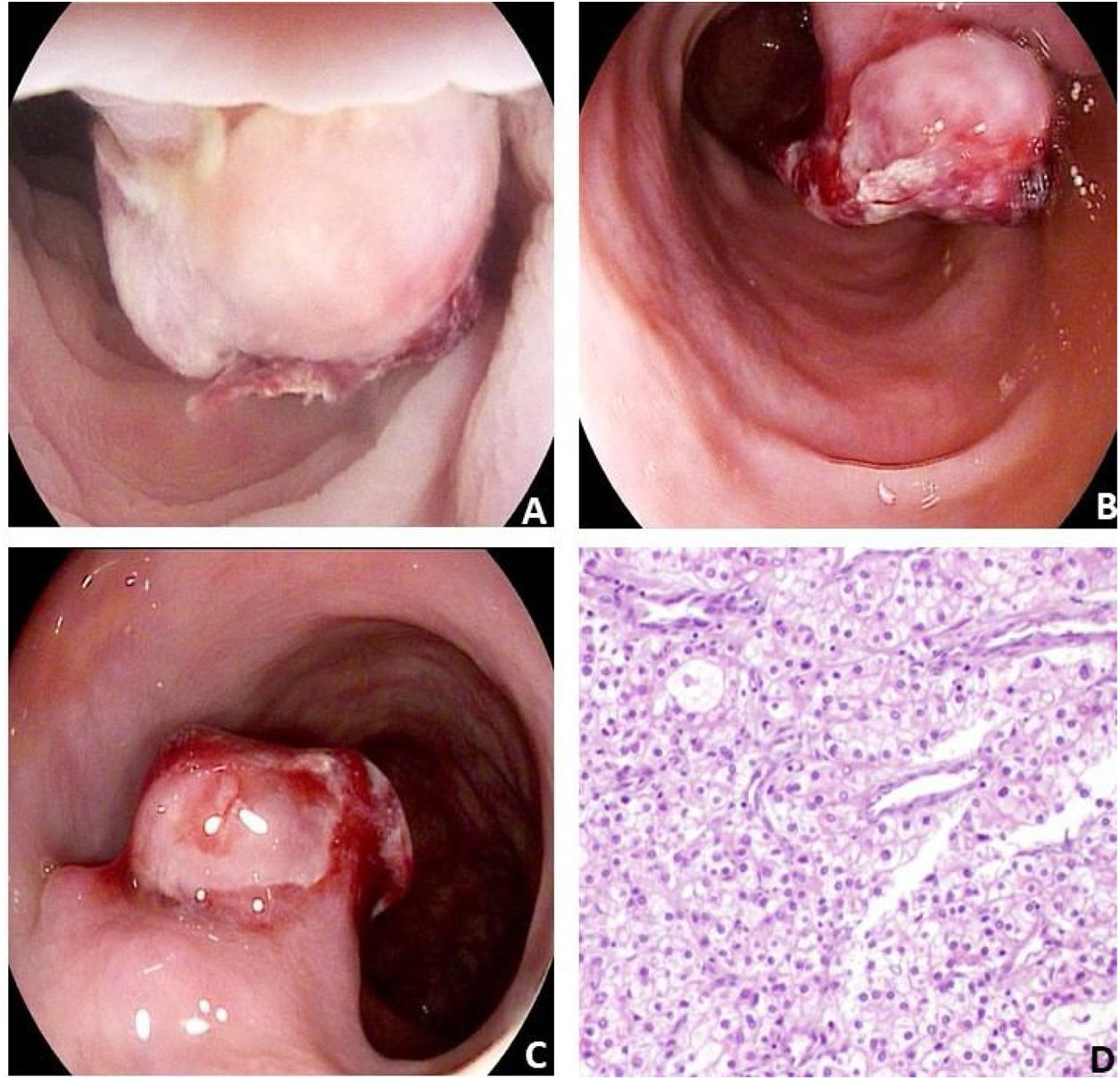
Acude a la consulta de gastroenterología, se solicita hemograma, el cual reporta hemoglobina 9,1g/dl, VGM 80,1fl y HCM 24,5pg. Debido a que presentaba datos de dispepsia y hemorragia digestiva se decide llevar a cabo una esofagogastroduodenoscopia, suspendiendo 48h previas a la intervención rivaroxabán, la cual se reporta sin alteraciones. Por lo anterior, continuando con el abordaje diagnóstico del paciente se procede a realizar colonoscopia donde se observa en el sitio de unión de colon descendente con sigmoides, una lesión que protruye hacia la luz intestinal, de probable origen subepitelial, formando un seudo-pólipo con un coágulo adherido y hemorragia en capa con distorsión del patrón mucoso y vascular, motivo por el cual se toman muestras de tejido empleando técnica de «biopsia sobre biopsia» del vértice de la lesión (fig. 1), decidiendo esta conducta a pesar de los estigmas recientes de hemorragia para obtener un diagnóstico precoz.
Imagen endoscópica, con técnica de inmersión en agua de colon descendente mostrando: A) Un seudo-pólipo de probable origen subepitelial, el cual protruye hacia la luz intestinal, observándose con un coágulo adherido y hemorragia en capa con distorsión del patrón mucoso y vascular. B) Se realizó extracción de tejido con técnica de biopsia sobre biopsia del vértice de la lesión. C) Hemorragia en capa posterior a la toma de biopsia. D) Estudio histopatológico: neoplasia epitelial maligna conformada por células de citoplasma claro y de membranas remarcadas de núcleos irregulares con nucléolos prominentes correspondientes a un grado histológico 3 de la WHO/ISUP (H&E X10).
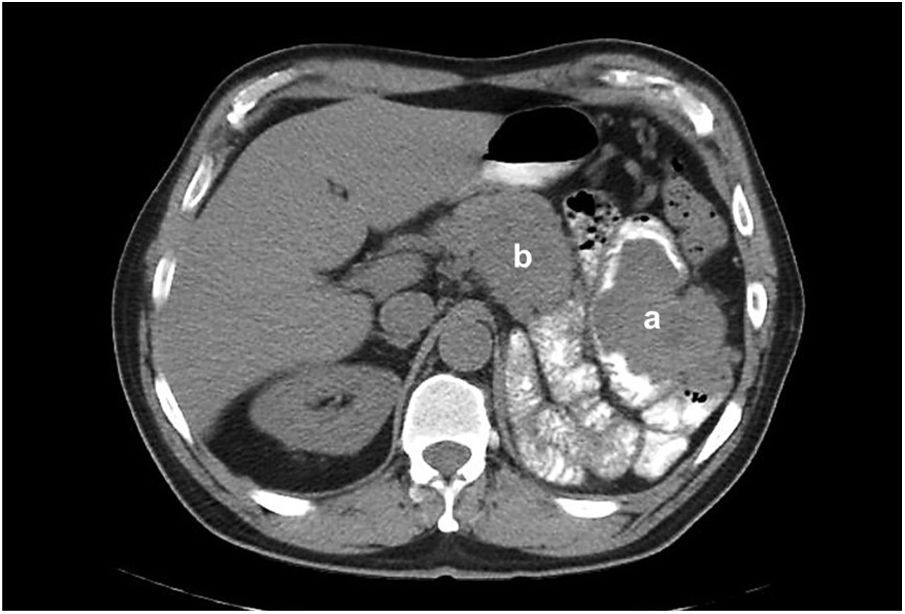
Al día siguiente, el paciente se encontraba sin datos de sangrado activo y se le efectuó TC de abdomen simple y con contraste oral, en la cual se observa ausencia quirúrgica de riñón izquierdo, con fosa renal ocupada por tumoración que mide 68×94×56mm, que infiltra la pared del colon por debajo del ángulo esplénico, reduciendo la luz intestinal; con imagen sugerente de invasión a un asa de yeyuno circundante, así como una tumoración retroperitoneal en relación a ganglios suprapancreáticos sugerentes de actividad metastásica la cual invade la curvatura menor del estómago (fig. 2). El reporte histopatológico revela la presencia de carcinoma de células claras metastásico ulcerado, con presencia de vasos de neoformación e infiltrado inflamatorio con predominio de macrófagos.
El carcinoma de células renales es el noveno cáncer más frecuente en varones, y ocupa el lugar 14 en mujeres, no obstante, es la neoplasia maligna urológica más letal en el mundo1. Actualmente su incidencia va en aumento en países desarrollados; aunque la tasa de mortalidad va a la baja, principalmente por la introducción de las terapias dirigidas con inhibidores de tirosina-cinasa y antagonistas de mTOR2. En México la incidencia para 2018 estaba calculada en 3,5 casos por 100.000 habitantes3. El manejo de carcinoma de células renales en etapa clínica IV debe de incluir terapia sistémica, más nefrectomía parcial y/o total, así como metastasectomía o terapias ablativas y un seguimiento activo del paciente que incluya examen médico, estudios de laboratorio, TC toraco-abdominal basal, a los 6 meses y posteriormente cada año4.
Cerca del 30% de los pacientes sometidos a nefrectomía parcial o radical, pueden desarrollar metástasis durante los 5 años de seguimiento, si ocurren dentro del primer año de seguimiento se consideran tempranas y posterior a este período se denominan tardías; siendo las metástasis tempranas de peor pronóstico para el paciente, recomendándose metastasectomía y/o terapia ablativa5. Las metástasis a colon son sumamente infrecuentes, ocurriendo en un 1% de todas las neoplasias desarrolladas a nivel colorrectal. La incidencia de metástasis a colon ocurre principalmente por cáncer de mama (3-12%), próstata (1-12%), pulmón (6%), melanoma (<7%) y renal (<10%); generalmente son múltiples lesiones originadas por extensión local, linfática, hematógena o implantación a distancia6.
El cuadro clínico de esta entidad es inespecífico, pudiendo presentarse como sangrado digestivo bajo, anemia, obstrucción mecánica o intususcepción, dolor abdominal y pérdida de peso; sin embargo, no es inusual que cursen de manera asintomáticas o bien se documenten solamente durante necropsias. En estudios tomográficos estas lesiones se observan como masas polipoides intraluminales, masas exofíticas y adelgazamiento de la pared intestinal7. Las metástasis renales posteriores a nefrectomía a nivel gastrointestinal son extremadamente infrecuentes. Vo et al., realizaron una revisión de la literatura entre 1991 a 2016 encontrando únicamente 9 casos, aunado a ello describen un caso visto por su grupo de trabajo. Se trata de un paciente con una metástasis solitaria a colon 5 años posteriores a nefrectomía, similar a nuestro paciente, cursó con dolor abdominal y hematoquecia8.
Este caso clínico es ilustrativo, sobre todo porque nos hace recordar que todo paciente con antecedente de algún tumor primario que inicie con sintomatología digestiva debe ser abordado de manera integral, es decir, de forma clínica, endoscópica y, en caso de ser necesario, radiológicamente.
El abordaje terapéutico inicial de la hemorragia digestiva baja es asegurar el adecuado estado hemodinámico del paciente. Una vez estable, se recomienda realizar un estudio endoscópico para determinar el origen del sangrado, en este caso se encontró una lesión de probable origen subepitelial. Cuando nos enfrentamos a este tipo de lesiones es de vital importancia determinar la extensión de la lesión, de ser posible mediante ultrasonido endoscópico con toma de biopsia guiada con aguja fina; de no ser posible se deberá de buscar alternativas con otras técnicas de imagen como la tomografía9. Las lesiones metastásicas en tubo digestivo que ocasionan sangrado pueden tratarse mediante con cauterización, coagulación mediante argón-plasma, colocación de hemoclips, inyección de epinefrina local o aplicación de agentes hemostáticos en polvo10. Sin embargo, será la extensión e invasión del tumor lo que determinará el tratamiento definitivo.
Responsabilidades éticasSe solicitó al paciente consentimiento informado para recibir el tratamiento o para participar en la investigación descrita. Este artículo no contiene información personal que permita identificar al paciente.
Este artículo cumple con la normativa vigente en investigación bioética en nuestro país.
FinanciaciónNo hubo financiación para la realización de esta carta científica.
Conflicto de interesesNinguno de los autores tiene conflictos de intereses para la publicación de este artículo.