Una tarea frecuente en el estudio de los carcinomas colorrectales (CCR) es identificar tumores que presenten sistemas defectuosos de reparación de errores de emparejamiento en el DNA (dMMR, por sus siglas en inglés), los cuales están asociados con la inestabilidad de microsatélites. Dado que se dispone de poca información sobre estos tumores en pacientes mexicanos, nuestro objetivo fue proporcionar una descripción de su frecuencia, características clínico-patológicas y resultados, lo cual es necesario para futuros ensayos.
Materiales y métodosSe realizó una serie consecutiva de pacientes de CCR, que fueron tratados y se les dio seguimiento en un hospital de tercer nivel. Se consideraron las variables clínico-patológicas y el riesgo de cáncer hereditario o familiar. Se evaluaron las laminillas originales y la expresión de las proteínas hMLH1, hPMS2, hMSH2 y hMSH6 mediante inmunohistoquímica. Los tumores con ausencia de al menos una proteína se consideraron dMMR. Las diferencias fueron contrastadas con pruebas no paramétricas.
ResultadosCiento cuarenta y cuatro pacientes fueron incluidos, edad mediana de 65 años, 134 (93%) pacientes esporádicos, 8 (5.6%) con historia familiar de CCR y 2 (1.4%) cumplían criterios diagnósticos para cáncer de colon hereditario no polipósico, según criterios de Bethesda y Ámsterdam. Los tumores dMMR se encontraron en 39 pacientes repartidos en los 3grupos. Fueron localmente avanzados (p<0.001), en colon derecho, con fenotipo mucinoso y reacción linfoide tipo Crohn (todos p<0.04). Se administró quimioterapia adyuvante o paliativa a 57 (39.6%), radioquimioterapia concomitante a 24 (16.7%) y 63 (43.8%) pacientes no tuvieron tratamiento adicional al quirúrgico. El seguimiento a 5 años se completó en 131, los desenlaces vivo con enfermedad/muerte por cáncer fueron observados con mayor frecuencia en lesiones con MMR presentes (pMMR).
ConclusionesEn esta serie pre-FOLFOX, el CCR dMMR tiene mejor desenlace que las lesiones pMMR.
A frequent task in the study of colorectal carcinomas (CRC) is to identify tumors harboring deficient DNA mismatch repair systems (dMMR), which are associated with microsatellite instability. Given that there is scant information on those tumors in Mexican patients, our aim was to describe their frequency, clinical and pathologic characteristics, and results, which are necessary for future trials.
Materials and methodsA consecutive series of CRC patients, treated and followed at a tertiary care center was performed. The clinical and pathologic variables and the risk of hereditary or familial cancer syndrome were retrieved. The original slides and hMLH1, hPMS2, hMSH2, hMSH6 immunohistochemistry were evaluated. Tumors with an absence of at least one protein were considered dMMR. Differences were contrasted, utilizing non-parametric tests.
ResultsOne hundred and forty-four patients were included, with a median age of 65 years. A total of 134/93% patients presented with sporadic CRC, 8/5.6% had a family history of CRC, and 2/1.4% met the diagnostic criteria for hereditary non-polyposis colon cancer, according to the Amsterdam and Bethesda criteria. dMMR tumors were found in 39 patients, distributed among the 3groups. They were locally advanced (P<.001), right-sided, had the mucinous phenotype, and harbored a Crohn's-like lymphoid reaction (all 3features, P<.04). Adjuvant or palliative chemotherapy was administered to 57 (39.6%), concomitant chemoradiotherapy to 24 (16.7%), but 63 (43.8%) patients received no additional treatment to surgery. Five-year follow-up was completed in 131 of the patients and the outcomes alive-with-disease or died-of-disease were more frequently observed in the proficient (pMMR) lesions.
ConclusionsIn the present pre-FOLFOX case series, outcomes were better in dMMR CRC than in proficient lesions.
La mortalidad por cáncer en la población mexicana en edad productiva es la segunda más alta, tomando en conjunto cáncer de mama, cervicouterino, pulmón, estómago y hepático, presentando un promedio de 20 muertes por cada 100,000 habitantes. El cáncer superaría a la diabetes como principal causa de muerte, si los órganos primarios restantes fueran incluidos en la clasificación anterior (http://sinais.salud.gob.mx, 2005).
En el sistema digestivo, el cáncer gástrico y el cáncer colorrectal son los más frecuentes, con las tasas más altas de morbimortalidad. En los últimos 25 años ha habido una disminución gradual en el cáncer gástrico y un incremento en el cáncer colorrectal en México, muy probablemente debido a las variaciones en la dieta y en el índice de masa corporal1-3. En América y Europa, una situación similar ha sido reportada ampliamente, a diferencia de las tasas más elevadas de muertes relacionadas al cáncer gástrico en África, el sureste asiático y la región del Pacífico asiático (www.who.int/whr/2004), lo cual sugiere que condiciones ambientales, de higiene y alimentación, étnicas y otras no identificadas favorecen dichas enfermedades4.
El carcinoma colorrectal (CCR) ha sido tradicionalmente considerado una sola enfermedad, con etapas clínicas separadas y fenotipos diversos, explicados por el grado de diferenciación y el patrón de crecimiento estructural de las células neoplásicas5. En este contexto, los pacientes que tuvieron cirugía, con márgenes libres, se sometieron a un seguimiento estandarizado o regímenes de quimioterapia, de acuerdo con la etapa clínica de la enfermedad6. A principios de los años 90, la identificación de genes asociados con el CCR sugirió la posibilidad de cánceres esporádicos, familiares y hereditarios6. Las primeras 2categorías explican menos del 5% de los casos observados en la población general y los síndromes reconocidos incluyen poliposis adenomatosa familiar, síndrome de Peutz-Jeghers, síndrome de Cowden y CCR hereditario no polipósico7. La identificación de este pequeño porcentaje de pacientes requirió de una amplia inversión tecnológica y económica que resultó en criterios de detección y herramientas para nuevos abordajes8-11. Dicha tamización también cubre el 95% restante de pacientes con CCR que actualmente llena los centros de salud6,7.
Con la descripción de mutaciones somáticas ubicuas en secuencias repetidas de DNA en CCR, se subclasificó estas neoplasias como cánceres con estabilidad de microsatélites y con inestabilidad de microsatélites6-8. A mayor inestabilidad de microsatélites, mayor proporción de casos de CCR familiar/hereditario9-11. Sin embargo, la disponibilidad de anticuerpos monoclonales para las proteínas de reparación de DNA, hMLH1, hMSH2, hPMS2 y hMSH6 permitieron la detección, por medio de inmunohistoquímica, de un mayor número de casos, con una gran sensibilidad y valor predictivo12,13. Dicho hallazgo no sería más que una simple curiosidad molecular, de no ser por el hecho de que: a) predice carcinogénesis por medio de una vía diferente a la secuencia adenoma-displasia-carcinoma6; b) el grado de inestabilidad de microsatélites parece predecir la respuesta a tratamientos de quimioterapia basados en 5FU e irinotecan14, y c) advierte sobre la posibilidad de reacciones adversas a dichos tratamientos13,14.
Dada la escasa información disponible sobre pacientes mexicanos con CCR y el estatus de sus proteínas de reparación de DNA15,16, el objetivo del presente estudio fue identificar la frecuencia y las características clínicas y patológicas en una serie consecutiva de casos tratados y seguidos en un hospital de tercer nivel en la Ciudad de México.
Materiales y métodosRealizamos una búsqueda retrospectiva de todos los pacientes con diagnóstico de CCR que recibieron atención médica y seguimiento en un hospital de tercer nivel, entre enero del 2000 y diciembre del 2004. El expediente de cada paciente fue revisado para identificar las variables demográficas, clínicas y quirúrgicas, el TNM patológico, el tratamiento de quimioterapia (regímenes basados en fluorouracilo), complicaciones de la enfermedad neoplásica y estatus en la última consulta. Se registró antecedente familiar o clínico de cáncer obtenido de los historiales médicos o de entrevistas con los pacientes durante el seguimiento. Se definió el riesgo de cáncer hereditario o familiar de acuerdo con los criterios de Ámsterdam II revisados y al sistema Bethesda9-11. Las laminillas histológicas fueron reevaluadas por 2patólogos con experiencia en enfermedad gastrointestinal (C-R C, G-D A). En cada tumor se identificaron las características generales, la ubicación, el número, el tamaño, las lesiones asociadas, la condición de ganglios linfáticos, el nivel de invasión y el estatus del margen. Con base en el examen microscópico, los tumores se clasificaron de acuerdo con las recomendaciones de la Organización Mundial de la Salud5. También determinamos la presencia de linfocitos intratumorales, la reacción linfoide tipo Crohn (RLC), fenotipo medular o cribiforme, el grado de diferenciación e invasión linfovascular, al igual que lesión precursora (pólipos: adenomatoso, hiperplásico, serrado, mixto o de focos de cripta aberrante)4,5. Todos los pacientes que se sometieron a la resección quirúrgica y tuvieron un seguimiento de 5 años fueron estudiados. El análisis de las proteínas de reparación de DNA fue realizado por medio de inmunohistoquímica para hMLH1, hMSM6 (Clones BD y GTBP, Pharmigen), hMSH2 y hPMS2 (Clones CM219C, CM344A, Biocare Mexico, División del Norte 4274-204, Tlalpan, Ciudad de México), en células normales y neoplásicas. Los tumores fueron clasificados como estables para proteínas de reparación de errores de emparejamiento (pMMR), si todas las reacciones inmunohistoquímicas estaban presentes, o deficientes para proteínas de reparación de errores de emparejamiento (dMMR), si al menos una proteína estaba ausente en el núcleo neoplásico. Se evaluó p de doble cola, utilizando pruebas no paramétricas.
Análisis estadísticoRealizamos una búsqueda retrospectiva con las características antes mencionadas. Se evaluó una p de 2colas por medio de pruebas no paramétricas.
ResultadosSe identificaron 192 casos de CCR, 48 fueron excluidos debido a la falta de bloques de parafina o de historia clínica, quedando 144 casos para incluir en el estudio. Setenta y ocho de los pacientes (54.2%) fueron hombres, la edad mediana de los pacientes al momento del diagnóstico fue de 65 años (18-91 años), y 33 pacientes (23%) fueron menores de 50 años en el momento del diagnóstico. Dos pacientes (1.4%) cumplieron con los criterios de diagnóstico para cáncer de colon hereditario no polipósico (síndrome de Lynch). Ocho pacientes (5.6%) tuvieron historia familiar de CCR, sin cumplir los criterios de diagnóstico para cáncer de colon hereditario no polipósico. Los 134 pacientes (93%) restantes sin historia familiar de CCR fueron considerados casos de cáncer esporádicos. La mayoría de los tumores fueron en colon derecho (53.5%), localmente avanzados (66.7%) y 33.3% de las lesiones fueron etapa iv. La resección intestinal fue realizada en 125 casos (86.8%) y la profundidad de la invasión de los tumores (pT) alcanzó la submucosa (3.2%) muscularis propria (11.2%) y subserosa (85.6%). Los tumores fueron poco diferenciados (42.4%), moderadamente diferenciados (42.4%) y bien diferenciados (4.9%). Se observaron lesiones precursoras en 9 pacientes (6.3%). Se identificó un patrón RLC en 17 casos (11.8%) y se encontraron células en anillo de sello y diferenciación mucinosa en el 5.6 y el 11.1% de los casos, respectivamente.
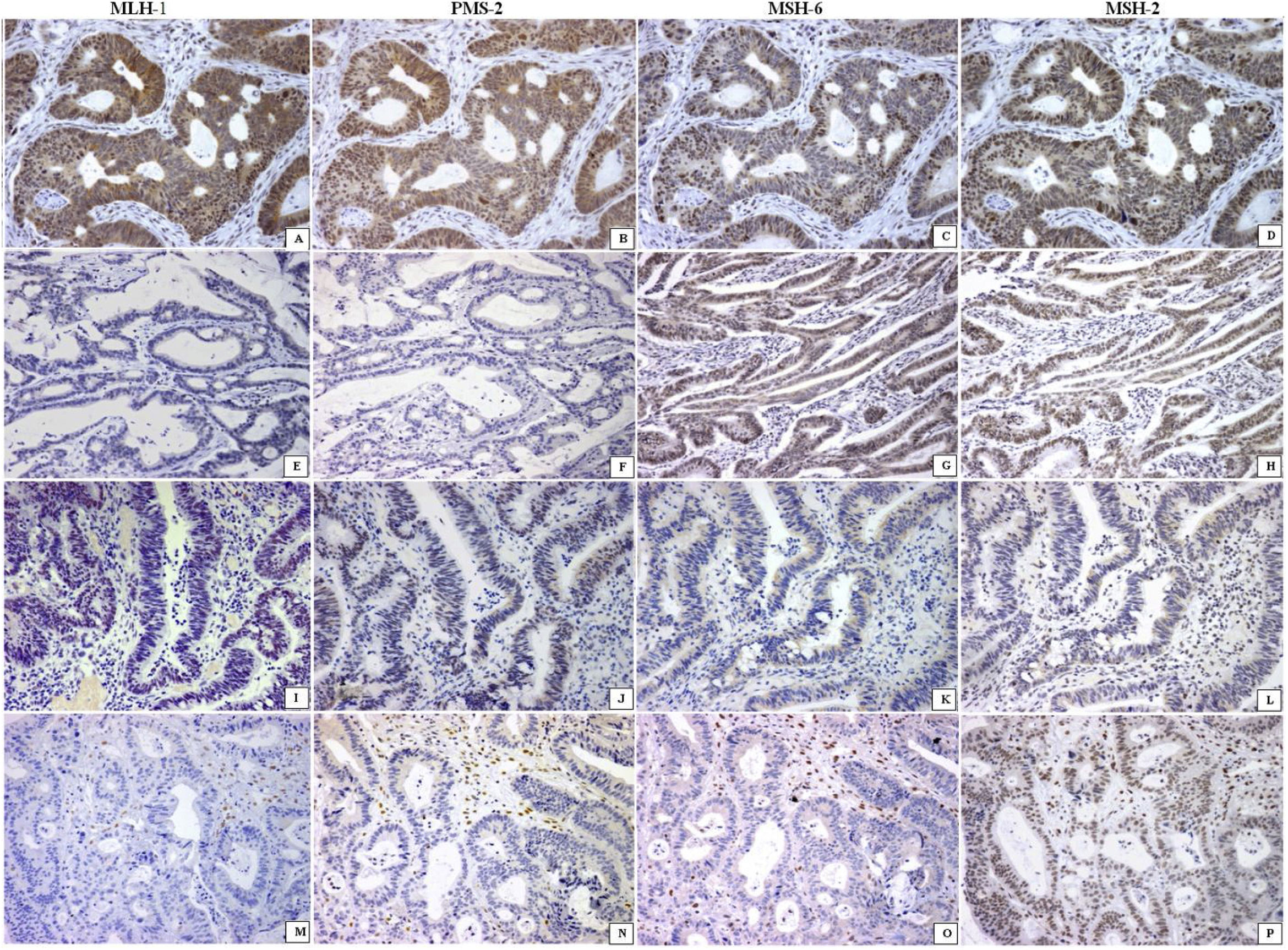
Treinta y nueve pacientes tuvieron tumores dMMR. La mayoría fueron identificados en hombres con enfermedad localmente avanzada (p <0.04) y con adenocarcinoma en colon derecho (p <0.04), fenotipo mucinoso (p <0.04) y reacción inflamatoria en la pared intestinal, con semejanza a la enfermedad de Crohn (p <0.04), en comparación con los tumores pMMR (tabla 1). Veintisiete pacientes tuvieron pérdida de 2proteínas MMR en células neoplásicas (22 MLH1/PMS2; 5 MSH2/MSH6). En 12 pacientes se identificó la ausencia de al menos una proteína MMR en tumor, PMS2 estuvo ausente en 7, MLH1 estuvo ausente en 4 y MSH2 estuvo ausente en un paciente (fig. 1).
Perfiles clínicos y patológicos y desenlaces relacionados, según la inestabilidad de microsatélites, en 144 pacientes
| dMMR (n=39) (27.1%) | pMMR (n=105) (72.9%) | p | |
|---|---|---|---|
| Hombres | 21 | 57 | NS |
| Mujeres | 18 | 48 | |
| Edad mediana (rango) | 64 (18-88) | 67 (20-91) | |
| Etapa | |||
| Localizado (I-III) | 31 (79.5) | 65 (61.9%) | <0.001 |
| Avanzado (IV) | 8 (20.5) | 40 (38.1%) | |
| Tratamiento | |||
| Solo cirugía | 19 | 44 | NS |
| Quimioterapia | 17 | 40 | |
| Radioquimioterapia | 3 | 21 | |
| Ubicación del tumor | |||
| Lado derecho | 27 | 35 | 0.04 |
| Lado izquierdo | 12 | 70 | |
| Morfología | |||
| Mucinoso | 8 | 9 | 0.04 |
| Reacción linfoide tipo Crohn | 8 | 9 | 0.04 |
| Supervivencia general a 5 años (%) | |||
| Etapa I | 80 | 80 | |
| Etapa II | 66.7 | 41.7 | |
| Etapa III | 36.4 | 41.7 | |
| Etapa IV | 7.1 | 5.9 | |
Perfil del sistema de reparación de errores de emparejamiento en carcinoma colorrectal (cada línea es un caso). Se observó reacción nuclear positiva de todas las enzimas en los tumores pMMR (A-D). La ausencia de 2proteínas (MLH-1/PMS2 o MSH6/MSH2) en la línea 2 (E-F) y la línea 3 (K-L) o la ausencia de 3proteínas (línea 4; M-O) caracterizó a los tumores dMMR. Todas son reacciones inmunohistoquímicas×200.
Se adjunta en PDF.
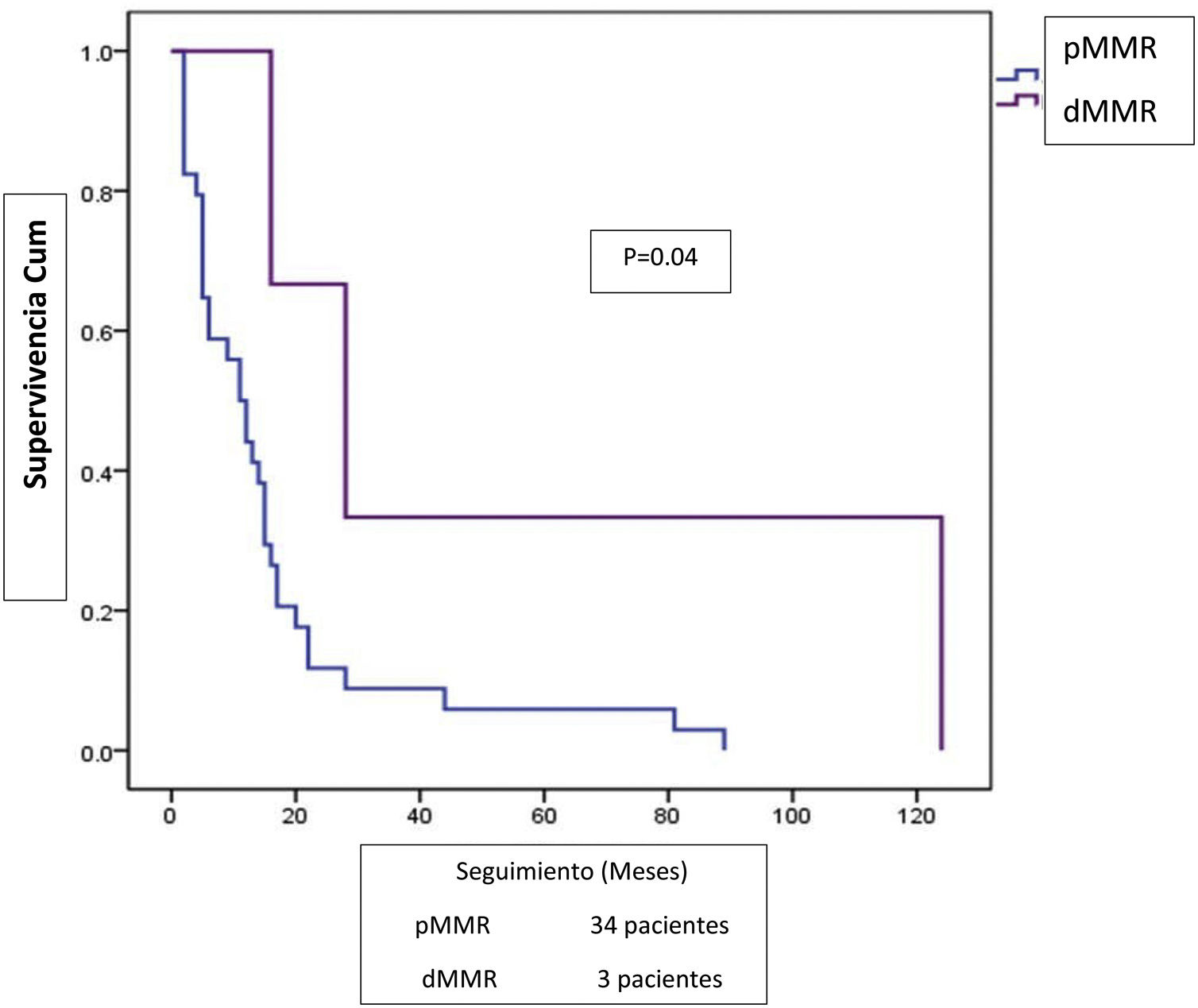
Se administró quimioterapia adyuvante o paliativa en 57 pacientes (39.6%), quimioterapia concomitante en 24 (16.7%) y 63 pacientes (43.8%) no recibieron tratamiento adicional a la cirugía. Se completó un seguimiento de 5 años en 131 pacientes. Los desenlaces de tumores dMMR en comparación con los pMMR fueron vivo con enfermedad (2.5 vs. 4.3%), vivo sin enfermedad (46.2 vs. 33.7%), muerte por enfermedad (51.3 vs. 58.7%) y muerte por otra causa (0 vs. 3.3%). Las tasas generales de supervivencia y de supervivencia a 5años para los tumores dMMR fueron del 41 y el 48.7%, respectivamente, mientras que para los tumores pMMR fueron del 32.6 y el 38%, respectivamente. El desenlace de diseminación de enfermedad en los pacientes con tumores dMMR fue mejor, aunque los grupos de comparación fueron pequeños (fig. 2).
Discusión y conclusionesLa inmunohistoquímica para enzimas del sistema de reparación del DNA de errores de emparejamiento en CCR es una técnica que, en conjunto con la identificación clínica, es un primer paso para el reconocimiento de las alteraciones en línea germinal y familiar en pacientes con CCR esporádico sin síndrome. Los tumores dMMR estuvieron distribuidos en los 3grupos del presente estudio: 2/2 pacientes tuvieron un pedigrí consistente con el síndrome de Lynch (100%), 3/8 tuvieron historia familiar de CCR (37.5%) y 34/134 (25.3%) tuvieron tumores esporádicos. La frecuencia general de tumores dMMR del 27.1% en nuestra serie consecutiva de CCR en pacientes mexicanos está en línea con 2comunicaciones previas que identificaron frecuencias del 34 y el 21.3%15,16, las cuales fueron todas más altas que las frecuencias observadas en pacientes latinos que viven en los Estados Unidos de América17. Las diferencias de frecuencia del CCR dMMR podrían ser debidas a la edad de la población analizada, el sesgo de selección del estudio o de factores no identificados. Sin embargo, su evaluación es importante ya que impacta el estándar actual de atención al CCR con FOLFOX (ácido folínico, fluorouracilo y oxaliplatino)18,19.
A pesar de que el 93% de los tumores muestreados fueron esporádicos, con inestabilidad de microsatélites, de acuerdo con los criterios de Ámsterdam y de Bethesda, el 25.3% de ellos tenían sistemas de reparación de DNA de errores de emparejamiento deficientes. El porcentaje de casos esporádicos con tumores dMMR fue principalmente asociado con la ausencia de MLH1, la cual es explicada por el silenciamiento de la expresión por metilación del promotor20. Se ha demostrado que la identificación del CCR dMMR es importante para el asesoramiento genético cuando se observa en pacientes jóvenes y es de influencia en ajustes realizados a la terapia sistémica cuando existe metástasis21. La mayoría de los adenocarcinomas en nuestro estudio fueron de tipo convencional, pero con un fenotipo mucinoso o con infiltraciones inflamatorias parecidas a la enfermedad de Crohn, en las lesiones dMMR (ambas p <0.04). Además de la ubicación en colon derecho (p <0.001), no encontramos otro hallazgo morfológico relacionado con los tumores dMMR. Estos datos estuvieron de acuerdo con reportes previos, en los cuales no existió asociación del fenotipo medular/sólido o necrosis sucia con deficiencias proteínicas22. Los pacientes con tumores dMMR fueron más jóvenes que la edad mediana de otros pacientes en la serie (64 vs. 67 años), 54% eran hombres y frecuentemente presentaron enfermedad en etapa i-iii (p <0.04). Ese subgrupo de pacientes debería ser estudiado utilizando los recientemente propuestos criterios para el estudio de linfocitos infiltrantes de tumor, especialmente aquellos que muestran el infiltrado inflamatorio tipo Crohn23. Se ha observado una reacción en tejido que podría estar relacionada a mejoras en la inmunoterapia en carcinomas colorrectales dMMR19,23.
En México, la información respecto a la incidencia y mortalidad del cáncer colorrectal es escasa y no hay datos que proporcionen información subcelular2,24-27. Como es de esperarse, la mayoría de los pacientes analizados tenían etapas avanzadas (iii, iv) de su enfermedad (59.7%) y se identificó muerte relacionada con cáncer en 74 pacientes (tasa de mortalidad de 54.1%). Esto contrasta con las bajas tasas de mortalidad sugeridas en reportes internacionales sobre CCR y concuerda con el patrón de alta incidencia y mortalidad observada en Costa Rica, Colombia y Brasil28, aunque en línea con la falta de datos nacionales confiables sobre cáncer29. Los tumores pMMR tuvieron el peor desenlace en enfermedad localmente avanzada, al igual que en etapas diseminadas del cáncer, en comparación con las lesiones dMMR.
Las limitaciones de la presente serie de casos son su naturaleza retrospectiva y su ejecución previa a la era FOLFOX, lo cual evita la comparación con los estándares actuales de atención.
En resumen, la mayoría de los pacientes con CCR en nuestro estudio tuvieron enfermedad esporádica y de los pacientes con tumores dMMR, las lesiones más frecuentes fueron en colon derecho, mucinosas y tuvieron infiltraciones inflamatorias como las de la enfermedad de Crohn. También estuvieron asociadas con mejores desenlaces en la comparación con los tumores pMMR.
Consideraciones éticasEl presente trabajo cumple con las regulaciones actuales sobre investigación bioética y fue autorizado por el comité de ética institucional. Los autores declaran que este artículo no contiene información personal que pudiera identificar a los pacientes. No se solicitó consentimiento informado de los pacientes para participar en el estudio.
FinanciaciónNo se recibió financiamiento con relación al presente estudio/artículo.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.