El síndrome de intestino corto (SIC) se refiere a la suma de alteraciones funcionales que resultan de una reducción crítica en la longitud del intestino, y que en ausencia de un tratamiento adecuado se manifiestan con diarrea crónica, deshidratación crónica, desnutrición, pérdida de peso, deficiencia de nutrimentos y electrolitos, así como falla para crecer que se presenta con mayor frecuencia durante el periodo neonatal. El objetivo de este artículo es realizar una revisión de la literatura médica sobre la definición, las causas más frecuentes de SIC así como entender la fisiopatología, los factores pronósticos y tratamiento.
Se realizó una búsqueda de artículos en PubMed, considerando la información existente en niños con SIC de 20 años hasta la fecha, utilizando las palabras clave “síndrome de intestino corto”. De un total de 784 artículos potenciales, se realizó una selección de 82 artículos donde realizamos la revisión de la literatura médica. Los pacientes con SIC son todo un reto para su tratamiento, por lo que se debe establecer un manejo multidisciplinario enfocado en mantener un soporte nutricional óptimo que cubra las necesidades para crecimiento, desarrollo y asimismo, disminuir al máximo la presencia de complicaciones a corto, mediano y largo plazo. El diagnóstico y manejo de un niño con SIC, implica un equipo de profesionales expertos en el manejo gastroenterológico, pediátrico y nutricional. El pronóstico del niño estará en función al manejo oportuno, así como longitud de la resección intestinal y presencia o no de válvula ileocecal.
Short bowel syndrome (SBS) refers to the sum of the functional alterations that are the result of a critical reduction in the length of the intestine, which in the absence of adequate treatment, presents as chronic diarrhea, chronic dehydration, malnutrition, weight loss, nutriment and electrolyte deficiency, along with a failure to grow that is present with greater frequency during the neonatal period. The aim was to carry out a review of the literature encompassing the definition and the most frequent causes of SBS, together with an understanding of its physiopathology, prognostic factors, and treatment.
An Internet search of PubMed articles was carried out for the existing information published over the last 20 years on SBS in children, using the keywords “short bowel syndrome”. From a total of 784 potential articles, 82 articles were chosen for the literature review. The treatment of patients presenting with SBS is quite a challenge and therefore it is necessary to establish multidisciplinary management with a focus on maintaining optimal nutritional support that covers the necessities of growth and development and at the same time provides a maximum reduction of short, medium, and long-term complications. The diagnosis and treatment of a child with SBS require a team of professionals that are experts in gastroenterologic, pediatric, and nutritional management. The outcome for the child will be directly related to opportune management, as well as to the length of the intestinal resection and the presence or absence of the ileocecal valve.
Pocas entidades en pediatría especialmente en gastroenterología, nutrición y cirugía pediátrica, representan un importante y significativo reto de manejo, como lo representa un niño con síndrome de intestino corto (SIC) secundario a una resección quirúrgica. La historia empieza ante el reto para el cirujano pediatra de enfrentarse a un niño con un evento que puede considerarse como catastrófico, sin posibilidad de sobrevida sino se practica una resección. Sigue con el gastroenterólogo y nutriólogo en donde se enfrentan al reto de alimentar y/o nutrir a un niño, en quien la superficie anatómica y funcional del intestino ha sido reducida en forma importante, condicionando un estado de malabsorción de agua, electrolitos y nutrimentos (proteínas, grasas, carbohidratos, vitaminas y minerales). Independiente del reto anterior, el SIC brinda la oportunidad al médico de ser un modelo educativo que permite poner en juego todos sus conocimientos de anatomía y fisiología del tracto gastrointestinal. El objetivo de este trabajo fue realizar una revisión de la literatura médica sobre la definición, las causas más frecuentes de SIC, así como entender su fisiopatología, factores pronósticos y tratamiento.
MétodosLa base de la información se tomó de libros de gastroenterología pediátrica, así como también se realizó una búsqueda de artículos en PubMed, considerando la información existente en niños con SIC de 20 años hasta la fecha, utilizando las palabras clave “síndrome de intestino corto en niños”, “causas de resección intestinal en niños”, “adaptación intestinal en síndrome de intestino corto”, “fases de adaptación posresección intestinal”, “complicaciones del síndrome de intestino corto”. De un total de 784 artículos potenciales, se realizó una selección de 82 artículos donde llevamos a cabo la revisión de la literatura.
Definición de SICEl intestino delgado (ID) tiene una longitud de 120cm durante el segundo trimestre de la gestación, el cual se duplica en el último trimestre hasta alcanzar 250cm en un recién nacido de término. Con un área de superficie mucosa de 950cm2, y alcanzando a la edad adulta una longitud de 6 a 8 m con una superficie mucosa de 7.500cm2. Este aspecto de crecimiento hace que la sobrevida en un niño sea 100,0% mejor comparada a la de un adulto, especialmente en pacientes prematuros1–4.
El SIC se refiere a la suma de alteraciones funcionales que resultan de una reducción crítica en la longitud del intestino, y que en ausencia de un tratamiento adecuado se manifiestan con diarrea crónica, deshidratación, desnutrición, deficiencia de nutrimentos y electrólitos, así como falla para crecer5,6.
La adaptación intestinal y presencia de las complicaciones nutricionales, metabólicas e infecciosas en el SIC, dependen de la longitud del intestino resecado, asociándose a un mayor número de complicaciones cuando quedan sólo 100cm de ID o bien, cuando se ha resecado más del 80,0% del mismo en ausencia de válvula ileocecal y colon2,7,8.
La falla intestinal se define como una enteropatía que puede ser primaria o congénita (atresias intestinales, trastornos de motilidad y mucosa), y secundaria a una resección intestinal, como en pacientes con SIC asociado a una disminución anatómica y funcional del ID para la digestión y absorción de nutrimentos, así como para mantener un adecuado crecimiento, desarrollo y balance hidroelectrolítico, y con uso obligado de nutrición parenteral por más de 8 semanas9–11.
Un cuestionamiento que con frecuencia se realiza, es ¿qué tan corto es el SIC? Se sabe de acuerdo a la literatura médica, que un niño con hasta 40cm de ID y válvula ileocecal tiene una buena oportunidad de sobrevida, en tanto que ésta disminuye en el mismo niño si hay menos de 25cm y la válvula ileocecal no esta preservada, las posibilidades de sobrevida son nulas12,13.
EpidemiologíaEl SIC es una patología que se presenta con mayor frecuencia durante el periodo neonatal asociado a malformaciones del tubo digestivo, prematurez (< 37 semanas de gestación), cardiopatías congénitas y/o eventos de hipoxia-isquemia intestinal, y en edades posteriores secundario a eventos de isquemia intestinal, enfermedad inflamatoria intestinal y radioterapia8,14–16 (tablas 1 y 2). Se ha reportado una incidencia entre 0,7% y 1,1% de casos de SIC en los Estados Unidos de Norteamérica, y en Canadá de 24,5 por cada 100.000 nacidos vivos14,17. Se ha reportado una mayor frecuencia de SIC en pacientes< 37 semanas de gestación comparado con recién nacidos vivos de término (353,7 por 100.000 habitantes vs 3,5 por 100.000 habitantes)14.
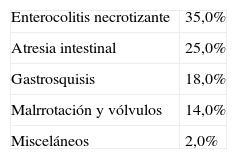
Causas más frecuentes de síndrome de intestino corto
| Enterocolitis necrotizante | 35,0% |
| Atresia intestinal | 25,0% |
| Gastrosquisis | 18,0% |
| Malrrotación y vólvulos | 14,0% |
| Misceláneos | 2,0% |
Adaptado de Gutiérrez I et al.9.
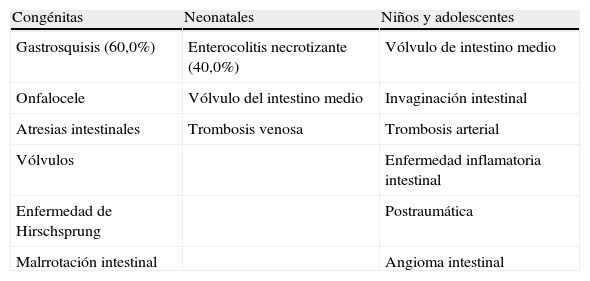
Causas más frecuentes por grupo de edad de síndrome de intestino corto
| Congénitas | Neonatales | Niños y adolescentes |
| Gastrosquisis (60,0%) | Enterocolitis necrotizante (40,0%) | Vólvulo de intestino medio |
| Onfalocele | Vólvulo del intestino medio | Invaginación intestinal |
| Atresias intestinales | Trombosis venosa | Trombosis arterial |
| Vólvulos | Enfermedad inflamatoria intestinal | |
| Enfermedad de Hirschsprung | Postraumática | |
| Malrrotación intestinal | Angioma intestinal |
En un estudio realizado por Hyams et al.15 se reporta que el grado de enterocolitis necrotizante y la resección intestinal son mayores en pacientes prematuros< 32 semanas de gestación. Así también, reportan una incidencia de 60,0% en gastrosquisis como causa de SIC15.
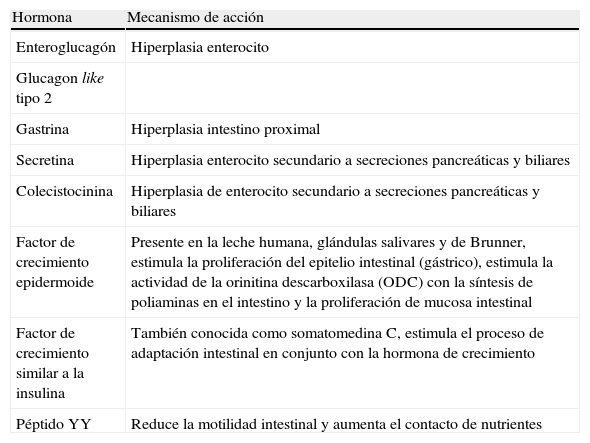
FisiopatologíaEl duodeno y el yeyuno son responsables de la absorción de la mayoría de los nutrimentos de la dieta, con excepción de la vitamina B12 y sales biliares. En términos generales, la digestión y absorción de los nutrimentos se completa dentro de los primeros 100 a 150cm del yeyuno en un niño sano. En ausencia de un colon íntegro, la longitud mínima de ID sano para evitar el uso de nutrición parenteral (NTP) es de aproximadamente 100cm. En niños con una cantidad menor de superficie anatómica absortiva y/o funcional de yeyuno presentan manifestaciones importantes de malabsorción. Aún y cuando el íleon es limitado en su función de formar quilomicrones comparado con el yeyuno, diferentes estudios han mostrado que el íleon tiene una mayor capacidad adaptativa en la absorción de nutrimentos en niños con SIC. Por lo contrario, el yeyuno no puede desarrollar transportadores específicos de vitamina B12 y sales biliares y en consecuencia, son mal absorbidos en pacientes con resección ileal. Aún más, la pérdida de la hormona enteroglucagón y péptido YY juegan un papel importante en la motilidad gastrointestinal (tabla 3)18–20.
- a)
Absorción de nutrimentos y funciones: El yeyuno se caracteriza por tener vellosidades intestinales grandes, altas con uniones apretadas no tan estrechas, haciendo que el epitelio intestinal sea más abierto, más poroso para grandes moléculas, permitiendo el flujo libre de agua y electrolitos, esto facilita la absorción de nutrimentos, líquidos, etc. Es decir, el yeyuno es el lugar donde se realiza la mayor parte de la absorción de nutrimentos. En contraste, el íleon tiene vellosidades intestinales más pequeñas con uniones apretadas más cerradas, lo que hace que su capacidad de absorción sea menor, permitiendo un flujo libre disminuido de líquidos y electrólitos desde el espacio vascular al lumen intestinal. En resumen, el íleon es más eficiente en la absorción de agua, y posee receptores específicos para la absorción de las sales biliares y de la vitamina B12. De hecho, muchas hormonas gastrointestinales que afectan la motilidad intestinal incluyendo enteroglucagón y péptido YY se producen en el íleon, así como la regulación de la motilidad intestinal por las grasas (freno ileal) y la inhibición de la gastrina, lo que condiciona hipergastrinemia e hipersecreción de ácido gástrico21,22.
Hormonas involucradas en la adaptación intestinal
| Hormona | Mecanismo de acción |
| Enteroglucagón | Hiperplasia enterocito |
| Glucagon like tipo 2 | |
| Gastrina | Hiperplasia intestino proximal |
| Secretina | Hiperplasia enterocito secundario a secreciones pancreáticas y biliares |
| Colecistocinina | Hiperplasia de enterocito secundario a secreciones pancreáticas y biliares |
| Factor de crecimiento epidermoide | Presente en la leche humana, glándulas salivares y de Brunner, estimula la proliferación del epitelio intestinal (gástrico), estimula la actividad de la orinitina descarboxilasa (ODC) con la síntesis de poliaminas en el intestino y la proliferación de mucosa intestinal |
| Factor de crecimiento similar a la insulina | También conocida como somatomedina C, estimula el proceso de adaptación intestinal en conjunto con la hormona de crecimiento |
| Péptido YY | Reduce la motilidad intestinal y aumenta el contacto de nutrientes |
Un aspecto importante a comentar es que en los niños con SIC y resección ileal se presenta hipersecreción de acidez gástrica, lo que conlleva una mayor cantidad de secreción ácida al duodeno inactivando a las enzimas pancreáticas, ya que como se sabe éstas funcionan mejor con un pH alcalino22. La mayor complicación de los pacientes con SIC es la malabsorción generalizada de nutrimentos debido a la pérdida de superficie de absorción, así como la disminución de enzimas digestivas y proteínas transportadoras, condicionando la presencia de diarrea osmótica en el caso de carbohidratos y proteínas, y malabsorción de grasas y vitaminas liposolubles en los casos con resección ileal23,24.
A nivel de la motilidad gastrointestinal, se establece un vaciamiento gástrico y tránsito intestinal más rápido a través del yeyuno por la pérdida de los mecanismos reguladores (hormonas, efectos de las grasas) de manera inicial, y durante la evolución se inicia una respuesta fisiológica de adaptación, con el objetivo de aumentar la superficie de absorción mucosa, lo que resulta en dilatación intestinal con disminución de la motilidad y aumento del tiempo de tránsito intestinal25,26.
Manifestaciones clínicasPosterior a una resección intestinal se producen modificaciones en la motilidad del intestino, sobre todo disminución del tiempo de tránsito intestinal, lo cual es responsable de la diarrea presente en estos niños además de la falta de enzimas y proteínas transportadoras, lo que condiciona a su vez la presencia de diarrea osmótica. Los pacientes más afectados son los que sufren resección de íleon, la válvula ileocecal y el colon, por sus efectos enlentecedores del tránsito mediante la producción de enterohormonas (PYY, GLP-2) y la acción de las grasas (freno ileal).
Las deficiencias nutricionales que se producen en los pacientes con SIC, dependerán de la longitud y del segmento intestinal resecado. La resección yeyunal es mejor tolerada que la del íleon. En los pacientes con yeyunostomías y resección ileal es más frecuente la deshidratación secundaria a las pérdidas de agua y electrolitos, sobre todo sodio (80 a100 mEq) y magnesio con malabsorción de nutrientes, incluida la vitamina B12. La hipomagnesemia es frecuente en los pacientes con SIC (especialmente en los pacientes con yeyunostomías). Se produce por disminución de la absorción intestinal de magnesio por quelación con los ácidos grasos en la luz intestinal, y por pérdidas renales (debidas al hiperaldosteronismo secundario). A su vez la hipomagnesemia disminuye la secreción y la función de la paratohormona (PTH), lo que incrementa las pérdidas renales de magnesio e indirectamente disminuye la absorción intestinal de éste, al disminuir la formación de 1,25 hidroxicalciferol-2 vitamina D. En los pacientes que presentan colon sano en continuidad, tendrán menor presencia de diarrea y deshidratación21,27–29.
El grado de malabsorción de nutrientes y de vitamina B12, dependerá de la longitud de íleon resecado, principalmente del íleon terminal. Estos pacientes pueden presentar otras complicaciones como la acidosis D-láctica y la litiasis renal por oxalato. La acidosis D-láctica se produce por la fermentación bacteriana en el colon de los carbohidratos no absorbidos. La litiasis por oxalato se debe al aumento de la reabsorción de oxalato en el colon que origina hiperoxaluria. En condiciones normales, el oxalato de los alimentos se quela con el calcio en la luz intestinal evitando la reabsorción del mismo en el colon. Sin embargo, en los pacientes que presentan esteatorrea el calcio se quela con las heces y el oxalato libre puede reabsorberse en el colon, pudiendo originar nefrolitiasis en el 25,0% de los mismos. También contribuyen a la formación de piedras de oxalato cálcico, el aumento de la permeabilidad del colon por efecto de las sales biliares no absorbidas, la reducida degradación bacteriana del oxalato, la deficiencia de piridoxina y tiamina y la hipocitraturia30,31.
La colelitiasis aparece en el 20,0% a 45,0% de los enfermos con SIC con alimentación parenteral. Esta se favorece por la malabsorción de las sales biliares, estasis biliar en la vesícula, alteración en el metabolismo de la bilis, que origina la formación de piedras de bilirrubinato cálcico.
El sobrecrecimiento bacteriano es frecuente en los pacientes con SIC, debido a los propios mecanismos de adaptación intestinal tras la resección (dilatación, disminución del tránsito intestinal), a la resección de la válvula ileocecal en muchos casos, al uso de fármacos (inhibidores de la secreción gástrica, antidiarreicos), y a otros factores (presencia de asas ciegas, seudoobstrucción intestinal). El sobrecremiento bacteriano puede ser un factor limitante en la adaptación intestinal, ya que crea inflamación en la mucosa intestinal, favorece la malabsorción, produce desconjugación de sales biliares ayudando a su depleción y produciendo esteatorrea. Además, produce malabsorción de vitaminas liposolubles y de vitamina B12. También aumenta el riesgo de traslocación bacteriana y favorece la aparición de hepatopatia en los pacientes tratados con NTP30,31. Clínicamente, los pacientes pueden presentarse con anorexia, vómitos, diarrea, distensión abdominal incluso con sangrado de tubo digestivo y cuadros de encefalopatía con acidosis D-láctica y/o hiperamonemia.
Adaptación intestinalLa clave para la supervivencia después de una resección intestinal es la capacidad de adaptación del intestino. Se ha observado que posterior a una resección intestinal extensa, se lleva a cabo un mecanismo de adaptación del intestino tanto morfológico como funcional, en el cual hay aumento de la profundidad de las criptas y alargamiento de las vellosidades intestinales para proporcionar mayor superficie absortiva. Existe hipertrofia de la mucosa e hiperplasia de los enterocitos, lo cual puede ocurrir dentro de las primeras 48 horas y continúa de meses a años, dependiendo de ciertos factores, tales como la longitud del segmento resecado y la presencia o no de válvula ileocecal y colon. En cuanto a la adaptación funcional hay incremento en la absorción de carbohidratos, proteínas, agua y electrolitos, por lo que se han buscado elementos que ayuden a mejorar ésta adaptación y los cuales se mencionan más adelante. Por otro lado, dependiendo del periodo crítico por el que esté cursando el niño con SIC serán las manifestaciones clínicas12,32.
La nutrición enteral juega un papel predominante para lograr la adaptación intestinal estimulando el trofismo intestinal, a través de los siguientes mecanismos33–35:
- 1.
Estimulacion directa de hiperplasia de los enterocitos, por la interacción del epitelio intestinal con nutrientes intraluminales.
- 2.
Estimulación de secreción de hormonas tróficas gastrointestinales (efecto paracrino).
- 3.
Estimulación de secreciones gástricas y pancreáticas con efecto trófico en el intestino.
La elevada concentración de nutrientes intraluminales estimula y mantiene la longitud de las vellosidades yeyunales y del íleon36. La regulación hormonal de la adaptación intestinal comprende la acción de hormonas en el trofismo intestinal37,38.
Se ha documentado la acción de las prostaglandinas en el proceso de adaptación intestinal, promoviendo el trofismo del enterocito, por lo contrario también se ha establecido la disminución del efecto mitogénico de algunas hormonas gastrointestinales con la inhibición de las prostaglandinas10,13,20,35,39.
El proceso global de adaptación intestinal se da en 3 fases:
- •
Fase 1 (desequilibrio hidroelectrolítico): Comprende de las 2 semanas de postoperatorio a los 2 meses. En ésta etapa, el paciente cursa con diarrea, vómito, desequilibrio hidroelectrolítico, acidosis metabólica, pérdida de peso y por lo cual, es recomendado que la alimentación sea exclusivamente por vía parenteral y cuando sea posible, valorar el inicio de estimulación enteral con uso de fórmula extensamente hidrolizada de proteínas (suero/caseína) o de aminoácidos (elemental)17. Es importante en esta etapa la vigilacia de complicaciones nutricionales, metabólicas e infecciosas presentes.
- •
Fase 2 (adaptación intestinal): Dura de 2 meses a 2 años, es donde se va a llevar a cabo el proceso propio de adaptacion intestinal y en la cual se pondrán en marcha los mecanismos compensadores (hiperplasia de enterocitos), alcanzando el 90,0% a 95,0% de los niños una adaptación intestinal para cubrir las necesidades nutricionales. En ésta etapa, la alimentación deberá ser mixta tanto enteral como parenteral, ya que la primera favorecerá la misma adaptación estimulando la producción de secreciones gastrointestinales y pancreáticas, y al mismo enterocito para la absorción de nutrimentos, así como lograr la suspensión de la alimentación parenteral. Es durante esta fase donde se debe intentar aportar la mayor cantidad de nutrimentos por la vía enteral, y lograr la suspensión de la NTP40–43.
- •
Fase 3: Abarca 2 años posteriores a la cirugía en adelante, y es la etapa en la cual los niños ya han alcanzado la adaptación intestinal, en esta debemos cuidar la estabilidad nutricional y metabólica. Así, el paciente ya se alimenta por vía enteral44.
El médico pediatra gastroenterólogo y nutriólogo que recibe un niño con el antecedente de resección quirúrgica, deberá hacerse las 4 preguntas básicas:
- 1.
¿Qué le quitaron (segmentos intestinal resecado) y por tanto, en qué condiciones y/o estado quedó, y cuál fue el procedimiento quirúrgico?
Es importante saber qué segmento del ID fue resecado, ya que por sus funciones no es lo mismo resecar yeyuno, íleon, válvula ileocecal y colon. Como hemos señalado anteriormente, el segmento de intestino con mayores funciones de absorción es el yeyuno. Asimismo es importante conocer qué tipo de anastomosis practicó el cirujano, y en qué condiciones está en el momento de iniciar el estudio del niño. En este caso es importante descartar que no exista una estenosis de la anastomosis, ya que ésta podría provocar una dilatación de asa intestinal y provocar un síndrome de asa ciega.
De la misma manera y muy importantemente habrá que saber si la resección intestinal incluyó o no la válvula ileocecal. Como se sabe, la válvula ileocecal es funcional y anatómicamente la barrera para evitar el paso de bacterias anaerobias al ID y así, provocar una contaminación duodeno-yeyunal que termina en proliferación intestinal. Además de la disminución en el tejido linfoide asociado a mucosa y placas de Peyer de mayor presencia en íleon, que disminuye el sistema inmune innato y adaptativo.
- 2.
¿Cuánto le quitaron?
Aún y cuando en un niño la resección podría no ser significativa, el acortamiento funcional del mismo lo puede ser. Sin embargo, se acepta que cuando la resección es amplia y deja ≤ 100cm de ID, esto es suficiente como para presentar manifestaciones de malabsorción moderadas y/o severas. La resección amplia más la presencia o no de la válvula ileocecal son modificadores importantes, cuando en un niño coexisten ambas situaciones45. Así, una resección que ha dejado 40cm de ID con válvula tiene una mejor evolución, que aquella sin válvula. De igual manera, una resección que ha dejado sólo 20cm sin válvula prácticamente condena al niño a una evolución fatal, pero la presencia de válvula en este podría mejorar sus expectativas de vida46,47.
- 3.
¿Por qué se lo quitaron?
¿Qué tipo de patología fue la que presentó el niño? En este sentido por ejemplo, es mucho más grave un niño con onfalocele que con gastrosquisis, aunque ambas situaciones por sí mismas implican una gravedad. En un prematuro que presentó enterocolitis necrosante, en este caso la posibilidad de crecimiento significativo del intestino y la edad temprana mejoran el pronóstico del niño48.
- 4.
¿A quién se lo quitaron?
No es lo mismo un paciente bien nutrido (eutrófico) que uno desnutrido. Sabemos los cambios gastrointestinales que presenta un niño desnutrido de tercer grado, tales como la hipoclorhidria que favorece la colonización de bacterias, la hipomotilidad intestinal ayuda a la proliferación bacteriana y traslocación, o bien, la disminución en el tamaño de las vellosidades que puede llegar a atrofia focal o total, lo que disminuye la capacidad de absorción, así como la función de barrido y/o limpieza de la adhesión bacteriana, disminución en la secreción de sales biliares y jugos pancreáticos, inmunoglobulina A, producción de moco y bicarbonato que forman parte de los mecanismo de defensa del intestino49.
Los pacientes con SIC son todo un reto para el pediatra, gastroenterólogo, cirujano, nutriólogo, enfermera, por lo que se debe establecer un manejo multidisciplinario enfocado en lograr mantener un soporte nutricional óptimo, que cubra las necesidades para el crecimiento y el desarrollo, asimismo disminuir al máximo la presencia de complicaciones a corto, mediano y largo plazo. El soporte nutricional juega un papel fundamental en el logro de la sobrevida de estos pacientes, y en casos donde el trasplante intestinal sea necesario50.
- a)
Nutrición parenteral: La NPT desde su implementación en 1.968, ha modificado sustancialmente la evolución de los pacientes con SIC, al ser una vía de administración de macro y micronutrimentos, electrolitos y agua aportando los requerimientos nutricionales durante las fases más críticas, y permitiendo llegar a la adaptación intestinal1,9. Tiene importancia fundamental principalmente en la primera etapa de adaptación intestinal, ya que en ésta existe una hipermotilidad intestinal y malabsorción de macronutrimentos, líquidos y electrólitos que deben aportarse por vía parenteral. De acuerdo a la evolución del paciente, se valora la alimentación de tipo mixto (enteral y perenteral) y en la cual la NPT continua jugando un papel importante facilitando la disponibilidad de vitaminas, minerales e incluso la glutamina considerada el “combustible del enterocito”, la cual participa en muchas funciones que el enterocito lleva a cabo para la digestión y absorción. Sin embargo, la NPT se asocia a complicaciones hepáticas importantes: hepatopatía secundaria a NPT y colestasis, donde se han realizado modificaciones en la preparación de los lípidos de la NTP para disminuir las mismas. El uso de preparaciones de lípidos a base de aceite de pescado han reportado una reducción en las cifras de colesterol, colesterol de baja densidad, menor duración en la recuperación de la colestasis (p<0,002) en comparación con lípidos a base de aceite vegetal, y se ha reportado una reducción en la mortalidad (10,0% vs 35,0%)9,51–54.
- b)
Hidrolizados extensos de proteínas y elementales: La elección de la alimentación oral y/o enteral depende del conocimiento de los efectos de la resección intestinal. Se ha observado que los pacientes con SIC se adaptan mejor cuando son alimentados con hidrolizados extensos de proteínas (semielementales), ya que la mayoría de éstos además de no contener lactosa y tener triglicéridos de cadena media (40,0% a 55,0%), con una porción de ácidos grasos de cadena larga que contribuyen a la adaptación intestinal, están compuestos por péptidos y oligopéptidos mejor absorbidos, por difusión facilitada y no estimulan la secreción pancreática7,9,51,55–58. En casos de resecciones extensas, con cuadros de malabsorción y desnutrición severa a pesar del uso de fórmulas extensamente hidrolizadas, se pueden utilizar las fórmulas de aminoácidos o elementales donde se sospeche sensibilización con proteína de leche de vaca secundario al estado inflamatorio intestinal con aumento en la permeabilidad intestinal.
- c)
Agentes que controlan la hipersecreción de acidez gástrica: El uso de los agentes inhibidores de secreción de ácido se establece en las fases iniciales posquirúrgicas, en pacientes con resección ileal y esteatorrea por inhibición en la activación de sales biliares.
- •
Antagonistas de receptores de histamina tipo 2: Inhiben la secreción de ácido por la vía de la histamina, con un pico de concentración en suero en 30 minutos, con la desventaja de desarrollar taquifilaxia después de 6 semanas de tratamiento, no disminuyen el escape nocturno de ácido clorhídrico. Se puede utilizar a dosis de 3-10mg/Kg/d de forma oral o intravenosa en 2 o 3 dosis, dependiendo de la vía.
- •
Inhibidores de bomba de protones: Bloquean la secreción ácida del estómago al unirse de manera covalente e irreversible su metabolito activo (sulfonamida cíclica) a la bomba de protones H+K+ ATP asa, inhibiendo las 3 vías de producción de ácido (histamina, gastrina y acetilcolina) durante 24 horas, no desarrolla taquifilaxia a diferencia de los antagonistas H2, lo que confiere superioridad sobre los demás inhibidores de ácido, disminuye el volumen intragástrico y mantiene su efecto durante 24 horas. Se utiliza a dosis de 1-2mg/Kg/d cada 24 horas, por vía oral o intravenosa.
- •
- d)
Agentes que actúan sobre la motilidad gastrointestinal: Existen medicamentos como la loperamida, que interfiere con la peristalsis mediante la acción directa sobre los músculos circulares intestinales reduciendo su motilidad, y también actúa reduciendo la secreción de fluidos y de electrólitos, aumentando la absorción de agua. Al aumentar el tiempo de tránsito y reducir la pérdida de líquidos, la loperamida aumenta la consistencia de las heces y reduce el volumen fecal, sin embargo, en pacientes que presentan dilatación intestinal y aumento del tránsito intestinal podrían ser factor de riesgo para la presencia de proliferación bacteriana9.
- e)
Agentes o medicamentos para el control de la proliferación bacteriana:
- •
Metronidazol: Útil principalmente en ausencia de válvula ileocecal, que favorece el paso de bacterias del colon al ID (contaminación bacteriana). A dosis de 30mg/Kg/d vía oral, durante 10 a 14 días y se puede alternar con trimetoprim con sulfametoxazol para disminuir resistencias bacterianas8,59.
- •
Trimetoprim con sulfametoxazol: Se puede utilizar de forma intraluminal en casos de sospecha de proliferación bacteriana, a dosis de 10mg/kg/d cada 24 horas60–62.
- •
- f)
Uso de enzimas pancreáticas: La presencia de esteatorrea y malabsorción de grasas es debida principalmente a factores asociados a la desnutrición y resección intestinal. Se observa déficit de enzimas pancreáticas por ausencia de secreción de enterocinasa por el enterocito (duodeno), y además por la hipergastrinemia secundaria, la cual no permite ante un pH ácido la activación de dichas enzimas, además de la disminución de sales biliares en casos de resección ileal, con disminución de la circulación enterohepática y la desconjugación de las sales biliares por proliferación bacteriana, condicionando esteatorrea. Por lo cual, éstas deben ser suplementadas vía oral (pancreolipasa) y cuya dosis dependerá el grado de malabsorción que revele la química en heces, por lo que puede variar de 1.000 a 10.000 UI/Kg/día sin sobrepasar ésta última, ya que su uso se ha asociado a estenosis colónica63.
- g)
Agentes coleréticos: Se utilizan ya que en niños con SIC disminuye el “pool” de sales biliares, y porque generalmente requieren NTP por tiempo prolongado, lo que puede ocasionar colestasis o incluso daño hepático irreversible64.
- •
Ácido ursodesoxicólico (AUDC): El AUDC es una sal biliar terciaria, que está presenta en 1,0% a 5,0% de las sales biliares del ser humano, se sintetiza a partir de sales de oso pardo. Inicialmente utilizado para disolver cálculos biliares, actualmente se utiliza además en el tratamiento de la cirrosis biliar primaria y como terapia adyuvante diversos tipos de enfermedades colestásicas hepatobiliares. El AUDC actúa en el hígado, la bilis y el intestino. Cuando se administra en dosis de unos 15mg/d, constituye aproximadamente el 15,0% de todos los ácidos biliares. Además de competir por las sales biliares desconjugadas, disminuye el daño citotóxico en el enterocito y hepatocito estimulando el flujo biliar. Chen et al. realizaron un estudio retrospectivo reportaron una disminución más rápida de bilirrubinas en pacientes con AUDC 10-30mg/Kg/d, en comparación con los controles (62,8 vs 92,4 días), sin impacto en la duración de NPT. San et al. en una revisión sistemática concluyen que el AUDC mejora los signos y síntomas de la hepatopatía secundaria a NPT, y en corto plazo mejoran los marcadores bioquímicos7,9,65.
- •
Fenobarbital: Indicado en casos de hepatopatía y/o colestasis secundaria a uso de NPT. Ejerce su acción al potenciar la inhibición sináptica por interacción con un lugar específico sobre el complejo receptor GABA-canal de cloro. Dicha interacción conduce a un aumento de la afinidad del GABA endógeno por su receptor y, como consecuencia, se prolonga el tiempo de apertura del canal de cloro. Se ha comprobado su utilidad en pacientes con síndrome colestásico a dosis de 3-5mg/Kg/d, ya que favorece la movilización del árbol biliar, relaja el esfínter de Oddi y así la excreción de bilirrubinas y la eliminación de éstas también por orina, estimula la enzima glucoroniltransferasa66.
- •
Colestiramina: Es una resina de intercambio iónico que se ha utilizado en diarrea colerética presente en pacientes con SIC. La resina de colestiramina libera un ión cloruro y se combina con los ácidos biliares presentes en el intestino, para formar complejos insolubles que se excretan en las heces. Como es sabido, los ácidos biliares son reciclados en la circulación enterohepática, siendo reutilizados para la síntesis del colesterol. Al inhibir la recaptación de los ácidos biliares, se estimula la síntesis endógena de colesterol mediante la HMG-CoA reductasa. El nuevo colesterol no permanece en el plasma, sino que es utilizado para reponer los ácidos biliares secuestrados. Se puede utilizar a dosis de 200-240mg/Kg/d67.
- •
- h)
Otros medicamentos, vitaminas y simbióticos:
- •
Octreótide: Es un octapéptido sintético de la somatostatina. Inhibe la secreción patológicamente aumentada de la hormona de crecimiento (GH), de los péptidos y serotonina producidos dentro del sistema endocrino gastroenteropancreático. Inhibe la liberación de GH, la liberación posprandial de insulina, glucagón, gastrina, otros péptidos del sistema gastroentéricopancreático y la liberación de insulina y glucagón estimulada por la arginina, la liberación de la hormona tirotropa (TSH) estimulada por la hormona liberadora de tirotropina (TRH). Disminuye la circulación esplácnica y se usa para control de la diarrea, en casos de SIC. Sin embargo, su uso en pediatría aún merece ciertas consideraciones por el riesgo de isquemia intestinal.
- •
Vitaminas hidrosolubles: En consecuencia a la poca superficie de absorción, existe déficit de vitaminas y minerales incluso malabsorción de vitamina B12, la cual se absorbe en íleon terminal junto con el factor intrínseco.
- •
Vitaminas liposolubles: En niños con SIC, especialmente cuando el íleon fue resecado, hay déficit de vitaminas liposolubles y por lo cual deben ser suplementadas: vitamina A, E, D y K (ésta última se produce por acción de bacterias colónicas).
- •
Hormona del crecimiento: La GH con la cual se han realizado estudios que demuestran que administrada con glutamina más modificaciones en la dieta, mejora la absorción de electrolitos únicamente, sin embargo hay otros que demuestran que a dosis de 0,14mg/Kg/d administrada por 3 semanas con glutamina y dieta modificada, incrementa la absorción de agua, electrolitos, aminoácidos y glucosa, pero no de grasas. Se han utilizado otras alternativas como el péptido 2 similar al glucagón, el cual retrasa el vaciamiento gástrico, mejora la absorción de nitrógeno, aumenta la profundidad de las criptas y la longitud de las vellosidades. Se han usado en animales IGF-1 y EGF para promover la actividad mitogénica68,69.
- •
Probióticos: La administración de prebióticos, probióticos y simbióticos podría ser de utilidad en estos enfermos70. Se ha estudiado el efecto de los simbióticos en pacientes con SIC principalmente Bifidobacterium breve, Lactobacillus casei y galactooligosacáridos (GOS), encontrando que mejoran los niveles de prealbúmina así como la velocidad de ganancia de peso y talla, incluso aumentan los niveles de ácidos grasos de cadena corta liberados por el colon, favoreciendo la proliferación celular del epitelio intestinal, producción de mucina, de enzimas pancreáticas, estimula la motilidad intestinal, disminuye la apoptosis de las células epiteliales y reducen la proliferación bacteriana71.
- •
Factor de crecimiento similar a insulina: La insulina es una hormona enterotrófica que promueve la proliferación del enterocito después de una resección intestinal, incluso se ha visto incremento en la actividad de sacarasa y maltasa72.
- •
Teduglutide: Es análogo del péptido-2 similar al glucagón, que es capaz de restaurar la integridad funcional y estructural del intestino, promoviendo la reparación de la mucosa intestinal y disminuyendo el vaciamiento y secreción gástrica, así como incrementando la absorción de líquidos y nutrientes. Se ha demostrado que reduce el soporte nutricional parenteral en pacientes con SIC73.
- i)
Tratamiento quirúrgico: Las opciones actuales de cirugía en pacientes con SIC incluyen la conservación del intestino, elongación del mismo y trasplante intestinal9,73–77.
- i)
- •
Conservación de ID: La primera cirugía debe tener como objetivo, limitar lo más posible la pérdida de segmento intestinal. En casos donde la viabilidad del intestino está en duda, se puede realizar una segunda cirugía en 24 horas. Con este abordaje quirúrgico, el intestino aparentemente viable es manejado conservadoramente y es revalorado en un segundo tiempo quirúrgico, donde sólo la(s) porción(es) francamente necróticas son resecadas. En caso de la atresia intestinal con< 35cm de ID, se puede realizar una enteroplastía transversa en serie, reanastomosando el segmentos proximal dilatado con el segmentos distal. La anastomosis y cierre de estoma se asocia con una mayor recuperación y suspensión de la NPT.
- •
Cirugía de elongación de ID: La elongación intestinal longitudinal fue introducida en 1.98073–77, con el concepto de que el segmento dilatado está rodeado de 2 hojas de mesenterio y separándolas cuidadosamente, cortando y realizando una anastomosis, se puede elongar y ajustar la porción dilatada del intestino. En 2.003, surgió la enteroplastía transversa en serie (STEP)73–77. Se ha asociado la cirugía de STEP con mejoría en la absorción de nutrimentos, aumento en el área de superficie de absorción, determinado con niveles de citrulina elevados. En una revisión reciente presentada en la Reunión anual de la Academia Americana de Pediatría 2.010, se presentaron >100 procedimientos de STEP, donde 50,0% de los pacientes con falla intestinal refractaria a manejo médico, lograron la adaptación intestinal y alimentación enteral en un tiempo de 2 años30.
- •
El trasplante intestinal: El primer trasplante exitoso en bloque hígado-intestino en un paciente con SIC, se realizó en 1.99074. Se ha vuelto una opción técnicamente posible en neonatos con SIC. Está indicado en pacientes con falla intestinal y hepatopatía secundaria irreversible. Las complicaciones asociadas son: infección, rechazo crónico del injerto y enfermedad linfoproliferativa postrasplante. El trasplante en bloque hígado-intestino aun así, se considera como última opción en pacientes con SIC78.
- •
Las complicaciones más frecuentes en pacientes con SIC son nutricionales, metabólicas e infecciosas (tabla 4).
Complicaciones de síndrome de intestino corto en niños
| Infecciones relacionadas a catéter venoso central |
| Desnutrición. Deficiencias de vitaminas y minerales |
| Hipergastrinemia |
| Alteraciones óseas (enfermedad ósea metabólica) |
| Hepatopatía secundaria a nutrición parenteral/colestasis |
| Colitis (proliferación bacteriana) |
| Detención de crecimiento |
| Sepsis |
Adaptado de Barclay AR et al.10.
La desnutrición crónica en pacientes con SIC tiene múltiples factores de riesgo: prematurez, bajo peso, presencia de cardiopatías, neumopatías, diarrea con malabsorción, intolerancia vía oral/enteral, infecciones recurrentes, y son condiciones que aumentan los requerimientos calóricos totales, aunado a la alteración en la digestión y/o absorción de nutrimentos por vía enteral, ayunos prolongados y la imposibilidad de llegar a los requerimientos nutricionales a pesar de NPT, por limitaciones en el volumen total de líquidos que se pueden suministrar.
Otra complicación es la hepatopatía secundaria a falla intestinal y por NPT. La toxicidad por NPT es un factor importante, donde se puede valorar el efecto de colestasis a partir de 10 a 14 días después del inicio de la NPT, asociado a la cantidad y tipo de lípidos. El daño hepático se caracteriza por elevación de bilirrubina directa (colestasis) y aminotransferasas, prolongación del tiempo de protrombina e INR. Puede asociarse con hepatoesplenomegalia y datos de hipertensión portal. La medición seriada de pruebas de función hepática en cada semana es necesaria en pacientes con SIC y NPT. La mejoría de la hepatopatía secundaria a falla intestinal generalmente se asocia con el inicio de la estimulación enteral, uso de agentes quelantes de sales biliares, ciclado de la NPT con resolución clínica, bioquímica (bilirrubina total y directa) y posteriormente de las aminotransferasas. Puede existir a nivel histopatológico daño en el hígado (fibrosis/cirrosis) en grado leve a moderado, el cual puede ser reversible4,9,73,79,80.
Quizás de las complicaciones más frecuentes y riesgosas en pacientes con SIC, que puede ser determinante para la suspensión del aporte calórico-proteico por NPT son las infecciones relacionadas con el catéter. Esto complica el curso de la adaptación intestinal, aumenta los requerimientos energéticos y eleva el riesgo de mortalidad. Los elementos clave como son el sitio de inserción de catéter, tipo y tamaño, el mantenimiento de una adecuada técnica de asepsia/antisepsia, son obligados para disminuir la presencia de infecciones relacionadas a catéter. Clínicamente, se manifiesta en un paciente con SIC que presente fiebre (> 38°C), letargia, irritabilidad, íleo, distensión abdominal, polipnea, palidez generalizada, datos de respuesta inflamatoria sistémica. Es mandatoria la toma de hemocultivos centrales y periféricos, PCR y el inicio de antibióticos contra los gérmenes entéricos. Infección por hongos e inestabilidad hemodinámica es indicación absoluta de retiro de catéter central. Una medida terapéutica novedosa para la prevención de infecciones asociadas a catéter es el candado de etanol, que penetra el biofilm bacteriano que se forma en el catéter y ninguna bacteria u hongo es resistente al etanol81,82.
La proliferación bacteriana ocurre en 60,0% de pacientes con SIC, con mayor frecuencia en pacientes sin válvula ileocecal, en áreas con dilataciones intestinales e hipomotilidad. Las manifestaciones clínicas son: dolor abdominal, alteraciones de la motilidad (íleo), úlceras mucosas con sangrado de tubo digestivo, desconjugación de sales biliares, translocación bacteriana y septicemia4,8.
El síndrome del asa ciega ocurre cuando se reseca parte del intestino, de tal forma que el alimento digerido se demora o deja de movilizarse a través de éste, lo que causa proliferación bacteriana y lleva a que se presenten problemas en la absorción de nutrientes. Dicha asa ciega no permite el flujo normal del alimento digerido a través del tubo digestivo. Se caracteriza por la presencia de esteatorrea, deficiencia de vitamina B12, distensión abdominal y detención de crecimiento.
ConclusionesComo puede apreciarse, el diagnóstico y manejo de un niño con SIC implica un equipo de profesionales expertos en el manejo gastrointestinal, pediátrico y nutricional. El pronóstico del niño estará en función al manejo oportuno, así como a la longitud de la resección intestinal y a la presencia o no de la válvula ileocecal.
FinanciamientoNo hubo financiamiento para la realización de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Jorge Romero por colaborar proporcionando información sobre el tema para la realización de este artículo. Al personal de archivo clínico, que permitió tener acceso a los expedientes clínicos para enriquecer la información y entendimiento del tema.