Introducción
El síndrome de intestino irritable (SII) es un trastorno heterogéneo que puede afectar a 10% a 20% de la población mexicana.1 Debido a su elevada prevalencia, la cronicidad de sus síntomas y el efecto en la calidad de vida, sus consecuencias socioeconómicas son enormes.2,3 Hoy en día, el diagnóstico de SII se considera un diagnóstico "positivo" y no de exclusión, lo cual significa que se basa en la presencia de síntomas o criterios característicos. Dado que no existen biomarcadores en el SII, se han ideado a través de los años criterios clínicos basados en estos síntomas. En la actualidad, los más utilizados son los criterios de Roma II, aunque desde el año 2006 están disponibles los nuevos criterios de Roma III,4 que se encuentran en proceso de traducción y validación para las naciones hispanoparlantes. En esencia, la propuesta novedosa de los criterios de Roma III radica en subclasificar a los pacientes de acuerdo con las formas de las evacuaciones con base en la escala de Bristol;5 en consecuencia, el SII se clasifica en SII con diarrea (SII-D), SII con estreñimiento (SII-C) y SII con síntomas alternantes de diarrea y estreñimiento o mixto (SII-M).
Se considera que el manejo actual de un paciente que sufre síntomas de SII debe ser un tratamiento "integral" enfocado en la mejoría global de los síntomas y la calidad de vida, con un adecuado perfil de seguridad. El tratamiento puede basarse en el síntoma más molesto (dolor abdominal o distensión), el hábito intestinal predominante (diarrea o estreñimiento) o la fisiopatología de la enfermedad (comorbilidad psiquiátrica, hipersensibilidad visceral, etc.).
En general, dentro de los fármacos utilizados para la atención habitual del SII figuran los antiespasmódicos, laxantes, antidiarreicos, analgésicos viscerales y antiflatulentos. En fecha más reciente se ha demostrado que el uso de antibióticos, probióticos y agentes que actúan sobre los receptores de serotonina y canales del cloro pueden ser útiles para el control del SII.
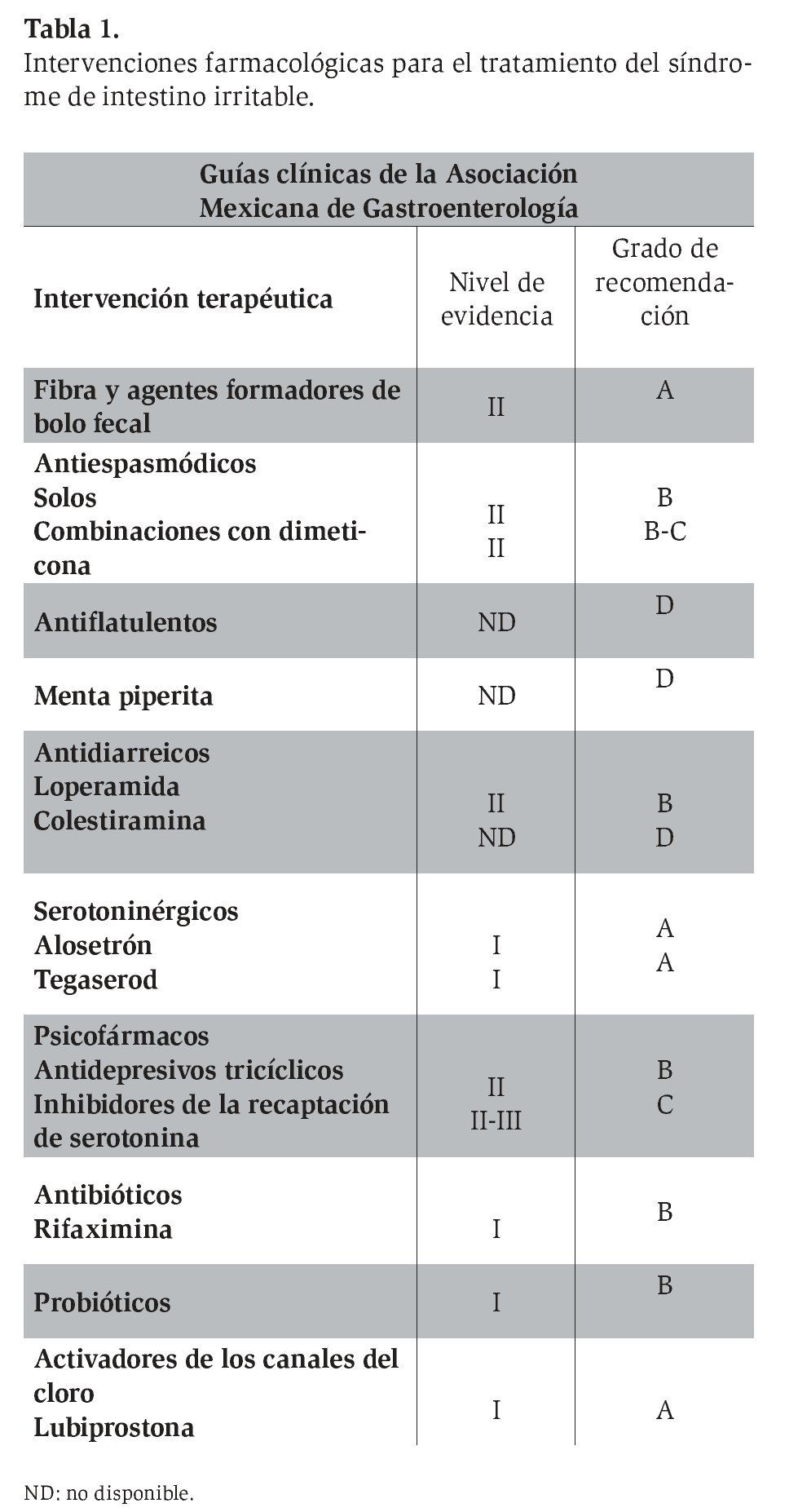
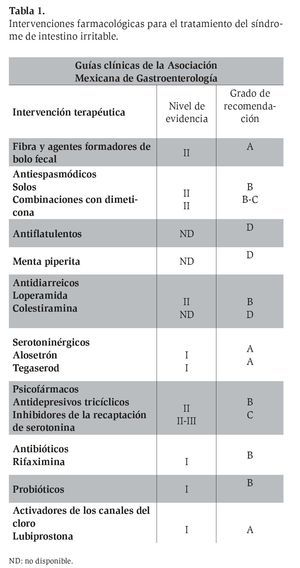
La Asociación Mexicana de Gastroenterología6 publicó a últimas fechas las guías clínicas de diagnóstico y tratamiento del SII, en las cuales se emiten las recomendaciones específicas para el uso de cada una de las intervenciones terapéuticas en el tratamiento de los pacientes con SII (Tabla 1).
El objetivo de la presente revisión técnica es describir los fármacos que se recomiendan hoy día en el tratamiento del SII, sus mecanismos de acción, efectos adversos, riesgos y beneficios, contraindicaciones, disponibilidad en México y la evidencia que apoya su administración.
Material y métodos
Se realizó una revisión técnica y narrativa que valoró los artículos publicados en la bibliografía nacional y mundial acerca del tratamiento farmacológico del SII. Para ello se llevó a cabo una búsqueda cruzada a través de los portales de Pub Med e IMBIOMED (hasta septiembre de 2009) de los siguientes términos con la finalidad de identificar los tratamientos farmacológicos del SII: SII, tratamiento, antiespasmódicos, anticolinérgicos, fibra, laxantes, lactulosa, polietilenglicol, docusato de sodio, senna, espasmolíticos, antiflatulentos, aceite de menta, antidiarreicos, loperamida, mebeverina, alverina, pinaverio, otilonio, cimetropio, butilhioscina, diciclomina, trimebutina, lidamidina, fenoverina, simeticona, dimeticona, agonistas serotoninérgicos, antagonistas serotoninérgicos, receptores 5-HT3, receptores 5-HT4, tegaserod, alosetrón, cilansetrón, lubiprostona, antibióticos, probióticos, rifaximina, antidepresivos tricíclicos, psicotrópicos, desimipramina, imipramina, amitriptilina, doxepina, fluotexina, paroxetina, inhibidores de la recaptación de serotonina, citalopram, escitalopram, velafaxina, tratamiento médico y México.
Se revisaron también los resúmenes publicados de los mismos tópicos en los suplementos de la Revista de Gastroenterología de México durante las Semanas Nacionales de Gastroenterología de los años 2000 a 2008. Por último, para determinar la disponibilidad de los fármacos en México, se revisó el Diccionario de Especialidades Farmacéuticas PLM, edición 55, del año 2009.
Todos los artículos identificados se agruparon de acuerdo con los siguientes nueve grupos de medicamentos: a) antiespasmódicos, b) antiflatulentos y menta piperita, c) laxantes, d) antidiarreicos, e) agentes serotoninérgicos, f) psicofármacos, g) antibióticos, h) probióticos e i) nuevos agentes farmacológicos. Con posterioridad, a cada autor se le envío toda la información disponible de alguno de los nueve grupos de medicamentos, la cual se revisó en un lapso de seis semanas y se pidió que se resumiera la información más relevante tras considerar para cada grupo de fármacos los siguientes tópicos: a) mecanismos de acción y efecto adversos, b) evidencia clínica, c) disponibilidad en México y d) conclusiones. A continuación se realizó un taller de dos días durante la Reunión Regional Centro de la Asociación Mexicana de Gastroenterología (10 y 11 de julio de 2009), en la que de forma sinóptica se analizaron las consideraciones de cada uno de los grupos de medicamentos. Al final se redactó el presente documento con la aprobación de todos los autores.
A) Antiespasmódicos
Los antiespasmódicos, también llamados espasmolíticos, son un grupo de sustancias que previenen o interrumpen los espasmos del músculo liso intestinal, uno de los mecanismos referidos en la génesis del dolor en sujetos con SII.7 En México son los agentes más utilizados de manera inicial para tratar el dolor o el malestar abdominal vinculados con el SII.8,9
A1. Mecanismos de acción y efectos adversos
Los antiespasmódicos se clasifican en varios grupos, de acuerdo con su mecanismo de acción (Tabla 2):7-10
Agentes relajantes directos del músculo liso. Estos fármacos actúan sobre las miofibrillas del músculo liso del aparato digestivo, reducen el tono y el peristaltismo y alivian los espasmos intestinales sin afectar de forma sustancial la motilidad gastrointestinal. A este grupo pertenecen la mebeverina, la trimebutina y los agentes derivados de la papaverina. Los efectos secundarios de esta clase de medicamentos son muy raros e incluyen cefalea y mareo.11
Antiespasmódicos anticolinérgicos. Este subgrupo de antiespasmódicos atenúa los espasmos o contracciones en el intestino y por lo tanto tiene el potencial de reducir el dolor abdominal. En este grupo se incluyen la butilhioscina, hioscina, hiosciamina, levsina, dicicloverina, butilescopolamina y bromuro de cimetropio. Los efectos secundarios más comunes de los anticolinérgicos son cefalea, mareo, visión borrosa, disuria, disminución de la sudación, exantema y xerostomía. Debido a ello, en Estados Unidos algunos anticolinérgicos se emplean en combinación con clorodiazepóxido para disminuir los efectos secundarios.11
Agentes bloqueadores de los canales del calcio. Los antagonistas del calcio relajan el intestino al prevenir la entrada de calcio en las células del músculo liso intestinal. Dado que el calcio desencadena la cascada de sucesos que activa la contracción muscular, la inhibición del calcio en las células causa relajación intestinal. Este grupo de medicamentos, al reducir el índice de motilidad, puede disminuir el reflejo gastrocólico y modificar el tiempo de tránsito colónico. A este grupo pertenecen el bromuro de pinaverio, bromuro de otilonio, alverina, fenoverina, rociverina y pirenzepina.
Las reacciones secundarias de los antagonistas del calcio como clase pueden incluir náusea, exantema, diarrea y xerostomía. En el caso de la fenoverina, se han descrito casos de miositis y rabdomiólisis con insuficiencia renal secundaria.11
Antiespasmódicos en combinación. En fecha reciente se han utilizado en México combinaciones de agentes relajantes directos de músculo liso y antagonistas del calcio con dimeticona o simeticona, sustancias tensoactivas que disminuyen la formación de gas gastrointestinal mediante una acción directa sobre la tensión superficial de las burbujas de gas, tras desintegrar dichas burbujas y evitar su formación, por lo que se han usado de modo adicional para mejorar la distensión abdominal relacionada y reducir la expulsión de flatos.
A2. Evidencia clínica
Antiespasmódicos. A través del tiempo, se han publicado diferentes revisiones y meta-análisis que intentan establecer la utilidad de los antiespasmódicos en el SII y otros trastornos funcionales digestivos con resultados controversiales. La explicación de esta variabilidad de resultados guarda relación con varios problemas de diseño de estos protocolos. Además de la diversidad de antiespasmódicos empleados en los meta-análisis, existen varios problemas adicionales que hacen difícil inferir conclusiones objetivas, como la heterogeneidad de los pacientes estudiados, la aplicación de diferentes criterios clínicos, las dosis y duración del tratamiento y los distintos análisis metodológicos.12
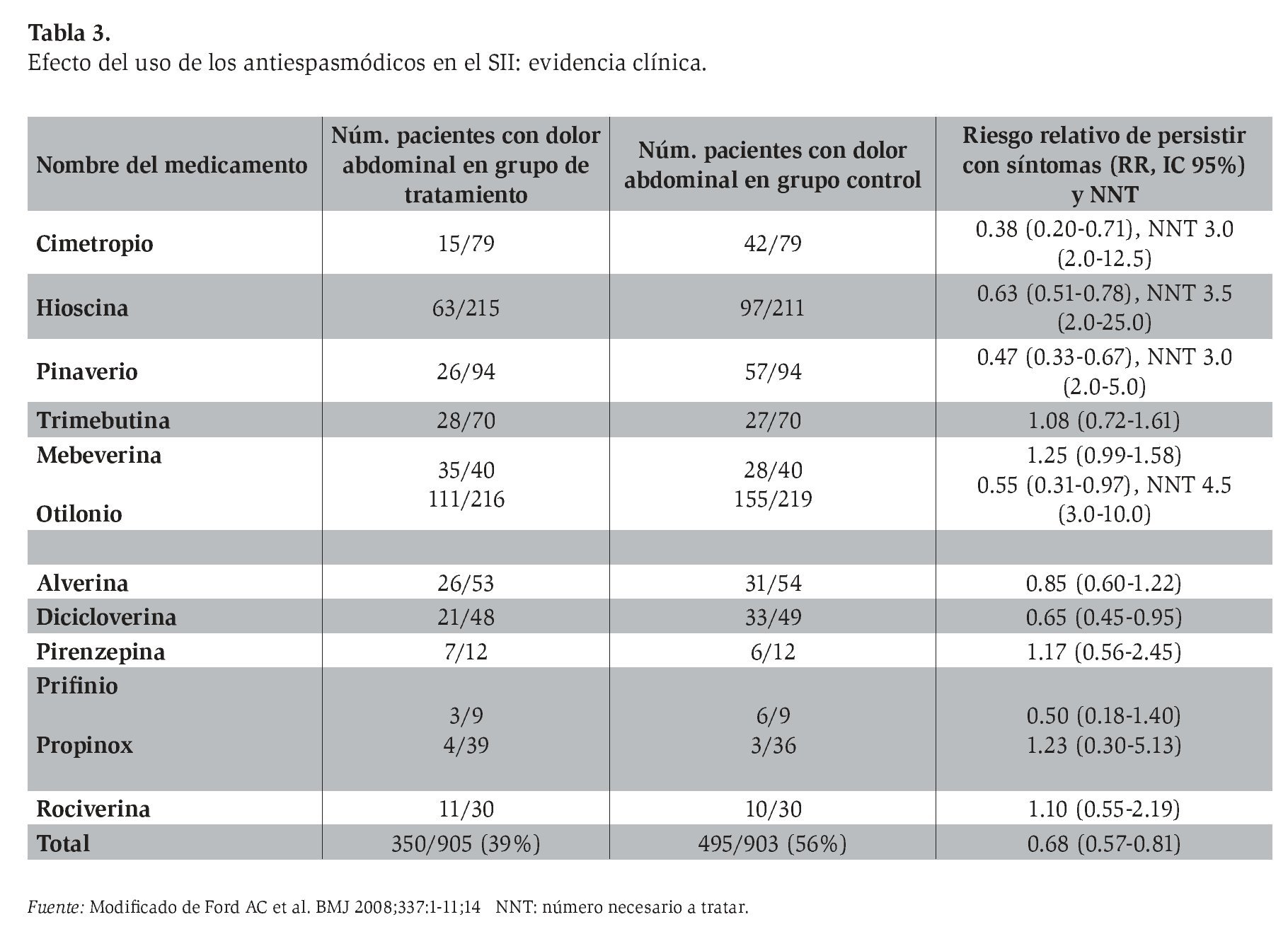
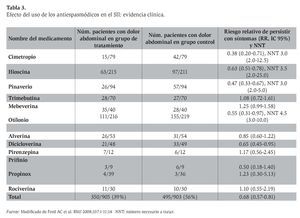
En una revisión de la utilidad de los antiespasmódicos disponibles en Europa,13 en donde se valoraron 18 estudios (Tabla 3), la mayoría de los cuales era de calidad baja a intermedia, y algunos eran pequeños y no se ajustaron a los criterios de Roma, sólo nueve mostraron una mejoría estadísticamente significativa de la atenuación del dolor abdominal al compararse con placebo (uno con pinaverio, dos con otilonio, tres con cimetropio, dos con trimebutina, uno con rociverina y uno con mebeverina). Tan sólo tres protocolos mostraron evidencia de mejoría global de los síntomas del SII (los tres con bromuro de cimetropio) y únicamente dos estudios reportaron mejoría de la función intestinal (uno con pinaverio y otro con cimetropio). Con base en estos resultados, los autores concluyen que existe un nivel de evidencia II en el uso de antiespasmódicos para el dolor abdominal, aunque no tienen el sustento suficiente para concluir una mejoría global sintomática en el SII.
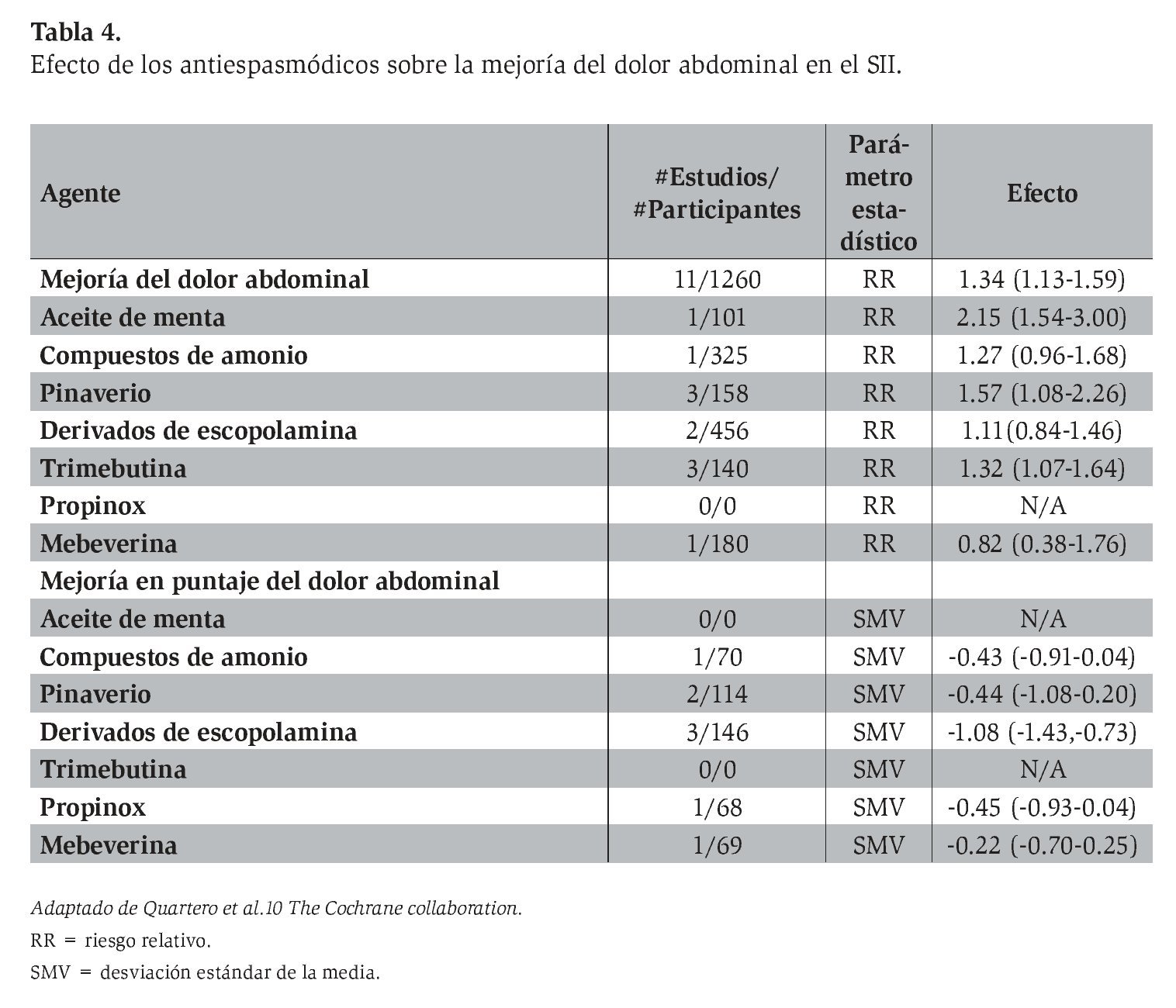
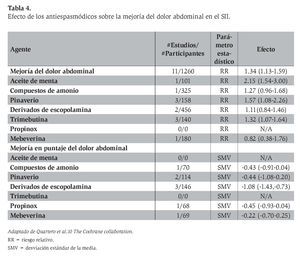
El meta-análisis publicado más reciente,14 que evaluó el efecto de la fibra, los antiespasmódicos y el aceite de menta en el SII, incluyó estudios aleatorizados controlados con placebo en adultos mayores de 16 años, con una duración mínima de tratamiento de una semana, y que analizan la valoración global, la curación o la mejoría de los síntomas, incluido el dolor abdominal, durante y después del tratamiento. Se evaluaron 22 estudios con 1 778 pacientes que incluyeron varios antiespasmódicos (pinaverio, trimebutina, prifinio, hioscina, otilonio, dicicloverina, mebeverina, cimetropio, pirenzepina, propinox y alverina).
El efecto de todos los antiespasmódicos valorados en este meta-análisis se muestra en la Tabla 4. Al incluir sólo 12 estudios con un puntaje de calidad de Jadad de 4 o mayor, el efecto benéfico persistió, con un riesgo relativo (RR) de 0.65 (IC 95%: 0.48-0.89), si bien se observó heterogeneidad entre estudios y sesgo de publicación. De los fármacos estudiados, la mayor cantidad de datos disponible se distribuye entre cinco agentes: otilonio, cimetropio, trimebutina, hioscina y pinaverio. De éstos, sólo la trimebutina parece no diferenciarse del placebo, mientras los otros cuatro redujeron de manera significativa el riesgo de síntomas persistentes en el SII al compararse con placebo.
Por último, una revisión de Cochrane publicada en fecha reciente analizó la eficacia de los antiespasmódicos como grupo y evaluó la utilidad de cada subgrupo por separado.10 El análisis incluyó 310 publicaciones, de las cuales se evaluaron 24 estudios después de excluir trabajos no originales, no aleatorizados y no controlados. Las conclusiones más importantes son las siguientes:
11 estudios con un total de 1 260 pacientes reportaron mejoría del dolor abdominal, con un RR de 1.34 (IC 95%: 1.13-1.59), RD de 0.17 (IC 95%: 0.06-0.28) y NNT de 6 (4.0-15.0). Al subdividir los subgrupos de acuerdo con el tipo de fármacos se observó un beneficio estadísticamente significativo para el bromuro de pinaverio (RR 1.57, 1.08-2.26), y trimebutina (RR 1.32, 1.07-1.64), pero no para los derivados de la escopolamina. Los otros subgrupos sólo incluyeron un estudio cada uno.
16 estudios con 1 236 pacientes notificaron una mejoría sintomática global. Mediante un modelo de efectos aleatorios, el RR fue de 1.42 (IC 95%: 1.17-1.72), RD de 0.20 (IC 95%: 0.09-0.30) y NNT de 5.0 (3.0-11.0). A partir de un modelo de efectos fijos, el RR fue de 1.34 (IC 95%: 1.21-1.49). Se observaron diferencias estadísticas por grupo en el caso del bromuro de pinaverio (RR 2.16, 1.54-3.02) y de los derivados de la escopolamina (RR 1.55, 1.14-2.11).
Antiespasmódicos en combinación. A últimas fechas se han utilizado en México combinaciones de antiespasmódicos con dimeticona o simeticona. El primero en evaluarse en el terreno clínico fue el bromuro de pinaverio (100 mg) junto con simeticona (300 mg). En una cohorte nacional de más de 2 000 pacientes con SII definido por criterios de Roma III, el uso de este medicamento durante cuatro semanas se vinculó con una mejoría del dolor abdominal y calidad de vida en todos los subgrupos de SII, además de que mejoró la consistencia de las evacuaciones en los subgrupos con SII-C y SII-M, y la frecuencia en los pacientes con SII-E y SII-D.15-17 Además, este mismo estudio demostró mejoría en la calidad de vida e incluso en otros síntomas gastrointestinales frecuentemente sobrepuestos, como los síntomas dispépticos.15-17
Otra combinación también disponible en México es el citrato de alverina con simeticona. Si bien los estudios iniciales aleatorizados y controlados con placebo y alverina no mostraron diferencia significativa en la mejoría del dolor,18 en fecha reciente se publicó un estudio abierto multinacional que incluyó a 894 pacientes con SII por criterios de Roma II y la combinación de alverina con simeticona se vinculó con mejoría del dolor y distensión abdominal, con cambios clínicos significativos a partir de la segunda semana de tratamiento, con mejoría cercana a 80% y con seguimientos hasta por 60 días.19
Un estudio publicado en resumen en la DDW de este año evaluó la efectividad de esta misma combinación en un grupo de 412 pacientes provenientes de 17 centros de Hungría y Polonia.20
El estudio determinó la eficacia sobre el dolor o malestar mediante una escala visual análoga en pacientes con SII por criterios de Roma III. Los pacientes recibieron la combinación de citrato de alverina (60 mg) con 300 mg de simeticona o placebo por cuatro semanas. El desenlace primario fue un cambio en la escala visual análoga. El porcentaje de respondedores, definido como una reducción de 50% en la escala visual de dolor/malestar entre las semanas 0 y 4, fue significativamente mayor en el grupo de alverina/simeticona (46.8% vs 34.3%), y se observó una ganancia terapéutica de 12.5% en comparación con el placebo, con una razón de momios (RM) de 1.3.
A3. Disponibilidad en México
Agentes relajantes directos del músculo liso. En México, la mebeverina está disponible en cápsulas de 200 mg y se prescribe una con cada alimento. Se dispone de la trimebutina en cápsulas de 200 mg, sola o en combinación con simeticona (75 mg). La pargeverina se encuentra en cápsulas de 10 mg y se administra cada 8 h.
Antiespasmódicos anticolinérgicos. En México, la butilhioscina se encuentra disponible en grageas, sola o en combinación con metamizol sódico, paracetamol o ibuprofeno y debe administrarse por corto tiempo para evitar efectos deletéreos sobre la motilidad del colon. Además, la butilhioscina se halla disponible en ampolletas de 20 mg para administración parenteral. El clorhidrato de dicicloverina (diciclomina) está disponible en cápsulas de 10 mg y se administra con los alimentos. Éste es uno de los pocos medicamentos de clase B para su administración durante el embarazo. En fecha reciente se ha puesto a disposición el bromuro de otilonio en tabletas de 40 mg y se administra cada 8 h.
Agentes bloqueadores de los canales del calcio. Los agentes bloqueadores del calcio disponibles en México son bromuro de pinaverio en cápsulas de 100 mg, solo o en combinación con 100 o 300 mg de dimeticona, y se administra cada 8 o 12 h. El citrato de alverina está disponible en cápsulas de 60 mg combinado con 300 mg de simeticona y se suministra con cada alimento. La presentación de fenoverina es la en cápsulas de 200 mg y se administra cada 8 h.
A4. Conclusiones
Existe suficiente evidencia que apoya el uso de los antiespasmódicos, solos o en combinación, para tratar el dolor en los pacientes con SII.
B) Antiflatulentos y menta piperita
Dentro de este grupo de fármacos, cuyo objetivo es la disminución de la producción de gases y por consecuencia de la distensión abdominal, figuran los compuestos como la dimeticona y el carbón activado.6,13,14,21 Aunque se emplean con frecuencia, la evidencia para apoyar su uso es muy escasa.
B1. Mecanismo de acción y efectos adversos
Simeticona. También llamada dimeticona o dimetilpolisiloxano, es una silicona inerte, con acción carminativa benéfica (ya que previene la formación de gases en el tubo digestivo y facilita la eliminación de éstos). Actúa en forma directa sobre las burbujas gastrointestinales al desintegrarlas o prevenir su formación, ya que disminuye la tensión superficial del moco gastrointestinal y evita la retención de gases, la flatulencia, la timpanización y el meteorismo.
En apariencia, puede ocasionar estreñimiento en dosis elevada, por lo que está contraindicada en la obstrucción intestinal. Sin embargo, también se ha reportado que en dosis de 300 mg bid en combinación con bromuro de pinaverio puede ocasionar diarrea.
Carbón activado. Su mecanismo de acción es la adsorción de gases presentes en el tubo gastrointestinal, a los que arrastra con él hasta que se excretan con las heces; de esta forma se eliminan los gases intestinales y se evita la distensión abdominal y el meteorismo. El problema del meteorismo, tanto para la simeticona como para el carbón activado, radica en que el paciente lo identifica como aumento de volumen abdominal o sensación de "burbuja grande a tensión" en el abdomen. No se conoce su fisiopatología, pero no parece ser el aumento del gas intestinal, sino las anormalidades en el reflejo de distensión y la propulsión del gas.22
Los efectos secundarios de este compuesto incluyen diarrea, estreñimiento, vómito y ennegrecimiento de las heces. Puede interferir con la absorción de otros medicamentos administrados de manera simultánea. También se menciona que está contraindicado en caso de disminución o ausencia de peristaltismo (como signo de inminente perforación, obstrucción o hemorragia).
Aceite de menta piperita. El aceite de menta se obtiene de la destilación de la menta X piperita L. El principio activo es el mentol, que actúa como bloqueador de los canales del calcio, con una función farmacológica similar a la de los dihidropiridínicos, antagonistas del calcio en el músculo liso. Relaja el esfínter esofágico inferior y alivia los síntomas de dispepsia; origina una reducción mensurable de los espasmos del colon durante la colonoscopia y el enema baritado.23
En un estudio mexicano realizado en 181 individuos, se reportó que 33 pacientes (18%) se quejaron de efectos secundarios.24 Los más frecuentes fueron pirosis/regurgitaciones y sabor a menta, ardor epigástrico, náusea y diarrea.
B2. Evidencia clínica
Antiflatulentos. Aunque se recomiendan para el control del meteorismo y la flatulencia, la mayoría de los expertos los considera equivalentes a un placebo.6,9,13,14 Escasos estudios demuestran su utilidad en la mejor visualización de la mucosa durante los estudios endoscópicos.
La revisión efectuada no identificó estudios que demuestren la efectividad de este grupo de agentes para el tratamiento del SII. Una revisión sistemática,9 un meta-análisis14 y las guías de manejo del ACG para el control del SII13 ni siquiera los mencionan. La guía clínica de diagnóstico y tratamiento del síndrome del intestino irritable de la AMG6 afirma que no hay estudios controlados, sólo evidencia de tipo D.
Menta piperita. Aunque existe un meta-análisis y cuatro estudios controlados con uso de ésta, existe evidencia que sustenta la administración de este compuesto en el tratamiento del SII. Se ha demostrado la efectividad a corto plazo (dos a 11 semanas) en el tratamiento del SII, si bien sólo en el meteorismo y la flatulencia. En el meta-análisis mencionado,14 aunque todos los estudios fueron de corto plazo, el riesgo relativo de permanecer asintomático bajo el tratamiento activo fue de 0.43 comparado con placebo (IC 95%: 0.32-0.59), de tal manera que el número necesario de pacientes tratados para mejorar a un paciente (NNT) es excelente: 2.5 (IC 95%: 14). El único estudio de largo plazo del uso de la menta piperita en 181 pacientes24 informó cierta mejoría en la calificación global de los síntomas a las dos semanas en 69%; al año, sólo 12% permanecía asintomático.
B3. Disponibilidad en México
La simeticona se comercializa bajo muchas marcas y a diferentes dosis (rango de 40 mg a 1 g), sola (cuatro nombres comerciales en el PLM 2009) y en combinación con alverina, guaiazuleno, metoclopramida, pinaverio, trimebutina, procinéticos, loperamida, hidróxido de aluminio y magnesio, magaldrato, diyodohidroxiquinoleína, probióticos, bilis de buey, pancreatina, etc. Al menos, se encontraron 17 nombres comerciales de productos que contienen simeticona en el PLM 2009.
El carbón activado se encuentra en tabletas de 250 mg y se pueden administrar dos a cuatro tabletas antes de cada alimento sin exceder de 16 al día. El aceite de menta se ha comercializado en el pasado, aunque por el momento no se halla disponible en México.
B4. Conclusiones
Aunque son fármacos empleados con frecuencia, la evidencia que apoya su uso es muy limitada.
C) Laxantes
Cuando el dolor y la distensión abdominal se acompañan de una baja frecuencia de evacuaciones, debe considerarse la variedad del síndrome de intestino irritable (SII), en que predoma el estreñimiento (SII-E). El SII-E, de acuerdo con los criterios de Roma III, debe presentar menos de tres evacuaciones por semana, esfuerzo con la defecación y heces duras o escíbalos en ausencia de cualquiera de los criterios que definen al subgrupo con predominio de diarrea.4,25 Además del control del dolor y la distensión como síntoma común a otros subgrupos, los pacientes con SII-E requieren a menudo apoyo de laxantes para mejorar los síntomas.
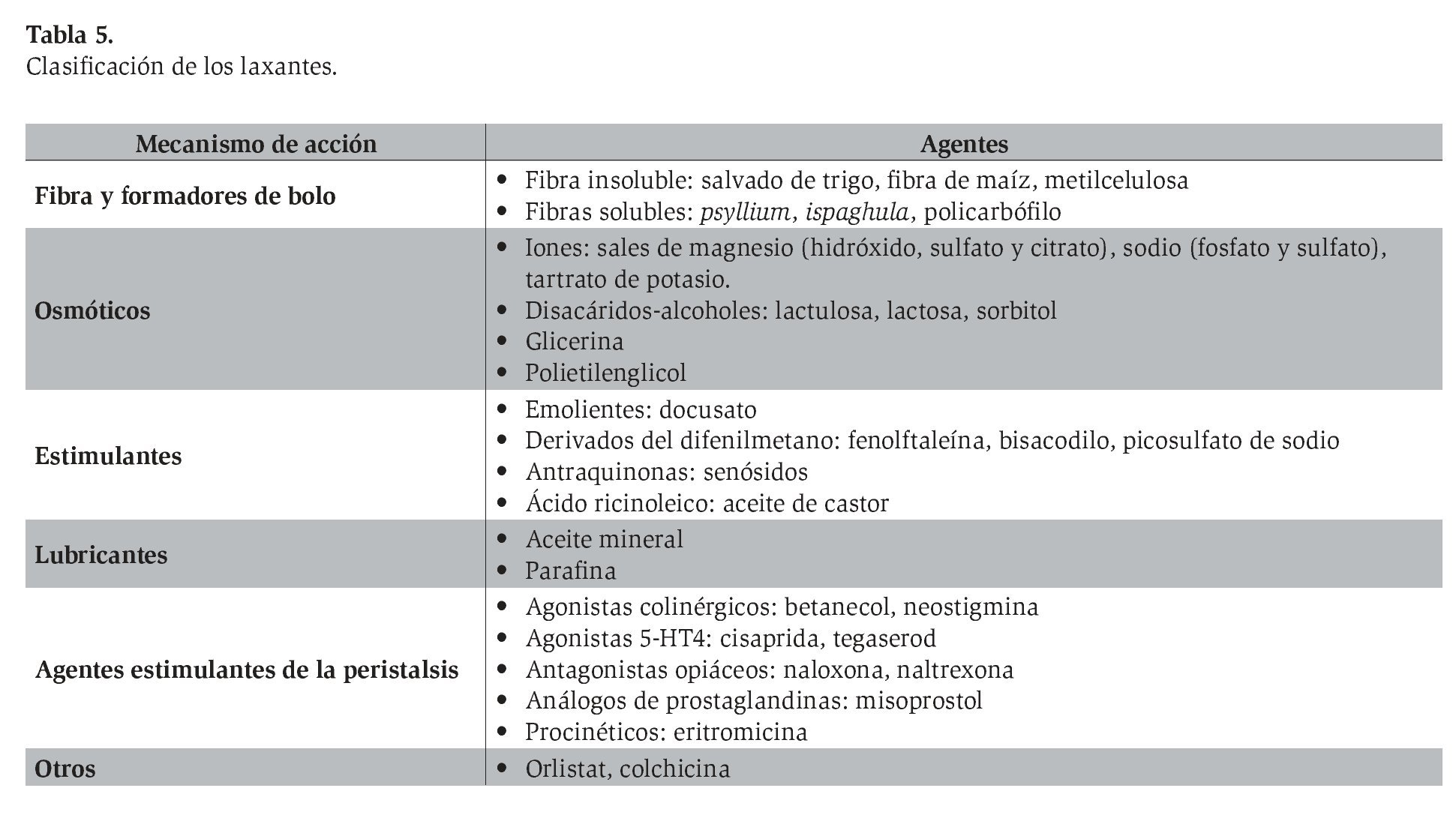
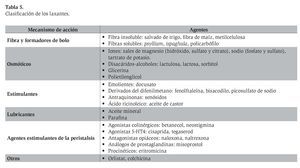
Los laxantes pueden clasificarse de acuerdo con su mecanismo de acción y propiedades químicas como sigue: formadores de bolo, osmóticos, estimulantes, lubricantes y agentes estimulantes de la peristalsis.26,27 La clasificación completa se muestra en la Tabla 5.
A estos laxantes se deben añadir algunos medicamentos con acción neuromuscular, cuya indicación primaria no es el estreñimiento pero que han mostrado efecto catártico y se han empleado con este fin. Es el caso de la colchicina, las prostaglandinas y el orlistat. A pesar de la amplia variedad de laxantes y su amplia utilización en SII-E, muy pocos se han valorado con esta finalidad.
C1. Mecanismos de acción y efectos adversos
Fibra y formadores de bolo. La fibra puede dividirse, según sea su solubilidad en agua, en soluble e insoluble.28 Las fibras insolubles incluyen a la pectina, las gomas y los mucílagos. Ciertas plantas producen goma y mucílagos que se utilizan en la industria farmacológica como agentes formadores de bolo (el guar y la isphagula). La fibra soluble se deriva sobre todo de granos y frutas y algunos cereales como la avena. La fibra soluble produce soluciones viscosas que retardan el vaciamiento gástrico, la absorción intestinal y se fermentan en el colon, hasta producir de forma secundaria ácidos grasos de cadena corta y gas. Algunos productos se emplean como formadores de bolo o suplementos como las semillas de psyllium y la metilcelulosa, mientras que otros se producen de forma semisintética como el policarbofilo de calcio.
Los efectos fisiológicos de este tipo de laxantes son la retención de agua en la luz intestinal, y por tanto el aumento de volumen de las heces, con lo que se acelera de forma secundaria el tránsito bucocecal y se disminuyen las presiones intracolónicas.
Los efectos indeseables informados con más frecuencia con el uso de los formadores de bolo son distensión y flatulencia. La fibra insoluble de trigo se ha administrado sin causar malestar abdominal en sujetos sanos, pero incrementa la distensión en pacientes con SII.28 Otros efectos indeseables graves no se han investigado ni informado en forma sistemática.
Laxantes osmóticos. Este grupo de laxantes está constituido por iones o moléculas con actividad osmótica que se absorben en escasa medida en el intestino y que incrementan la secreción de agua a la luz intestinal para mantener la isotonicidad con el plasma.26,27 Los grupos principales de laxantes osmóticos son aniones o sales no absorbibles (leche de magnesia), disacáridos no absorbibles (lactulosa) y polímeros no absorbibles (polietilenglicol).
El polietilenglicol 3 350 (PEG) es un polímero con alta actividad osmótica.27 Es inerte en el terreno metabólico y las bacterias del colon no pueden degradarlo; por esta razón, al ingerirse, produce retención de agua forzosa en la luz intestinal. Cuando se compara con la lactulosa, el PEG 3 350 es más efectivo y produce menos efectos adversos.
Los laxantes osmóticos no aniónicos incrementan la brecha osmolar en las heces a más de 50 mOsm/kg e inducen una diarrea osmótica farmacológica, que es su principal efecto adverso. Los laxantes osmóticos con base en iones de magnesio o fosfato pueden causar alteraciones metabólicas, en particular en presencia de insuficiencia renal. Efectos secundarios atribuidos a estos fármacos incluyen náusea, inflamación, flatulencia y trastornos hidroelectrolíticos.
La lactulosa, dado que es un azúcar que no se absorbe y se fermenta en el colon, se vincula con flatulencia, distensión abdominal y diarrea. Otro efecto reportado con frecuencia es su palatabilidad.
Agentes estimulantes. Los agentes que incrementan de forma directa la motilidad intestinal también se conocen como "estimulantes".26,27 Existen tres grupos de laxantes estimulantes, los difenilmetanos (fenolftaleína, bisacodilo), las antraquinonas (cáscara sagrada, senna) y el aceite de ricino. Los difenilmetanos alteran el transporte neto de líquidos y electrólitos y tienen un efecto promotor directo de la motilidad intestinal. Las antraquinonas ejercen una acción selectiva en colon, alteran el transporte epitelial de líquidos y electrólitos e incrementan la motilidad mediante el aumento de la síntesis intestinal de prostaglandinas, histamina y serotonina. El ácido ricinoleico es un ácido graso insaturado que reduce la absorción de glucosa y aminoácidos, además de ser un secretagogo en el intestino delgado y el colon.
Se ha sugerido que los laxantes estimulantes son factores iniciadores y promotores de la tumorogénesis. Se encontró mayor riesgo de neoplasia en animales con el uso de los difenilmetanos,29 pero este efecto no se comprobó en seres humanos.30,31 El uso prolongado de laxantes estimulantes induce cambios anatómicos en el colon caracterizados por la pérdida de las haustras, un hallazgo que sugiere daño neuronal o del músculo longitudinal inducido por estos laxantes (colon catártico).32
C2. Evidencia clínica
Fibra y formadores de bolo. El consumo de fibra es una recomendación que muchos médicos dan a los pacientes con SII-E con el fin incrementar el número de evacuaciones y mejorar los síntomas. Sin embargo, la evidencia que sustenta esta recomendación es débil. La fibra acelera el tránsito intestinal en sujetos sanos y en pacientes con SII.33 Un meta-análisis valoró la utilidad de la fibra en el SII-E,28 incluidos 17 ensayos clínicos controlados: nueve de ellos con fibra soluble (ispaghula, psyllium y policarbófilo de calcio) y ocho estudios que evaluaron fibras insolubles (de maíz y trigo). Ambos tipos de fibra mejoraron el estreñimiento y ninguno de los dos mejoró el dolor. La respuesta fue diferente en lo relativo al alivio global de los síntomas, ya que la fibra soluble logró mejoría global significativa (RR, 1.55; IC 95%: 1.352-1.78), mientras que la fibra insoluble mostró una tendencia a empeorar los síntomas (RR, 0.89; IC 95%: 0.72-1.1).
Laxantes osmóticos. El PEG se ha valorado ampliamente en el tratamiento del estreñimiento funcional en niños y adultos.34 Un estudio clínico de 151 enfermos con estreñimiento crónico, controlado con placebo, demostró un incremento de la frecuencia de evacuaciones en el grupo tratado con 17 g/día de PEG (p <0.001), con la mayor diferencia en eficacia a la segunda semana de tratamiento (p <0.001). En la segunda semana de tratamiento, en promedio, los individuos del grupo con placebo tuvieron 2.7 evacuaciones por semana, en tanto que los que recibieron PEG tuvieron 4.5 (p <0.01). No existieron diferencias significativas en parámetros de laboratorio o efectos adversos entre los grupos.35 A pesar de ser muy efectivo en el control del estreñimiento crónico, existe poca evidencia acerca de su empleo en el SII. En un estudio en adolescentes con SII, el PEG demostró aumentar el número de evacuaciones por semana sin mostrar efecto sobre el dolor abdominal.36 El número de pacientes tratados en este estudio fue pequeño y el objetivo primario no fue cuantificar el efecto del PEG, sino del tegaserod. Un estudio reciente no demostró ningún efecto del PEG sobre la sensibilidad rectal en personas con SII-E al compararse con placebo, aunque mejoró la consistencia de las heces.37
Al igual que el PEG, la lactulosa y la leche de magnesia han demostrado su utilidad en el tratamiento del estreñimiento crónico, pero su utilidad específica en el manejo del SII-E se desconoce.
Agentes estimulantes. Otros laxantes disponibles en México, como los estimulantes (docusato, picosulfato de sodio, bisacodilo, senósidos) y osmóticos (parafina, glicerina, leche de magnesia, lactulosa), no se han estudiado en el SII-E. También existen en México diversas combinaciones de los anteriores que tampoco se han probado, en particular en el SII-E.
Otros agentes. En un estudio publicado en fecha reciente en forma de resumen se evaluó la combinación de colchicina y olsalzina en 12 pacientes con SII-E. Las dosis empleadas de ambos fármacos fueron variables y el análisis retrospectivo de los resultados mostró que todos los pacientes tratados respondieron de forma completa y mantuvieron la respuesta durante 10 meses de seguimiento. El estudio tiene graves deficiencias metodológicas (grupo pequeño de pacientes, falta de grupo control, análisis retrospectivo).38
El orlistat y las prostaglandinas se han empleado en el tratamiento del estreñimiento, pero no se han valorado en el SII.
C3. Disponibilidad en México
Fibras y formadores de bolo. De los formadores de bolo que cuentan con evidencia científica en México existen en forma comercial psyllium e isphagula. Existen múltiples presentaciones de fibra insoluble de trigo registradas como suplementos alimenticios. También hay múltiples presentaciones comerciales de fibras que no se han evaluado en forma específica en el SII, como la fibra de nopal y la linaza, entre otras. También se dispone de presentaciones que combinan fibras solubles y senósidos. Sin embargo, no se cuenta con estudios publicados que determinen su utilidad en el SII.
Laxantes osmóticos. Existen diversas dosis y presentaciones de lactulosa, casi todas como jarabe, con una dosificación de 66.7 g/100 ml, o en polvo (5 g por sobre). Una novedosa presentación es la mezcla de lactulosa con parafina líquida (100 g = 35 g de lactulosa), la cual parece tener mejor palatabilidad. El PEG se encuentra disponible en presentación en polvo y cada sobre contiene 17 g. La posología se determina de acuerdo con la respuesta y por lo regular la dosis inicial es de un sobre por las noches.
Agentes estimulantes. La mayor parte de estos agentes está disponible en tabletas o comprimidos con dosis variables, como picosulfato de sodio (5 mg por tableta), bisacodilo comprimidos (5 mg) y senósidos (tabletas, dosis de 15 a 185 mg). Estos agentes no se recomiendan en el control regular de los pacientes con SII-E
C4. Conclusiones
Algunos compuestos como la lactulosa y el PEG son útiles en el manejo del estreñimiento crónico; sin embargo, existe poca evidencia que demuestre su efectividad en el tratamiento del SII-E.
D) Antidiarreicos
A diferencia de lo que sucede en los pacientes con SII-E, los sujetos que sufren SII con predominio de diarrea (SII-D), en quienes las evacuaciones son frecuentes, muy flojas e incluso líquidas, es indispensable prescribir fármacos que reducen el tránsito intestinal.4 Como muchos otros medicamentos, los agentes antidiarreicos han estado disponibles en el mercado desde hace muchos años y se pueden adquirir con facilidad sin necesidad de una receta; estos agentes se usan de manera racional para retardar el tránsito intestinal en el SII con diarrea como signo principal, aunque en la bibliografía muy pocos productos se han valorado con el rigor científico necesario, excepto la loperamida.6,13,14
Los más usados y disponibles en México son loperamida, colestiramina y lidamidina.
D1. Mecanismos de acción y efectos adversos
Loperamida.. Los derivados de los opioides son útiles para disminuir el número de evacuaciones en la mayoría de los casos de diarrea del adulto, con excepción de las diarreas secretoras y en niños. En México, debido al abuso potencial y sus efectos adversos, el difenoxilato se retiró del mercado. En la actualidad se utiliza loperamida, un derivado sintético de la piperidina con menores efectos opioides secundarios. Este fármaco, desprovisto de efectos opioides en el sistema nervioso central, estimula los receptores inhibitorios presinápticos del sistema nervioso entérico, con lo cual inhibe la peristalsis y la secreción intestinal. El medicamento está contraindicado ante la sospecha de íleo mecánico o seudoobstrucción intestinal, así como en caso de evidencia de una diarrea de tipo disenteriforme. Sus efectos secundarios incluyen xerostomía, estreñimiento, náusea, vómito, somnolencia, retención urinaria y, en casos extremos, megacolon tóxico.
Colestiramina. Este fármaco, que es una resina de intercambio iónico, ha demostrado atenuar la diarrea en pacientes siempre y cuando se determine que el sujeto cursa con mala absorción de sales biliares, como algunos individuos colecistectomizados,39 algunos casos de colitis colagenosa40 y en la diarrea relacionada con antibióticos.41 En fecha reciente, el suministro de 4 g de colestiramina al día para el control de la diarrea crónica en pacientes con incontinencia fecal demostró ser una terapia útil, segura y efectiva.42 Dentro de sus efectos secundarios se incluyen mal sabor de boca, hipercolesterolemia, distensión abdominal y flatulencia.
Lidamidina. Es un derivado amidinourético no opiáceo con acción específica sobre el músculo gastrointestinal que regula la motilidad y reduce la actividad secretora hidroelectrolítica. Las principales indicaciones son el síndrome de intestino irritable y la diarrea crónica. Existen escasos efectos secundarios, como cefalea, estreñimiento y xerostomía.
D2. Evidencia clínica
La loperamida ha mostrado reducción de la diarrea en el SII sin efecto sobre el dolor abdominal; tres estudios en la revisión del ACG mostraron beneficio al reducir el número de evacuaciones, pero sin modificar el dolor ni la distensión.6,13,14
La colestiramina es un agente secuestrador de las sales biliares, se une a los ácidos biliares e impide su resorción; en teoría, algunos pacientes con SII y predominio de diarrea pueden perder sales biliares y ese sería el razonamiento para administrar la colestiramina; sin embargo, no hay estudios aleatorizados con este medicamento y las revisiones actuales no le confieren una función relevante en el control del SII.6,13,14
Existen dos estudios mexicanos que analizan la efectividad de la lidamidina en el tratamiento del SII. En el primero se demuestra un discreto beneficio sobre el placebo43 y en el estudio realizado por Nogueira y colaboradores se reconoció una ventaja marginal sobre el placebo.44
D3. Disponibilidad en México
En México, la loperamida se encuentra disponible en tabletas de 2 mg y la dosis recomendada es de 4 mg seguidos de 2 mg después de cada evacuación, con un máximo en 24 h de ocho tabletas; en el tratamiento de mantenimiento los paciente reciben dosis de 6 mg al día por lo regular. La lidamidina está disponible en tabletas de 4 mg y la dosis promedio es de una tableta cada 8 h.16 La colestiramina se encuentra disponible en polvo, sobres de 4 g y la dosis se ajusta de acuerdo con la respuesta entre 2 y 4 g al día.
D4. Conclusiones
Aunque los agentes antidiarreicos gozan de amplio uso en la práctica clínica en el tratamiento del síndrome del intestino irritable con predominio de diarrea, no hay evidencia que apoye su eficacia para el tratamiento de los síntomas generales del SII; aun así, los datos actuales señalan que la loperamida es útil en el SII con diarrea como signo principal. No hay datos sistemáticos publicados acerca de los otros antidiarreicos que establezcan la seguridad y tolerabilidad de estos agentes, si bien en algunos pacientes, al parecer, pueden inducir estreñimiento, por lo cual se recomienda vigilancia en el uso a largo plazo.
E) Agentes serotoninérgicos
La serotonina (5-hidroxitriptamina) es un neurotransmisor importante para el funcionamiento del tubo digestivo.45 En realidad, el 95% de esta molécula se sintetiza, almacena y libera en el tracto gastrointestinal.46 La serotonina actúa sobre varios subtipos de receptores del eje cerebrointestino y media algunas actividades del aparato digestivo.46,47 Los receptores 5-HT3 se relacionan con excitación del tracto gastrointestinal y por lo tanto con un aumento de la motilidad intestinal, la secreción y la sensibilidad. Los antagonistas de los receptores de 5-HT3 atenúan el tránsito colónico, incrementan la absorción de líquidos y mejoran por consiguiente los síntomas del síndrome de intestino irritable (SII) con predominio de diarrea.48 Estudios in vitro indican que los receptores 5-HT4 son mediadores del reflejo peristáltico y por tanto los agonistas de este receptor estimulan la motilidad intestinal.49 La secreción de líquidos y electrólitos también puede modularse a través de los receptores 5-HT3 y 5-HT4. El antagonismo hacia los receptores 5-HT3 produce una disminución de la secreción, mientras que la estimulación de los receptores 5-HT4 incrementa la secreción de líquidos y electrólitos.50 La hipersensibilidad visceral, marcador del SII, parece tener modulación de la serotonina. Los antagonistas de los receptores 5-HT3 inhiben de manera dependiente de la dosis la activación del SNC y reducen la percepción del dolor.51 Por su parte, los agonistas de los receptores 5-HT4 inhiben la respuesta dolorosa visceral, la señalización aferente inducida por distensión rectal y alteran las respuestas sensoriales reflejas.52,53
Existen varios agentes que interactúan con los receptores de 5-HT, entre los cuales dos tienen relevancia clínica para el tratamiento del SII: alosetrón y tegaserod.
E1. Mecanismos de acción y efectos adversos
Alosetrón. El alosetrón es un antagonista de los receptores 5-HT3 y actúa a través de varios mecanismos como son la reducción del reflejo gastrocólico, la disminución del tiempo de tránsito colónico, la reducción de la secreción de agua y cloro, el aumento de la "distensibilidad" colónica y la menor sensibilidad rectal a la distensión.6,48 Sin embargo, después de su aparición en Estados Unidos a principios del 2000, el alosetrón se retiró del mercado en noviembre de 2000 por el reporte de casos de colitis isquémica y episodios adversos graves, como impacción fecal y obstrucción intestinal, razón por la cual no llegó a México. El fármaco se reintrodujo en el mercado estadounidense dos años después, pero con indicaciones restringidas. Chang y colaboradores54 realizaron un meta-análisis que incluyó información de 1995 a 2004, en el que encontró que la frecuencia de colitis isquémica y sucesos adversos graves relacionados con estreñimiento fue muy baja. Estos episodios rara vez se vincularon con secuelas y no se encontró mortalidad atribuida al tratamiento con alosetrón.
Tegaserod. El tegaserod es un agonista parcial del receptor 5-HT4. Sus efectos se deben a que aumenta el vaciamiento gástrico y el tránsito en el intestino delgado y colon en sujetos con SII con predominio de estreñimiento; modula la sensibilidad visceral, ya que disminuye el estímulo a través de las vías aferentes espinales e incrementa la secreción intestinal de agua y electrólitos.55-57 Los efectos adversos reportados más a menudo con el uso del tegaserod son diarrea leve y transitoria (10.1 %), cefalea (8.3 %), dolor abdominal (7.4 %) y flatulencia (5.5 %). 21 A principios de 2007, el tegaserod fue retirado del mercado estadounidense debido a un aparente aumento del riesgo de episodios cardiovasculares en pacientes bajo tratamiento con tegaserod comparados con el placebo.58 Este nexo fue poco claro, por lo que en México la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) decidió no suspender su comercialización en el país y sólo restringió su uso a pacientes sin riesgo cardiovascular (menores de 55 años, sin hipertensión y sin hipercolesterolemia).6 Un análisis reciente de una cohorte de más de 52 000 pacientes estadounidenses que utilizaron tegaserod se comparó con un número igual de individuos de características similares que no recibieron el agente. Los resultados no mostraron aumento del riesgo de sucesos cardiovasculares isquémicos en los individuos sometidos a tegaserod.59 En México, Schmulson y colaboradores tampoco identificaron diferencias en el riesgo cardiovascular en sujetos que recibieron tegaserod por SII o estreñimiento crónico.60
E2. Evidencia clínica
Alosetrón. Estudios controlados han demostrado su efectividad en mujeres con la variedad diarreica del SII , pero grave y refractaria a otros tratamientos como signo predominante, ya que es efectivo en la mejoría global de los síntomas, logra un alivio adecuado del dolor y el malestar abdominal, aumenta la consistencia fecal y reduce la frecuencia de las evacuaciones.61 En fecha reciente se publicó un meta-análisis de ocho ensayos clínicos aleatorizados (dosis de al menos 1 mg/día) en los que se incluyó un total de 4 170 pacientes (80% mujeres).62 Aunque se incorporaron pacientes de los diferentes subgrupos del SII, el subgrupo mayor fue el de personas con predominio de la diarrea. Este estudio demostró que el alosetrón fue superior al placebo en la mejoría global de síntomas del SII y en el alivio adecuado del dolor o malestar abdominal tanto en mujeres como en varones. Sólo dos episodios adversos ocurrieron con más frecuencia en el grupo del alosetrón: estreñimiento (RR, 4.35; IC 95%: 3.01-6.26) y dolor abdominal (RR, 1.95; IC 95%: 1.46-2.64).
Tegaserod. Su eficacia en el tratamiento del SII la han sugerido varios ensayos clínicos aleatorizados y multicéntricos, en los que el tegaserod mostró ser superior al placebo en la mejoría global de los síntomas del SII, así como en la mejoría específica del dolor o malestar abdominal, y en el número y consistencia de las evacuaciones.63-65 Algunos estudios muestran también superioridad del tegaserod sobre el placebo con respecto a la distensión abdominal.62,63
E3. Disponibilidad en México
En México sólo se encuentra disponible el tegaserod en presentación de tabletas de 6 mg, con una posología de una cada 12 h y con las restricciones mencionadas antes. El alosetrón no está disponible en México.
E4. Conclusión
Los serotoninérgicos son medicamentos que actúan sobre los mecanismos fisiopatológicos específicos y han demostrado ser eficaces para aliviar los síntomas del SII, por lo que en la mayor parte de las guías de práctica clínica su grado de recomendación es A. Sin embargo, son fármacos que requieren precaución en su uso y una selección adecuada del paciente.
F) Psicofármacos
Cuando los pacientes con SII incurren en incumplimiento del tratamiento con las terapias farmacológicas convencionales, y si el síntoma predominante es el dolor abdominal grave, deben considerarse candidatos para recibir tratamiento con propiedades analgésicas viscerales como los antidepresivos tricíclicos (ATC) y los inhibidores de la recaptación de serotonina (IRSS).6,9,10,66 Aunque existen otros fármacos como los inhibidores de la recaptación de norepinefrina, los ATC y los IRSS son los más estudiados en el SII.
Se han administrado los antidepresivos en el SII porque estos fármacos pueden alterar la percepción visceral del dolor por una modulación central de las vías viscerales aferentes, además de que pueden actuar sobre la comorbilidad psicológica y modificar el tránsito intestinal.6,66 Las diferentes clases de antidepresivos actúan por combinaciones de mecanismos.10,67,68
F1. Mecanismos de acción y efectos adversos
Antidepresivos tricíclicos (ATC). Los pacientes con el SII tienen un bajo umbral sensitivo a la distensión con balón del recto y también a los estímulos eléctricos, de ahí que los efectos benéficos de los ATC pueden explicarse a través de un incremento parcial del umbral central al dolor.67-69
Otro de los mecanismos que pueden explicar los mecanismos de acción de los ATC son sus efectos anticolinérgicos (causantes también de sus efectos adversos), regulación del tránsito intestinal y el efecto antineuropático periférico. La elección del ATC depende de la tolerancia de los pacientes, los efectos adversos e incluso del subtipo de SII. Se sabe, por ejemplo, que la amitriptilina mejora la sensibilidad visceral y reduce el tiempo de tránsito colónico, por lo que se ha indicado que puede ser una opción útil cuando la diarrea es el síntoma predominante.69-71 Dentro de los efectos secundarios del uso de estos medicamentos se incluyen la xerostomía, estreñimiento, cefalea, náusea, vómito y, en casos raros, alteraciones del ritmo cardiaco. Por lo regular, estos efectos son transitorios y se presentan en la primera semana del tratamiento.
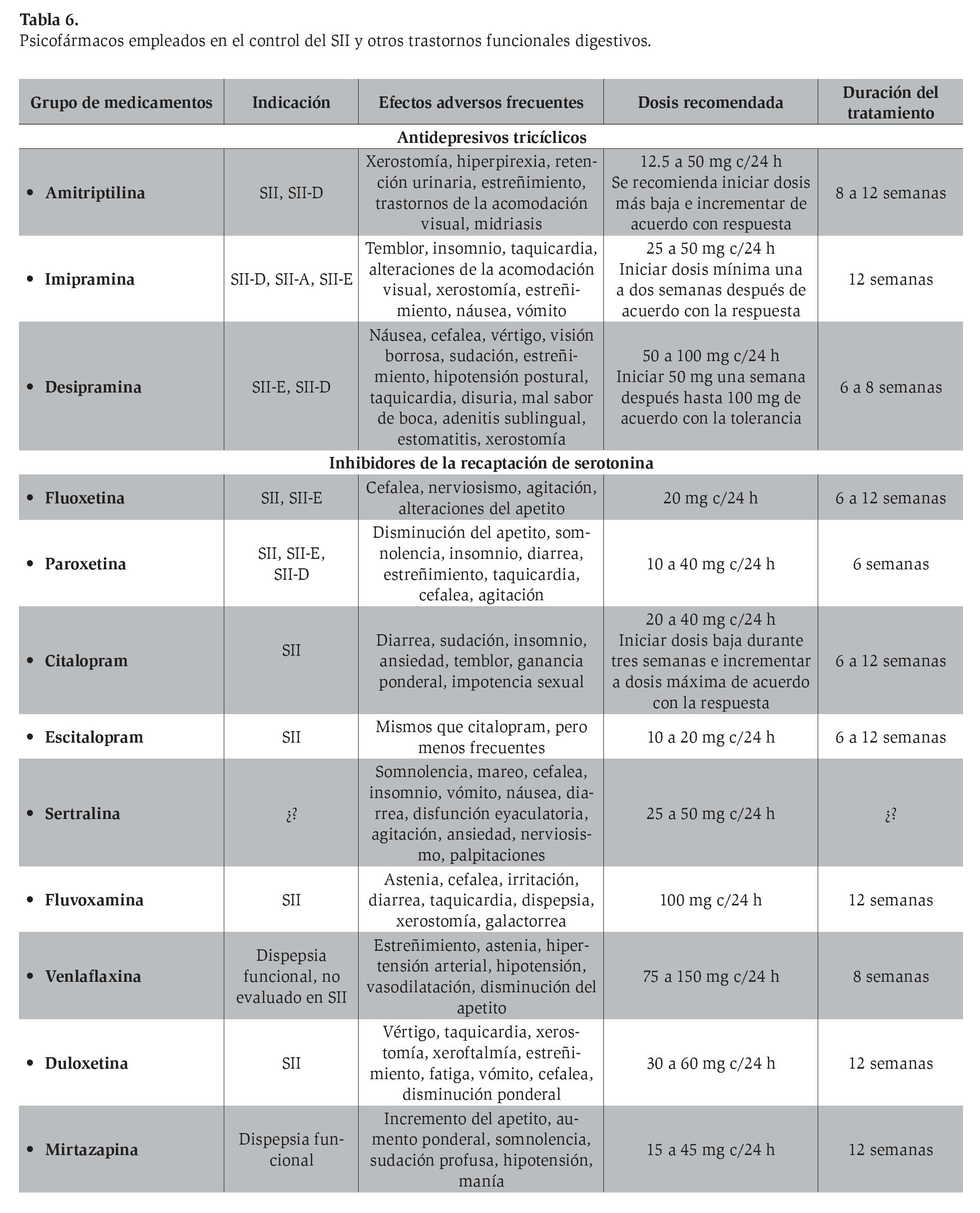
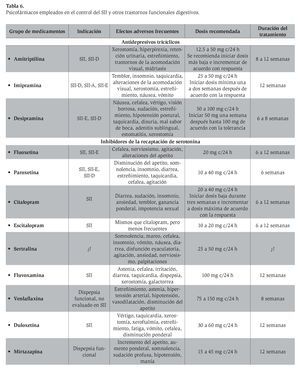
En la Tabla 6 se mencionan los ATC más utilizados, efectos adversos, dosis y tiempo recomendado en el control del SII. Un hecho relevante es que por lo regular las dosis necesarias para la obtención de los efectos de analgesia visceral son bastante menores (12.5 a 25 mg) que las empleadas para el manejo de la depresión (100 mg).
Inhibidores de la recaptación de serotonina (IRSS). En comparación con los ATC, los IRSS son un grupo de fármacos que los médicos prefieren y se sienten más cómodos en utilizar debido a sus menores efectos adversos. Sin embargo, comparados con los ATC, los resultados en el control del SII son más controvertidos. En teoría, los ATC producen un beneficio en el SII debido a sus efectos centrales y periféricos, en tanto que los IRSS actúan de forma diferente, con al parecer menos efectos adversos. Por ejemplo, la fluoxetina atenúa el tránsito bucocecal y el tránsito intestinal total en individuos con SII-E y los controles.72,73 La venlafaxina (inhibidor de la recaptación de serotonina y norepinefrina) ha demostrado reducir la distensibilidad colónica y la relajación del colon,71 mientras que el citalopram no produce ningún efecto sobre las propiedades nociceptivas del colon.74
Por lo general, estos fármacos se utilizan en dosis bajas, las cuales se incrementan hasta obtener el efecto deseado y los efectos terapéuticos se observan a partir de la segunda semana de tratamiento; casi siempre se recomienda mantener los medicamentos entre 12 y 24 semanas antes de su suspensión.
Otros agentes. En la actualidad están disponibles agentes que ejercen sus efectos de analgesia visceral y desensibilización nerviosa mediante el bloqueo conjunto de serotonina y norepinefrina, como la duloxetina, la venlaflaxina y la mirtazapina. Aunque son necesarios más estudios en el SII, se cuenta con protocolos pilotos que demuestran efectividad similar a los ATC y los IRSS.
F2. Evidencia clínica
Antidepresivos tricíclicos. La eficacia de los ATC en el tratamiento del SII se ha revisado en varios meta-análisis de estudios aleatorizados controlados.68-74 Los datos recolectados incluyen estudios realizados hasta el año 2008 donde se demuestra que los ATC inducen una respuesta con significancia clínica en la reducción del síntoma principal del SII: el dolor abdominal. El riesgo relativo acumulado para la mejoría clínica con ATC se calcula en 1.93 (IC 95%: 1.44-2.6), con un cambio porcentual en la mejoría sintomática promedio de 44.15% (IC 95%: 35-52%) comparado con el placebo. Aún más, se calcula que el número necesario a tratar (NNT) para prevenir los síntomas persistentes del SII es de 4 (IC 95%: 3-8).
Por ejemplo, en uno de los mejores estudios realizado, Drossman y colaboradores69 demostraron que la administración de desimipramina durante 12 semanas para tratar el SII moderado a grave fue significativamente mejor que el placebo (73% vs 49%), aunque 11% de los pacientes interrumpió el agente en algún momento debido a los efectos adversos. Pese a que estos resultados son contundentes, los estudios que comparan la efectividad entre los diversos ATC son escasos. Forootan y colaboradores68 cuantificaron los efectos de nortriptilina, amitriptilina y fluoxetina, lo que demostró que los tres fármacos mejoran el dolor abdominal y la flatulencia, pero que la amitriptilina y la nortriptilina mejoraron la frecuencia de la defecación tanto en el grupo de estreñimiento como en el de diarrea, en tanto que la fluoxetina mejoró el tránsito intestinal y el estreñimiento. Por otra parte, en otro estudio, Talley y colaboradores71 demostraron que los síntomas del SII después de la administración de imipramina, citalopram y placebo son similares (56%, 47% y 56%, respectivamente).
En cuanto a los efectos adversos, en todos los estudios valorados se asevera que 18% de los sujetos que reciben algún ATC manifiesta alguna reacción secundaria, en comparación con 9% de la población que recibe placebo. Se calcula que el riesgo relativo para sufrir un efecto adverso relacionado con los ATC es de 1.63 (IC 95%: 0.94-2.80). Los efectos más comunes de estos medicamentos se mencionan en la Tabla 6, así como las dosis y el tiempo recomendado en el tratamiento del SII.
Inhibidores de la recaptación de serotonina.
Aunque existen menos estudios, los meta-análisis sugieren que este grupo de medicamentos puede ser igual de efectivo que los ATC, aunque se necesitan más ensayos clínicos controlados.68-71 Por lo menos cinco estudios han demostrado que el riesgo relativo para persistir con síntomas de SII de moderados a graves después de recibir un IRSS comparado con el placebo es de 0.62 (IC 95%: 0.45-0.87) y que existe mucha heterogeneidad entre los estudios analizados. El número necesario a tratar con IRSS para evitar la recaída del SII es de 3.5 (IC 95%: 2-14).
Este grupo de fármacos es mejor tolerado que los ATC e incluso, debido a algunos efectos procinéticos, se considera que estos medicamentos pueden funcionar mejor en los pacientes con SII-E respecto de los que sufren SII-D. Debido a la limitada información específica sobre el control del SII, existen pocos datos sobre la interrupción del tratamiento en virtud de los efectos adversos. No obstante, por ejemplo, para el control del dolor neuropático, se sabe que el número necesario para dañar es de 16.2 con estos fármacos (IC 95%: 8-436).
F3. Disponibilidad en México
Los ATC que han demostrado efectividad para el manejo del SII, aún disponibles en México, son la amitriptilina y la imipramina (Tabla 6). Existen otros agentes, como la clorimipramina, la mianserina y la maprotilina, que pertenecen al mismo grupo de fármacos y que pueden suministrarse, aunque su utilidad en el SII no se ha valorado.
En México se cuenta con una gran variedad de IRSS valorados para el SII y prácticamente todos están disponibles, como fluoxetina, paroxetina, citalopram y escitalopram. Otros fármacos disponibles no evaluados con potenciales efectos son la sertralina y la fluvoxamina.
F4. Conclusiones
Los ATC y los IRSS muestran clínica y estadísticamente mejoría en el control de los síntomas en pacientes con SII pero, en virtud de los efectos colaterales, sólo deben emplearse en casos moderados o graves. Debe iniciarse el tratamiento con dosis menores a las prescritas en la depresión y la elección del medicamento debe tener en cuenta los síntomas. En los pacientes ancianos con predominio de estreñimiento, se sugiere iniciar con el ATC de menor efecto anticolinérgico, como doxepina y desipramina. En los pacientes con la variedad diarreica del SII e insomnio, la imipramina y la amitriptilina son efectivas. En los sujetos con estreñimiento predominante, se recomienda un IRSS, como paroxetina o fluoxetina, ya que puede acelerar el tránsito intestinal. Son necesarios nuevos estudios con una estricta vigilancia sobre el cumplimiento del tratamiento para valorar la función de los antidepresivos en la práctica diaria.
G) Antibióticos
Los mecanismos fisiopatológicos del SII aún no se caracterizan del todo, pero existe evidencia de que el sobrecrecimiento bacteriano puede jugar un papel importante en al menos un subgrupo de estos individuos.75-77 El fenómeno de sobrecrecimiento bacteriano podría explicar, al menos en parte, las alteraciones en la motilidad, hipersensibilidad visceral, interacciones anormales cerebrointestinales y activación inmunitaria presentes en los sujetos con síndrome de intestino irritable.75-77
Se ha observado que 92% de las personas con SII presenta distensión abdominal, cualquiera que sea su síntoma principal. Además, se ha identificado que un número significativo de individuos con SII (10% a 84%) tiene una producción anormal de gas que evidencia la práctica de una prueba de aliento.77
Estas evidencias respecto de la función de las bacterias en la fisiopatología del SII han constituido la base para el empleo de antibióticos en estos pacientes. Diversos estudios muestran que los antibióticos sistémicos (ciprofloxacina, metronidazol, tetraciclina) mejoran los síntomas del síndrome de intestino irritable, pero su uso se ha visto limitado por la presencia de efectos adversos, así como por el riesgo de generar resistencia bacteriana a dichos antibióticos. También se han conducido estudios en relación con la neomicina (antibiótico no absorbible) para el SII. En la actualidad se estudia sobre todo el papel de la rifaximina, que es un antibiótico oral, no absorbible, de amplio espectro, con actividad gastrointestinal local.76,77
G1. Mecanismos de acción y efectos adversos
La rifaximina es un antibiótico oral no absorbible (absorción menor de 1%), análogo semisintético de la rifamicina, que tiene un anillo piridoimidazol que evita su absorción gastrointestinal. La rifaximina se une de manera irreversible a la subunidad beta de la polimerasa de RNA e inhibe la síntesis del RNA bacteriano y la síntesis de proteínas.76-80 La rifaximina es un antibiótico de amplio espectro con actividad contra bacterias enterales grampositivas y gramnegativas, incluidas las aerobias y las anaerobias. Después de su administración por vía oral, actúa de manera local en el intestino, donde alcanza concentraciones mucho más altas que las concentraciones inhibitorias mínimas (CIM) de los enteropatógenos intestinales. El 97% de la dosis se excreta en la evacuación. La rifaximina tiene un perfil de seguridad más favorable que los antibióticos sistémicos. No se ha observado resistencia bacteriana con relevancia clínica al antibiótico en los más de 20 años de uso en Europa, ni hay evidencia de colitis por Clostridium difficile en pacientes tratados con rifaximina.76,77 A pesar de lo anterior, existe el temor de que el uso de la rifaximina para un número cada vez mayor de indicaciones pueda causar la aparición de bacterias resistentes (micobacterias, Neisseria meningitidis y Enterococcus), lo cual se vincula con el riesgo teórico de resistencia cruzada con rifampicina. Esto podría ocurrir si la rifaximina se utiliza de modo indiscriminado, por periodos prolongados o de manera recurrente.
La rifaximina tiene mínima absorción gastrointestinal (0.4%), lo cual se vincula con un efecto local a nivel intestinal sobre los agentes patógenos enterales y bajo riesgo de efectos adversos (0.7% a 2%). Dichos efectos se limitan casi de manera exclusiva al tubo digestivo (náusea, dispepsia, vómito, urgencia para defecar, estreñimiento y dolor abdominal), con intensidad leve a moderada y en la mayoría de los casos autolimitados, por lo que de manera habitual no es necesario modificar la dosis ni suspender el tratamiento. Rara vez puede presentarse reacción cutánea tipo urticaria o reacciones de hipersensibilidad, incluido el angioedema. Como efecto secundario, la orina puede presentar color rojo a anaranjado.
G2. Evidencia clínica
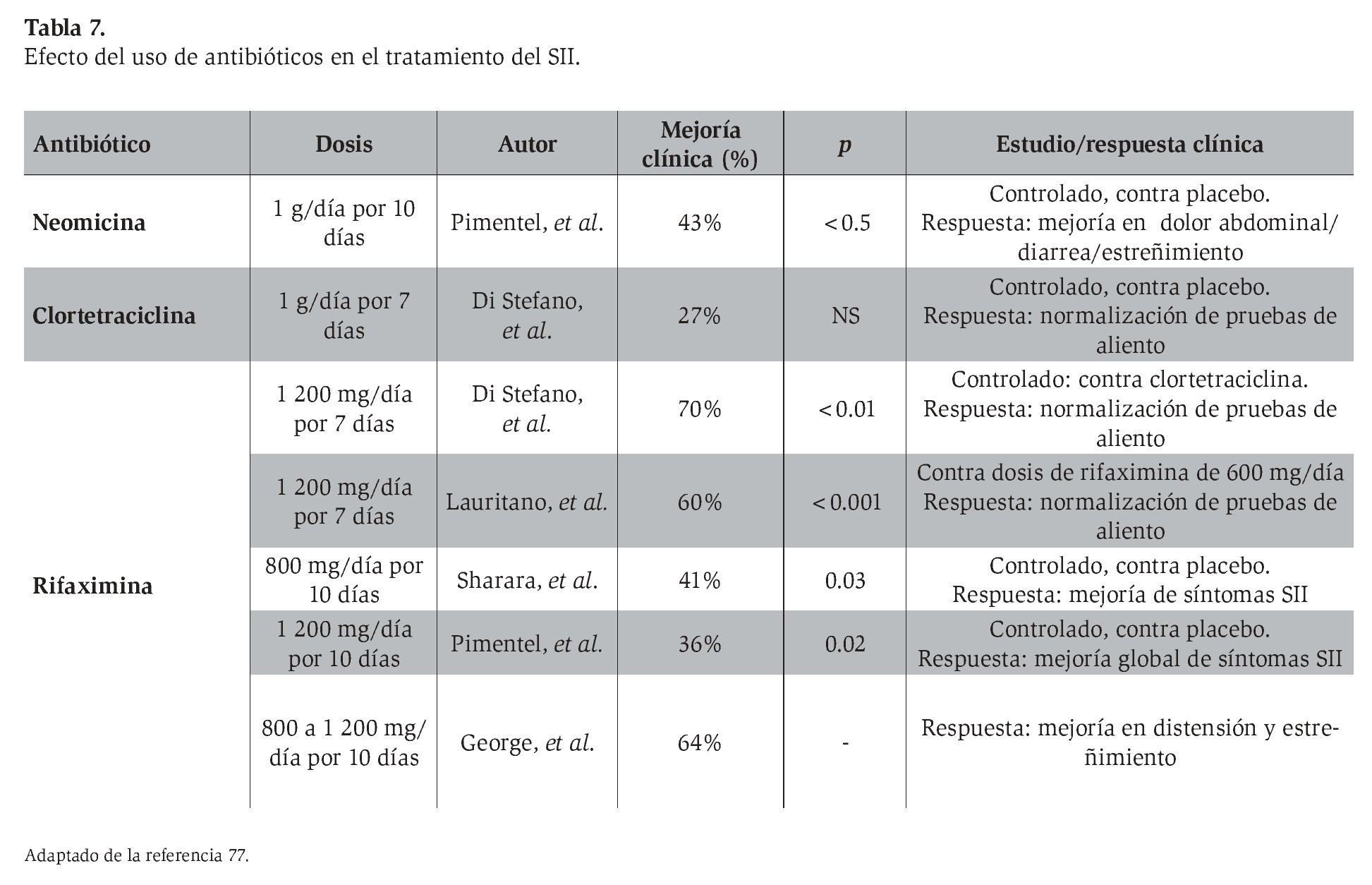
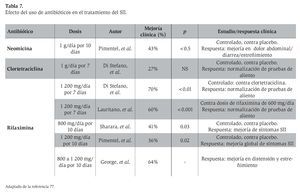
Se han realizado diversos estudios que buscan demostrar la utilidad de los antibióticos en la reducción de síntomas del SII. Estudios iniciales mostraron una reducción significativa de los síntomas del SII posterior a la administración de antibióticos, como neomicina, metronidazol, ciprofloxacina y doxiciclina. Estudios más recientes han evaluado la efectividad y seguridad de la rifaximina en el tratamiento del SII9,77-80 (Tabla 7). Estos estudios exhiben resultados promisorios que permiten considerar el uso de antibióticos como una medida terapéutica alternativa a las opciones farmacológicas tradicionales o como tratamiento concomitante al uso de agentes sintomáticos en el SII. Es importante destacar que también los pacientes con SII sin sobrecrecimiento bacteriano presentan mejoría con la administración de rifaximina.
Una revisión sistemática reciente muestra que un curso corto de antibiótico no absorbible es más efectivo que el placebo para lograr una mejoría global del SII y la distensión.9 En pacientes tratados con rifaximina se observa además, en un seguimiento a 10 semanas, mejoría del dolor abdominal, diarrea y estreñimiento. La mejoría de los síntomas dura hasta 10 semanas, aunque existe recurrencia posterior. De manera gradual, las pruebas de aliento se vuelven positivas de nueva cuenta (13% a los tres meses, 28% a los seis meses y 46% a los nueve meses). Las dosis de rifaximina utilizadas fueron de 400 mg dos veces al día (800 mg/día) por 10 días, 400 mg tres veces al día (1 200 mg/día) por 10 días y 550 mg dos veces al día (1 100 mg/día) por 14 días. Esta revisión sistemática concluye que la dosis apropiada de rifaximina debe ser de 1 100 a 1 200 mg diarios por 10 a 14 días. Además, se ha observado que los pacientes con recurrencia de los síntomas pueden responder a cursos repetidos del antibiótico.9
G3. Disponibilidad en México
En México, la rifaximina se encuentra disponible en tabletas de 200 mg. Por ello, la dosis suministrada para el SII es de 400 mg tres veces al día (1 200 mg/día) por 10 a 14 días.
G4. Conclusiones
Existe evidencia científica que sustenta el uso de un antibiótico no absorbible, la rifaximina, en un subgrupo de pacientes que sufren SII. De forma específica, los sujetos que no han cumplido las terapias previas y cuyos síntomas predominantes son distensión abdominal y evacuaciones líquidas son los que se benefician más de este fármaco, Aunque la evidencia es sólida en términos científicos, se necesitan más estudios al respecto para recomendar su uso definitivo.
H) Probióticos
La microflora gastrointestinal ha sido objeto de estudio desde principios del siglo XX con los trabajos de Metnichoff,81 al proponer que múltiples enfermedades se relacionaban con la actividad de las bacterias intestinales y que el consumo de los productos de la fermentación bacteriana (a través de la ingestión de leches fermentadas) promovía factores benéficos a la salud. Avances científicos recientes resaltan el interés en dichos aspectos clínicos al destacar la función de la microflora en diferentes funciones metabólicas, protección e inmunorregulación.
Se ha propuesto la alteración existente entre la flora bacteriana y el huésped en el SII y se ha encontrado diversidad en la microflora de estos pacientes e incremento de los síntomas después de infecciones gastrointestinales.82-86 A últimas fechas, se ha explorado a través de diversos ensayos clínicos relacionados con la efectividad de los probióticos en el síndrome de intestino irritable.
H1. Mecanismos de acción y efectos adversos
El término probiótico (del griego pro, en favor, y biosis, vida) se define como microorganismos vivos, apatógenos, que al ser ingeridos ejercen una influencia positiva en la salud y la fisiología del huésped.87 Las características que los probióticos deben reunir y mediante las cuales ejercen un beneficio son las siguientes:88
Capacidad de adherencia a la mucosa e inhibición de la adherencia de bacterias patógenas.
Mejoría de la función de barrera del epitelio.
Secreción de bacteriocinas.
Acidificación del colon por la fermentación de nutrimentos.
Acciones inmunomoduladoras.
Alteración de la mucosa en respuesta al estrés.
Resistencia a la digestión por el ácido gástrico y la bilis.
Capacidad de colonizar el tracto gastrointestinal. s En el caso del SII, disminución de la hipersensibilidad visceral.
Tener origen humano.
La acción benéfica de la flora intestinal puede estimularse por alimentos no absorbibles, los cuales se conocen como prebióticos, y que se definen como ingredientes alimenticios no absorbibles que proporcionan beneficio al huésped al estimular de forma selectiva el crecimiento y la actividad de una o más bacterias en el colon.89 Los criterios que deben reunir son: a) resistencia a la acidez gástrica, la hidrólisis enzimática y la absorción gastrointestinal; b) fermentación por la microflora intestinal; c) estimulación selectiva del crecimiento, y d) actividad de bacterias intestinales que contribuyen a la salud y bienestar del huésped.90
Aunque por lo regular son compuestos considerados seguros y con mínimos efectos secundarios, de manera excepcional se reportan efectos adversos como incremento de los síntomas gastrointestinales (distensión abdominal, diarrea, estreñimiento, náusea y dolor epigástrico), epistaxis, ansiedad y dolor torácico. Otros efectos más raros son infecciones en pacientes inmunocomprometidos.91,92
H2. Evidencia clínica
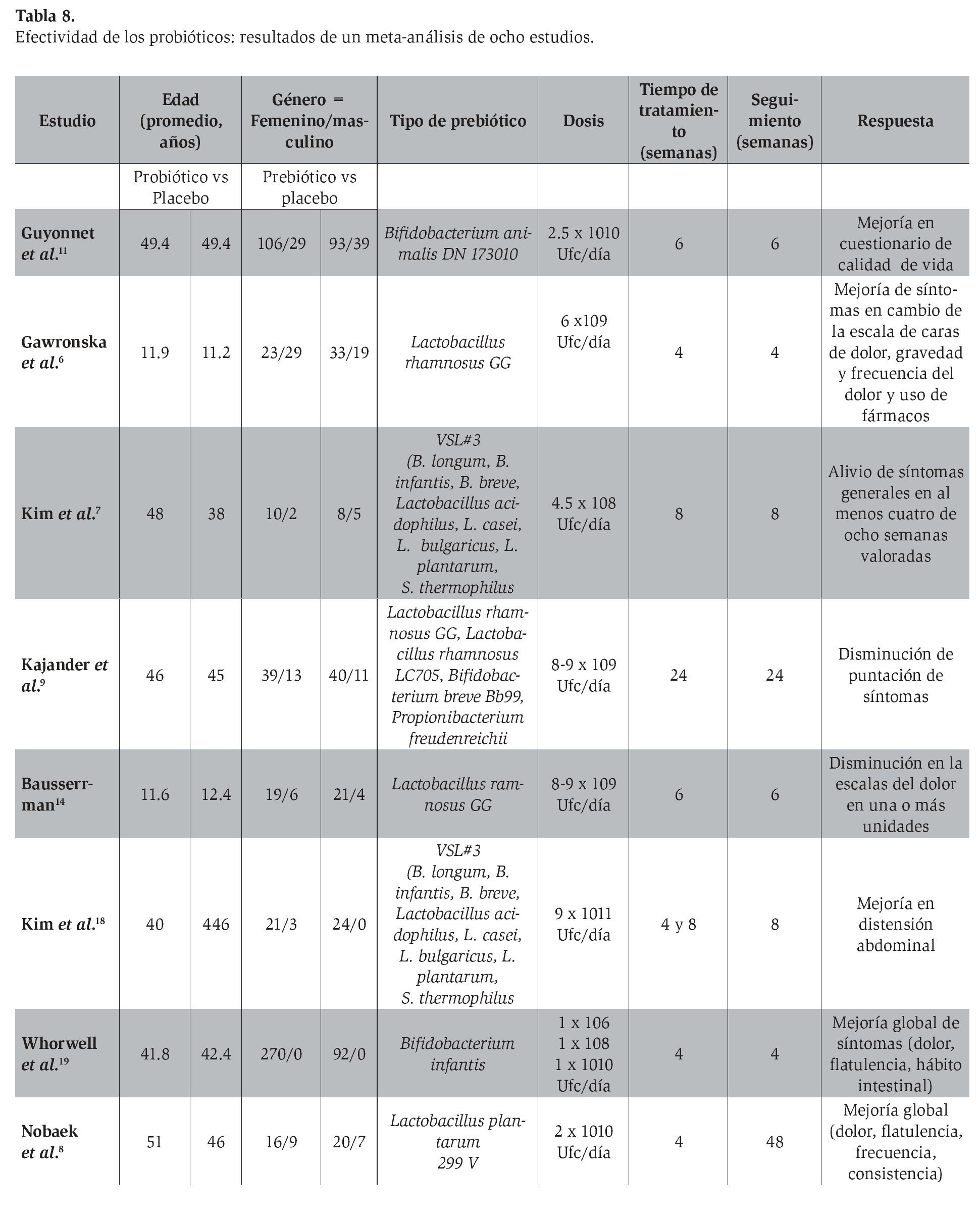
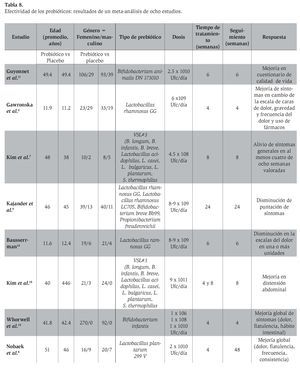
Existen diversos ensayos clínicos acerca de la efectividad de los probióticos en el SII; sin embargo, los resultados han resultado contradictorios con frecuencia, algunos de ellos con efectos benéficos93,94 y algunos otros sin poder demostrar que los probióticos son superiores al placebo en el SII.95-98 Nifkar y colaboradores99 realizaron un meta-análisis de ocho estudiosen pacientes con SII tratados con probióticos que valoraron los estudios con adecuada calidad metodológica y basados en el diagnóstico establecido por los criterios de Roma. Se evaluó un total de 1 011 pacientes que recibieron probióticos o placebo de manera aleatoria; los resultados se muestran en la Tabla 8. La mejoría clínica en el grupo de pacientes que recibieron probióticos fue de 53.1% (292/550) y en el grupo placebo de 44.9% (167/372). La razón de momios para la mejoría clínica en los estudios fue de 1.22 (IC 95%: 1.07-1.04) con un RR (p= 0.0042). Se concluyó mediante estos resultados que los probióticos mejoran los síntomas al compararse con el placebo, pero caben limitaciones por las características de los pacientes (edad, sexo, estilo de vida), dosis, cepas y duración del tratamiento. McFarland y colaboradores100 realizaron también un meta-análisis e incluyeron 20 estudios (1 404 pacientes) seleccionados de acuerdo con la calidad metodológica con el fin de determinar la eficacia de los probióticos en el síndrome de intestino irritable, en el que evaluaron mejoría o modificación de los puntajes de los síntomas. En 15 de 20 estudios (75%), los pacientes recibieron un total de 23 diferentes probióticos y se observó una mejoría de la valoración global de los síntomas.
Hasta el momento no existe ningún estudio controlado acerca del uso de los prebióticos en el síndrome de intestino irritable; algunos, como la lactulosa, fructosa y sorbitol, dado que son carbohidratos que se absorben en escasa medida, alcanzan el colon y pueden actuar como sustratos para las bacterias intestinales; no obstante, su actividad osmótica puede promover diarrea y la lactulosa meteorismo y dolor abdominal frecuentes. De igual forma, la inulina y las oligofructosas pueden incrementar la flatulencia en voluntarios sanos, lo cual resulta poco útil para los pacientes con síndrome de intestino irritable y probablemente poco tolerado. La posibilidad de una respuesta favorable al combinarlos con los probióticos aún es imprecisa.
H3. Disponibilidad en México
Son múltiples y variadas las presentaciones de los probióticos disponibles en el mercado. Para las presentaciones orales, en yogur o derivados de la leche, deben escogerse aquellas que contengan al menos las cepas que han demostrado efectividad en el control del SII: Bifidobacterium infantis, Saccharomyces boulardii, Saccharomyces boucardii, Lactobacillus casei, Lactobacillu plantarum, Lactobacillis rhamnosus, Saccharomyces cerevisiae, y otras más ( Tabla 8).
Algunas presentaciones orales de los probióticos en forma de cápsulas incluyen microorganismos aislados y combinaciones de varias cepas, como Lactipan ®, Enterogermina®, Floratil ®, Lacteol Forte ®, Liolactil®, Levadura Bioclon®, Neoflor, Neo-panlacticos plus ® y Sinuberase ®, entre otros.
H4. Conclusiones
Con base en lo anterior, puede concluirse que los probióticos pueden mejorar los síntomas de los pacientes con SII. Sin embargo, la gran heterogeneidad de los estudios, en virtud del reducido número de participantes, diferentes probióticos utilizados (individuales o combinados, o bien especies y cepas distintas), variaciones notorias en los grupos de edad (dos estudios se realizaron en niños), dosis diversas y duración distinta entre los tratamientos, puede limitar el grado de recomendación y obligar a llevar a cabo un mayor número de estudios.
I) Nuevos agentes farmacológicos
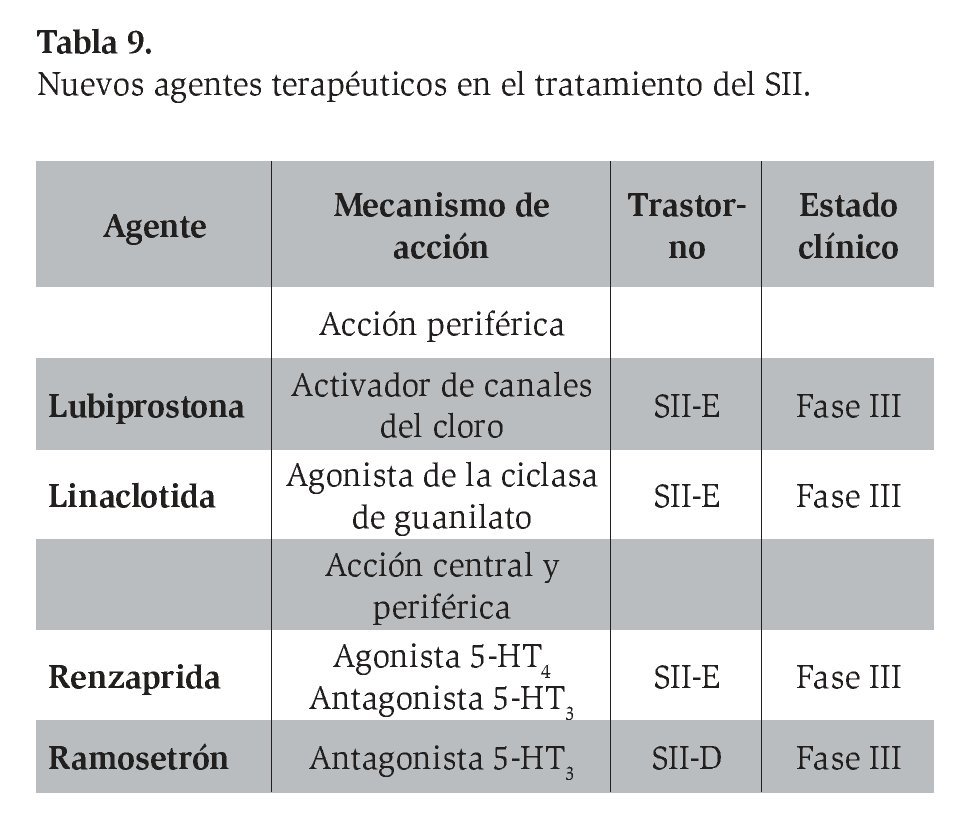
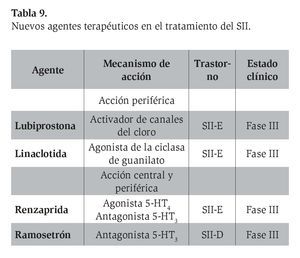
En fecha reciente se ha demostrado la efectividad de nuevos y diversos agentes destinados al tratamiento de los síntomas y los mecanismos fisiopatológicos relacionados con el SII (Tabla 9). La efectividad de algunos de estos fármacos es evidente de acuerdo con los estudios conducidos en otros países, si bien ninguno de estos fármacos que se mencionan a continuación está disponible todavía en México.
I1. Lubiprostona
I1.1. Mecanismo de acción y efectos adversos. En el tracto digestivo existen diferentes canales del cloro, con una función esencial en el transporte de líquidos, despolarización de células del músculo liso, transmisión postsináptica y mantenimiento del pH y volumen intracelular. Uno de los más importantes CIC es la proteína reguladora de la conductancia transmembrana de la fibrosis quística (CFTR). Los defectos genéticos a este nivel ocasionan la fibrosis quística.101 La lubiprostona es un ácido graso derivado de un metabolito de PGE1, pero con un diferente mecanismo de acción. Activa de manera selectiva a los CIC-2, con aumento de la secreción de líquidos. Los CIC-2 se localizan en la membrana apical de las células del estómago, intestino delgado y colon. Este medicamento acelera el tránsito de intestino delgado y colon en voluntarios sanos; asimismo, aumenta el tránsito colónico sin modificar el vaciamiento del colon ascendente, lo cual sugiere que su acción ocurre en el colon distal, quizá por estimulación de los receptores locales a la distensión.102
La lubiprostona es segura e induce pocos efectos indeseables; en un análisis de todos los estudios de SII-E, los efectos adversos más frecuentes fueron náusea (8%) y diarrea (6%). No hubo diferencia con el grupo control en electrólitos, BH, azoados o cambios en el electrocardiograma. En un análisis posterior a su comercialización, se informó la presencia en algunos pacientes de reacción alérgica y disnea una hora después de la primera dosis, pero con resolución en dos a tres horas y sin efectos adversos a largo plazo. Esto puede recurrir en dosis repetidas. La disnea se presentó en 2.5% de los pacientes con estreñimiento tratados con 24 +g bid y en 0.4% en el SII-E a dosis de 8 +g. Se establece como categoría de grado C en el embarazo.103,104
I1.2. Evidencia clínica. La lubiprostona ha mostrado su eficacia y seguridad en el tratamiento del estreñimiento crónico en diferentes publicaciones. En un estudio multicéntrico de fase III controlado con placebo que incluyó a 242 pacientes de 20 centros de Estados Unidos con diagnóstico de EC basado en el consenso de Roma II, al principio permanecieron dos semanas bajo valoración basal sin medicamento y luego recibieron 24 +g bid en comparación con placebo durante cuatro semanas. Los 120 pacientes que recibieron lubiprostona informaron un mayor número de evacuaciones por semana (5.6 vs. 3.4 con placebo, p <0.01). La frecuencia de evacuaciones fue mayor a las semanas 2, 3 y 4° (p <0.01). Los efectos indeseables más comunes fueron náusea (31.7%) y cefalea (11.7%).103 En enero del 2006, la FDA aprobó su uso para el estreñimiento crónico (varones y mujeres) con dosis de 24 +g dos veces al día y en abril del 2006 para el SII-C en mujeres con dosis de 8 +g dos veces al día.101
Se ha sugerido que la suspensión súbita del fármaco podría precipitar una acentuación de los síntomas. Ello se investigó en 128 sujetos tratados con lubiprostona (24 +g bid por cuatro semanas), en un periodo de cuatro semanas con el fármaco y posteriormente durante tres semanas más con el medicamento o placebo. No se encontró un efecto de estreñimiento de rebote al suspender el fármaco.104
La eficacia y seguridad de la lubiprostona en el SII-C se valoraron en un estudio multicéntrico, doble ciego, controlado con placebo de 195 pacientes con SII-C de acuerdo con los criterios de Roma III; los individuos se aleatorizaron para recibir 12 semanas de tratamiento en comparación con el placebo en tres dosis (8, 16 o 24 +g bid), después de un periodo basal de cuatro semanas. Se incluyó de forma predominante a mujeres (92%) caucásicas (83%). En los dos primeros meses, los sujetos tratados sintieron mejoría en el dolor y las molestias al comparar con el placebo. No hubo diferencia en el tercer mes. La distensión no mejoró. Con la dosis más alta (24 +g bid) se obtuvo mayor respuesta, pero con más efectos adversos. Los autores concluyeron que la dosis de 8 μg bid es la que proporciona mejor combinación de eficacia y seguridad.105 El fármaco fue bien tolerado y los efectos indeseables fueron náusea (8% vs. 4% en comparación con el placebo) y diarrea (6% vs. 4% respecto del placebo).106
I2. Linaclotida
I2.1. Mecanismo de acción y efectos adversos. Es un péptido de 14 aminoácidos que actúa en el intestino a través de la activación de los receptores de la ciclasa-c de guanilato en los enterocitos. El efecto en estos receptores propicia un incremento del monofosfato de guanosina cíclico y activación del CFRT, lo que lleva al incremento de la secreción de cloro y bicarbonato a la luz intestinal.107
I2.2. Evidencia clínica. En un primer estudio de fase II, doble ciego y aleatorio, controlado con placebo. se utilizó 0.1 mg de linaclotida (1 mg c/24 h) en 36 mujeres con SII-E. El fármaco redujo el tiempo medio de vaciamiento del colon ascendente (7.8 ± 1.7 h vs. placebo de 17 ± 2 h, p <0.01) y el tiempo total del tránsito colónico y aumentó la frecuencia de las evacuaciones, consistencia de las heces y facilidad para la defecación. Los efectos fueron dependientes de la dosis y se observaron con 1 mg.108
Datos preliminares de un estudio de fase IIB en el que se aleatorizaron 420 pacientes con SII-C de acuerdo con el consenso de Roma II y se trataron con diferentes dosis de linaclotida (75, 150, 300 y 600 mg al día por 12 semanas) muestran un beneficio en la frecuencia de las evacuaciones y el dolor abdominal.109 Hoy en día, el fármaco está sometido a estudios de fase III.
I3. Renzaprida
Un nuevo agente serotoninérgico en el tratamiento del SII-R es la renzaprida, un agonista de los receptores 5-HT4 y antagonista de los 5-HT3. El efecto se ha documentado en pacientes con SII y EC. En un estudio de farmacodinamia de fase II controlado con placebo se administraron durante 11 a 14 días tres dosis de renzaprida (1, 2 y 4 mg/día) en comparación con placebo en 48 pacientes (46 mujeres y dos varones) con SII-E, según los criterios de Roma II. Se encontró una dosis-respuesta significativa para el tiempo de tránsito de colon y colon ascendente, pero no para el vaciamiento gástrico o el movimiento propulsivo del intestino delgado. Hubo mejoría de los síntomas, con disminución de la consistencia de las heces y reducción del tiempo de tránsito colónico. No se presentaron efectos adversos clínicos, de laboratorio ni cambios electrocardiográficos.110
Se realizó un ensayo clínico de fase IIB y se informaron los resultados de un estudio doble ciego de 510 pacientes con SII-C que recibieron renzaprida (1, 2 y 4 mg/día) o placebo; la mejoría no alcanzó significancia estadística, pero en un análisis post hoc se reconoció una respuesta en mujeres con dosis de 4 mg (12%). Un elevado porcentaje de los enfermos suspendió el tratamiento, en primer lugar por los efectos adversos (diarrea, cefalea y dolor abdominal).111,112 Los estudios indican que la renzaprida podría ser útil en individuos con SII-E.
I4. Ramosetrón
Es un antagonista de los receptores 5-HT3 que se ha evaluado para el tratamiento del SII-D. Se llevó a cabo un estudio de fase III, doble ciego, aleatorizado, de 12 semanas, con dosis de 5 mg de ramosetrón controlado con placebo en 539 pacientes en Japón con SII-D (criterios de Roma II). Se identificó una mejoría global de los síntomas del SII (47% del ramosetrón vs. 27% del placebo). No se registraron efectos adversos graves. Recibió aprobación para los varones con SII-D en Japón en octubre de 2008.113
En un estudio de fase II realizado en Europa que incluyó a 691 pacientes tratados durante 12 semanas con cuatro diferentes dosis (2.5, 5, 10, 20 +g), se observó una mejoría de los síntomas y alivio del dolor abdominal respecto del placebo.113 No se ha informado colitis isquémica, pero el número de personas expuestas al fármaco es reducido. Están en preparación estudios de fase III en Estados Unidos y Europa.
Correspondencia: Dr. José María Remes Troche.
Laboratorio de Fisiología Digestiva y Motilidad Gastrointestinal, Instituto de Investigaciones
Medico-Biológicas, Universidad Veracruzana, Veracruz. Iturbide S/N, Colonia Flores Magón, C.P. 91400. Veracruz, Veracruz.
Teléfono: (229) 922 3292. Fax: (229) 202-1231.
Correo electrónico:joremes@uv.mx, jose.remes.troche@gmail.com