Presentamos el caso de un varón de 30 años sin antecedentes de interés, quien consultó por una tumoración a nivel de la articulación esternoclavicular izquierda, sin traumatismo previo. A la exploración se palpaba una tumoración de 6cm bien delimitada, fija y adherida a planos profundos.
Se realizó ecografía de partes blandas que mostraba una masa heterogénea hipoecoica con calcificaciones, marcada vascularización y patrón de destrucción óseo en la clavícula adyacente.
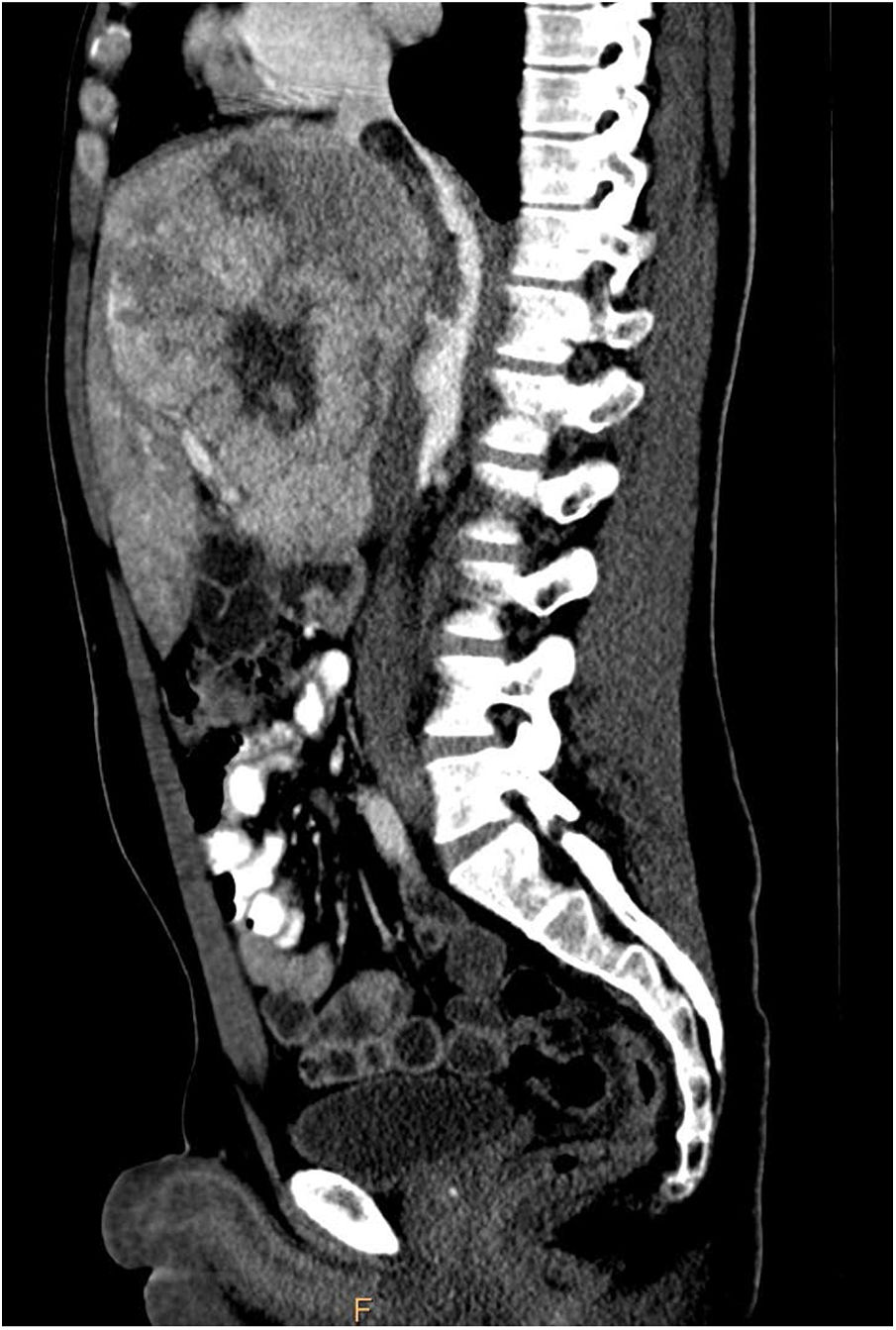
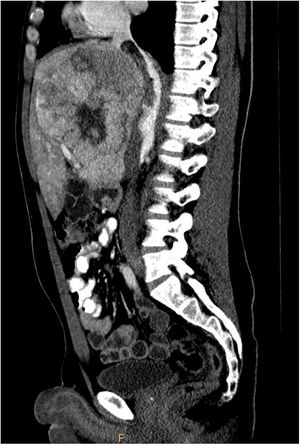
Se completó el estudio con una RMN en la que se describía una masa redondeada en epífisis proximal de clavícula izquierda, hipointensa en T1 y discretamente hiperintensa en T2, que presentaba signos de agresividad con rotura de la cortical (fig. 1).
Se realizó biopsia de la masa observando un infiltrado por una proliferación tumoral con crecimiento en nidos, con celularidad de talla grande con amplios citoplasmas eosinófilos granulares. La inmunohistoquímica mostraba positividad citoplasmática a Hepatocyte Paraffin 1 (Hep Par-1), Glypican-3 (GPC3), antígeno epitelial de membrana (EMA) y citoqueratina 7 (CK7). Todo ello era compatible con metástasis de carcinoma hepatocelular (CHC).
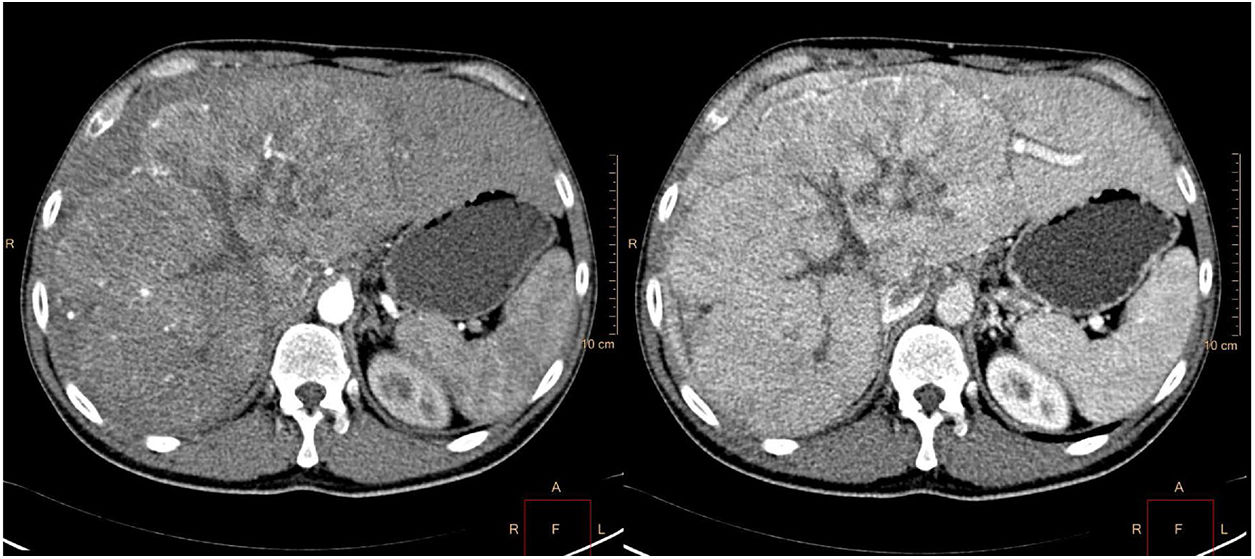
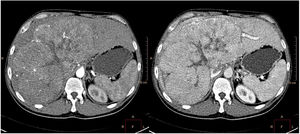
Se remitió a consulta para completar el estudio. A la exploración física destacaba una hepatomegalia del lóbulo hepático derecho. Analítica sanguínea con bilirrubina 1.5mg/dl, AST 154U/l, ALT 159U/l, alfa-fetoproteína 170119ng/ml (0-6). Se solicitó TAC de abdomen observando una masa de 23cm de diámetro en lóbulo hepático derecho, con centro cicatricial estrellado y contornos lobulados, con presencia de vascularización muy patente en fase arterial, realce heterogéneo en fase portal y lavado en fase de equilibrio (fig. 2).
Dado el contexto clínico y el perfil inmunohistoquímico se diagnosticó de hepatocarcinoma fibrolamelar (CHC-FL) estadio iv. Se inició tratamiento quimioterápico con gemcitabina y oxaliplatino (GEMOX) así como radioterapia paliativa sobre la lesión clavicular, con seguimiento por el servicio de Oncología.
El CHC-FL es una rara variante del CHC. Representa el 1-9% de todos los carcinomas hepáticos primarios con una incidencia de 0.02 casos/100,000 habitantes año1. Afecta principalmente a jóvenes menores de 40 años, sin diferencias en cuanto al sexo y en la gran mayoría de pacientes sin hepatopatía previa2.
Está causado por mutación DNAJB1-PRKACA en el cromosoma 19 con deleción de 8 genes, siendo los más comunes MUC4 (asociado a otros tumores gastrointestinales) y GOLCA6L23.
Habitualmente se acompaña de síntomas inespecíficos (dolor abdominal, distensión abdominal, ictericia) por lo que hasta un 70% se diagnostican en estadios avanzados de la enfermedad. Se han publicado otras presentaciones inusuales del CHC-FL como síndrome de Budd-Chiari, hemoperitoneo, ginecomastia, metástasis ósea, fallo hepático agudo y síndromes paraneoplásicos como hipoglucemia, hipertiroidismo y trombosis venosa profunda4.
La vía de diseminación más frecuente del CHC-FL es la ganglionar (50-70%), siendo la invasión venosa o arterial poco frecuente. Los lugares más frecuentes de metástasis a distancia son el pulmón, el peritoneo y las glándulas suprarrenales5. La alfafetoproteína se eleva solamente en una minoría de los casos6.
La radiología es esencial para el diagnóstico, requiriéndose estudios multifásicos mediante TC y/o RMN para una evaluación correcta. Se debe realizar diagnóstico diferencial con otras lesiones hepáticas focales como la hiperplasia nodular focal, el adenoma hepatocelular, el CHC clásico y las metástasis hepáticas.
En el estudio con TC suele presentarse como una lesión grande y heterogénea, bien definida y polilobulada, hipodensa sin contraste y con calcificaciones (40-68%). Alrededor del 70% tiene una cicatriz central estrellada, no patognomónica. En fase arterial se produce un realce heterogéneo temprano; en fases portal y de equilibrio el realce es variable7.
En la RMN el CHC-FL es hipointenso en secuencias potenciadas en T1 e hiperintenso en secuencias potenciadas en T2, mientras que la cicatriz central es hipointensa en ambos tipos de secuencias.
No obstante, la mayoría de las veces los hallazgos radiológicos no son concluyentes para el diagnóstico, siendo necesaria la histología. El perfil inmunohistoquímico con tinción positiva para Hep Par-1 y GPC3 es similar al CHC; sin embargo, CK7, EMA y CD68 son positivos solo en el CHC-FL8.
En relación con el tratamiento, la resección hepática y el trasplante hepático son las únicas opciones de tratamiento potencialmente curativo. La resección hepática agresiva es el tratamiento de elección en la mayoría de los casos. La resección hepática consigue supervivencias a los 5 años que oscilan entre 26-76%9. La supervivencia libre de enfermedad a los 5 años es baja (18%). A pesar de ello e incluso en pacientes con enfermedad avanzada, parece que la cirugía agresiva aporta beneficio en términos de supervivencia10. En la actualidad, el papel de la quimioterapia en el CHC-FL es controvertido, dada la ausencia de estudios de calidad que demuestren beneficio en la supervivencia.
Tradicionalmente el CHC-FL ha sido considerado menos agresivo que el CHC clásico. Sin embargo, dicha afirmación se está cuestionando ya que, en estadio similar y en pacientes no cirróticos, el CHC-FL no tiene mejor pronóstico ni responde de forma diferente al tratamiento que el CHC. Esto hace pensar que el hecho de poder aplicar tratamientos potencialmente curativos en el CHC-FL en un mayor número de casos pueda estar relacionado con la ausencia de cirrosis y la edad joven al diagnóstico11.
En conclusión, el CHC-FL requiere la combinación de hallazgos clínicos, radiológicos e histológicos para su diagnóstico. La peculiaridad de este caso es la inusual presentación en forma de tumoración metastásica clavicular. Esta localización metastásica ha sido descrita en la literatura en relación con otros tumores (cáncer papilar de tiroides12, feocromocitoma) pero no existe ningún caso publicado de tumoración clavicular secundaria a un CHC-FL.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos personales de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo el artículo.
Conflicto de interesesLos autores firmantes declaran no presentar conflicto de interés alguno.