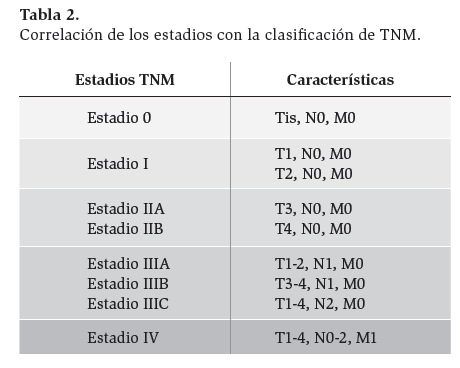
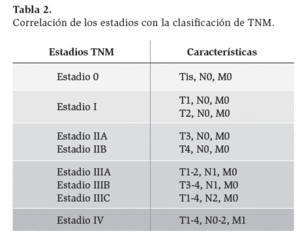
Hasta el momento la única posibilidad de curar el carcinoma de colon y recto ha consistido en la resección quirúrgica. Para establecer los resultados del tratamiento quirúrgico es conveniente clasificar los carcinomas del colon y del recto de acuerdo con la extensión de la diseminación. En algunas instituciones se ha abandonado por completo la clasificación de Dukes y su modificación por Astler y Coller por la clasificación de TNM, en la que se registra mucho más información sobre el tumor primario (T), los ganglios linfáticos (N) y las metástasis a distancia (M) (tablas 1 y 2).
Tabla 1. Estadios del cáncer de colon de acuerdo con el American Joint Committee on Cancer (AJCC) actualización de 2003.
Tabla 2. Correlación de los estadios con la clasificación de TNM.
¿Cuál es el mejor tratamiento para el cáncer de colon?Las técnicas de resección para los tumores de colon han mejorado sustancialmente gracias al conocimiento de los mecanismos de diseminación, con lo que se ha logrado aumentar las tasas de curación. La elección de la técnica quirúrgica depende de diversos factores que en todos los enfermos se deben tomar en consideración. Éstos son: estado general del sujeto, el sitio de localización del tumor, la presencia de obstrucción y/o de metástasis locales o a distancia, si la cirugía es electiva o de urgencia y si existe una preparación adecuada del colon. La resección de los diversos segmentos del colon incluye, como piedra angular, la ligadura, desde su origen, de la arteria que irriga dicho segmento. Se recomienda un margen de resección de 5 a 8 cm de distancia del tumor. Esto se logra, por lo general, con las técnicas ya establecidas de resección como son: hemicolectomía derecha, hemicolectomía derecha extendida, transversectomía, hemicolectomía izquierda, hemicolectomía izquierda extendida, sigmoidectomía y colectomía subtotal o total. Nivel de evidencia I. Recomendación A. En cualquiera de las técnicas antes mencionadas, cuando el tumor está adherido a otros órganos, se debe hacer la resección en bloque de la zona afectada para disminuir la posibilidad de recurrencia. La morbilidad y mortalidad están determinadas por el o los órganos que son resecados. Nivel de evidencia II. Recomendación B.
¿Qué enfermos se curan con la cirugía?Enfermos con tumores en estadio I (T1, N0, M0 y T2, N0, M0) y II sin factores de riesgo. En éstos, la quimioterapia adyuvante no ha demostrado impacto en supervivencia. En 40-50% de enfermos con tumores en estadio III. Nivel de evidencia I.
¿En qué enfermos son necesarios otros tratamientos además de la cirugía?En sujetos con tumores en estadio II con factores de riesgo [invasión linfovascular, tumores T4, obstrucción, tumores pobremente diferenciados, inadecuado número de ganglios valorables en la pieza quirúrgica (menos de 12)]. Nivel de evidencia II. Recomendación B. El 15% de los enfermos en estadio III se bene- ficiarán con el esquema de tratamiento adyuvante. Nivel de evidencia II. Recomendación B. En los pacientes en estadios avanzados (estadio IV), la quimioterapia se utiliza para paliación. Nivel de evidencia I. Recomendación B.
¿Son los nuevos esquemas de tratamientos biológicos mejores que los tradicionales?Se ha evaluado el papel de los nuevos agentes biológicos tanto en primera como en segunda línea de tratamiento. El bevacizumab, en combinación con esquemas que contengan oxaliplatino o irinotecán ha demostrado aumentar significativamente el porcentaje de respuesta, el tiempo a la progresión y a la supervivencia global. Nivel de evidencia II. Recomendación A.
¿Cuáles son los esquemas de tratamiento adyuvante recomendados?Estadios II sin factores de riesgo (T3, N0, M0): capecitabina o 5-FU/leucovorin o 5-FU/leucovorin/ oxaliplatino (FOLFOX).
Estadios II con factores de riesgo y estadios III: 5-FU/leucovorin/oxaliplatino o capacitabina o 5- FU/leucovorin.
Estadios IV con metástasis resecable (hígado o pulmón): FOLFIRI (5-FU/leucovorin/irinotecán) o FOLFOX o capacitabina + oxaliplatino (CapeOX) con o sin bevacizumab.
Estadios IV con metástasis no resecable: terapia de infusión intraarterial hepática con o sin infusión sistémica de: 5-FU/leucovorin. Para enfermedad metastásica confinada al hígado: 5-FU infusión IV continua.
Para enfermedad metastásica peritoneal no obstructiva: FOLFOX/bevacizumab o CapeOX/bevacizumab o FOLFIRI/bevacizumab.
Otra opción: 5-FU/leucovorin/bevacizumab. Nivel de evidencia I. Recomendación B.
¿Cuál es el tratamiento de elección para la enfermedad metastásica peritoneal obstructiva?Para la enfermedad metastásica peritoneal obstructiva el tratamiento es quirúrgico (by-pass, ileostomía o colostomía) o la colocación endoscópica de prótesis. Nivel de evidencia II. Recomendación B.
¿Cuál es el tratamiento de elección para la enfermedad metastásica confinada al hígado?Metástasis resecables en la cirugía índice (primera cirugía): resección. Metástasis no resecable en la cirugía índice: dar esquema de quimioterapia descrito anteriormente con objeto de convertirla en resecable y cirugía posterior. El hígado es el sitio predominante de metástasis de cáncer colorrectal; cuando son aisladas pueden recibir un tratamiento individual. Existen diversos procedimientos útiles, pero el más eficiente es el tratamiento quirúrgico. La selección de pacientes exige la ausencia de enfermedad extrahepática no tratable, infiltración de la arteria hepática, de los conductos biliares mayores o de la vena porta y se debe calcular una adecuada función hepática residual. Nivel de evidencia II. Recomendación B. Convencionalmente, las indicaciones señalan que debe haber menos de cuatro metástasis en un solo lóbulo y menores de 5 cm, corroborados con biopsia; sin embargo, está surgiendo la tendencia de ampliar las indicaciones, pero deben adaptarse a la experiencia y disponibilidad de recursos. Con este tratamiento se ha logrado sobrevida de 36% a cinco años y una sobrevida media de 42.5 meses. En el caso excepcional de que exista enfermedad primaria no diseminada, excepto por metástasis hepática, es posible darle tratamiento a ambos sitios en el mismo tiempo operatorio. Nivel de evidencia 2. Recomendación B.
¿Cuál es el tratamiento del cáncer del recto?La elección de la técnica quirúrgica en el recto depende de los siguientes factores: estado general del paciente, nivel de localización del tumor, tamaño, movilidad, tipo histológico, presencia de obstrucción o de metástasis local o a distancia, cirugía electiva o de urgencia, entre otras. No existe un límite anatómico definido entre el colon y recto y en diversos estudios se utilizan diferentes referencias anatómicas, como el promontorio sacro, la tercera vértebra sacra y distancia desde el ano. Para fines prácticos el recto se divide en tercios. El tercio inferior abarca de la línea anorrectal hasta los 7 cm; el tercio medio, de 7 a 11 cm, y el tercio superior, de 11 a 15 cm. Aún existe controversia acerca de la mejor resección curativa con preservación del aparato esfinteriano, el procedimiento operatorio estándar exige la extirpación del cáncer con márgenes adecuados, incluyendo los ganglios linfáticos regionales. Los procedimientos quirúrgicos disponibles son: resección local, extirpación con anastomosis anterior, anterior baja o coloanal y resección abdominoperineal. La dificultad técnica para efectuar la anastomosis, la elevada morbilidad debida a la fuga anastomótica y sepsis, aunadas a un margen distal adecuado, son motivos de preocupación para el cirujano. Con respecto a esto último, en múltiples estudios se ha demostrado que un margen de 2 a 2.5 cm del borde inferior del tumor es adecuado para una cirugía curativa que incluye la zona linfática de la región. Nivel de evidencia II. Recomendación B.
¿Cuáles son las opciones de tratamiento para el cáncer del recto?Dependen de su localización y estadio:
Estadio I (T1, N0, M0 y T2, N0, M0):
Tercio inferior: escisión local, resección radical o resección abdominoperineal (no se recomienda la terapia adyuvante). T2: resección local con terapia adyuvante en el pre o posoperatorio. Resección local sin terapia adyuvante o resección abdominoperineal.
Tercio medio: resección total mesorrectal, resección radical, resección anterior baja con anastomosis, con o sin colostomía protectora. T2: resección total mesorrectal con terapia adyuvante en el pre o posoperatorio. La terapia adyuvante no es necesaria en la resección radical, pero es recomendable en la resección total mesorrectal.
Tercio superior: resección anterior baja. Nivel de evidencia II. Recomendación B.
Estadios II y III [estadio II tiene invasión a la grasa mesorrectal (T3) y no invade los ganglios linfáticos mesorrectales. El estadio III incluye T1, T2 y T3 con invasión a ganglios linfáticos]:
Tercio inferior: se recomienda terapia adyuvante preoperatoria seguida de resección radical o resección abdominoperineal; si no está claramente definido el estadio, se recomienda terapia adyuvante en el posoperatorio.
Tercio medio: se utilizan los mismos criterios que se mencionan en el tercio inferior y se pre- fiere realizar resección anterior baja en lugar de resección abdominoperineal.
Tercio superior: resección anterior baja con terapia adyuvante en el pre o posoperatorio. Nivel de evidencia II. Recomendación B.
Estadio IV (T1-4, cualquier N, M1):
El tratamiento depende de la extensión de las metástasis; la mejor opción es el tratamiento quirúrgico y médico de la enfermedad metastásica; el control del tumor primario locorregional debe ser agresivo y similar a las recomendaciones con excepción de los casos más avanzados. Nivel de evidencia II. Recomendación B.
¿Cuál es el papel de la radioterapia?El uso de radioterapia externa en el manejo del cáncer rectal ha recibido considerable atención en años recientes como un tratamiento adyuvante pre o posoperatorio; no hay uniformidad de criterios para establecer superioridad de uno de estos métodos sobre el otro, ya que hay estudios fuertemente preferentes por uno u otro. La radioterapia preoperatoria tiene las siguientes ventajas sobre la posoperatoria: puede disminuir el tamaño del tumor y la extensión de la invasión tumoral, es más probable que el enfermo complete el tratamiento, permite una resección completa, aumenta las posibilidades de cirugía con preservación del aparato esfinteriano, los tejidos se encuentran mejor oxigenados, y por tanto, son más sensibles, puede disminuir la siembra local o a distancia de células cancerosas desprendidas al momento de la cirugía, las asas del intestino delgado se encuentran excluidas de la pelvis y disminuye el riesgo de recurrencia local. La ventaja de la radioterapia posoperatoria es que se conoce la extensión total del tumor, y por ello, se evita la radiación de quien no la necesita. Las desventajas incluyen el incremento en la posibilidad de radiar intestino delgado, dado que éste se deposita en la pelvis después de la cirugía y existe una mayor tasa de disfunción del reservorio colónico. No hay un consenso unánime en cuanto a la dosis de radiación que se debe utilizar. Las dosis de radioterapia más utilizadas preoperatoriamente son en dos modalidades: la rápida de 25 Gy en una semana y la normal o de larga duración de 45 Gy en cinco a seis semanas, en una proporción de 1.8 Gy diarios en 25 sesiones; se deja pasar cinco a ocho semanas y se procede con la cirugía. La dosis posoperatoria es similar, 45 a 50.4 Gy, con una fracción de 1.8 Gy diarios. Nivel de evidencia II. Recomendación B.
¿Cuál es la vigilancia postratamiento curativo?