El cáncer primario de hígado es un problema de salud pública en México y en el mundo. El trasplante hepático (TH) es el tratamiento ideal para el carcinoma hepatocelular (CHC) temprano. El objetivo fue evaluar las características de los pacientes con CHC y colangiocarcinoma (CC) en dos centros e identificar a los candidatos a trasplante.
Material y métodosEstudio retrospectivo, observacional del 2012 al 2018 en el Centro de Hepatología (CH) y el Centro Universitario contra el Cáncer (CUCC). Se confirmó CHC o colangiocarcinoma intrahepático (CCi) en 109 pacientes, a los CHC se les aplicaron clasificaciones de estadiaje, modelos de selección para trasplante y modelo pronóstico de recidiva post-TH.
ResultadosDe la población total, 93% (n = 102) eran cirróticos. El 86% (n = 94) tuvo CHC (58% CH y 42% CUCC) y 14% (n = 15) CCi (40% CH y 60% CUCC). En los pacientes con CHC del CH predominó Okuda I-II, clasificación de Barcelona Clinic Liver Cancer (BCLC) A-B y niveles < 100 ng/mL de alfafetoproteína (AFP), mientras que en el CUCC predominó Okuda II-III, BCLC C-D y niveles > 1,000 ng/mL de AFP. La mitad de la población del CH con CHC cumplía con los criterios para TH, en cambio, en el CUCC solo lo hizo el 23%. Se valoraron 15 pacientes para TH y, a la fecha, se trasplantaron seis.
ConclusionesLa neoplasia primaria de hígado más frecuente fue CHC. Los pacientes del CH presentaron la enfermedad más temprana y una proporción más alta cumplía con los criterios para TH. Solo quienes pertenecían a este centro recibieron un trasplante.
Primary liver cancer is a public health problem in Mexico and the world. Liver transplantation (LT) is the ideal treatment for early hepatocellular carcinoma (HCC). Our aim was to evaluate the characteristics of patients with HCC and cholangiocarcinoma (CC) at two centers and identify transplantation candidates.
Materials and methodsA retrospective observational study was conducted at the Hepatology Center (HC) and the University Center Against Cancer (UCAC), within the time frame of 2012-2018. HCC or intrahepatic CC was confirmed in 109 patients. Staging classifications, transplant selection models, and a predictive model for post-LT recurrence were applied to the HCC patients.
ResultsOf the total population, 93% (n = 102) presented with cirrhosis, 86% (n = 94) had HCC (HC: 58%, UCAC: 42%), and 14% (n = 15) had intrahepatic CC (HC: 40%, UCAC: 60%). Of the HC patients with HCC, Okuda I-II, BCLC A-B, and AFP levels < 100 ng/m predominated, whereas Okuda II-III, BCLC C-D, and AFP levels > 1,000 ng/mL predominated in the UCAC patients. Half of the HC population with HCC met the criteria for LT, in contrast to 23% of the UCAC patients. Fifteen patients were evaluated for LT, and at present, six have undergone transplantation.
ConclusionsThe most frequent primary liver tumor was HCC. Patients from the HC presented with earlier-stage disease and a high number of them met the criteria for LT. Only patients from the HC underwent transplantation.
Las neoplasias primarias del hígado constituyen un problema de salud pública en el mundo, de acuerdo con la Organización Mundial de la Salud (OMS), en 2018, se registraron 841,808 casos nuevos. Son la sexta causa de cáncer y ocupan el cuarto puesto de mortalidad por esta patología a nivel mundial1. En México, se ha reportado que, dentro de las causas de muerte relacionadas con la neoplasia, estas ocupan el tercer puesto2. El carcinoma hepatocelular (CHC) es la neoplasia primaria del hígado más frecuente3, seguida por el colangiocarcinoma (CC)4. Alrededor del 90% de los casos de CHC se desarrollan en pacientes con cirrosis, siendo las etiologías más frecuentes de esta última la infección crónica por el virus de la hepatitis B (VHB), el virus de la hepatitis C (VHC), la enfermedad hepática alcohólica (EHA) y, en los últimos años, la esteato hepatitis no alcohólica (EHNA). Otras causas menos recurrentes de CHC son las enfermedades hepáticas autoinmunes, la hemocromatosis, la exposición a aflatoxinas y la enfermedad de Wilson3,5, entre otras.
El CC es un tumor agresivo que se desarrolla a partir del epitelio de la vía biliar y se divide en intrahepático (CCi) y extrahepático (CCe). El CCe, a su vez, se clasifica en hiliar/peri hiliar (tumor de Klatskin) y distal6. Se ha encontrado una asociación positiva del CC con la cirrosis hepática, la infección por VHB, el VHC, la colangitis esclerosante primaria, la coledocolitiasis, la obesidad, la diabetes mellitus tipo 2 (DM2) y el tabaquismo7,8. El tumor combinado de CHC-CC es una neoplasia poco común que representa < 5% de todas las neoplasias primarias de hígado9. En estudios de imagen, el CHC-CC es casi indistinguible del CHC, e incluso en la biopsia, puede que se obtenga material de solo uno de los componentes10. Esto dificulta el diagnóstico y, con frecuencia, es confirmado después de un trasplante hepático (TH), en el estudio histopatológico del explante11.
De acuerdo con las guías internacionales3,5, el manejo terapéutico del CHC se divide en curativo y no curativo. La resección quirúrgica, la ablación por radiofrecuencia (ARF), la crioterapia, la inyección percutánea de etanol y el TH son considerados tratamientos curativos para el CHC, por su efectividad a largo plazo. Las terapias no curativas disponibles son la quimioembolización transarterial (TACE), la radioembolización y la terapia sistémica con sorafenib, estas retrasan la progresión del tumor y aumentan la sobrevida de los pacientes5,12. Respecto al CC, este puede ser tratado con resección quirúrgica, ARF, TACE y en estadios avanzados se opta por quimioterapia sistémica (QT)13.
En la actualidad, el TH es el tratamiento ideal para el CHC, debido a que se retira tanto el tumor, como el hígado cirrótico14. Estudios recientes han publicado que hasta el 30% de todos los TH en Europa y Estados Unidos son realizados en pacientes con CHC3,15. A pesar de que es considerado el mejor tratamiento, no todos son candidatos a este. Los criterios de Milán son el estándar de oro mundial para la selección de los mejores candidatos con CHC temprano para TH16. Los individuos con tumores dentro de los criterios de Milán tienen una probabilidad de sobrevida a cinco años mayor al 70%, no obstante, se han reportado sobrevidas similares en pacientes con tumores más allá de los criterios de Milán, sugiriendo que es un modelo muy restrictivo17. Otros lineamientos distintos a los criterios de Milán han incorporado marcadores bioquímicos como la alfafetoproteína (AFP) para mejorar la predicción de sobrevida y disminuir el riesgo de recurrencia post TH18.
Históricamente, el CCi era una contraindicación absoluta para TH, debido a las altas tasas de recurrencia del tumor11,13 y la baja sobrevida reportada (< 25% a cinco años)19. Además, con frecuencia, el diagnóstico se realiza de manera tardía, cuando los tratamientos curativos ya no son opción20. En los últimos años, algunos estudios han reportado que los tumores únicos de CCi, ≤ 2 cm tienen una sobrevida similar a los tumores de CHC dentro de los criterios de Milán20,21. El objetivo de este estudio fue evaluar las características de las neoplasias primarias de hígado e identificar a los posibles candidatos a TH en dos centros del Hospital Universitario de la Universidad Autónoma de Nuevo León (UANL).
Material y métodosDiseño de estudio y criterios de inclusiónSe realizó un estudio retrospectivo observacional en el Centro de Hepatología (CH) y el Centro Universitario contra el Cáncer (CUCC), ambos pertenecientes al Hospital Universitario «Dr. José Eleuterio González», en pacientes con neoplasia primaria del hígado confirmada en el período del primero de enero del 2012 al 31 de diciembre del 2018. Se incluyeron a personas mayores de 18 años, que contaran con más de una consulta médica de seguimiento, con o sin cirrosis.
Variables de estudioSe evaluaron las características demográficas de la población, las comorbilidades, la etiología de la cirrosis, las clasificaciones de función hepática (Child-Pugh en pacientes cirróticos, model for end-stage liver disease [MELD]), además, el número de tumores, el diámetro tumoral mayor y el nivel sérico de AFP al diagnóstico de CHC. En este trabajo solo nos enfocamos en las neoplasias primarias del hígado, CHC y CCi, no se incluyeron los CCe. Se utilizaron las clasificaciones de Okuda22 y la de Barcelona Clinic Liver Cancer (BCLC)23 para estadiar a los pacientes con CHC en A-temprano, B-intermedio, C-avanzado y D-terminal. Se aplicaron los criterios de Milán16 y los de la Universidad de California San Francisco (UCSF)17 para determinar quiénes eran aptos para recibir un TH y con el modelo de AFP17 se agrupó a la población en bajo (≤ dos puntos) y alto (> dos puntos) riesgo de recurrencia de CHC post TH.
Los CCi se subdividieron en temprano (tumor único ≤ 2 cm) y tardío (> 2 cm o multinodular ± invasión microvascular y/o diseminación a distancia)20. Se enlistaron los tratamientos recibidos y se registró a la población que fue valorada para recibir un TH, así como a los pacientes que lo recibieron. Se documentó la sobrevida de cada grupo.
Análisis estadísticoPara el análisis estadístico se utilizaron las medidas de tendencia central (media, desviación estándar y porcentajes). Se aplicó la prueba F de Fisher y X2 a las variables categóricas y la prueba de T de Student y U de Mann-Whitney a las variables continuas. Las curvas de sobrevida de Kaplan-Meier se compararon con la prueba de log-rank. Se tomó como significancia estadística una p < 0.05.
Consideraciones éticasEl estudio fue aprobado por el comité de ética e investigación del Hospital Universitario «Dr. José Eleuterio González» (registro HI18-00001).
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que se ha preservado el anonimato de los datos.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo el consentimiento informado no se solicitó para la publicación porque no se revelan datos personales que permitan identificar al paciente.
Población de estudioSe evaluaron 189 pacientes entre ambos centros, se excluyeron 42 por confirmación de otro diagnóstico y 38 por falta de seguimiento. Se incluyeron 109 en los cuales el diagnóstico de CHC y/o CC se confirmó mediante un estudio de imagen contrastado (tomografía computarizada o resonancia magnética) y elevación de AFP (CHC) o histopatología.
Del total de la población estudiada, 61 (56%) pacientes pertenecían al CH y 48 (44%) al CUCC. La edad promedio al diagnóstico fue de 64 ± 11.18 (29 a 91) años, 71 (65%) eran hombres. En el CH se realiza screening a pacientes cirróticos cada seis meses con ultrasonido (US) y medición de AFP, en el CUCC no se hace tamizaje debido a que los individuos acuden ya con el diagnóstico de cáncer, es un centro que recibe población abierta para cualquier tipo de neoplasia ya identificada.
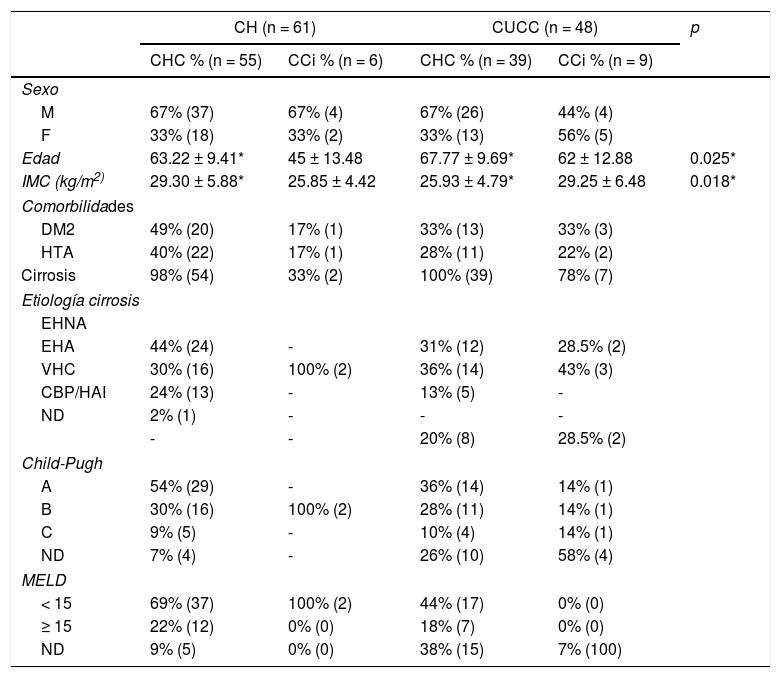
ResultadosDe la población total de estudio en ambos centros, 94 (86%) pacientes fueron diagnosticados con CHC, de los cuales 67% (n = 63) eran hombres, 65 ± 9.69 años. El 99% (n = 93) de los pacientes con CHC tenía cirrosis al diagnóstico, siendo la etiología más frecuente la EHNA. Un total de 15 (14%) personas presentó CCi, de las cuales, 53% (n = 8) fueron hombres con una edad promedio de 56 ± 14.89. El 60% (n = 9) de la población con CC era cirrótica y la etiología más prevalente fue la EHA (tabla 1). En el CH, 90% (n = 55) de los pacientes tuvieron diagnóstico de CHC y 10% (n = 6) CCi, en cambio, en el CUCC, 81% (n = 39) de la población obtuvo un diagnóstico de CHC y 19% (n = 9) con CCi. Se encontró que 34% (n = 37) de todos los pacientes tenían DM2 y 33% (n = 36) padecían hipertensión arterial (HTA). En el CUCC, 22% (n = 2) de los casos de CCi tenían antecedente de colecistolitiasis y colecistectomía. Se determinó Child-Pugh al diagnóstico en 85% (n = 79) de los pacientes cirróticos con CHC y 55% (n = 5) de los CC. Predominó la clasificación A de Child-Pugh en los individuos con CHC. La mayor parte de la población en ambos centros obtuvo un puntaje < 15 de MELD (tabla 1).
Demografía, etiologías y clasificaciones funcionales
| CH (n = 61) | CUCC (n = 48) | p | |||
|---|---|---|---|---|---|
| CHC % (n = 55) | CCi % (n = 6) | CHC % (n = 39) | CCi % (n = 9) | ||
| Sexo | |||||
| M | 67% (37) | 67% (4) | 67% (26) | 44% (4) | |
| F | 33% (18) | 33% (2) | 33% (13) | 56% (5) | |
| Edad | 63.22 ± 9.41* | 45 ± 13.48 | 67.77 ± 9.69* | 62 ± 12.88 | 0.025* |
| IMC (kg/m2) | 29.30 ± 5.88* | 25.85 ± 4.42 | 25.93 ± 4.79* | 29.25 ± 6.48 | 0.018* |
| Comorbilidades | |||||
| DM2 | 49% (20) | 17% (1) | 33% (13) | 33% (3) | |
| HTA | 40% (22) | 17% (1) | 28% (11) | 22% (2) | |
| Cirrosis | 98% (54) | 33% (2) | 100% (39) | 78% (7) | |
| Etiología cirrosis | |||||
| EHNA | |||||
| EHA | 44% (24) | - | 31% (12) | 28.5% (2) | |
| VHC | 30% (16) | 100% (2) | 36% (14) | 43% (3) | |
| CBP/HAI | 24% (13) | - | 13% (5) | - | |
| ND | 2% (1) | - | - | - | |
| - | - | 20% (8) | 28.5% (2) | ||
| Child-Pugh | |||||
| A | 54% (29) | - | 36% (14) | 14% (1) | |
| B | 30% (16) | 100% (2) | 28% (11) | 14% (1) | |
| C | 9% (5) | - | 10% (4) | 14% (1) | |
| ND | 7% (4) | - | 26% (10) | 58% (4) | |
| MELD | |||||
| < 15 | 69% (37) | 100% (2) | 44% (17) | 0% (0) | |
| ≥ 15 | 22% (12) | 0% (0) | 18% (7) | 0% (0) | |
| ND | 9% (5) | 0% (0) | 38% (15) | 7% (100) | |
CBP/HAI: colangitis biliar primaria/hepatitis autoinmune; CCi: colangiocarcinoma intrahepático; CH: Centro de Hepatología; CHC: carcinoma hepatocelular; CUCC: Centro Universitario contra el Cáncer; DM2: diabetes mellitus tipo 2; EHA: enfermedad hepática alcohólica; EHNA:esteatohepatitis no alcohólica; HTA: hipertensión arterial; IMC: índice de masa corporal; MELD: model for end-stage liver disease ND: no determinada; VHC: virus de la hepatitis C.
* Resultados de la comparación de los pacientes con CHC de cada centro.
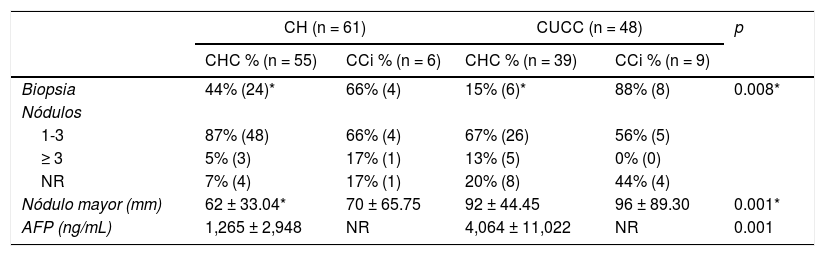
En ambos lugares, la mayoría de la población estudiada (76%) tuvo entre uno a tres nódulos (tabla 2). Se encontró una diferencia significativa en el diámetro del tumor mayor de CHC entre el CH y el CUCC. En 12 de 15 (80%) pacientes con CCi del CH se diagnosticaron mediante biopsia, en tres el TAC contrastado fue interpretado con datos sugestivos de CCi por un radiólogo experimentado. En dos personas con CCi del CUCC, el diagnóstico se hizo posterior a un hallazgo en una colecistectomía.
Características de la neoplasia
| CH (n = 61) | CUCC (n = 48) | p | |||
|---|---|---|---|---|---|
| CHC % (n = 55) | CCi % (n = 6) | CHC % (n = 39) | CCi % (n = 9) | ||
| Biopsia | 44% (24)* | 66% (4) | 15% (6)* | 88% (8) | 0.008* |
| Nódulos | |||||
| 1-3 | 87% (48) | 66% (4) | 67% (26) | 56% (5) | |
| ≥ 3 | 5% (3) | 17% (1) | 13% (5) | 0% (0) | |
| NR | 7% (4) | 17% (1) | 20% (8) | 44% (4) | |
| Nódulo mayor (mm) | 62 ± 33.04* | 70 ± 65.75 | 92 ± 44.45 | 96 ± 89.30 | 0.001* |
| AFP (ng/mL) | 1,265 ± 2,948 | NR | 4,064 ± 11,022 | NR | 0.001 |
AFP: alfafetoproteína; CCi: colangiocarcinoma intrahepático; CH: Centro de Hepatología; CHC: carcinoma hepatocelular; CUCC: Centro Universitario contra el Cáncer; NR: no reportado.
* Resultados de la comparación de los pacientes con CHC de cada centro.
En 74 pacientes de ambos centros se obtuvo la determinación de AFP. De estos, 38 (51.3%) tenían un nivel menor a 100 ng/mL, 16 (21%) tenían entre 101 y 999 ng/mL y 20 (27%) igual o mayor a 1,000 ng/mL. El rango en el CH fue de 1.07 a 12,378 ng/mL y de 0.79 a 52,477 ng/mL en el CUCC (tabla 2). Respecto a la determinación del antígeno CA19-9 en pacientes con CCi, se registró en ocho de 15 (53%) entre ambos centros, con un promedio de 85.11 UI/mL (2 a 323 UI/mL) en el CH y 952.2 UI/mL (808.8 a 1,000 UI/mL) en el CUCC.
De acuerdo con las clasificaciones de estadiaje de CHC, en el CH predominó la de Okuda I-II y la BCLC A-B, mientras que, en el CUCC se usó la de Okuda II-III y la BCLC C-D (tabla 3). De acuerdo con los criterios de Milán y los de la UCSF, entre el 33 y el 51% de los pacientes del CH podían ser considerados para recibir TH ortotópico, en cambio, solo 12 a 23% de la población del CUCC cumplía con los criterios. Únicamente el 30% de todos los casos de CHC obtuvo ≤ dos puntos en el modelo de AFP (tabla 3). Entre ambos centros, 17 de 19 pacientes dentro de los criterios de Milán y 20 de 31 dentro de los de la UCSF obtuvieron una calificación ≤ dos puntos en el modelo de AFP. Ningún paciente que rebasara los criterios de Milán y los de la UCSF alcanzó una valoración de bajo riesgo en el modelo de AFP. Del total de la población, solo un paciente tuvo características de CCi temprano (CUCC).
Estadiaje y modelos de selección para TH en pacientes con CHC
| CH (n = 55) | CUCC (n = 39) | p | |
|---|---|---|---|
| OKUDA | 0.01 | ||
| I | 45% (25) | 13% (5) | |
| II | 42% (23) | 43% (17) | |
| III | 7% (4) | 18% (7) | |
| ND | 5% (3) | 26% (10) | |
| BCLC | 0.02 | ||
| A | 29% (16) | 18% (7) | |
| B | 40% (22) | 18% (7) | |
| C | 14% (8) | 33% (13) | |
| D | 13% (7) | 23% (9) | |
| ND | 4% (2) | 8% (3) | |
| Criterios de Milán | 31% (15/49) | 12% (3/26) | |
| Criterios de San Francisco | 51% (25/49) | 23% (6/26) | 0.036 |
| Modelo de AFP | > 2 61% (27/44) | > 2 86% (19/22) |
AFP: alfafetoproteína; BCLC: clasificación de Barcelona Clinic Liver Cancer; CH: Centro de Hepatología; CHC: carcinoma hepatocelular; CUCC: Centro Universitario contra el Cáncer; ND: no determinada; TH: trasplante hepático.
El 64% (n = 70) del total de la población recibió tratamiento. El 36% (n = 39) que no se sometió a terapia dentro del período de estudio fue debido a que se trasladaron a otra institución y/o ciudad para tratarse, fallecieron antes de obtener la terapia, continuaban en valoración para recibir TACE o sorafenib al corte del estudio, se opusieron a tratarse a pesar de la insistencia del médico o tenían problemas económicos para cubrir la terapia. En el CH se dio tratamiento curativo (resección quirúrgica, ARF, crioterapia, TH) a 32% (n = 10) de los pacientes con CHC y no curativo (TACE, sorafenib) a 68% (n = 21); referente a la población con CCi en este centro, solo tres personas recibieron terapia (QT: capecitabina, gemcitabina, cisplatino). En el CUCC, 11% (n = 3) de la población con CHC recibió tratamiento curativo (resección, crioablación), 52% (n = 14) no curativo (TACE, sorafenib) y 37% (n = 10) QT (ácido folínico, fluorouracilo, oxaliplatino ± capecitabina, oxaliplatino). De los pacientes con CCi que fueron tratados, 89% (n = 8) recibió QT (capecitabina, gemcitabina, cisplatino, fluorouracilo) y el 11% (n = 1) falleció antes de conseguir el tratamiento.
Durante el período de estudio, solo en el CH se valoraron 15 pacientes (27%) de la población para TH y se trasplantaron seis. De los nueve restantes: en un individuo progresó el tamaño del tumor y excedió los criterios de Milán, en dos se hizo quimioembolización para bajar el estadiaje, pero no se logró, una paciente se cambió de centro para TH, cuatro terminaron el protocolo y estaban en lista de espera y una persona retiró el consentimiento. En el estudio del explante, el 100% (n = 6) de los trasplantados tuvo un tumor, con tamaño promedio de 30 (10 a 50) mm. Todos los pacientes estaban dentro de los criterios de Milán y los de la UCSF y tuvieron ≤ dos puntos en el modelo de AFP.
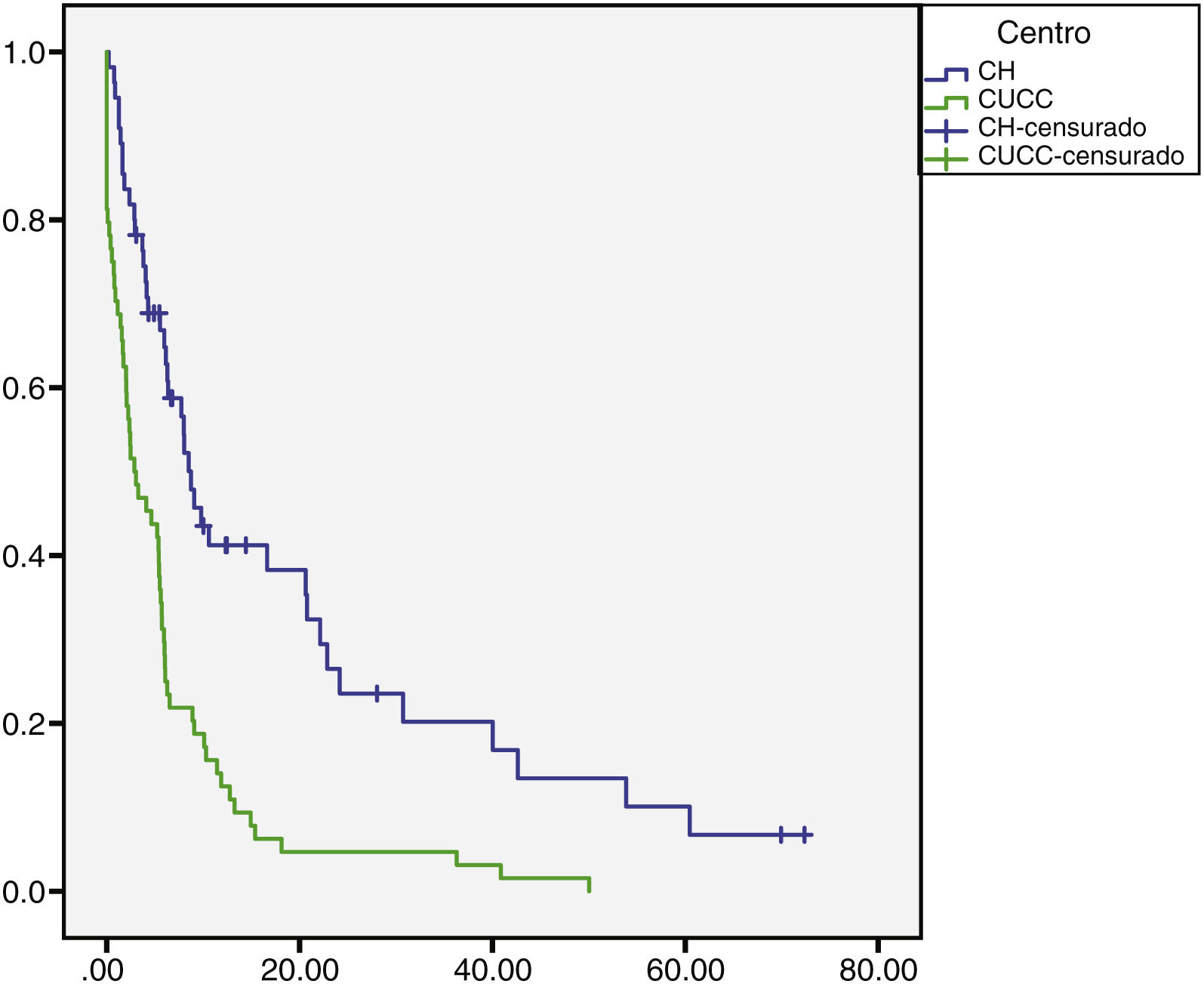
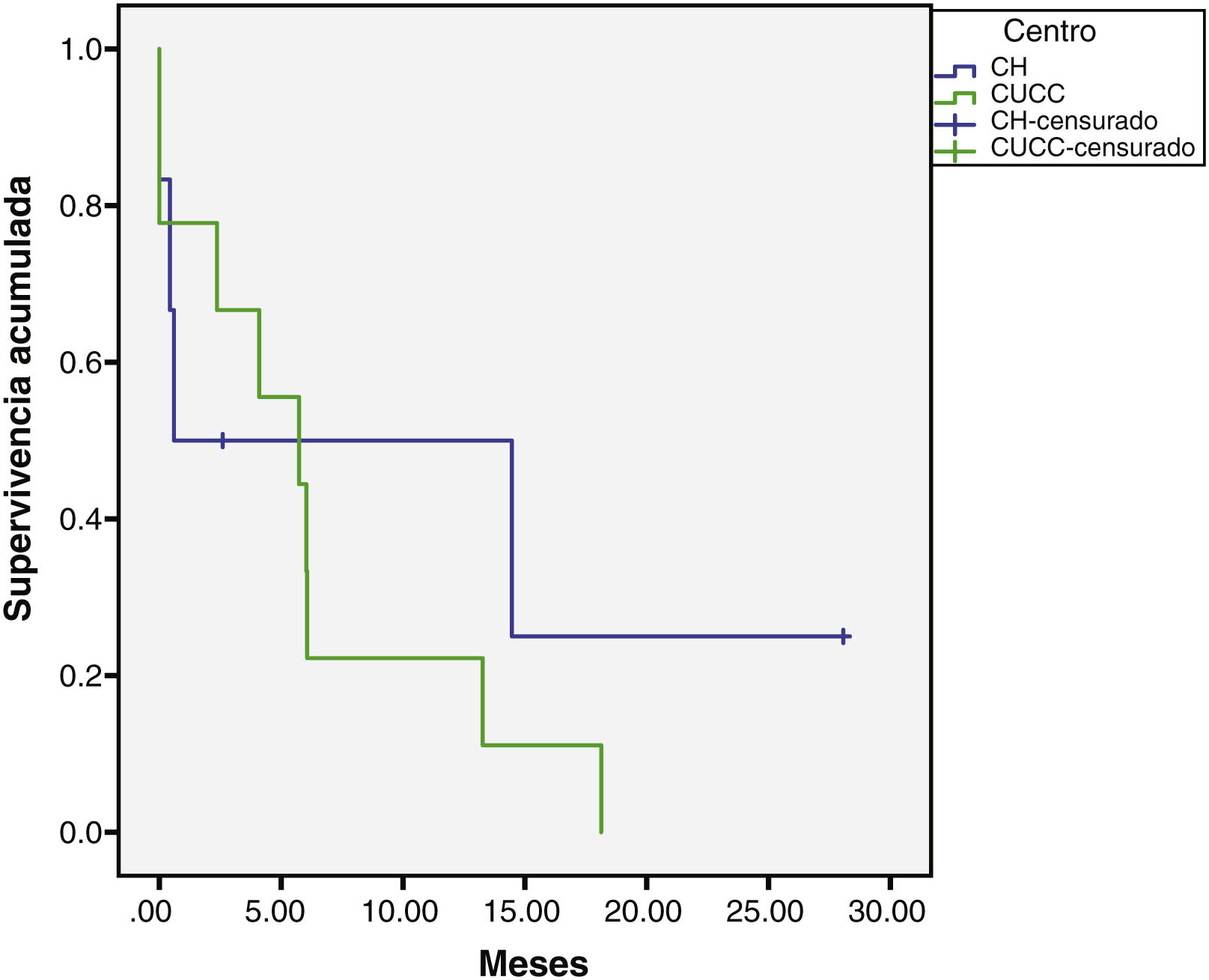
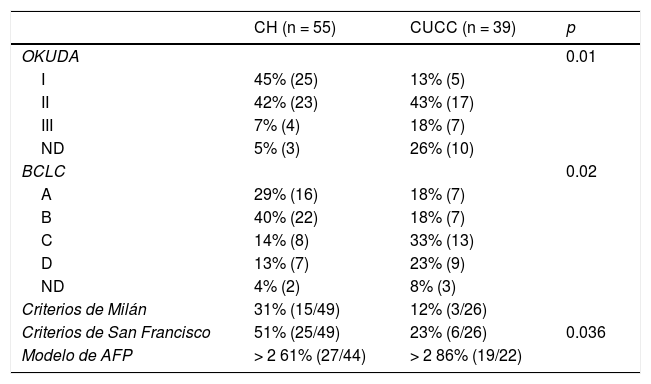
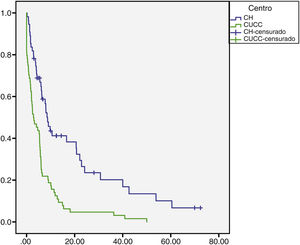
La mediana de seguimiento global fue de 5.7 (0.10 a 72) meses. En el CH fue de 6.8 (0.76 a 72) meses para CHC y 1.6 (0.26 a 28) meses para CCi, mientras que en el CUCC fue de 5.23 meses para CHC (0.10 a 50) y CCi 5.73 (1.43 a 18.13) meses (figs. 1 y 2). En el CH se perdió el seguimiento de 34% (n = 21) de la población después de seis años y en el CUCC no se pudo contactar al 100% de la población después de cuatro años. A todos los pacientes con pérdida de seguimiento se les buscó vía telefónica, sin embargo, no hubo respuesta. Del total de la población, 14% (n = 15) fallecieron durante el estudio y 60% (n = 9) por causas hepáticas.
Tasa de supervivencia en meses de los pacientes con CHC en el CH y en el CUCC.
Los pacientes del CH tuvieron mayor sobrevida respecto al CUCC, se demostró significancia estadística (log-rank p = 0.000).
CH: Centro de Hepatología; CHC: carcinoma hepatocelular; CUCC: Centro Universitario contra el Cáncer.
De los seis pacientes que recibieron TH, dos fallecieron, uno a las dos semanas por shock séptico y el otro habia tenido una hepatectomía extendida por CHC dos años antes del TH, y en el explante había invasion microvascular, de manera que nueve meses después del TH tuvo recidiva, recibió tratamiento con nexavar y sobrevivió tres años cinco meses.
Discusión y conclusionesEn este estudio retrospectivo que se llevó a cabo en dos centros del Hospital Universitario UANL, el CH y el CUCC, el primero es un centro de hepatología de referencia nacional de pacientes hepatópatas y el segundo recibe a población abierta oncológica, con el diagnóstico de cáncer hepático en pacientes que no son conocidos previamente. Aquí se analiza una población de 109 personas con neoplasia primaria de hígado, 94 (86%) con CHC y 15 (14%) con CCi.
La cirrosis es un factor de riesgo muy frecuentemente asociado con el desarrollo de CHC5. Esto no necesariamente es así para CC, Tyson y cols.7 publicaron una prevalencia de cirrosis menor al 10% en pacientes con CC, en nuestro estudio, nueve de 15 (60%) personas con CC tenían cirrosis. Históricamente, las etiologías más frecuentes de la cirrosis han sido VHC y EHA, sin embargo, recientemente se ha visto un aumento importante en el número de pacientes con EHNA, dada la epidemia global de obesidad y de DM2 actual en México24 y en Latinoamérica15. Este estudio concuerda con esta nueva tendencia de EHNA como la principal causa de cirrosis, en los pacientes con CHC. Llama la atención que en el trabajo de Cisneros y cols.25 las etiologías principales de la cirrosis fueron VHC, VHB y EHA entre los años 2008 al 2014 y en nuestro estudio, que fue hecho entre el 2012 y el 2018, la más frecuente fue EHNA seguida de EHA y VHC. Se demostró una diferencia significativa entre centros con relación al estadiaje de los pacientes con CHC. En el estudio de Riaz y cols.26 realizado en un centro oncológico, 41% de la población analizada se encontraba en estadio de BCLC C, similar al estadiaje de los pacientes del CUCC. En otra investigación en nuestro país donde se examinan personas con CHC del noreste y centro25, la mayoría (71%) se encontraban en estadios BCD de BCLC, y en nuestros pacientes, de igual forma, el 70% estaba en estos mismos. La sobrevida en estadios ABC fue entre 8.9 a 16.5 meses en el estudio de Cisneros25 y en el nuestro osciló entre 11.3 a 14.8 meses, siendo similar, sin embargo, en el estadio D tuvimos una sobrevida de 8.9 a diferencia de 4.5 en el trabajo de Cisneros25.
La diferencia entre el CH y el CUCC es que en el primero existe una población con cirrosis hepática en seguimiento, a los que se le solicita cada seis meses una ecografía Doppler, precisamente porque la presencia de cirrosis por sí sola es un factor de riesgo para desarrollar CHC y CC. En el CUCC, los pacientes acuden con estados más avanzados del tumor, debido a que es un centro de oncología en general y estos no son conocidos previamente en este lugar. Es importante mencionar que ambos centros pertenecen al Hospital Universitario «Dr. José Eleuterio González», UANL.
El tamizaje que se realizó a todos los pacientes cirróticos en CH demostró impactar en la sobrevida de estos. Lo universalmente aceptado es hacer un estudio de imagen (siendo el más accesible el ultrasonido) cada seis meses con o sin medición de AFP3,5. La AFP ha sido utilizada a lo largo del tiempo como importante predictor de recurrencia post tratamiento en los pacientes con CHC, a pesar de que solo se encuentra elevada en 50 al 60% de los pacientes27. Se ha incluido en diversos modelos de selección para TH, Duvoux y cols.18 y Mazzaferro y cols.28 añadieron la AFP a sus modelos para mejorar la predicción de sobrevida y recurrencia de CHC post TH. La mayor parte de la población estudiada del CH tuvo un nivel de AFP considerado como de bajo riesgo, no así en el CUCC.
Debido a lo avanzado de la enfermedad que se vio en los pacientes con CHC del CUCC, la mayoría recibió tratamiento no curativo y todos estaban fuera de los criterios para TH. En el CH, 15 personas con CHC iniciaron una valoración para TH, seis lo recibieron y cuatro estaban en lista de espera, esto refleja la dificultad en nuestro medio para que los pacientes tengan acceso a esta terapia.
Nosotros reunimos 15 casos de CCi en siete años en el norte del país y en el centro, en el estudio de Chinchilla8, reunieron 18 en un lapso de 11 años, quizá esto pueda dar una idea de la prevalencia de esta enfermedad en ambas entidades. En años recientes, el aumento de patologías hepáticas como la hepatitis C y el hígado graso pudieran explicar el aumento en el CCi. Llama la atención que en el estudio de Chinchilla y cols.8 se encontró cirrosis solamente en uno de 18 (5.5%) casos con CCi, mientras que en el nuestro el 30% de los casos en el CH y 78% de los del CUCC tenían cirrosis, aunque como la muestra es pequeña, no podemos generalizar. La sobrevida del CCi a cinco años es menor del 5%, y la mortalidad a un año es del 75%29. De acuerdo con datos epidemiológicos en Estados Unidos, la población hispana tiene mayor prevalencia de CCi y mejor sobrevida comparada con la población blanca no hispana, no hispana negra, indoamericana, nativa de Alaska y de Asia/Pacífico29. De acuerdo con los registros del 1973 al 2011, en 18 centros de registro de la Unión Americana el CCi representa el 28% de la población americana29.
En el CH, fue mayoría el sexo masculino en CCi, en el CUCC predominó levemente el sexo femenino, la n es muy pequeña para sacar conclusiones. La mayoría de los pacientes de ambos centros tenían el factor de riesgo de cirrosis en CCi. Es de resaltar que en el CUCC se presentaron proporcionalmente más casos de CC 18.7% (nueve de 48), mientras que en el CH fueron 9.8% (seis de 61). La prevalencia reportada en la literatura es de 11 a 15% de las neoplasias malignas hepáticas30. Se podría especular si la prevalencia en el CUCC refleja mejor lo que sucede en la población abierta, ya que el CH es un centro de referencia nacional y puede haber más sesgo en la población analizada. Por otro lado, la sobrevida de los pacientes con CCi fue similar a otros reportes nacionales8, ya que son diagnosticados tardíamente, fueron 286 días (9.5 meses) de sobrevida en el estudio de Chinchilla, mientras que en nuestro reporte fue de 20 (CUCC) y 30 (CH) meses.
Una limitación en nuestra investigación es que se trata de un estudio retrospectivo. La pérdida de seguimiento fue un problema observado en ambos centros, esto limitó conocer el desenlace en varios pacientes. Se estimó que, muy probablemente, estos fallecieron debido a lo avanzado de su enfermedad. Otra limitación son las diferencias en el criterio para tratar a estos individuos en ambos centros, actualmente se está trabajando para establecer una comunicación más amplia para poder uniformar criterios.
En conclusión, la neoplasia primaria del hígado más frecuente en esta población fue el CHC en ambos centros. En el CUCC se detectaron más casos con CCi que en el CH. Los pacientes que se atendieron en el CH con CHC tuvieron una enfermedad más temprana, estos deben ser referidos oportunamente a centros altamente especializados en hepatología. Una proporción mucho más alta del CH cumplía con los criterios de Milán y con los de la UCSF para TH y solamente los pacientes del CH recibieron trasplante. Los individuos con puntaje de bajo riesgo en el modelo de AFP francés tuvieron una mayor probabilidad de sobrevida, que los de alto riesgo.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.