La enfermedad celíaca (EC) es una de las enteropatías autoinmunes del intestino delgado más comunes; afecta a las personas con predisposición genética, derivada de la exposición al gluten, proteína presente en trigo, cebada y centeno. Provoca cambios en la mucosa del duodeno, caracterizada por atrofia de vellosidades intestinales, hiperplasia de criptas e infiltración linfocítica, generando, con mayor frecuencia, síntomas por malabsorción1.
Presentamos el caso de una mujer de 41 años con antecedentes de hipotiroidismo e infertilidad (G2-A2), con historia de estreñimiento y vómito de 10 años de evolución, patrón evacuatorio <3 por semana, consistencia Bristol 1 y 2, dificultad para expulsarlas; negó la sensación de bloqueo anal, evacuación incompleta o manipulación digital; no sangre o moco en las evacuaciones que mejoran con la administración de fibra. Refirió vómitos de origen posprandial, de contenido biliar y alimentario. Negó borborigmos, dolor o distensión abdominal. Refirió saciedad precoz y plenitud posprandial de uno a 2 días por semana, desencadenado por la ingesta de grasas o hidratos de carbono. No presentó pérdida de peso. La exploración física neurológica y abdominal sin hallazgos relevantes; inspección perianal diferida por pudor de la paciente.
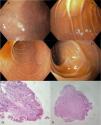
En la endoscopia inicial reportó esofagitis grado A de Los Ángeles, úlcera sobre cara anterior-curvatura mayor en antro gástrico de 10mm Forrest III y duodeno con aplanamiento vellositario, principalmente en segunda y tercera porción. Las biopsias de úlcera gástrica con cambios epiteliales reparativos sin atipia y Helicobacter pylori negativo. En bulbo, segunda y tercera porción de duodeno con atrofia vellositaria leve, Giardia negativo y linfocitos intraepiteliales (LIE) CD3/CD8 del 50% con clasificación de MARSH 3A. Los anticuerpos antitransglutaminasa tisular IgA (anti-tTg IgA) más IgA sérica, ambos fueron negativos. El manejo clínico con esomeprazol a dosis estándar por 12 semanas (fig. 1).
Imágenes de esofagogastroduodenoscopia: A) bulbo duodenal (D1) con cambios endoscópicos sugerentes de atrofia vellositaria a la maniobra de inmersión. B y C) Aplanamiento vellositario en D2. D) Aplanamiento moderado de vellosidades en D3. E) Histopatología con reporte de atrofia vellositaria leve y presencia de linfocitos intraepiteliales CD3/CD8 del 50% (Marsh 3A). Fuente: Historia clínica del paciente.
Por los hallazgos en duodeno y la sospecha de EC vs. enteropatía seronegativa, se solicitó anticuerpos antiendomisio IgA (anti-EMA IgA) y anticuerpos contra péptidos de gliadina deaminados (anti-PDG) IgA e IgG. Con el hallazgo positivo de anti-PDG IgA constituimos el diagnóstico de EC e iniciamos la restricción de gluten. Tres meses posteriores al inicio de tratamiento, la paciente refirió mejoría con relación al vómito, estreñimiento y síntomas dispépticos (tabla 1).
Panel de resultados para EC
| Determinaciones | Resultado | Rango de normalidad |
|---|---|---|
| Leucocitos | 8.82×103/μl | 4.4-10 |
| Neutrófilos | 5.45×103/μl | 2-8 |
| Linfocitos | 2.77×103/μl | 1-4.4 |
| Hemoglobina | 14.2 g/dl | 13.5-17.3 |
| VCM | 91.9fL | 76-96 |
| HCM | 30.2pg | 28-33 |
| Glucosa | 86mg/dl | 50-100mg/dl |
| TSH | 1.71uUI/ml | 0.27-4.2 |
| T3 Libre | 5.91pg/ml | — |
| T4 Libre | 1.09ng/dl | 0.8-2 |
| Sodio | 138mEq/l | 135-145mEq/l |
| Potasio | 3.2mEq/l | 3.5-4.5mEq/l |
| Calcio | 8.9mg/dl | 8.2-10.5mg/dl |
| Magnesio | 1.8mg/dl | 1.7-2.2mg/dl |
| Bilirrubina total | 0.94mg/dl | 0.1-1.2 |
| Bilirrubina directa | 0.78mg/dl | 0.0-0.14 |
| Bilirrubina indirecta | 0.16mg/dl | |
| TGO | 17.9UI/l | 0-40 |
| TGP | 27.7UI/l | 0-45 |
| Fosfatasa alcalina | 146.3UI/l | 0-400 |
| GGT | 49.4 UI/l | 11-50 |
| VSG | 10mm/h | 10-20 |
| PCR | 1.2mg/l | 0.5-3.58 |
| Inmunoglobulina A (IgA) | 2.87g/l | 0.7-4.0g/l |
| Anticuerpos transglutaminasa tisular IgA (anti-tTg IgA) | 1.10U/ml | 0-25U/ml |
| Anticuerpos transglutaminasa tisular IgG (anti-tTg IgG) | 1.80U/ml | Negativo: <10 u/ml |
| Anticuerpos Antiendomisio (Anti-EMA) | Negativo | |
| Péptido gliadina deaminada IgA(DPG-IgA) | 25.80UR/ml | Positivo:Mayor o igual a 25UR/ml |
| Péptido gliadina deaminada IgG(DPG-IgG) | <2UR/ml | Positivo:Mayor o igual a 25UR/ml |
| Antígeno fecal para H. pylori | Negativo | |
| Calprotectina fecal | 15μg/g | <50μg/g |
GGT: gamma-glutamil transferasa; HCM: hemoglobina corpuscular media; PCR: reacción en cadena de la polimerasa; TGO: transaminasa glutámico-oxalacética; TGP: transaminasa glutámico pirúvica; TSH: hormona estimulante de la tiroides; VCM: volumen corpuscular medio; VSG: velocidad de sedimentación globular.
Fuente: historia clínica del paciente.
La EC afecta al 1% de los adultos y la restricción del gluten en la dieta es el único tratamiento eficaz. Existe mayor riesgo en personas con enfermedades autoinmunes, como diabetes tipo 1 o tiroiditis autoinmune2. México ha reportado una prevalencia del 0.5-0.7%, mientras que en Latinoamérica alcanza el 1.3%, siendo más frecuente en Argentina y Brasil. Según su presentación, la EC se clasifica en sintomática, asintomática y potencial.
La EC sintomática se caracteriza por la presencia de síntomas gastrointestinales, referidos como clásicos y extraintestinales como no clásicos. Las manifestaciones clásicas son diarrea, esteatorrea y pérdida de peso. Por otra parte, la EC no clásica se caracteriza por la ausencia de síntomas de malabsorción y predominan otras manifestaciones como son la distensión y dolor abdominal, borborigmos, estreñimiento, vómitos, anemia, entre otros. Mantener un alto índice de sospecha es indispensable, ya que menos del 50% de los adultos presentan síntomas gastrointestinales clásicos. Por otra parte, la variedad asintomática se caracteriza por la ausencia de síntomas, con serología positiva y alteraciones en la mucosa duodenal, mientras que la EC potencial se presenta en personas con riesgo de desarrollar la enfermedad, con histología normal y serología positiva3.
Los anticuerpos anti-tTg IgA más IgA sérica son indispensables para el diagnóstico. Su sensibilidad es del 78% y con una especificidad del 98%. Debido a la precisión diagnóstica variable, los anticuerpos antiendomisio IgA (EMA-IgA) y péptido gliadina deaminada (DPG-IgA) son útiles para el diagnóstico en pacientes con alta sospecha de EC con anti-tTg IgA+IgA negativa. Estos anticuerpos cuentan con una sensibilidad de 94 y 74% y especificidad del 100 y 95%, respectivamente. En los casos de deficiencia selectiva de IgA, la determinación de anticuerpos IgG apoya al diagnóstico4.
La información de DPG-IgA/IgG en población adulta es escasa. La mayor evidencia disponible es en población pediátrica; Vootukuru et al. evaluaron la utilidad diagnóstica de DPG-IgG positiva con anti-tTg-IgA negativa en una cohorte de 26 pacientes en edad infantil; el hallazgo positivo por sí solo tiene un rendimiento diagnóstico bajo (OR: 3.9%; IC 95%: 0.7-18.9%) y recomienda apoyarse de la histología para establecer el diagnóstico5. Por otra parte, Saadah et al. compararon los anti-tTg IgA con DPG IgA e IgG en 26 pacientes pediátricos con EC, encontrando una correlación significativa entre los niveles de estos dos anticuerpos (r=0.69; p<0.001), y lo considera útil como alternativa a los anti-tTg IgA en el diagnóstico y seguimiento6. Zingone et al., en un intento de buscar estrategias de diagnóstico sin la necesidad de biopsias, evaluaron el rendimiento de anti-tTg-IgA+DPG-IgG en población adulta. La incorporación de DPG-IgG junto con anti-tTg-IgA en un enfoque de un solo paso puede ser una estrategia de confirmación válida para el diagnóstico definitivo sin biopsias para EC7.
Las manifestaciones clínicas como estreñimiento y vómitos no explicados, en una paciente con antecedentes de hipotiroidismo e infertilidad, donde se identificó una atrofia de vellosidades Marsh 3A, serología anti-tTg IgA negativo sin deficiencia de IgA, nos invitan a sospechar en EC sintomática no clásica; el estudio de EMA-IgA y DPG-IgA aportará al diagnóstico temprano8. Araujo et al. reportaron que el diagnóstico tardío por serología negativa inicial llevaba a desenlaces fatales, como linfoma o adenocarcinoma intestinal; la ampliación del panel serológico permite un diagnóstico y tratamiento temprano9.
Contribución de los autoresPDME y MACC: Investigación y redacción del borrador original y DACR: Realización del procedimiento endoscópico, fotos, validación, edición y supervisión del escrito.
Consideraciones éticasSe obtuvo el consentimiento informado del paciente para el tratamiento recibido y la publicación del presente caso clínico. Este trabajo cumple con la normativa bioética vigente; no obstante, al tratarse de un informe de caso y no de un estudio con sujetos de investigación, no se requirió la aprobación del comité de ética. Asimismo, los autores aseguran que el artículo no contiene información que permita la identificación del paciente, garantizando la confidencialidad y el respeto a su privacidad.
FinanciaciónLos autores declaran que este estudio no recibió financiamiento de ninguna fuente pública, privada o comercial. La investigación, recolección de datos, análisis y preparación del manuscrito fueron realizados sin apoyo económico externo.
Conflicto de interesesNo existen conflicto de intereses que puedan influir en la interpretación o publicación del artículo.