El carcinoma hepatocelular (CHC) es la quinta neoplasia más común a nivel mundial, y el virus de la hepatitis C (VHC) es la causa principal, condicionando un riesgo del 3 al 7% por año, en pacientes con cirrosis hepática (CH)1. En la era del interferón pegilado (PEG-IFN), la respuesta viral sostenida (RVS) era de aproximadamente el 50%, y se asociaba a una disminución del 0.5 al 1% por año en la incidencia del CHC en pacientes con CH que alcanzaron RVS2.
La introducción de la terapia con antivirales de acción directa (AAD) se asoció con una tasa de RVS mayor al 90%, con un impacto positivo en el curso de la enfermedad, lo cual redujo los efectos adversos en pacientes en una etapa más avanzada de la enfermedad3. A pesar de los resultados prometedores de la terapia con AAD, algunos reportes sugieren que podría incrementar el riesgo de ocurrencia y recurrencia de CHC4, motivo para presentar los 2 casos siguientes (tabla 1).
Resumen de casos clínicos
| Caso | Edad | Sexo | Genotipo VHC | PCRIU/ml | AAD | Duración del tratamiento | RVS | Tamaño de tumor | TLR |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 66 | M | 1b | 2,900,000 | SofosbuvirLedipasvir | 24 semanas | Sí | 7.3cmsegmento VIII | TAERFA |
| 2 | 74 | F | 1b | 3,292,886 | SofosbuvirLedipasvir | 12 semanas | Sí | 1.7cmsegmento VI0.7cmsegmento V | RFA |
AAD: antivirales de acción directa; F: femenino; M: masculino; PCR: reacción en cadena de la polimerasa; RFA: ablación por radiofrecuencia; RVS: respuesta viral sostenida; TAE: embolización transarterial; TLR: terapia locorregional; VHC: virus de la hepatitis C.
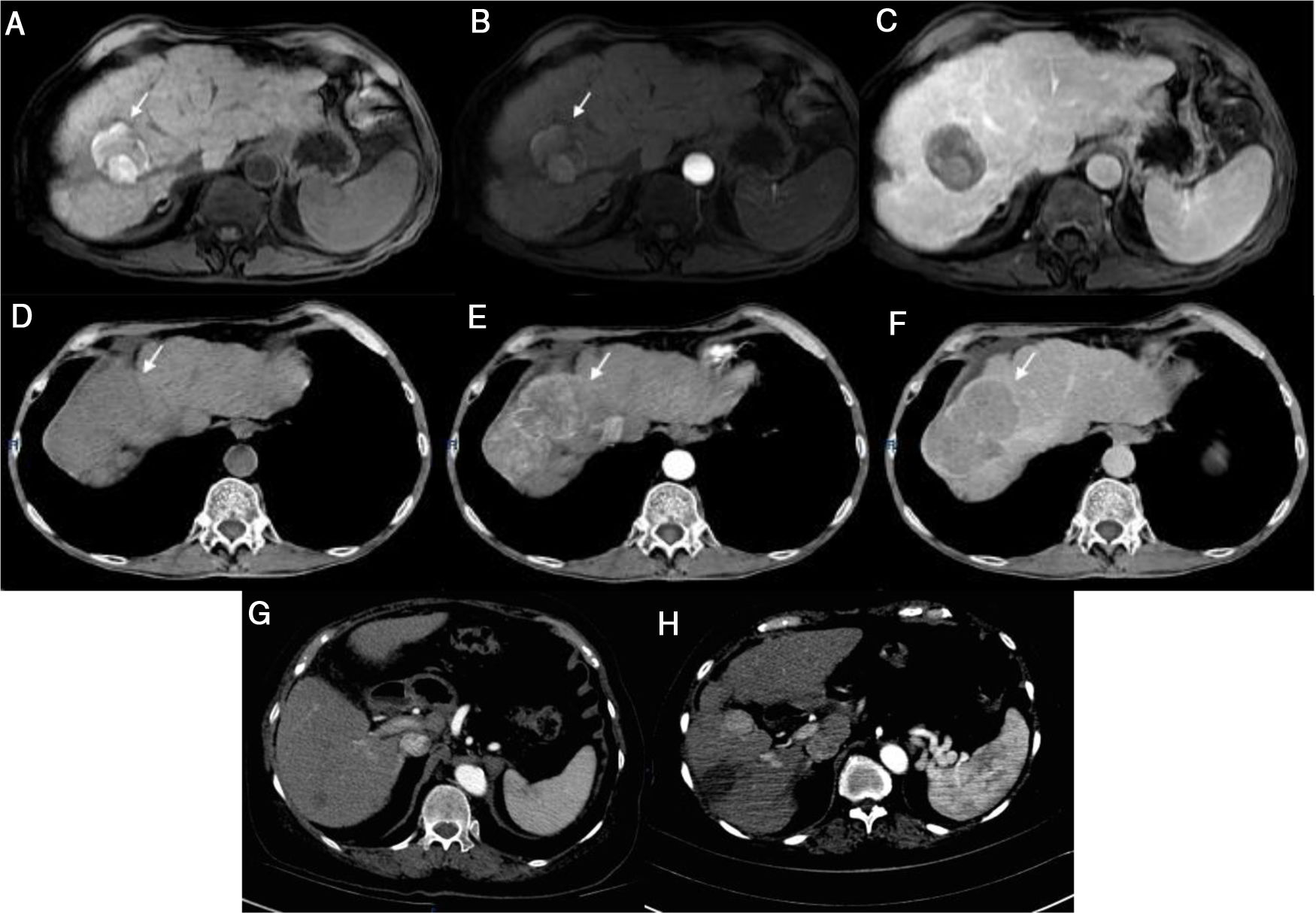
Masculino de 66 años con CH secundaria a VHC diagnosticada en 2014. En una resonancia magnética (RM) realizada ese año, se detectó una lesión de 7.3cm en el segmento VII, mostrando comportamiento típico de CHC, por lo que fue sometido a embolización transarterial (TAE, por sus siglas en inglés). En el año 2015, requirió nuevamente TAE, después de la cual tuvo una respuesta radiológica completa (RRC) (fig. 1a-c) y permaneció en observación. En marzo de 2017, el paciente logró RVS con la terapia de AAD. Un estudio de imagen de control posterior a la RVS mostró que la lesión había progresado, con invasión vascular (fig. 1d-f).
Caso 1) Imagen por resonancia magnética (RM: T1 imagen Fat-Sat muestra hiperintensidad del tumor en segmento VII secundaria a necrosis sin reforzamiento en fase arterial, y sin evidencia de nuevas lesiones en fase venosa (a-c). El tumor observado en la RM previa, muestra ahora actividad e incremento en el tamaño (d-f). Caso 2) Tomografía computarizada (TC): lesión de 7mm con realce y una lesión de 17mm con comportamiento típico (g). La imagen de control 2 meses posterior a la ablación por radiofrecuencia muestra crecimiento de 7 a 25mm, con una imagen típica de CHC (h).
Femenino de 74 años con diagnóstico de CH secundaria a VHC diagnosticada en 2016. Recibió terapia con AAD, sin evidencia de lesiones en ultrasonido previo a iniciar terapia. Tras lograr RVS cursó con colecistitis aguda, por lo cual se le realizó una tomografía que reveló 2 lesiones, una de 7mm que presentaba comportamiento típico de CHC y otra de 1.7cm sin forzamiento con medio de contraste (fig. 1). Se realizó una biopsia a la lesión de mayor tamaño que reportó CHC. La paciente se sometió a ablación por radiofrecuencia (RFA, por sus siglas en inglés), y 2 meses después, la lesión creció de 7mm a 2.5cm (fig. 1h).
A pesar de que el desarrollo y la recurrencia del CHC observados en los reportes de nuestros casos parecen estar asociados con la terapia AAD, la evidencia de estudios recientes no ha mostrado dicha asociación. En un estudio de cohorte que incluyó 33,137 pacientes, Mun et al. evaluaron el riesgo para desarrollar CHC de novo posterior a la terapia, y concluyeron que no existían diferencias significativas en el riesgo para CHC tras el tratamiento con AAD5. Dichos resultados fueron consistentes con los casos de novo y recurrencia en una revisión sistemática y metaanálisis de Rutledge et al. que incluyó 138 estudios (n=177,512)6.
Se evaluó el impacto de los AAD en pacientes sometidos a trasplante hepático, en cohortes de centros europeos y latinoamericanos, en ambos estudios no se reportó evidencia de incremento en la progresión de pacientes en lista de espera o incremento en la recurrencia después del trasplante7,8. La controversia derivada de análisis previos parece estar relacionada con el diseño metodológico de los estudios.
Actualmente, el beneficio de tratar a pacientes con AAD es claro y se ha asociado con disminución en la mortalidad por todas las causas9. Incluso se han desarrollado puntajes de propensión con la finalidad de estratificar el riesgo de CHC en pacientes que se han sometido a terapia con AAD10.
Responsabilidades éticasLa presente carta científica cumple con las regulaciones bioéticas de investigación. El artículo fue autorizado por el Comité de Ética del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Los pacientes no pueden ser identificados o reconocidos por medio de las imágenes o datos contenidos en el presente artículo.
FinanciaciónNo se recibió financiación para la realización de este artículo.
Conflicto de interesesLos autores declaran que no existió conflicto de intereses.