Introducción
La enfermedad de Crohn (EC) y la colitis ulcerativa crónica idiopática (CUCI) son padecimientos que comprenden dos entidades clínicas denominadas como enfermedad inflamatoria intestinal (EII). Ambas, se caracterizan por un estado inflamatorio con remisiones y recaídas durante el curso de la enfermedad. La EC puede afectar cualquier sitio del aparato gastrointestinal, involucra más frecuentemente el íleon y colon derecho, en cambio, la CUCI solamente afecta la mucosa del colon.
La etiología es multifactorial, cuya hipótesis postula que se debe al desequilibrio del sistema inmune de base, aunado a una intolerancia hacia la flora microbiana y que puede asociarse a mutaciones genéticas o ser iniciado por factores ambientales. Durante las recaídas o brotes de la enfermedad, se requiere de la intervención farmacológica o quirúrgica para restablecer la remisión. Idealmente se requiere una terapia que induzca una respuesta rápida, con mantenimiento de la remisión sin esteroides, curación completa y sostenida de la mucosa (remisión endoscópica), evitar las complicaciones relacionadas con la terapéutica y/o cirugía empleada, prevenir la muerte prematura y mejorar la calidad de vida.1
La decisión acerca del tipo de tratamiento está basada en la gravedad y la localización de la enfermedad.
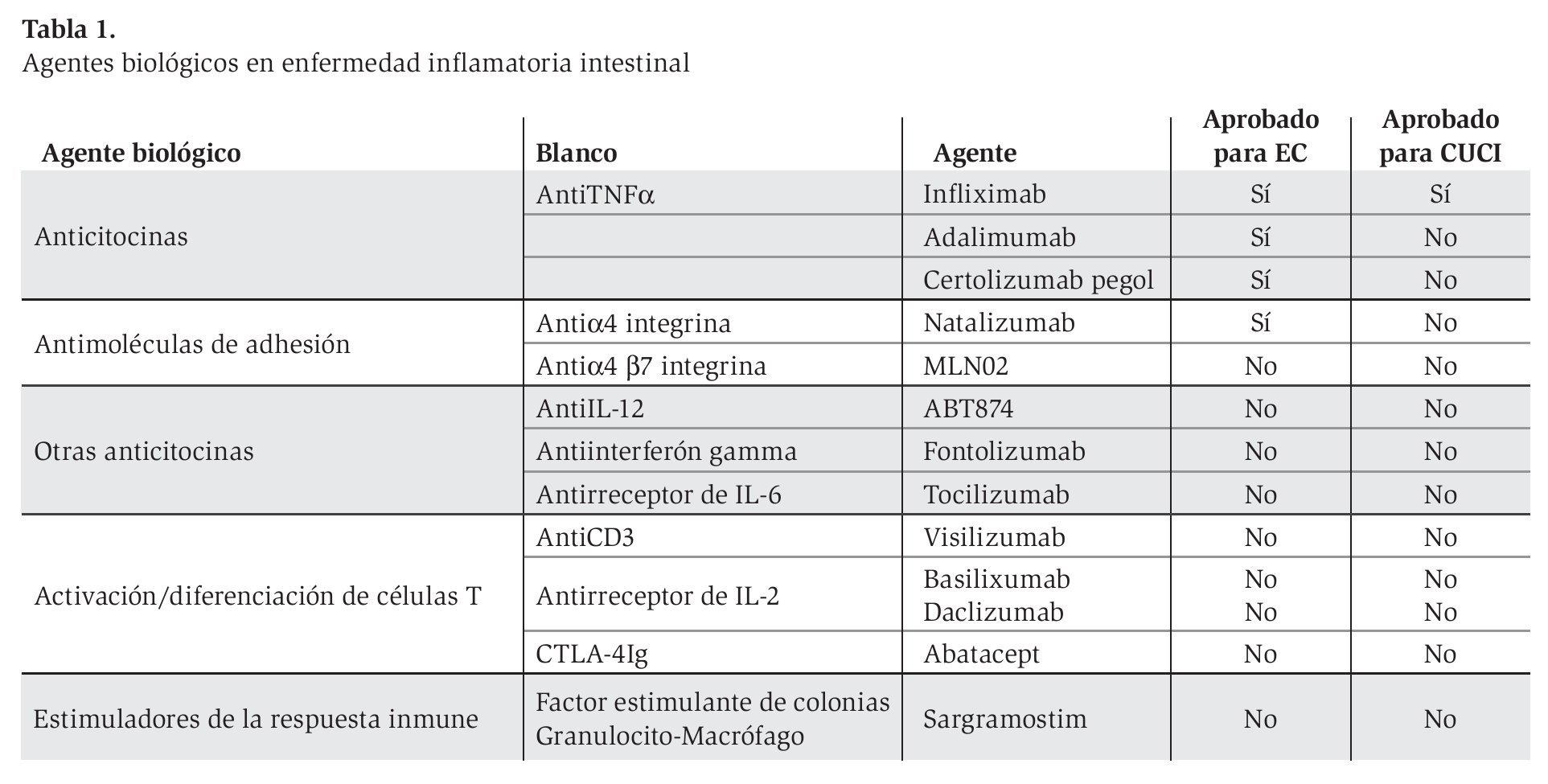
A pesar de los tratamientos disponibles en la actualidad (aminosalicilatos, corticoesteroides, inmunomoduladores y cirugía), una gran cantidad de pacientes experimentan recaídas frecuentes y desarrollan complicaciones significativas. Los avances en el conocimiento de la inmunología de la EII ha permitido el desarrollo de conceptos terapéuticos nuevos dirigidos a factores efectores específicos de enfermedad (factor de necrosis tumoral alfa [TNFa], integrinas, interferón, citocinas, moléculas de adhesión, células T estimuladores de la respuesta inmune) (Tabla 1). Esto ha alterado sustancialmente el manejo de la EII en años recientes y han probado su eficacia, particularmente, en el caso de la enfermedad refractaria o fistulizante. Estos avances también se han acompañado del surgimiento de efectos colaterales graves, potencialmente fatales, asociados al uso de la terapia biológica sola o en combinación a la terapia convencional.2
A continuación se hará una descripción breve de la terapia biológica disponible en la actualidad y de nuevos fármacos en desarrollo para el manejo de la EC y CUCI.
Enfermedad de Crohn (EC)
Infliximab
Infliximab (Remicade® Centocor, de Malvern) es un anticuerpo monoclonal quimérico (75% de ratón 25% del antiTNFa humano), introducido a la práctica clínica para el tratamiento de la EC en 1997, actualmente es utilizado para la inducción y la terapia de mantenimiento en EC y CUCI.
El TNFa regula múltiples procesos proinflamatorios centrales en la patogenia de la EII. El primer estudio que demostró la eficacia de infliximab en el tratamiento de EC activa, seleccionó al azar a pacientes con enfermedad moderada-grave, refractaria al tratamiento médico, para recibir una sola infusión de placebo o una dosis de 5, 10 o 20 mg/kg de infliximab. Diecisiete, 81, 50 y 64% de los pacientes, respectivamente tuvieron respuesta (evaluada con una disminución en el índice CDAI ≥ 70 puntos) en la semana 4 (p < 0.001 para todos los pacientes de infliximab vs. placebo). Globalmente, 33% de todos los pacientes tratados con infliximab comparados con 4% de placebo alcanzaron la remisión en la semana 4 (p = 0.005). A mayor dosis de infliximab los pacientes mantuvieron una respuesta a la semana 12, pero se observó que 37% habían recaído, sugiriendo que una sola dosis no era suficiente.3 Aquellos pacientes con respuesta inicial a una sola infusión fueron aleatorizados para recibir una dosificación de 10 mg/kg cada 8 semanas o placebo. Después de 44 semanas, 53% del grupo del infliximab estaban en remisión contra 20% del grupo del placebo (p = 0.013).4
El estudio ACCENT I se basó en las ventajas potenciales del esquema de mantenimiento con infliximab, después de observar una respuesta inicial. En el estudio, 573 pacientes recibieron una infusión intravenosa de 5 mg/kg de infliximab en la semana 0, después de lo cual fueron evaluados con el índice CDAI (se consideró una respuesta clínica a la disminución 3 70 puntos y/o del 25% de la calificación total). Trescientos treinta y cinco pacientes (58%) cumplieron este criterio y fueron seleccionados al azar a uno de tres grupos de tratamiento: placebo en la semana 2 y 6, y cada 8 semanas (grupo 1), infliximab 5 mg/kg con la misma frecuencia (grupo 2) o 5 mg/kg en la semana 2 y 6, y 10 mg/kg cada 8 semanas (grupo 3). Se continuó el tratamiento por 46 semanas. A partir de la semana 14, se permitió a los pacientes de todos los grupos que tuvieron respuesta inicial y que después empeoraron, el cruzarse entre los grupos de tratamiento activo de una dosis superior (infliximab 5, 10 o 15 mg/kg, respectivamente). En la semana 30, 21% de los pacientes en grupo 1, 39% del grupo 2 (p = 0.003) y 45% en grupo 3 (p = 0.0002) se mantenían en remisión; la pérdida de respuesta se observó en un tiempo de 19 semanas, 38 semanas (p = 0.002) y más de 54 semanas (p = 0.0002), respectivamente. Tomados en conjunto, más pacientes en los grupos 2 y 3 combinados (29%) comparado con el grupo 1 (9%) había logrado descontinuar los esteroides en la semana 54, así como una menor frecuencia de hospitalizaciones y cirugías relacionadas con la enfermedad en los grupos con terapia de mantenimiento. No hubo diferencias en la tasa de efectos adversos serios entre los tres grupos.5 Un análisis endoscópico secundario, recientemente publicado a partir del estudio ACCENT I, demostró que la terapia que incluía el esquema de mantenimiento vs. tratamiento episódico dio lugar a una mejoría en el grado de ulceración mucosa y a índices más altos de curación endoscópica, aunque con la correlación clínico-endoscópica fue débil.6
El uso de infliximab también es eficaz en el tratamiento del EC fistulizante. En un ensayo inicial de inducción, aleatorizaron a 94 pacientes con drenaje activo de las fístulas perianal o abdominales para recibir tres infusiones en las semanas 0, 2, y 6 de placebo o una dosis de 5 o 10 mg/kg de infliximab. Veintiséis, 68 y 56% de los pacientes alcanzaron reducción en el drenaje de la fístula en 50% (p = 0.002 y p = 0.02). Trece por ciento en el grupo placebo, 55 y 38% de pacientes en manejo con infliximab, respectivamente, tuvieron cierre de las fístulas (p = 0.001 y p = 0.04).7 En el estudio ACCENT II, se reclutaron a 306 pacientes con una o más fístulas abdominales/perineales de más de tres meses de duración, quienes recibieron un régimen de inducción con tres infusiones de infliximab (5 mg/kg).
Se seleccionó al azar a 195 pacientes que tuvieron respuesta en la semana 10 y 14, así como a 87 sin respuesta a recibir un placebo o infliximab (5 mg/kg) cada 8 semanas hasta la semana 54. El tiempo necesario para observar la pérdida de respuesta era perceptiblemente más largo para los pacientes en el grupo de infliximab que de placebo (> 40 vs. 14 semanas, p < 0.001). Además, en la semana 54, 36% de los pacientes en el grupo de infliximab comparado con 19% en el grupo placebo no tenían ninguna fístula (p = 0.009).8 Se observa que la recaída de la enfermedad perianal después de la suspensión de infliximab puede ocurrir más tempranamente que en la enfermedad luminal.9
Los anticuerpos contra infliximab se conocen como antiinfliximab (ATI) o anticuerpos contraquiméricos humanos (HACAs), se han asociado a una concentración más baja del fármaco en suero, con la administración episódica y se asocia con disminución en la eficacia.5,10,11 En el estudio ACCENT I, los pacientes con y sin anticuerpos mantuvieron la respuesta clínica.5 Además, aunque los ATIs se asocian a un riesgo aumentado de reacciones tras la infusión,10,11 la mayoría de los pacientes ATI positivos no tendrán una reacción después del retratamiento con infliximab y por lo tanto, no se recomienda su medición de rutina, con excepción en el enfermo con pérdida de la respuesta o después de una reacción a la infusión.12 El riesgo de formación de anticuerpos se puede disminuir, empleando un esquema de dosis de inducción (tres dosis) seguida por la terapia de mantenimiento5,11 y el uso concomitante de esteroides y/o de los inmunomoduladores.5,7,10,11 Asimismo, el género, la localización de la enfermedad y el tabaquismo no parece correlacionar con el desarrollo de ATI.10
Se debe señalar que aproximadamente 30% de los pacientes no tienen respuesta a infliximab y que no todos los respondedores tienen una respuesta completa. Según lo reportado por Rutgeerts y cols., los predictores positivos de respuesta incluyen un valor de proteína C reactiva (PCR) elevado, enfermedad no estenosante, afección colónica exclusiva y uso concomitante de inmunomoduladores.13
La azatioprina y la 6-mercaptopurina son los inmunomoduladores más comúnmente combinados con infliximab para EC; sin embargo, no está claro si las tasas de respuesta más altas asociadas a la terapia de combinación comparada con infliximab sólo representan un efecto en la baja formación de anticuerpos o a un efecto sinérgico que resulta de añadir otros mecanismos de acción. Infliximab se ha utilizado en forma combinada con metotrexato en pacientes con artritis reumatoide y un estudio experimental pequeño en EC demostró que el metotrexato aunado a infliximab puede aumentar las tasas de remisión, el tiempo de respuesta y disminuir el uso de esteroides con respecto a la monoterapia con infliximab.14 Respecto al tabaquismo, se han encontrado resultados mixtos, ya que fue un predictor negativo de respuesta en dos estudios,15,16 pero no en uno de los estudios más grandes en donde se evaluaron factores que influyeran en la respuesta al infliximab.17
Existe controversia sobre la duración del tratamiento con infliximab; si ésta necesariamente debe ser administrada de manera "indefinida," o si el tratamiento episódico o por necesidad puede ser una alternativa viable. Mientras que las ventajas clínicas y endoscópicas de la terapia de mantenimiento se demuestran en los estudios ACCENT I y II, se ha propuesto que el régimen de inducción (0, 2 y 6 semanas) podría servir como puente al manejo con azatioprina, pero esta estrategia pareció ser eficaz por sólo seis a doce meses.18
Actualmente, se recomienda el uso del infliximab por un periodo indefinido. Otra discusión que emerge es la posición de infliximab en el algoritmo del tratamiento de EC, puesto que las aprobaciones regulatorias han reservado las indicaciones para los pacientes que son dependientes o refractarios a esteroides a pesar de la terapia inmunomoduladora. Algunos discuten que esta pirámide sea invertida y se coloque al infliximab en la cúspide, pues se ha demostrado que el tratamiento inicial con infliximab y azatioprina comparados con los que reciben esteroides y tardíamente se les añade azatioprina, conduce a una mayor remisión clínica y endoscópica, terapia libre de esteroides a la semana 26 (60% vs. 41%, p = 0.03).19 El uso temprano de infliximab demostró modular de manera más rápida la enfermedad, por lo tanto, el abordaje terapéutico "de arriba-abajo o top-down", podría demostrar ser la mejor opción de tratamiento. Las discusiones contra esta estrategia incluyen los costos económicos y el riesgo de efectos colaterales.20
Finalmente, los aspectos acerca de la seguridad de infliximab preocupan por los efectos adversos que pueden ser potencialmente fatales y que incluyen las reacciones a la infusión, infecciones oportunistas que incluyen a la tuberculosis, la aparición de Linfoma No Hodgkin (NHL), otras neoplasias y la muerte. Ha sido difícil de calcular un riesgo verdadero, puesto que la mayoría de los estudios clínicos no incluían brazos de placebo puro, sino por el contrario, eran diseños con estrategia de cruces, de tal manera que expusieron a la mayoría de los pacientes a infliximab en un cierto punto.21
Las infecciones graves fueron reportadas en 4% de pacientes en el estudio ACCENT I5 y la tasa de infecciones relacionada a infliximab se consideró que ocurrió en 8% de un estudio de cohorte grande de la clínica Mayo (n = 500) de las cuales la mitad fueron graves.22 A febrero del 2005, se habían reportado 709 casos de tuberculosis relacionadas con infliximab, incluyendo 62 muertes por esta causa.13 El riesgo del linfoma y de otras neoplasias ha sido difícil de establecer.23 El ACCENT I y el estudio de la cohorte de la clínica Mayo reportaron neoplasias extracolónicas en 1 y 1.5% respectivamente, pero la relación causal a infliximab no es clara.24,25
El registro TREAT ha incluido 6,000 pacientes que se han clasificado en dos grupos: los que habían recibido infliximab y los tratados con otras terapias que no incluían infliximab. Ambos grupos tuvieron riesgos similares de muerte, linfoma y otras neoplasias; el riesgo de infección fue ligeramente menor en el grupo de infliximab.26 En cambio, un modelo analítico recientemente publicado, reveló una tendencia aumentada de linfoma y muerte en pacientes tratados con infliximab, comparado con la terapia estándar, con una mejor calidad de vida para infliximab.27 Se han reportado 12 casos del linfoma hepatoesplénico de células T, (un tipo raro e incurable de linfoma) en una población en gran parte pediátrica (12-31 años), con la combinación de infliximab y 6-mercaptopurina o azatioprina; esto ha conducido a una preocupación acerca del uso combinado de estas terapias, especialmente en niños, y existen estudios en curso para entender mejor el perfil de eficacia y seguridad con respecto a la combinación contra la monoterapia.
Adalimumab
Adalimumab (D2E7, Humira®; Laboratorios Abbott, Chicago, IL), es un anticuerpo monoclonal recombinante humano de tipo IgG1, con alta especificidad y afinidad al TNFa humano de administración subcutánea. El adalimumab fue aprobado en Estados Unidos y Europa para el tratamiento de la EC. Dos estudios de fase abierta trataron a pacientes que tenían exposición previa a infliximab con adalimumab. En el primero, trataron a 24 pacientes con pérdida de respuesta o intolerancia a infliximab con una dosis inicial de 80 y 40 mg cada dos semanas por 12 semanas. Aunque el 79% requirieron de un aumento de la dosis a 40 mg por semana, se observó respuesta clínica favorable en la semana 12 en 29 y 59%, respectivamente.28 En el segundo estudio se trataron a 15 pacientes con respuesta atenuada a infliximab por seis meses con la misma dosis e intervalo de adalimumab que en el primer estudio. De los 13 pacientes que terminaron el estudio, 54% obtuvieron una respuesta completa, 31% parcial y en 73% se pudo descontinuar los esteroides.29 Recientemente, el ensayo CLASSIC-I aleatorizó a 299 pacientes con EC moderada a grave, vírgenes a terapia antiTNFa a una de tres dosis administradas en la semana 0 y 2 (160/80 mg, 80/40 mg, o 40/20 mg) o placebo. En la semana 4, 36% (p = 0.001), 24% (p = 0.06), y 18% (p = 0.36) del grupo que recibió adalimumab respectivamente, se encontraron en remisión clínica comparado con 12% en el grupo de placebo.30
Se seleccionó al azar a cincuenta y cinco pacientes del estudio CLASSIC-I que estaban en remisión en la semana 4 a recibir 40 mg de adalimumab como un esquema de mantenimiento cada dos semanas, semanalmente o placebo por hasta un año como parte del estudio llamado CLASSIC II, observando que 74, 83 y 44% de los pacientes respectivamente, logró mantener la remisión en la semana 56.31 Similar al estudio del ACCENT I con el infliximab, la terapia combinada con inmunomoduladores no alteró los resultados.32 Finalmente, en el estudio CHARM (n = 854) se probó la eficacia de la terapia de inducción y mantenimiento con adalimumab en pacientes con EC moderada a grave. Se administró una dosis de 80 mg en la semana cero y 40 mg en la semana 2, a todos los pacientes, con una respuesta clínica en 499 (58%), posteriormente, a estos pacientes se les aleatorizó a recibir mantenimiento con placebo, 40 mg de adalimumab cada 2 semanas o 40 mg semanalmente hasta la semana 56. Se observaron mayores índices de remisión en los grupos de adalimumab, comparados con placebo en la semana 26 (40 y 47% vs. 17%, p < 0.001) y en la semana 56 (36 y 41% vs. 12%, p < 0.001). En los pacientes que recibieron adalimumab también se observó un mayor porcentaje en el cierre de fístulas y suspensión de esteroides. El perfil de seguridad fue comparable a la otra terapia antiTNFa.33
Certolizumab
Certolizumab Pegol o CDP870 (UCB; Smyrna, GA) es un fragmento humanizado monoclonal de la región Fab del anticuerpo antiTNFa ligado químicamente a una molécula de polietilenglicol (PEG). En contraste con el infliximab y adalimumab, el fragmento de anticuerpo no induce apoptosis.34
Certolizumab ha sido evaluado en estudios tanto para la inducción como el mantenimiento de la remisión de la EC.34,35 Se aleatorizaron a 92 pacientes con EC moderada a grave a recibir una sola dosis intravenosa de 1.25, 5, 10 o 20 mg/kg de CDP870 o placebo, observando que la respuesta clínica o la remisión después de cuatro semanas no eran diferentes entre los grupos de tratamiento y el placebo, pero la cifra de la remisión en la semana 2 era del 47% en el grupo de 10 mg/kg comparado con 16% en el grupo del placebo (p = 0.041).35
El estudio PRECISE 1 comparó el uso de certolizumab subcutáneo (100, 200 o 400 mg) con placebo administrado en la semanas 0, 4, y 8 en 292 pacientes con EC moderada a grave. Con todas las dosis del certolizumab se obtuvo mejoría clínica significativa sobre placebo en la semana 2; la dosis de 400 mg tuvo el mayor efecto en todos los puntos de tiempo evaluados, siendo más marcado en la semana 10 (52.8% vs. 30.1%, p = 0.006); sin embargo, no se consideró estadísticamente significativa la respuesta clínica en la semana 12, (objetivo final primario). Cuando se reanalizó de acuerdo a la estratificación de los pacientes por los niveles séricos de PCR (> 10 mg/L), el grupo de 400 mg obtuvo mayor respuesta en la semana 12 (53.1% vs. 17.9%, p = 0.005) y ésta fue atribuida a una respuesta menor al placebo que la observada en los pacientes con PCR < 10 mg/L y por tanto, una enfermedad menos intensa.34 En el ensayo PRECISE 2, los pacientes que respondieron a una dosis de inducción 400 mg en la semana 0 y 2 (64%) fueron aleatorizados para recibir certolizumab o placebo a una dosis de 400 mg cada 4 semanas por 26 semanas. En el brazo de certolizumab se observó que un mayor número de pacientes alcanzó una respuesta clínica (62.8% vs. 36.2%, p < 0.001) y remisión (47.9% vs. 28.6%, p < 0.001) en la semana 26.36 El perfil de seguridad y tolerabilidad fue similar a otros agentes antiTNFa, aunque se observó que los pacientes tratados con certolizumab tuvieron índices más bajos de formación de autoanticuerpos.
Fontalizumab
El interferón g es una citocina con actividad proinflamatoria implicada en modelos animales de colitis y con concentraciones elevadas en la mucosa de pacientes con EC. El fontalizumab (Protein Design Labs Inc, Fremont, CA) es una forma humanizada de anticuerpo antiinterferón g murino estudiado recientemente en EC. Un estudio controlado seleccionó al azar a 133 pacientes con EC moderada a grave para recibir 1 o 2 dosis de fontalizumab de 4 mg/kg, 10 mg/kg, o placebo (28 días de intervalo entre cada dosis). No se demostró ninguna diferencia en la tasa de respuesta con una sola dosis, pero en los que recibieron dos dosis, la tasa de respuesta evaluada al día 56 fue del 69 y 67% para los grupos del fontalizumab comparados con 32% en los grupos de placebo (p = 0.02 y 0.03, respectivamente). Esta diferencia fue mayor en pacientes con valores elevados de PCR. Los efectos adversos fueron similares en los grupos de tratamiento y placebo. Todos los acontecimientos adversos graves, excepto uno, fueron relacionados con exacerbaciones de la EC.37
Inhibidores selectivos de moléculas de adhesión molecular
La migración de leucocitos del espacio vascular hacia al tejido inflamado es un proceso complicado que implica múltiples interacciones del leucocito con las células endoteliales, incluyendo movilización, adherencia y diseminación. La adherencia del leucocito al endotelio activado es mediada, sobre todo por las denominadas integrinas a4 y b2. La integrina a4 se expresa en todos los tipos de células blancas y puede unirse con la subunidad b1 y b7.
Los ligandos endoteliales reconocidos por la integrina a4 incluyen la molécula de adherencia vascular (VCAM-1) y la molécula de adherencia mucosa (MadCAM-1), la primera se induce en los sitios de inflamación, mientras que la última se expresa de forma constitutiva en el endotelio, placas de Peyer y el tejido linfoide asociado al intestino.38
Natalizumab
Natalizumab es un anticuerpo humanizado recombinante derivado de un anticuerpo monoclonal murino (AN100226m), que es 95% humano y 5% murino, el cual está dirigido a la integrina a4. Estos anticuerpos han demostrado su eficacia en modelos animales de esclerosis múltiple y colitis.39,40 Los datos preliminares que apoyaron el uso del natalizumab como agente de inducción eran ambiguos, pues dos estudios en EC demostraron una tendencia positiva con una o dos dosis de 3 o 6 mg/kg contra placebo, pero los objetivos primarios no alcanzaron significancia estadística.41,42
El estudio ENACT-1 no demostró diferencia significativa en respuesta a la inducción de remisión clínica en 10 semanas entre pacientes con EC (n = 905) tratados con una infusión intravenosa (300 mg) de natalizumab o placebo en la semana 0, 4, y 8.43
En cambio, el estudio denominado ENCORE incluyó solamente a pacientes con valores de PCR elevados (n = 509) con una respuesta a la remisión clínica en todos los intervalos de tiempo, tratados con tres dosis de natalizumab de 300 mg (0, 4 y 8) contra placebo.44
Asimismo, se han demostrado resultados más constantes en los estudios de mantenimiento para natalizumab. En el estudio ENACT-2, los pacientes con respuesta a la terapia de inducción (n = 339)
se aleatorizaron a recibir 300 mg de natalizumab o placebo cada 4 semanas hasta la semana 56. Un mayor número de pacientes en el grupo de natalizumab comparado al placebo, obtuvo una respuesta sostenida (61% vs. 28%, p < 0.001) y remisión (44% vs. 26%, p = 0.003) en la semana 36.43 El uso concomitante de inmunomoduladores no afectó la eficacia.45 Un estudio con seguimiento de la cohorte del grupo ENCORE demostró que 84% de los pacientes que permanecían en remisión después de un año continuaban así dos años después mediante la aplicación mensual de natalizumab.46
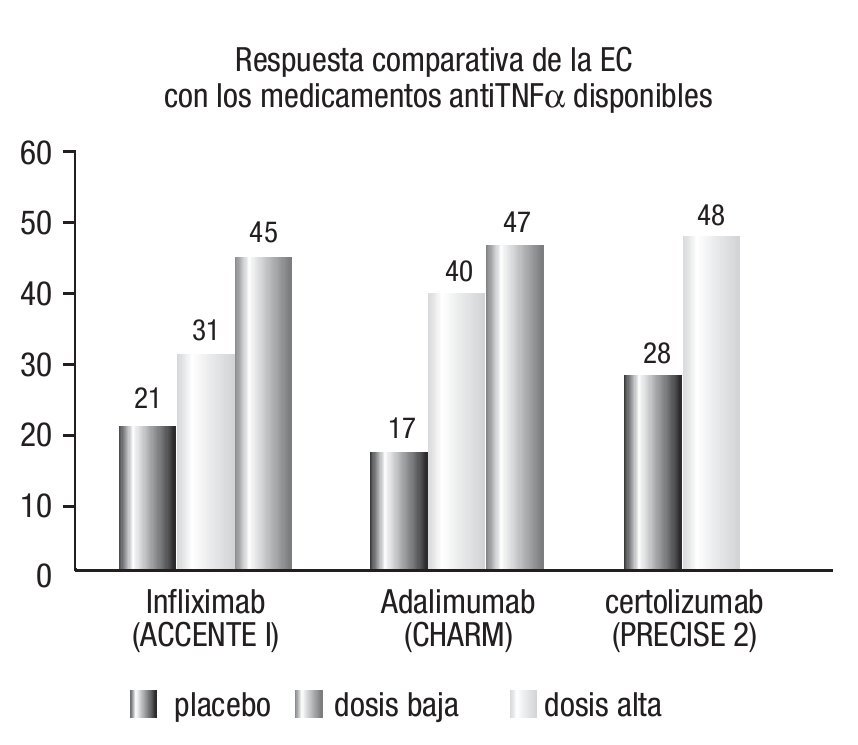
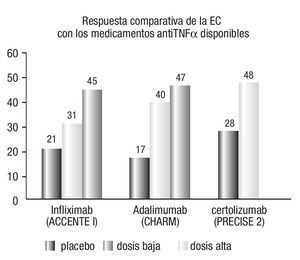
Sin embargo, a principios del año 2005, se reportaron tres casos de leucoencefalopatía multi-focal progresiva (LMP) en pacientes tratados con natalizumab, dos de ellos con una evolución fatal. Dos pacientes tenían esclerosis múltiple y una tenía EC. Los estudios fueron suspendidos y el fármaco retirado del mercado por la Administración de Fármacos y Alimentos en Estados Unidos (FDA). Un estudio de seguridad que incluyó 90% de todos los pacientes con EC, esclerosis múltiple y artritis reumatoide que habían recibido natalizumab no demostró casos adicionales de LMP, y el riesgo total de LMP estimado fue de 0.1%.47 En enero del 2008, la FDA aprobó nuevamente la comercialización del natalizumab para pacientes con EC estrictamente seleccionados. En la Figura 1 se muestran los resultados comparativos de los medicamentos biológicos aprobados para inducir y mantener la remisión en la EC.
Figura 1. Porcentaje de respuesta observada a diferentes agentes antiTNFa en pacientes con EC que recibieron tratamiento a largo plazo (≥ 30 semanas). Sólo se incluyeron enfermos que mostraron una respuesta inicial al tratamiento biológico empleado (semanas 2 a 4).
MLN02
MLN02 es un anticuerpo monoclonal humanizado que reconoce específicamente el heterodímero a4b7 sin reacción cruzada con otros monómeros individuales.48 El ligando principal para a4b7 es MadCAM1, y por lo tanto, este anticuerpo debe ser específico del intestino. Aunque la eficacia clínica y endoscópica se ha demostrado en pacientes con CUCI, los pacientes con EC leve a moderada (n = 185) que recibieron dos dosis de 0.5 o 2 mg/kg a los 0 y 29 días no alcanzaron el objetivo primario de respuesta clínica a los dos meses. Por otra parte, la remisión clínica fue considerada en 36.9% del grupo de 2.0 mg/kg comparado con 20.7% del grupo del placebo (p < 0.05).49
Nuevos agentes biológicos en evaluación
Visilizumab
Visilizumab (NuvionTM, Protein Design Labs) es un anticuerpo monoclonal humanizado IgG2 (HuM291) dirigido a la cadena de CD3e del receptor de la célula T expresado en las células T activadas. Diseñado para amplificar el efecto inmunosupresor potente de OKT3 (un anticuerpo monoclonal murino usado en el trasplante de órganos sólidos), éste reduce al mínimo la respuesta de anticuerpo vs. anticuerpo antirratón y los efectos nocivos del síndrome de liberación de citocinas. Mientras que los estudios en CUCI han demostrado seguridad y eficacia, sólo hay un estudio de fase abierta pequeño en EC refractarios a terapia médica (incluyendo infliximab) (n = 14) en el que se administró 2 dosis de visilizumab 10µg/kg los días 0 y 1 o placebo; con 58% de respuesta y remisión clínica contra 33% respectivamente en el día 89, y disminución en el uso de prednisona de 19 mg/día basales a 4 mg/día.50
Anticuerpos contra el receptor de IL-6
La IL-6 es otra citocina que desempeña un papel central en el proceso inflamatorio de la EC. Recientemente, se ha demostrado que un anticuerpo monoclonal dirigido contra el receptor de IL-6 (IL-6R), el cual logra la disminución de la expresión de las moléculas de adherencia y múltiples citocinas proinflamatorias en modelos animales de colitis. Un estudio experimental con selección al azar usando un anticuerpo humanizado contra IL-6R (MRA), demostró en 36 pacientes con EC activa que la administración cada 2 semanas de una infusión de MRA tenía una tasa de respuesta del 80% comparada con 31% de pacientes que recibieron placebo (p = 0.019), aunque la endoscopia e histología no demostraron ninguna diferencia.51
Anticuerpos contra IL-12
La interleucina 12 es una citocina importante en la respuesta inflamatoria mediada por células Th1. También se ha evaluado un anticuerpo monoclonal dirigido contra IL-12, y se aleatorizó a un grupo de pacientes a recibir una dosis de 3 mg/kg semanalmente por 7 semanas; encontrando que la tasa de respuesta fue superior para este anticuerpo (75% vs. 25%, p = 0.03), pero la diferencia se perdió a la semana 18 (69% vs. 25%, p = 0.08). La mayor respuesta clínica en el grupo que recibió antiIL-12 ocurrió de forma paralela a una disminución de la secreción de las células mononucleares colónicas de IL-12, IFNg, y TNFa.52
Talidomida
Debido a su efecto antiTNFa y antiIL-12, este fármaco se ha probado en dos estudios pequeños en forma abierta, en poblaciones combinadas de EII, obteniendo en la mayoría de los pacientes respuesta o remisión clínica;53,54 el uso de este medicamento está restringido debido a su teratogenicidad bien conocida y está limitado por los efectos secundarios de sedación y trastornos del ánimo.
Estimulación de la respuesta inmune innata
Aunque se piensa que la regulación defectuosa del sistema inmune es una pieza clave en la patogenia de EII, una hipótesis alternativa propone que una respuesta inmune natural alterada pudiera estar presente en la etiología de la EC.
Basado en los resultados positivos observados en otros desórdenes de la función de los neutrófilos, se ha estudiado al factor estimulante de crecimiento de colonias de granulocitos-macrófagos(GM-CSF), un factor de crecimiento mieloide que estimula el crecimiento y función de células fagocitarias, en pacientes con EC.
En un estudio se aleatorizaron a 124 pacientes a recibir sargramostim (GM-CSF) 6 µg/kg/día por vía subcutánea o un placebo por 8 semanas: el objetivo principal fue evaluar la respuesta clínica definida por una disminución del CDAI ≥ 70 puntos, lo que no se cumplió; sin embargo, más pacientes en el grupo del sargramostim alcanzó los objetivos secundarios (disminución de CDAI de ≥ 100 puntos) con un 48% vs. 26%, p = 0.01 y lograron la remisión en el día 57 (40% vs. 19% p = 0.01). El grupo del sargramostim sufrió de más reacciones en el sitio de la inyección y dolor óseo.55
Colitis ulcerativa crónica idiopática (CUCI)Infliximab
Mientras que varios estudios con series pequeñas de pacientes a los que se les administró infliximab demostraron en forma colectiva eficacia ambigua en CUCI, el estudio ACT 1 y 2 proporcionó la evidencia definitiva que apoyaba su eficacia en esta población.55 Los pacientes del ACT 1 eran enfermos refractarios o intolerantes a esteroides, azatioprina o 6-MP, mientras que el estudio ACT 2 también incluyó pacientes con refractariedad e intolerancia a los agentes 5-ASA. En cada estudio, 364 pacientes recibieron placebo o infliximab a dosis de 5 o 10 mg/kg en la semana 0, 2, y 6, y después cada 8 semanas hasta la semana 46 y 22 respectivamente, con seguimiento y registro de datos en la semana 54 y 30. En el ACT 1 y 2, el infliximab en cualquier dosis fue mejor que placebo en todas las mediciones en los diferentes intervalos de tiempo en cuanto a remisión clínica, endoscópica y disminución de esteroides. Dos terceras partes en el grupo del infliximab alcanzó respuesta clínica y la mitad logró la remisión a largo plazo, mientras que 22% pudo descontinuar la terapia esteroidea. Los efectos adversos fueron similares entre los grupos; en el grupo de infliximab se presentaron un caso de tuberculosis y uno de histoplasmosis (lo que causó la muerte), así como tres complicaciones neurológicas. En 6% se encontraron autoanticuerpos (ATIs) y esto confirió un riesgo ligeramente más alto de reacción a la infusión. La terapia concomitante con inmunomoduladores fue asociada a un índice más bajo de formación de anticuerpos, pero no se pudo concluir nada definitivo dado el número pequeño de pacientes con ATIs. Basado en estos estudios, 5 mg/kg es la dosis de inicio recomendada, dado que no hubo diferencias significativas entre las dos dosis de infliximab empleadas. Mientras que los estudios del ACT han definido al infliximab como tratamiento eficaz para el manejo de pacientes con CUCI ambulatorios, el papel del infliximab en el tratamiento de pacientes hospitalizados es todavía incierto. En un ensayo clínico se trataron 45 pacientes con CUCI de moderado a grave o fulminante, refractarios a esteroides intravenosos, después de un lapso de iniciada la terapia de 5 y 3 días, aplicando una sola dosis de infliximab de 5 mg/kg o placebo. Considerando a todos los pacientes que recibieron infliximab, éstos lograron evitar la colectomía en los primeros tres meses comparados con placebo en 67% vs. 29%, p = 0.017; sin embargo, en el análisis del subgrupo de colitis fulminante, esta diferencia no fue significativa (69% vs. 47%, p = 0.276).56 En un estudio de tipo abierto con el uso de infliximab administrado a 12 pacientes hospitalizados refractarios a esteroides, nueve fueron colectomizados en un plazo de tres meses.57 Dos estudios recientes demostraron perfiles favorables de respuesta a infliximab en pacientes con CUCI grave-agudo,58,59 y se ha observado que este subgrupo de pacientes puede ser diferente de aquellos con enfermedad establecida.
Inhibidores selectivos de las moléculas de la adherencia
Natalizumab (Tysabri®, Elan y Biogen Inc.)
Se ha conducido sólo un estudio de forma abierta de natalizumab en CUCI, en el cual se administró una sola dosis de 3 mg/kg a 10 pacientes con enfermedad activa, con una respuesta clínica significativa y mejoría en la calidad de vida observada en el primer mes, con 2 pacientes que alcanzaron remisión clínica y a las 8 semanas, 80% de pacientes requirieron medicación de rescate.60 Dado la asociación con LMP en pacientes con EC y esclerosis múltiple, la posibilidad de ensayos futuros con este fármaco se desconoce.
MLN02
En un estudio de pacientes con CUCI leve a moderado (n = 181), éstos fueron aleatorizados a recibir una dosis de MLN-02 de 0.5 o 2 mg/kg o placebo y fueron evaluados a un mes, los pacientes del grupo de MLN-02 experimentaron índices más altos de remisión clínica (33 y 32% vs. 14%, p = 0.03) y remisión endoscópica (48 y 35% vs. 16% p = 0.001).48 Se encontraron anticuerpos vs. MLN-02 en 44% de los pacientes; se observó que aquellos con títulos elevados de 31:125, 24% tenían pérdida de saturación a los sitios a4b7, con índices de remisión en este grupo más bajos, cercanos a los de placebo. No hubo diferencias en la tasa de eventos adversos. El MLN-02 parece prometedor, pero se requiere determinar la respuesta a largo plazo y la dosificación óptima.
Alicaforsen
El alicaforsen (IS-IS 2302, Isis Pharmaceuticals, Inc. Carlsbad, CA) es una molécula que regula el RNA mensajero que codifica para la síntesis de la molécula de adhesión intracelular I (ICAM-1), una glucoproteína transmembrana estimulada por mediadores antiinflamatorios. El ICAM-1 está implicado en la activación y migración de los leucocitos, y valores altos de esta proteína en suero y mucosa han sido observados en modelos animales de EII.61
El uso de alicaforsen parenteral no fue eficaz en EC,62 pero las formulaciones en enema parecen reportar beneficios en la CUCI y pouchitis en estudios con series pequeñas. En un estudio de pacientes con CUCI distal leve a moderada (n = 40), que recibieron enemas en una concentración de 0.1, 0.5, 2 o 4 mg/mL en una dosis diaria, experimentaron una mejoría de tipo dosis dependiente en el índice de actividad de la enfermedad (DAI) (p = 0.003). A los 3 meses, el DAI en el grupo de 4 mg/mL disminuyó 72% comparado con 11.5% en el grupo placebo (p = 0.016), además ningún paciente del grupo de alicaforsen necesitó terapia adicional en los siguientes seis meses comparado con 50% de los pacientes del grupo placebo que sí requirieron.63 No se reportó ningún efecto adverso serio.
Anticuerpos antiinterleucina-2 (IL-2)
La IL-2 es una citocina producida por las células-T activadas que se fija al receptor de alta afinidad IL-2R en presencia de la cadena a CD25 y de esta manera perpetúa la proliferación y activación de la célula T.64 Además, los niveles altos de IL-2 se han asociado a una conducta de resistencia a esteroides.65 Se han evaluado dos anticuerpos antiIL en pacientes con CUCI.
Daclizumab
(Zenapax, Roche, Basel, Suiza), es un anticuerpo monoclonal humanizado recombinante (IgG1) dirigido al IL-2R. Un estudio piloto de fase abierta pequeño, demostró resultados prometedores para este anticuerpo;66 sin embargo, en un estudio controlado aleatorizado recientemente publicado (n = 159) no encontró ninguna diferencia en la tasa de respuesta o remisión entre las dos dosis de daclizumab y placebo, los que fueron administrados cada dos semanas por 8 semanas.67
Basilixumab
Es un anticuerpo monoclonal quimérico dirigido a la cadena a del IL-2R (CD25), indujo remisión en la mayoría de 10 pacientes con CUCI resistentes a esteroides con una sola dosis observadas en un estudio fase abierta.64 Además, en un estudio in vitro la prueba realizada en voluntarios sanos y en pacientes con CUCI en remisión, demostraron que el Basiliximab revertía la resistencia a esteroides, y así se piensa que el tratamiento antiIL-2 puede tener utilidad potencial en este subgrupo de pacientes.
Visilizumab (NUVION)
Es un anticuerpo monoclonal antiCD3, está siendo evaluado en casos de CUCI grave. En un estudio abierto fase I, 79 y 54% de pacientes con CUCI refractarios a esteroides tratados con 10 mcg/kg/día (n = 24) por 2 días consecutivos, experimentaron respuesta y remisión respectivamente al día 30, y 100% de los enfermos tratados con 15 mcg/kg/día (n = 8) alcanzaron ambas respuesta y remisión. De estos pacientes, 66% recibieron la dosis más alta por un año y se observó que al menos dos terceras partes de los pacientes experimentaron síntomas del síndrome de liberación de citocinas 1 a 3 horas posinfusión (náusea, escalofríos, fiebre, cefalea y artralgias). Persistieron con niveles bajos de células T hasta 3 semanas después de la infusión. Además, se ha reportado la elevación en los títulos de anticuerpos contra el virus del Epstein Barr (EBV) en pacientes con enfermedad injerto contra huésped que recibieron visilizumab. Por esta razón, en este estudio se excluyó a los pacientes con anticuerpos positivos vs. EBV.68,69
Interferones
Interferón-alfa (IFNa)
IFNa tiene una amplia gama de actividad antivirus, antitumoral y antiinflamatoria, incluyendo la inducción del antagonista del receptor IL-1 y del receptor soluble p55 del TNFa, y disminución en las citocinas Th2.70 Posterior al reconocimiento de que el IFNa no induce reactivaciones de la colitis en pacientes con CUCI tratados por hepatitis viral71,72 se ha estudiado su papel terapéutico en la CUCI. En un estudio abierto (n = 28) se administró IFNa2a subcutáneo durante 6-12 meses en pacientes con CUCI, 93% alcanzó y mantuvo remisión clínica y endoscópica durante dos años,73 mientras que otro estudio pequeño demostró solamente la ventaja con una duración del efecto breve de IFNa2a comparada con enemas de prednisolona en CUCI distal.74 En el único estudio aleatorizado placebo controlado realizado con pacientes con CUCI refractario a los agentes 5-ASA, los esteroides o azatioprina (n = 60), se les administró una dosis semanal con placebo vs. INFa2b pegilado 0.5 o 1 mg/kg; no se demostró ninguna diferencia en la tasa de respuesta clínica o endoscópica.70 Así, podemos decir que el IFNa no parece exacerbar la CUCI al tratar la hepatitis crónica, no ha mostrado ser eficaz como tratamiento primario para la CUCI.
Interferónb (IFNb)
IFNb también tiene características antiinflamatorias, incluyendo un aumento de los receptores de antagonistas para la IL-1 e IL-10 y una disminución del IFNa e IL-2. Con el uso del IFNb se han obtenido resultados variados en el tratamiento de CUCI. En un estudio experimental de 25 pacientes con CUCI refractarios a esteroides tratados con IFNb natural humano o IFNb recombinante subcutáneo por un promedio de 52 semanas, 88% alcanzó la remisión, con una duración de un año.75 Mientras que un estudio aleatorizado demostró la ventaja endoscópica en los pacientes tratados con IFNb1 comparado con placebo.76 Un estudio controlado más grande no pudo demostrar ninguna ventaja IFNb1a recombinante sobre placebo en la tasa de respuesta o remisión clínica, endoscópica, o la reducción en la dosis de esteroides.77
Factores de crecimiento
Éstos pueden restaurar la función protectora y reparativa del colon, y por lo tanto, representan una opción terapéutica para la CUCI. Los factores de crecimiento que se han identificado como potencialmente beneficiosos incluyen el factor del crecimiento b (TGFb ), el factor de crecimiento epidérmico (EGF), el factor de crecimiento de keratinocitos 1 y 2 (KGF-1 o 2, también conocido como factor de crecimiento de fibroblastos 7 o 10). El repifermin es un KGF-2 truncado, purificado expresado en la bacteria Escherichia coli, que induce la proliferación de la mucosa intestinal y colónica, reduce las úlceras y la inflamación intestinal en los modelos animales.78 Sin embargo, el repifermin administrado por vía intravenosa (1-50 µg/kg) por cinco días consecutivos no demostró respuesta clínica o remisión en la semana 4 comparado con placebo en pacientes con CUCI activo.78 Entre otras razones, los autores sugirieron que la dosificación subóptima pudiera explicar los resultados negativos. El EGF es un péptido mitogénico producido por las glándulas de Brunner salival y duodenal. El uso tópico es beneficioso en la curación de las heridas y el EGF en administración sistémica es útil en el tratamiento de la enterocolitis necrotizante neonatal.79 Se ha demostrado una tasa de remisión del 83% en pacientes con CUCI del lado izquierdo grados leve a moderado (n = 24) que fueron seleccionados al azar a recibir enemas diarios de EGF por 2 semanas comparados con 8% en el grupo de placebo (p < 0.001); el índice de actividad de la enfermedad, tanto endoscópica e histológica seguía siendo perceptiblemente mejores en el grupo de EGF a las 12 semanas.79 El rebamipide es un aminoácido análogo de la 2 (1H) quinolinone que se ha usado para tratar úlceras gástricas en Japón. Tiene un efecto curativo en la mucosa al estimular la síntesis local de prostaglandinas y favorece la regeneración de la célula epitelial a través de la regulación del EGF y de su receptor, supresión de neutrófilos y producción disminuida de las citocinas inflamatorias estimuladas por anti-inflamatorios no esteroideos y/o por el H. pylori.80
En un estudio abierto pequeño en el cual se administró enemas de rebapimide dos veces al día a pacientes con proctitis, se demostró al mes mejoría clínica, endoscópica e histopatológica significativa.81 Estos resultados preliminares justifican más estudios controlados de tamaño suficiente para evaluar esta clase de terapia en la CUCI.
Curcúmina
Derivado de la curcúmina, el curcumin parece inhibir al NF-kB y posee propiedades antiinflamatorias, antimicrobianas y de supresión tumoral; se ha utilizado para prevenir y para tratar colitis en modelos animales. En estudios clínicos se aleatorizaron pacientes (n = 82) con CUCI en remisión a recibir 5-ASA más curcumin contra 5-ASA más placebo y se evaluó a seis meses la frecuencia de recaída (2 vs. 8%, p = 0.04).82
Conclusiones
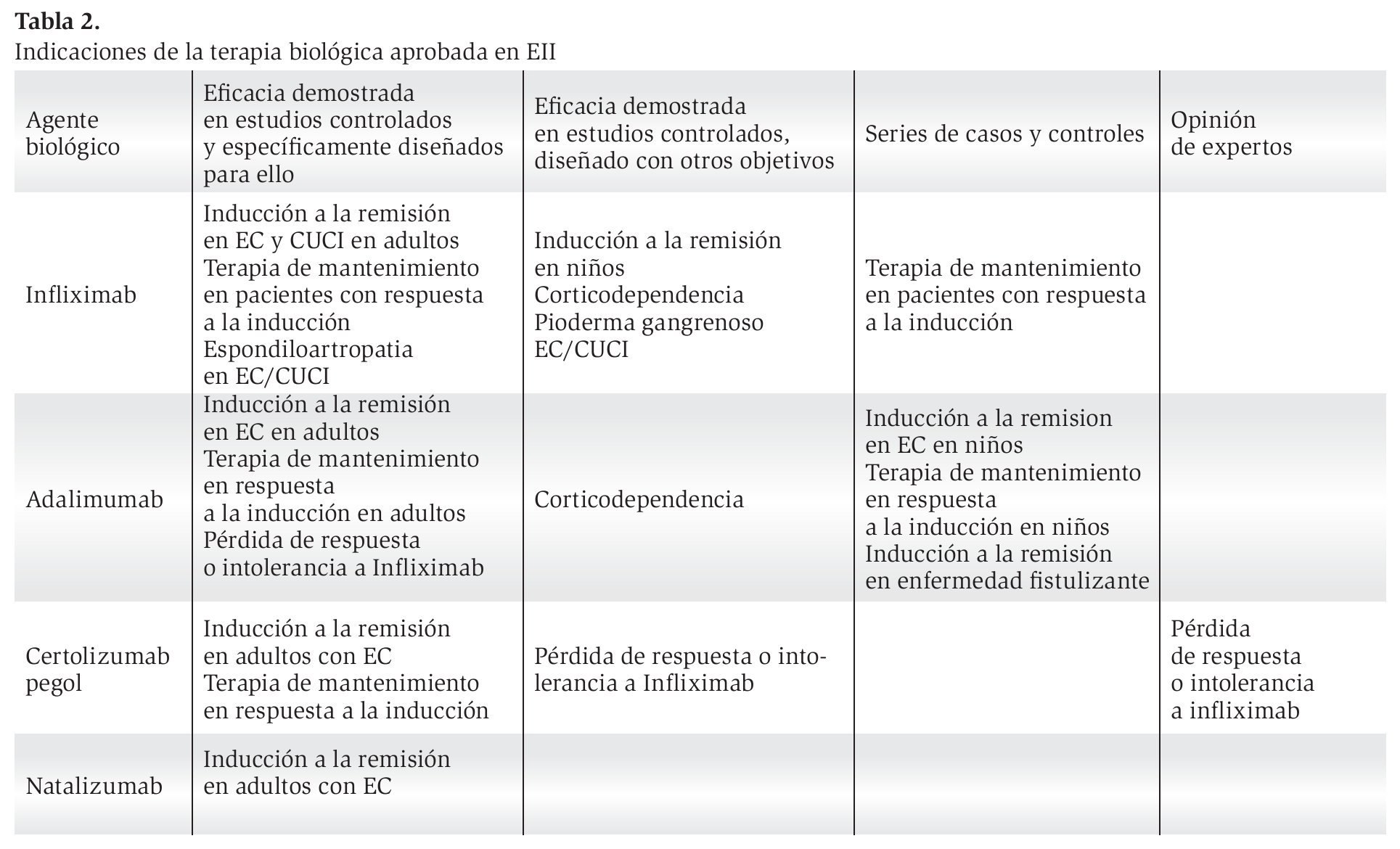
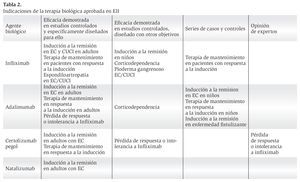
El tratamiento de la EII es un campo de investigación en constante crecimiento. La terapia biológica ha venido a revolucionar el manejo que tradicionalmente se daba a estos pacientes; en particular la introducción de infliximab hace un poco más de una década ha sido la contribución más significativa al espectro de opciones terapéuticas que por muchos años estuvo limitado a los aminosalicilatos, antibióticos, esteroides, inmunomoduladores y cirugía. Estos agentes se utilizan para inducir y/o mantener la remisión. En la Tabla 2 se muestran las indicaciones y el nivel de evidencia que existe para cada fármaco aprobado en el manejo de la EII. Su utilidad parece depender de la gravedad y localización de la enfermedad y para su uso debemos considerar también otros factores como los efectos secundarios que pueden ser potencialmente graves, así como los costos. Actualmente, existe controversia sobre el mejor momento de iniciar esta terapia, es decir, siguiendo un esquema tradicional escalonado de acuerdo a la gravedad de la enfermedad o seguir un esquema propuesto recientemente de terapia denominado "cuesta abajo" que se supone proporciona una respuesta más rápida y completa. Otros factores relacionados con la inmunopatogénesis de la EII se evalúan en este momento para que en un futuro puedan ser empleados como blancos terapéuticos.
Correspondencia:
Dr. Francisco Bosques-Padilla. Av. Madero y Gonzalitos S/N, Colonia Mitras Centro. Monterrey N.L., C.P. 64460.
Correo electrónico: fbosques58@hotmail.com.
Fecha recibido: 03 diciembre 2008
Fecha aprobado: 15 diciembre 2008