La Asociación Mexicana de Hepatología A.C. llevó a cabo el consenso del manejo de las complicaciones de la cirrosis hepática en población pediátrica, con el fin de proveer a los médicos de información útil para su tratamiento. Participaron un grupo de gastroenterólogos pediatras y expertos en nutrición, nefrología y enfermedades infecciosas, quienes revisaron la literatura médica. El método Delphi fue aplicado para obtener el nivel de acuerdo de los enunciados emitidos; estos fueron enviados a los participantes para ser analizados, votados y en sesiones virtuales fueron discutidos, obteniendo así las declaraciones finales. Los resultados del consenso fueron emitir las indicaciones para el manejo de un niño con cirrosis hepática, con el fin de prevenir o controlar las complicaciones.
The Asociación Mexicana de Hepatología A.C. carried out the Consensus on the Management of Complications of Cirrhosis of the Liver in Pediatrics to provide physicians with useful information for treating said complications. A group of pediatric gastroenterologists and experts in nutrition, nephrology, and infectious diseases participated and reviewed the medical literature. The Delphi method was applied to obtain the level of agreement on the statements that were formulated. The statements were sent to the participants to be analyzed and voted upon, after which they were discussed in virtual sessions, and the final versions were produced. The aim of the consensus results was to issue indications for the management of pediatric patients with liver cirrhosis, to prevent or control complications.
La cirrosis en niños se presenta como resultado común de un espectro amplio de enfermedades genéticas, infecciosas, inflamatorias, vasculares y colestásicas1. Suele resultar de 2 principales procesos: lesión hepatotóxica (infecciosa, metabólica e hígado graso) o por lesión colestásica, esta última habitualmente resultado de la obstrucción al flujo biliar, principalmente atresia de vías biliares (AVB)1,2. La mayoría de los casos con enfermedad hepática crónica (EHC) pueden progresar a fibrosis hepática, cirrosis e, incluso, al desarrollo de carcinoma hepatocelular3.
En México las enfermedades hepáticas y la cirrosis hepática constituyen la 4.ª causa de muerte en la población general. En la edad pediátrica no existen registros específicos de cirrosis hepática en relación con su incidencia4,5. La información relacionada con las diversas complicaciones, cuyo diagnóstico y tratamiento es escasa, adolece de poca evidencia de alta calidad que permita apoyar recomendaciones fuertes para su manejo. Por lo anterior, la Asociación Mexicana de Hepatología convocó a un grupo de gastroenterólogos pediatras con experiencia en el área de la hepatología, así como profesionales de la salud con especialidad pediátrica en infectología, nefrología y nutrición clínica con el objetivo de realizar un consenso y obtener un documento como una guía útil para el manejo de las complicaciones de la cirrosis hepática en la edad pediátrica.
MetodologíaSe organizaron 8 mesas de trabajo con diferentes tópicos sobre las distintas complicaciones de la cirrosis, cada una de ellas con un coordinador; participaron 22 gastroenterólogos pediatras y 3 especialistas en infectología, nefrología y nutrición. Se creó un comité de revisión, integrado por 3 gastroenterólogos pediatras (JFC, JACH y RVF) para la elaboración del protocolo y revisión de los enunciados. Se realizó una búsqueda inicial de información en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), que comprendiera un período entre el 1 de enero de 1990 al 1 marzo del 2021. Los criterios de búsqueda bibliográfica (keywords) fueron: cirrosis y enfermedad hepática crónica en niños (chronic liver disease in children, cirrhosis in children, combinado con los siguientes términos: «epidemiology», «incidence», «prevalence», «Mexico», «mortality», «diagnosis», «differential diagnosis», «treatment», «antibiotics», «infection», «therapy», «management», «nutrition», «review», «guidelines», «transplant», «meta-analysis» «portal hypertension», «esophageal variceal hemorrhage», «hepatic encephalopathy», «malnutrition», «hepatorenal syndrome», «ascites», «spontaneous bacterial peritonitis», «hepatoportal syndrome», «portopulmonary», «cholangitis» y sus equivalentes en español. Se identificaron todas las publicaciones en inglés y español (artículos originales, consensos, guías, revisiones sistemáticas y metaanálisis), y publicaciones que los coordinadores consideraron relevantes y se compartieron con todo el grupo.
Posterior a la revisión de la información se procedió a la elaboración de enunciados; por cada mesa de trabajo fueron propuestos, analizados y evaluados mediante un proceso Delphi, de voto anónimo (con posibilidad de escribir comentarios), vía electrónica, para conocer el nivel de acuerdo en los enunciados/declaraciones. Cada enunciado o declaración fue evaluado acorde con la escala Likert de 5 puntos: a) totalmente de acuerdo; b) parcialmente de acuerdo; c) incierto; d) parcialmente en desacuerdo; y e) totalmente en desacuerdo.
En las votaciones participaron únicamente los gastroenterólogos pediatras. Después de una primera vuelta de votación se presentaron los resultados durante varias reuniones de trabajo virtual (4 para la primera ronda), donde los participantes emitieron sus comentarios con respecto a los enunciados presentados. Aquellos enunciados para los que existió consenso (>75% de acuerdo) fueron aceptados; aquellos para los que no existió consenso (menos del 75% de acuerdo) fueron revalorados para su eliminación o para ser reformulados por los miembros de la mesa de trabajo que los elaboró, y fueron puestos para una segunda ronda de votación anónima. Los resultados de la segunda ronda de votación se presentaron en 2 reuniones de trabajo virtual, donde los participantes emitieron sus comentarios, continuando con el mismo método previamente descrito para la aceptación de cada uno de los enunciados. Se realizó una tercera ronda de votación, y en una reunión final de trabajo virtual, donde los participantes emitieron sus comentarios, quedaron establecidos los enunciados del consenso. Los coordinadores de cada mesa elaboraron de forma analítica y sintética la parte correspondiente del manuscrito.
ResultadosSe elaboraron un total de 90 enunciados. Después de una tercera ronda de votación y discusión fueron incluidos 66 enunciados o declaraciones, con los que se realizó el presente documento.
Diagnóstico clínico y evaluación de la gravedadLa cirrosis hepática se caracteriza por 2 etapas clínicas, la compensada sin significación clínica (asintomáticos y estables) y la descompensada cuando se presentan complicaciones relacionadas con la hipertensión portal y/o la presencia de insuficiencia hepática. En ocasiones puede manifestarse como fallo aguda sobre crónico secundario a algún evento precipitante como infección viral, bacteriana o tóxica. En niños habitualmente existe una historia de daño hepático previo, muchas veces inadvertida, que progresa y que seguirá su curso hasta el desarrollo de fallo hepático y muerte del paciente6.
Las causas que dan lugar a cirrosis hepática en niños son múltiples (tabla 1). Dependiendo del grupo etario la AVB es la más frecuente en niños menores de 2 años de edad y la hepatitis autoinmune en niños mayores. Existe un grupo en el cual no se encuentra la causa, denominado de origen criptogénico, cuya frecuencia ha disminuido con el avance en el conocimiento de nuevas enfermedades hepáticas, en especial metabólicas/genéticas y de sus técnicas para el diagnóstico1,7.
Causas que originan cirrosis hepática en la edad pediátrica
| Obstrucción biliar | Colestasis familiar intrahepática | Enfermedad genética-metabólica | Alteraciones vasculares |
|---|---|---|---|
| Atresia de vías biliaresQuiste de colédocoLitiasisEstenosis del conducto biliar | Síndrome AlagilleDeficiencia gen FIC1 (ATP8B1)Deficiencia gen BSEP (ABCB11)Deficiencia gen MDR3 (ABCB4)Alteración en la síntesis de ácidos biliares | Deficiencia A1ATGlucogenosis tipo iii y ivGalactosemiaFructosemiaTirosinemia tipo 1Fibrosis quísticaEnfermedad de WilsonHepatopatía mitocondrialPorfiria cutánea tardíaHemocromatosisEnfermedad de Wolman | Síndrome Budd-ChiariEnfermedad VenooclusivaCardiopatía congénita (fallo cardíaca)Pericarditis constrictiva |
| Drogas y toxinas | Autoinmune | Virus hepatotróficos | Otras enfermedades |
|---|---|---|---|
| NPTIsoniazidaMetotrexatoIntoxicación Vitamina A | Hepatitis autoinmuneColangitis esclerosante | Hepatitis B y DHepatitis C | EHGNAHepatitis neonatal idiopáticaEnfermedad Zellweger |
A1AT: alfa 1 antitripsina; EHGNA: enfermedad hepática grasa no alcohólica; NPT: nutrición parenteral total.
Modificado: Pinto et al.9.
El patrón de progresión de una hepatopatía crónica al desarrollo de cirrosis difiere según la etiología. Los niños con colestasis neonatal, como la AVB y los síndromes de colestasis familiar progresiva, pueden desarrollar cirrosis de forma muy temprana, y otras como las de origen autoinmune, las hepatitis virales B y C y la enfermedad por hígado graso no alcohólico pueden evolucionar con datos inespecíficos o pasar inadvertidas y manifestarse clínicamente hasta que ya exista una descompensación hepática7,8. La búsqueda del agente causal de la cirrosis es importante, ya que en aquellas en las que existe un tratamiento específico puede ser posible retrasar o frenar la progresión; los estudios para el diagnóstico etiológico de las causas más frecuentes que originan cirrosis en niños se muestran en la tabla 21,7,8.
Causas Frecuentes Y Estudios Para El Diagnostico Etiologico En Niños Con Enfermedad Hepatica Cronica Que Desarrollan Cirrosis
| <2 años de edad | > 2años de edad | ||
|---|---|---|---|
| Causa | Estudios para el diagnóstico | Causa | Estudios para el diagnostico |
| Atresia de vías biliares | Colangiograma transoperatorio | Hepatitis autoinmune | ANA, AML, anti–LKM IgG |
| Colestasis intrahepática familiar progresiva (CIFP) | GGTBiopsia con InmunohistoquímicaMicroscopia electrónicaEstudio genético | Colangitis esclerosante primaria | Ultrasonido, CPRE,Biopsia hepática |
| Síndrome de Alagille | Fenotipo clínico, biopsia hepática, estudio genético | Hepatitis virus B | AgVHBe/ADN-VHB |
| Fibrosis quística | Cloruros en sudor, estudio genético | Hepatitis virus C | Anti-VHC, ARN-VHC |
| Enfermedad por almacenamiento de glucógenoGalactosemiaTirosinemia | Ácido láctico, glucemia y perfil de lípidos en ayunas, ácido úrico, prueba genéticaSustancias reductoras en orina, galactosa-1-fosfato en eritrocitos, nivel de uridiltransferasaSuccinilacetona urinaria, aminoácidos séricos | Enfermedad de Wilson | Ceruloplasmina, cobre orina 24h [CU] en biopsia hepática, anillo de Kayser-Fleischer |
| Deficiencia de A1AT | Niveles séricos de A1AT fenotipo | EHGNA | PFH, perfil de lípidos, glucemia e insulina sérica, índice de HOMA |
ADN-VHB: ácido desoxirribonucleico-virus de la hepatitis B; AgVHBe: antígeno «e» del virus de la hepatitis B; AML: anticuerpos anti-músculo liso; ANA: anticuerpos antinucleares; anti-LKM IgG: anticuerpo contra antígeno antimicrosomal de hígado y riñón; anti-VHC: anticuerpo para el virus de la hepatitis C; ARN-VHC: ácido ribonucleico-virus de la hepatitis C; CPRE: colangiopancreatografía retrógrada endoscópica; CU: cobre urinario; GGT: gamma glutamil transpeptidasa; HOMA: homeostasis model assessment; PFH: pruebas de función hepática.
Adaptado de: Cordova et al.7.
Nivel de acuerdo: totalmente de acuerdo 95.45%; parcialmente de acuerdo 4.55%.
La presentación clínica de la cirrosis depende de la causa; hasta en el 40% de los casos puede ser asintomática hasta la aparición de complicaciones como fallo hepático o hipertensión portal7,9,10. En la mitad de los casos en una etapa avanzada de cirrosis pueden tener pruebas de función hepática anormales antes del diagnóstico11. No existe un biomarcador específico; sin embargo, el conjunto de datos clínicos (parámetros antropométricos, fallo de crecimiento, ictericia, hepatoesplenomegalia y ascitis), bioquímicos (alteración de las pruebas de función y síntesis hepática) y marcadores de fibrosis no invasivos son de ayuda como complementación diagnóstica y evaluación de la gravedad7,9,10.
2. El marcador más utilizado para evaluar la gravedad de la enfermedad hepática, su pronóstico y priorización para trasplante hepático (TH) es el índice Pediatric End-Stage Liver Disease (PELD) para<12 años de edad y el Model for End-stage Liver Disease (MELD) para>12 años de edad.Nivel de acuerdo: totalmente de acuerdo 95.45%; parcialmente de acuerdo 4.55%.
Un índice de PELD o MELD >25, o en caso de datos de descompensación es indicativo de evaluación para TH. Los criterios de referencia en estos casos serían un fallo aguda sobre crónico, y complicaciones como falta de ganancia de peso, fallo para crecer, sangrado variceal, ascitis intratable, colangitis recurrente, episodios de peritonitis, prurito incontrolable, no corrección de la coagulopatía y encefalopatía progresiva12.
3. La escala de Child-Pugh y el score CLIF-SOFA se han utilizado en pacientes adultos para estimar el pronóstico y la necesidad de trasplante hepático, sin embargo no existe suficiente evidencia en niños.Nivel de acuerdo: totalmente de acuerdo 83.33%; parcialmente de acuerdo 16.67%.
El índice de Child-Pugh (ascitis, bilirrubina, albúmina, tiempo de protrombina, (por International Normalized Ratio [INR] y encefalopatía) se ha desestimado por la utilización de variables subjetivas como el grado de encefalopatía y de ascitis, aunque está descrito que un CHILD B podría ser indicativo de TH13,14. Bolia et al. evaluaron en niños con EHC descompensada la escala de CLIF-SOFA (tabla 3) basada en la medición de fallo orgánico, reportando que una puntuación mayor a 11 predice mortalidad a 28 días con una sensibilidad de 94.9% y especificidad de 91.5%15. Los factores que empeoran el pronóstico son la elevación de la creatinina mayor de 0.3mg/dl respecto a la previa (más que el valor total de creatinina mayor a 2mg/dl)15,16 y el descenso en el nivel de sodio sérico17. Para esta escala se requieren más estudios para su validación, sin embargo puede ser útil en casos graves.
Escala De pCLIF-SOFA
| Evaluación de fallo orgánico | |||||
|---|---|---|---|---|---|
| Escala | 0 | 1 | 2 | 3 | 4 |
| Respiratorio (PaO2/FiO2) | >400 | <400 | a <300 | a <200 | a <100 |
| Neurológico | Sin EH | EH grado 1 | EH grado 2 | EH grado 3 | EH grado 4 |
| Circulatorio | Sin hipotensión | aPresión sistólica< percentil 5 para la edad | a Dopamina<5 mcg/kg/min | aDopamina>5 o epinefrina≤0.1 o norepinefrina≤0.1 mcg/kg/min | adopamina>15 o epinefrina>0.1 o norepinefrina>0.1mcg/kg/min |
| Hematológico (INR) | ≤1.1 | >1.1 a <1.25 | ≤1.25 a <1.5 | ≥1.5 a <2.5 | a≥2.5 |
| Renal (creatinina sérica) (mg/dl) | Normal para la edad | >1 a<2 sobre el valor normal para la edad | a >2 a<3 sobre el valor normal para la edad | a >3 sobre el valor normal para la edad | a Uso de terapia renal sustitutiva |
| Hígado (bilirrubina sérica mg/dl) | <1.2 | ≥1.2 a<2 | ≥2 a<6 | ≥6 a <12 | a>12 |
EH: encefalopatía hepática; PaO2/FiO2: presión parcial de oxígeno/fracción inspirada de oxígeno.
Adaptado y modificado de: Bolia et al.15.
Nivel de acuerdo: totalmente de acuerdo 91.67%; parcialmente de acuerdo 8.33%.
El índice APRI (relación AST/plaquetas) es un método sencillo, que se ha estudiado en niños con diversas causas de EHC. En los escasos estudios publicados en niños los niveles del índice de APRI≥0.51 pueden predecir la presencia de fibrosis avanzada (F≥3), no existe suficiente evidencia en población pediátrica, sin embargo por su accesibilidad puede orientar y ayudar a decidir una biopsia hepática18–20.
El FibroTest tiene una serie de marcadores séricos que incluyen: alfa-2 macroglobulina, haptoglobina, apolipoproteína A1, bilirrubina total, gamaglutamil transpeptidasa (GGT) y edad del paciente y sexo. La puntuación se obtiene con estos datos accediendo a una licencia desde un sitio web. Solo puede realizarse en laboratorios validados y permite distinguir entre los pacientes con fibrosis significativa y aquellos sin fibrosis o con fibrosis leve, en donde un valor>59 se correlaciona con un Metavir>F221. El FibroTest para diferenciar entre un estadio de fibrosis avanzada (F2-F4) vs. fibrosis leve o no fibrosis (F0-F1) se ha reportado con una AUROC de 0.97 en niños con hepatitis por virus C22.
5. Para la evaluación de fibrosis avanzada y cirrosis hepática la elastografía y la elastorresonancia detectan el grado de rigidez hepática y su correlación con hipertensión portal; sin embargo se requieren más estudios en población pediátrica para su validación.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 13.64%.
La elastografía transitoria (ET) con el FibroScan® detecta el grado de rigidez hepática23. En niños existen pocos estudios que determinen valores estandarizados24,25 y según la edad se reportó el límite superior normal en niños pequeños, escolares y adolescentes, con valores de 5.96, 6.65 y 6.82kPa, respectivamente24.
En niños con diferente EHC la ET mostró variaciones en los niveles de corte para distinguir la presencia de cirrosis (F4). En AVB se reportó de 18.1kPa, en hepatitis por virus C de 12.5kPa y en EHC de diferentes etiologías 14.1kPa26–28. Adicionalmente la ET se ha estudiado para la detección de hipertensión portal 29,30. La ET es una técnica útil para la detección fibrosis en niños, sin embargo no distingue entre estadios leves o moderados; puede ser un estudio complementario junto con la evaluación clínica y bioquímica del paciente al diagnóstico y durante el seguimiento en niños con EHC.
La elastorresonancia (EMR) examina secciones enteras del hígado, y es posible medir tanto la rigidez hepática como la rigidez esplénica y evaluar de manera integral la fibrosis hepática avanzada/cirrosis y la hipertensión portal. Sin embargo, la mayoría de los estudios se han realizado en adultos, por lo que en pediatría hay información escasa. Un estudio con EMR para medir la rigidez esplénica reportó que un valor de corte de 9.9kPa puede predecir varices esofágicas en niños con AVB post-Kasai31.
6. La biopsia hepática establece el diagnóstico definitivo de cirrosis, evalúa la gravedad y el pronóstico de la enfermedad y es útil para el seguimiento a la respuesta a un tratamiento. Se trata de un procedimiento invasivo, así que debe individualizarse.Nivel de acuerdo: totalmente de acuerdo 91.67%; parcialmente de acuerdo 4.17%, incierto 4.17%.
La biopsia hepática es el estándar de oro para evaluar el grado de fibrosis o cirrosis hepática. Existen varias clasificaciones histológicas para su estadificación: la escala de Metavir es la más utilizada en pediatría y gradúa la fibrosis en 5 estadios: F0 ausencia de fibrosis, F1 fibrosis portal, F2 fibrosis periportal, F3 puentes de fibrosis entre espacios porta y F4 cirrosis32. La biopsia hepática tiene algunas desventajas, como alto coste, el error de muestreo y la variabilidad interobservador, y no está exenta de complicaciones, como son: ocurrencia de sangrado (2.8%), fuga biliar (0.6%), neumotórax (0.2%) y la mortalidad hasta en un 0.6% de los casos33. En cuanto al riesgo de sangrado posterior al procedimiento, aun cuando no existen valores de corte de los parámetros para identificar alteración en la hemostasia, la cifra de plaquetas<60,000/ml y un INR>1.5 son indicadores de riesgo de sangrado34. La indicación de este procedimiento debe individualizarse después de una investigación exhaustiva con métodos no invasivos que no hayan aclarado un diagnóstico.
Consideraciones nutricionales en las complicaciones de la cirrosis en pediatríaLa desnutrición y la sarcopenia tienen una prevalencia elevada en el paciente cirrótico (40% a 80%) y los mecanismos fisiológicos por los que ambas se originan son similares. La sarcopenia es ocasionada específicamente por pérdida de masa muscular, con la subsecuente pérdida de la fuerza y disminución del desempeño físico, y se ha descrito con mayor frecuencia en pacientes con mayor Child-Pugh. Ambas entidades tienen un papel fundamental en la morbimortalidad del paciente cirrótico, por lo que su diagnóstico y tratamiento oportunos son determinantes en la evolución de estos pacientes35,36. La vigilancia del estado nutricional en el paciente pediátrico es esencial para asegurar el crecimiento y desarrollo, más aún en aquellos con una condición crónica agregada como la cirrosis, independientemente de si se encuentra compensada o descompensada, principalmente porque muchos de los ciclos metabólicos y alteraciones bioquímicas que se presentan en el desarrollo de esta entidad están estrechamente asociados con el estado nutricional.
7. El peso de los pacientes pediátricos cirróticos debe tomarse con cautela debido a la afectación que tiene sobre este la ascitis y las visceromegalias.Nivel de acuerdo: totalmente de acuerdo 100%.
La evaluación antropométrica del paciente pediátrico con cirrosis debe incluir: peso, talla, perímetro cefálico (en menores de 3 años de edad), circunferencia media del brazo (CMB) y pliegue cutáneo tricipital.
El peso no debe ser utilizado como único marcador del estado nutricional, principalmente en pacientes con afección en la talla menos de 2 desviaciones estándar (<2DS). Así mismo el índice de masa corporal o peso para la talla no distinguen componentes corporales, como masa magra o masa grasa. Para esto el uso de mediciones como CMB o el pliegue cutáneo tricipital son excelentes herramientas para evaluar los cambios en la composición corporal, ya que tienen buena correlación cuando se las compara con las mediciones de composición corporal realizadas por densitometría ósea. Además es importante resaltar que la antropometría del brazo permite identificar principalmente la pérdida de masa magra y no se afecta por la ascitis o visceromegalias37–41.
8. La frecuencia con la que se debe realizar la evaluación antropométrica del paciente pediátrico con cirrosis dependerá de su compensación hepática y del estado nutricional.Nivel de acuerdo: totalmente de acuerdo 87.5%; parcialmente de acuerdo 12.5%.
En pacientes con compromiso nutricional grave o con descompensación hepática la monitorización deberá ser estrecha, desde 2 veces por semana hasta 2 veces por mes, mientras que los que tengan afectación nutricional moderada o leve pueden evaluarse al menos cada 3 meses9,37,42. Una adecuada historia dietética, en conjunto con una evaluación antropométrica y clínica completa, permitirá identificar cualquier tipo de deficiencia nutricional y realizar una intervención oportuna, siempre teniendo como objetivo primordial evitar la desnutrición-sarcopenia, y si estas ya existen revertirlas a la mayor brevedad, para evitar el desarrollo de morbilidades que deterioran el pronóstico del paciente cirrótico7,9,37,43.
9. No se recomienda el uso de fórmulas predictivas para establecer la meta calórica del paciente pediátrico con cirrosis.Nivel de acuerdo: totalmente de acuerdo 79.17%; parcialmente de acuerdo 20.83%.
Uno de los principales retos es establecer la meta calórica para lograr un estado nutricional óptimo, principalmente en aquellos en etapa terminal, debido a que son dependientes de la gravedad y las complicaciones de la enfermedad hepática. Se puede utilizar como punto de partida los requerimientos de la Organización Mundial de la Salud (OMS) de acuerdo a sexo y edad y evaluar la evolución nutricional para realizar los ajustes correspondientes37,44,45. Una de las consideraciones más importantes es la estimación de los requerimientos energéticos que dependen de diversos factores, como son: a) el desequilibrio metabólico ocasionado por disfunción de los hepatocitos, afectando las vías metabólicas de los macronutrientes; b) incremento del catabolismo debido a la propia disfunción hepática y a las complicaciones propias del paciente cirrótico; y c) pérdida de energía por malabsorción, secundaria a colestasis, insuficiencia pancreática o enteropatía perdedora de proteínas. Todas estas condiciones incrementarán los requerimientos energéticos de forma variable de acuerdo a la condición propia de cada individuo37,45,46.
Para establecer los requerimientos energéticos se puede utilizar como punto de partida las directrices propuestas por la OMS, no obstante se debe considerar que dependiendo del estado nutricional y el estado de compensación de la cirrosis, estos requerimientos se pueden incrementar entre un 120% a 150%, incluso más del 150% para lograr recuperación nutricional. Las modificaciones en el aporte energético van acorde con la evolución antropométrica del paciente, la adherencia a la dieta y la identificación de otros factores que afecten el cumplimiento de la meta calórica planeada37,43,44.
10. Se recomienda que el aporte energético proveniente de los hidratos de carbono sea de un 50% a un 65%, de preferencia hidratos de carbono complejos, especialmente útiles para el control de la glucosa en pacientes con hipoglucemias o con resistencia a la insulina.Nivel de acuerdo: totalmente de acuerdo 100%.
En el paciente cirrótico la composición de la dieta principalmente relacionada con los hidratos de carbono y las proteínas es fundamental, debido a las alteraciones que ocurren en su ciclo metabólico. Estas alteraciones metabólicas se observan con mayor frecuencia en lactantes y en pacientes con estadios avanzados de cirrosis, y la ingesta de hidratos de carbono simple puede favorecer estas alteraciones en el control de la glucosa37,38,47.
11. No se recomienda la restricción proteica en los pacientes pediátricos con cirrosis.Nivel de acuerdo: totalmente de acuerdo 90.91%; parcialmente de acuerdo 4.55%; incierto 4.55%.
Los requerimientos de proteína superan a los establecidos por la OMS para sexo y edad, y van desde 2 hasta 4g/kg/día. Los suplementos orales de aminoácidos ramificados han demostrado utilidad en la recuperación nutricional38,47–50. Los requerimientos de proteína están incrementados por la disfunción metabólica secundaria al daño hepático y por la afectación del estado nutricional, por lo que para evitar el catabolismo proteico la dieta deberá de tener al menos 2g/kg/día de proteína. Se debe tener en cuenta que el aporte proteico debe estar directamente relacionado con el estado nutricional, la sarcopenia y el estado de compensación de la cirrosis47,48. Los pacientes con encefalopatía, con niveles de amonio entre 150 a 200μmol/l, tienen mayor riesgo de edema cerebral, y podrían requerir restricción de proteínas, no obstante, esta restricción no debe durar más allá de 48horas, pues el ayuno prolongado y el estrés al que están sometidos estos pacientes incrementan el catabolismo de proteínas, y por tanto los niveles de amonio. La restricción proteica no justifica disminución en el aporte energético, el cual se debe cubrir siempre al 100%, incluso un 20% extra para revertir el catabolismo. En pacientes pediátricos los suplementos en polvo de aminoácidos de cadena ramificada no han demostrado tener utilidad en el manejo de la encefalopatía, pero administrarlos por vía oral puede ayudar a la recuperación nutricional de los pacientes desnutridos con enfermedad hepática avanzada37,51,52.
12. Se recomienda en los pacientes cirróticos con colestasis la suplementación con vitaminas liposolubles y triglicéridos de cadena media, en una proporción del 30% al 70% de las grasas totales de la dieta y para evitar la deficiencia de los ácidos grasos esenciales no exceder del 80%.Nivel de acuerdo: totalmente de acuerdo 90.91%; parcialmente de acuerdo 4.55%; incierto 4.55%.
En los pacientes con cirrosis compensada o descompensada la ingesta de grasa debe ser normal, entre el 25% a 30% del aporte energético total, y solo se incrementará el aporte en aquellos pacientes con datos de malabsorción 37,38,47,49.
13. El uso de una sonda de alimentación, preferentemente sonda nasogástrica o transpilórica, se deberá considerar para ofrecer una dieta enteral con alta densidad energética, 1-1.5kcal/ml en todo paciente que no cubra por sí mismo la ingesta de su meta calórica.Nivel de acuerdo: totalmente de acuerdo 79.17%; parcialmente de acuerdo 16.67%.
La alimentación enteral está indicada también en aquellos pacientes con desnutrición grave o CMB<percentil 5 o en aquellos pacientes que tengan cirrosis descompensada con comorbilidades que limiten su ingesta. El uso de una sonda es seguro y no incrementa el riesgo de rotura de varices esofágicas; se recomienda que idealmente sea de material suave, como el silicón. El aporte de la dieta enteral también se puede hacer en primera instancia por vía oral si el paciente no ha alcanzado su meta calórica en 2 semanas37,47,48,53.
14. La nutrición parenteral debe ser utilizada cuando exista incapacidad para utilizar la vía oral o enteral por más de 72 horas, o como complemento calórico cuando sea imposible lograr un crecimiento pondoestatural adecuado a pesar de un aporte enteral pleno.Nivel de acuerdo: totalmente de acuerdo 81.82%; parcialmente de acuerdo 13.64%; parcialmente desacuerdo 4.55%.
Es importante tener en cuenta que el paciente cirrótico debe cubrir el aporte energético estimado al 100%, independientemente del estado de compensación de la cirrosis37,53,54.
15. La restricción de sodio debe establecerse solo en los casos de ascitis descompensada.Nivel de acuerdo: totalmente de acuerdo 91.67%; parcialmente de acuerdo 8.33%.
La restricción de sodio de forma rutinaria en todo paciente cirrótico puede comprometer la aceptación de la dieta y su ingesta calórica, Considerándose como restricción<2 mEq/kg de sodio al día en conjunto con el manejo diurético y de líquidos correspondiente1,37,43,54,55.
Encefalopatía hepáticaLa encefalopatía hepática (EH) es una disfunción cerebral condicionada por insuficiencia hepática y/o shunt portosistémico. Se puede manifestar como encefalopatía hepática evidente (EHE) o como encefalopatía de cambios mínimos (EHm). La prevalencia de EH en niños cirróticos es entre el 30-40%. En la EHE el espectro clínico comprende anormalidades neuropsiquiátricas, desde alteraciones subclínicas hasta el coma, y debe excluirse cualquier enfermedad extrínseca. En EH grave lo más importante son los cuidados intensivos con vigilancia estrecha de los niveles de glucosa y el balance de líquidos y electrolitos1,56–61.
La EHm puede pasar inadvertida, ya que clínicamente las manifestaciones neuropsiquiátricas no son detectables, y solo se evidencian mediante pruebas neurológicas o electrofisiológicas anormales1,56,59,62, y se desconoce con exactitud la prevalencia de EHm en niños, aunque puede ser que se presente hasta en un 50% de los casos63.
16. La EH evidente se diagnostica mediante los criterios clínicos de West Haven adaptados para niños y la escala de coma de Glasgow para lactantes y adolescentes; para la EHm se utilizan pruebas psicométricas y neurofisiológicas, sin embargo no existe una prueba de detección estandarizada pediátrica.Nivel de acuerdo: totalmente de acuerdo 91.3%; parcialmente de acuerdo 8.70%.
En la EH se alteran las funciones como la atención, memoria de trabajo, velocidad psicomotora y la capacidad visoespacial, así como la capacidad electrofisiológica y cerebral funcional. Cuando progresa se presenta apatía, irritabilidad, desinhibición, alteraciones de la función motora, asterixis, alteración del estado de alerta, del ciclo sueño-vigilia, desorientación en el tiempo-espacio, así como un comportamiento inapropiado, estado de confusión agudo con agitación o somnolencia, estupor y finalmente coma60,64.
Los criterios de West Haven son el estándar de oro para la evaluación clínica de la EH (tabla 4)60. En los casos con sospecha de EHm hasta el momento no existe un estándar de oro y se han utilizado pruebas psicométricas y neurofisiológicas; la prueba de conexión numérica, la puntuación psicométrica de encefalopatía hepática, la frecuencia crítica de parpadeo, el tiempo de reacción continua, el test de control inhibitorio, la prueba de Stroop y la evaluación conductual de la función ejecutiva (BRIEF-2) han sido instrumentos para la detección en EHm en adultos, en población pediátrica no existen datos que permitan decidir cuál de estos métodos puede ser más apropiado, y hasta el momento con estas pruebas no se tiene suficiente evidencia en niños64–66.
Criterios de West Haven y descripción clínica
| Clínica | Descripción | Criterios | Comentarios | |
|---|---|---|---|---|
| Mínima | Asintomático | Alteraciones en pruebas psicométricas y neuropsicológicas que exploran la velocidad psicomotora, funciones ejecutoras o alteraciones neurofisiológicas. Sin evidencia clínica de cambios mentales | Resultados anormales de pruebas neurofisiológicas y psicométricas sin manifestaciones clínicas | No existen criterios universales para el diagnóstico y los estándares locales y la experiencia requerida son limitados |
| Grado I | Asintomático | Carencia de convivencia trivial. Euforia o ansiedad. Atención corta. Deterioro en la suma/resta. Alteración del ritmo del sueño | Desorientación en tiempo y espacio, deterioro conductual y cognitivo manifestado por el cuidador y corroborado por el médico | Los hallazgos clínicos usualmente no son consistentes |
| Grado II | Sintomático | Letargia o apatía. Desorientación en el tiempo. Cambio de personalidad. Comportamiento inapropiado. Dispraxia y asterixis | Desorientación en el tiempo (al menos 3 de las preguntas son erróneas: día del mes, de la semana, año, estación del año) ±los otros síntomas mencionados | Los hallazgos clínicos son variables, pero consistentes hasta cierto punto |
| Grado III | Sintomático | Somnolencia o estado semiestuporoso. Respuesta a estímulos. Confusión. Grado de desorientación. Comportamiento extraño | Desorientación también en el espacio. Al menos 3 de las preguntas son erróneas: lugar, ciudad, estado, país | Los hallazgos clínicos son consistentes hasta cierto punto |
| Grado IV | Sintomático | Coma | No responde al dolor | Estado comatoso |
Modificada de: Vilstrup et al.60.
Nivel de acuerdo: totalmente de acuerdo 95.65%; parcialmente en desacuerdo 4.35%.
18. Un nivel normal de amonio no excluye la presencia de EH.Nivel de acuerdo: totalmente de acuerdo 100%.
La determinación de niveles de amonio no son un indicador confiable para el diagnóstico, evaluación de la gravedad y resolución de la EH. Se ha demostrado que no en todos los casos los niveles de amonio corresponden al estado clínico del paciente, y pueden coexistir también otros factores tales como el sobrecrecimiento bacteriano, la elevada ingesta de proteínas, el shunt portosistémico, la deficiencia de cinc o la muestra inadecuada (torniquete prolongado, falta de transporte en hielo) entre otros que modifican los niveles de amonio60,67,68.
19. El electroencefalograma detecta cambios en la actividad cerebral cortical. Es un estudio que no depende de la edad, es inespecífico y no necesariamente determina el grado de encefalopatía.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 9.09%; incierto 4.55%.
El electroencefalograma no es específico por sí mismo para el diagnóstico de EH, pero puede detectar cambios en la actividad cerebral cortical inespecíficos, se puede realizar sin necesidad de la cooperación del paciente e independientemente de su edad. Entre los hallazgos se encuentran el enlentecimiento de la frecuencia de las ondas, la desincronización de la actividad dominante, la disminución de actividad en las bandas θ y/o δ y la aparición de ondas trifásicas60,64.
20. Para el diagnóstico diferencial de EH los estudios de imagen como la TAC y resonancia magnética (RM) se utilizan para descartar otras enfermedades; la RM con espectroscopia puede detectar metabolitos neurotóxicos y la gammagrafía tiene valor pronóstico en los casos de EHm.Nivel de acuerdo: totalmente de acuerdo 81.82%; parcialmente de acuerdo 18.18%.
Hasta la fecha no existe ningún método de imagen que pueda diagnosticar la EH o EHm, y se han utilizado como parte del protocolo de estudio la tomografía, la RM y gammagrafía, así como la espectroscopia para la obtención de imágenes con tensor de difusión del cerebro y los mapas de difusividad media y anisotropía fraccionada como posibles biomarcadores de EHm.
Las pruebas neuropsicológicas se ha reportado que tienen una correlación positiva significativa con la colina y el mioinositol cerebral evidenciadas por la RM; el aumento de osmolaridad intracelular causado por hiperamonemia produce una disminución de las resonancias de la colina y del mioinositol y un incremento de la glutamina-glutamato en el paciente cirrótico. Estas anomalías metabólicas se correlacionan con la severidad clínica y son reversibles tras el tratamiento.
La gammagrafía ha demostrado que tiene valor pronóstico positivo, ya que es capaz de medir la velocidad y posee precisión para realizar una tarea de memoria de creciente complejidad60,63,69,70.
21. Las medidas de prevención para la EH son optimizar el estado nutricional, identificar los factores precipitantes y en caso necesario establecer profilaxis farmacológica.Nivel de acuerdo: totalmente de acuerdo 86.96%; parcialmente de acuerdo 13.04%.
La presencia de EHE en pacientes cirróticos representa un estado de descompensación de la enfermedad habitualmente asociada a factores precipitantes que deberán tratarse; estos factores de acuerdo al tiempo en que estos se presentan son de tipo: a) episódico (última presentación de EH de más de 6 meses): infecciones, sangrado del tubo digestivo, sobredosis de diuréticos, desórdenes electrolíticos y estreñimiento; y b) recurrentes (última presentación de EH de menos de 6 meses): desórdenes electrolíticos, infecciosos, estreñimiento, sobredosis de diuréticos, sangrado de tubo digestivo y otros no identificables59,60,71.
22. El tratamiento farmacológico para la EH de primera línea es la administración de lactulosa (enema o vía oral) y antibiótico intraluminal en niños y adultos.Nivel de acuerdo: totalmente de acuerdo 100%.
La mayoría de los estudios se han realizado en pacientes adultos. En niños con cirrosis se reportó que en un 73% de los casos tratados con lactulosa presentaron recuperación completa de la EHE61,72.
23. Posterior a un episodio de EH recurrente, como profilaxis secundaria se recomienda la administración de lactulosa y/o antibióticos intraluminales (rifaximina).Nivel de acuerdo: totalmente de acuerdo 81.82%; parcialmente de acuerdo 13.64%; incierto 4.55%.
La EHE debe ser rutinariamente tratada, mientras que la EHm, al no ser obvia al examen físico, solo se tratará cuando existan circunstancias especiales que tengan significación en la vida cotidiana del paciente, como son la calidad de vida y/o las dificultades cognitivas60.
La recomendación para prevenir la recurrencia de la EHE es la profilaxis secundaria con azúcares no absorbibles; los que se han utilizado en niños son lactulosa, lactitol y polietilenglicol (PEG)56,61,62,73; a pesar de que no existen estudios aleatorizados controlados con placebo, la lactulosa se ha recomendado para mantener la remisión. Se ha reportado que la combinación de lactulosa y rifaximina mantiene la remisión en pacientes que han tenido uno o más eventos de EH. La terapia a largo plazo cíclica recomendada entre 3 a 6 meses disminuye los episodios de EH sintomática59,71.
Los antibióticos disminuyen la cantidad de bacterias productoras de amonio, por lo que se deben preferir los que tienen efectos luminales (neomicina, rifaximina), aunque también se pueden utilizar otros como el metronidazol y la vancomicina74–76.
Para el manejo de la EHm se ha empleado la L-ornitina L-aspartato (LOLA), que mejora la encefalopatía y ha demostrado que disminuye la mortalidad73,75,76.
Los probióticos también se han utilizado para prevenir y mejorar la EHm, y se ha reportado que no tienen impacto en la mortalidad. Existe poca evidencia al respecto y se necesitan más estudios controlados para su recomendación rutinaria62,73,75,76.
24. La combinacion de L-carnitina y cinc ha demostrado que mejora el grado de EH.Nivel de acuerdo: totalmente de acuerdo 80.95%; parcialmente de acuerdo 19.05%.
La L-carnitina ha demostrado tener un efecto protector en contra de la neurotoxicidad del amonio, mejora la energía de los pacientes y el grado de encefalopatía. El cinc mejora la neurotransmisión y ayuda a la conversión hepática de los aminoácidos a urea. Sin embargo, no se ha demostrado efecto en la encefalopatía si se utiliza solo62,73,76.
25. El trasplante hepático es una opción de tratamiento en los casos en que la EH no mejore con la terapia médica máxima o que tenga repercusión en la calidad de vida del paciente, independientemente de que su función hepática se mantenga estable.Nivel de acuerdo: totalmente de acuerdo 78.26%; parcialmente de acuerdo 17.39%; incierto 4.35%.
Todo paciente con cirrosis descompensada o daño hepático avanzado, y ante el primer episodio de EH, debe ser evaluado para TH; también deberán considerarse aquellos pacientes cuando hay deterioro en la calidad de vida y escolar; la realización oportuna de un TH puede mejorar el rendimiento escolar y las funciones neurocognitivas a largo plazo, sin embargo si se realiza tardíamente, sobre todo si el padecimiento empezó en los primeros años de vida, neurológicamente no tendrá el mismo impacto61,77,78.
Hipertensión portal y coagulopatíaLa hipertensión portal y la hemorragia variceal son la principal causa de morbimortalidad en pacientes pediátricos con cirrosis. La tasa de mortalidad por sangrado variceal va del 7.3% al 20%. La morbilidad asociada como bacteriemia, peritonitis y fallo renal agudo tienen un gran impacto en la mortalidad por hemorragia variceal78,79.
26. El uso de bloqueadores beta no selectivos para prevenir el primer evento de hemorragia variceal es una indicación sustentada en adultos, sin embargo en pediatría no existen ensayos clínicos que demuestran su eficacia; su empleo deberá considerar el riesgo frente al beneficio.Nivel de acuerdo: totalmente de acuerdo 100%.
El objetivo del tratamiento farmacológico en la hipertensión portal del paciente cirrótico es modificar el lecho vascular hepático y esplácnico. En adultos la profilaxis primaria (prevenir el primer sangrado variceal) es una terapia bien establecida, con sustento en ensayos clínicos que demuestran el beneficio de bloqueadores beta no selectivos a dosis que reduzcan la frecuencia cardiaca al 25% o la reducción de la presión venosa portal al 20% y el uso de ligadura variceal endoscópica, logrando disminuir el índice de sangrado. Sin embargo, en pediatría no hay ensayos clínicos controlados, de ahí que en su empleo se deberá considerar el riesgo contra el beneficio80–83.
27. Para prevenir el primer sangrado de la ligadura variceal puede considerarse en casos con alto riesgo de sangrado como múltiples varices esofágicas (VE) grado 2 o 3 con puntos cereza.Nivel de acuerdo: totalmente de acuerdo: 95.65%; parcialmente de acuerdo 4.35%.
Estudios observacionales han evaluado la ligadura endoscópica de varices para profilaxis primaria del primer sangrado en niños con cirrosis con buenos resultados, con seguimiento a corto plazo 16 meses, sin embargo la ligadura está limitada para niños>10kg84.
28. El tratamiento del episodio agudo de sangrado incluye reanimación, restitución de volumen sanguíneo, terapia vasoactiva (octreótido) y con el paciente estable terapia endoscópica.Nivel de acuerdo: totalmente de acuerdo 91.3%: parcialmente de acuerdo 8.7%.
El tratamiento del episodio agudo de sangrado incluye reanimación, restitución del volumen para lograr la estabilidad hemodinámica y transfusión de paquete globular conservadora. El objetivo de Hb es un nivel de 7 a 8g/dl, aun cuando debe individualizarse considerando la comorbilidad asociada. La administración de octreótido debe iniciarse antes de la endoscopia, con dosis de 2 a 5μg/kg/hora, administrado en infusión continua por 5 días78,84,85.
29. La profilaxis antimicrobiana dentro de las primeras 48horas del ingreso puede tener un impacto positivo por la disminución de bacteriemia y la tasa de reingreso a 30 días.Nivel de acuerdo: totalmente de acuerdo 78.26%; parcialmente de acuerdo 21.74%.
La profilaxis con antibióticos es una parte integral del tratamiento y debe considerarse desde la admisión del paciente, en casos con enfermedad avanzada Child-Pugh B y C, acorde con los factores de riesgo individuales; patrones de susceptibilidad antimicrobiana local en cada centro, cefalosporina de tercera generación (ceftriaxona 100mg/kg/día). El uso de antibióticos dentro de las 48horas posteriores al ingreso podría tener un impacto positivo en el porcentaje de niños libres de bacteriemia y la tasa de reingreso a 30 días86.
30. La profilaxis secundaria es el tratamiento después del primer episodio de sangrado y está indicado realizar escleroterapia y/o ligadura de VE.Nivel de acuerdo: totalmente de acuerdo 95.65%; parcialmente de acuerdo 4.35%.
En el paciente pediátrico se ha informado que tanto la escleroterapia como la ligadura de VE (LVE) erradican las varices entre el 91% y el 96% de los casos, respectivamente. Se han utilizado diversos agentes esclerosantes en niños, entre ellos etanolamina al 5%, tetradecil sulfato del 1% o al 1.5%, morruato de sodio al 5% y polidocanol del 1% al 1.5%. Se requieren un promedio de 4 sesiones para la erradicación de varices por ligadura, en comparación con 6 sesiones de escleroterapia (p≤0.0001). Puede existir un 25% de resangrado en el grupo de escleroterapia y un 4% en el grupo de ligadura (p=0.49). Después de la escleroterapia endoscópica o LVE el paciente debe ser monitorizado, vigilar la presencia de probables complicaciones agudas y administrar supresión de ácido con inhibidores de la bomba de protones o terapia local con sucralfato para promover la cicatrización de la úlcera87–89.
31. El tratamiento para sangrado por varices gástricas (VG) es ligadura para varices esofagogástricas (GOV1) y aplicación de cianoacrilato para varices GOV 2 y VG aisladas. Este último procedimiento es limitado en pediatría, sin embargo ha mostrado buenos resultados.Nivel de acuerdo: totalmente de acuerdo: 82.71%; parcialmente de acuerdo 17.39%.
En series de casos con pacientes pediátricos se ha reportado buena respuesta en el control del sangrado con el uso de cianoacrilato para la profilaxis secundaria de la hemorragia por VG. La obturación u obliteración variceal con pegamento tisular (como el N-butil-cianoacrilato o isobutil-2-cianoacrilato) se polimeriza inmediatamente al hacer contacto con la sangre, se inyecta estrictamente dentro de la variz y oblitera VG grandes90,91.
32. En los casos de resangrado grave posterior al tratamiento endoscópico, la aplicación de Hemospray® es útil como un procedimiento de rescate, ya sea para VE, VG o gastropatía portal hipertensiva.Nivel de acuerdo: totalmente de acuerdo 78.26%; parcialmente de acuerdo 8.70%; incierto 13.04%.
El uso de Hemospray® para la hemorragia digestiva alcanza tasas de hemostasia por encima del 90% con baja recurrencia. Aunque inicialmente se empleó para ulcera péptica existen publicaciones de su utilidad incluso en sangrado variceal, por lo que se puede emplear como terapia de rescate en casos en los que posterior a ligadura o escleroterapia el paciente curse con resangrado92,93.
33. En sangrado por gastropatía portal hipertensiva la coagulación con argón o láser reduce las necesidades transfusionales en el 85% de los casos de afección localizada, con menor respuesta en la enfermedad difusa.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 9.09%; incierto 4.55%.
La coagulación con argón plasma para el tratamiento de pacientes cirróticos con gastropatía hipertensiva portal, logra controlar el sangrado con una sesión en el 75.4% y proporciona una significativa mejoría en los niveles de hemoglobina, con disminución de la necesidad de transfusiones en el 85% (p<0.0001)94,95.
34. En comparación con el tratamiento farmacológico y endoscópico el taponamiento con sonda de balones es de menor eficacia, se debe reservar como medida de rescate y terapia puente antes de un procedimiento definitivo (quirúrgico).Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 9.09%; incierto 4.55%.
La inserción de la sonda de doble balón (esofágico y gástrico) tiene un papel en el tratamiento de la hemorragia variceal. Los pacientes hemodinámicamente inestables, con altos requerimientos transfusionales sin respuesta al tratamiento médico y endoscópico, son candidatos a colocación sonda doble balón. Cuando permanece por más de 4 días puede desarrollar necrosis por presión, neumonitis por aspiración, por lo que debe considerarse como una terapia de rescate temporal mientras se realiza un procedimiento definitivo como el TH o una derivación portal96,97.
35. La coagulopatía es una complicación en pacientes con cirrosis; la utilidad de corregir cifras de laboratorio con productos sanguíneos en pacientes que no tienen sangrado es cuestionable y puede exponerlos a mayor riesgo.Nivel de acuerdo: totalmente de acuerdo 82.61%; parcialmente de acuerdo 13.04%; incierto 4.35%.
Existen pocos datos sobre el riesgo de sangrado con procedimientos invasivos en el contexto de fallo hepático aguda, y tampoco hay guías clínicas con respecto a un objetivo de corrección del INR para evitar el sangrado. Actualmente el consenso general es que el INR debe ser corregido a≤1.5 para controlar el riesgo de sangrado antes de un procedimiento. El tratamiento intensivo de un INR anormal con grandes volúmenes de plasma fresco congelado (PFC) en este tipo de paciente puede ser perjudicial, ya que la sobrecarga de volumen incrementa el gradiente de presión venoso hepático con el subsecuente riesgo de sangrado variceal. En el caso de trombocitopenia en el paciente cirrótico que se someterá a ligadura variceal, la administración de una unidad plaquetaria produce un pequeño incremento en la cuenta plaquetaria sin ningún efecto significativo en la generación de trombina o en la tromboelastometría98–100.
36. El manejo de sangrado por coagulopatía incluye administración de PFC, vitamina K para corrección de un tiempo de protrombina (TP) prolongado, infusión de crioprecipitados para hipofibrinogenemia y concentrados plaquetarios cuando las cifras de plaquetas son < 50,000 si el paciente va a someterse a un procedimiento invasivo.Nivel de acuerdo: totalmente de acuerdo 90.91%; parcialmente de acuerdo 4.55%; incierto 4.55%.
Se recomienda una dosis de PFC en niños de 15ml/kg, con un rango de 10-20ml/kg, con un seguimiento de TP después de la infusión de PFC para asegurarse de alcanzar la corrección deseada de INR. En caso de coagulopatía adquirida en un paciente con sospecha de deficiencia de vitamina K debería recibir suplementación, pero si no hay respuesta se debe evitar la administración repetida a grandes dosis. La dosis pediátrica para deficiencia de vitamina K es de 30μg/kg vía intravenosa, subcutánea u oral. Existe un acuerdo general en las guías, tanto en niños como adultos, en cuanto a que el fibrinógeno debe ser reemplazado cuando la cifra es menor a 100g/dl. La dosis de crioprecipitado en pediatría es de 4-5ml/kg o 1 unidad (10-20ml) por cada 10kg de peso corporal. Se ha sugerido mantener una cifra plaquetaria mayor a 50,000/dl antes de un procedimiento invasivo con alto riesgo de sangrado o para el tratamiento de sangrado evidente101,102.
37. Si no se corrige el TP con PFC y existe riesgo de sobrecarga circulatoria se recomienda como alternativa el uso de concentrado de complejo de protrombina.Nivel de acuerdo: totalmente de acuerdo 90.91%, parcialmente de acuerdo 4.55%; incierto 4.55%.
El concentrado de complejo de protombina se ha utilizado en el contexto de enfermedad hepática para controlar el sangrado, y en preparación de cirugía electiva que conlleva un riesgo de sangrado. También se es útil cuando el riesgo de sobrecarga circulatoria limita el uso de PFC. La dosis es de 20 a 25 unidades/kg103.
38. La derivación portosistémica quirúrgica y el TH deben considerarse cuando el sangrado por varices persiste a pesar de la combinación farmacológica y terapia endoscópica. Si no son factibles está indicado un shunt intrahepático portosistémico transyugular paliativo.Nivel de acuerdo: totalmente de acuerdo 86.96%; parcialmente de acuerdo 13.04%.
Existen diferentes abordajes quirúrgicos para el tratamiento de la hemorragia variceal secundario a cirrosis hepática refractaria a tratamiento médico y endoscópico, desde la derivación quirúrgica como la mesorrenal, esplenorrenal, la mesentérico/vena porta izquierda (derivación meso-Rex), que dependiendo de la anatomía de la hipertensión portal de cada paciente (desarrollo de colaterales, presencia de trombosis venosa) y del estadio de la enfermedad hepática se podrán considerar, hasta el TH como tratamiento definitivo104,105.
Lesión renal aguda y síndrome hepatorrenalLesión renal agudaLa lesión renal aguda (LRA) es una complicación en pacientes con cirrosis hepática descompensada, con una incidencia hasta de un 20% de pacientes adultos hospitalizados; en niños es desconocida106,107.
La LRA se define como el incremento del creatinina sérica (CrS)≥0.3mg/dl (26.5μmol/l) a partir del nivel basal, en las primeras 48horas, o un incremento≥50% del valor de CrS basal ocurrido dentro de los 7 días previos al diagnóstico, según los criterios de Kidney Disease Improving Global Outcome adaptados y validados en pediatría108–110.
39. El tratamiento de LRA debe iniciarse tan pronto como se establece el diagnóstico e incluye suspensión de diuréticos, medicamentos nefrotóxicos, tratar procesos infecciosos y mantener un volumen intravascular adecuado.Nivel de acuerdo: totalmente de acuerdo 90.91%; parcialmente de acuerdo 9.09%.
El tratamiento de LRA en pacientes con cirrosis debe iniciarse cuando el diagnóstico se establece para prevenir la progresión. Es importante identificar y tratar los factores precipitantes como infecciones, medicamentos nefrotóxicos como antiinflamatorios no esteroideos y bloqueadores beta y hemorragia gastrointestinal para prevenir complicaciones renales posteriores107,109,111,112.
Se deben suspender los diuréticos, expandir el volumen sanguíneo intravascular a través de la administración de líquido intravenoso y/o albúmina a dosis de 1g/kg/día. La albúmina suele ser el expansor de volumen recomendado debido a sus efectos antiinflamatorios y antioxidantes. En pacientes con LRA y ascitis tensa la paracentesis terapéutica debe asociarse con la infusión de albúmina, incluso cuando se extrae un volumen bajo de líquido ascítico108,113.
Síndrome hepatorrenalEl síndrome hepatorrenal (SHR) es un fallo prerrenal debido a una reducción de la perfusión renal en pacientes con enfermedad hepática crónica grave, con cirrosis o insuficiencia hepática aguda. La incidencia en niños ha sido reportada en un 5%109,111.
El SHR se clasifica en SHR-LRA, antes SHR tipo 1, definido por un incremento de la CrS basal>0.3mg/dl dentro de las 48horas desde el inicio, o incremento de 50% del valor basal en los últimos 3 meses y SHR-no LRA (SHR-NLRA), antes SHR tipo 2 asociado a la existencia de disfunción renal aguda (menor a 90 días) o crónica (mayor de 90 días)106,109.
40. En un paciente cirrótico con LRA sin respuesta al tratamiento inicial se debe evaluar la presencia de criterios de SHR-LRA e iniciar tratamiento con un vasoconstrictor como la terlipresina o norepinefrina más albúmina.Nivel de acuerdo: totalmente de acuerdo 90.91%; parcialmente de acuerdo 9.09%.
Se debe considerar el diagnóstico de SHR-LRA si la función renal no mejora después de una expansión adecuada de volumen e iniciar tratamiento con albúmina a dosis de 1g/kg/día. Los vasoconstrictores sistémicos son la primera línea de tratamiento109,111,114. La terlipresina se recomienda como primera opción en el SHR-LRA en adultos y en niños se han publicado solo en reportes de casos. Las dosis utilizadas en niños varían desde 15 a 20μg /kg hasta 20μg/kg cada 4horas asociado con la infusión de albúmina hasta la mejora de la función renal. En casos de recurrencia de SHR-LRA al cesar el tratamiento se debe repetir la terapia. La noradrenalina es otro vasopresor utilizado en las unidades de terapia intensiva. Algunos estudios sugieren su uso asociada a albúmina en el tratamiento inicial del SHR-LRA. La dosis recomendada es de 0.5 a 1μg/kg/min109,113–115.
41. La terapia de reemplazo renal (TRR) puede estar indicada para pacientes con SHR-LRA que no responden al tratamiento farmacológico y con sobrecarga de volumen o uremia; su uso debe estar reservado como puente al TH.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 13.64%.
Las TRR extracorpóreas pueden ser útiles en el tratamiento del SHR. Existen pocos estudios que orientan a la identificación de los pacientes pediátricos con cirrosis que sean candidatos para TRR. Algunos de ellos reportan que hasta un 40% de los pacientes con LRA requieren tratamiento con TRR. Estos tratamientos están indicados en los pacientes con SHR-LRA que no responden al tratamiento con albúmina y vasopresores, y que además tengan signos de uremia, hipervolemia, acidosis metabólica severa o hipercalcemia110,116. La TRR no mejora la supervivencia en el SHR, sin embargo puede ser útil como un puente al TH cuando este está indicado. La modalidad de hemodiálisis continua es la técnica recomendada en los pacientes que no responden al tratamiento médico, principalmente cuando se encuentran en lista de espera de TH110,116,117.
42. El TH es el tratamiento de elección para el tratamiento de SHR.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 13.64%.
En los pacientes que no responden a ninguna modalidad de tratamiento médico el TH se convierte en la única opción de supervivencia108,117,118.
43. El trasplante de hígado-riñón debe considerarse en pacientes con enfermedad renal crónica significativa (SHR-ERC), o aguda persistente incluida la S-LRA sin respuesta al tratamiento farmacológico.Nivel de acuerdo: totalmente de acuerdo: 95.45%; parcialmente de acuerdo 4.55%.
Aunque muchos niños cirróticos con enfermedad renal recuperan la función renal después del TH, una alta proporción requieren apoyo con TRR después del trasplante, por lo que se ha considerado como una opción el trasplante simultáneo de hígado-riñón (THR)116,119. Múltiples estudios han sugerido guías para establecer los criterios de indicación de THR, pero hasta el momento no se han definido. Se consideran candidatos para THR aquellos pacientes con cirrosis y LRA sostenida, independientemente del tipo, cuando es refractaria a la terapia con TRR>4 semanas o tasa de filtrado glomerular (TFG) estimada≤35ml/min o TFG medida≤25ml/min≥4, así como aquellos pacientes con daño renal crónico preexistente116,119.
Síndrome hepatopulmonarEl síndrome hepatopulmonar (SHP) es un desorden pulmonar vascular caracterizado por la tríada clínica de: dilatación vascular intrapulmonar, hipoxemia (PaO2<80mmHg y diferencia alvéolo-arterial>15mmHg) en el contexto de una enfermedad hepática avanzada con o sin hipertensión portal. Suele ser más frecuente y severo en pacientes con cirrosis120–124.
Los pacientes pueden cursar asintomáticos en las etapas tempranas, y la disnea se ha descrito como el síntoma cardinal. Su inicio es generalmente insidioso y con exacerbación ante el ejercicio121,124, aunando a esto la presencia de platipnea y la ortodeoxia, que se reportan hasta en un cuarto de los pacientes122,123.
44. En el SHP la oximetría de pulso no se recomienda para tamizaje diagnóstico, ya que los valores normales no descartan SHP leve o moderado. En niños se utiliza por ser un método no invasivo y por su utilidad en las etapas graves, sin embargo no reemplaza la gasometría.Nivel de acuerdo: totalmente de acuerdo 95.45%; parcialmente de acuerdo 4.55%.
Los valores recomendados para el diagnóstico son: presión arterial parcial de oxígeno (PaO2) <80mmHg o el gradiente de oxígeno alveolar-arterial (PAaO2)>15mmHg125,126, ya que el uso de la gasometría arterial es problemático por su naturaleza invasiva se ha intentado suplirla con oximetría de pulso, la cual es bien aceptada en niños, con reportes de que saturaciones<97% que reflejan hipoxemia probada por gasometría arterial (PaO2<70mmHg) en adultos con cirrosis, con una sensibilidad hasta del 100% y especificidad del 65%125,127,128; sin embargo, de acuerdo a la clasificación de gravedad, la oximetría de pulso fallaría en identificar a todos los pacientes con SHP leve y algunos con SHP moderado, por lo que no se recomienda como prueba de cribado diagnóstico128,129.
45. La ecocardiografía contrastada mediante microburbujas es el mejor método para la comprobación de las dilataciones vasculares intrapulmonares y se considera el estándar de oro para el diagnóstico de síndrome hepatopulmonar.Nivel de acuerdo: totalmente de acuerdo 90.91%; parcialmente de acuerdo: 9.09%.
La ecocardiografía con contraste es el estándar de oro en el diagnóstico de shunts intrapulmonares, con una sensibilidad del 67-80% y especificidad del 93-100%. Resulta positiva si, tras la inyección de 10ml de suero salino agitado en una vena periférica, aparecen microburbujas en la aurícula derecha y al cabo de 3 a 6 ciclos cardiacos estas se ven en la aurícula izquierda; esto tomando en cuenta que el diámetro normal de los capilares pulmonares es<8μm y la solución salina agitada crea microburbujas>10μm en diámetro que, de forma normal, no atraviesan los capilares pulmonares120,123–125,130.
46. No existe una terapia médica eficaz y el TH es el único tratamiento que permite la reversión del SHP.Nivel de acuerdo: totalmente de acuerdo 100%.
Ningún tratamiento médico utilizado hasta la fecha ha logrado revertir esta condición en niños. Las medidas generales incluyen proveer alivio sintomático, mejoría de la calidad de vida y la capacidad de ejercitarse, así como facilitar el TH si se encuentra indicado, permite la reversión del SHP con tasas de éxito que oscilan entre el 70-84%127. El SHP está listado como una excepción de la puntuación MELD para priorizar dichos pacientes para TH131; sin embargo, la hipoxemia muy severa (PaO2<50mmHg) incrementa el riesgo de complicaciones y mortalidad post-TH132.
Hipertensión portopulmonarLa hipertensión portopulmonar (HPP) es una vasculopatía pulmonar rara y grave, definida por la presencia de hipertensión arterial pulmonar en el contexto de una hipertensión portal con o sin daño hepático de fondo y en ausencia de otras causas de hipertensión pulmonar132,133.
47. La ecocardiografía transtorácica se recomienda como cribado para HPP, el diagnóstico definitivo se realiza mediante cateterismo cardiaco.Nivel de acuerdo: totalmente de acuerdo 100%.
La presentación clínica es muy variable, predomina el estado asintomático, siendo la disnea el síntoma más frecuente134. El diagnóstico definitivo se realiza mediante cateterismo cardiaco, pero la ecocardiografía transtorácica, debido a su nula invasividad y a que permite medir de forma indirecta la presión de la arteria pulmonar se ha establecido como el estudio de cribado de elección135. Es por eso que tanto la guía de la Sociedad Europea para Enfermedades Respiratorias como la Sociedad Europea de Cardiología recomiendan la realización de la ecocardiografía transtorácica en todos los pacientes candidatos para TH y en los pacientes sintomáticos con cirrosis e hipertensión pulmonar133.
48. El tratamiento médico recomendado para la hipertensión portopulmonar es a base de vasodilatadores pulmonares con una meta de presión media de la arteria pulmonar (PAPm) por debajo de 35mmHg.Nivel de acuerdo: totalmente de acuerdo 100%.
En las últimas décadas ha habido un marcado avance en el manejo médico de la hipertensión arterial pulmonar y sus diferentes modalidades; actualmente se dispone de vasodilatadores bronquiales que se clasifican en 3 diferentes grupos: prostanoides, antagonistas del receptor de la endotelina e inhibidores de la fosfodiesterasa tipo 5136,137. En relación con estos medicamentos se recomienda en población adulta su inicio posterior a la confirmación de HPP, para lograr mantener y/o disminuir una presión de la arteria pulmonar por debajo de 35mmHg, monitorizando dicha presión de forma periódica, mínimo de manera trimestral o semestral, en lo que se realiza el TH138. En pediatría se han considerado dichas indicaciones, pero no hay ensayos clínicos suficientes para recomendarlas de forma efectiva.
49. El trasplante hepático puede resolver la hipertensión portopulmonar, sin embargo formas graves con una PAPm>45mmHg tienen una alta mortalidad perioperatoria y contraindican el trasplante hepático.Nivel de acuerdo: totalmente de acuerdo 100%.
El trasplante hepático pudiera ser la única opción disponible de tratamiento para disminuir definitivamente la presión pulmonar y las resistencias vasculares pulmonares139. Es por eso que algunos artículos lo consideran como la única opción de tratamiento efectiva139,140, siempre y cuando la PAPm esté por debajo de 35mmHg y evitar así un fallo cardiaco aguda del ventrículo derecho, precipitado por los cambios hemodinámicos postrasplante, lo que sucede cuando la PAPm sobrepasa dicho valor141.
Mientras que la HPP no es una indicación única para trasplante hepático en adultos142, en el 2014 las guías de práctica para trasplante hepático pediátrico recomendaron que todos los niños con evidencia de HPP se califiquen como portadores de enfermedad hepática terminal y sean considerados para TH prioritario, por lo que deberán de derivarse de inmediato a centros especializados143,144.
Colangitis y otras infeccionesSe define la colangitis aguda (CA) como aquella condición mórbida resultado de la inflamación e infección aguda de los conductos biliares. El principal factor predisponente es la obstrucción biliar de cualquier causa145.
50. La CA en niños ocurre principalmente en pacientes con antecedente de cirugía de la vía biliar, con síntomas que varían de acuerdo a la edad, como fiebre, vómito, dolor abdominal e ictericia, en ausencia de algún otro proceso infeccioso.Nivel de acuerdo: totalmente de acuerdo 95%; parcialmente de acuerdo 5%.
La CA en niños ocurre principalmente en pacientes con antecedente de cirugía de la vía biliar, como niños con AVB postoperados de portoenterostomía (cirugía de Kasai), defectos en la unión pancreatobiliar o después de la realización de un TH. Los pacientes post-Kasai desarrollan CA hasta en un 50% de los casos146. La presencia de fiebre, vómito, dolor abdominal frecuente en el hipocondrio derecho o epigastrio e ictericia son datos clínicos importantes que permiten orientar al diagnóstico de CA147.
51. La leucocitosis y elevación de proteína C reactiva, bilirrubina directa, GGT, fosfatasa alcalina y aminotransferasas orientan al diagnóstico de colangitis.Nivel de acuerdo: totalmente de acuerdo: 81.82%; parcialmente de acuerdo 18.18%.
En la CA los estudios bioquímicos muestran elevación de la cifra leucocitaria, proteína C reactiva, bilirrubina plasmática, GGT, fosfatasa alcalina y aminotransferasas. Con el fin de determinar la gravedad de la enfermedad otros estudios como cuenta plaquetaria, nitrógeno de urea, creatinina, tiempos de coagulación, albúmina y estudio de gases sanguíneos resultan fundamentales. La toma de hemocultivos permite orientar el tratamiento antimicrobiano148.
52. El ultrasonido abdominal permite documentar dilatación de las vías biliares y en ocasiones identificar su causa (litiasis biliar).Nivel de acuerdo: totalmente de acuerdo 95%; parcialmente de acuerdo 5%.
El ultrasonido abdominal permite detectar dilatación de la vía biliar en CA, así como en algunos casos identificar la causa, como en el caso de la litiasis biliar; la limitante es que este estudio es operador dependiente147. Otros estudios son la tomografía axial computarizada, la colangiopancreatografía por RM e incluso el ultrasonido endoscópico que se han utilizado para determinar obstrucción biliar, nivel de la obstrucción y su origen, y también para detectar complicaciones como abscesos hepáticos o trombosis portal149.
53. La colangitis es ocasionada predominantemente por bacterias gramnegativas y en menor porcentaje por grampositivas. El tratamiento empírico con piperacilina tazobactam, ceftriaxona más metronidazol y las cefalosporinas de tercera generación han mostrado resultados favorables.Nivel de acuerdo: totalmente de acuerdo 95%; parcialmente de acuerdo 5%.
Los pacientes con CA deben ser hospitalizados y requieren inicio temprano de soluciones intravenosas y antibióticos. El tratamiento empírico antimicrobiano incluirá la cobertura para microorganismos gramnegativos, grampositivos y anaerobios. Las bacterias más frecuentemente aisladas son Escherichia coli, Klebsiella spp., Enterococcus spp. y Enterobacter spp.145,150. Los esquemas antibióticos empleados incluyen piperacilina-tazobactam, ticarcilina-clavulanato, cefalosporinas de tercera generación, ceftriaxona con metronidazol, amoxicilina con clavulanato, ampicilina sulbactam, carbapenémicos o gentamicina con metronidazol. En caso de alergia a la penicilina la alternativa de tratamiento será con ciprofloxacino más metronidazol150,151. El antibiótico debe ajustarse conforme a los resultados de los hemocultivos, considerando que solo entre el 21% y el 71% de los casos hay desarrollo145.
54. Ante la sospecha de proceso infeccioso en el paciente con cirrosis debe considerarse la hospitalización.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 4.55%; incierto 9.09%.
Hasta un 35% de los pacientes con cirrosis hepática cursan una infección bacteriana en el momento de su hospitalización, y las infecciones son la causa de muerte más importante en pacientes con cirrosis hepática descompensada. Las infecciones más frecuentes después de la colangitis y la peritonitis bacteriana espontánea (PBE) son las infecciones del tracto urinario, neumonía, bacteriemia, infecciones en la piel y en los tejidos blandos145,152.
55. La fiebre y valores anormales en la cifra de leucocitos pueden estar ausentes hasta en el 30% de los pacientes con infección y cirrosis hepática; en estos casos se recomienda realizar marcadores confiables de infección como la procalcitonina y proteína C reactiva.Nivel de acuerdo: totalmente de acuerdo 81.82%; parcialmente de acuerdo 18.18%.
La fiebre puede estar ausente y la cuenta de leucocitos es difícil de interpretar debido a la presencia de hiperesplenismo y pancitopenia, por lo que niveles de procalcitonina >0.5ng/ml pueden orientar en el diagnóstico de infección bacteriana en niños con enfermedad hepática151. El inicio oportuno del tratamiento antibiótico empírico con fármacos de amplio espectro está recomendado hasta contar con el resultado de los cultivos que permitan un tratamiento dirigido, y es particularmente importante en pacientes con datos de choque séptico. Cuando el paciente no mejora con el esquema antimicrobiano utilizado se debe agregar antimicótico151,152.
56. En los pacientes con AVB poscirugía de Kasai no existe evidencia suficiente para el inicio de profilaxis antimicrobiana para colangitis. La profilaxis secundaria oral disminuye la recurrencia de colangitis, aunque aún la evidencia es limitada.Nivel de acuerdo: totalmente de acuerdo 80%; parcialmente de acuerdo 20%.
La CA se presenta en más del 50% de los niños postoperados de Kasai, a pesar del uso de antibióticos profilácticos. En los reportes para la profilaxis primaria y secundaria de la CA se han empleado diferentes antibióticos, tiempo y vía de administración, inclusive asociados a la administración de inmunoglobulina y esteroides; los resultados no han sido consistentes aun cuando se reporta disminución de la ocurrencia de colangitis. No existe suficiente evidencia y se requieren más estudios para su recomendación153–157.
Ascitis y peritonitisLa ascitis es la acumulación patológica de líquido en la cavidad peritoneal y la complicación más común de la cirrosis. La sobrevida de pacientes con cirrosis se reduce de forma significativa después de presentar ascitis158,159.
La ascitis se clasifica de acuerdo a su severidad y respuesta a los diuréticos. En el grado 1 (leve) los pacientes pueden permanecer asintomáticos y habitualmente se detecta mediante ultrasonido de seguimiento; pueden tratarse de forma ambulatoria. El grado 2 (moderada) se presenta distensión abdominal y pueden mostrar complicaciones relacionadas con alteraciones de electrolitos séricos o infecciones, su manejo es dinámico y en función de la evaluación clínica y del compartimento extracelular, la diuresis y electrolitos séricos. En el grado 3 (grave), ascitis a tensión, se recomienda hospitalización por alto riesgo de complicaciones graves y por requerir de intervenciones terapéuticas oportunas160,161.
57. Los criterios de hospitalización son ascitis a tensión con o sin restricción respiratoria, alteraciones hidroelectrolíticas, fallo al tratamiento diurético y sospecha de PBE.Nivel de acuerdo: Totalmente de acuerdo 86.36%; parcialmente acuerdo 13.64%.
También se recomienda hospitalización de pacientes con ascitis refractaria o intratable. La ascitis refractaria hace referencia a la ausencia de respuesta clínica después de 7 días de tratamiento adecuado con dieta baja en sodio (1-2mEq/kg/día) y dosis máximas de espironolactona y furosemida, o cuando la acumulación de líquido se vuelve a presentar después del primer mes de tratamiento. La ascitis intratable se define cuando los diuréticos están contraindicados por la presencia de efectos adversos como encefalopatía, hiponatremia (Na sérico<125 mEq/l, fallo renal, hipo e hipercalemia [K<3 o>6mEq/l])162.
58. Los datos de respuesta adecuada al tratamiento de la ascitis incluyen: disminución de peso a expensas de pérdida de líquido ascítico y resolución del edema; disminución del perímetro abdominal y aumento de la diuresis.Nivel de acuerdo: totalmente de acuerdo 77.27%; parcialmente de acuerdo 22.73%.
El objetivo del tratamiento es reducir aproximadamente del 0.5% al 1% del peso a expensas de líquido ascítico por día hasta su desaparición y prevenir la reacumulación del mismo. Una respuesta inadecuada indica que el balance negativo de sodio no fue alcanzado. Los datos clínicos que se deben vigilar en el seguimiento son peso, diuresis, signos vitales incluyendo la temperatura y la presencia de edema periférico y circunferencia abdominal. El examen físico debe ser realizado al tiempo del diagnóstico, durante la consulta y diariamente en los hospitalizados161.
59. En el manejo de la ascitis grado 1 o leve lo recomendado es una dieta baja en sodio (1-2mEq/kg/día).Nivel de acuerdo: totalmente de acuerdo 76.19%; parcialmente de acuerdo 23.81%.
Para el tratamiento de la ascitis leve se recomienda un consumo de sodio de 1-2mEq/kg/día. En los pacientes con alimentación con leche materna exclusivamente no es necesario la restricción de sodio. En los que están con alimentación complementaria, para la preparación de otros alimentos se recomienda no añadir sodio. Una dieta más restrictiva es innecesaria y poco tolerada160,163.
60. El manejo de la ascitis Grado 2 o moderada incluye restricción de sodio en la dieta, y diuréticos.Nivel de acuerdo: totalmente de acuerdo 81.82%; parcialmente de acuerdo 18.18%.
En ascitis grado 2 es insuficiente la monoterapia con la dieta, por lo que se añade el tratamiento diurético160. La espironolactona es efectiva por su efecto sobre el hiperaldosteronismo, y debido a su vida media prolongada los efectos terapéuticos pueden observarse después del tercer día; la dosis es de 2-4mg/kg/día, con incremento hasta 6mg/kg/día de acuerdo a la respuesta cada 3 a 5 días, y en caso de que no haya respuesta después de la dosis máxima de espironolactona se deberá añadir furosemida a 1mg/kg/día y aumentar a dosis máxima. La furosemida por ser un diurético de asa puede incrementar la excreción de sodio hasta un 30%, sin embargo, se debe usar con cautela, ya que reduce el volumen circulante efectivo. La dosis es 1-4 hasta 12mg/kg/día164–166.
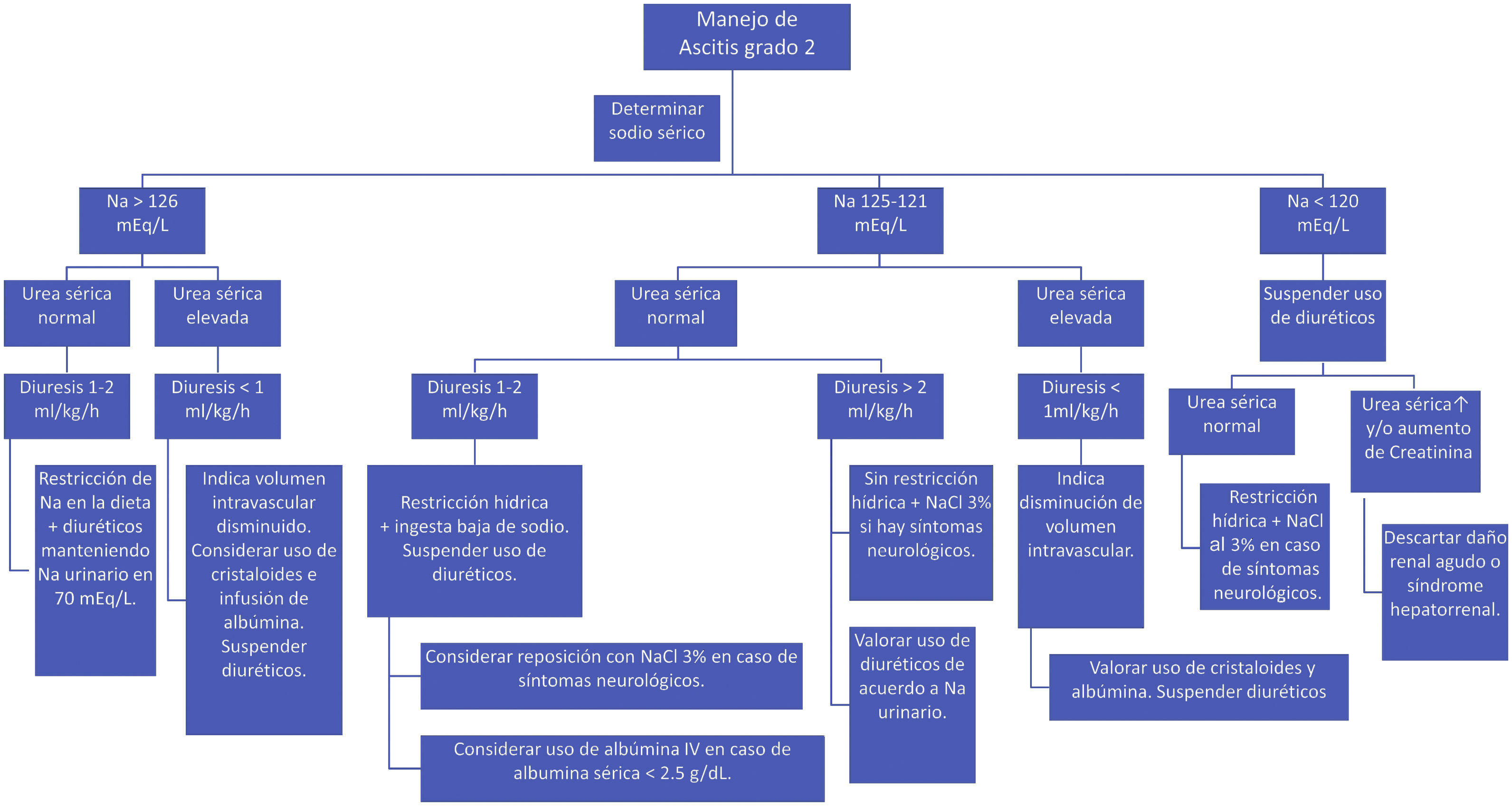
Durante el tratamiento con diuréticos se recomienda vigilar el estado de hidratación, química sanguínea, electrolitos séricos y urinarios. Una vez que la ascitis se resuelve los diuréticos deben ser reducidos a la mitad de la dosis y si es posible suspenderlos. Las recomendaciones para el tratamiento de la ascitis según los diferentes escenarios clínicos se muestran en la figura 1.
Algoritmo. Ascitis grado 2.
Fuente: Bes et al.160.
Nivel de acuerdo: totalmente de acuerdo 94.1%; parcialmente de acuerdo 5.9%.
La paracentesis es un procedimiento a través del cual se drena líquido del espacio peritoneal; en pacientes con ascitis a tensión las estrategias terapéuticas incluyen paracentesis de gran volumen (≥50ml/kg) y diuréticos a dosis altas, aunque en niños no hay estudios que comparen ambas intervenciones, la evidencia en adultos apoya la paracentesis como primera línea por ser más efectiva, segura y con menos efectos adversos167.
En adultos con cirrosis y ascitis de gran volumen se ha descrito el uso de la terapia con shunt intrahepático portosistémico transyugular, sin embargo, en niños no existe evidencia sobre su uso, por lo que no se recomienda168.
62. La infusión de albúmina para el manejo de la ascitis está indicada en casos con hipoalbuminemia<2.5g/dl junto con la administración de diuréticos.Nivel de acuerdo: totalmente de acuerdo 90%; parcialmente de acuerdo 10%.
La albúmina es el expansor de volumen ideal en ascitis de origen hepático por mejor índice de respuesta, mejoría en la calidad de vida y menor estancia hospitalaria y riesgo de readmisión. La administración de albúmina combinada con diuréticos es más efectiva que los diuréticos de forma individual. En pacientes con PBE la infusión única de albúmina 1g/kg al 20-25% y antibióticos sistémicos disminuye el compromiso renal y la mortalidad162,163.
La infusión de albúmina durante la paracentesis de gran volumen (≥50ml/kg) disminuye la disfunción circulatoria, la recurrencia de ascitis y el desarrollo de síndrome hepatorrenal o hiponatremia dilucional. La dosis recomendada es 0.5-1g/kg de peso e infundir la mitad en las primeras 2horas y el resto dentro de las 6 a 8horas siguientes. Posterior a la movilización del líquido ascítico se recomienda utilizar diuréticos con dosis mínima necesaria para prevenir reacumulación169,170.
En el SHR la albúmina intravenosa disminuye la morbimortalidad secundaria. En pacientes con hipoalbuminemia (<2.5g/dl) la intervención favorece la reabsorción extravascular de agua, mejorando el volumen circulatorio, el gasto cardiaco y la función renal. En casos de hiponatremia hipervolémica se evita el deterioro de la función renal cuando se combinan restricción hídrica con infusión de albúmina169,170.
63. El tratamiento empírico con cefalosporinas de tercera generación está indicado en casos de infección de líquido ascítico por primera vez, infección adquirida en la comunidad y sin uso de antimicrobianos en las últimas 4 semanas.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 13.64%.
La PBE se presenta en uno de cada 3 niños con cirrosis158,171. Las manifestaciones clínicas son poco sensibles y específicas, hasta un 50% de los infectados cursan asintomáticos. En pacientes sintomáticos las manifestaciones son fiebre, dolor abdominal, diarrea y descompensación hemodinámica y/o metabólica162,171,172.
Se recomienda realizar cultivo y citoquímico de líquido de ascitis en pacientes detectados por primera vez con ascitis y en aquellos con signos y síntomas de infección. El mejor rendimiento de los cultivos se obtiene si el líquido ascítico se inocula en frascos de cultivo en el sitio de realización de la paracentesis, con una alícuota≥10ml172.
64. En niños con sospecha de PBE se recomienda paracentesis diagnóstica para estudio citoquímico, cultivo para bacterias aerobias y anaerobias, hemocultivo y urocultivo.Nivel de acuerdo: totalmente de acuerdo 90.91%; parcialmente de acuerdo 9.09%.
El diagnóstico de PBE se establece con un líquido ascítico con≥250células polimorfonucleares (PMN)/mm3 y cultivo bacteriano positivo. Otras variantes de la infección son la ascitis neutrocítica (≥250células PMN/mm3) con cultivo negativo y sin presencia de otra causa de inflamación, como pancreatitis y/o hemorragia intraabdominal y la ascitis monobacteriana sin incremento de células PMN en el líquido de ascitis159,171,172.
65. El tratamiento antimicrobiano empírico debe administrarse ante la sospecha de infección (PBE) en casos de recurrencia, adquisición intrahospitalaria y uso de antibióticos durante el último mes.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 13.64%.
El uso de antimicrobiano empírico en la infección de líquido ascítico idealmente debe brindar espectro para estas bacterias prevalentes, como son la Escherichia coli, la Klebsiella pneumoniae y el Streptococcus pneumoniae y debe administrarse inmediatamente después de la sospecha de infección162,171,173–176. El antibiótico de primera elección son las cefalosporinas de tercera generación158,173. Antes de la elección del tratamiento empírico se sugiere identificar factores de riesgo para infecciones por patógenos resistentes, como son las infecciones asociadas a los servicios de salud, el uso previo de antimicrobianos y una estancia hospitalaria prolongada158,173. Las opciones terapéuticas en estos casos son cefepime, piperacilina/tazobactam, cefoperazona/tazobactam y meropenem. En quienes el aislamiento bacteriano cuente con pruebas de sensibilidad se sugiere prescribir el antibiótico al cual haya sensibilidad y tenga el menor espectro antimicrobiano, siendo las cefalosporinas de tercera generación el medicamento de elección158. Se sugiere administrar por lo menos 5 días de antibióticos intravenosos. Los parámetros para definir la mejoría son los signos y síntomas, los reactantes de fase aguda y el recuento de PMN en el líquido ascítico176.
66. No existe evidencia para profilaxis antimicrobiana para PBE en niños. En pacientes adultos se ha reportado que los eventos de infección disminuyen con la administración de trimetoprim-sulfametoxazol o rifaximina.Nivel de acuerdo: totalmente de acuerdo 86.36%; parcialmente de acuerdo 13.64%.
Diferentes autores han propuesto que después del primer evento de ascitis se prescriba profilaxis antimicrobiana por tiempo indefinido o hasta el trasplante hepático100, sin embargo, en niños es incierto el beneficio de la intervención. Un inconveniente en relación con el uso de antibióticos profilácticos son la colonización y/o infección por bacterias resistentes173,175,176.
ConclusiónEl objetivo principal del manejo de un niño con cirrosis hepática debe ser prevenir o controlar las complicaciones. Consideramos de importancia dar a conocer los avances en el conocimiento para la detección del niño con cirrosis para ofrecer un manejo oportuno de sus complicaciones, con el fin de frenar su progresión, y si el caso lo requiere dar la oportunidad para su referencia y evaluación para TH.
FinanciaciónNo se recibió financiamiento alguno en relación a este artículo.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.