El daño hepático inducido por medicamentos (DILI, por sus siglas en inglés), es un diagnóstico basado en la exclusión de potenciales hepatopatías, y que se consolida, estableciendo la causalidad entre una sustancia potencialmente hepatotóxica y la alteración del perfil bioquímico hepático. La incidencia de este fenómeno fluctúa en un amplio rango a nivel mundial, con muy poca documentación de los agentes causantes de DILI en Colombia.
Con el objetivo de documentar las sustancias causantes de DILI en pacientes con biopsia hepática y de relacionar los tipos de patrones histológicos con el perfil analítico de toxicidad (índice R), se realizó un análisis retrospectivo de los pacientes atendidos en la clínica Centro de Estudios en Salud (CES) entre enero de 2015 y junio de 2020.
ResultadosDe 254 pacientes adultos, con disponibilidad de biopsia hepática sin etiología tumoral, 20 pacientes fueron identificados como DILI (7.87%). Las 2 sustancias más frecuentemente encontradas fueron efavirenz en 3 pacientes HIV positivos, y en 2 pacientes Moringa oleifera (moringa). Se encontró asociación significativa entre los patrones colestásicos (p=0.037) y mixtos (p=0.031) en la comparación de las categorías histopatológicas y el índice R.
ConclusiónEn lo mejor de nuestro conocimiento, no hay reportes de casos de DILI secundarios a Moringa oleifera (moringa). El índice R podría ser una herramienta útil de relación con el patrón histopatológico, para el caso de los patrones mixto y colestásico.
Drug-induced liver injury (DILI) is a diagnosis based on the ruling out of potential liver diseases and consolidated by establishing causality through the temporal relation between a potentially hepatotoxic substance and altered liver biochemistry. Incidence fluctuates greatly worldwide, with very few reports of causal agents of DILI in Colombia.
A retrospective study on patients treated at the Centro de Estudios en Salud (CES), within the time frame of January 2015 and June 2020, was conducted to document the causal substances of DILI in patients with liver biopsy and to correlate the types of histologic patterns with the biochemical pattern of liver injury (R ratio).
ResultsOf the 254 adult patients with liver biopsy and no tumor etiology, 20 patients were identified as cases of DILI (7.87%). The two most frequently found causal substances were efavirenz, in three HIV-positive patients, and Moringa oleifera (moringa), in two patients. There was a statistically significant association between cholestatic patterns (P=.037) and mixed patterns (P=.031), in the comparison of the histopathologic categories and the R ratio.
ConclusionTo the best of our knowledge, there are no reports on DILI secondary to Moringa oleifera (moringa). The R ratio could be a useful tool, in relation to the histologic pattern of injury, in cases of mixed and cholestatic patterns.
El daño hepático inducido por medicamentos (DILI, por sus siglas en inglés), es un término genérico relacionado con la alteración del perfil bioquímico hepático (PBH), con relación de causa-efecto con medicamentos o sustancias químicas. DILI es la principal causa del retiro de medicamentos del mercado1 y combinando reacciones idiosincráticas y dosis dependiente tiene una incidencia anual estimada en un amplio rango, de entre 2.5-23 casos por 100,000 habitantes2,3. Aproximadamente el 50% de todos los casos de falla hepática aguda tiene como etiología medicamentos4 y el 40% de estos terminan en trasplante hepático5, lo cual representa una gran carga para cualquier sistema de salud.
El diagnóstico de DILI, se basa en la exclusión de otras potenciales causas, y en la capacidad clínica de establecer causalidad entre la sustancia potencialmente hepatotóxica y la alteración del PBH, empleando como guía el número R obtenido matemáticamente a partir de los resultados de la bioquímica hepática del paciente6. Dado que no existe un estándar de oro para el diagnóstico de esta enfermedad, frecuentemente es difícil o imposible cumplir con los requisitos anteriormente mencionados y hacer un diagnóstico certero7. La biopsia hepática puede sumarse a los argumentos para el diagnóstico, excluyendo por histopatología otras posibles causas de alteraciones del PBE y documentando la presencia de hallazgos sugestivos de DILI, agrupados en 3 patrones: necroinflamatorio, colestásico y mixto8. No se ha investigado hasta la fecha una posible relación estadística entre las categorías posibles del número R y los patrones histopatológicos sugestivos de DILI.
Poco se conoce sobre los agentes causantes de DILI en nuestro medio debido a la limitada cantidad de estudios sobre el tema. La frecuencia y tipos de agentes causales de DILI varía de acuerdo a una gran cantidad de factores, entre ellos la localización geográfica, el tipo de población, la epidemiología local y el nivel hospitalario donde se describen los casos, por lo que los hallazgos documentados en otras cohortes sobre el tema pudieran no ser aplicables a la población local9–11. Con el objeto de describir una posible relación entre el número R y los hallazgos histopatológicos de la biopsia hepática y obtener información sobre agentes causantes de DILI en el medio local y las sustancias causantes, el presente estudio analizó una serie retrospectiva de casos de pacientes atendidos en una institución hospitalaria de tercer nivel de la ciudad de Medellín.
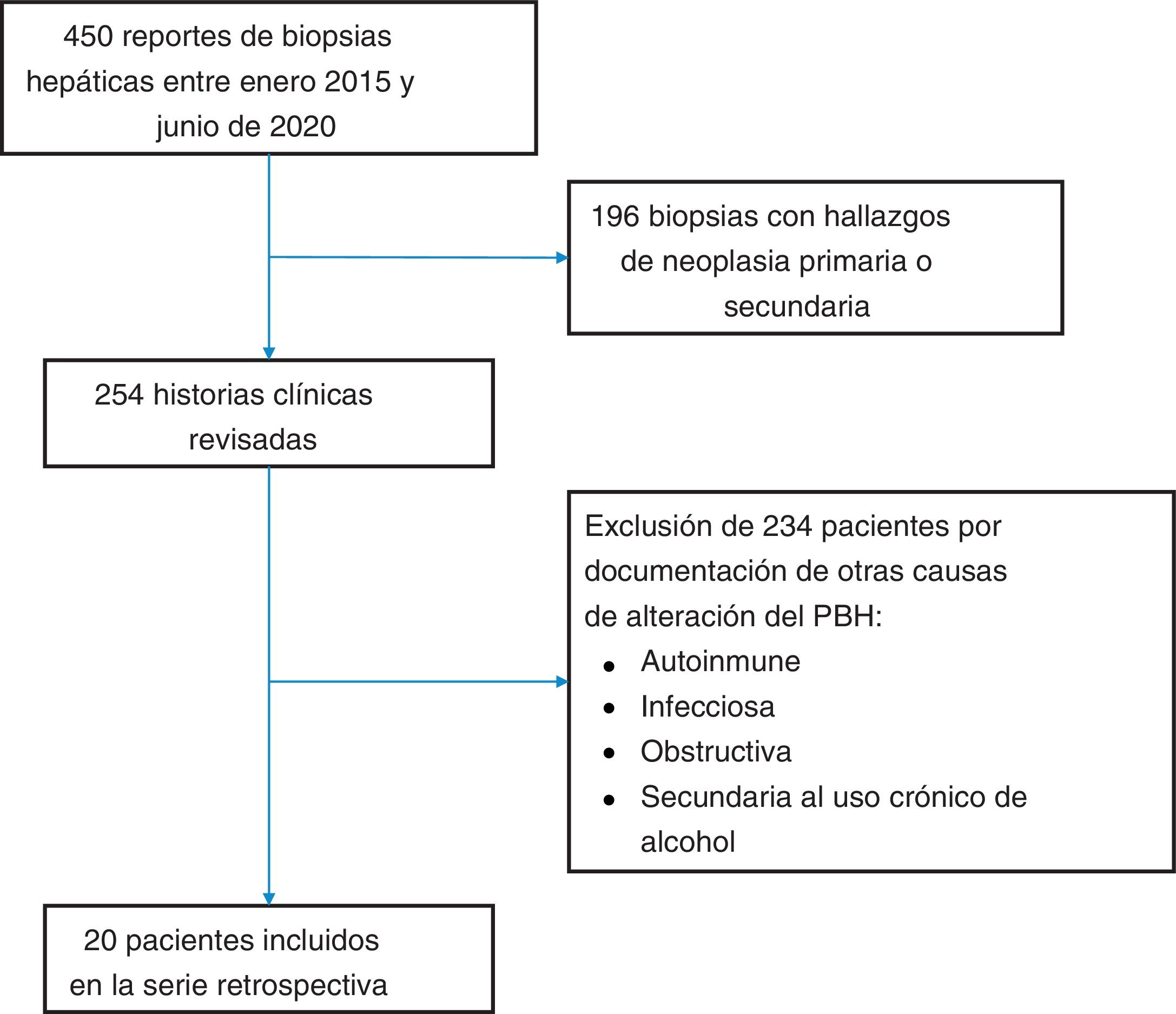
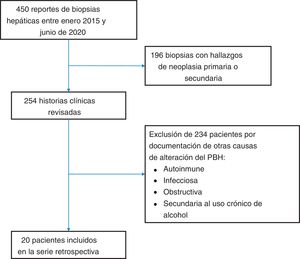
Material y métodosMaterial y métodosLuego de la aprobación del estudio por parte del comité de ética de la clínica Centro para Estudios en Salud (CES), se solicitó al laboratorio de patología de la institución el listado de muestras de tejido hepático de pacientes adultos y mujeres no embarazadas, analizadas entre enero de 2015 y junio de 2020, obteniendo en total 450 reportes correspondientes a igual número de pacientes (fig. 1). Posteriormente se excluyeron procedimientos motivados por neoplasias hepáticas primarias o secundarias, quedando 254 historias clínicas. Se realizó un análisis retrospectivo de estas 254 historias clínicas, utilizando como método para evaluación de la causalidad los criterios de inclusión y exclusión presentados en la tabla 1, seleccionando aquellas donde se indicó biopsia hepática por alteración del PBH no asociada a una enfermedad hepática previamente conocida del paciente, y en las que se excluyó con certeza aceptable durante el periodo de hospitalización enfermedades hepáticas metabólicas, autoinmunes, infecciosas, secundarias al consumo crónico de alcohol y obstructivas. Se consideró el diagnóstico de DILI, como diagnóstico de exclusión luego de descartar los diferenciales anteriormente mencionados, con documentación de hallazgos histológicos compatibles. Luego de aplicar los criterios anteriormente señalados, se seleccionaron 20 pacientes, de los cuales se hizo revisión detallada de la historia clínica, tabulación de los datos de laboratorio y se revisaron las láminas histológicas de sus biopsias hepáticas, caracterizando los hallazgos histopatológicos de acuerdo con la clasificación propuesta por Kleiner et al.12,13, en patrón necroinflamatorio, patrón colestásico o patrón mixto. En el estudio no se incluyeron pacientes con diagnóstico de hepatotoxicidad sin biopsia hepática. No se aplicó el método de evaluación de causalidad de hepatotoxicidad de Roussel-Uclaf14 ni otros métodos propuestos15, debido a que estos métodos tienen muchas limitaciones para estudios de enfoque retrospectivo como el nuestro16.
Criterios de inclusión y exclusión
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| Pacientes adultos con biopsia hepática institucional | Mujeres embarazadas y pacientes menores de 18 años |
| ALT mayor de 2 veces el límite superior de referencia | Diagnóstico previo de enfermedad hepática |
| y/o | Cirugía previa sobre la vía biliar, excepto colecistectomía |
| FA mayor de 2 veces el límite superior de referencia | Estudios imagenológicos de la vía biliar intra y extrahepática considerados como anormales |
| y/o | Diagnóstico durante la hospitalización de enfermedad hepática: |
| BT sobre el límite superior del valor normal de referencia | • Autoinmune |
| • Infecciosa | |
| • Obstructiva | |
| • Secundaria al uso crónico de alcohol | |
| • Neoplásica |
ALT: alanino aminotransferasa; BT: bilirrubina total; FA: fosfatasa alcalina.
El análisis estadístico, tablas y gráficas se realizaron con ayuda del software R versión 4.0.3 (2020-10-10). Se utilizó la prueba de Shapiro-Wilk para contrastar la distribución normal de los datos (ALT: alanino aminotransferasa; BD: bilirrubina directa; BT: bilirrubina total; FA: fosfatasa alcalina), y dependiendo de estos resultados se realizaron análisis de varianza entre los grupo o prueba de Kruskal-Wallis. La evaluación de la relación entre los patrones histológicos y el perfil analítico del tipo de toxicidad (índice R) se hizo mediante la prueba de Fisher. Se consideró el valor de p<0.05 como significativo.
Consideraciones éticasLa presente investigación cumple con las normas locales y mundiales para investigación en humanos y fue avalada por el comité de ética de la Clínica CES. Los autores declaran que este artículo no tiene información personal que permita identificar a ninguno de los pacientes, conservando el anonimato. Durante el estudio no se realizaron experimentos en humanos ni en animales y no requirió de solicitud de consentimiento informado para obtención ni publicación de los datos. No se recibió patrocinio financiero por parte de ninguna institución.
ResultadosDe los 20 casos identificado como DILI, 13 eran mujeres (65%) y 7 varones (35%), con edades entre los 17 y 74 años (media de 37.5 años). De los pacientes con diagnóstico final de DILI, el 50% (10 pacientes) no tenían este diagnóstico diferencial entre los posibles causantes de la alteración del PBH. El método más común para obtener la biopsia hepática fue percutáneo guiado por ecografía o tomografía en 14 casos (70%) y quirúrgico en 6 casos (30%). La tabla 2 muestra los patrones histopatológicos generales y específicos de cada uno de los casos junto con el índice R del caso al momento del ingreso a la institución, la sustancia identificada como causante y otras variables clínicas. En 7 de los 20 pacientes (35%) no se registró claramente en la historia clínica un único agente causal de DILI.
Características clínicas e histopatológicas de los pacientes identificados con DILI
| Edad | Sexo | Patrón general | Patrón específico | Sustancia | ALT | FA | R | Perfil analítico del tipo de toxicidad | BT | BD |
|---|---|---|---|---|---|---|---|---|---|---|
| 74 | F | Necroinflamatorio | Hepatitis aguda | NA | 1025 | 446 | 7.24 | Hepatocelular | 13.64 | 11.38 |
| 50 | M | Necroinflamatorio | Necrosis coagulativa | NA | 582 | 157 | 11.68 | Hepatocelular | 1.83 | 1.4 |
| 34 | F | Necroinflamatorio | Hepatitis crónica | NA | 90 | 240 | 1.18 | Colestásico | 3.49 | 3.27 |
| 23 | F | Necroinflamatorio | Hepatitis crónica | Efavirenz | 497 | 144 | 10.88 | Hepatocelular | 9.66 | 8.57 |
| 56 | F | Necroinflamatorio | Hepatitis crónica | NA | 1830 | 184 | 31.34 | Hepatocelular | 0.97 | 0.65 |
| 30 | F | Necroinflamatorio | Hepatitis crónica | Fluconazol | 216 | 2153 | 0.32 | Colestásico | 0.28 | 0.21 |
| 30 | F | Necroinflamatorio | Hepatitis crónica | Efavirenz | 586 | 91 | 20.29 | Hepatocelular | 2.16 | 1.51 |
| 65 | F | Necroinflamatorio | Hepatitis crónica | NA | 1304 | 393 | 10.46 | Hepatocelular | 16.36 | 14.73 |
| 37 | F | Necroinflamatorio | Hepatitis crónica | Ganoderma | 1015 | 142 | 22.53 | Hepatocelular | 7.01 | 6.43 |
| 52 | F | Necroinflamatorio | Esteatohepatitis | Metilprednisolona | 242 | 129 | 5.91 | Hepatocelular | 1.68 | 1.01 |
| 17 | F | Mixto | Mixto | NA | 303 | 153 | 6.24 | Hepatocelular | 2.37 | 2.27 |
| 51 | F | Mixto | Mixto | Amoxicilina/clavulanato | 496 | 348 | 4.49 | Mixto | 3.83 | 3.62 |
| 37 | M | Mixto | Mixto | Moringa | 710 | 152 | 14.72 | Hepatocelular | 1.39 | 1.17 |
| 32 | M | Mixto | Mixto | Efavirenz | 847 | 887 | 3.01 | Mixto | 5.89 | 5.37 |
| 35 | M | Colestásico | Colestasis blanda | Esteroides anabólicos | 71.8 | 238 | 0.95 | Colestásico | 24.14 | 20.9 |
| 38 | M | Colestásico | Colestasis blanda | LIV 52+proteína | 43 | 190 | 0.71 | Colestásico | 5.48 | 4.52 |
| 52 | M | Colestásico | Colestasis blanda | Moringa | 438 | 1034 | 1.33 | Colestásico | 0.31 | 0.2 |
| 38 | F | Colestásico | Colestasis blanda | Azatioprina | 15.7 | 51 | 0.97 | Colestásico | 8.3 | 7.73 |
| 35 | M | Colestásico | Colestasis blanda | NA | 538 | 165 | 10.28 | Hepatocelular | 6.7 | 6 |
| 49 | F | Colestásico | Colestasis blanda | Multivitamínicos | 574 | 214 | 8.45 | Hepatocelular | 0.57 | 0.27 |
ALT: alanino aminotransferasa; BD: bilirrubina directa; BT: bilirrubina total; F: femenino; FA: fosfatasa alcalina; M: masculino; NA: no aclarada; R: índice R.
En la mayor parte de los casos (65%) no hubo claridad sobre el tiempo de exposición a las sustancias identificada como potenciales hepatotóxicos. La media de este dato en las historias en que sí se especificó fue de 3 meses. Cinco de los pacientes (25%) tenían diagnóstico previo de VIH al momento del ingreso hospitalario, descartándose infecciones hepáticas por oportunistas. La media de tiempo de estancia hospitalaria de los casos fue de 12.5 días, rango de 1 a 96. En 2 pacientes la presentación clínica fue de falla hepática aguda (10%), uno de los pacientes fue remitido a otra institución con propuesta de trasplante hepático por elevación progresiva del índice internacional normalizado (INR, por sus siglas en inglés) y el otro paciente falleció a causa de complicaciones derivadas de falla hepática. Los restantes (18 pacientes, 90%) tuvieron una evolución clínica con tendencia a la mejoría y se les dio alta con orden de seguimiento ambulatorio.
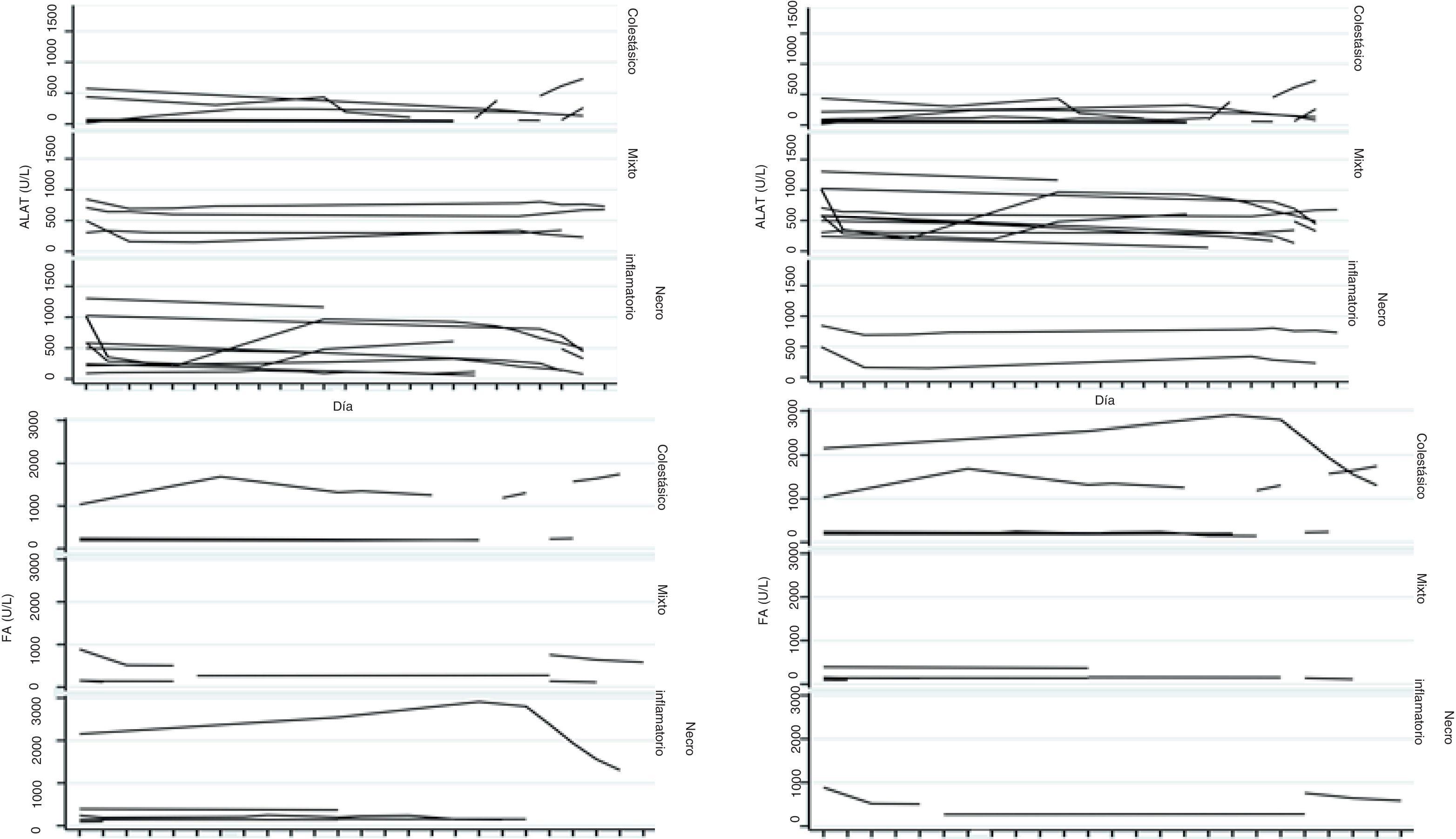
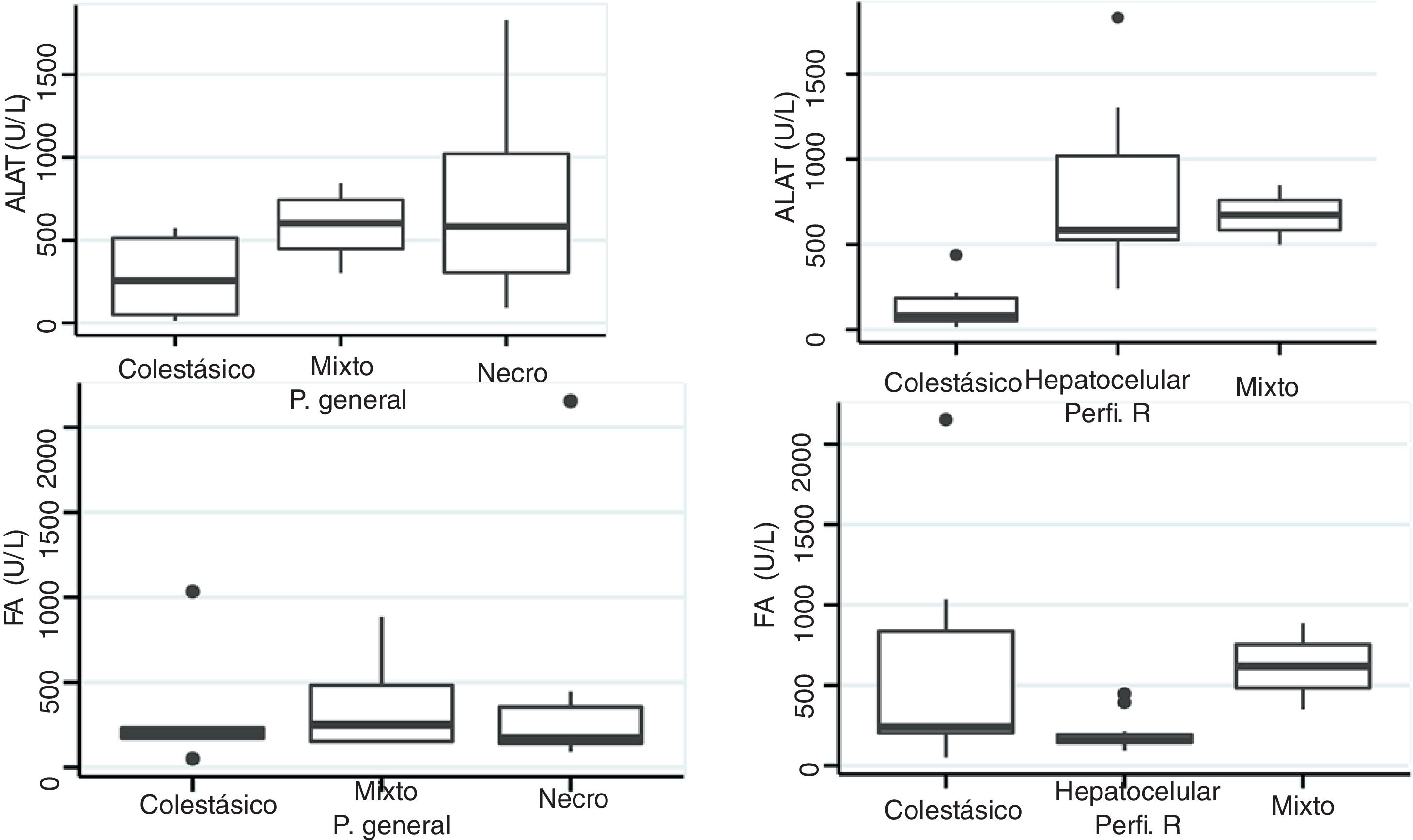
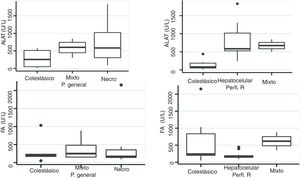
Perfil bioquímico hepáticoLa periodicidad de los controles del PBH no fue constante durante la estancia intrahospitalaria de los pacientes. La media de los valores iniciales de aspartato aminotransferasa (AST) y ALT fue 538 y 571UI/l, respectivamente, con rangos entre 2 y 40 veces el límite superior del laboratorio. En cuanto a BT, 13 pacientes (76%) tenían elevación por encima del rango del laboratorio, los demás pacientes nunca presentaron alteración de este valor. Solo 4 pacientes (25%) tenían elevación del INR por encima del rango que define falla hepática aguda (>1.5). El mayor valor de INR registrado en toda la serie de casos fue de 2.8, correspondiente al paciente fallecido. Los análisis de varianza y Kruskal-Wallis realizados comparando ALT, FA, BT y BD contra patrones histológico no fueron significativos. El índice R fue calculado para cada caso17 como un perfil analítico del tipo de toxicidad, teniendo como límite superior para ALT 33UI/l y para FA 104UI/l, utilizando los primeros resultados de laboratorio obtenidos de cada paciente. De acuerdo con el valor del índice R, 12 de los pacientes tenían un patrón hepatocelular de alteración del PBH (R>5), 2 pacientes un patrón mixto (R 2-5) y 6 pacientes un patrón colestásico (R<2). El valor del índice R del paciente fallecido fue de 7.42. El margen de alteración de los parámetros del PBH fue bastante amplio y poco predictivo del curso clínico del paciente, al igual que la tendencia de normalización de estos (fig. 2). En tan solo un caso hubo una relación entre un laboratorio y el desenlace, específicamente la elevación progresiva del INR ocurrida en el caso del paciente fallecido. Los análisis de varianza y Kruskal-Wallis realizados comparando ALT, FA, BT y BD contra los perfiles analíticos del tipo de toxicidad, índice R, no fueron significativos (fig. 3).
Los hallazgos histopatológicos fueron clasificados como patrones generales y específicos de acuerdo con lo propuesto por Kleiner et al.12,13. En 10 de los pacientes (50%) los hallazgos histopatológicos se clasificaron como patrón general de tipo necroinflamatorio, 6 pacientes (30%) con patrón colestásico y 4 (20%) con patrón mixto. Entre los pacientes con patrón general necroinflamatorio, el patrón secundario de hepatitis crónica fue el más frecuente (70%) y entre los pacientes con patrón general colestásico el patrón de colestasis blanda fue el único identificado (100%). Además, el 80% de los pacientes con patrón general necroinflamatorio eran mujeres y el 66% de los pacientes con patrón colestásico eran varones. No se observaron depósitos de tejido conectivo de importancia patológica en la coloración de tricrómico. En cuanto a la concordancia de la clasificación histopatológica y el perfil analítico del tipo de toxicidad basados en el índice R, en los pacientes con patrón general necroinflamatorio la concordancia fue del 80%, en los pacientes con patrón mixto fue del 50% y en los pacientes con patrón colestásico fue del 66%. El resultado de la prueba de Fisher al comparar el patrón histológico vs. el patrón en el perfil analítico de toxicidad (tabla 3), arroja un valor de p no significativo, comparando el patrón necroinflamatorio vs. patrón hepatocelular (p=0.17). En cambio, el análisis comparando los 2 patrones colestásicos (p=0.037) y los patrones considerados como mixto fue significativo (p=0.031). Los análisis de varianza y Kruskal-Wallis realizados comparando ALT, FA, BT y BD contra los tipos de patrones histopatológicos no fueron significativos (fig. 2).
Comparación entre patrón histopatológico y perfil analítico de toxicidad
| Perfil analítico del tipo de toxicidad | |||
|---|---|---|---|
| Patrón histopatológico | Hepatocelular | No hepatocelular | |
| R>5 | R<5 | Valor de p | |
| Necroinflamatorio Sí | 8 | 2 | 0.16 |
| Necroinflamatorio No | 4 | 6 | |
| Mixto | No mixto | ||
|---|---|---|---|
| 2<R<5 | R≠ | Valor de p* | |
| Mixto Sí | 2 | 2 | 0.031 |
| Mixto No | 0 | 16 |
| Colestásico | No colestásico | ||
|---|---|---|---|
| R<2 | R>2 | Valor de p* | |
| Colestásico Sí | 4 | 2 | 0.037 |
| Colestásico No | 2 | 12 |
R: índice R.
Prueba de Fisher.
El DILI es una condición clínica de incidencia desconocida en nuestro medio, cuyo perfil de sustancias inductoras debe ser caracterizado para cada población. En nuestro estudio, de 254 historias clínicas no tumorales revisadas, 20 tenían hallazgos clínicos e histopatológicos de DILI equivalentes al 7.87% de los pacientes con biopsia hepática por lesiones no tumorales. Teniendo en cuenta que solo alrededor del 50% de los casos de DILI son biopsiados18, DILI es realmente un problema subvalorado del cual se necesitan registros nacionales, similares a otras iniciativas para Latinoamérica19, que nos permitan identificar tanto medicamentos de mayor riesgo de DILI para nuestra población, como sustancias aparentemente inocuas que son vendidas como productos naturales sin regulación, pero con potencial hepatotóxico. En 7 pacientes con hallazgos histopatológicos dentro del amplio espectro DILI y diagnóstico clínico del mismo, ante ausencia de otra explicación de la alteración del PBH, no se encontró un agente único causal, con incertidumbre de si esto ocurrió por no haberse indagado al respecto, por falta de información por parte del paciente o por el uso simultáneo de múltiples medicamentos.
Dentro de las sustancias identificadas como causantes de DILI (tabla 2), efavirenz y moringa fueron las 2 sustancias más frecuentemente encontradas. Efavirenz en pacientes VIH positivo, con patrón necroinflamatorio y mixto, y moringa en pacientes masculinos con patrones histopatológicos variables, colestásico y mixto. Los tres pacientes analizados con hepatotoxicidad por efavirenz, son 2 pacientes femeninos y uno masculino, con presentación clínica leve, a diferencia de los escasos reportes descritos que suelen ser de mayor severidad20,21. No tenemos una explicación del porqué la presentación leve para el caso de nuestros pacientes. Moringa oleifera (moringa) es una planta de la familia Moringaceae, endémica en climas tropicales y subtropicales, reconocida por su uso en la medicina tradicional y por su valor nutricional22. Semillas, hojas, flores y raíces son vendidas en forma de aceite, polvos y preparados para infusión, sin restricción en la mayoría de los países donde se produce y comercializa23,24. No solo moringa es reconocida por su supuesto impacto positivo en la salud de animales y humanos, sino que además se han reconocido efectos antioxidantes y protectores de fibrosis hepática en modelos animales25,26. En lo mejor de nuestro conocimiento, no se han publicado casos de DILI secundarios a moringa en humanos, no se encontraron registros en la página de LiverTox® actualizada el 1 de octubre de 202027, ni existen reportes locales. La asociación entre moringa y la alteración de PBH en los 2 pacientes del estudio es clara, debido a que estos no consumían regularmente ningún otro medicamento, la exclusión de otras enfermedades y la mejoría del PBH ante la suspensión del consumo de los derivados de la planta.
El perfil de las sustancias encontradas como más frecuentes en nuestro análisis difiere de las encontradas en otros estudios internacionales28,29. Esto puede ser debido a la inclusión en nuestro estudio de sólo pacientes con biopsia hepática, lo que denota la dificultad diagnóstica de DILI en nuestra serie de casos y el perfil epidemiológico específico de nuestro país. Adicionalmente, muchos de los pacientes con DILI por medicamentos más comunes como antibióticos, son identificados y manejados por el médico tratante de manera rutinaria, sin registro formal del evento ni indicación de biopsia hepática. Por esto, el subgrupo de pacientes con DILI e indicación de biopsia hepática se podría constituir en una población especial de difícil diagnóstico dentro del universo de pacientes con DILI, además con un perfil epidemiológico distintivo.
La biopsia hepática es una herramienta diagnóstica de suma importancia en el contexto de pacientes con hepatopatía, siendo capaz de proveer información útil en cuanto a diagnósticos diferenciales y severidad del daño hepático. A pesar de esto, solo está indicada en el contexto de DILI si no se logran excluir las demás posibilidades diagnósticas por otros métodos30. Los patrones histológicos encontrados en DILI, recrean prácticamente todos los patrones histológicos no neoplásico de la enfermedad hepática, por lo cual el análisis de la biopsia hepática resulta muchas veces frustrante para el clínico, que usualmente espera un diagnóstico concreto de DILI por parte del patólogo. La clasificación en patrones generales y específicos es lo usual desde el punto de vista histopatológico, así como el reporte de estos en el renglón diagnóstico, graduando de manera semicuantitativa o descriptiva la severidad del daño especialmente en el patrón necroinflamatorio y comentando acerca de la posibilidad de DILI cuando existen datos clínicos contextuales. En nuestro estudio el patrón general necroinflamatorio representó la mitad de los patrones observados, seguido del patrón colestásico y luego el patrón mixto. Los resultados de un estudio de DILI y patrones histológicos en población norteamericana, el cual analizó prospectivamente 249 pacientes, y en el cual el patrón histopatológico más frecuente es el patrón mixto, contrasta con nuestros resultados en los cuales el patrón necroinflamatorio es el más fecuentes13. Este mismo estudio, coincide con nuestros resultados en cuanto que el perfil analítico (índice R) más frecuentes es el hepatocelular, pero se contrapone a la frecuencia del tipo de patrón histológico. Costa-Moreira et al., realizan un análisis retrospectivo de 10 años en pacientes con DILI y biopsia hepática en población portuguesa, identificando 53 pacientes, encontrado hallazgos similares a los de nuestro estudio en cuanto a la preponderancia del patrón histológico necroinflamatorio, pero sin asociación estadísticamente significativa en cuanto al patrón histológico y el índice R31. En nuestro análisis, el perfil analítico de toxicidad registrado como índice R se asoció de manera estadísticamente significativa al patrón colestásico y mixto, indicando esto, que en nuestra serie de casos la presencia de los mencionados patrones histológicos tiene interdependencia en su presentación. Esa interdependencia significa que los patrones histopatológicos colestásico y mixto tienen una fuerte y significativa asociación con similares patrones de acuerdo con el índice R. Lo anterior debe ser validado en otros estudios, pero podria servir como herramienta para patólogos en el caso de sospecha de DILI, relacionando las características histológicas esperadas de acuerdo con el índice R calculado, como mecanismo de apoyo diagnóstico.
Entendemos que la muestra de nuestro estudio es pequeña y por esto son necesarios más estudios de DILI en nuestro medio, que nos permitan visualizar mejor este problema. Estos estudios, nos deben permitir identificar las sustancias más comúnmente involucradas como agentes causales en nuestras regiones y de esa forma mejorar el entendimiento de este fenómeno en nuestro país. Idealmente, estos estudios deberían incluir biopsias hepáticas, pero entendemos que este tipo de intervención no hace parte rutinaria del enfoque diagnóstico. Adicionalmente, sustancias que se comercializan con productos «naturales» o suplementos vitamínicos han empezado a llamar la atención como agentes causales de DILI en otras localizaciones geográficas32, e igualmente en la percepción de muchos clínicos, pero desconocemos su real carga dentro de esta enfermedad por la carencia de registros.
Contribución y autoríaArdila OM, Ortiz-Benjumea L, Guevara LG y Arteta AA, participaron en el diseño del estudio, en la selección de los pacientes, revisión de historias clínicas y evaluación de hallazgos histopatológicos. Todos los autores contribuyeron en el análisis de los datos, y en la redacción y revisión crítica del artículo.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.