La incidencia y la prevalencia de la enfermedad inflamatoria intestinal (EII) se han incrementado en los últimos años en varios países de Latinoamérica. Existe una necesidad de concientizar a gastroenterólogos y a la población en general para poder tener un diagnóstico y tratamiento oportunos en la colitis ulcerosa crónica idiopática (CUCI) y enfermedad de Crohn (EC). Es importante que todos los médicos tengan un criterio homogéneo acerca del diagnóstico y el tratamiento de la EII en América Latina. La Pan American Crohn's and Colitis Organisation (PANCCO) es un organismo con el propósito de incluir a todos los países del continente americano pero se enfoca de manera específica a los países latinos. Este Consenso está dividido en 2 partes para su publicación: 1) diagnóstico y tratamiento, y 2) situaciones especiales.
Este es el primer Consenso latinoamericano cuyo objetivo es promover una perspectiva adaptada a nuestros países latinos para el diagnóstico, el tratamiento y la monitorización de pacientes con CUCI y EC.
The incidence and prevalence of inflammatory bowel disease (IBD) has increased in recent years in several Latin American countries. There is a need to raise awareness in gastroenterologists and the population in general, so that early diagnosis and treatment of ulcerative colitis (UC) and Crohn's Disease (CD) can be carried out. It is important for all physicians to have homogeneous criteria regarding the diagnosis and treatment of IBD in Latin America. The Pan American Crohn's and Colitis Organisation (PANCCO) is an organization that aims to include all the countries of the Americas, but it specifically concentrates on Latin America. The present Consensus was divided into two parts for publication: 1) Diagnosis and treatment and 2) Special situations.
This is the first Latin American Consensus whose purpose is to promote a perspective adapted to our Latin American countries for the diagnosis, treatment, and monitoring of patients with UC and CD.
La enfermedad inflamatoria intestinal (EII) comprende principalmente la colitis ulcerosa crónica idiopática (CUCI) o colitis ulcerosa, la enfermedad de Crohn (EC) y la colitis indeterminada o inclasificable (CI). Es crónica e incurable, y se presenta con periodos de recaída y remisión. Se desconoce la etiología de la EII, pero se ha postulado como una enfermedad multifactorial debido a factores genéticos, inmunológicos y ambientales involucrados en su desarrollo. La Pan American Crohn's and Colitis Organisation (PANCCO) es una organización que tiene por objetivo la inclusión de todos los países del continente americano pero se enfoca de manera específica en los países latinos. Este Consenso se encuentra agrupado en 2 partes: diagnóstico y tratamiento, y situaciones especiales. Este es el primer Consenso Latinoamericano cuyo objetivo es proporcionar a todos los médicos un criterio homogéneo con respecto al diagnóstico y tratamiento de la EII en América Latina, y así mejorar el estándar y la calidad del cuidado otorgado a los pacientes.
ObjetivoPromover una perspectiva adaptada a nuestros países latinoamericanos en relación con el diagnóstico, el tratamiento y la monitorización de pacientes con CUCI y EC.
MétodosPara lograr el consenso, se emplearon en la estrategia los siguientes pasos:
- 1.
Para el desarrollo de las primeras guías de la PANCCO, el Dr. Jesús K. Yamamoto-Furusho coordinó y organizó el contenido del consenso en conjunto con el Comité Directivo de la PANCCO, conformado por médicos de 6 países latinoamericanos: Argentina, Brasil, Chile, Colombia, México y Venezuela. El Dr. Yamamoto-Furusho estableció y distribuyó cada uno de los temas a los expertos de estos 6 países latinoamericanos. Cada miembro fue responsable de desarrollar las preguntas relevantes por separado para cada uno de los 12 temas sobre el diagnóstico, el tratamiento y las situaciones especiales en las enfermedades de la CUCI y EC. El enfoque de las preguntas fue sobre la práctica clínica actual y cuestiones controversiales. Se pidió a los participantes contestar las preguntas basándose en su experiencia y de acuerdo con la literatura médica (proceso de Delphi). Se formaron equipos de trabajo que revisaron el progreso descrito en la literatura publicada.
- 2.
En paralelo, los miembros del Consenso llevaron a cabo una búsqueda sistemática de la literatura para cada una de las cuestiones utilizando Medline/Pubmed, la base de datos Cochrane, EMBASE (Ovid) y LILACS.
La estrategia de la búsqueda incluyó los siguientes términos MeSH para el diagnóstico: enfermedad inflamatoria intestinal, enfermedad de Crohn, colitis ulcerosa crónica idiopática, diagnóstico, biomarcadores séricos y fecales, índices clínicos, endoscopía, radiología (tomografía computarizada [TC], y enterografía por resonancia magnética [RM enterografía]). Los términos MeSH para el tratamiento médico incluyeron: 5 aminosalicilatos (5-ASA), esteroides, budesonida, tiopurinas (azatioprina y 6-mercaptopurina), inmunosupresores (ciclosporina, tacrolimús, metotrexato) y terapia biológica (agentes antifactor de necrosis tumoral [FNT] [infliximab, adalimumab, certolizumab pegol, golimumab] y terapias antiintegrina [natalizumab, vedolizumab]). Los términos utilizados para el tratamiento quirúrgico fueron: proctocolectomía, resección intestinal, bolsa, anastomosis íleo-anal, pouchitis, complicaciones, megacolon tóxico y cirugías EII.
Incluimos todas las guías de práctica clínica, ensayos controlados aleatorizados, revisiones sistemáticas, metaanálisis, estudios de cohorte y estudios de caso y controles publicados en los últimos 15 años (2000-2014).
El nivel de evidencia se clasificó (tabla 1) de acuerdo con el Centre for Evidence-Based Medicine de Oxford.
Tabla 1.Niveles de evidencia y grados de recomendación basados en el Oxford Centre for Evidence-Based Medicine
Nivel Estudio diagnóstico Estudio terapéutico 1a RS (homogénea) de estudios diagnósticos de nivel 1 RS (homogénea) de ECA 1b Estudio de cohorte de validación con buenos estándares de referencia ECA individual (con un estrecho intervalo de confianza) 1c La especificidad es tan alta que un resultado positivo establece el diagnóstico («SpPin») o la sensibilidad es tan alta que un resultado negativo descarta el diagnóstico («SnNout») Todos o ninguno 2a RS (homogénea) de estudios diagnósticos de nivel > 2 RS (homogénea) de estudios de cohorte 2b Estudio de cohorte de exploración con buenos estándares de referencia Estudio de cohorte individual (incluyendo ECA de baja calidad; p. ej., seguimiento < 80%) 2c Investigación de «Resultados»; estudios ecológicos 3a RS con homogeneidad de 3b y mejores estudios RS (homogénea) de estudios de casos y controles 3b Estudio no consecutivo; o sin la aplicación consistente de estándares de referencia Estudio de casos y controles individual 4 Estudio de casos y controles, estándares de referencia no favorables o no independientes Estudios de serie de casos (y estudios de cohorte y de casos y controles de baja calidad) 5 Opinión experta sin una explícita evaluación crítica, o basada en fisiología, investigación de laboratorio o «principios básicos» Opinión experta sin una explícita evaluación crítica, o basada en fisiología, investigación de laboratorio o «principios básicos» ECA: ensayos controlados aleatorizados; RS: revisión sistemática.
- 3.
Las declaraciones revisadas sobre los temas fueron escritas por aquellos a cargo de cada tema, basadas en las respuestas recibidas del equipo de trabajo, así como de la evidencia de la literatura, y se mostraron a todos los participantes. La estructura de cada declaración consistió de la recomendación basada en el diseño de estudio y evidencia clínica y, por último, se determinaron los niveles de evidencia y acuerdo.
- 4.
En mayo del 2015, todos los participantes se encontraron en Washington DC, EE. UU., para aceptar las declaraciones. Los participantes se reunieron bajo la coordinación del Dr. Yamamoto-Furusho para llegar a un acuerdo sobre la versión final de cada declaración. Técnicamente, esto se realizó proyectando las declaraciones en una pantalla y revisándolas hasta llegar a un consenso. Consenso se definió como el acuerdo>80% de los participantes. Se estableció una Declaración de Consenso y fue enumerada en el documento con propósitos de conveniencia.
- 5.
Se redactó el documento final de cada tema por la persona a cargo de cada tema o sección. Las Declaraciones del Consenso están escritas en negritas y seguidas de comentarios sobre la evidencia y una opinión. La intención es que las declaraciones sean leídas en el contexto de los comentarios calificativos y no de manera aislada. El Dr. Yamamoto-Furusho editó el texto final para consistencia de estilo y fue aprobado por los participantes. En algunas áreas, hay muy pocos ensayos controlados aleatorizados, resultando en un nivel de evidencia bajo general. Cuando este fue el caso, se incluyó una opinión experta.
La clasificación de Montreal se utilizó en el presente Consenso para definir la distribución de la enfermedad como sigue:
- –
E1 Proctitis. Su afectación se limita al recto (es decir, la extensión proximal de inflamación es distal a la unión rectosigmoidea).
- –
E2 Colitis izquierda. Su afectación se limita a la porción del colon distal a la flexura esplénica (análoga a la «colitis distal»).
- –
E3 Colitis extendida. Su afectación se extiende a la flexura esplénica e incluye pancolitis.
Algunas de las evidencias indican que pacientes con CUCI, estratificados por edad (A1: < 16; A2: 16-40, y A3:>40 años de edad), tienen diferentes cursos de la enfermedad.
Enfermedad activaPara los propósitos de este Consenso, la actividad clínica de la enfermedad se agrupó en 4 categorías, tomando en cuenta los criterios de Truelove y Witts: inactiva o en remisión, leve, moderada, y severa.
RemisiónLa remisión se describe como la completa resolución de síntomas y/o cicatrización endoscópica de la mucosa.
RespuestaLa respuesta se define como la mejoría clínica y endoscópica, es decir, una disminución>30% en el índice de actividad, además de una disminución en el sangrado rectal y los subpuntajes endoscópicos.
RecaídaLa recaída es la exacerbación de síntomas en un paciente con CUCI establecida que había estado en remisión clínica, ya sea espontáneamente o después de tratamiento médico.
Recaída tempranaEsto consiste en síntomas de actividad de la enfermedad en un periodo<3 meses después de lograr la remisión clínica.
Patrón de recaídaLa recaída puede ser rara (≤ una recaída/año), común (≥ 2 recaídas/año) o continua (síntomas persistentes de la CUCI activa sin un periodo de remisión).
Colitis ulcerosa crónica idiopática refractaria a esteroidesPacientes con enfermedad activa a pesar de una dosis de prednisona de hasta 0.75mg/kg/día durante un periodo de 4 semanas.
Colitis ulcerosa crónica idiopática dependiente de esteroides- 1.
Pacientes incapaces de reducir la dosis de esteroides por debajo de lo equivalente a 10mg/día de prednisona dentro de los primeros 3 meses de tratamiento, sin una enfermedad recurrente activa, o
- 2.
pacientes que tienen una recaída en los primeros 3 meses después de haber descontinuado los esteroides.
Estos pacientes tienen enfermedad activa o recaída a pesar de la administración de terapia con tiopurina en la dosis apropiada por al menos 3 meses (es decir, azatioprina 2-2.5mg/kg/día o 6-mercaptopurina 1-1.5mg/kg/día en la ausencia de leucopenia).
Colitis ulcerosa crónica idiopática distal refractariaDefinida por síntomas persistentes causados por la inflamación colónica limitado al recto (proctitis) o al colon izquierdo, a pesar de la administración de esteroides orales y tópicos, y 5-ASA por 4-8 semanas.
Definiciones en la enfermedad de CrohnEnfermedad activaa. Índice de actividad de la EC (IAEC):
- 1.
Leve: 150-220 puntos.
- 2.
Moderada: 220-450 puntos.
- 3.
Severa:>450 puntos.
Remisión: IAEC<150.
Respuesta a tratamiento: cambio de puntaje en el IAEC; disminución >100 puntos en el IAEC.
Recaída: exacerbación de síntomas en un paciente con EC que había estado en remisión clínica, ya sea espontáneamente o después del tratamiento médico; un incremento de setenta puntos en el IAEC.
Recaída temprana: exacerbación de síntomas en un paciente con EC en remisión en menos de 3 meses bajo tratamiento médico.
Patrón de recaída: poco común: ≤ una vez por año; común: ≥ 2 veces por año y síntomas persistentes continuos de la EC activa sin un periodo de remisión.
Enfermedad refractaria a esteroides: pacientes con actividad de la enfermedad a pesar de la administración de prednisona de hasta 0.75mg/kg/día durante un periodo de 4 semanas.
Enfermedad dependiente de esteroides:- 1.
los pacientes son incapaces de reducir la dosis de esteroides por debajo del equivalente a 10mg/día de prednisona (budesonida bajo 3mg/día) dentro de los primeros 3 meses de recibir los esteroides, sin enfermedad recurrente activa, o
- 2.
los pacientes tienen una recaída en los primeros 3 meses después de descontinuar los esteroides,
- 3.
la duración total de los esteroides no debe de exceder los 3 meses.
Recurrencia: las lesiones vuelven después de someterse a una resección quirúrgica.
Recurrencia morfológica: la presencia de lesiones de la EC después de resección macroscópica de la enfermedad, como establece el puntaje de Rutgeerts.
Recurrencia endoscópica según el puntaje de Rutgeerts:- 1.
0: no hay lesiones evidentes.
- 2.
1: menos de 5 lesiones aftosas.
- 3.
2: más de 5 lesiones con mucosa normal entre lesiones.
- 4.
3: ileítis aftosa difusa con mucosa inflamada.
- 5.
4: inflamación ileal con nódulos, úlceras, estenosis.
Recurrencia clínica: reaparición de síntomas después de la resección macroscópica de la enfermedad una vez que se haya confirmado la recurrencia de la lesión.
Enfermedad localizada: afectación intestinal de la EC menor de 30cm.
Enfermedad extendida: condición intestinal de la EC extendida más de 100cm, sin importar la localización. Incluye la suma de áreas inflamadas alternadas con áreas sin compromiso.
DiagnósticosA. Aspectos clínicos y biomarcadores1. El diagnóstico de la EII debe basarse en la correlación de aspectos clínicos, de laboratorio, endoscópicos e histológicos. Los posibles diagnósticos diferenciales deben ser descartados. Nivel de evidencia: 3. Nivel de acuerdo: 100%.
La EII se refiere a un grupo de trastornos de una etiología poco clara, pero con aspectos clínicos e histopatológicos comunes. Las enfermedades principales son CUCI y EC. La CUCI es un trastorno inflamatorio de la mucosa colónica, que comienza en el recto, pero puede extenderse proximalmente y envolver el colon. Por otra parte, la EC es una enfermedad crónica que puede causar inflamación desde la boca hasta el ano, con una distribución irregular de lesiones que pueden afectar no solo la mucosa, sino también a la pared intestinal en su grosor completo. El diagnóstico diferencial de la EII y otros trastornos inflamatorios, infecciosos o funcionales es a menudo difícil. Solo recientemente se han empleado los biomarcadores para ayudar en el diagnóstico y manejo de la EII1-4.
El diagnóstico puede realizarse tomando una historia clínica muy detallada que deberá incluir información sobre la aparición inicial de síntomas, crisis previas, sangrado rectal, diarrea, dolor abdominal, pérdida de peso y lesiones perianales, y la presencia de síntomas extraintestinales. Deben también evaluarse antecedentes familiares de la EII, viajes recientes, el uso de fármacos antiinflamatorios e infecciones (incluyendo tuberculosis)1,4.
El diagnóstico de la EII debe basarse en datos clínicos, endoscópicos, de laboratorio e imagenológicos. Actualmente, la evaluación endoscópica es la prueba de valor basal para la EII para detectar y medir la inflamación intestinal, pero es costosa, invasiva y molesta para el paciente. Al menos uno de 3 pacientes presenta actividad clínica y endoscópica con niveles normales de proteína C reactiva (PCR). Hay pruebas sencillas, seguras y económicas relacionadas adecuadamente con la endoscopia que son apoyos bien recibidos en el diagnóstico y la monitorización de la EII. Se pueden utilizar regularmente en lugar de otras pruebas invasivas, como la colonoscopia, especialmente cuando los pacientes presentan síntomas5,6. Los posibles diagnósticos diferenciales deben descartarse, y en casos de duda, cuando la inflamación se limita al colon o se trata de una CI. Las siguientes pruebas de rutina son las recomendadas, de acuerdo con la necesidad/el sitio/las condiciones locales:
- 1.
Exploración física.
- 2.
Pruebas de laboratorio: biometría hemática, velocidad de sedimentación globular (VSG), PCR, albúmina, hierro, ferritina, examen coprológico (calprotectina fecal).
- 3.
Eliminación de la posibilidad de virus de la inmunodeficiencia humana (sida), tuberculosis y otras patologías, como infecciones intestinales, isquemia, etc. (pruebas sanguíneas y fecales).
- 4.
Íleo-colonoscopia.
- 5.
Ultrasonido (US) abdominal.
- 6.
La imagen por RM (IRM) es preferida sobre la TC debido a la exposición a radiación, y se realiza con un protocolo enterográfico.
- 7.
Exámenes radiológicos con contraste de bario (tránsito intestinal y colon por enema) (cuando no están disponibles la IRM o la TC).
- 8.
Cápsula endoscópica (en casos donde no se ha establecido el diagnóstico, aun después de las pruebas anteriores).
2. Los índices de actividad más utilizados y confiables para la EC son el IAEC y el índice Harvey-Bradshaw (IHB). Los índices más utilizados recomendados para la CUCI son la puntuación de la clínica Mayo y el índice de Truelove y Witts. Nivel de evidencia: 3. Nivel de acuerdo: 89%.
Los índices de actividad más utilizados y confiables para la EC son el IAEC y el IHB. Los índices más utilizados recomendados para la CUCI son la puntuación de la clínica Mayo y el índice de Truelove y Witts7.
3. Los anticuerpos anti-Saccharomyces cerevisiae (ASCA) y los anticuerpos anticitoplasma de neutrófilos (ANCA) son los marcadores serológicos que son útiles para el diagnóstico diferencial entre la CUCI y EC. No son útiles para el diagnóstico de la EII. Nivel de evidencia: 4. Nivel de acuerdo: 100%.
A pesar del éxito logrado en la búsqueda de biomarcadores para la EII, los marcadores serológicos que tenemos hoy en día todavía son muy limitados para el diagnóstico de la EII. Por ejemplo, cuando la sospecha es alta, la negatividad del marcador no previene la realización de los estudios apropiados de imagenología o endoscopia. Sin embargo, cuando la sospecha es baja, la positividad del marcador puede llevar a que se realicen al paciente pruebas invasivas innecesarias. Cuando la sospecha es alta y los marcadores positivos, el paciente también tiene que someterse a exámenes radiográficos y endoscópicos para obtener información sobre el alcance, la localización y la gravedad de la enfermedad. Por lo tanto, ya que los marcadores son relativamente sensibles y específicos, son de poco uso para el diagnóstico. En América Latina, son generalmente realizados únicamente las pruebas para ASCA (IgA y IgG), ANCA con patrón perinuclear (p-ANCA), PCR y VSG. Los primeros 2 son utilizados para el diagnóstico diferencial (tienen una especificidad razonable) y los demás para la evaluación de síntomas inflamatorios (no específicos)8-12. En pacientes con CUCI, encontramos una prevalencia más alta de ANCA con patrón atípico (x-ANCA) que de p-ANCA (50% vs. 32%), junto con una especificidad más alta (96% vs. 92%) y un valor predictivo positivo (99% vs. 96%)13. Además, se asoció el patrón x-ANCA con la presencia de extensión de enfermedad y artralgias en pacientes mexicanos con CUCI14.
4. Los reactantes de fase aguda, como la PCR y la VSG, son no específicos y deben realizarse si se sospecha el diagnóstico de la EII. También son útiles en la monitorización de actividad inflamatoria en pacientes con EII. Nivel de evidencia: 2. Nivel de acuerdo: 89%.
La PCR es sintetizada en el hígado y es un marcador serológico sensible para inflamación. Durante la inflamación aguda, la PCR puede incrementar enormemente, hasta mil veces15-17. Un estudio realizado en el 2002 mostró que cuando se empleó el método ELISA para PCR, un valor de corte de 2.3mg/l tenía una sensibilidad del 100% y una especificidad del 67% en la diferenciación de la EII de trastornos funcionales intestinales16. La PCR parece ser el marcador serológico más sensible para la detección de EII, pero también se incrementa en otras condiciones, como infecciones activas (tuberculosis, neumonía, y otras infecciones bacterianas) y otros procesos inflamatorios (artritis reumatoide, lupus, pancreatitis, infarto agudo de miocardio y tumores), embarazo, y el uso de medicamentos (como contraceptivos orales)6,15,18. La PCR no puede distinguir entre la CUCI y EC. Una revisión del papel de la PCR en el diagnóstico de enfermedades del tracto gastrointestinal ha concluido que debe ser empleada como una herramienta auxiliar para complementar la observación clínica y exploración física, pero no las puede reemplazar15,17. Un estudio mexicano encontró una correlación significativa entre la PCR sérica ultrasensible y la actividad histológica (r2=0.39, p=0.01). La utilidad de diagnóstico se determinó por curvas ROC que mostraban un punto de corte de ≥ 0.36mg/dl y un área bajo la curva de 0.7319.
5. Los marcadores fecales, como la calprotectina, son sensibles y específicos para la documentación de la inflamación intestinal. También son útiles para la monitorización de pacientes con EII. Nivel de evidencia: 2. Nivel de acuerdo: 89%.
Además de los marcadores sanguíneos, existen marcadores fecales que valoran la actividad inflamatoria, pero no son específicos para la CUCI y la EC, ya que indican únicamente la presencia de inflamación. Son importantes para la distinción entre la EII y el síndrome del intestino irritable (SII) y también para la monitorización de pacientes con EII después del diagnóstico. Hay una fuerte correlación entre la calprotectina fecal y la excreción de neutrófilos marcados, apoyando la hipótesis de que el incremento en la calprotectina es un resultado de la migración de leucocitos a la mucosa inflamada y la resultante pérdida de leucocitos en la luz intestinal20. La calprotectina es una proteína vinculada al calcio, principalmente derivada de neutrófilos. Excretada en las heces, es estable hasta por una semana. No es específica para la detección de inflamación intestinal y puede estar elevada con el uso de los AINE y por infecciones entéricas. Es importante para el diagnóstico diferencial de EII y SII, además de que es capaz de predecir recaídas, y por lo tanto es útil para la monitorización de pacientes en remisión21. Algunos estudios han mostrado que la excreción elevada de calprotectina fecal es muy sensible (84%) y muy específica (96%) para enfermedades inflamatorias con un valor predictivo positivo del 95% vs. un valor predictivo negativo del 85% para la discriminación entre EII y SII. Se estableció en muchos estudios la concentración de calprotectina fecal regular mostrando un valor promedio de 25mg/kg. Niveles mayores a 50mg/kg se consideran niveles altos, mientras que niveles entre 200 y 20,000mg/kg indican la presencia de inflamación. Aquellos casos con niveles entre 50 y 200 son inconclusos y no pueden ser considerados significativos para la inflamación22-30.
La calprotectina parece tener gran potencial en la pediatría para diagnósticos diferenciales y en la selección de pacientes que requerirán una colonoscopia para determinar la etiología22,23. Algunos estudios también muestran su capacidad de predecir la recaída de enfermedad en pacientes con colitis o EC23.
6. El análisis histológico puede ser de ayuda en el diagnóstico de la EII, así como en la verificación del grado de inflamación, y por lo tanto, en el comportamiento terapéutico. Nivel de evidencia: 3. Nivel de acuerdo: 89%.
El análisis histológico puede ser útil para complementar el diagnóstico de la EII, pero por sí solo es de poco valor. Además, granulomas ocurren en no más del 25-30% de los casos con EC. No hay lesiones específicas en la CUCI, pero algunas alteraciones microscópicas pueden ser de utilidad en la confirmación del diagnóstico1. Bitton et al. mostraron que la plasmocitosis basal era el predictor histológico principal de recaída, independiente de la terapia de mantenimiento, entre 74 pacientes con CUCI clínica y endoscópica quiescente31.
Azad et al. encontraron que cantidades incrementadas de neutrófilos y eosinófilos en la lámina propia se asociaban a un riesgo elevado de recaída sobre un periodo de 12 meses en pacientes con CUCI quiescente32.
La resolución de inflamación histológica en la CUCI también se ha asociado con una probabilidad más alta de permanecer libre de síntomas a los 12 meses después de un curso de corticoides, así como con una reducción en tasas de hospitalización y colectomías33,34.
El valor pronóstico de la histología ha sido valorado en un solo estudio sobre la EC, el cual encontró que la inflamación de la mucosa no estaba asociada con recaídas clínicas más frecuentes, la formación de estenosis o cirugía35.
7. El diagnóstico temprano de la EII (CUCI y EC) tiene un gran impacto en el desarrollo de la enfermedad. Nivel de evidencia: 4. Nivel de acuerdo: 100%.
El diagnóstico temprano de la EII (CUCI y EC) tiene un gran impacto en el desarrollo de la enfermedad. Esta es la única manera de prevenir daños y secuelas en los pacientes36-38. Aun después de establecido el diagnóstico, la monitorización es muy importante para prevenir otras crisis y complicaciones subsecuentes39.
B. Aspectos endoscópicos8. Si se sospecha de EII, la íleo-colonoscopia es el procedimiento de elección para establecer el diagnóstico y determinar la extensión de la enfermedad. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
La íleo-colonoscopia representa la prueba más importante y poderosa en el diagnóstico cuando se sospecha de EII y debe de ser llevada a cabo rápidamente y antes de comenzar cualquier tratamiento médico. En la CUCI, los cambios endoscópicos comienzan típicamente proximales al borde anal y se extienden en sentido proximal y de manera continua, concéntrica y confluente. La demarcación entre áreas normales e inflamadas es usualmente clara y puede ocurrir de manera abrupta, especialmente en la enfermedad distal40. La ausencia de compromiso rectal microscópico y macroscópico se ha descrito en niños con colitis ulcerosa antes de tratamiento41,42. En adultos, parches de inflamación o una apariencia normal en el recto puede ser debido al uso de una terapia tópica previa. Parches de inflamación en el ciego43 son observados en pacientes con colitis izquierda. Cuando en un nuevo diagnóstico de colitis no hay compromiso rectal ni de parche cecal, además de la íleo-colonoscopia, debe ser evaluado el intestino delgado. La ausencia de una lesión del apéndice se reporta en más del 75% de pacientes con CUCI44-46. Esto se asocia a una mejor respuesta al tratamiento médico y a un riesgo elevado de pouchitis44-46. La extensión continua de inflamación del ciego al íleo distal se define como ileítis por reflujo, observada en más del 20% de los pacientes con pancolitis47,48, y se asocia con un curso refractario de la enfermedad49.
La característica endoscópica de la EC es la distribución de inflamación en parches desiguales, con áreas de inflamación intercaladas con mucosa de apariencia normal. Las úlceras de la EC tienden a ser longitudinales y pueden asociarse a un aspecto adoquinado en el íleo o el colon, con estenosis y con aperturas de fístulas. El recto está comprometido en un patrón opuesto y circunferencial, y la inflamación continua es poco frecuente. Se deben realizar biopsias de los bordes de las úlceras y las erosiones aftoides para aumentar la posibilidad de encontrar granulomas, que son patognomónicas para la EC50.
Cuando hay una enfermedad activa severa, en ambas, la EC y CUCI, debe valorarse la colonoscopia total, debido a su alto riesgo de perforación. La edad avanzada, la enfermedad grave, el uso de esteroides, el sexo femenino y la dilatación endoscópica parecen estar asociadas con un riesgo aumentado de perforación (0.3 al 1%)51,52. En este caso, iniciar con una sigmoidoscopia es seguro y la íleo-colonoscopia debe posponerse hasta que el estado clínico del paciente mejore. Sin embargo, un estudio reciente indica que el riesgo no incrementa cuando se realiza por manos experimentadas53.
9. Para el diagnóstico de la EC y la colitis ulcerosa deben obtenerse biopsias múltiples de 6 segmentos (íleo terminal, ascendente, transverso, y colon descendente, colon sigmoideo, y recto). Las biopsias múltiples constan de al menos 2 muestras de cada segmento, incluyendo segmentos macroscópicamente normales. Nivel de evidencia: 2. Nivel de acuerdo: 88%.
Las biopsias de mucosa normal efectivamente excluyen la EII activa. Para el diagnóstico de la EII, múltiples biopsias representativas son necesarias. De ser posible, deben tomarse al menos 2 biopsias en 5 sitios del colon, incluyendo el recto y el íleo terminal. Las biopsias representativas deben de ser tomadas de áreas que tienen niveles de inflamación, tanto altos como bajos, para representar de manera adecuada la intensidad y el espectro de la inflamación. Deben de tomarse biopsias de la mucosa con apariencia normal50. Pueden ser tomadas biopsias de estenosis, lesiones polipoideas u otras lesiones, y deben ser marcados en viales separados. Las biopsias deben de siempre estar acompañadas de información clínica detallada para así asistir al patólogo en proporcionar un diagnóstico preciso. Es importante recordar que la actividad histológica puede correlacionarse pobremente con la actividad clínica54.
10. Cuando se tiene duda sobre el diagnóstico, es apropiado repetir la endoscopia e histología. Nivel de evidencia: 5. Nivel de acuerdo: 13%.
Una de las desventajas en el diagnóstico de la EII es la dificultad en el diagnóstico diferencial. En el 10% de los pacientes adultos, el diagnóstico puede cambiarse de la CUCI a la EC o viceversa, y el diagnóstico de la EII puede quedar descartado durante los primeros 5 años después de aparecidos los síntomas55. Se han documentado errores en la clasificación diagnóstica de pacientes incluidos en estudios genéticos de la EII, mostrando que el diagnóstico erróneo de EII no fue infrecuente56. Aproximadamente, el 5% de pacientes diagnosticados inicialmente con EII son clasificados posteriormente con CI. Alrededor del 80% de los pacientes con CI en el momento de la aparición de síntomas, luego son diagnosticados con CUCI o EC durante los primeros 8 años de seguimiento, a través de la reevaluación de las características clínicas y demográficas.
11. La evaluación endoscópica debe realizarse en casos de recaída, refractariedad, nuevos síntomas, o al considerar la cirugía. Nivel de evidencia: 5. Nivel de acuerdo: 89%.
Actualmente, se indica la reevaluación endoscópica para optimizar el tratamiento, tomar biopsias de la mucosa y descartar la presencia de infección por citomegalovirus. Frecuentemente, este es el caso en la EII pediátrica, en la cual la frecuencia de cambio en el manejo después de la evaluación endoscópica es de más del 42% de los casos57.
12. La íleo-colonoscopia es la prueba de valor basal en el diagnóstico de la recurrencia íleo-colónica postoperatoria en la EC. Define la severidad de las lesiones y predice el curso de la enfermedad. Nivel de evidencia: 2. Se recomienda de 6-12 meses después de la cirugía, el periodo en el cual las decisiones sobre el tratamiento podrían cambiar. Nivel de evidencia: 2. Nivel de acuerdo: 90%.
En la historia natural de la EC, la resección intestinal es inevitable en una cantidad sustancial de pacientes. La mayoría de los pacientes desarrollan recurrencia de la enfermedad en el sitio anastomótico o proximal a la anastomosis, y la recurrencia endoscópica predice el desarrollo de síntomas clínicos. Los datos del seguimiento endoscópico después de la resección y de la enfermedad ileocecal han mostrado que en la ausencia de tratamiento la recurrencia postoperatoria es de alrededor del 65 al 70% en los 12 meses subsecuentes, y del 80 al 100% dentro de los 3 años después de la cirugía58. La identificación y el tratamiento de la recurrencia temprana en la mucosa podrían prevenir la recurrencia clínica. La íleo-colonoscopia es el valor basal en el diagnóstico de la recurrencia postoperatoria. Define la presencia y la severidad de la recurrencia morfológica. La íleo-colonoscopia es recomendada 6 meses después de la cirugía, cuando puede afectar las decisiones de tratamiento.
13. No hay lesiones endoscópicas específicas de la colitis ulcerosa o de la EC. Los hallazgos endoscópicos más característicos de la colitis ulcerosa son aquellos de afectación continua del colon, con una clara demarcación entre la inflamación y el compromiso rectal. Nivel de evidencia: 2. Los hallazgos endoscópicos más útiles en la EC son lesiones no continuas, úlceras profundas, una apariencia adoquinada de la mucosa, la presencia de estenosis y fístulas, y afectación perianal. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
No hay rasgos endoscópicos específicos de la CUCI o EC. En ausencia de enfermedad extracolónica, ciertos hallazgos endoscópicos podrían indicar el diagnóstico de la EC, en vez del diagnóstico de la CUCI48-50,55,56,59. El aspecto más importante es la detección de áreas de inflamación intercaladas entre la mucosa de aspecto normal. Úlceras lineales o serpiginosas profundas, múltiples úlceras aftoides y mucosa adoquinada apoyan el diagnóstico de la EC colónica. La presencia de ileítis, enfermedad perianal o aperturas de fístulas indican la EC. El patrón de la afectación de la mucosa en la CUCI es continuo, con una clara demarcación de la inflamación en la mayoría de los casos, y la afectación rectal está casi siempre presente59-65. La estenosis es poco común en la CUCI y EC y el diagnóstico de una enfermedad maligna debe considerarse. La información detallada de las evaluaciones colonoscópicas es importante, porque una vez comenzada la terapia la inflamación puede parecer segmentaria, y a menudo sin compromiso rectal66. Existen otras desventajas en la diferenciación de CUCI y EC, una de las cuales es la ileítis por reflujo49.
14. La evaluación endoscópica con biopsias de por lo menos un sitio es esencial en la colitis ulcerosa severa para confirmación diagnóstica y descartar otras causas. Nivel de evidencia: 3. En la mayoría de los casos, la sigmoidoscopia flexible es suficiente, y se puede evitar los laxantes y la colonoscopia. Nivel de evidencia: 5. Nivel de acuerdo: 80%.
Cuando se requiere del diagnóstico urgente en un paciente que presenta diarrea con sangre y con sospecha de EII aguda, la sigmoidoscopia flexible con biopsias de la mucosa es el examen inicial apropiado, porque ayuda a diferenciar la CUCI de otras causas de la colitis aguda67. La colitis infecciosa puede encontrarse en el 38% de casos de pacientes con síntomas de colitis hemorrágica aguda. Sin embargo, los cultivos de materia fecal son positivos en solo en el 40-60% de aquellos pacientes y un cultivo negativo no descarta infección. Se puede utilizar la endoscopia en conjunto con pruebas microbiológicas en estos pacientes68.
15. La dilatación endoscópica de estenosis en la EC, en manos expertas, es una alternativa efectiva y segura a la cirugía, y debe considerarse antes de esta en pacientes selectos. Nivel de evidencia: 2. Se obtiene los mejores resultados en las estenosis cortas (menores de 4cm) y en las estenosis anastomóticas. Nivel de evidencia: 2. La posibilidad de estenosis maligna debe ser excluida. Nivel de evidencia: 3. Nivel de acuerdo: 100%.
Las estenosis intestinales son una causa mayor de morbilidad en la EC y requieren de cirugía. El tratamiento tradicional es la resección quirúrgica y la estenoplastia, pero debido a la alta frecuencia de recurrencia, se requiere de una nueva cirugía69. Hay una mayor evidencia para la dilatación con balón endoscópico como un procedimiento efectivo y seguro, especialmente en las estenosis anastomóticas y estenosis íleocecales70-87. Sin embargo, estos estudios son retrospectivos con un diseño observacional y existen pocos estudios prospectivos con seguimiento a largo plazo73,75,82,84,88. El éxito desde el punto de vista técnico de la dilatación endoscópica varió entre el 86 y el 93%, y el éxito clínico se definió como la resolución de síntomas obstructivos en el 64-70% de los pacientes84,88.
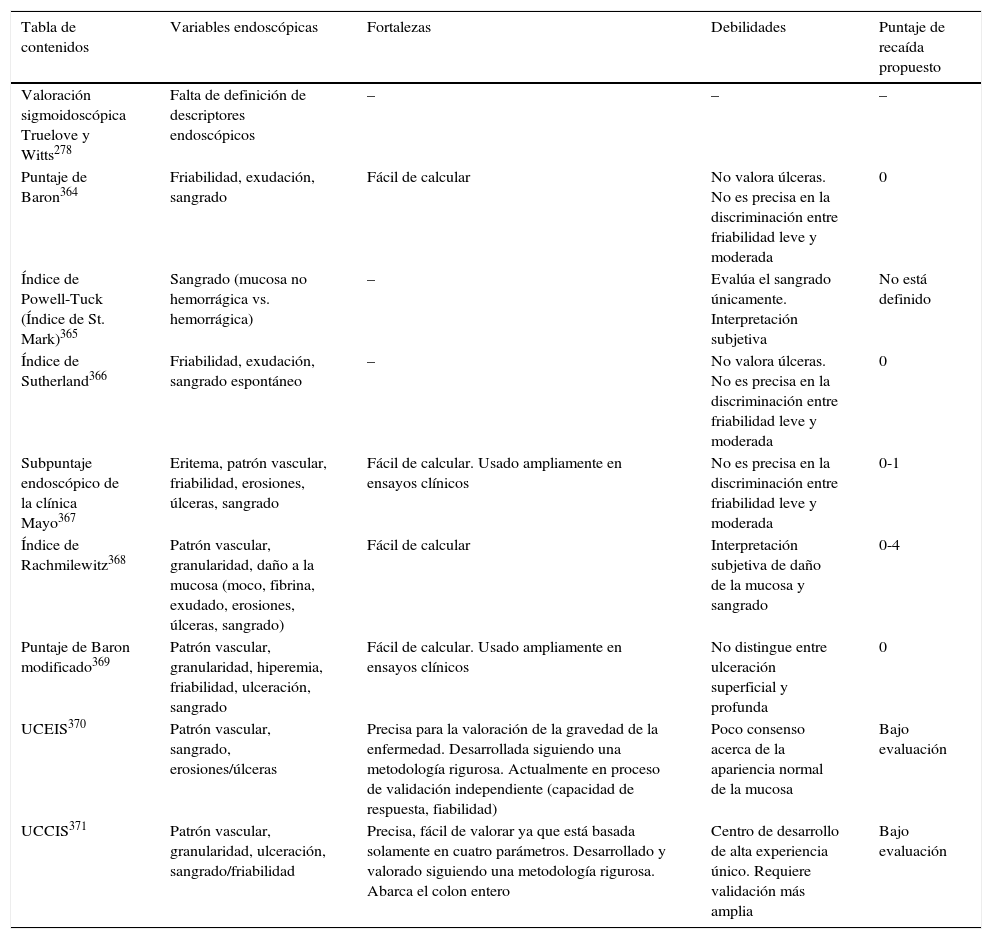
16. Para la evaluación de la actividad endoscópica, recomendamos el uso de índices estandarizados y validados, tales como el índice endoscópico de gravedad de la colitis ulcerosa (UCEIS, siglas en inglés) y el índice colonoscópico de gravedad de la colitis ulcerosa (UCCIS, siglas en inglés). Nivel de evidencia: 2. El subíndice endoscópico de la clínica Mayo es utilizado en estudios controlados aleatorizados, aunque no está validado. Nivel de evidencia: 2. Nivel de acuerdo: 91%.
Como se muestra en la tabla 2.
Comparación de tasas de puntajes endoscópicas en la colitis ulcerosa (Índice Endoscópico de Gravedad de la Colitis Ulcerosa [UCEIS, siglas en inglés], Índice Colonoscópico de Gravedad de la Colitis Ulcerosa [UCCIS, siglas en inglés])
| Tabla de contenidos | Variables endoscópicas | Fortalezas | Debilidades | Puntaje de recaída propuesto |
|---|---|---|---|---|
| Valoración sigmoidoscópica Truelove y Witts278 | Falta de definición de descriptores endoscópicos | – | – | – |
| Puntaje de Baron364 | Friabilidad, exudación, sangrado | Fácil de calcular | No valora úlceras. No es precisa en la discriminación entre friabilidad leve y moderada | 0 |
| Índice de Powell-Tuck (Índice de St. Mark)365 | Sangrado (mucosa no hemorrágica vs. hemorrágica) | – | Evalúa el sangrado únicamente. Interpretación subjetiva | No está definido |
| Índice de Sutherland366 | Friabilidad, exudación, sangrado espontáneo | – | No valora úlceras. No es precisa en la discriminación entre friabilidad leve y moderada | 0 |
| Subpuntaje endoscópico de la clínica Mayo367 | Eritema, patrón vascular, friabilidad, erosiones, úlceras, sangrado | Fácil de calcular. Usado ampliamente en ensayos clínicos | No es precisa en la discriminación entre friabilidad leve y moderada | 0-1 |
| Índice de Rachmilewitz368 | Patrón vascular, granularidad, daño a la mucosa (moco, fibrina, exudado, erosiones, úlceras, sangrado) | Fácil de calcular | Interpretación subjetiva de daño de la mucosa y sangrado | 0-4 |
| Puntaje de Baron modificado369 | Patrón vascular, granularidad, hiperemia, friabilidad, ulceración, sangrado | Fácil de calcular. Usado ampliamente en ensayos clínicos | No distingue entre ulceración superficial y profunda | 0 |
| UCEIS370 | Patrón vascular, sangrado, erosiones/úlceras | Precisa para la valoración de la gravedad de la enfermedad. Desarrollada siguiendo una metodología rigurosa. Actualmente en proceso de validación independiente (capacidad de respuesta, fiabilidad) | Poco consenso acerca de la apariencia normal de la mucosa | Bajo evaluación |
| UCCIS371 | Patrón vascular, granularidad, ulceración, sangrado/friabilidad | Precisa, fácil de valorar ya que está basada solamente en cuatro parámetros. Desarrollado y valorado siguiendo una metodología rigurosa. Abarca el colon entero | Centro de desarrollo de alta experiencia único. Requiere validación más amplia | Bajo evaluación |
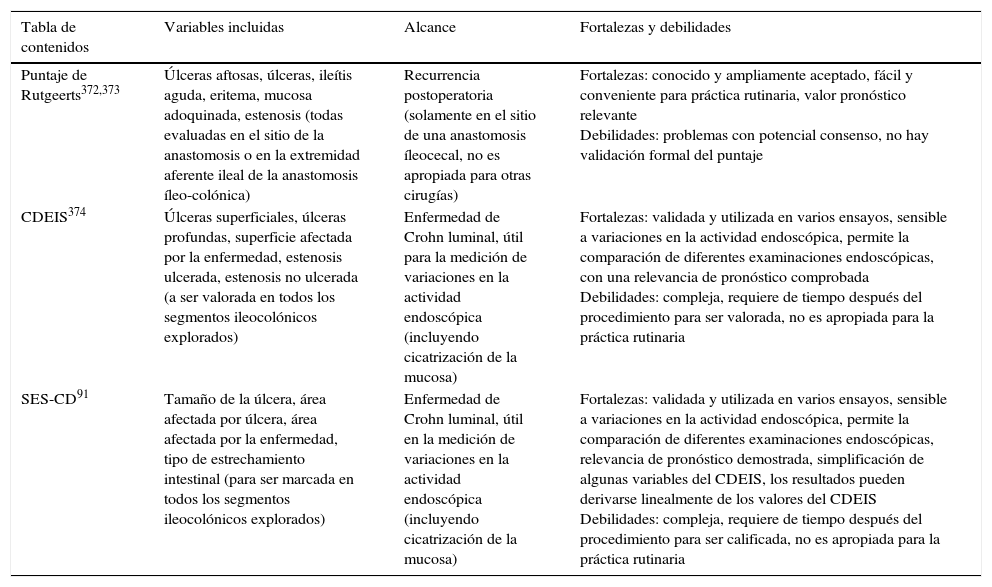
17. La recurrencia de la EC en el íleon terminal después de la resección ileocecal deberá ser clasificada preferiblemente según el puntaje de Rutgeerts. Nivel de evidencia: 3. El índice endoscópico de gravedad de la EC (CDEIS, siglas en inglés) (nivel de evidencia: 1) y la puntuación endoscópica simplificada para la EC (SES-CD, siglas en inglés) (nivel de evidencia: 1) son sistemas de medición reproducibles y validados dedicados a la medición de la actividad endoscópica intraluminal de la EC, pero su uso clínico aún está por definirse. Nivel de evidencia: 5. Nivel de acuerdo: 91%.
Como se muestra en la tabla 3.
Puntajes endoscópicos usados con mayor frecuencia para la enfermedad de Crohn (Índice Endoscópico de Gravedad de la Enfermedad de Crohn [CDEIS, siglas en inglés], Puntuación Endoscópica Simplificada para la Enfermedad de Crohn [SES-CD, siglas en inglés])
| Tabla de contenidos | Variables incluidas | Alcance | Fortalezas y debilidades |
|---|---|---|---|
| Puntaje de Rutgeerts372,373 | Úlceras aftosas, úlceras, ileítis aguda, eritema, mucosa adoquinada, estenosis (todas evaluadas en el sitio de la anastomosis o en la extremidad aferente ileal de la anastomosis íleo-colónica) | Recurrencia postoperatoria (solamente en el sitio de una anastomosis íleocecal, no es apropiada para otras cirugías) | Fortalezas: conocido y ampliamente aceptado, fácil y conveniente para práctica rutinaria, valor pronóstico relevante Debilidades: problemas con potencial consenso, no hay validación formal del puntaje |
| CDEIS374 | Úlceras superficiales, úlceras profundas, superficie afectada por la enfermedad, estenosis ulcerada, estenosis no ulcerada (a ser valorada en todos los segmentos ileocolónicos explorados) | Enfermedad de Crohn luminal, útil para la medición de variaciones en la actividad endoscópica (incluyendo cicatrización de la mucosa) | Fortalezas: validada y utilizada en varios ensayos, sensible a variaciones en la actividad endoscópica, permite la comparación de diferentes examinaciones endoscópicas, con una relevancia de pronóstico comprobada Debilidades: compleja, requiere de tiempo después del procedimiento para ser valorada, no es apropiada para la práctica rutinaria |
| SES-CD91 | Tamaño de la úlcera, área afectada por úlcera, área afectada por la enfermedad, tipo de estrechamiento intestinal (para ser marcada en todos los segmentos ileocolónicos explorados) | Enfermedad de Crohn luminal, útil en la medición de variaciones en la actividad endoscópica (incluyendo cicatrización de la mucosa) | Fortalezas: validada y utilizada en varios ensayos, sensible a variaciones en la actividad endoscópica, permite la comparación de diferentes examinaciones endoscópicas, relevancia de pronóstico demostrada, simplificación de algunas variables del CDEIS, los resultados pueden derivarse linealmente de los valores del CDEIS Debilidades: compleja, requiere de tiempo después del procedimiento para ser calificada, no es apropiada para la práctica rutinaria |
18. La curación de la mucosa en la colitis ulcerosa es asociada con un riesgo más bajo de recaída clínica, hospitalización, colectomía y riesgo de neoplasia asociado con colitis. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
El objetivo del tratamiento de la CUCI es curar la mucosa, la cual ofrece un mejor pronóstico que el control de síntomas. La curación de la mucosa puede variar en su definición de eritema leve, granularidad y friabilidad89, e incluir las definiciones más estrictas, como mucosa normal sin ulceración alguna, o ambas, la curación microscópica y macroscópica.
19. La curación de la mucosa lograda a través de terapia para la EC se asocia con una disminución de recaída, hospitalización y la necesidad de cirugía. Nivel de evidencia: 2. Nivel de acuerdo: 100%. En la ausencia de definiciones validadas formalmente, la curación de la mucosa puede definirse como la ausencia de úlceras, y entonces se recomienda emplear el CDEIS. Nivel de evidencia: 3. Nivel de acuerdo: 100%. La recurrencia endoscópica postoperatoria temprana (puntaje de Rutgeerts>i2) es asociada con una recurrencia subsecuente sintomática y quirúrgica más frecuente. Nivel de evidencia: 1. Por lo tanto, la optimización del tratamiento médico debe considerarse. Nivel de evidencia: 5. Nivel de acuerdo: 100%.
Existe mayor evidencia que indica que la curación de la mucosa podría cambiar el desarrollo de la EC, la cual disminuiría la frecuencia de recaídas y hospitalización, y la necesidad de cirugía. Desafortunadamente, las definiciones de curación de la mucosa varían enormemente en los diferentes ensayos clínicos90-102.
20. En pacientes con sospecha de EC e íleo-colonoscopia negativa, la cápsula endoscópica podría ser la modalidad de diagnóstico inicial (sujeto a disponibilidad) para la evaluación del intestino delgado, en la ausencia de síntomas de obstrucción o estenosis. Nivel de evidencia: 2. Nivel de acuerdo: 91%.
La EC a menudo afecta el íleon terminal, el cual puede ser tratado con la íleo-colonoscopia convencional. Sin embargo, en algunos pacientes, la EC puede afectar al intestino delgado proximal, el cual se encuentra fuera del alcance de la íleo-colonoscopia. En estos pacientes, la cápsula endoscópica tiene un rendimiento muy alto. Detecta lesiones mejor que la enterografía por resonancia, especialmente en lesiones tempranas. Por esta razón, donde haya un diagnóstico con sospecha de EC con íleo-colonoscopia negativa y sin síntomas obstructivos, la videocápsula endoscópica debe realizarse para establecer el diagnóstico41,42,50,103-109.
21. La enteroscopia asistida es recomendada en casos especiales para la evaluación de los hallazgos endoscópicos, así como las biopsias para la evaluación histológica. Nivel de evidencia: 3. Nivel de acuerdo: 100%. Si se indica la terapia endoscópica, incluyendo la dilatación de estenosis, la extracción de una cápsula retenida y el tratamiento de sangrado, la enteroscopia asistida debe realizarse por endoscopistas expertos. Nivel de evidencia: 4. Nivel de acuerdo: 100%.
Se indica la enteroscopia en el diagnóstico de la EC cuando se requiere de la histología para la confirmación y exclusión de otras patologías. Se indica en la EC confirmada, cuando se necesita realizar endoscopia terapéutica, como la dilatación de estenosis, el manejo de sangrado, masas y pólipos, y la colocación y extracción de cápsula, entre otros110-121.
C. Imagenología e histopatología22. La elección de la enterografía por TC o la enterografía por RM para el diagnóstico de la EII debe estar de acuerdo con la disponibilidad del método en el servicio de referencia. Nivel de evidencia: 4. Nivel de acuerdo: 100%. En los servicios de urgencia, deben utilizarse la TC abdominal y pélvica o US. La radiografía abdominal simple tiene un papel en la toma de decisiones clínicas para casos de urgencia específicos. La enterografía por RM es el estudio preferido para el seguimiento del paciente. Nivel de evidencia: 3. Nivel de acuerdo: 100%.
La disponibilidad de la enterografía por RM o la enterografía por TC aún está limitada a unos cuantos centros de diagnóstico, y es secundaria a la baja disponibilidad del equipo y a la experiencia interpretativa del personal122,123.
En la sala de urgencia, las radiografías abdominales simples se han empleado rutinariamente en la evaluación de pacientes con EII, pero ahora son utilizadas con menor frecuencia que el US y la TC, especialmente a partir del desarrollo de técnicas de TC de baja dosis de radiación124-126.
Aunque este método no puede evaluar adecuadamente la actividad de la enfermedad, sí puede contribuir a la valoración de la distribución y la severidad de la colitis (extensión de la materia fecal, dilatación, engrosamiento de la pared intestinal) y a la localización de obstrucciones del intestino delgado (dilatación pequeña del intestino). La radiografía abdominal simple junto con la radiografía de tórax pueden identificar la perforación, pero son menos sensibles que la TC en la detección de abscesos intraabdominales y gas libre127,128.
El US abdominal y la radiografía simple deben considerarse para todos los pacientes con EII que estén siendo evaluados para dolor abdominal agudo. La TC también debe considerarse para los pacientes con sospecha de perforación y estudios de primera línea negativos o inconclusos129. En la colitis aguda y severa, la radiografía abdominal simple es un primer estudio aceptable en la detección de megacolon tóxico (promedio de dilatación colónica>5.5cm en el colon transverso detectado mediante estudios de imagenología)130.
En casos dudosos o selectos, la TC también puede usarse como primera técnica de imagenología para el rastreo de complicaciones (p. ej., perforación, absceso, trombosis, isquemia) que requieren cirugía de emergencia131. En la mayoría de los pacientes con colitis severa, el megacolon tóxico también es posible de predecirse por la extensión de la distensión gástrica y del intestino delgado129,131. La imagenología de cortes transversales también puede usarse, particularmente la RM, para la monitorización de la respuesta terapéutica, incluyendo la EC del intestino delgado y colon. Sin embargo, hay un retraso en la línea de tiempo en comparación con los cambios clínicos o endoscópicos en la EC colónica. Para la precisión de otros métodos, esta línea de tiempo no está bien definida129.
23. Cuando existe la sospecha de EC, se recomienda la enterografía por TC pélvica y abdominal o imagenología por RM con contraste venoso y distensión luminal (enterografía TC o enterografía RM) para la evaluación del intestino delgado y colon, así como la extensión de la enfermedad. Nivel de evidencia: 5. Nivel de acuerdo: 100%.
24. Las técnicas de imagenología de cortes transversales (enterografía RM, enterografía TC) permiten la evaluación de la actividad de la enfermedad y las complicaciones (inflamatorias, estenosantes o fistulizantes) en la EC. Son importantes en la monitorización del progreso y la optimización del tratamiento. Nivel de evidencia: 1. Nivel de acuerdo: 82%.
Se requiere del uso de la inyección de medio de contraste intravenoso (IV) para la evaluación del patrón de realce de la pared intestinal y de los vasos mesentéricos132-134. La distensión intestinal es un requerimiento fundamental para cualquier método de imagenología del intestino delgado, ya que las asas intestinales colapsadas pueden esconder o simular el engrosamiento de la pared intestinal y las lesiones patológicas135. Los agentes de contraste bifásicos incluyen varias soluciones isoosmolares no absorbentes (polietilenglicol o soluciones de manitol)129.
La enterografía TC es más rápida y menos demandante para los radiólogos, y proporciona buena distensión del íleon terminal medio, pero ofrece una distensión limitada del yeyuno136. La exposición a la radiación es la limitante principal de la TC, especialmente en pacientes sometidos a repetidas exámenes137.
La TC y RM tienen una precisión diagnóstica similar para imágenes de la EII. La TC tiene mayor disponibilidad y requiere menos tiempo que la RM137. Dependiendo de la localización y la intensidad de la actividad de la enfermedad, la TC y RM pueden detectar signos de la EC. Para la presentación inicial de la localización del íleon terminal de la EC, la precisión diagnóstica es alta y comparable entre la TC y la RM. En la localización del intestino delgado, cambios de la RM relacionados con la presencia de inflamación incluyen engrosamiento de la pared intestinal, hiperrealce de la pared después de la inyección del medio de contraste, presencia de edema de la pared, y presencia de úlceras, así como cambios afuera de la pared, como la presencia del signo del peine, el aumento anormal de la atenuación de grasa y el engrandecimiento de nódulos linfáticos138.
En la EC colónica, la RM puede proveer datos útiles sobre la extensión del daño (engrosamiento de la pared, presencia de úlceras, profundidad de la pared, penetración, edema, pérdida de haustras, pólipos, y hallazgos/complicaciones extraluminales), aunque la enfermedad leve puede no ser detectada139,140.
Además, estas modalidades tienen alta precisión para la evaluación del fenotipo penetrante y diagnóstico de estenosis del intestino delgado129,141.
Comparando la precisión de la RM y TC para el diagnóstico de pacientes con EII sospechada o establecida, principalmente la EC, se detectó, sobre una base por paciente, una alta sensibilidad promedio y una diferencia no significativa para el diagnóstico de la EII entre las modalidades de imagenología (el 93 y el 88% para la RM y TC, respectivamente). La especificidad promedio calculada por paciente también fue alta, el 93% para la RM y el 95% para TC142.
25. El US abdominal realizado por manos expertas es una técnica de imagenología bien tolerada y libre de radiación, particularmente para la exploración del intestino delgado y el colon, y puede guiar procedimientos intervencionistas (p. ej., drenaje de abscesos). Cuando se utiliza junto con contraste puede mejorar su precisión diagnóstica. Nivel de evidencia: 2. Nivel de acuerdo: 90%.
Cuando el US abdominal es utilizado para el estudio de EII, se requerirán de sondas lineales de alta frecuencia (17.5MHz) para mejorar la resolución espacial y permitir la evaluación adecuada del diámetro intestinal y el patrón reconocible de la pared de 5 capas143.
Para la búsqueda de anormalidades en la pared intestinal, se recomienda un abordaje sistemático, incluyendo 4 posiciones de escaneo en los cuadrantes superiores e inferiores derechos e izquierdos. La región íleocecal, el colon sigmoideo, así como las regiones superiores e inferiores del colon, son visualizados efectivamente en la mayoría de los pacientes. El íleon proximal y el yeyuno pueden ser difíciles de valorar debido a múltiples asas intestinales sobrepuestas y su localización pélvica profunda, mientras que el estudio del colon transversal es difícil debido a su anatomía variable y la accesibilidad del recto. El US con contraste (CEUS, siglas en inglés) puede mejorar la precisión y confianza de diagnóstico en la detección de actividad inflamatoria144,145.
La guía de procedimientos intervencionistas es también una técnica validada. Por ejemplo, el drenaje de abscesos percutáneos o transrectales bajo la guía de US tiene una tasa de éxito técnico alta del 96%146.
26. La radiología convencional (examen de tránsito intestinal) es una alternativa en la ausencia de TC y RM para el diagnóstico de lesiones superficiales y transmurales. El examen de tránsito del intestino delgado con o sin enteroclisis, en comparación con la enterografía RM y enterografía TC, no es preciso para la evaluación de la actividad de la enfermedad y no es útil para complicaciones murales y extramurales. Nivel de evidencia: 3. Nivel de acuerdo: 82%.
27. El US abdominal, la enterografía TC y la enterografía RM son de alta precisión para la evaluación de complicaciones penetrantes y para la monitorización de la progresión de la enfermedad. Nivel de evidencia: 1. Nivel de acuerdo: 91%.
Para fístulas perianales complejas, es preferido la RM pélvica o US endoanal. Nivel de evidencia: 4. Nivel de acuerdo: 91%.
El US abdominal, la TC y la RM son de alta precisión para la evaluación de complicaciones penetrantes (es decir, fístula y absceso) y en la monitorización de la progresión de la enfermedad. Para fístulas profundas, se prefieren la TC y la RM al US129. Las complicaciones penetrantes pueden detectarse por US, con sensibilidades que varían entre el 71 y el 87%, y especificidades que van del 90 al 100%147. La utilidad del diagnóstico por RM para fístulas colónicas intraabdominales se determinó, reportando una sensibilidad entre el 71 y el 100%, y una especificidad entre el 92 y el 100%148,149.
Utilizando un estándar de referencia quirúrgico, se demostró una precisión diagnóstica similar entre la TC y el US para el diagnóstico de la complicación de la EC por fístulas intraabdominales: la sensibilidad y la especificidad fueron del 68 y el 91% para TC, comparadas con el 87 y el 91% para US, respectivamente147.
El valor del US para la detección de abscesos mostró una sensibilidad desde el 81 hasta el 100% y una especificidad desde el 92 hasta el 94%. Una comparación de US y TC, utilizando un estándar de referencia quirúrgico, mostró que los abscesos eran correctamente detectados en proporciones similares, US 91% y TC 86%. Sin embargo, la precisión global fue más alta para la TC (92%) que para el US (87%)147.
Ambos, el US y la RM, son capaces de identificar y clasificar trayectos fistulosos con buena precisión. La RM es el método de imagenología más preciso (80-100%) para el diagnóstico de la EC perianal. Es recomendada durante el diagnóstico inicial, a menos que haya una necesidad inmediata para el drenaje de sepsis. El US anal es superior al examen clínico, con una precisión que varía entre el 50 y el 100%. Es una alternativa a la RM129. A su vez, estos 2 procedimientos son superiores a la evaluación clínica simple en la valoración de la respuesta a tratamiento, especialmente para la detección de abscesos residuales. Cambios significativos en las terapias quirúrgicas o médicas, o su cese total, también deben de ser tomadas en cuenta. Aunque existen comparaciones directas entre la RM y el US endoanal, la RM ha mostrado un uso clínico mayor para la evaluación de la curación de fístulas, particularmente durante terapias médicas150-152.
28. Los métodos de imagenología de cortes transversales, la enterografía TC y la enterografía RM, así como la radiografía convencional (estudio de tránsito intestinal con o sin enteroclisis), son altamente sensibles y específicos para el diagnóstico de estenosis del intestino delgado. Nivel de evidencia: 2. Nivel de acuerdo: 82%. La precisión diagnóstica de la enterografía RM y la enterografía TC para estenosis se basa en el uso del contraste luminal. La enterografía TC, el US abdominal y la enterografía RM pueden ayudar a diferenciar entre estenosis inflamatorias o predominantemente fibróticas. Nivel de evidencia: 5. Nivel de acuerdo: 82%.
29. Las biopsias del tracto gastrointestinal son una necesidad, pero los hallazgos histopatológicos no son siempre concluyentes para el diagnóstico de la EII. Nivel de evidencia: 5. Nivel de acuerdo: 82%.
Antes de iniciar cualquier tipo de tratamiento, es importante realizar un examen histológico en pacientes con sospecha de EII. Esto facilita el diagnóstico adecuado y excluye cambios de morfología inducidos por ciertos medicamentos. El diagnóstico histopatológico no puede ser establecido si la cantidad de biopsias es baja, la biopsia no está bien determinada u obtenida de todos los segmentos, o si no existen suficientes parámetros clínicos, endoscópicos o histológicos para establecer el diagnóstico.
30. Las muestras enviadas para el análisis histológico deben estar acompañadas por la historia clínica del paciente, su edad, la duración de la enfermedad, el tipo y la duración del tratamiento de comorbilidad, así como por una descripción de los hallazgos endoscópicos. Nivel de evidencia: 5. Nivel de acuerdo: 91%.
El diagnóstico de la EII se basa en un abordaje multidisciplinario, asociado a la historia clínica, la exploración física, los exámenes de laboratorio, los datos endoscópicos e histológicos típicos, y los hallazgos radiológicos. El examen histológico de las muestras endoscópicas o piezas de resección es un paso clave en la evaluación de los pacientes afectados. También puede utilizarse para el diagnóstico diferencial50,153. La información necesaria deberá incluir datos demográficos, características de la enfermedad, duración de la enfermedad, comorbilidades, viajes recientes, hallazgos endoscópicos y cualquier información del tratamiento.
31. Para una evaluación basal adecuada de la EII, el material del íleon terminal, así como las muestras seriales del colon y recto, deben de ser colectadas en viales separados. Al menos 2 muestras deben ser recolectadas por segmento. Las áreas de mucosa normal y anormal deben de ser empaquetadas en viales separados. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
En pacientes con sospecha de EII, el análisis histológico de las muestras obtenidas de segmentos inflamados debe realizarse antes de comenzar el tratamiento para que así sea posible establecer un diagnóstico adecuado. El diagnóstico se basa en el análisis de una serie completa de biopsias colonoscópicas67. Se requiere de biopsias rectales para descartar o confirmar la afectación rectal y ayudar en su distinción de otras lesiones inflamatorias. La distribución atípica de lesiones, tales como la inflamación periapendicular, asociada con colitis izquierda, es detectable únicamente a través de este método154. También deben realizarse biopsias del íleon terminal para así confirmar la sospecha de EC o hacer un diagnóstico diferencial con la ileítis por reflujo, la cual se da en pacientes con CUCI. Las muestras deben de ser colectadas en viales separados para facilitar el diagnóstico de afectación discontinua de la EC, así como su localización155. Las muestras deben de ser fijadas inmediatamente en 10% formol. No se recomienda el uso de papel de filtro o cualquier producto similar. La inclusión correcta en parafina es esencial para el diagnóstico (facilitado por la tinción de los fragmentos antes de procesarlos), ya que previene secciones tangenciales. Se recomienda múltiples cortes para detectar cambios focales.
32. El siguiente criterio microscópico debe considerarse para la EC de íleo y colon (en biopsias endoscópicas): inflamación crónica focal, distorsión de las criptas de forma discontinua y granulomas (sin relación a la lesión de cripta). Nivel de evidencia: 2. Nivel de acuerdo: 100%.
Para ayudar a establecer el diagnóstico de la EC debe evaluarse una gran variedad de características microscópicas. El incremento variable en celularidad (linfocitos y células plasmáticas) en la lámina propia debe considerarse como una inflamación focal (discontinua). Se puede ver tal inflamación en una muestra de biopsia. La inflamación focal se caracteriza como un incremento localizado en células redondas con o sin infiltración de granulocitos, confinadas a uno o más focos. Este proceso inflamatorio puede ocurrir contra el fondo normal de células redondas o asociado con grados variantes de inflamación que pueden infiltrar la submucosa54. La irregularidad de la cripta (la distorsión y la ramificación, y el acortamiento de la cripta) puede ocurrir, independiente del grado del proceso inflamatorio54.
El granuloma (colección de histiocitos epitelioides con límites no bien definidos) se considera como la característica patognomónica de la EC, pero solo en la lámina propia. No está relacionado con lesiones de cripta. Los granulomas no caseificantes, colecciones pequeñas de histiocitos epitelioides, y de células gigantes, o células gigantes aisladas, pueden ser observadas en varios tipos de colitis infecciosa. En muestras de resección intestinal, la presencia de agregados linfoides transmurales, principalmente fuera de las áreas ulceradas, y granulomas no relacionados con lesiones de cripta es una característica típica de la EC54. Deben evaluarse una gran variedad de características microscópicas para ayudar a establecer el diagnóstico de la EC. La naturaleza irregular de la inflamación también puede ser observada en la resolución de la CUCI activa en gente joven con CUCI (< 10 años) y en pacientes adultos con EC sin tratamiento41,156,157.
Se ha indicado que el diagnóstico de la EC a partir del material quirúrgico o biopsias endoscópicas sea establecido cuando estén presentes 3 características histológicas en la ausencia de granulomas, o cuando un granuloma epitelioide esté presente con otras características histológicas, después de la exclusión de infecciones específicas. La segunda característica puede ser inflamación focal o, preferiblemente, anormalidades arquitecturales54.
33. En el análisis histológico basal, el patólogo debe realizar el diagnóstico diferencial de EII y otras enfermedades intestinales, incluyendo la EC y la colitis ulcerosa. La discriminación entre la EC colónica y la colitis ulcerosa no es siempre posible. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
En general, el diagnóstico de la EII depende de la evaluación compleja de varios cambios microscópicos y su distribución topográfica. La discriminación precisa entre EC y CUCI aún no es óptima entre patólogos gastrointestinales expertos, con un diagnóstico correcto en el 64% de los casos con EC y el 74% de los casos con CUCI. Una Junta Internacional de Patólogos Gastrointestinales Expertos concluyó que: 1) biopsias múltiples son necesarias para establecer un diagnóstico preciso de la EII; 2) biopsias rectales por sí solas no son diagnósticas; 3) la precisión diagnóstica global de los criterios endoscópicos y las guías entre patólogos puede mejorar la precisión diagnóstica, especialmente en la EC. Varios de los parámetros útiles que contribuyen al diagnóstico de la EC en piezas quirúrgicas no están presentes en las muestras colectadas por biopsias endoscópicas (inflamación transmural, fibrosis, fístula), y 4) la mayoría de las lesiones de la CUCI están limitadas a la mucosa y submucosa, y pueden ser detectadas en biopsias endoscópicas154,158. La descripción macroscópica de la pieza reseccionada en la CUCI es caracterizada por un proceso inflamatorio continuo con una extensión proximal desde el recto. Sin embargo, puede haber un patrón poco común sin inflamación en el recto o ileítis por reflujo.
34. Lo siguiente debe considerarse como criterios microscópicos de la CUCI: la distorsión esparcida de arquitectura de criptas, inflamación continua de la mucosa con plasmocitosis basal, con o sin asociación con criptitis y abscesos de criptas, y una reducción marcada de células caliciformes. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
El proceso crónico con arquitectura distorsionada e infiltración inflamatoria limitada a la mucosa es una característica microscópica mayor de la CUCI. La ausencia de fisuras, la arquitectura irregular y distorsionada de las vellosidades, y la ramificación y atrofia de criptas son muy comunes en la CUCI54. La infiltración inflamatoria es continua con una severidad incrementada hacia el recto. La celularidad es más alta en la mucosa comparada con la submucosa y está comprendida por linfocitos, células plasmáticas y neutrófilos que causan criptitis (presencia de neutrófilos dentro del epitelio de la cripta) y abscesos de cripta (presencia de neutrófilos dentro de las luces de la cripta)54. La distinción entre el primer ataque de CUCI y la colitis infecciosa puede hacerse cuando existe una presencia predominante de células plasmáticas entre la base de las criptas y la muscularis mucosae (plasmocitosis basal) en la CUCI (63% vs. 6%). Esta característica poco común puede ser observada en la EC. La supresión de la mucina epitelial es una característica diagnóstica menor, la cual también puede ser detectada en la colitis infecciosa y la EC159. Otras características relacionadas con un proceso inflamatorio crónico que se pueden observar son: seudopólipos inflamatorios, hipertrofia muscular de la mucosa, y rara vez, fibrosis de la submucosa. Una observación importante relacionada con las características morfológicas es que pueden cambiar, dependiendo de la edad del paciente, la duración de la enfermedad y el tratamiento previo54.
El reporte del patólogo debe contener una descripción microscópica basada en un mínimo de elementos para justificar el diagnóstico de la EII. No se requiere del uso de una clasificación específica.
35. La displasia (neoplasia intraepitelial) asociada con colitis ocurre solo en áreas de inflamación crónica y puede ser dividida en categorías morfológicas: negativa, indefinida y positiva para displasia de bajo o alto grado. Se recomienda la confirmación de displasia por un patólogo GI experto independiente. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
El concepto de displasia es epitelio neoplásico histológico sin invasión160 y es el mejor y más confiable marcador de riesgo aumentado de la progresión a neoplasia en pacientes con CUCI161. La displasia puede ocurrir en cualquier parte del colon y es a menudo multifocal, pero puede también ser un foco aislado. Sin embargo, la displasia debe considerarse relacionada con EII si se desarrolla dentro de las áreas con inflamación crónica161,162. La displasia se estratifica en 3 categorías: negativa para displasia, indefinida para displasia y positiva para displasia (de grado bajo y alto)160. Los parámetros microscópicos utilizados en el diagnóstico de displasia incluyen: hacinamiento de glándulas, engrosamiento de la mucosa y elongación y distorsión de las criptas, con brotes excesivos y agrandamiento. La superficie y las criptas están bordeadas por células columnares altas, en las cuales hay algo de diferenciación de la mucosa. La mucina tiende a permanecer en las células columnares más que en las células caliciformes normales. Las alteraciones nucleares son similares a aquellas observadas en los adenomas tubulares de pacientes sin EII (núcleos hipercromáticos y alargados, y sobreposición frecuente de estratificación nuclear). Los núcleos mitóticos pueden estar presentes dentro de la parte superior de las criptas y hasta en la superficie (lo cual es anormal)160.
Debe haber una segunda opinión sobre el reporte histopatológico (revisión de placas y bloques de muestras colectadas) para confirmar el diagnóstico inicial de displasia establecido por el patólogo experto162,163.
Existe un mayor nivel de acuerdo entre patólogos gastrointestinales cuando la displasia es de alto grado o negativa, pero es bajo para la displasia de grado bajo o indefinida164. La detección inmunohistoquímica de P53 no es útil en la EII para la diferenciación entre regeneración y displasia verdadera debido a su alta frecuencia de falsos positivos54.
TratamientoA. Convencional36. El tratamiento con aminosalicilatos tópicos en dosis de 1g/día se recomienda como primera elección para inducir remisión en pacientes con proctitis activa leve a moderada. Nivel de evidencia: 1b. Nivel de acuerdo: 100%.
En un metaanálisis de 38 estudios en pacientes con CUCI leve a moderada165, 10 estudios compararon el 5-ASA rectal con placebo y demostraron que los fármacos tópicos 5-ASA son más efectivos que placebo, con una OR para remisión clínica de 8.30 (8 estudios, intervalo de confianza del 95% [IC 95%]: 4.28-16.12; p<0.00001) y una OR para remisión endoscópica de 5.31 (7 estudios, IC 95%: 3.15-8.92; p<0.00001). Los 5-ASA por vía rectal fueron superiores a los esteroides rectales en la inducción de remisión sintomática, OR de 1.65 (6 estudios, IC 95%: 1.11-2.45; p=0.01). No hubo diferencia entre dosis de 1-4g, independiente del uso de supositorio, enema o espuma.
El 5-ASA tópico es más efectivo que 5-ASA por vía oral para la proctitis ulcerosa166. Un reciente estudio controlado aleatorizado mostró que el supositorio 5-ASA logró una remisión endoscópica del 83.8% en 4 semanas, comparado con el 36.1% con placebo167.
Un consenso reciente168 indica que es preferible utilizar 5-ASA en supositorios para pacientes con proctitis ulcerosa en dosis no excedentes de 1g/día. Para pacientes con proctosigmoiditis ulcerosa y colitis izquierda activa, es preferible utilizar 5-ASA en enemas o espuma169,170.
37. El tratamiento con aminosalicilatos por orales en dosis entre 3.0 y 4.8 g por día o sulfasalazina 4.5 g por día se recomienda para la inducción de remisión en pacientes con CUCI activa leve a moderada, con cualquier extensión más allá del recto. Nivel de evidencia: 1a. Nivel de acuerdo: 100%.
Hay evidencia clínica que demuestra la eficacia de los aminosalicilatos orales en la CUCI leve a moderada. Dos metaanálisis con 8 y 11 estudios mostraron eficacia para la inducción de remisión con un RR de 0.86 (IC 95%: 0.81-0.91) y 0.79 (IC 95%: 0.73-0.85), respectivamente171,172. En cuanto a las dosis, 2.0g/día fue superior a una dosis<2g/día, pero se encontró una diferencia no significativa entre dosis de 2.4 y 4.8g/día. Sin embargo, un análisis de subgrupo en pacientes con actividad moderada mostró que estos pacientes se vieron beneficiados por dosis más altas173-175. Vale la pena mencionar que cuando la variable analizada era remisión endoscópica, las dosis de 3g/día o mayores eran más eficientes176. La sulfasalazina fue tan efectiva como los diferentes salicilatos utilizados en la inducción de remisión177. Los pacientes con CUCI deben de ser evaluados dentro de 4-8 semanas después de comenzar el tratamiento con 5-ASA y, si no hay respuesta sintomática, la necesidad de modificar el tratamiento debe considerarse168.
No se han encontrado diferencias significativas entre los fármacos 5-ASA y placebo en la incidencia de efectos adversos178. Sin embargo, el 15% de los pacientes no toleran estos medicamentos. Los efectos adversos incluyen flatulencia, dolor abdominal, náuseas, diarrea, cefalea, deterioro clínico de la CUCI, irritación de la piel y trombocitopenia. La insuficiencia renal idiosincrática ha sido descrita, entonces se recomienda la evaluación de la función renal antes y durante el tratamiento con estos medicamentos179.
38. El tratamiento concomitante con aminosalicilatos orales y tópicos es superior a los aminosalicilatos orales como tratamiento de primera línea para la inducción de remisión en pacientes con CUCI activa leve a moderada, con cualquier extensión más allá del recto. Nivel de evidencia: 1b. Nivel de acuerdo: 100%.
Un metaanálisis con 4 estudios controlados aleatorizados mostró que la combinación de 5-ASA tópico y oral era superior a 5-ASA oral para la inducción de remisión de la CUCI activa con cualquier extensión más allá del recto, con un RR de 0.65 (IC 95%: 0.47-0.91)166. No se encontró una diferencia significativa en efectos adversos entre los 2 grupos, 22.3 y 26.9%, respectivamente, RR 0.77 (IC 95%: 0.55-1.09). Un reciente consenso recomienda que pacientes con CUCI en tratamiento con 5-ASA sean evaluados si no hay respuesta sintomática en 4-8 semanas para determinar si es necesario modificar el tratamiento168. En pacientes con CUCI leve a moderada que no responden a tratamiento con aminosalicilatos orales, no se indica cambiar a otra clase de fármaco 5-ASA, ya que, en términos de seguridad, no se han encontrado diferencias significativas con respecto a la eficacia clínica entre las diferentes clases de agentes 5-ASA180.
39. Una dosis diaria de aminosalicilatos orales puede ser utilizada para inducir y mantener la remisión clínica en pacientes con CUCI y así mejorar la adherencia al tratamiento. Nivel de evidencia: 1b. Nivel de acuerdo: 80%.
Un metaanálisis con 3 estudios no mostró una diferencia significativa entre el uso de una única dosis de 5-ASA y dosis múltiples por día para la inducción de remisión, con un RR de 0.95 (IC 95%: 0.82-1.10)181. Un estudio adicional reciente reportó cero diferencias en tasas de remisión o seguridad entre una dosis diaria o 2 veces al día con 5-ASA oral182. En el mantenimiento de la remisión, un metaanálisis con 7 estudios demostró que no hubo una diferencia significativa en la tasa de recaída al comparar una sola dosis diaria con la dosis convencional, RR 0.94 (IC 95%: 0.82-1.08). Adicionalmente, no se encontró una diferencia significativa en cuanto a efectos adversos183. La mayoría de los pacientes prefiere una dosis única al día, lo cual resulta en una adherencia al tratamiento aumentada, especialmente durante la fase de mantenimiento184,185.
40. En los pacientes con CUCI leve a moderada que logran una remisión clínica con aminosalicilatos orales o tópicos, se recomienda continuar con la misma terapia para el mantenimiento de la remisión completa. La dosis recomendada de 5-ASA oral debe ser individualizada para cada caso y la dosis recomendada es al menos 2g/día. Nivel de evidencia: 1b. Nivel de acuerdo: 100%.
Existe un alto riesgo de recaída en sujetos con CUCI, entonces la terapia de mantenimiento es necesaria en estos pacientes. Un metaanálisis Cochrane mostró un OR de 0.47 (IC 95%: 0.36-0.62), con un número necesario a tratar (NNT) de 6, a favor de 5-ASA oral, comparado con placebo, para el mantenimiento de la remisión clínica186. Ambos, la sulfasalazina y mesalazina, son claramente más efectivos que el placebo en la prevención de recaídas de CUCI, sin diferencias significativas entre ellas177. La dosis ideal de sulfasalazina para el mantenimiento es de 2g diarios. No hay evidencia de que las dosis superiores a 2g/día de mesalazina sean más efectivas, pero debe mencionarse que se ha estudiado en una cantidad muy limitada de pacientes el tratamiento con dosis más elevadas187. Un metaanálisis de 7 estudios para el mantenimiento con 5-ASA rectal encontró un RR para recaída de 0.60 (IC 95%: 0.49-0.73) y un NNT de 3. En comparación con el placebo, no hubo diferencia para efectos adversos188. Un reciente consenso indica que 5-ASA rectal puede ser utilizado diariamente o a una frecuencia reducida para mantener remisión completa168.
41. En pacientes con CUCI moderada a severa de cualquier extensión, se indica el uso de esteroides sistémicos orales como tratamiento de primera línea para la inducción de la remisión clínica. Se recomienda el uso de esteroides sistémicos orales como terapia de segunda línea para la inducción de remisión de pacientes con CUCI activa leve a moderada que son resistentes a los aminosalicilatos. No se recomienda el uso de esteroides sistémicos orales por más de 12 semanas. Los esteroides no son de utilidad en la terapia de mantenimiento de remisión en la CUCI. Además, su uso prolongado se asocia con efectos adversos. Nivel de evidencia: 1b. Nivel de acuerdo: 100%.
Un metaanálisis con 5 estudios controlados aleatorizados mostró que los esteroides son superiores a placebos para la inducción de remisión en pacientes con CUCI, RR 0.65 (IC 95%: 0.45-0.93)189. Una revisión sistemática reportó que no hubo beneficios con las dosis arriba de 60mg/día. Por lo tanto, se indica utilizar dosis de prednisona oral de entre 40-60mg/día165. Aproximadamente, el 50% de pacientes utilizando esteroides experimentan efectos adversos tales como acné, edema, fluctuaciones en el estado de ánimo, intolerancia a la glucosa y dispepsia, entre otros190. Un consenso canadiense reciente recomienda la evaluación de pacientes con CUCI en el tratamiento con esteroides para la inducción de remisión que no tienen respuesta sintomática, para que la modificación a la necesidad de tratamiento pueda determinarse168.
42. Los esteroides rectales se indican como terapia de segunda línea para la inducción de remisión completa en pacientes con proctitis ulcerosa leve a moderada que no responden a 5-ASA tópico. Nivel de evidencia: 1b. Nivel de acuerdo: 91%.
Un metaanálisis sobre los esteroides convencionales y budesonida rectal mostró que la terapia con esteroides rectal era superior a placebo en la inducción de la remisión clínica. Sin embargo, un metaanálisis de 6 estudios controlados aleatorizados mostró que 5-ASA rectal era superior a los esteroides rectales para la inducción de la remisión clínica, con un OR de 1.65 (IC 95%: 1.41-2.88 p=0.0001)165. Por lo tanto, una terapia de segunda línea razonable para pacientes que no responden a 5-ASA rectal puede ser la adición de esteroides rectales. Un estudio reciente con espuma de budesonida demostró eficacia en la inducción de remisión en pacientes con proctitis ulcerosa activa leve a moderada y proctosigmoiditis, comparado con placebo190.
43. El uso de esteroides orales novedosos de biodisponibilidad baja, como la budesonida multi-matrix (MMX), se indica para la inducción de remisión en pacientes con CUCI activa leve a moderada de cualquier extensión que es resistente a los aminosalicilatos. Esto puede intentarse antes del uso de esteroides sistémicos. Nivel de evidencia: 1. Nivel de acuerdo: 91%.
Estudios controlados aleatorizados con budesonida MMX oral han mostrado que esta es más efectiva que el placebo e igual de efectiva que 5-ASA oral para la inducción de la remisión clínica191-193. Sin embargo, esto no se ha demostrado con otras formulaciones de liberación ileal de budesonida, como Entocort® y Budenofalk®, cuya efectividad era más baja que placebo y 5-ASA194,195. Comparada con esteroides convencionales, la budesonida tiene menos eventos adversos sistémicos (33% vs. 55%)196 y no se ha asociado con una disminución significativa en la densidad mineral ósea197.
44. El uso de esteroides sistémicos IV, como hidrocortisona 100mg cada 6 a 8 h o metilprednisolona 60mg por día, se recomienda para la inducción de remisión en pacientes con CUCI severa aguda que requieren hospitalización. Nivel de evidencia: 2b. Nivel de acuerdo: 100%.
Se ha demostrado que los esteroides IV son efectivos como un tratamiento de primera línea para la CUCI severa aguda, con remisión clínica en 36 de 49 pacientes (73.5%), después de 5 días de tratamiento198. Estudios subsecuentes han mostrado que los esteroides IV reducen la morbimortalidad en esta población de pacientes199,200. Con respecto a la tasa de colectomía, no se encontraron diferencias en cuanto a la eficacia de los diferentes tipos de esteroides o las dosis empleadas. Consecuentemente, no se recomienda utilizar una dosis de metilprednisolona IV superior a 60mg o su equivalente199. Un estudio que comparó el uso de un bolo IV de metilprednisolona cada 12h con su infusión continua no mostró diferencias significativas en cuanto a la respuesta o eventos adversos entre los 2 regímenes201.
45. Los inmunomoduladores de tiopurina no son recomendados para la inducción de remisión en pacientes con CUCI corticorresistente activa leve a moderada. Nivel de evidencia: 1b. Nivel de acuerdo: 100%.
Un metaanálisis de 4 estudios controlados mostró que la azatioprina y 6-mercaptopurina no eran efectivas para la inducción de remisión en pacientes con CUCI, en comparación con placebo o 5-ASA (OR 1.59, IC 95%: 0.59-4.29; p=NS)202. Un análisis de los 2 estudios comparado con placebo203 no encontró un beneficio significativo en la remisión endoscópica (RR 0.85; IC 95%: 0.71-1.01)204 o la remisión clínica (OR 1.44, IC 95%: 0.68-3.03, p=NS). Un estudio italiano mostró que la azatioprina era más efectiva que 5-ASA en la inducción de remisión completa libre de esteroides en el grupo de pacientes con CUCI dependiente de esteroides (OR: 4.78; IC 95%: 1.57-14.5, p=0.006)205.
46. El uso de inmunosupresores de tiopurina se recomienda para el mantenimiento de remisión en pacientes con CUCI corticodependiente. Nivel de evidencia: 1b. Nivel de acuerdo: 100%.
Un metaanálisis de 4 estudios controlados aleatorizados encontró que el 44% de los pacientes que reciben azatioprina no lograron mantener remisión, comparado con el 65% de pacientes que recibieron placebo, RR: 0.68 (IC 95%: 0.54-0.86)206. Se encontraron resultados similares en otro metaanálisis de 3 estudios, RR 0.60 (IC 95%: 0.37-0.95)204. La calidad de estos estudios era insuficiente, con una cantidad reducida de pacientes y heterogeneidad. Entre los eventos adversos asociados con el uso de la tiopurina están la supresión de médula ósea, la pancreatitis, la hepatotoxicidad, las reacciones alérgicas y las infecciones oportunistas, especialmente cuando el fármaco es combinado con esteroides o inhibidores del factor necrosis tumoral alfa207. Adicionalmente, existe un riesgo de linfoma (incluyendo el linfoma hepatoesplénico de células T)208 y cáncer de piel no melanoma209. La respuesta a las tiopurinas debe evaluarse en 10-12 semanas. Idealmente, los niveles de la enzima tiopurina metiltransferasa deben medirse antes de comenzar el uso de tiopurinas, para así identificar a los pacientes con riesgo de mielosupresión. Esto no reemplaza la monitorización continua de la biometría hemática completa en estos pacientes207. El uso de metotrexato no es recomendado para la inducción o el mantenimiento de la remisión clínica completa en pacientes con CUCI.
47. Se recomienda la ciclosporina IV, en centros con experiencia en su uso, a una dosis de 2mg/kg para la inducción de remisión en pacientes con CUCI activa severa refractaria a los esteroides sistémicos IV. Nivel de evidencia: 1b. Nivel de acuerdo: 100%.
La ciclosporina es un inhibidor de calcineurina y tradicionalmente se ha utilizado como un agente de segunda línea IV en pacientes con CUCI aguda a severa que son refractarios a esteroides IV. En un estudio controlado por placebo aleatorizado, a 20 pacientes que no habían respondido a tratamiento con esteroides IV por 7 días se les dio ciclosporina en dosis de 4mg/kg/día. El 82% de los pacientes respondieron, comparado con el 0% en el grupo placebo (p<0.001)210.
Otro estudio controlado aleatorizado comparó las dosis de ciclosporina de 4mg/kg/día vs. 2mg/kg/día. No se encontraron diferencias significativas en términos de respuesta clínica y el efecto adverso principal en el grupo con la dosis más alta fue presión arterial alta211. Una revisión Cochrane con 2 estudios controlados y aleatorizados mostró que en pacientes con CUCI severa la falta de respuesta al tratamiento médico era menos frecuente con la ciclosporina, cuando se comparó con placebo, RR 0.18 (IC 95%: 0.05-0.64)210. En estudios controlados por ciclosporina, la proporción de pacientes que evitaron colectomía a plazo corto varió del 64 al 90%. Sin embargo, la tasa de colectomía a largo plazo en sujetos con respuesta fue del 20% al año, y del 69% a los 5 años212,213.
48. Como tratamiento de primera elección de la EC ileocecal localizada leve, se recomienda el uso de budesonida de liberación ileal a una dosis de 9mg/día. Nivel de evidencia: 1a. Nivel de acuerdo: 82%. El beneficio de la mesalazina es limitada. Nivel de evidencia: 1b. Nivel de acuerdo: 82%. Se indica que pacientes con EC colónica y actividad leve pueden ser tratados con sulfasalazina. Nivel de evidencia: 1b. Nivel de acuerdo: 82%.
Un porcentaje significativo de pacientes con EC tiene un patrón de comportamiento leve de la enfermedad. La budesonida a una dosis de 9mg/día es la terapia de elección para la inducción de remisión en pacientes con EC con actividad leve y localización íleo-colónica. Estudios clínicos han mostrado que la budesonida es superior al placebo (RR 1.96, IC 95%: 1.19-3.23) y mesalazina (RR 1.63, IC 95%: 1.23-2.16)214. Se prefiere la budesonida a la prednisolona porque es asociada con eventos adversos menores (RR 0.64, IC 95%: 0.28-0.95). La tasa de remisión con budesonida es del 51-60% en 8-10 semanas, según varios estudios215,216.
Un metaanálisis de 3 ensayos clínicos grandes no encontró una eficacia clínica significativa con mesalazina en pacientes con EC ileocecal de actividad leve a moderada217. Un metaanálisis más reciente encontró una tendencia hacia un efecto benéfico relacionado con el uso de la sulfasalazina, en comparación con placebo (2 estudios), con un RR de fracaso en lograr remisión de 0.83 (IC 95%: 0.69-1.00). Una revisión sistemática y un metaanálisis de ensayos controlados aleatorizados reportaron ningún beneficio con mesalazina (4 estudios) RR: 0.91 (IC 95%: 0.77-1.06)218.
49. El uso de corticoides sistémicos orales es recomendado para la inducción de remisión en pacientes con EC activa, ileocecal o colónica, moderada a severa. Nivel de evidencia: 1a. Nivel de acuerdo: 100%.
La prednisolona es una opción apropiada para la EC leve a severa. Una revisión sistemática Cochrane con 2 estudios mostró que los corticoides son más efectivos que placebo para la inducción de remisión, con un RR de 1.99 (IC 95%: 1.51-2.64, p<0.00001). La idea es minimizar la exposición prolongada con esteroides en pacientes con EC, dada la falta de eficacia en el mantenimiento de remisión219.
50. El uso de corticoides sistémicos orales es recomendado para la inducción de remisión en pacientes con EC del intestino delgado extensa. Se indica asociar el uso de tiopurinas o metotrexato para el mantenimiento de remisión. Nivel de evidencia: 5. Nivel de acuerdo: 100%.
La EC se define como extensa cuando la afectación excede los 100cm en longitud, la cual se asocia a deficiencias nutricionales. En estos pacientes, el tratamiento con esteroides sistémicos es recomendado, algunas veces asociado con tiopurinas o terapia biológica anti-FNT, dependiendo de la severidad de la enfermedad196. El apoyo nutricional es importante en el tratamiento de estos individuos220. En este grupo de pacientes, la opción quirúrgica siempre debe considerarse.
51. En pacientes con EC que logran remisión con corticoides sistémicos, se recomienda el uso de tiopurinas o metotrexato. Nivel de evidencia: 1b. Nivel de acuerdo: 100%. El uso de corticoides no es recomendado como terapia de mantenimiento de remisión. Nivel de evidencia: 1a. Nivel de acuerdo: 100%.
Un metaanálisis de 6 estudios clínicos comparó azatioprina con placebo y encontró una tasa de remisión del 71% vs. 52%, respectivamente (OR 2.32; IC 95%: 1.55-3.49, con NNT: 6, para prevenir recaída), con un efecto de respuesta a dosis de 1mg/kg/día (OR: 1.2; IC 95%: 0.60-2.41), 2mg/kg/día (OR 3.01; IC 95%: 1.66-5.45) y 2.5mg/kg/día (OR 4.13; IC 95%: 1.59-10.71)221.
Un estudio comparó metotrexato a dosis de 15mg por semana, por vía intramuscular vs. placebo, para el mantenimiento de la remisión en pacientes con EC. A las 40 semanas, las tasas de remisión eran del 65% vs. 39% (p=0.04), respectivamente222. Un metaanálisis de 12 estudios por Seow et al. mostró que la budesonida a dosis de 6mg/día no era más efectiva que el placebo en el mantenimiento de remisión a los 3 meses (RR 1.25, IC 95%: 1.00-1.58; p=0.05), 6 meses (RR 1.15, IC 95%: 0.95-1.39; p=0.14) o 12 meses (RR 1.13, IC 95%: 0.94-1.35; p=0.19)214.
B. Tratamiento biológico52. La terapia biológica contra el FNT alfa (anti-FNT-α), como infliximab, adalimumab, y certolizumab pegol, es indicada en pacientes con EC moderada a severa que han sido refractarios o intolerantes al tratamiento con esteroides e inmunomoduladores. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
El estudio ACCENT 1 evaluó la eficacia y la seguridad de infliximab en pacientes con EC a través de un ensayo multicéntrico, aleatorizado, doble ciego, controlado por placebo, de 54 semanas que involucró a 573 pacientes con un puntaje del IAEC>220. Un total de 335 pacientes que respondieron a dosis de inducción fueron aleatorizados en 3 grupos: grupo i con placebo; grupo ii con infliximab con dosis de mantenimiento de 5mg/kg, y grupo iii con infliximab con dosis de mantenimiento de 10mg/kg.
A las semanas 30 y 54, la proporción de pacientes en remisión fue más alta en los grupos de infliximab ii (39%) y iii (45%), comparado con el grupo i (21%) (p=0.002). No se encontró diferencia en las tasas de remisión entre los grupos recibiendo 5mg/kg y 10mg/kg de infliximab. A la semana 54, el 29% de los pacientes en los grupos de infliximab estaban en remisión clínica y habían descontinuado su tratamiento con corticoides, en comparación con el 9% en el grupo placebo (p=0.004). Este ensayo mostró que la administración de infliximab era efectiva y segura en pacientes con EC95.
El estudio CLASSIC 1 fue un ensayo multicéntrico, aleatorizado, doble ciego, controlado por placebo, con diferentes rangos de dosis de inducción. En este estudio, pacientes con EC moderada a severa sin previa terapia anti-FNT recibieron terapia de inducción en las semanas 0 y 2 con adalimumab 40/20mg, 80/40mg, 160/80mg o placebo, y tuvieron seguimiento a la semana 4.
El resultado primario medido de este estudio fue la eficacia de terapia de inducción con adalimumab en pacientes con EC. Un total de 299 pacientes fueron aleatorizados en la semana 0 para recibir inducción con placebo, adalimumab 40mg/20mg, adalimumab 80mg/40mg o adalimumab 160mg/80mg. Se encontró una diferencia estadísticamente significativa (p=0.004) en las tasas de remisión entre los grupos de pacientes que recibieron adalimumab 80/40mg (24%), adalimumab 160/80mg (36%) o placebo (12%) en la semana 4. Este estudio mostró que la dosis de inducción 160/80mg de adalimumab fue superior a las otras dosis de adalimumab y placebo en pacientes con actividad de la EC moderada a severa223.
El estudio CLASSIC II incluyó a pacientes que lograron remisión después de una inducción de 4 semanas en el estudio CLASSIC I y que también mantuvieron remisión por 4 semanas adicionales (semanas 0 y 4 de CLASSIC II) con dosis de adalimumab de 40mg cada 2 semanas, en la fase de etiqueta abierta. Los pacientes fueron subsecuentemente aleatorizados para recibir adalimumab o placebo por otras 56 semanas en un ensayo doble ciego.
De un total de 256 pacientes, hubo una diferencia significativa en la tasa de remisión entre los grupos tratados con 40mg de adalimumab cada 2 semanas (79%) y 40mg de adalimumab cada semana (83%), comparado con placebo (44%) (p<0.05).
Los resultados de este estudio apoyan la eficacia de adalimumab en la inducción y el mantenimiento de remisión en pacientes con EC moderada a severa sin previa terapia con infliximab. La terapia con adalimumab resultó en un incremento de remisión clínica en el 46% de los pacientes a la semana 56224.
El estudio CHARM, un ensayo de fase 3, aleatorizado, doble ciego, controlado por placebo, de 56 semanas de duración, evaluó la eficacia y la seguridad de adalimumab en el mantenimiento de respuesta, así como remisión, en pacientes con EC moderada a severa. En la primera visita, todos los pacientes recibieron una dosis de etiqueta abierta de adalimumab de 80mg, seguida de una dosis de 40mg en la semana 2. En esa semana, 778 pacientes fueron aleatorizados en 3 grupos: adalimumab 40mg cada 2 semanas, adalimumab 40mg cada semana o placebo, y continuaron hasta la semana 56. El porcentaje de pacientes que respondieron a la semana 4 y estuvieron en remisión a la semana 56 fue: 36% adalimumab 40mg cada 2 semanas, 41% adalimumab 40mg semanalmente y 12% placebo (p<0.001). La diferencia entre los grupos de adalimumab no fue estadísticamente significativa (p=0.34). Los resultados de este ensayo confirman que adalimumab es más efectivo que el placebo en el mantenimiento de remisión a largo plazo en pacientes con EC moderada a severa que respondieron inicialmente a adalimumab225.
El objetivo del estudio ADHERE fue evaluar el efecto a largo plazo de la terapia con adalimumab a los 2 años en un ensayo abierto, como una extensión del ensayo CHARM, e incluyó a 467 pacientes. A la semana 60, la remisión clínica fue del 37.6, el 41.9% y el 49.8% en pacientes que recibieron placebo, adalimumab 40mg cada 2 semanas y adalimumab 40mg cada semana, respectivamente. Un total de 84.1% de pacientes que recibieron adalimumab en el ensayo CHARM mantuvieron remisión hasta el final del estudio ADHERE.
Este estudio mostró que la terapia con adalimumab puede mantener la remisión a largo plazo y reducir la cantidad de hospitalizaciones en pacientes con EC moderada a severa226.
El propósito del estudio GAIN fue determinar la eficacia de adalimumab en pacientes con EC que no mejoraron o que perdieron la capacidad de responder a infliximab. El ensayo incluyó a 325 pacientes con EC moderada a severa que fueron aleatorizados para recibir dosis de inducción de adalimumab 160/80mg a la semana 0 y 2 o placebo durante 4 semanas. Al final de la semana 4, el 21% del grupo de adalimumab logró remisión clínica, comparado con el 7% de pacientes en el grupo placebo (p<0.001). La terapia con adalimumab fue superior a placebo para la inducción de remisión y repuesta en pacientes con EC moderada a severa que no toleraron infliximab o que perdieron la capacidad de responder a infliximab227.
El estudio PRECISE 1 fue un ensayo de 26 semanas, multicéntrico, aleatorizado, doble ciego, controlado por placebo. Un total de 662 pacientes con EC fueron divididos en 2 grupos: 1) certolizumab pegol 400mg, y 2) placebo. Entre los pacientes con ≥ 10mg/l en niveles basales de PCR, el 22% en el grupo certolizumab tuvo una reducción de por lo menos 100 puntos en el IAEC a la semana 26, comparado con el 12% en el grupo placebo (p=0.05). El tratamiento con certolizumab pegol se asoció con un beneficio modesto en las tasas de respuesta, pero no hubo mejoría en las tasas de remisión comparado con placebo en pacientes con EC moderada a severa228.
El estudio PRECISE 2 fue diseñado como un estudio multicéntrico, aleatorizado, doble ciego, controlado por placebo. Evaluó la eficacia de certolizumab pegol como terapia de mantenimiento en pacientes con EC moderada a severa. En este estudio, los pacientes recibieron una dosis de etiqueta abierta de inducción de 400mg a las semanas 0, 2 y 4. Los pacientes que respondieron a la terapia de inducción a la semana 6 fueron aleatorizados para recibir 400mg de certolizumab pegol o placebo. El seguimiento se realizó a la semana 26. En total, 213 pacientes tenían niveles basales de PCR ≥ 10mg/l. Un total de 62% de pacientes en el grupo certolizumab pegol tuvieron respuesta clínica, comparado con el 34% en el grupo placebo (p<0.001). La tasa de remisión clínica fue del 48% en el grupo certolizumab pegol, comparado con el 29% con el grupo placebo (p<0.001). Este estudio mostró que la administración continua de certolizumab pegol fue superior a la administración de placebo en el 64% de los pacientes con EC moderada a severa229.
53. La terapia anti-FNT basada en infliximab y adalimumab es efectiva en el cierre de fístulas y en el mantenimiento de ese cierre en pacientes con EC. Tratamiento por antibióticos y quirúrgico puede ser requerido. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
El estudio ACCENT II196 evaluó la eficacia de infliximab en el tratamiento de la EC fistulizante. En comparación con placebo, la mayoría de los pacientes que recibió infliximab 5mg/kg respondió al tratamiento, definido como una disminución del 50% o más en el drenaje de fístula (p=0.002). Hubo una respuesta completa (cierre de fístula) en el 55% de los pacientes que recibieron infliximab 5mg/kg, comparado con el 13% de los pacientes en el grupo placebo (p=0.001).
El ensayo ACCENT II230 incluyó a pacientes con EC y fístula simple o compleja. Se observó que a la semana 54, el 23% de los pacientes en el grupo placebo tuvieron respuesta (definida como una disminución del 50% en el drenaje de fístula), comparado con el 46% de los pacientes que recibieron infliximab (p=0.001).
En un subestudio del ensayo ACCENT II231 que evaluó a los pacientes con fístula recto-vaginal, el 71.4% de los pacientes que recibieron infliximab lograron curación de la fístula, comparado con el 54.5% en el grupo placebo.
El grupo francés GETAID232 realizó un estudio retrospectivo y multicéntrico en pacientes con fístulas enterocutáneas recibiendo tratamiento anti-FNT. Mostró que únicamente el 33% de los pacientes estudiados lograron curación completa de la fístula enterocutánea. En el análisis multivariado, se asoció la falta de curación con trayectos de fístulas múltiples (cociente de riesgo [CR]: 5.80, IC 95%: 1.07-31.5, p=0.04) y con la presencia de estenosis intestinal (CR: 4.67, IC 95%: 1.05-20.82, p=0.04).
La terapia con adalimumab se ha mostrado efectiva en la inducción y el mantenimiento del cierre de fístulas perianales por un periodo mayor a 2 años225,226.
Una revisión sistemática de la literatura233 demostró que el tratamiento combinado de terapia farmacológica (anti-FNT e inmunomoduladores) y cirugía es la estrategia con las mejores tasas de curación, comparado con la terapia farmacológica o quirúrgica por sí solas.
54. Las terapias anti-FNT basadas en infliximab y adalimumab inducen curación de la mucosa en pacientes con EC y son asociadas con la remisión libre de esteroides, menores procedimientos quirúrgicos y hospitalizaciones, y mejoramiento en la calidad de vida. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
La curación de la mucosa ha sido propuesta como una meta en el tratamiento de la EII y se ha asociado con un control más efectivo de la enfermedad, una remisión libre de esteroides, menor cantidad de procedimientos quirúrgicos, menos hospitalizaciones, mejor calidad de vida y uso reducido de esteroides234,235.
Un consenso experto de la International Organization for the Study of Inflammatory Bowel Disease definió la curación de la mucosa en la CUCI como una restauración de la apariencia normal en la endoscopia de una región previamente inflamada, y la completa ausencia de úlceras, friabilidad, sangre, erosiones, y signos macroscópicos e histológicos de inflamación7,89,90,236-238.
Se llevó a cabo un subestudio endoscópico dentro del estudio ACCENT 195, mostrando a la semana 10 que el 29% de los pacientes que recibieron 3 infusiones de infliximab lograron curación de la mucosa, comparado con el 3% de pacientes que recibieron solo una infusión (p=0.006). A la semana 54, el 50% de los pacientes que recibieron el tratamiento programado de infliximab lograron completa curación, comparado con el 7% de los pacientes con tratamiento episódico (p=0.007). En el mismo estudio, los pacientes que lograron curación de la mucosa con infliximab tuvieron un periodo libre de recaídas que duró más tiempo que aquellos pacientes que no lograron curación. Ningún paciente con curación de la mucosa a las semanas 10 y 54 fue hospitalizado, en comparación con los pacientes que lograron curación solo una vez (25%) y aquellos que no lograron curación en ninguna de las semanas (46%). Todo esto indica que la curación de la mucosa predice una reducción en hospitalizaciones.
El ensayo MUSIC239 es un estudio de fase abierta utilizado para la evaluación de la mejoría endoscópica en pacientes con EC activa tratados con certolizumab pegol. A la semana 10, el 5% de los pacientes lograron curación de la mucosa.
El estudio EXTEND240 evaluó la eficacia de adalimumab en pacientes con EC. La curación de la mucosa se evaluó a la semana 52 y el 24.2% de los pacientes tratados con adalimumab lograron curación de la mucosa, comparado con el 0% de los pacientes tratados con placebo (p<0.001).
55. La terapia combinada de un agente anti-FNT (infliximab o adalimumab) con un inmunomodulador (tiopurina o metotrexato) es superior a la monoterapia con un agente anti-FNT o azatioprina en pacientes con EII, en cuanto a la respuesta y remisión clínica, curación de la mucosa y remisión libre de esteroides. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
Varios estudios indican que el tratamiento combinado de agentes anti-FNT con inmunomoduladores es más efectiva que la monoterapia con cualquiera de estos fármacos. Sin embargo, existen dudas respecto a la eficacia a largo plazo de esta estrategia terapéutica y de la seguridad de combinar 2 inmunosupresores por un periodo indefinido, especialmente en hombres jóvenes208,241,242. Hay muy poca información sobre el efecto de la terapia combinada con agentes anti-FNT que no sean infliximab, como es adalimumab, certolizumab pegol o golimumab.
Un estudio llevado a cabo por Sokol et al.243 evaluó la diferencia entre la efectividad de la terapia con infliximab y la terapia combinada con un inmunosupresor (tiopurinas o metotrexato). La terapia combinada mostró reducir el riesgo de recaída (OR: 0.50, IC 95%: 0.32-0.77) y redujo la necesidad de cirugía abdominal (OR: 0.18, IC 95%: 0.05-0.63).
Un ensayo multicéntrico, aleatorizado, doble ciego, de 30 semanas de duración llamado SONIC244, el cual se extendió 20 semanas, se llevó a cabo entre marzo del 2005 y noviembre del 2008. Un total de 508 pacientes diagnosticados con EC fueron divididos en 3 grupos de acuerdo con la terapia administrada: 1) monoterapia con azatioprina; 2) monoterapia con infliximab, y 3) terapia combinada con infliximab y azatioprina. A la semana 26, el 56.8% de los pacientes que recibieron terapia combinada se encontraban en remisión libre de esteroides, comparado con los pacientes que recibieron monoterapia con azatioprina (30%, p<0.001) y los pacientes que recibieron monoterapia con infliximab (44.4%, p=0.02). También hubo una diferencia estadísticamente significativa en la curación de la mucosa entre pacientes que recibieron terapia combinada vs. azatioprina (p<0.001) e infliximab (p=0.06). La incidencia de eventos adversos fue similar entre los 3 grupos, con ninguna diferencia significativa.
El estudio UC SUCCESS245 es un ensayo aleatorizado, doble ciego, que evaluó la eficacia de la terapia combinada de infliximab y tiopurina en pacientes con CUCI, dentro del periodo de noviembre del 2007 a febrero del 2010. A la semana 16, un porcentaje más alto de pacientes que recibieron terapia combinada lograron remisión clínica libre de esteroides, comparado con aquellos que recibieron ya sea azatioprina (p=0.32) o infliximab (p=0.017), por sí solos. Se evaluó la curación de la mucosa a la semana 16 y ocurrió en un porcentaje más alto de pacientes que recibieron la terapia combinada vs. el grupo de la monoterapia azatioprina (p=0.001). Una mejora más grande se observó en la puntuación de la Clínica Mayo total en pacientes que recibieron terapia combinada, comparado con pacientes que recibieron azatioprina (p<0.001) o infliximab (p=0.028). Los pacientes no reportaron diferencias estadísticamente significativas entre los 3 grupos respecto a los efectos adversos.
En el ensayo COMMIT246, que evaluó la eficacia de la combinación de infliximab y metotrexato, no se encontraron diferencias significativas entre aquellos pacientes y los pacientes que recibieron monoterapia con infliximab, con respecto a la remisión libre de esteroides a la semana 50 (p=0.63).
Algunos estudios han reportado que el utilizar un inmunomodulador concomitante puede reducir la formación de anticuerpos anti-FNT, permitiendo así cantidades mayores de concentración del agente, resultando en una eficacia terapéutica incrementada.
Ungar et al.247 demostraron que la terapia combinada resultó en una supervivencia más larga libre de formación de anticuerpos (p=0.003) y un periodo de remisión más largo en pacientes sin formación de anticuerpos antifármaco (AAF) que en aquellos pacientes que desarrollaron AAF (p=0.01).
Un estudio248 reportó que la combinación de terapia con anti-FNT e inmunomoduladores puede disminuir la formación de AAF.
56. En pacientes con EC con predictores de pronóstico pobre, se recomienda comenzar terapia intensiva (Top-Down), la cual consiste de iniciar la terapia anti-FNT asociada con inmunomoduladores. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
Se han identificado factores de pronóstico pobre en pacientes con EC. Por ejemplo, edad joven en el momento de diagnóstico (< 40 años de edad), patrón estenosante y fistulizante que incluye enfermedad perianal, afectación del tracto digestivo superior, enfermedad extensa (más de 70cm) y tabaquismo activo249,250.
En el estudio Top-Down99, 133 pacientes con nuevos diagnósticos de la EC fueron aleatorizados en 2 grupos: el primer grupo recibió tratamiento temprano con inmunosupresores combinados (infliximab y tiopurinas) y el segundo grupo recibió tratamiento convencional con corticoides.
A la semana 52, el 61.5% de los pacientes que recibieron tratamiento temprano con inmunosupresión estaban en remisión clínica, comparado con el 42.2% de los pacientes que recibieron tratamiento convencional (p=0.0278, IC 95%: 2.4-36.3). Después de la semana 52, no se encontraron diferencias entre los 2 grupos. A la semana 104, se encontró curación de la mucosa en el 73.1% de los pacientes con el abordaje Top-Down, comparado con el 30.4% con el protocolo Step-Up (p=0.002).
El estudio demostró que la terapia temprana con agentes inmunosupresores combinados produjo un porcentaje más grande de pacientes en remisión clínica, normalización más rápida de los niveles de la PCR e inducción de remisión en pacientes con EC no tratados previamente con corticoides, tiopurinas o fármacos biológicos, comparado con pacientes que recibieron terapia convencional.
Varios estudios de cohorte realizados en hospitales de tercer nivel de atención y en otras poblaciones han reportado que el curso de la enfermedad en hasta un 50% de pacientes con EII es benigno. Por consiguiente, este porcentaje de pacientes nunca requerirá el uso de terapia inmunosupresora o anti-FNT. Debido a los posibles efectos secundarios que la terapia anti-FNT puede tener, varios estudios indican que el tratamiento sea un protocolo Step-Up acelerado para pacientes con desenlaces pobres, para recibir el tratamiento apropiado a tiempo para prevenir complicaciones a largo plazo.
Un estudio alemán reciente251 en una cohorte prospectiva evaluó el actual tratamiento de pacientes con EII recién diagnosticada y los factores asociados con el uso de inmunosupresores y terapia anti-FNT. El uso de esteroides en el diagnóstico, la localización de la enfermedad y la necesidad de cirugía relacionada con la EII mostraron ser factores predictivos independientes para el uso de inmunosupresores y terapia anti-FNT. La extensión de la enfermedad fue el único factor predictivo encontrado en pacientes con CUCI.
57. La duración de la terapia anti-FNT en pacientes con EII aún no se define y la recomendación es tratarlos caso por caso. Se indica mantener una terapia anti-FNT de largo plazo, ya que la descontinuación se asocia con recaída de la enfermedad. Nivel de evidencia: 4. Nivel de acuerdo: 100%.
Hay pocos estudios que evalúan qué tanto tiempo la terapia con agentes anti-FNT debe mantenerse en pacientes con EC y no existen estudios en pacientes con CUCI.
El ensayo STORI252 se realizó en Francia y Bélgica, desde marzo del 2006 hasta diciembre del 2009, en pacientes con EC que habían estado recibiendo terapia con infliximab y un inmunomodulador por un año, y que habían estado en remisión clínica libre de esteroides por al menos 6 meses. El objetivo principal del estudio fue determinar el tiempo de recaída después de la descontinuación del tratamiento con infliximab e identificar los factores asociados con un menor riesgo de recaída. De un total de 115 pacientes, 52 tuvieron recaídas. El tiempo promedio de seguimiento fue de 28±2 meses. Hubo 40 recaídas dentro del primer año y 7 en el segundo. De los pacientes que tuvieron recaída, el 93% logró remisión después de ser tratados nuevamente con infliximab y el 98% tuvo respuesta clínica.
Los factores asociados con el tiempo de recaída fueron analizados y los niveles de PCR ≥ 5mg/l (p=0.0008, CR: 2.49, IC 95%: 1.41-4.39) y niveles de calprotectina fecal ≥ 300μg/g (p=0.0002, CR: 3.22, IC 95%: 1.68-6.15) mostraron estar asociados con un riesgo mayor de recaída.
El estudio demostró que la descontinuación de tratamiento con infliximab no era una buena estrategia. Aproximadamente, el 50% de los pacientes recayeron después de un año o 2 de descontinuar el tratamiento. Otro problema con respecto a la descontinuación del tratamiento anti-FNT fue el índice incrementado de inmunización, que resultó en reacciones de hipersensibilidad a infliximab, así como la pérdida del efecto terapéutico.
Dada la actual falta de evidencia, no es posible hacer una recomendación en cuanto a la duración del tratamiento con agentes anti-FNT153. Sin embargo, en la práctica clínica la decisión de mantener el tratamiento indefinidamente o su descontinuación debe tomarse de acuerdo con las características individuales de cada paciente.
58. La terapia biológica anti-FNT (infliximab, adalimumab y golimumab) es indicada en pacientes con falta de respuesta o intolerancia al tratamiento con aminosalicilatos, esteroides o inmunomoduladores en pacientes con CUCI con actividad moderada a severa. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
Dos estudios aleatorizados, doble ciego, controlados por placebo, evaluaron la eficacia de infliximab como terapia de inducción y mantenimiento en adultos con CUCI con actividad moderada a severa que eran refractarios o intolerantes a tratamiento convencional. Un total de 364 pacientes que recibieron tratamiento con placebo o infliximab (5 o 10mg/kg) a las semanas 0, 2, 6 y luego cada 8 semanas, fueron incluidos. Se llevó a cabo un seguimiento para los pacientes a la semana 54 en ACT1 y a la semana 30 en ACT2. La respuesta clínica a la semana 54 para pacientes en el estudio ACT1 fue del 19.8, el 45.4 y el 44.3% (p<0.001) y la respuesta clínica a la semana 30 para pacientes en el estudio ACT2 fue del 26, 47.1 y 60% (p<0.001) para los grupos placebo, infliximab 5mg/kg e infliximab 10mg/kg, respectivamente. Las tasas de remisión clínica a la semana 54 para pacientes en ACT1 fueron del 16.5, el 34.7 y el 32% para los grupos placebo, infliximab 5mg/kg e infliximab 10mg/kg, respectivamente, y del 10.6, el 33.9 y el 35.8% a la semana 30 para los pacientes en ACT2. No se encontraron diferencias significativas entre las 2 dosis de infliximab. Estos estudios mostraron que infliximab era efectivo para tanto la respuesta y la remisión clínica en pacientes con CUCI con actividad moderada a severa a pesar del uso de tratamiento convencional253.
El estudio ULTRA1, un ensayo de 8 semanas, multicéntrico, aleatorizado, doble ciego, controlado por placebo y de fase 3, incluyó a 576 pacientes con CUCI para la evaluación de la eficacia de adalimumab en la inducción de remisión clínica en pacientes con CUCI moderada a severa sin previa terapia anti-FNT. Los pacientes fueron aleatorizados para recibir tratamiento con adalimumab 160/80mg, adalimumab 80/40mg y placebo.
La remisión clínica a la semana 8 fue del 9.2, el 10 y el 18.5% en los grupos placebo, adalimumab 80/40mg y adalimumab 160/80mg, respectivamente (p=0.31). El efecto del tratamiento fue más pronunciado en pacientes que no tenían colitis extensiva, pacientes tratados con inmunomoduladores sin corticoides al inicio del ensayo y pacientes que no recibieron aminosalicilatos al comienzo del ensayo.
Una dosis de adalimumab de 160/80mg fue efectiva en la inducción de remisión clínica en pacientes con CUCI moderada a severa que no respondieron o toleraron terapias convencionales254.
El estudio ULTRA2, un ensayo de 52 semanas, aleatorizado, doble ciego, controlado por placebo, fase 3, evaluó la eficacia de adalimumab en la inducción y el mantenimiento de remisión clínica en 494 pacientes con CUCI moderada a severa que recibieron terapia concomitante con corticoides o inmunosupresores orales. Los pacientes se asignaron a 2 grupos: adalimumab 160mg a la semana 0, 80mg a la semana 2 y 40mg cada 2 semanas hasta la semana 52 o placebo. A la semana 52, el 17.3 y el 8.5% de los pacientes lograron remisión clínica en los grupos de adalimumab y placebo, respectivamente (p=0.002). A la semana 52, se observó respuesta clínica en el 30.2% vs. 18.3% para los grupos de adalimumab y placebo, respectivamente (p=0.002). De los pacientes sin previo tratamiento con anti-FNT, el 22% en el grupo de adalimumab y el 12% en el grupo placebo lograron remisión clínica a la semana 52 (p=0.029). Se demostró que el tratamiento con adalimumab fue efectivo en el mantenimiento de remisión clínica en pacientes con CUCI moderada a severa que no respondieron a tratamiento convencional240.
El golimumab es un anticuerpo monoclonal anti-FNT-α de origen humano administrado subcutáneamente utilizado en pacientes con CUCI moderada a severa que está aprobada por la US Food and Drug Administration (FDA) y la European Medicines Evaluation Agency (EMEA). En un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo, fase 2 (dosis/respuesta) y fase 3 (confirmatoria) del 2007, llamado PURSUIT-SC, 1,064 pacientes con CUCI moderada a severa fueron analizados (puntuación de la Clínica Mayo 6-12, subpuntaje endoscópico ≥ 2). Los pacientes fueron aleatorizados en grupos en los cuales recibieron dosis de golimumab de 100mg/50mg (únicamente fase 2), 200mg/100mg o 400mg/200mg cada 2 semanas. En la fase 3, se utilizó como punto de corte 6 semanas en espera de respuesta clínica. Los resultados de las dosis de 100mg/50mg, 200mg/100mg y 400mg/200mg correspondieron a la puntuación de la Clínica Mayo –1.0, –3.0, –2.0, respectivamente, comparado con –3.0 en el grupo placebo. En la fase 3, las tasas de respuesta a la semana 6 eran del 51.0% con la dosis de 200mg/100mg y del 54.9% con la dosis de 400mg/200mg de golimumab en pacientes con CUCI, comparado con el 30.3% en el grupo placebo (p ≤ 0.0001). Las tasas de remisión clínica y curación de la mucosa fueron significativamente más altas en los grupos golimumab, comparados con placebo (p ≤ 0.0014). El tratamiento subcutáneo con golimumab indujo respuesta clínica, curación de la mucosa y mejora en la calidad de vida de pacientes con CUCI activa, comparados con el grupo placebo255.
59. La terapia con infliximab es una opción para pacientes con CUCI severa refractaria a esteroides IV, como una alternativa para evitar la colectomía. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
La CUCI severa es una condición potencialmente mortal. Los datos de prevalencia histórica muestran que el 18.8% de la exacerbación inicial de la enfermedad es severa y que el 17.6% de todos los pacientes tienen serias recaídas en el curso de su enfermedad. La dosis única de infliximab (5mg/kg) ha mostrado ser un tratamiento de rescate efectivo para pacientes con CUCI severa refractaria a esteroides. Un estudio controlado aleatorizado incluyó a 45 pacientes (24 recibieron infliximab y 21 placebo) inicialmente tratados con betametasona IV256. A los 3 meses, las tasas de colectomía eran significativamente más bajas en los pacientes que recibieron infliximab que en aquellos que recibieron placebo (7/24 vs. 14/21, p=0.017; OR 4.9, IC 95%: 1.4-17). El seguimiento a largo plazo reveló una tasa de colectomía después de 3 años de 12/24 (50%) de los pacientes que recibieron infliximab y 16/21 (76%) de los que recibieron placebo (p=0.012). Sin embargo, el uso de la terapia con tiopurina no fue controlado y varió entre grupos257,258.
En cambio, el estudio de etiqueta abierta CYSIF colocó aleatoriamente a 111 pacientes que nunca habían tomado tiopurina y que padecían de CUCI severa (puntuación Lichtiger>10) a pesar de 5 días de esteroides por vía IV, a ciclosporina IV en dosis de 2mg/kg/día durante 8 días (niveles 150-250ng/ml) seguido de terapia oral de 4mg/kg/día, o a dosis de infliximab de 5mg/kg a las semanas 0, 2, y 6. Todos los pacientes que respondieron al día 7 recibieron azatioprina oral y sus dosis de esteroides fueron gradualmente reducidas a partir del día 8. Inicialmente, el estudio tuvo un poder estadístico para demostrar menos fracasos de tratamiento con ciclosporina que con infliximab entre los días 7 y 98 (falta de remisión libre de esteroides al día 98, colectomía, o interrupción de tratamiento antes del día 98). Aproximadamente, el 85% de pacientes en ambos grupos respondieron al tratamiento el día 7. El fracaso de tratamiento (el resultado primario de eficacia) se reportó en el 60% de pacientes en el grupo que recibió ciclosporina, comparado con el 54% de los pacientes que recibieron infliximab (diferencia de tratamiento 6.4%, IC 95%: –12 a 24.8%, p=0.49). Las tasas de colectomía al día 98 en el grupo que recibió ciclosporina vs. el grupo que recibió infliximab fueron del 18 y el 21%, respectivamente (p=0.66). Eventos adversos serios fueron más comunes en el grupo de infliximab (17/56 vs. 9/55 en el grupo de ciclosporina), con un total de 9 infecciones serias dentro de los 98 días del estudio, pero las diferencias no fueron estadísticamente significativas259. Como en otros estudios, infliximab y ciclosporina mostraron ser efectivos en reducir las tasas de colectomías en pacientes con CUCI severa refractarias a esteroides IV260-263.
60. La optimización del tratamiento con anti-FNT está basado empíricamente en doblar la dosis o disminuir los intervalos de administración. Nivel de evidencia: 4. Sin embargo, sería ideal medir los niveles séricos de anti-FNT y formación de anticuerpos anti-FNT. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
La monitorización de niveles séricos de fármacos y la medición de niveles de anticuerpos antifármaco (AAF) que se desarrollan en algunos pacientes han emergido como una herramienta para ayudar a clarificar los mecanismos de pérdida de respuesta, así como para servir de guía para el tratamiento en una cantidad grande de pacientes. Esto puede ayudar en la identificación de pacientes que se beneficiarían de un incremento de dosis del agente y de aquellos que apenas responderían a esta estrategia.
Un estudio retrospectivo264 evaluó la utilidad clínica de la medición de los niveles de infliximab y anticuerpos (AAF) en pacientes que habían perdido respuesta o que tuvieron respuesta incompleta a infliximab. Solo el 18% de los pacientes con anticuerpos positivos no respondieron a una dosis incrementada de infliximab, comparado con el 86% de pacientes con anticuerpos negativos y concentraciones subterapéuticas que se beneficiaron significativamente de un incremento en la dosis (p<0.016).
Un estudio265 que evaluó a pacientes tratados con infliximab encontró que 12 meses después de la descontinuación de tratamiento con infliximab, los títulos de los anticuerpos se tornaron indetectables en la mayoría (13/16) de ellos. Es por esto que el valor clínico de la medición de anticuerpos en meses previos a la reintroducción de este fármaco es limitado, ya que los anticuerpos son indetectables, especialmente si la exposición previa fue hace más de 12 meses. El manejo inicial de un paciente con recaída durante terapia anti-FNT determina los niveles de anticuerpos antifármaco y fármacos biológicos, y deduce el mecanismo de fracaso de tratamiento. Una vez que se ha establecido que los síntomas son debidos a recaída, a pesar de la adherencia al tratamiento, hay varias opciones terapéuticas, de las cuales la más común es la intensificación de la dosis y la reducción de intervalos de administración. La segunda opción más comúnmente utilizada es la de cambiar a otro agente anti-FNT. Un cambio en el tipo de fármaco o cirugía266 es recomendado cuando hay una pérdida de respuesta con niveles óptimos de anti-FNT y anticuerpos negativos.
Las concentraciones séricas anti-FNT detectables se han asociado con remisión clínica y mejora endoscópica. En cambio, niveles indetectables de infliximab son asociados con un riesgo incrementado de colectomía, una pérdida secundaria de eficiencia, resultados clínicos peores o actividad inflamatoria incrementada267-272.
Un estudio observacional273 encontró que concentraciones mínimas de infliximab eran significativamente menores en pacientes que eran positivos para anticuerpos antiinfliximab, comparado con pacientes que tenían anticuerpos negativos (p=0.015). Un incremento en la VSG y en el nivel de PCR fueron correlacionados con niveles séricos bajos de infliximab (p=0.04 y p=0.002, respectivamente).
En su estudio, Baert et al.268 encontraron que los niveles de anticuerpos séricos de antiinfliximab estaban correlacionados inversamente con la duración de la respuesta al fármaco (p<0.001). También se encontró que pacientes con>12μg/ml tenían una duración de respuesta significativamente más larga que pacientes con concentraciones más bajas (p<0.01). Esto se confirmó por el equipo de Maser et al.267, en un análisis multivariado, en el cual niveles séricos más altos de infliximab eran predictores de remisión clínica (OR: 38, IC 95%: 9-60, p<0.001) y mejora endoscópica (OR: 23, IC 95%: 4-124, p<0.001) en aquellos pacientes.
En conclusión, concentraciones de anti-FNT apropiadas se han asociado a la remisión clínica y endoscópica. Los niveles bajos o indetectables de anti-FNT se han asociado con un riesgo incrementado de colectomía, pérdida de eficacia secundaria, desenlaces clínicos peores o un aumento en la actividad inflamatoria.
61. La terapia biológica con vedolizumab es una alternativa para pacientes con EC refractaria o aquellos que no toleran el tratamiento con corticoides, tiopurinas (azatioprina o 6 mercaptopurina) y que han fracasado con terapia anti-FNT. Nivel de evidencia: 1. El tratamiento con vedolizumab es efectivo para la inducción y mantenimiento de remisión en pacientes con EC que nunca han recibido terapia biológica con anti-FNT. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
El vedolizumab es un anticuerpo monoclonal humanizado específico que tiene por objetivo la integrina α4ß7 (una glucoproteína de superficie variable expresada en la superficie de células circulantes T y B), interactuando con la molécula de adhesión MAdCAM-1, que se expresa específicamente en la vasculatura intestinal.
El estudio GEMINI 2 analizó la eficacia de vedolizumab en pacientes con EC, ya que su papel y eficacia en esta enfermedad se desconoce. Los resultados para vedolizumab en pacientes con EC activa mostraron que los pacientes recibiendo vedolizumab en dosis de 300mg, a la sexta semana de la fase de inducción, tuvieron una tasa de remisión del 15%, comparada con una tasa del 7% (p=0.02) en aquellos recibiendo placebo. En la fase de mantenimiento (300mg cada 4 u 8 semanas), los pacientes que respondieron a la terapia de inducción mostraron remisión de la enfermedad a la semana 52 del 36% (p=0.004) y 39% (p<0.001), comparados con el 22% de los pacientes que recibieron placebo274.
El estudio GEMINI 3 evaluó el efecto y la eficacia de vedolizumab en pacientes con EC moderada a severa que habían tenido al menos un fracaso a un agente anti-FNT. Un total de 315 pacientes fueron aleatorizados para recibir placebo o vedolizumab a una dosis de 300mg diarios a la semana 0, 2 y 6. El resultado primario medido fue la remisión clínica a la semana 6, que se encontró en el 15.2% del grupo vedolizumab, comparado con el 12.1% del grupo placebo (p=0.433). Sin embargo, la remisión clínica a la semana 10 se evaluó como un resultado secundario. Hubo diferencia estadística a favor del grupo de vedolizumab, con el 26.6% vs. 12.1% en el grupo con placebo (p=0.001)275.
62. La terapia biológica con vedolizumab es indicada para la inducción y el mantenimiento de la remisión en pacientes con colitis ulcerosa moderada a severa que han fracasado con terapia convencional. Nivel de evidencia: 1. Puede ser utilizada como tratamiento biológico de primera línea en este tipo de pacientes antes del uso de terapia anti-FNT. Nivel de evidencia: 4. Nivel de acuerdo: 91%.
El estudio GEMINI 1 evaluó la eficacia y la seguridad de vedolizumab en pacientes con CUCI. Los resultados de vedolizumab en pacientes con CUCI mostraron que el 17% de los pacientes que recibieron vedolizumab y el 5% que recibieron placebo tuvieron remisión clínica (p<0.001). Para la terapia de mantenimiento a la semana 52, los pacientes asignados aleatoriamente para seguir recibiendo vedolizumab (el 42% cada 8 semanas y el 45% cada 4 semanas) eran más probables de tener remisión clínica que aquellos asignados aleatoriamente a cambiar a placebo (16%) (p<0.001)276.
Estos hallazgos fueron confirmados en una revisión sistemática, la cual incluyó 4 estudios con un total de 606 pacientes con CUCI. La tasa general de inducción de remisión clínica fue del 52%, comparado con el 38% del grupo placebo después de la sexta semana de tratamiento. A la semana 52, el 54% del grupo tuvo una recaída clínica de la CUCI, comparado con el 84% del grupo con placebo. No se observó un incremento en efectos adversos en los pacientes que recibieron vedolizumab277.
C. Tratamiento quirúrgico63. Se obtienen mejores resultados cuando ambos, el gastroenterólogo y el cirujano colorrectal, llevan a cabo el tratamiento y la monitorización de pacientes con CUCI severa a partir de su ingreso al hospital. Nivel de evidencia: 5. Nivel de acuerdo: 100%. Los síntomas, la exploración física y los signos de toxicidad sistémica deben de ser monitoreados de cerca. En el caso de cualquier deterioro clínico, debe considerarse una colectomía de urgencia. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
La CUCI severa aguda es una condición seria potencialmente mortal. Los pacientes deben de ser ingresados al hospital y ambos, el gastroenterólogo y el cirujano colorrectal, deben proporcionar un manejo multidisciplinario. En el momento de su ingreso, el paciente debe ser informado acerca de las opciones quirúrgicas disponibles en caso de que fracase el tratamiento médico278,279. El diagnóstico de la CUCI severa está basado en el índice de Truelove y Witts, el cual es el más simple, mejor validado y ampliamente utilizado para la clasificación clínica de CUCI. Cualquier paciente con>6 deposiciones con sangre/día y taquicardia (> 90×min) o temperatura (> 37.8°C) o anemia (Hb<10.5g/dl) o VSG elevada (> 30mm/h) tiene colitis severa. Con solo un criterio, más la frecuencia de 6 deposiciones con sangre/día, es suficiente para definir un ataque severo199. El tratamiento médico intensivo con esteroides IV, estudios de imagenología y monitorización de laboratorio y clínica continua son requeridos. Desde el punto de vista quirúrgico, se necesita del apoyo hidroelectrolítico y nutricional, así como de transfusiones sanguíneas, cuando sea necesario. Durante la hospitalización del paciente, son realizadas las pruebas necesarias para confirmar el diagnóstico. Las infecciones entéricas, como del citomegalovirus, Clostridium difficile y otras bacterias, son excluidas a través de la sigmoidoscopia flexible y biopsias. Las radiografías abdominales simples pueden alertar sobre dilatación tóxica o perforación153. En el caso de cualquier deterioración clínica, signos de toxicidad o signos de advertencia abdominal (dilatación o signos de irritación peritoneal) que ocurran durante la terapia inmunosupresora, una colectomía subtotal con ileostomía debe considerarse280.
64. La respuesta de pacientes con CUCI severa a esteroides IV debe evaluarse al tercer día. En casos refractarios, otras opciones de tratamiento deben discutirse con el paciente, incluyendo terapia de rescate o terapia de segunda línea, como infliximab o ciclosporina IV. Nivel de evidencia: 1. Nivel de acuerdo: 100%. Si no hay mejoría después de 5-7 días de terapia farmacológica de segunda línea, se recomienda la colectomía. Nivel de evidencia: 2. Nivel de acuerdo: 100%. El retraso en cirugía se asocia a un riesgo incrementado de complicaciones postoperatorias y mortalidad. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
En la CUCI severa, la falta de respuesta se considera si las condiciones se deterioran mientras que el paciente está bajo terapia médica o si no hay mejoría después de un periodo de estabilización inicial. Los corticoides son el pilar fundamental de la terapia convencional de primera línea e incluyen la administración IV de hidrocortisona 100mg/4 veces al día o metilprednisolona 60mg/día. Los esteroides IV administrados por más de 7-10 días no tienen beneficios adicionales y presentan una incrementada morbimortalidad. Por lo tanto, la respuesta debe evaluarse En una etapa temprana después del tercer día de tratamiento199. A menudo es difícil definir la necesidad y la oportunidad de cirugía en pacientes cuyas condiciones parecen persistir después de un periodo inicial de mejora. Los criterios de Oxford establecen que los pacientes con>8 deposiciones/día o 3-8 deposiciones/día y PCR>45mg/ml después de 3 días de terapia con esteroides IV tienen un 85% de riesgo de colectomía durante su hospitalización198.
Si no hay respuesta a esteroides IV, se recomienda una terapia de segunda línea o terapia de rescate con ciclosporina o infliximab IV259,281. En América Latina, la terapia de rescate con infliximab es utilizada más seguido. Los reportes sobre ambas, la eficacia y la seguridad de la terapia de rescate con infliximab en pacientes con CUCI severa refractaria a esteroides IV, han sido ampliamente publicados. Järnerot et al. reportaron que la infusión de infliximab redujo la tasa de colectomía a corto plazo (90 días) en el 29% vs. 67% de los pacientes que no recibieron infliximab256. Kohn et al. reportaron que infliximab redujo la tasa de colectomía en pacientes hospitalizados con CUCI severa en un 34% con una sola infusión de infliximab vs. el 5.3% con 2 o más infusiones a los 60 días (p=0.001)282. Recientemente, se reportó que un régimen acelerado de infusión de infliximab (24 días) redujo la tasa de colectomía temprana (12 meses) en pacientes con CUCI severa aguda (6.7%, 1 de 15), comparado con el régimen estándar de infusión de infliximab de 5mg/kg a la semana 0, 2 y 6, seguido de mantenimiento cada 8 semanas (40%, 14 de 35). Sin embargo, cabe señalar que los promedios de colectomías a largo plazo eran iguales que los del periodo prebiológico en aquellos pacientes283. Estos resultados permiten una terapia de rescate oportuna, para que la colectomía electiva pueda realizarse bajo mejores condiciones de menor morbimortalidad para el paciente. Se recomienda que los cirujanos eviten la proctocolectomía total en un solo tiempo con reservorio íleo-anal en pacientes sometidos a terapia anti-FNT.
65. El procedimiento de elección para la cirugía de urgencia en CUCI refractaria a esteroides IV, sangrado severo, dilatación o megacolon tóxico es la colectomía abdominal subtotal con ileostomía terminal y muñón rectal o fístula mucosa, dependiendo de la decisión del cirujano. Nivel de evidencia: 4. Nivel de acuerdo: 100%. Si la cirugía laparoscópica está disponible, un abordaje mínimamente invasivo es posible en pacientes estables, lo cual puede tener las ventajas específicas de ese método. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
El tratamiento médico puede ser efectivo en un gran porcentaje de casos de la CUCI severa aguda. Sin embargo, el retraso en la cirugía perjudica los resultados de los pacientes284. Se considera una proctocolectomía en etapas que inicia con una colectomía subtotal un primer paso en el tratamiento quirúrgico de la colitis ulcerosa severa aguda. Una colectomía subtotal con ileostomía y un cierre de Hartmann del intestino distal, o creación de una fístula mucosa, es un abordaje seguro y efectivo, y curará al paciente de colitis al permitir la recuperación y la normalización alimenticia. También le dará tiempo al paciente de considerar la construcción de un reservorio íleo-anal, una ileostomía definitiva o, en unos cuantos casos seleccionados, una anastomosis íleo-rectal, en un segundo tiempo. El manejo del muñón rectal es controversial. La mayoría de los cirujanos dividen el recto al nivel del promontorio o dejan la parte distal del colon sigmoideo anclado a la pared abdominal anterior, facilitando su identificación y disección subsecuente, o mueven el intestino a través de la fascia abdominal encerrándola en la grasa subcutánea o como una fístula mucosa. Esta última opción es considerada muy segura porque no permanece dentro del abdomen, aunque le da al paciente otro estoma, el cual puede ser difícil de manejar285,286. Si la cirugía laparoscópica está disponible, un abordaje mínimamente invasivo es posible en pacientes estables, lo cual puede tener algunas ventajas específicas a ese método, principalmente menos dolor, una estancia hospitalaria más corta y menos infecciones de los sitios quirúrgicos287.
66. La proctocolectomía restauradora con reservorio íleo-anal se ha vuelto el procedimiento quirúrgico de elección realizado con más frecuencia para pacientes con CUCI. Idealmente, la cirugía puede realizarse laparoscópicamente, si hay experiencia previa. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
La proctocolectomía restauradora es el procedimiento quirúrgico de elección realizado con más frecuencia para pacientes con CUCI que requieren cirugía electiva. Este procedimiento puede realizarse por laparotomía abierta o con técnicas mínimamente invasivas, con la experiencia y medios apropiados. Es un procedimiento relativamente confiable y seguro288,289. La técnica quirúrgica tiene 4 pasos principales. Primero, el colon es removido. Luego, se lleva a cabo una disección pélvica con resección del recto; los nervios pélvicos y los esfínteres permanecen intactos. Subsecuentemente, se construye el reservorio ileal y, finalmente, el reservorio se anastomosa al canal anal. La anastomosis íleo-anal tiene un promedio de morbilidad aceptable (19-27%), un promedio de mortalidad bajo (0.2-0.4%) y un resultado de calidad de vida muy bueno280.
Las complicaciones son similares a las de cualquier procedimiento quirúrgico abdominal mayor: además de los riesgos secundarios a la disección pélvica, como infertilidad o disfunción sexual, y complicaciones de bolsa específicas, como pouchitis (inflamación del reservorio), fuga anastomótica con sepsis pélvica, fístula, estenosis y cuffitis (inflamación del muñón rectal), hay evidencia clara que los cirujanos de alto volumen (> 10 reservorios por año) en centros de referencia especializados tienen un promedio menor de complicaciones y un promedio mayor de preservación de reservorios íleo-anales complicados290.
Al comparar el abordaje abierto con el abordaje laparoscópico, una revisión Cochrane del 2009 de 11 estudios que incluyó a más de 600 pacientes estableció días de estancia hospitalaria, reoperaciones, readmisiones y promedios de mortalidad similares entre los 2 abordajes quirúrgicos. El abordaje laparoscópico es asociado con un mejor resultado estético (menos cicatrización), una longitud de incisión total más pequeña y tiempos de operación más largos291. Comparando los 2 procedimientos, datos retrospectivos han mostrado que la laparoscopia se asocia con un tiempo menor para cerrar la ileostomía, restauración de continuidad intestinal y, secundariamente, una disminución en la formación de adhesiones, principalmente los anexiales (trompas de Falopio y ovarios). Más del 70% de los pacientes estudiados no presentaron adhesiones en los anexos292.
El impacto de las diferentes terapias médicas en esta cirugía, principalmente con esteroides e inmunosupresores, está ampliamente documentado. En general, la literatura describe una morbilidad aumentada en pacientes con altas dosis de esteroides293,294. El impacto de terapias biológicas anti-FNT es más controversial y se requieren más estudios prospectivos, multicéntricos y estandarizados para establecer una posición definitiva. Algunos estudios muestran promedios mayores de complicaciones quirúrgicas a corto plazo. Un estudio retrospectivo de la Clínica Mayo (EE. UU.) reportó que la exposición previa a infliximab incrementa el promedio de complicaciones quirúrgicas de reservorio íleo-anal, indicando que los pacientes que recibieron infliximab tenían un riesgo incrementado de fugas anastomóticas y complicaciones infecciosas y específicas del reservorio que los controles295. Otro estudio de la Clínica de Cleveland (Ohio, EE. UU.) mostró resultados semejantes en complicaciones tempranas y sepsis, concluyendo que la exposición previa a infliximab podría llevar a los pacientes a un procedimiento quirúrgico de reservorio íleo-anal en 3 tiempos, dado el alto riesgo de complicaciones y pobres desenlaces296. Sin embargo, otros estudios han mostrado resultados contrastantes, demostrando que dosis altas de esteroides y cirugía de reservorio sin ileostomía desfuncionalizante eran factores independientes para promedios mayores de complicaciones después de una proctocolectomía restauradora con reservorio íleo-anal, pero la administración preoperatoria de infliximab (dentro de 12 semanas) no lo era296. El análisis más significativo con una muestra más grande de pacientes se realizó en un estudio nacional en Dinamarca. Incluyó a 1,200 pacientes, de los cuales 199 habían recibido infliximab previamente (dentro de las 12 semanas antes de cirugía). Se concluyó que no había un incremento significativo en complicaciones después de la cirugía en pacientes previamente expuestos a infliximab297.
67. El reservorio en J es el tratamiento de elección debido a su simplicidad de construcción y sus resultados funcionales buenos a largo plazo. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
Varias configuraciones de reservorio han sido realizadas (S, J, W). En un metaanálisis que incluyó a 1,519 pacientes no se encontró ninguna diferencia significativa en los resultados quirúrgicos, las tasas de sepsis pélvica, el fallo temprano del reservorio o la mortalidad298. Sin embargo, el tiempo operativo fue más corto y la técnica quirúrgica más simple con el reservorio en J. Al principio, había un número más alto de deposiciones (debido al tamaño más pequeño de la bolsa), pero disminuyeron con el tiempo. En un estudio, la cantidad promedio de deposiciones por día era igual para pacientes con reservorios en J o W. No había diferencia entre los 2 reservorios en cuanto a los promedios de incontinencia, urgencia, fuga y el uso de agentes antidiarreicos299.
La anastomosis íleo-anal no debe realizarse más de 2cm arriba de la línea dentada. Una de las complicaciones mayores para la realización de la técnica de anastomosis íleo-anal es dejar un muñón de mucosa rectal más grande arriba de la línea dentada, lo cual puede llevar a inflamación crónica (cuffitis) con disfunción del reservorio y un riesgo de displasia o cáncer. La anastomosis íleo-anal puede realizarse manualmente o con una engrapadora. Sin embargo, hay reportes que indican que la anastomosis manual y la mucosectomía resultan en un grado mayor de incontinencia, una presión anal de reposo más baja y una pérdida permanente del reflejo rectoanal inhibitorio. Las ventajas de la anastomosis con doble engrapadora incluyen: menor dificultad técnica porque se evitan la mucosectomía y la fase perineal del procedimiento, menor esfuerzo sobre la línea de sutura anastomótica y mejores resultados funcionales. Las lesiones al esfínter también son minimizadas y la zona de transición anal y sus terminaciones nerviosas permanecen intactas. Esto se ve reflejado en una menor incidencia de enuresis nocturna. Además, la incidencia subsecuente de cáncer es la misma que después de una mucosectomía con anastomosis manual. Por estas razones, la técnica de anastomosis íleo-anal con doble engrapadora es actualmente la más ampliamente utilizada300,301.
El realizar una ileostomía protectora durante la cirugía del reservorio íleo-anal reduce el riesgo de fugas anastomóticas (50%), complicaciones sépticas, disfunción del reservorio y mortalidad. El tiempo óptimo para el cierre de la ileostomía son 12 semanas o más y se indica la realización de un enema con contraste antes del cierre para mostrar la morfología del reservorio y descartar fugas301-303.
68. La proctocolectomía con ileostomía definitiva es una opción quirúrgica en pacientes con CUCI. Sus indicaciones principales son en pacientes que no eligen tener un reservorio íleo-anal o que tienen un riesgo significativo de falla del reservorio, como disfunción del esfínter anal, enfermedad anal y perineal previa, y otros trastornos fisiológicos secundarios a condiciones comórbidas. Nivel de evidencia: 5. Nivel de acuerdo: 100%.
Aunque la proctocolectomía restauradora con reservorio íleo-anal es el procedimiento quirúrgico más comúnmente realizado en pacientes con CUCI, la proctocolectomía con ileostomía sigue siendo realizada en pacientes con disfunción del esfínter anal, comorbilidades significativas o cáncer rectal distal, o en pacientes de edad avanzada o aquellos que eligen no tener un reservorio278.
Durante el tiempo perineal de esta técnica quirúrgica, se recomienda la proctectomía interesfintérica para lograr un buen cierre del piso pélvico y reducir el riesgo de problemas en la sanación de la herida perineal304. Pueden ocurrir complicaciones en el 26% de pacientes y pueden incluir obstrucción del intestino delgado, trastornos de la función de la vejiga, disfunción sexual, infertilidad y, con mayor frecuencia, complicaciones relacionadas a estomas305.
La proctocolectomía total con ileostomía continente (bolsa de Kock) es un procedimiento complejo con un alto riesgo de reoperación. Es una alternativa tanto en pacientes con CUCI que no son candidatos para tener un reservorio íleo-anal, como en aquellos en los cuales ha fallado este procedimiento. La proctocolectomía total es principalmente indicada en pacientes con función pobre del esfínter o un reservorio íleo-anal disfuncional, o en aquellos que están insatisfechos con la ileostomía convencional (Brooke). Estas pocas indicaciones son el resultado de una proctocolectomía restauradora exitosa con reservorio íleo-anal y el promedio elevado de complicaciones tempranas y tardías asociadas con ileostomía continente, como sepsis y retención de la bolsa ileal306.
69. La colectomía con anastomosis íleo-rectal debe considerarse en un grupo altamente seleccionado de pacientes con CUCI (morbilidad baja y preservación de fertilidad femenina) como una alternativa a reservorio íleo-anal que debe valorarse contra la necesidad de vigilancia rectal y proctectomía subsecuente en aproximadamente el 50% de los casos. Nivel de evidencia: 4. Nivel de acuerdo: 100%.
Para realizar una anastomosis segura, la colectomía abdominal subtotal con anastomosis íleo-rectal puede ser una opción en pacientes con un recto mínimamente afectado. Además de la enfermedad anal-perineal y la disfunción del esfínter anal280, otras contraindicaciones del procedimiento incluyen inflamación rectal severa y una disminución marcada en la capacidad rectal (complianza), en la cual el recto no puede actuar como un reservorio. Por lo tanto, es necesario tomar precauciones en pacientes con displasia o carcinoma en condiciones potencialmente curativas280.
Resultados funcionales impredecibles después de una anastomosis íleo-rectal en un recto inflamado con complianza disminuida, así como el desarrollo subsecuente de cáncer, explican el por qué los cirujanos se rehúsan a realizar la anastomosis íleo-rectal en pacientes con CUCI. Además de la simplicidad técnica y la baja morbilidad, entre otras ventajas, este procedimiento evita la disección pélvica y elimina el riesgo de impotencia en hombres y fertilidad disminuida en mujeres307. Las desventajas están relacionadas con la durabilidad a largo plazo del procedimiento. Algunos estudios han mostrado un promedio de fracaso del 12 al 53% con un seguimiento de 3.5 años. Finalmente, esto resulta en la extirpación del recto debido a síntomas persistentes o al desarrollo de cáncer308. El riesgo de desarrollar cáncer rectal debe tomarse en cuenta cuando se indica este procedimiento. Aunque la incidencia parece baja a largo plazo (0-8%), se debe advertir a los pacientes que requerirán seguimiento endoscópico con biopsias cada año. La urgencia de defecar es la causa más común de falla de la anastomosis rectal (22-23%)280.
70. Hay un riesgo mayor de complicaciones tromboembólicas en pacientes que se someten a cirugía por EII. Se recomiendan medidas preventivas y de reducción de riesgo para estos pacientes. Nivel de evidencia: 3. Nivel de acuerdo: 100%.
Los pacientes con CUCI tienen un riesgo aumentado de eventos tromboembólicos309. En una revisión grande de pacientes quirúrgicos en los EE. UU., la incidencia fue del 3.3%, con un riesgo de mortalidad más alto (4%). Se recomienda el uso de agentes antitrombóticos, medias de compresión de miembro inferior y movilización temprana310.
71. La pouchitis (reservoritis) es la complicación tardía más frecuente del reservorio íleo-anal. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
Las complicaciones a largo plazo de reservorios incluyen: obstrucción del intestino delgado, fístulas, disfunción del reservorio, pouchitis, disfunción sexual y fertilidad reducida. La pouchitis es la más común y ocurre en>50% de pacientes a los 10 años311-313. Sin embargo, no se requiere de vigilancia de reservorio en pacientes asintomáticos. Se requiere de un protocolo de seguimiento únicamente en el caso de factores de riesgo, como displasia, cáncer o colangitis esclerosa primaria280. Evidencias múltiples indican que la microbiota intestinal desempeña un papel clave en la ocurrencia y la progresión de la pouchitis. El sobrecrecimiento bacteriano causa disbiosis, con una predominancia de algunas bacterias anaeróbicas en el reservorio, lo cual provoca una respuesta inmunitaria con el desarrollo de la EII314,315. La CUCI extensa, las manifestaciones extraintestinales, como colangitis esclerosa primaria, no fumadores, altos niveles preoperatorios de p-ANCA, el uso de esteroides preoperatorios y la ingesta de AINE, son considerados factores de riesgo para el desarrollo de pouchitis316.
72. El diagnóstico de pouchitis (reservoritis) se hace basado en criterios clínicos, endoscópicos e histológicos. Nivel de evidencia: 3. Nivel de acuerdo: 91%.
El diagnóstico de pouchitis no es siempre simple, debido a la falta de síntomas y signos específicos. En pacientes con reservorios no inflamados, se esperan de 4-7 deposiciones/día con continencia. En pacientes con pouchitis puede haber varias manifestaciones clínicas que varían desde el incremento de frecuencia de deposiciones, urgencia, calambres abdominales, enuresis nocturna e incontinencia. Estos síntomas no son específicos y pueden presentarse en otros trastornos del reservorio, ya sean inflamatorios y no inflamatorios317. Sin embargo, se requiere una evaluación combinada de síntomas y características endoscópicas e histológicas para hacer el diagnóstico y el diagnóstico diferencial de pouchitis318. Varios instrumentos de diagnóstico han sido utilizados para el diagnóstico y la clasificación de pouchitis. El de mayor uso es el índice de actividad de la enfermedad pouchitis de 18 puntos, basado en la evaluación de síntomas, la endoscopia y la histología. Este instrumento propone que la pouchitis sea diagnosticada en presencia de síntomas clínicos de diarrea>6 deposiciones/día; hallazgos endoscópicos de>4 signos de edema, granularidad, friabilidad, pérdida del patrón vascular, exudados de mucosa o ulceraciones, y trastornos histopatológicos de al menos grado 4 en un índice de 6 puntos (infiltración de leucocitos polimorfonucleares y porcentaje de ulceración por campo de bajo aumento). La endoscopia es la herramienta más valiosa para el diagnóstico y el diagnóstico diferencial de pouchitis. La endoscopia temprana es requerida en pacientes sintomáticos para establecer un diagnóstico diferencial entre pouchitis, cuffitis (inflamación activa del muñón rectal), estenosis, fuga anastomótica, isquemia, síndrome de bolsa irritable, fístulas, abscesos, EC, citomegalovirus, C. difficile, displasia y cáncer319,320.
73. La mayoría de los pacientes con pouchitis aguda (reservoritis) responden a ciprofloxacino 500mg/2 veces al día durante 2 semanas o metronidazol 1g/2 veces al día. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
Pacientes con episodios iniciales de pouchitis aguda responden bien a la terapia con antibióticos. Debe haber la sospecha de complicaciones quirúrgicas, como fuga anastomótica o fístulas, en pacientes con síntomas de pouchitis inmediatamente después de la construcción de reservorio y el cierre de ileostomía que no responden a la terapia con antibióticos. Se han publicado pocos estudios aleatorizados y controlados con placebo sobre el tratamiento o la prevención de la pouchitis. En la práctica clínica, metronidazol, ciprofloxacino, tinidazol y rifaximina han sido utilizados en el tratamiento de pouchitis aguda321. Las terapias de primera línea incluyen un curso de 14 días de metronidazol (15-20mg/kg/día) o ciprofloxacino (1g/día). Los efectos secundarios son menos comunes con ciprofloxacino. Otros antibióticos, incluyendo tinidazol, rifaximina y amoxicilina-ácido clavulánico, también se han investigado y encontrado ser efectivos en algunos pacientes en pequeños estudios322.
74. La budesonida es una alternativa para pacientes con pouchitis crónica (> 4 semanas) que no responden al tratamiento con antibióticos. Nivel de evidencia: 2. Nivel de acuerdo: 91%.
Pacientes con pouchitis crónica son aquellos que presentan síntomas por más de 4 semanas. En algunos casos, los pacientes no responden a la monoterapia con antibióticos y una terapia combinada con antibióticos es indicada. La administración de ciprofloxacino 1g diario más 2g de rifaximina o metronidazol 1g/día o tinidazol 1-1.5g/día durante 4 semanas se ha mostrado efectiva en la pouchitis crónica refractaria323,324. Los pacientes con recaídas continuas (> 4 episodios/año) después de la descontinuación de antibióticos son considerados como dependientes de antibióticos. En una pequeña serie de casos, se han evaluado los corticoides (incluyendo la budesonida oral o tópica) para el tratamiento de pouchitis crónica refractaria a antibióticos, mostrando algo de eficacia325. En otra pequeña serie de casos, el uso de agentes anti-FNT, como infliximab326 o adalimumab327, demostró una buena eficacia clínica. La eficacia de estos agentes indica el compromiso de procesos inmunitarios en la ocurrencia, la recaída y la progresión de pouchitis crónica refractaria.
75. La administración durante 9 a 12 meses del probiótico VSL#3 (18×10)11, compuesto de 8 cepas bacterianas, ha demostrado ser efectiva en el mantenimiento de la remisión inducida por antibióticos. Nivel de evidencia: 2. Nivel de acuerdo: 82%.
La pouchitis recurrente es común después del tratamiento y resolución del episodio inicial. Se estima que hasta un 19% de pacientes con pouchitis aguda desarrollarán refractariedad al tratamiento o recaídas frecuentes328.
Estudios aleatorizados y controlados han reportado que el probiótico VSL#3 (el cual contiene 4 cepas de Lactobacillus [L. casei, L. plantarum, L. acidophilus y L. delbrueckii subsp. bulgaricus], 3 cepas de Bifidobacterium [B. longum, B. breve y B. infantis], y una cepa de Streptococcus salivarius) fue efectivo en el mantenimiento de remisión inducida por antibióticos en pacientes con pouchitis recurrente. En el primer ensayo aleatorizado y controlado en Bolonia, Italia, se administró VSL#3 a una dosis de 6g diarios como terapia de mantenimiento después de haber inducido remisión con ciprofloxacino y rifaximina. Este estudio de 9 meses con 40 pacientes mostró que el 15% de los pacientes en el grupo probiótico tuvieron recaída, comparado con el 100% de los pacientes en el grupo con placebo329. La administración de probióticos también se ha mostrado efectiva en la prevención de la aparición de pouchitis330.
76. Pacientes con pouchitis crónica refractaria a todos los tratamientos médicos deben referirse al cirujano colorrectal para evaluar la extirpación del reservorio íleo-anal. Nivel de evidencia: 4. Nivel de acuerdo: 91%.
Los pacientes con pouchitis crónica refractaria a todos los tratamientos médicos deben ser valorados por el cirujano colorrectal para la evaluación del mecanismo funcional del reservorio y trastornos estructurales de la bolsa, como estenosis, senos anastomóticos o fístulas e isquemia del reservorio. Además, se debe evaluar la calidad de vida del paciente para determinar si el paciente es un candidato para cirugía para remover el reservorio. Los promedios de fallas de reservorio en la CUCI van desde el 3 hasta el 15%331. La ileostomía definitiva no es la única alternativa. Hay procedimientos perineales o abdominoperineales para rescatar el reservorio con buenos promedios de éxito: entre el 48 y el 93%332.
Cirugía para la enfermedad de Crohn77. La cirugía es principalmente indicada en la EC complicada. Las indicaciones urgentes son: perforación del intestino, abscesos, obstrucción del intestino delgado y, más raro, sangrado masivo. En el marco crónico, la cirugía es indicada en el fracaso del tratamiento médico, la fibrosis del intestino, la EC abdominal fistulizante y la displasia asociada o la neoplasia. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
No se considera la cirugía como fracaso y es importante en el manejo de la EC. Aproximadamente, el 80% de los pacientes serán sometidos a resección intestinal dentro de unos 20 años del diagnóstico333.
En relación con la urgencia, las indicaciones para cirugía pueden ser obvias, como en casos de perforación intestinal y abscesos abdominales múltiples. Algunos pacientes con rasgos de obstrucción pueden en ocasiones ser manejados con tratamiento conservador, pero la obstrucción aguda es también una clara indicación para cirugía. El sangrado masivo en una indicación poco común para cirugía en la EC, siendo más común en la CUCI severa. Los abscesos perianales requieren de drenaje inmediato334.
En el marco crónico, la indicación más común para cirugía es el fracaso del tratamiento médico. La definición de fracaso no es reconocida fácilmente en la práctica clínica. Una definición puede ser la «incapacidad de controlar síntomas a pesar de una terapia médica óptima»335. Aún hay controversia acerca de si las tasas quirúrgicas son reducidas en estudios de población después de la introducción de la terapia biológica. El fracaso a la terapia biológica puede ocurrir y es una indicación común para cirugía, principalmente cuando hay fibrosis asociada. La fibrosis que causa síntomas obstructivos también es una indicación común para la cirugía en el escenario crónico. Se requiere de atención en los casos con sospecha de neoplasia, en los cuales la cirugía es indicada rápidamente. La cirugía también es esencial en combinación con la terapia médica en el manejo de la EC perianal fistulizante334.
El momento apropiado para cirugía puede definirse mejor a través de la evaluación conjunta entre gastroenterólogos y cirujanos. Es esencial para los equipos multidisciplinarios estar involucrados en la toma de decisiones junto con los pacientes336. Una extensa evaluación de pruebas endoscópicas y de imagenología ayuda a definir la necesidad de una operación y el mejor momento para el procedimiento.
78. La estenoplastia (cirugía preservadora del intestino) es una opción válida en la EC del intestino delgado. Las estenosis cortas (< 10cm) pueden ser tratadas por la estenoplastia convencional (p. ej., la técnica Heineke-Mikulicz). Las estenosis extensas, cuando llevan a síndrome del intestino corto, constituyen una buena indicación para estenoplastias no convencionales (p. ej., la técnica Michelassi). Las estenoplastias se contraindican en el colon y en casos con fístulas asociadas. Nivel de evidencia: 2. Nivel de acuerdo: 82%.
Preservar la longitud del intestino y prevenir el fracaso intestinal secundario al síndrome del intestino corto están entre las metas más importantes en el manejo de la EC del intestino delgado. Las estenosis<10cm pueden ser tratadas con estenoplastias convencionales, como la técnica Heineke-Mikulicz (para estenosis cortas) o la técnica Finney (indicada en estenosis largas, más de 10cm de longitud). Hay buena evidencia de que la realización de suturas intestinales en tejido inflamado con fibrosis asociada es segura y no incrementa las complicaciones, comparada con la anastomosis337.
Hay evidencia de un aumento en el uso de estenoplastias no convencionales, en casos de estenosis que afectan a segmentos más largos del intestino delgado, principalmente en pacientes con resecciones previas o pacientes con múltiples estenosis confinadas a un segmento más largo del intestino. Los resultados son prometedores, con la preservación de la absorción de nutrientes, pero hay una posibilidad de un incremento en problemas funcionales después de la cirugía. En casos sin resecciones previas, varias estenosis cortas confinadas a un segmento definido del intestino son manejadas preferiblemente con resección intestinal147,338.
Las estenosis con fístulas y abscesos asociados son mejor manejadas con resección. Un estado nutricional pobre con albúmina baja es también una contraindicación para estenoplastia. Debe ponerse atención especial a la sospecha de neoplasia en ciertas estenosis en las cuales la resección es obligatoria. Se han reportado algunos casos con adenocarcinoma en el sitio de la estenoplastia y es esencial el seguimiento a largo plazo para rápidamente diagnosticar y tratar a aquellos pacientes339.
79. La resección ileocecal está entre los procedimientos quirúrgicos más comunes en la EC. Un abordaje laparoscópico es la opción preferida si se cuenta con la experiencia adecuada. La técnica anastomótica preferida después de la resección ileocecal en la EC es una anastomosis de amplia luz latero-lateral engrapada (término-terminal funcional). Nivel de evidencia: 2. Nivel de acuerdo: 100%.
En casos de la EC abdominal que requieren resección, la resección ileocecal es el procedimiento quirúrgico más común. En las recientes décadas, ha habido un incremento significativo en el desarrollo de equipo quirúrgico, técnicas y protocolos de recuperación. Actualmente, la resección ileocecal laparoscópica es el procedimiento de elección en la EC ileocecal localizada con indicación quirúrgica. Los pacientes con enfermedad luminal, refractaria a medicamentos, o estenótica constituyen candidatos óptimos para este abordaje, con resultados favorables.
Las ventajas del abordaje laparoscópico incluyen tasas de complicación más bajas, estancia hospitalaria más corta, menos sangrado, recuperación más rápida y mejores resultados estéticos. Varios estudios y 2 metaanálisis fueron publicados en la literatura comparando las técnicas convencionales y laparoscópicas340,341. Los beneficios del abordaje laparoscópico son claros en términos de morbilidad postoperatoria reducida y mejor recuperación. Ciertamente, hay lugar para el abordaje laparoscópico en la EC complicada, como los casos con masas inflamatorias, enfermedad penetrante y resecciones previas. Estos casos pueden ser manejados con laparoscopia únicamente en centros con equipo adecuado y experiencia extensa, así como tasas de conversión significativas. No hay evidencia de que en las enfermedades complicadas, la resección laparoscópica logre mejores resultados que el abordaje convencional, aunque la realización de estos procedimientos es viable342.
La recurrencia no parece estar afectada por el tipo de acceso a la cavidad abdominal, sin alguna diferencia en las tasas de recurrencia postoperatoria entre las técnicas laparoscópicas y convencionales. Además, los procedimientos laparoscópicos llevan a tasas de formación de adherencias más bajas que con el abordaje convencional y hacen las intervenciones en la cavidad abdominal (las cuales pueden ocurrir con el tiempo en la EC) más fáciles343.
Otras técnicas mínimamente invasivas, como las cirugías de un solo puerto, también son viables en la EC ileocecal localizada. Sin embargo, los beneficios de este abordaje sobre los procedimientos laparoscópicos multipuerto están todavía por definirse.
Un metaanálisis demostró que hay tasas de fuga anastomótica más bajas y complicaciones postoperatorias globales más bajas con la anastomosis latero-lateral engrapada comparada con la técnica término-terminal344. La anastomosis engrapada es considerada más segura, más rápida y más fácil de realizar, principalmente cuando se observan diferentes diámetros entre las asas ileales y colónicas. Las tasas de recurrencia no parecen ser afectadas por el tipo de anastomosis, sin alguna diferencia entre las anastomosis ileocolónicas término-terminales y latero-laterales. Un estudio prospectivo de Canadá demostró esta similitud en un seguimiento de un año345.
80. La colectomía segmentaria puede realizarse cuando la EC afecta un solo sitio en el colon. Cuando los 2 segmentos del colon están afectadas, 2 colectomías segmentarias asociadas pueden realizarse como una alternativa a la colectomía total o proctocolectomía. Cuando el recto también está afectado y es refractario a terapia médica o cuando está presente la EC severa fistulizante perianal, la proctocolectomía total e ileostomía son indicadas. Nivel de evidencia: 3. Nivel de acuerdo: 100%.
La colectomía segmentaria es una alternativa a la colectomía total o proctocolectomía cuando la EC afecta al colon346. Es una alternativa válida para evitar estomas permanentes en la proctocolectomía total, de acuerdo con la preferencia del paciente. Las tasas de recurrencia son más altas en la colectomía segmentaria, comparada con resecciones más extensas. Sin embargo, la terapia médica intensiva para prevenir la recurrencia, principalmente con agentes biológicos, puede ser una opción para reducir las tasas de recurrencia. Existe una falta de estudios que comparen las tasas de recurrencia entre la colectomía segmentaria y la colectomía total/proctocolectomía en la era biológica.
El recto desempeña un papel significativo en decidir la extensión de resección en la colitis secundaria a la EC. En casos de proctitis significativa y enfermedad fistulizante perianal con otros segmentos patológicos asociados en el colon, la proctocolectomía total y la ileostomía son indicadas347.
En casos con 2 segmentos diferentes del colon afectados por la EC con un recto normal y sin fístulas perianales, la colectomía total con anastomosis íleo-rectal puede ser indicada348. Dos resecciones segmentarias asociadas son una opción en los casos cuando ambos extremos del colon están afectados.
81. Los corticoides preoperatorios incrementan las tasas de complicaciones globales en la cirugía abdominal para la EC. Las tiopurinas pueden ser utilizadas de manera segura en el periodo perioperatorio. Existe controversia en cuanto al impacto de agentes anti-FNT preoperatorios sobre las tasas de complicaciones en la resección intestinal abdominal para la EC. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
Los corticoides preoperatorios incrementan las complicaciones en operaciones abdominales para la EC. Las tasas de complicaciones son proporcionales a la dosificación de los medicamentos. En situaciones electivas, los corticoides deben retirarse por al menos 6 semanas, cuando sea posible, para reducir complicaciones postoperatorias349. El mismo principio no puede ser aplicado a las tiopurinas. Estos fármacos demostraron ser seguros cuando se utilizaron en el periodo perioperatorio. No necesitan ser retirados antes de las operaciones y pueden comenzarse tan pronto que la dieta oral sea reintroducida350.
Existe controversia en cuanto al impacto de agentes anti-FNT en sí sobre las complicaciones postoperatorias en la EC abdominal. Varios estudios demostraron un posible efecto negativo, culpando a los agentes biológicos por un aumento de las infecciones y las complicaciones globales351, pero la mayoría de los estudios no mostraron esta asociación352. Casi todos los estudios son retrospectivos. Solo hay un estudio prospectivo que demostró que pacientes con niveles séricos más altos de infliximab una semana antes de las operaciones tenían un incremento en complicaciones globales y más readmisiones hospitalarias que aquellos pacientes con niveles indetectables del fármaco353. Por lo tanto, de ser posible, los agentes anti-FNT pueden retirarse para posiblemente reducir complicaciones.
Y entonces, la decisión de cuál estrategia quirúrgica debe utilizarse (p. ej., anastomosis primaria vs. estoma no funcional) debe ser individualizada en cada caso. Los factores de confusión, como estado de nutrición pobre y corticoides previos, deben de tomarse en consideración. No hay evidencia clara que apoye el momento apropiado para la reintroducción de biológicos después de la cirugía. Se puede recomendar un periodo de por lo menos 4 semanas después de la cirugía, al descartarse complicaciones.
82. Los abscesos abdominales secundarios a la EC son tratados preferiblemente a través del drenaje percutáneo guiado por estudios de imagenología, junto con la administración de antibióticos. El retraso de la resección es preferible, cuando sea posible. Nivel de evidencia: 2. Nivel de acuerdo: 100%.
En la ausencia de síntomas obstructivos, los abscesos abdominales secundarios a la EC activa son tratados preferiblemente por drenaje percutáneo asociado con antibióticos, sin ingesta oral y observación. Cuando no hay la posibilidad técnica de drenaje percutáneo, o existen abscesos múltiples, la laparotomía con drenaje quirúrgico es aconsejable. El retraso de la resección es preferido cuando se logra un drenaje exitoso, sin sepsis activa, y mejores condiciones clínicas. No hay consenso en cuanto a si esta estrategia puede ser aplicada en pacientes con sepsis severa o en niños146,354,355.
83. La EC fistulizante perianal requiere un manejo multidisciplinario. La exploración bajo anestesia con colocación de setón en combinación con terapia médica (antibióticos, inmunomoduladores y/o agentes anti-FNT) es considerada el mejor abordaje. En la presencia de inflamación rectal persistente, la optimización del tratamiento es necesaria. Nivel de evidencia: 1. Nivel de acuerdo: 100%.
Las fístulas perianales secundarias a la EC son uno de los retos más importantes en el manejo de la EII. El diagnóstico apropiado con una combinación de métodos (en general, exploración bajo anestesia asociada con RM pélvica) es esencial para la planeación de acciones terapéuticas. Los abscesos perianales necesitan drenaje inmediato. Las fístulas superficiales simples pueden ser tratadas con fistulotomías356.
Actualmente, la combinación del tratamiento quirúrgico (colocación de setón, dilatación de estenosis y legrado del tracto fistuloso) y la terapia médica es considerada el mejor abordaje para el manejo de fístulas perianales complejas en la EC. Agentes anti-FNT en combinación con inmunomoduladores son usados mayormente en estos casos230. Hay evidencia de que la asociación de agentes anti-FNT con antibióticos puede mejorar los resultados a corto plazo357-359. Hay una falta de información en cuanto al uso de inmunomoduladores y antibióticos como terapias principales en el manejo de este fenotipo de enfermedad358.
No hay consenso sobre el momento apropiado de retirar los setones o repetir la exploración bajo anestesia. Cada caso debe ser individualizado358,359. Generalmente, se necesita la curación de la mucosa del recto antes de retirar el setón. En pacientes sin curación de la mucosa después de la inducción y un periodo variable de terapia de mantenimiento con agentes anti-FNT, la optimización del tratamiento es requerida. En pacientes con un recto curado y persistencia de drenaje de fístula, los procedimientos quirúrgicos adicionales, como el colgajo de avance rectal o el ligado del trayecto fistuloso interesfinteriano, pueden ofrecerse. En casos de enfermedad fistulizante severa con incontinencia fecal, estenosis severa y abscesos recurrentes complejos, una proctocolectomía debe considerarse358.
84. Después de la resección ileocólica, se recomienda el tratamiento profiláctico para la recurrencia. Dejar de fumar es obligatorio después de la cirugía. El metronidazol es más efectivo que placebo para la prevención de la recurrencia a corto plazo. La azatioprina es también más efectiva que placebo y la mesalazina en el escenario preventivo. Los agentes anti-FNT son más efectivos que la terapia convencional en la prevención de la recurrencia y se recomiendan principalmente en pacientes con alto riesgo de recurrencia. Se necesita la estratificación de los riesgos después de la cirugía para guiar la terapia profiláctica. La evaluación colonoscópica con la detección de recurrencia después de 6 meses postoperatorios es recomendada para optimizar la terapia médica. Nivel de evidencia: 1. Nivel de acuerdo: 82%
La recurrencia endoscópica ocurre en aproximadamente el 75% de los pacientes un año después de la resección ileocólica para la EC. Precede a las recurrencias clínicas y quirúrgicas. Por lo tanto, la prevención de la recurrencia con terapia médica adecuada es una verdadera necesidad para un mejor control de la actividad de la enfermedad360.
Los pacientes con alto riesgo de recurrencia son fumadores, pacientes con resecciones previas y pacientes con enfermedad penetrante abdominal. Todos los fumadores deben dejar de fumar después de cirugía. Se consideran de bajo riesgo los pacientes que no presentan estas características361. Aquellos pacientes con alto riesgo de recurrencia deben al menos estar tomando inmunomoduladores como terapia preventiva para la recurrencia. Los agentes anti-FNT son recomendados en pacientes con el uso preoperatorio de estos fármacos, así como en aquellos que presentan enfermedad extremadamente severa. No se recomiendan para todos los pacientes de alto riesgo debido a los costos y a las limitaciones de disponibilidad362.
La terapia ajustada basada en una exploración colonoscópica 6 meses después del procedimiento quirúrgico es la mejor estrategia para optimizar el manejo de la recurrencia. La terapia actual puede mantenerse en pacientes con una mucosa normal. La optimización del tratamiento es necesaria en pacientes que presentan recurrencia. Los pacientes que toman tiopurinas pueden comenzar a tomar agentes anti-FNT y aquellos que ya estén tomando agentes biológicos podrían requerir una optimización de dosis362,363.
FinanciaciónLaboratorios Global Takeda proveyó el apoyo financiero en cuanto a la logística y gastos de viaje para todos los participantes en la formulación del Consenso. No recibieron honorarios.
AutoríaTodos los coautores contribuyeron en igual medida a este trabajo.
Conflicto de interesesEl Prof. Jesús K. Yamamoto-Furusho ha recibido honorarios de Abbvie, Takeda, Janssen, UCB, Almirall, Pfizer, Novartis y Danone como ponente, líder de opinión clave, y miembro de consejos asesores nacionales e internacionales. Ha recibido fondos para investigación de Bristol, Shire y Pfizer y es presidente del Pan American Crohn's and Colitis Organisation (PANCCO) y tesorero de la Asociación Mexicana de Gastroenterología.
Francisco Bosques-Padilla. Ponente y asesor para Abbvie, Janssen, Takeda y Ferring.
Juan de-Paula. Ponente y asesor para Abbvie, Janssen y Takeda.
María T. Galiano. Ponente y asesor para Abbvie, Janssen y Takeda.
Patricio Ibañez. Médico consultor de AbbVie.
Fabián Juliao. Ponente y asesor para Abbvie, Janssen, Biotoscana y Takeda.
Paulo G. Kotze. Ponente y asesor para Abbvie, Janssen, Takeda, UCB, Pfizer y Ferring.
José L. Rocha. Ponente para Abbvie, Janssen y Ferring.
Flavio Steinwurz. Ponente y asesor o investigador para Abbvie, Ferring, Gilead, Janssen, Pfizer, Takeda y UCB.
Guillermo Veitia. Ponente para Abbvie, Janssen, Farma y Takeda.
Cyrla Zaltman. Ponente y asesor para Abbvie, Janssen, Takeda, UCB y Ferring.
Los autores desean agradecer a Carlos Augusto Barrera-Ochoa por su ayuda en el formato de referencia de este manuscrito.