La enfermedad renal crónica (ERC) es una de las principales comorbilidades que afectan a los pacientes receptores de trasplante hepático. Muchos de ellos son trasplantados con cierto grado de disfunción renal aguda o crónica, sin embargo, también pueden desarrollar ERC de novo una vez trasplantados. Se ha observado un incremento importante de la incidencia de ERC en la «era MELD», en parte se ha atribuido este fenómeno al peso que tiene la función renal para la asignación de órganos. Por otro lado, el uso generalizado de inhibidores de calcineurina también ha contribuido a este fenómeno. Es de suma importancia familiarizarnos con los métodos actuales para evaluar la función renal antes y después de un trasplante hepático. Los 2 principales biomarcadores disponibles hoy en día para este fin son la creatinina sérica y la cistatina C. Existen varias ecuaciones derivadas de estos biomarcadores que han sido probadas en este contexto, obteniéndose resultados mixtos debido a su variabilidad biológica y a la falta de estandarización en su determinación. El estándar de oro continúa siendo la medición directa de la tasa de filtrado glomerular por diversos métodos, sin embargo, esto solo se realiza con fines de investigación. También es importante conocer la clasificación actual de la lesión renal aguda y de la ERC con el fin de poder realizar un diagnóstico temprano. Esta revisión se centra en el reconocimiento, diagnóstico y clasificación de la ERC y la lesión renal aguda en pacientes receptores de trasplante hepático.
Chronic kidney disease is one of the main comorbidities affecting liver transplant recipients. Most of those patients have some degree of acute or chronic kidney dysfunction at the time of transplantation, moreover they can also develop de novo chronic kidney disease once transplanted. An important increase in the incidence of chronic kidney disease in the «MELD era» has been observed. This phenomenon has partially been attributed to the weight that kidney function carries for organ allocation. In addition, the generalized use of calcineurin inhibitors has also been a contributing factor. It is of the utmost importance for us to be familiar with the current methods for evaluating kidney function before and after a liver transplantation. The two main biomarkers available today for that purpose are serum creatinine and cystatin C. Several equations have been derived from those biomarkers and have been tested in that context with mixed results, due to their biologic variability and the lack of standardization in their measurement. The gold standard continues to be the direct determination of the glomerular filtration rate through different methods; however, that is only done for research purposes. It is also essential to know the current classification of acute kidney injury and chronic kidney disease in order to make early diagnosis. The present review focuses on the recognition, diagnosis, and classification of chronic kidney disease and acute kidney injury in liver transplantation recipients.
La enfermedad renal crónica (ERC) y la lesión renal aguda (LRA), son complicaciones frecuentes de pacientes con enfermedad hepática avanzada en lista de espera para un trasplante hepático (TH) ortotópico. Asimismo, son de las principales comorbilidades a las que se enfrentan una vez trasplantados. Actualmente se realizan cada año en Estados Unidos más de 75001 trasplantes de hígado con excelentes resultados a largo plazo. Este éxito es debido en parte a la introducción de los inhibidores de calcineurina (ICN) como terapia inmunosupresora de mantenimiento. Sin embargo, se ha demostrado que estos fármacos son intrínsecamente nefrotóxicos por un mecanismo mediado por vasconstricción renal crónica, así como al desarrollo de otros efectos secundarios potencialmente adversos para los riñones como: dislipidemia, hipertensión y diabetes2. O’Riordan et al. reportaron en un estudio de biopsias renales realizadas en pacientes receptores de TH que las principales causas de ERC fueron: toxicidad por ICN (48%), nefropatía diabética (19%), glomerulonefritis membranoproliferativa (17%), nefropatía por IgA (9%), necrosis tubular aguda (4%) y glomerulonefritis crescéntica (3%)3. Por su parte, Gonwa et al. atribuyeron el 73.3% de las causas de enfermedad renal crónica terminal (ERCT) a la toxicidad por los ICN, seguida por el síndrome hepatorrenal que no recuperó la función renal2.
La alta prevalencia de alteraciones en la función renal aguda o crónica en pacientes receptores de órgano sólido, y su asociación con una disminución de la sobrevida global4, nos obliga a diagnosticarla y tratar oportunamente. La prevalencia de disfunción renal en pacientes en lista de espera para TH es muy variable; se ha reportado que la prevalencia de ERC es del 30 al 90% y de LRA del 25 al 50%5. En parte esta variabilidad se debe a que los métodos diagnósticos actuales son imprecisos. A finales de los años noventa, Nair et al. evaluaron la presencia de disfunción renal en casi 20 000 pacientes que fueron receptores de TH entre 1988 y 1996. Al momento del TH, el 33% de los pacientes tuvieron una tasa de filtrado glomerular (TFG) alterada. Demostraron que una tasa de TFG estimada (TFGe) pretrasplante <40ml/min/1.73m2 estaba asociada a una menor sobrevida a corto y largo plazo en pacientes receptores de TH. Por último, fueron de los primeros en sugerir que se lleve a cabo un trasplante combinado de hígado y riñón (TCHR) en pacientes con una TFGe menor de 30ml/min/1.73m26.
Impacto del MELD en el desarrollo de la enfermedad renal crónicaEn un intento por disminuir la mortalidad de los pacientes en lista de espera, dando prioridad «al más enfermo», en febrero de 2002 se adoptó en Estados Unidos de Norteamérica (EUA) el puntaje MELD (por sus siglas en inglés: model for end-stage liver disease) para la asignación de órganos. Este modelo predice la mortalidad a los 3 meses y utiliza 4 variables: creatinina sérica (CrS), bilirrubina total, INR y terapia de remplazo renal (TRR)7.
Este modelo se adoptó como la principal herramienta para la asignación de órganos en EUA. Se ha postulado que la CrS tiene un peso desproporcionado para el cálculo del MELD, por lo que desde su introducción los pacientes con disfunción renal (aguda o crónica) han tenido prioridad en las listas de espera8. Gonwa et al. en su análisis retrospectivo de 25 023 trasplantes realizados en la era post-MELD, encontraron un incremento significativo en el número de pacientes trasplantados con CrS>1.0mg/dl o en hemodiálisis, así como un aumento de más del doble de TCHR. Los pacientes con un alto puntaje MELD tienen aún mayor riesgo de desarrollar ERC y sus complicaciones9.
No es sorprendente entonces, que la incidencia de ERC avanzada en la era post-MELD se haya incrementado. Sharma et al. analizaron una cohorte de 221 pacientes que recibieron un TH entre febrero 2002 y febrero 2007; definieron ERC postrasplante hepático (post-TH) como una TFGe<30ml/min/1.73m2 por 3 o más meses, inicio de TRR o listado para trasplante renal. Con una media de seguimiento de 2.6 años (rango: 0.01-5.99), encontraron que 31 pacientes desarrollaron ERC con una incidencia acumulada a 5 años del 22%. Al momento del trasplante, el 36% de sus pacientes tenían una TFGe<60ml/min/1.73m2. La TFGe pretrasplante fue el único predictor independiente para el desarrollo de ERC post-TH (HR=1.33; p<0.05)10.
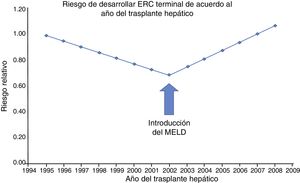
No solo se ha incrementado el riesgo de ERC en la era post-MELD, si no también el de enfermedad renal crónica terminal (ERCT), es decir aquellos pacientes que necesitan terapia sustitutiva de la función renal. Esto se hizo patente en un estudio de Sharma et al. donde compararon la incidencia de ERCT antes y después de la introducción del MELD. Incluyeron pacientes receptores de TH desde abril 1995 y diciembre 2008 (n=59 242) con datos obtenidos del Scientific Registry of Transplant Recipients (fig. 1). Su principal hallazgo fue que el riesgo relativo de desarrollar ERCT aumentó en un 15% (p=0.0049) desde 2002. Esta condición también se asoció fuertemente a mortalidad (HR=3.32; p<0.0001)11.
Tendencia en la incidencia ajustada por covarianza de la ERC, de acuerdo al año en que se realizó el trasplante hepático. Antes de 2002 (era pre-MELD), la tasa de la ERC postrasplante hepático disminuyó significativamente al 5.1% por año (RR: 0.949; IC 95%: 0.924-0.975; p=0.0001). Sin embargo, esta tendencia se revirtió en el 2002 (era MELD), mostrando un aumento anual en la incidencia de la ERCT del 7.6% (p=0.0001).
MELD: Model for End-stage Liver Disease.
Fuente: adaptado de Sharma et al.11.
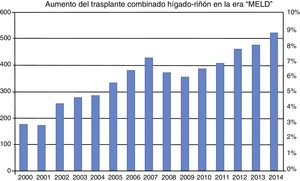
Por otro lado, se ha observado un aumento importante del número de TCHR en la era post-MELD. Simplemente en el reporte anual estadounidense del 2005, el número de TCHR realizados en ese país fue de 425, lo que se traduce en un aumento del 200% con respecto a la era pre-MELD12 (fig. 2). En la tabla 1 se listan los criterios aceptados actualmente para que un paciente sea considerado candidato para un TCHR.
Incidencia de trasplante combinado hígado-riñón 2000 a 2014. El número de trasplantes combinados se ha incrementado notablemente desde la inclusión del MELD en febrero de 2002. La incidencia de este tipo de trasplante en la era pre-MELD era menor al 3%. En la era MELD se ha incrementado a más del 8%.
MELD: Model for End-stage Liver Disease.
Fuente: adaptado de Sharma et al.38.
Criterios para un TCHR en pacientes en lista de espera para TH
| 1. Candidatos con LRA persistente >4 semanas más uno de los siguientes: |
| a. Estadio F (RIFLE) |
| b. TFG≤ 35ml/min/1.73m2 (estimada por MDRD) o ≤25 ml/min (medida mediante aclaramiento de 125I-iotalamato) |
| 2. Candidatos con ERC, definida por KDOQI, por al menos 3 meses, más uno de los siguientes: |
| a. TFG≤40ml/min/1.73m2 (estimada por MDRD) o ≤30 ml/min (medida mediante aclaramiento de 125I-iotalamato) |
| b. Proteinuria >2g/día |
| c. Biopsia renal con >30% de esclerosis glomerular o >30% de fibrosis intersticial |
| d. Presencia de enfermedad metabólica |
ERC: enfermedad renal crónica; LRA: lesión renal aguda; TFG: tasa de filtrado glomerular; TH: trasplante hepático; TCHR: trasplante combinado hígado-riñón.
Por otro lado, aumentó la tasa de trasplantes renales secuenciales, es decir, aquellos que se realizan en pacientes receptores de TH. El número total de trasplantes renales secuenciales se incrementó de 37 a 124 al año en el 2008 (0.9% de todos los trasplantes renales realizados). Gonwa et al. analizaron los trasplantes renales realizados de 1997 a 2008 utilizando datos del OPTN. En este periodo fueron realizados 157 086 trasplantes renales, de estos 680 trasplantes de donador fallecido y 410 de donador vivo fueron hechos en pacientes con un TH previo13.
Evaluación de la función renal pretrasplante hepáticoLa determinación precisa de la función renal es un aspecto crítico de la evaluación de los pacientes candidatos a recibir un TH; es relevante para la asignación equitativa de órganos destinados para trasplantes en solitario y para la toma de decisiones concernientes a trasplantes combinados. Diversos estudios han demostrado que las ecuaciones que se basan en la CrS no son lo suficientemente exactas para determinar la TFG en pacientes cirróticos candidatos a TH14,15. La introducción de nuevas fórmulas para estimar la TFG con base en los niveles serios de cistatina C (CistC) o en la combinación de este marcador con CrS, reavivaron la esperanza de contar con un método no invasivo que nos permitiera conocer la función renal de estos pacientes, sin embargo, se han obtenido resultados mixtos.
Biomarcadores y ecuaciones más utilizadasLa CrS es el biomarcador mas difundido y su uso se remonta a 1920. Es un aminoácido de 113Da producto de la degradación no enzimática de la creatina en los músculos. Se distribuye en la totalidad del agua corporal, se filtra libremente, no se une a las proteínas, ni es metabolizada en los riñones. Estas características la podrían hacer un buen marcador de la filtración glomerular, sin embargo, existen varios determinantes extra renales que influyen en su concentración sérica y, por lo tanto, disminuyen su utilidad. Los principales factores son: la edad, el sexo, la raza, la talla y la dieta, entre otros. De ellos el que cobra mayor relevancia es la masa muscular, ya que la mayoría de los pacientes con cirrosis hepática tienen algún grado de desnutrición. Por otro lado, aproximadamente el 10-20% de su excreción se debe a la secreción tubular y a su degradación por la microbiota intestinal. Estos factores disminuyen la concentración de CrS por lo que existe una tendencia a sobreestimar la TFG. Algunos fármacos como el trimetoprim o la cimetidina disminuyen su secreción tubular y tienen el efecto contrario en la TFGe16.
Las ecuaciones para el cálculo de la TFGe basadas en la CrS son las más utilizadas a nivel mundial y con las que se cuenta mayor experiencia. La fórmula de Cockcroft-Gault lleva el nombre de los autores que la describieron en 1976. Estima la depuración de creatinina a partir de la edad, el sexo y el peso. Fue descrita con datos de 249 pacientes de sexo masculino y se ajusta en mujeres asumiendo una producción menor de creatinina. Actualmente ha caído en desuso por su poca exactitud ya que sistemáticamente sobreestima la TFG en pacientes con sobrepeso o en estados edematosos17. La fórmula derivada del estudio: «The Modification of Diet in Renal Disease (MDRD)» utiliza edad, sexo, raza y CrS estandarizada para el cálculo de la TFGe. La población en la que se describió fue 1628 enfermos renales crónicos enrolados en el estudio MDRD que tuvieron una TFG medida (TFGm) por depuración de 125I-iotalamato. Dada la población utilizada en su concepción, esta fórmula no es exacta en niveles altos de TFG (>60ml/min/1.73m2)18. Existen 2 versiones, una de 6 variables (que además toma en cuenta el BUN o urea y la albúmina sérica) y la clásica de 4 variables, ambas son igual de exactas19.
En 2009 fue descrita otra ecuación basada en creatinina por el grupo Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) que incluyó a una población más diversa: jóvenes, diabéticos, trasplantados, personas con y sin diagnóstico de ERC, buscando mejorar las limitaciones de la ecuación MDRD. Utiliza las mismas 4 variables que esta última, sin embargo, corrige la infraestimación del la TFG en personas jóvenes o con mejor función renal. Es decir, es igual de exacta que la ecuación MDRD para TFGe<60ml/min/1.73m2, pero más exacta en >60ml/min/1.73m218.
Otro biomarcador que ha cobrado relevancia recientemente es la CistC. Esta es una enzima inhibidora de proteasa de cisteína de 13kDa se encuentra presente en todas las células nucleadas del organismo, se distribuye en el espacio extracelular, y se filtra libremente. Posteriormente es reabsorbida en su totalidad en los túbulos donde es degradada, por lo que en condiciones normales no se puede recuperar de la orina. No tiene secreción tubular ni una eliminación extrarrenal significativa. La concentración sérica de la CistC es independiente del sexo, edad, masa muscular y estado nutricional. Estas características la hacen un excelente marcador de la TFG y probablemente superior a la CrS. Sin embargo, su concentración se puede alterar en enfermedades tiroideas, neoplasias, estados inflamatorios y con el uso de glucocorticoides20. En general se puede afirmar que se conoce su comportamiento en individuos sanos, sin embargo, en pacientes enfermos podría tener un comportamiento distinto. Una de las principales ventajas que la CistC tiene sobre la CrS es su independencia de la masa muscular y esto la hace más exacta en las distintas composiciones corporales16. Por otro lado, su determinación es más costosa que la CrS y los ensayos estandarizados no están disponibles en todos los laboratorios.
Se ha demostrado que los niveles séricos de CistC predicen mejor la TFG, ya que se ven menos afectados que la CrS por la edad, la raza, el género y el estado nutricional, por ello se ha considerado como una potencial alternativa para el cálculo de la TFG21. Asimismo, la CistC es mejor predictor de mortalidad cardiovascular y por cualquier causa, que la CrS22. Sin embargo, las ecuaciones que se han basado solamente en CistC no han demostrado ser más exactas que aquellas basadas en CrS por los determinantes de los niveles de CistC independientes del filtrado glomerular23.
En 2012 Inker et al. del grupo CKD-EPI en colaboración con la National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), publicaron un estudio parte aguas para el cálculo de la TFGe utilizando ambos marcadores. Utilizaron información derivada de 5352 pacientes de 13 estudios distintos que contaban con TFGm por depuración de 125I-iotalamato. Desarrollaron 2 ecuaciones: una que utilizaba exclusivamente en CistC (CKD-EPI-CistC) y otra que combinaba CrS y CistC (CKD-EPI-Cr-CistC). Concluyeron que la ecuación CKD-EPI-Cr-CistC tuvo el mejor desempeño y excatitud para la estimación de la TFG comparado con la depuración de 125I-iotalamato y que esta ecuación podría ser de utilidad para confirmar la presencia de la ERC23. En Internet se puede acceder a una calculadora que incluye estas ecuaciones en: www.kidney.org/professionals/kdoqi/gfr_calculator.
Desempeño de las ecuaciones para el cálculo de TFGe en pacientes cirróticosDe Souza et al. condujeron el primer estudio donde compararon el desempeño de las ecuaciones descritas por los grupos CKD-EPI (CKD-EPI-Cr, CKD-EPI-CistC y CKD-EPI-Cr-CistC) con las más conocidas (MDRD-4, MDRD-6 y Hoek)24, en pacientes cirróticos evaluados para TH. El estándar de oro que utilizaron fue el aclaramiento renal de inulina. La muestra poblacional fue de 202 sujetos evaluados para TH que contaba con sujetos principalmente caucásicos y cuyas causas de fallo hepático fueron predominantemente cirrosis hepática por alcohol e infección crónica por virus de hepatitis C o B; esta muestra fue dividida en los siguientes subgrupos: sujetos con ascitis clasificados por la gravedad de esta y por el grado de disfunción hepática (MELD<15 o>15) y renal (clasificación de la Kidney Disease Outcomes Quality Initiative [KDOQI]). En general la media de TFG fue 80+31ml/min/1.73m2, el 74% de los sujetos tuvieron una TFGm>60ml/min/1.73m2 y el 26%<60ml/min/1.73m2; el 32% de los sujetos tuvieron una clasificación Child-Pugh C y el 18% tenían ascitis refractaria. El promedio del score MELD fue de 11+4, el 84% de los sujetos tuvieron un MELD<15. En general las ecuaciones que se basan en CistC (CKD-EPI-CistC y CKD-EPI-Cr-CistC) mostraron un mejor desempeño (menos sesgo y una mejor exactitud entre el 10 y el 30%) en los 3 grupos de ascitis y en los 2 subgrupos de MELD y Child-Pugh. De esperarse, las ecuaciones MDRD-4, MDRD-6 y CKD-EPI-Cr tuvieron un peor desempeño en general, sobre todo al empeorar el grado de ascitis. La ecuación CKD-EPI-CistC tuvo un mejor desempeño en pacientes con ascitis severa y con una TFGm inicial<60ml/min/1.73m2. Sin embargo, solamente el 47-67% de los candidatos a TH fueron clasificados correctamente de acuerdo con la clasificación de KDOQI. En este estudio encontraron que las ecuaciones que usan CrS tuvieron una tendencia de sobreestimar la TFG mientras que las basadas en CistC tendieron a infraestimarla, sobretodo en sujetos con una TFGm>60ml/min/1.73m225.
A su vez Mindikoglu et al. compararon el desempeño de la ecuación de CKD-EPI-Cr-CistC (usando los parámetros: sesgo, precisión y exactitud) contra las ecuaciones de Cockcroft-Gault, MDRD-4, MDRD-6, CKD-EPI-Cr y CKD-EPI-CistC, y la depuración de CrS en 24h. Analizaron 72 pacientes con cirrosis hepática, usando la TFGm mediante la depuración de 125I-iotalamato como referencia. La mayoría de los sujetos (40%) tenían cirrosis hepática secundaria a infección por VHC. En cuanto a la ascitis, el 35% no la presentaron, el 37% tenían ascitis que respondía al uso de diuréticos y el 28% tuvieron ascitis refractaria. En cuanto a la ERC, el 29% tuvieron una TFGm<60ml/min/1.73m2. Esta fue significativamente menor en sujetos con ascitis (71.1 contra 106.9ml/min/1.73m2, respectivamente; p=0.0001). A diferencia del estudio publicado por De Souza et al.25, excluyeron a los pacientes con el diagnóstico de hepatocarcinoma. Encontraron que la ecuación CKD-EPI-Cr-CistC tiene una exactitud significativamente mejor que las otras ecuaciones analizadas. Sin embargo, en el 23.6% de los sujetos se encontraron una diferencia >30% (1-P30), y en el 44.4% se encontraron una diferencia mayor al 20% (1-P20), al ser comparadas con la TFGm. Por otro lado, la ecuación CKD-EPI-Cr-CistC tuvo una mejor precisión y exactitud en pacientes con una TFGm<60ml/min/1.73m226.
Los resultados de estos 2 últimos estudios concuerdan con lo previamente reportado en la literatura. Las ecuaciones MDRD-6, CKD-EPI-CistC y CKD-EPI-Cr-CistC tuvieron desempeños aceptables y aplicables en la clínica, sin embargo, fueron mejores en pacientes con ERC avanzada. Las ecuaciones con base en CrS tienden a sobrestimar la TFG, por el contrario, las que usan CistC tendieron a infraestimarla. Este hecho tiene especial relevancia cuando la TFGe se acerca a 40ml/min/1.73m2, límite donde se recomienda llevar a cabo un TCHR27.
Se ha observado una tendencia de las fórmulas tradicionales a tener un desempeño más pobre en pacientes con cirrosis avanzada o con ascitis. Esto no se observó con las nuevas ecuaciones que se basan en CistC según lo publicado por De Souza et al.25. Esta característica podría constituir una de sus principales ventajas, sin embargo, dicho estudio tuvo como característica la inclusión de sujetos con puntajes de MELD predominantemente bajos. En conjunto estos datos apoyan el uso de las nuevas ecuaciones que utilizan CistC, lamentablemente este marcador no se encuentra disponible en la mayoría de los centros25,26,28.
Recientemente Kalafateli et al.29, desarrollaron y validaron una fórmula (usando regresión linear múltiple por etapas) para estimar la TFG en pacientes cirróticos y la compararon con algunas de las fórmulas existentes (MDRD-4, MDRD-6, CKD-EPI-Cr, CKD-EPI-CistC y CKD-EPI-Cr-CistC). Incluyeron 469 sujetos en evaluación para TH entre 2011 y 2014, y 2 cohortes para la validación interna y externa de 82 y 174 pacientes, respectivamente. La TFGm fue determinada mediante el aclaramiento de un isótopo radioactivo. La ecuación derivada con la r2 máxima (74.6%) es la siguiente:
TFGe=45.9 × (CrS-0.836 en ?mol/l) × (urea-0.229 en mmol/l) × (INR-0.113) × (edad-0.129) × (Na-0.972 en mmol/l) × (0.809 si es mujer) × (0.92 si tiene ascites moderada o severa)
Encontraron que esta ecuación, denominada: TFG en cirróticos del Royal Free Hospital (RFH), tuvo un mejor desempeño y exactitud para predecir la TFGm, con valores de P10, P30 y P50 (es decir su variación porcentual con respecto de la TFGm) del 56.1, 89 y 98.8%, respectivamente en la cohorte de validación externa y del 45.4, 88.5 y 96.6% en la cohorte de validación interna. Esto no se vio influenciado por el grado de disfunción hepática. Los autores también reportan un mayor grado de exactitud comparado con las ecuaciones con base en CistC, sin embargo, no utilizaron un método estandarizado para su medición por lo que no lo consideraron como un resultado relevante.
De ser posible nuestra primera opción para determinar la TFG en pacientes cirróticos candidatos a TH sería medirla directamente mediante uno de los métodos estándar como la depuración de inulina o 125I-iotalamato. Como segunda opción se recomienda utilizar las ecuaciones CKD-EPI-CistC o CKD-EPI-Cr-CistC, sin embargo, los ensayos para medir CistC no están todos estandarizados, su uso no está generalizado y es más costosa. Finalmente, si no tenemos acceso a ninguno estos métodos, podemos utilizar la ecuación descrita por Kalafateli et al.29 (que no ha sido estudiada en población mexicana) o la ecuación MDRD. No debemos de olvidar que el desempeño de las fórmulas para estimar la TFG es pobre en pacientes cirróticos. La explicación más razonable es que estas fórmulas no fueron descritas ni validadas en pacientes con cirrosis hepática por lo que su desempeño es subóptimo. La ecuación del RFH fue diseñada para el cálculo de la TFG en pacientes cirróticos, sin embargo, falta ser validada en diferentes poblaciones, incluyendo latinoamericanos.
Evaluación de la función renal postrasplante hepáticoLa evaluación de la función renal después de un TH es de vital importancia para el seguimiento ulterior de estos pacientes. El riesgo de ERC o de que esta progrese a ERCT, en pacientes receptores de un órgano sólido es alto. Por otro lado, tener ERC les confiere una mayor morbimortalidad4.
Lesión renal aguda post-THEl desarrollo de LRA después de un TH es una de las complicaciones tempranas más frecuentes. Recientemente se ha descrito que la LRA es uno de los principales factores de riesgo para en un futuro desarrollar ERC y ERCT, de ahí surge la importancia en su prevención, identificación y tratamiento oportuno30. Debido a las múltiples definiciones usadas en diferentes estudios, la incidencia reportada es muy variable. Así, por ejemplo, cuando se ha definido LRA como un incremento en la CrS≥50% por encima del nivel preoperatorio, podemos encontrar una incidencia del 56.6% en el posoperatorio. Las 2 clasificaciones más estudiadas para definir la LRA en el contexto del TH, son la clasificación de Risk, Injury, Failure, Loss, End stage (RIFLE)28 y la de Acute Kidney Injury Network (AKIN)31. Cuando se utiliza la definición de LRA de acuerdo al grupo AKIN la incidencia postrasplante es del 60.1%32. En el 2012 fueron publicadas las guías Kidney Disease Improving Global Outcomes (KDIGO) de la LRA que combina los aspectos más importantes de las clasificaciones previas. Sin embargo, en la mayoría de la literatura todavía se encuentran las clasificaciones antiguas33 (tabla 2).
Definición de lesión renal aguda
| Criterios por CrS | Diuresis | |||
|---|---|---|---|---|
| RIFLE | AKIN | KDIGO | ||
| Definición | Incremento de la CrS>1.5 veces la basal en <7 días | Incremento de la CrS en 0.3mg/dl o 1.5 veces la basal en <48h | Incremento de la CrS de 0.3mg/dl en <48h o 1.5 veces la basal en los 7 días previos | Diuresis <0.5ml/kg/h por >6h |
| Estadio | ||||
| RIFLE-Risk, AKIN estadio 1, KDIGO estadio 1 | Incremento de la CrS basal de 1.5 veces | Incremento de la CrS basal de 0.3mg/dl o de 1.5 a 1.9 veces | Incremento de la CrS basal de 0.3mg/dl en <48h o 1.5 a 1.9 veces | Diuresis <0.5ml/kg/h por >6h |
| RIFLE-Injury, AKIN estadio 2, KDIGO estadio 2 | Incremento de la CrS basal de 2 a 2.9 veces | Incremento de la CrS basal de 2 a 2.9 veces | Incremento de la CrS basal de 2 a 2.9 veces | Diuresis <0.5 ml/kg/h por >12h |
| RIFLE-Failure, AKIN estadio 3, KDIGO estadio 3 | Incremento de la CrS basal >3 veces | Incremento de la CrS basal >3 veces | Incremento de la CrS basal >3 veces o CrS>4mg/dl o inicio de la TRR | Diuresis <0.3ml/kg/h por ≥24h o anuria por ≥12h |
| RIFLE-Loss | Necesidad de la TRR por >4 semanas | |||
| RIFLE-End Stage. | Necesidad de la TRR por >3 meses | |||
CrS: creatinina sérica; TRR: terapia de remplazo renal.
Al comparar la clasificación RIFLE y AKIN para determinar la incidencia de LRA, en los pacientes post-TH, encontramos diferencias significativas. Karapanagiotou et al. aplicaron ambos criterios para determinar la incidencia de LRA en una cohorte de 71 pacientes. De acuerdo con RIFLE, un 39.4% de los pacientes tuvieron LRA post-TH. Empero, de acuerdo a los criterios de AKIN, un 52.1% de los pacientes presentaron LRA, siendo una diferencia significativa34. En un estudio reciente, Hilmi et al. determinaron que la incidencia de LRA (usando la clasificación de KDIGO) dentro de las primeras 72h post-TH era del 52%, siendo esta tasa similar a lo publicado previamente usando la clasificación de LRA de AKIN35.
El perfil hemodinámico de los pacientes con cirrosis hepática avanzada, así como las intervenciones destinadas para su tratamiento, les confieren un riesgo especialmente elevado de desarrollar LRA y/o ERC. Esto cobra aun mayor relevancia si el paciente en cuestión tiene además una cirrosis descompensada. La LRA en pacientes cirróticos puede clasificarse en 3 grandes grupos5:
- 1.
Daño renal intrínseco, como necrosis tubular aguda o glomerulonefritis: 29%.
- 2.
Alteraciones funcionales por la disminución del flujo sanguíneo renal, como síndrome hepatorrenal: 70%.
- 3.
Problemas obstructivos de las vías urinarias: 1%.
Estas distintas causas de disfunción renal no son mutuamente excluyentes y pueden coexistir, o inclusive ser parte de un continuo donde el daño renal intrínseco puede ser precedido de una alteración funcional u obstructiva36.
Teniendo en cuenta que un porcentaje significativo de los pacientes postrasplantados pueden cursar con LRA, es importante conocer cuáles son los factores asociados a su desarrollo. Entre los factores de riesgo identificados se encuentran: historia de infección por virus de hepatitis C, diabetes mellitus, hipertensión arterial sistémica, disfunción renal previo al trasplante (aguda o crónica), uso de diuréticos, puntajes MELD y de Child-Pugh, uso de ICN postrasplante, momento del inicio de ICN, el índice de masa corporal (IMC) y la necesidad de trasfundir concentrados eritrocitarios, entre otros5,35,37.
La mayoría de estas variables reflejan la gravedad del paciente previo al TH. La transfusión de hemoderivados, principalmente concentrados eritrocitarios durante el procedimiento quirúrgico, refleja sangrado y una disminución del volumen intravascular efectivo. Esto finalmente impacta negativamente en la función renal después del procedimiento mediante un mecanismo de hipoxia local y generación de radicales libres de oxígeno al restablecer la circulación normal (isquemia-reperfusión)38. Se ha observado que la obesidad afecta la dosificación y el volumen de distribución de medicamentos potencialmente nefrotóxicos. Finalmente, los ICN, como el tacrolimus, inducen vasoconstricción transitoria de la arteria renal que lleva a un deterioro en la función renal mediante el mecanismo de isquemia-reperfusión39.
Hoy en día no existe una fórmula para estimar la TFG en LRA. Las fórmulas habituales fueron descritas en pacientes sin variaciones agudas o abruptas de la función renal, es decir, en su estado basal. Es por ello que su uso en escenarios agudos no es adecuado ya que sobreestiman la TFG real.
Las estrategias de prevención de LRA y por ende ERC descritas, si bien son tema de una revisión completa, vale la pena mencionarlas40:
- 1.
Mantener un estado de volumen adecuado usando principalmente soluciones balanceadas para evitar la aparición de acidosis metabólica hiperclorémica41.
- 2.
Prevenir la sobrecarga de volumen siguiendo el esquema conceptual de las 4 fases de reanimación: rescate, optimización, estabilización y desescalamiento42. Bouchard et al. definieron esta condición como un aumento del peso corporal >10% y lo asociaron a un aumento de mortalidad a 60 días en pacientes con LRA y a una menor recuperación de la función renal43.
- 3.
Asegurar una perfusión renal adecuada, con una TAM>65mmHg, mediante el uso apropiado de soluciones cristaloides o coloides (albúmina) para restituir el volumen circulante efectivo, así como el uso de aminas vasoactivas (norepinefrina) de forma temprana40. En pacientes con historia de hipertensión arterial una TAM objetivo de 80-85mmHg se asoció a mejores desenlaces renales (LRA y TRR) en pacientes sépticos; sin embargo, también presentaron mayor incidencia de fibrilación auricular44.
- 4.
Existen diversos estudios que sugieren que la técnica quirúrgica utilizada en el TH también es importante para el desarrollo de LRA. Entre ellos, el publicado por Cabezuelo et al. sugirió que técnica denominada «piggy-back» reducía significativamente el riesgo de LRA posquirúrgica comparada con la técnica habitual (con o sin bypass venovenoso). Esto se atribuyó a que en esta técnica no se tiene que hacer una disección retrocava, disminuyendo el sangrado retroperitoneal45.
- 5.
El uso temprano de los ICN se ha asociado a LRA temprana. Sin embargo, como fue mencionado al inicio de la revisión, su principal problema es su uso crónico. Los ICN si bien son parte esencial de la inmunosupresión de la mayoría de trasplantes de órgano sólido, a largo plazo pueden ser nefrotóxicos. Inicialmente causan vasoconstricción reversible de la arteriola aferente, hipertensión, acidosis metabólica e hiperkalemia46. Con el uso crónico se desarrolla nefropatía por ICN que se caracteriza por: hialinosis arteriolar, arteriolopatía obstructiva, atrofia y vacuolización tubular, fibrosis intersticial y esclerosis glomerular. Algunos estudios han demostrado que la introducción tardía de estos fármacos, reducción de su dosis o terapias de mantenimiento libres de ICN mejoran sustancialmente la función renal5,47. Por otro lado, Ishani et al. describieron una menor tasa de nefrotoxicidad (definido como duplicar la CrS basal) asociada al uso de tacrolimus comparado con ciclosporina A en pacientes trasplantados de pulmón o corazón48.
La prevalencia de ERC en pacientes receptores de un órgano sólido se ha reportado desde un 10 hasta un 90%37,38. Esta variabilidad se explica por los diferentes criterios utilizados para su definición, diferentes metodologías de cada estudio, pero sobre todo por las limitaciones inherentes a las fórmulas para el cálculo de la TFG dependientes de CrS. El diagnóstico de ERC se ha asociado a un incremento dramático en eventos adversos cardiovasculares, un riesgo incrementado de hospitalizaciones y a una mortalidad 4 veces mayor comparados con pacientes con función renal conservada5.
El estudio más extenso y completo sobre este tema fue publicado por Ojo et al. donde se definió a la ERC como una TFG<30ml/min/1.73m2 (calculada con la fórmula MDRD-4). Los autores reportaron una prevalencia del 16% de ERC a 5 años en pacientes post-TH, siendo esta superada solo por los pacientes trasplantados de intestino en los que se reportó una prevalencia del 21.3%4. Cabe mencionar que si se hubiera utilizado la definición moderna propuesta por KDIGO que va desde una TFG<60ml/min/1.73m2 e incluye albuminuria, esta prevalencia hubiera sido mucho más elevada. También recientemente O’Riordan et al. publicaron un estudio donde examinado el riesgo de ERC en 230 receptores de TH, utilizando los criterios de KDOQI, encontraron que, a 10 años, el 2.26% desarrollaron ERC estadio 5, el 6.11% estadio 4, el 56.77% estadio 3 y el 23.7% estadio 2. El resto tuvieron un mínimo deterioro o no tuvieron deterioro de la función renal49. Asimismo, se ha reportado que el riesgo de desarrollar ERCT es del 5% por año en pacientes que han recibido un trasplante de órgano sólido o de células hematopoyéticas50. Gonwa et al. reportaron una incidencia de ERCT de hasta el 18% a 10 años post-TH2.
El impacto que tiene la función renal en la sobrevida de estos pacientes quedó patente en el trabajo de Allen et al. Los autores realizaron un estudio prospectivo de una cohorte de pacientes receptores de TH. Su objetivo fue determinar la asociación que guardan una disminución en la TFG con su sobrevida. Incluyeron un total de 1211 trasplantados de la Clínica Mayo, donde de forma protocolizada se les realizan mediciones de la TFG a estos pacientes utilizando 125I-iotalamato. Después de 25 años del TH, el 54% de los pacientes fallecieron, el 9% se sometieron a trasplante renal, y el 7%, 21% y 18% tuvieron una TFGm>60, 59 a 30 y<30ml/min/1.73m2, respectivamente. El riesgo de morir aumentó significativamente cuando la TFGm disminuía a<30ml/min/1.73m2; HR: 2.67 (IC 95%: 1.8-3.96) para una TFGm de 29 a 15ml/min/1.73m2 y HR: 5.47 (IC 95%: 3.1-9.65) para una TFGm<15ml/min/1.73m2. Cabe destacar que la TFGe mediante las fórmulas convencionales, infraestimaba este riesgo en pacientes con TFGm de 30 a 90ml/min/1.73m251.
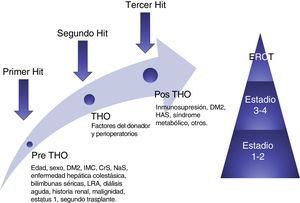
Recientemente Sharma et al. propusieron una teoría de 3 «hits» para simplificar la compleja fisiopatología de esta enfermedad. Previo al TH, la hemodinámica de los pacientes cirróticos descompensados, en especial la renal, se ve comprometida por la presencia de hipertensión portal y vasodilatación sistémica; esto constituye el primer «hit». Posteriormente durante el trasplante existen condiciones inherentes que pueden afectar la función renal, principalmente episodios de hipovolemia, segundo «hit». Por último, el tercer «hit» está constituido por los factores que a la larga pueden contribuir al deterioro de la función renal, como son: el uso de inmunosupresores (ICN), diabetes, hipertensión arterial, nefrotóxicos, y episodios subsecuentes de LRA37 (fig. 3).
Modelo conceptual de la ERC postrasplante hepático ortotópico. El modelo muestra los factores de riesgo y 3 «hits» que resultan en daño renal y, finalmente contribuyen al desarrollo de ERC.
CrS: creatinina sérica; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; ERCT: enfermedad renal crónica terminal; IMC: índice de masa corporal; LRA: lesión renal aguda; NaS: sodio sérico; THO: trasplante hepático ortotópico.
Fuente: adaptado de Sharma et al.38.
Identificar qué pacientes tiene mayor riesgo de desarrollar ERC a mediano plazo puede ser todo un reto. Se han estudiado varias cohortes que han tratado de identificar los factores de riesgo que más frecuentemente se han asociado a esta complicación. Históricamente los más aceptados son la función renal previa al trasplante, las características demográficas de cada paciente, sus comorbilidades, los episodios de LRA en el periodo peritrasplante y la exposición crónica a los ICN52. En el trabajo de Sharma et al. los principales factores de riesgo asociados al desarrollo de ERCT fueron: raza negra, hepatitis C, historia de diabetes mellitus (DM) previo al TH, niveles elevados de CrS pretrasplante, niveles bajos de albúmina sérica, niveles bajos de bilirrubinas y NaS >141mEq/l al momento del trasplante11.
O’Riordan et al. desarrollaron un modelo que predice el riesgo de alcanzar una TFGe menor a 30ml/min/1.73m2 en el año posterior al TH. Utilizaron una cohorte de 368 pacientes del Reino Unido sometidos a TH, cuya información fue obtenida prospectivamente. Las variables que se usaron en el modelo final fueron: CrS, historia de hipertensión, grado de proteinuria y duración de LRA postrasplante. Estas variables fueron evaluadas pretrasplante (excepto los episodios de LRA). Para pacientes con un puntaje mayor a 2.16, su sensibilidad y especificidad fueron de 99.2 y 100%, respectivamente (valor predictivo positivo del 70%, valor predictivo negativo del 100%), con un área bajo la curva ROC de 0.996, para predecir el desarrollo de ERC (TFG<30ml/min/1.73m2)52. La ecuación que generaron es la siguiente:
Riesgo de progresión a una TFGe<30ml/min/1.73m2a un año postrasplante
R=−1.8+[(0.001) (duración de LRA en días)+(0.64) (proteinuria en g/24h)+(0.013) (CrS en μmol/l)+(1.5 si tiene diagnóstico de hipertensión arterial)
Israni et al. por su parte realizaron un estudio de la cohorte de receptores de TH, mayores de 18 años tomando datos de Scientific Registry of Transplant Recipients (SRTR) y US Renal Data System (USRDS), respectivamente, pertenecientes a la era del MELD. Pacientes con un trasplante previo, trasplante multiorgánico o con diagnóstico de enfermedad ERCT fueron excluidos; la muestra final estudiada incluyó a 39 611 pacientes. Desarrollaron un modelo para predecir el riesgo de desarrollar ERCT a 6 meses y de 6 meses a 5 años postrasplante. Los principales predictores independientes para el desarrollo de ERCT a 6 meses fueron: edad, historia de DM, historia de neoplasias malignas, IMC, CrS, hemodiálisis la semana previa al trasplante e índice de riesgo del donador (DRI). En cuanto a la incidencia de ERCT después de 6 meses, los principales predicadores fueron: DM al momento del trasplante, estatus de hepatitis C, raza afroamericana, nivel de albúmina sérica, bilirrubinas totales y CrS al momento del trasplante. La debilidad de este último modelo fue que no incluyó los episodios de LRA peritrasplante53.
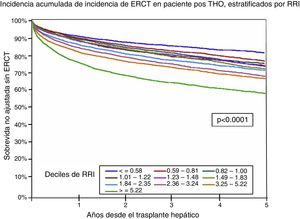
Por último, Sharma et al. realizaron y validaron un puntaje para determinar el riesgo de ERC post-TH y lo llamaron índice de riesgo renal (RRI). Este puntaje se derivó de una cohorte que incluyó a 43 514 receptores de TH. Se realizó con base en 14 factores de riesgo independientemente asociados al desarrollo de ERCT: edad del receptor al momento de trasplante, raza afroamericana, enfermedad colestásica, HCV positivo, IMC, diagnóstico de DM2, nivel de albúmina, CrS, bilirrubinas, NaS, estatus 1, retrasplante, historia de TIPS y hemodiálisis aguda postrasplante. El RRI fue estratificado en deciles con base al riesgo estimado, donde puntajes mayores se asociaron a una mayor tasa de ERCT a 5 años. Este puntaje representa el riesgo relativo de desarrollar ERCT postrasplante (IC 95%: 0.75-0.78). Este riesgo también se asoció a una mayor mortalidad postrasplante54 (fig. 4).
Sobrevida sin ERCT posterior a un trasplante hepático ortotópico estratificado por el RRI.
ERCT: enfermedad renal crónica terminal; RRI: índice de riesgo renal.
Fuente: adaptado de Sharma et al.55.
Conocer estos factores de riesgo nos permite desarrollar estrategias de prevención para el desarrollo de ERCT por lo que no podemos dejar de enfatizar su importancia. Por ejemplo, en un paciente que tiene alto riesgo para el desarrollo de ERCT debemos de maximizar nuestros esfuerzos para evitar eventos de LRA en el periodo peritrasplante; por otra parte, existen condiciones que no podremos modificar como neoplasias o condiciones derivadas del donador. Asimismo, debemos de prestar especial atención al tratamiento de las comorbilidades asociadas al deterioro de la función renal, principalmente DM2, HAS, infección por virus de la hepatitis C, minimizar la exposición a los ICN, entre otros53,54.
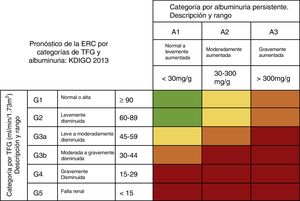
Diagnóstico de enfermedad renal crónica postrasplante hepáticoKDIGO define la ERC como: el conjunto de anormalidades renales anatómicas o funcionales presentes por más de 3 meses y que tiene implicaciones para la salud. Se clasifica de acuerdo a su causa, la TFG y la albuminuria27 (fig. 5).
Riesgo de progresión y desenlaces adversos de la ERC: verde: bajo riesgo (sin otros marcadores de enfermedad renal, no se considera que exista tal); amarillo: riesgo moderadamente incrementado; naranja: alto riesgo, y rojo: muy alto riesgo.
ERC: enfermedad renal crónica; TFG: tasa de filtrado glomerular.
Fuente: adaptado de Guías KDIGO 201328.
La correcta estimación de la TFG es de vital importancia para el diagnóstico y la clasificación de la ERC. Sin embargo, actualmente aun no contamos con un método preciso y confiable para estimarla en pacientes sometidos a un trasplante de órgano sólido. El «estándar de oro» es la medición directa de la TFG mediante el aclaramiento de inulina, 125I-iotalamato u otros radio-marcadores. Estos son métodos caros, técnicamente laboriosos y poco disponibles. Debido a esto, las guías de TCHR más recientes publicadas en 2012 aun recomiendan la estimación de la TFG mediante la fórmula MDRD ya que era la que sobreestimaba la TFG con menor frecuencia55.
Conociendo las limitaciones de la CrS, en 2002 Schück et al. publicaron un estudio donde demostraron una correlación negativa de la función renal en pacientes receptores de TH y los niveles de CistC. Incluyeron en su estudio 58 pacientes receptores de TH (media: 14+10 meses) a quienes se les determinó CrS, CistC, depuración de creatinina y se compararon con el aclaramiento de inulina como estándar de oro. Encontraron una correlación entre una disminución en el aclaramiento de inulina <80ml/min con unos niveles serios de CistC>1.2mg/dl, con una sensibilidad del 96%. Sin embargo, no demostraron una clara superioridad de este parámetro comparado con la CrS56.
En un estudio más reciente, Wagner et al. evaluaron a las fórmulas basadas en CrS y CistC para el cálculo de la TFG en pacientes receptores de TH usando el aclaramiento inulina como referencia. Las fórmulas evaluadas fueron MDRD 4, Cockcroft-Gault, Hoek, Larsson, CKD-EPI basadas en CrS y CistC. Incluyeron 49 pacientes (67% sexo masculino) receptores de un TH a quienes se les hizo una determinación de CrS, CistC y el aclaramiento de inulina a los 24 meses postrasplante. Se determinó el sesgo, la precisión y la exactitud para cada fórmula en comparación con el aclaramiento de inulina. Del grupo estudiado, el 45% tuvieron un TFG medida menor a 60ml/min/1.73m2 a los 2 años postrasplante. En general las ecuaciones que usan CistC fueron superiores a las basadas en CrS en la identificación de pacientes con una TFG<60ml/min/1.73m2. Las fórmulas que identificaron correctamente un mayor número de pacientes con ERC fueron: Hoeck, Larsson y CKD-EPI-CistC (84, 88 y 88%, respectivamente). Las fórmulas de MDRD4 y CKD-EPI-Cr solamente identificaron el 48 y el 40% de estos pacientes, respectivamente57.
ConclusionesEl desarrollo de ERC es una de las comorbilidades mas frecuentemente encontradas en los pacientes trasplantados de órgano sólido. Es sumamente importante conocer con precisión la función renal de los pacientes en lista de espera de trasplante para, desde ese momento, poder tomar medidas preventivas y así preservar su función renal. Durante la cirugía también se deben de tomar las medidas necesarias para prevenir el desarrollo de LRA que es uno de los principales factores de riesgo para el desarrollo de ERC. Desafortunadamente, los distintos métodos, fórmulas y herramientas con las que contamos para su diagnóstico, seguimiento y tratamiento distan de ser ideales. El cálculo de la TFG es impreciso en pacientes cirróticos y en pacientes post-TH ya que la mayoría de las fórmulas no fueron descritas en estas poblaciones. Sin embargo, conocer la trayectoria de la función renal de dichos pacientes nos permitirá establecer estrategias de prevención y/o tratamientos a largo plazo. Consideramos importante que los pacientes con disfunción renal o con alto riesgo de complicaciones renales tengan una evaluación nefrológica como parte de su evaluación pretrasplante. Asimismo, debemos tener un bajo umbral para referir con un nefrólogo a los pacientes trasplantados con alto riesgo de progresión de ERC o de presentar desenlaces renales adversos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores no recibieron financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses para la realización de este trabajo.