El tratamiento y el pronóstico de la diarrea crónica en el paciente inmunosuprimido dependen de la capacidad para detectar rápidamente los agentes etiológicos.
ObjetivosEvaluar los resultados del panel gastrointestinal (GI) FilmArray® en pacientes con diarrea crónica e infección por VIH de reciente diagnóstico.
Material y métodosMuestreo no probabilístico a conveniencia de manera secuencial. Se incluyeron 24 pacientes a quienes se realizó el estudio molecular para la detección simultánea de 22 patógenos.
ResultadosEn 24 pacientes infectados por el VIH con diarrea crónica se detectaron bacterias enteropatógenas en el 69% de los casos, parásitos en el 18% y virus en el 13%. Escherichia coli enteropatógena y Escherichia coli enteroagregativa fueron las principales bacterias identificadas; Norovirus fue el agente viral más frecuente encontrado (33%), seguido de Giardia lamblia (25%). La mediana del número de agentes infecciosos por paciente fue 3 (rango de 0 a 7). Los agentes biológicos no identificados por este método fueron tuberculosis y hongos.
ConclusionesUtilizando el panel GI FilmArray® se detectaron simultáneamente varios agentes infecciosos en pacientes con diarrea crónica e infección por VIH.
The treatment and diagnosis of chronic diarrhea in the immunocompromised patient depends on the ability to rapidly detect the etiologic agents.
AimsOur aim was to evaluate the results of the FilmArray® gastrointestinal panel in patients newly diagnosed with HIV infection that presented with chronic diarrhea.
Material and methodsUtilizing nonprobability consecutive convenience sampling, 24 patients were included that underwent molecular testing for the simultaneous detection of 22 pathogens.
ResultsIn 24 HIV-infected patients with chronic diarrhea, enteropathogen bacteria were detected in 69% of the cases, parasites in 18%, and viruses in 13%. Enteropathogenic Escherichiacoli and enteroaggregative Escherichiacoli were the main bacteria identified, Giardia lamblia was found in 25%, and norovirus was the most frequent viral agent. The median number of infectious agents per patient was three (range of 0 to 7). The biologic agents not identified through the FilmArray® method were tuberculosis and fungi.
ConclusionsSeveral infectious agents were simultaneously detected through the FilmArray® gastrointestinal panel in patients with HIV infection and chronic diarrhea.
La diarrea es una morbilidad común y es responsable de más de un millón de muertes por año en todo el mundo1; si los síntomas persisten más de cuatro semanas se denomina diarrea crónica, convirtiéndose en un problema que afecta hasta al 5% de la población en un momento dado2. En pacientes inmunocomprometidos puede ser fatal, y es al menos 10 veces más alta entre los infectados con el virus de la inmunodeficiencia humana (VIH) comparado con la población general3. La diarrea puede afectar a los pacientes con VIH en todas las etapas de la enfermedad, y hasta el 60% de ellos informan síntomas de diarrea4. A pesar de la terapia antirretroviral (TAR), la diarrea asociada al VIH sigue siendo de etiología multifactorial, que incluye los procesos infecciosos, neoplasias y enteropatía5, produciendo alteración de la calidad de vida, fracaso a la adherencia al tratamiento antirretroviral, pérdida de peso y desnutrición6,7.
La investigación del agente etiológico de la diarrea crónica en el paciente con VIH incluye el examen microbiológico de heces (principalmente el coprocultivo, los diferentes métodos para la detección de parásitos intestinales y la baciloscopia), los métodos moleculares (reacción en cadena de la polimerasa [PCR por sus siglas en inglés]), la evaluación clínica (considerando el recuento de linfocitosT CD4 y la determinación de la carga viral del VIH), la tomografía abdominal y la colonoscopia8. Se ha observado que los agentes infecciosos que ocasionan esta morbilidad pueden ser múltiples y la identificación de un solo agente etiológico suele no proporcionar el cuadro clínico completo, persistiendo las deposiciones líquidas a pesar del tratamiento instaurado, por lo que, continua en investigación nuevos métodos de diagnóstico para lograr la identificación de todos los agentes etiológicos.
Cuando estos agentes no son identificados oportunamente pueden causar una morbilidad significativa y ser responsables de aproximadamente el 80% de las muertes relacionadas con el síndrome de inmunodeficiencia adquirida (sida)9. Debido a que este tipo de diarrea es de difícil manejo por no identificar el agente etiológico, y dado que el examen físico y los resultados de microbiología pueden no ser suficientes para dirigir la terapia en algunos pacientes, a veces el médico recurre a utilizar medicamentos antidiarreicos para mejorar la calidad de vida del paciente10.
Entre los agentes bacterianos más frecuentes se encuentran Salmonella spp., Shigella spp., Campylobacter spp. y Mycobacterium tuberculosis; entre los agentes parasitarios están Cystoisospora belli, Cryptosporidium parvum, Cyclospora cayetanensis y Microsporidia; entre los agentes virales se puede mencionar al citomegalovirus o al herpes simple de tipo1 y tipo2; finalmente, se han reportado hongos causantes de micosis invasivas, como Histoplasma capsulatum y Paracoccidioides brasiliensis. Generalmente la identificación del agente etiológico es difícil debido a múltiples factores, como la automedicación antes de acudir al establecimiento de salud, los pobres métodos de diagnóstico disponibles en muchos laboratorios y la técnica de análisis especial que requiere cada agente microbiano11.
Uno de los métodos moleculares disponibles para poder identificar a varios agentes infecciosos en forma simultánea es el panel gastrointestinal (GI) FilmArray® (MEP, BioFire Diagnostics/Biomerieux, Salt Lake City, UT, EE.UU.), técnica basada en PCR que es útil para la detección rápida y simultánea de 22 patógenos (13 bacterias, 5 virus y 4 parásitos) a partir de muestras de heces líquidas12. Sin embargo, el rendimiento real en pacientes inmunocomprometidos en comparación con los métodos de diagnóstico convencionales sigue siendo desconocido, principalmente en pacientes con VIH.
El objetivo del estudio fue evaluar los agentes infecciosos que ocasionan la diarrea crónica en los pacientes con infección por VIH utilizando el panel molecular GI FilmArray®. Este es el primer estudio utilizando este método para identificar el agente etiológico en este tipo de pacientes con enfermedad crónica.
Material y métodosDiseño del estudioSe realizó un estudio observacional analítico transversal de los pacientes que acudieron al servicio de enfermedades infecciosas y tropicales del hospital Daniel Alcides Carrión (HDAC) de Huancayo, Perú, en el periodo comprendido entre enero y diciembre de 2021. Ingresaron al estudio los pacientes que cumplían los criterios de inclusión: mayores de 18años, diagnóstico de infección por VIH, presencia de deposiciones líquidas por más de 4semanas de duración, recuento de linfocitosT CD4 y carga viral para VIH. Se recolectaron muestras de heces líquidas para identificar el agente etiológico de la diarrea crónica.
Recopilamos datos clínicos, tiempo de enfermedad, tratamiento recibido, conteo de CD4, nivel de carga viral y TAR. Todos los participantes dieron su consentimiento informado.
Análisis estadísticoSe realizó un muestreo consecutivo, no aleatorizado, hasta completar el tamaño muestral, el cual fue determinado por el programa estadístico Stata versión 14. Para el cálculo del tamaño de la muestra se asumió que el principal factor limitante sería la proporción de casos positivos, ya que su precisión depende de la identificación del agente infeccioso y de la mejoría clínica después de recibir el tratamiento específico. Con un margen de error del 10%, una potencia del 80% y una supuesta sensibilidad mínima aceptable del 80% para identificar el agente etiológico13-14, estimamos que deberían ser enrolados un mínimo de 24 pacientes con diarrea crónica e infección por VIH. La tabla de doble ingreso de datos se realizó con Excel. Mostramos el número y el porcentaje de pacientes para las variables categóricas y la mediana (rango intercuartílico [IQR, por sus siglas en inglés]) para variables continuas.
ProcedimientoLuego de identificar a los pacientes que cumplían los criterios de inclusión, se les invitó a participar del estudio y, previo consentimiento informado, se les indicó que colectaran las muestras de heces en un frasco con tapa de rosca para muestras coprológicas, las cuales fueron recibidas en el laboratorio e inmediatamente procesadas mediante el panel GI FilmArray®. Las muestras pastosas o sólidas fueron rechazadas por no contar con el medio Cary-Blair que permite realizar la dilución para el correcto procesamiento del panel. No se almacenaron las muestras para estudios posteriores debido a que el tiempo y la temperatura podrían afectar futuros procedimientos, por lo que todos los procesos se realizaron en el momento en que llegó la muestra al laboratorio.
En caso de que los pacientes continuaran con diarrea crónica a pesar del tratamiento instaurado y dirigido contra los agentes infecciosos identificados por el panel GI FilmArray®, o cuando estos resultados eran negativos, se solicitó realizar colonoscopia a cargo del médico gastroenterólogo con toma de biopsia de la zona afectada, priorizando las tinciones de Ziehl-Neelsen modificado, PAS y Grocott Gomori, además de las tinciones convencionales para el estudio histopatológico a las muestras obtenidas.
Panel gastrointestinal FilmArray®El panel GI FilmArray® es una prueba de diagnóstico in vitro multiplexada con sistema cerrado que contiene todos los reactivos necesarios para la transcripción inversa, la PCR y la detección del ácido nucleico de diversos patógenos gastrointestinales en una muestra única de heces. Este sistema está aprobado por la FDA de Estados Unidos y por la Unión Europea.
El panel GI FilmArray® identifica 22 patógenos, que incluyen: bacterias (Campylobacter jejuni, Campylobacter coli, Campylobacter upsaliensis, Clostridium difficile (toxina A/B), Plesiomonas shigelloides, Salmonella spp., Yersinia enterocolitica, Vibrio parahaemolyticus, Vibrio vulnificus, Vibrio cholerae, Shigella spp. y patotipos de Escherichia coli diarrogénicos, como: E.coli enteroagregativa (EAEC), E.coli enteropatógena (EPEC), E.coli enterotoxigénica (ETEC) lt/st, E.coli productora de toxina Shiga (STEC) stx1/stx2, E.coli O157 y E.coli enteroinvasiva (EIEC), parásitos (Cryptosporidium, Cyclospora cayetanensis, Entamoeba histolytica, Giardia lamblia) y virus (Adenovirus F 40/41, Astrovirus, Norovirus GI/GII, Rotavirus A, Sapovirus [I, II, IV y V]).
Las muestras fueron procesadas de acuerdo a las instrucciones del fabricante (The BioFire® FilmArray® Gastrointestinal Panel). El tiempo de procesamiento de cada muestra fue de alrededor de una hora, siendo los resultados informados inmediatamente al médico tratante.
Un resultado se consideró positivo o negativo cuando se obtuvo el reporte final del software del equipo.
Consideraciones éticasEste trabajo fue aprobado por el comité de ética del HDAC de Huancayo, Perú, con autorización 018-2021, respetándose la identificación de los pacientes mediante códigos y previo consentimiento informado.
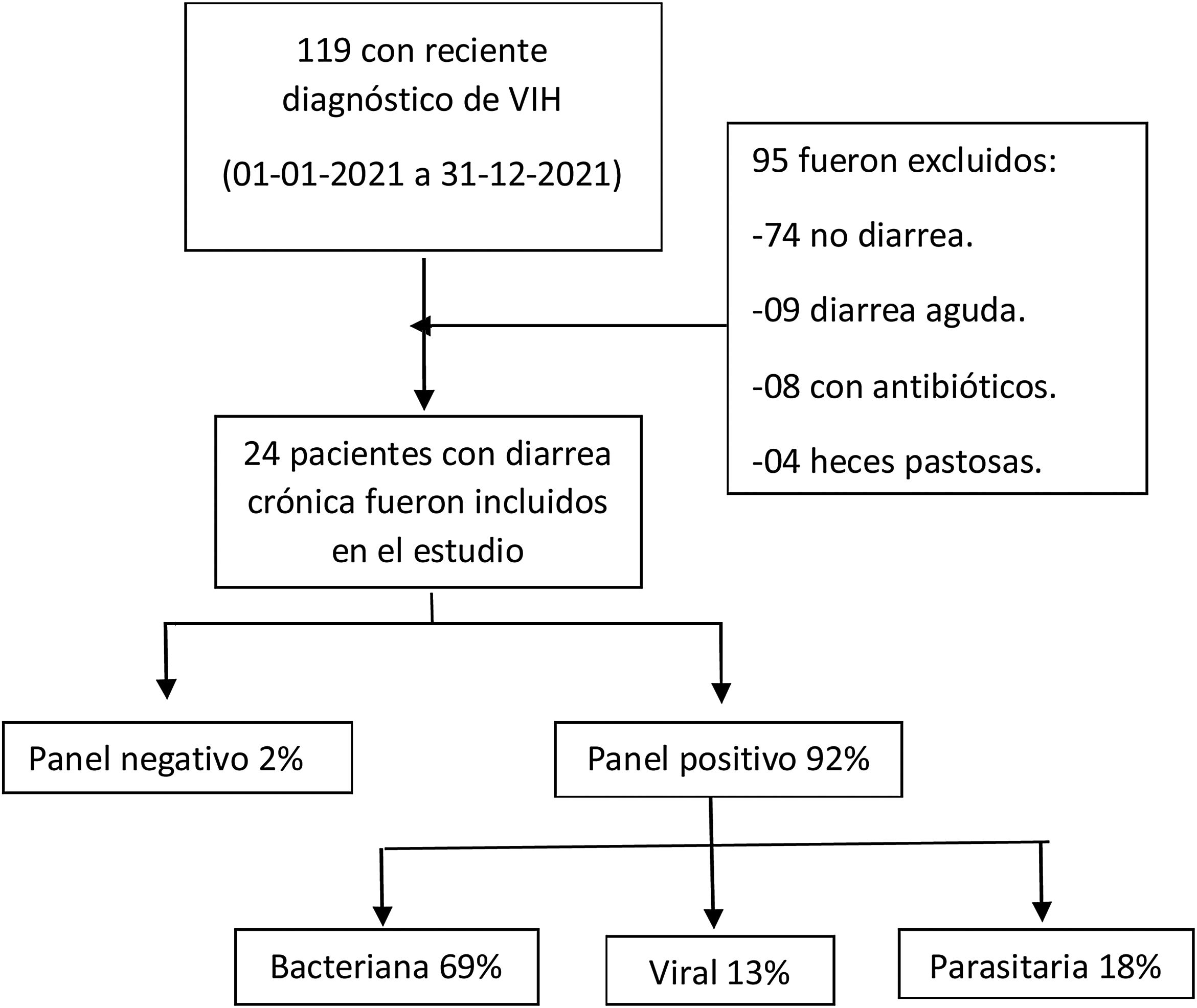
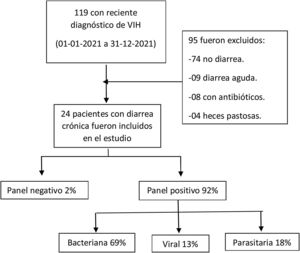
ResultadosDe enero a diciembre de 2021, 119 pacientes con reciente diagnóstico de VIH fueron evaluados en el servicio de infectología del HDAC. De ellos, 24 cumplieron los criterios de inclusión y fueron admitidos al estudio (fig. 1). Todos los pacientes cumplieron con la definición de reciente diagnóstico de infección por VIH y diarrea crónica. Dieciocho participantes fueron varones, la mediana de la edad fue de 37años, con un IQR de 26 a 75años.
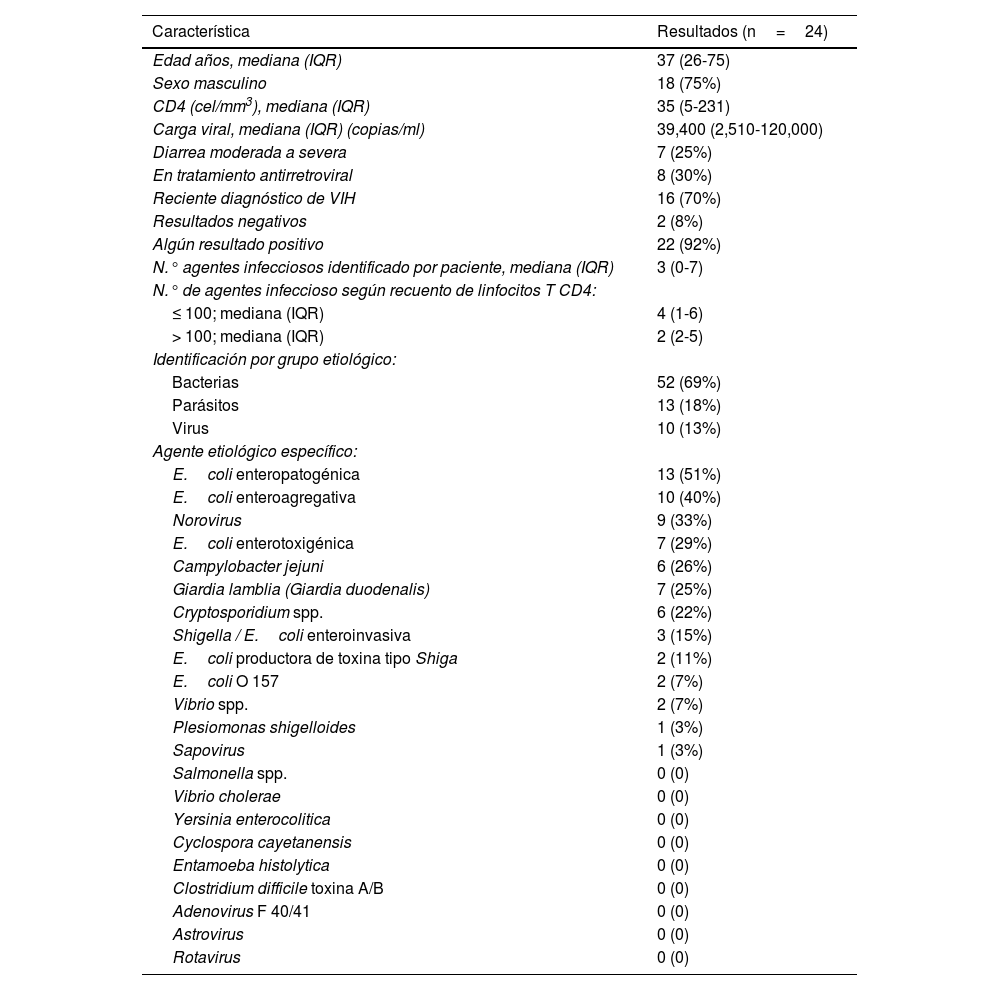
La mediana del recuento de linfocitosT CD4 fue 35células por mm3, con un IQR de 5 a 231células por mm3; la mediana de la carga viral fue 39,400copias /ml, con el IQR de 2,510 a 12,0000copias/ml. Ocho (30%) personas habían iniciado TAR en el último mes, y todas ellas iniciaron la medicación coformulada en una sola tableta al día de dolutegravir 50mg/lamivudina 300mg/tenofovir 300mg. Dieciséis (70%) pacientes fueron diagnosticados en el servicio de infectología y no recibían TAR en el momento del ingreso al estudio (tabla 1).
Características generales de los pacientes con infección por VIH con diarrea crónica
| Característica | Resultados (n=24) |
|---|---|
| Edad años, mediana (IQR) | 37 (26-75) |
| Sexo masculino | 18 (75%) |
| CD4 (cel/mm3), mediana (IQR) | 35 (5-231) |
| Carga viral, mediana (IQR) (copias/ml) | 39,400 (2,510-120,000) |
| Diarrea moderada a severa | 7 (25%) |
| En tratamiento antirretroviral | 8 (30%) |
| Reciente diagnóstico de VIH | 16 (70%) |
| Resultados negativos | 2 (8%) |
| Algún resultado positivo | 22 (92%) |
| N.° agentes infecciosos identificado por paciente, mediana (IQR) | 3 (0-7) |
| N.° de agentes infeccioso según recuento de linfocitos T CD4: | |
| ≤ 100; mediana (IQR) | 4 (1-6) |
| > 100; mediana (IQR) | 2 (2-5) |
| Identificación por grupo etiológico: | |
| Bacterias | 52 (69%) |
| Parásitos | 13 (18%) |
| Virus | 10 (13%) |
| Agente etiológico específico: | |
| E.coli enteropatogénica | 13 (51%) |
| E.coli enteroagregativa | 10 (40%) |
| Norovirus | 9 (33%) |
| E.coli enterotoxigénica | 7 (29%) |
| Campylobacter jejuni | 6 (26%) |
| Giardia lamblia (Giardia duodenalis) | 7 (25%) |
| Cryptosporidium spp. | 6 (22%) |
| Shigella / E.coli enteroinvasiva | 3 (15%) |
| E.coli productora de toxina tipo Shiga | 2 (11%) |
| E.coli O 157 | 2 (7%) |
| Vibrio spp. | 2 (7%) |
| Plesiomonas shigelloides | 1 (3%) |
| Sapovirus | 1 (3%) |
| Salmonella spp. | 0 (0) |
| Vibrio cholerae | 0 (0) |
| Yersinia enterocolitica | 0 (0) |
| Cyclospora cayetanensis | 0 (0) |
| Entamoeba histolytica | 0 (0) |
| Clostridium difficile toxina A/B | 0 (0) |
| Adenovirus F 40/41 | 0 (0) |
| Astrovirus | 0 (0) |
| Rotavirus | 0 (0) |
IQR: intervalo intercuartílico.
De acuerdo con el agente etiológico agrupado por tipo de microorganismo infeccioso, en las muestras con resultado positivo se observó que las bacterias fueron responsables de la diarrea crónica en el 69% de los pacientes, los parásitos fueron identificados en el 18% de ellos y los virus en el 13% de los pacientes.
Entre las 24 muestras de heces líquidas con resultado positivo, E.coli fue el agente bacteriano identificado con más frecuencia en diarrea crónica; los patotipos diarrogénicos más frecuentes fueron EPEC, EAEC y ETEC, con valores del 51%, del 40% y del 29%, respectivamente. La segunda bacteria más detectada fue Campylobacter jejuni, encontrándose en el 26% de las muestras. Norovirus fue el más prevalente de los agentes virales, habiéndose detectado en el 33% de las muestras; Sapovirus se identificó en el 3% de las muestras.
De los agentes parasitarios, Giardia lamblia fue el parásito más frecuente, encontrándose en el 25% de las muestras, seguido por Cryptosporidium spp., que se identificó en el 22% de los pacientes con diarrea crónica.
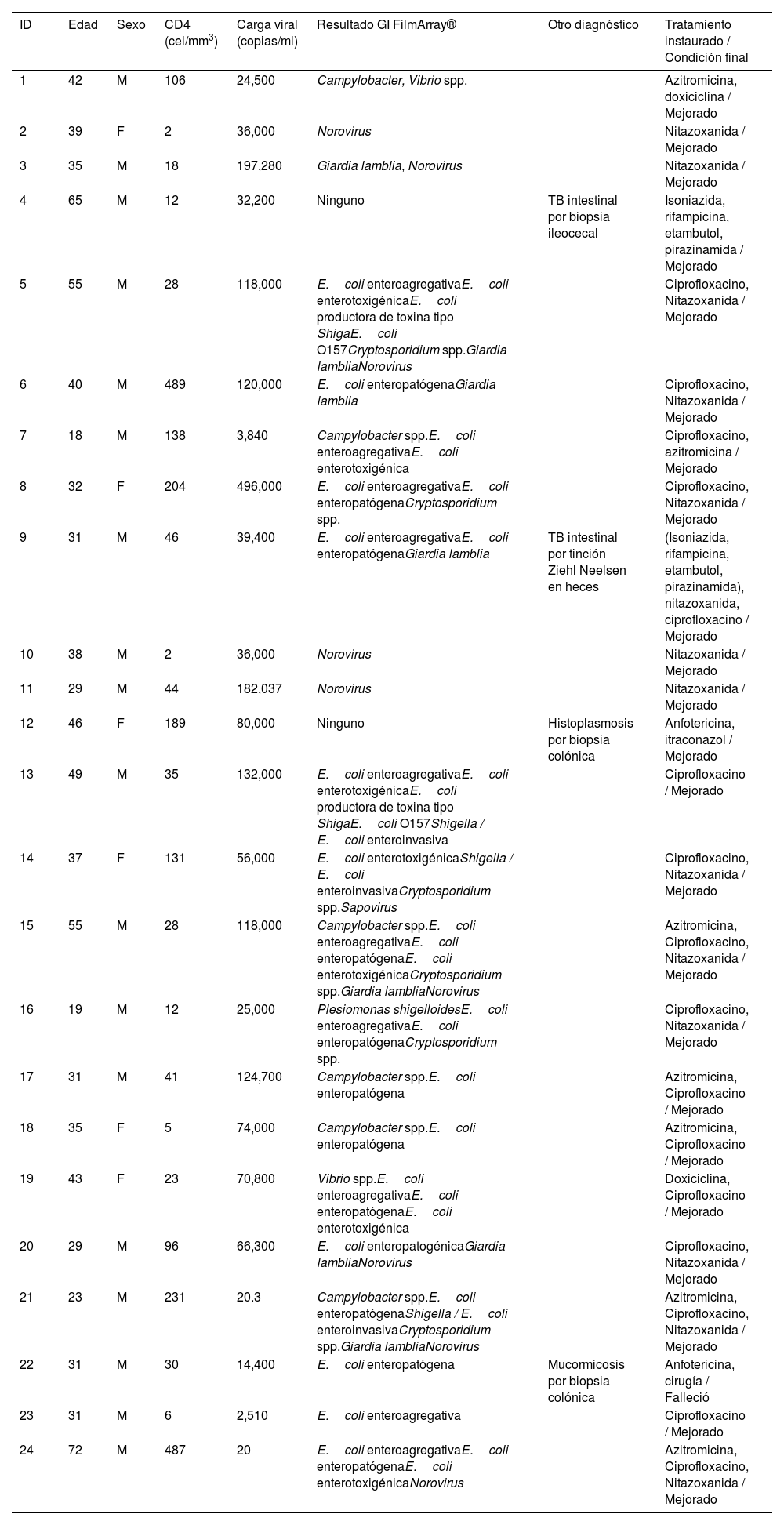
La mediana del número de agentes infecciosos encontrados en un solo paciente con VIH fue de 3microorganismos, con un rango de 0 a 7 gérmenes infecciosos por paciente. De 24 muestras analizadas, 2 (8%) fueron negativas y 22 (92%) fueron positivas. La tabla 2 resume el desempeño del panel GI FilmArray® para cada uno de los 24 pacientes en forma detallada.
Resultados de identificación del agente etiológico con el panel GI FilmArray® en pacientes con diarrea crónica e infección por VIH
| ID | Edad | Sexo | CD4 (cel/mm3) | Carga viral (copias/ml) | Resultado GI FilmArray® | Otro diagnóstico | Tratamiento instaurado / Condición final |
|---|---|---|---|---|---|---|---|
| 1 | 42 | M | 106 | 24,500 | Campylobacter, Vibrio spp. | Azitromicina, doxiciclina / Mejorado | |
| 2 | 39 | F | 2 | 36,000 | Norovirus | Nitazoxanida / Mejorado | |
| 3 | 35 | M | 18 | 197,280 | Giardia lamblia, Norovirus | Nitazoxanida / Mejorado | |
| 4 | 65 | M | 12 | 32,200 | Ninguno | TB intestinal por biopsia ileocecal | Isoniazida, rifampicina, etambutol, pirazinamida / Mejorado |
| 5 | 55 | M | 28 | 118,000 | E.coli enteroagregativaE.coli enterotoxigénicaE.coli productora de toxina tipo ShigaE.coli O157Cryptosporidium spp.Giardia lambliaNorovirus | Ciprofloxacino, Nitazoxanida / Mejorado | |
| 6 | 40 | M | 489 | 120,000 | E.coli enteropatógenaGiardia lamblia | Ciprofloxacino, Nitazoxanida / Mejorado | |
| 7 | 18 | M | 138 | 3,840 | Campylobacter spp.E.coli enteroagregativaE.coli enterotoxigénica | Ciprofloxacino, azitromicina / Mejorado | |
| 8 | 32 | F | 204 | 496,000 | E.coli enteroagregativaE.coli enteropatógenaCryptosporidium spp. | Ciprofloxacino, Nitazoxanida / Mejorado | |
| 9 | 31 | M | 46 | 39,400 | E.coli enteroagregativaE.coli enteropatógenaGiardia lamblia | TB intestinal por tinción Ziehl Neelsen en heces | (Isoniazida, rifampicina, etambutol, pirazinamida), nitazoxanida, ciprofloxacino / Mejorado |
| 10 | 38 | M | 2 | 36,000 | Norovirus | Nitazoxanida / Mejorado | |
| 11 | 29 | M | 44 | 182,037 | Norovirus | Nitazoxanida / Mejorado | |
| 12 | 46 | F | 189 | 80,000 | Ninguno | Histoplasmosis por biopsia colónica | Anfotericina, itraconazol / Mejorado |
| 13 | 49 | M | 35 | 132,000 | E.coli enteroagregativaE.coli enterotoxigénicaE.coli productora de toxina tipo ShigaE.coli O157Shigella / E.coli enteroinvasiva | Ciprofloxacino / Mejorado | |
| 14 | 37 | F | 131 | 56,000 | E.coli enterotoxigénicaShigella / E.coli enteroinvasivaCryptosporidium spp.Sapovirus | Ciprofloxacino, Nitazoxanida / Mejorado | |
| 15 | 55 | M | 28 | 118,000 | Campylobacter spp.E.coli enteroagregativaE.coli enteropatógenaE.coli enterotoxigénicaCryptosporidium spp.Giardia lambliaNorovirus | Azitromicina, Ciprofloxacino, Nitazoxanida / Mejorado | |
| 16 | 19 | M | 12 | 25,000 | Plesiomonas shigelloidesE.coli enteroagregativaE.coli enteropatógenaCryptosporidium spp. | Ciprofloxacino, Nitazoxanida / Mejorado | |
| 17 | 31 | M | 41 | 124,700 | Campylobacter spp.E.coli enteropatógena | Azitromicina, Ciprofloxacino / Mejorado | |
| 18 | 35 | F | 5 | 74,000 | Campylobacter spp.E.coli enteropatógena | Azitromicina, Ciprofloxacino / Mejorado | |
| 19 | 43 | F | 23 | 70,800 | Vibrio spp.E.coli enteroagregativaE.coli enteropatógenaE.coli enterotoxigénica | Doxiciclina, Ciprofloxacino / Mejorado | |
| 20 | 29 | M | 96 | 66,300 | E.coli enteropatogénicaGiardia lambliaNorovirus | Ciprofloxacino, Nitazoxanida / Mejorado | |
| 21 | 23 | M | 231 | 20.3 | Campylobacter spp.E.coli enteropatógenaShigella / E.coli enteroinvasivaCryptosporidium spp.Giardia lambliaNorovirus | Azitromicina, Ciprofloxacino, Nitazoxanida / Mejorado | |
| 22 | 31 | M | 30 | 14,400 | E.coli enteropatógena | Mucormicosis por biopsia colónica | Anfotericina, cirugía / Falleció |
| 23 | 31 | M | 6 | 2,510 | E.coli enteroagregativa | Ciprofloxacino / Mejorado | |
| 24 | 72 | M | 487 | 20 | E.coli enteroagregativaE.coli enteropatógenaE.coli enterotoxigénicaNorovirus | Azitromicina, Ciprofloxacino, Nitazoxanida / Mejorado |
CD4: conteo de linfocitos T CD4; F: femenino; M: masculino.
De los 24 pacientes evaluados, dos de ellos no respondieron al tratamiento instaurado contra el agente infeccioso identificado y en otros dos no se logró identificar el patógeno, por lo que los cuatro pacientes fueron sometidos a colonoscopia, encontrándose a M.tuberculosis en dos, Histoplasma spp. en uno y mucormicosis en el otro. Se reportó el fallecimiento de un paciente con mucormicosis intestinal (tabla 2).
DiscusiónConsistente con estudios previos, la diarrea es la morbilidad más frecuente en pacientes con infección por VIH, y sin TAR la posibilidad de desarrollar diarrea crónica es de hasta el 80%. Las causas más frecuentes de estas infecciones entéricas son principalmente de origen bacteriano15. Un estudio reportó que los parásitos son la principal causa de la diarrea crónica16, mientras otro estudio reportó a la tuberculosis como la primera causa17, cada uno de ellos con distinto antecedente epidemiológico.
A pesar de todos los métodos existentes, todavía hay un grupo de pacientes en los que no se llega a identificar el agente patógeno causante de la diarrea crónica, ocasionando malnutrición y desgaste físico y denominándose enteropatía por VIH18, que se convierte en un problema para la salud pública debido al uso inadecuado de múltiples antibióticos e incrementando la resistencia antimicrobiana. Es conocido que estas infecciones disminuyen con el inicio temprano de TAR, pero ello también está relacionado con la capacidad para detectar los agentes etiológicos asociados con la diarrea crónica.
El panel GI FilmArray® ha sido evaluado para detectar el agente infeccioso de enteritis en pacientes inmunocompetentes; la sensibilidad es del 100% y la especificidad, del 97%, comparado con cultivos convencionales19, y con la capacidad de detectar los agentes comúnmente no estudiados hasta en el 40%20.
Sin embargo, en pacientes inmunosuprimidos hay pocos reportes. En un caso de mieloma múltiple con diarrea crónica el agente identificado por este método fue E.coli21. En nuestro estudio los agentes identificados con mayor frecuencia fueron las bacterias, similar a lo reportado en un estudio de los Estados Unidos en pacientes con diarrea crónica que, mediante cultivo de heces, identificaron en primer lugar Salmonella spp. (principalmente S.enterica, S.typhimurium y S.enteritidis). Sin embargo, fue el aislamiento de E.coli, y particularmente la variedad EAEC es la que puede contribuir a un mayor desarrollo de la enfermedad diarreica, al disminuir la inmunidad local y prolongar su cronicidad22, pero el uso de cultivo es aún pobremente entendido, porque sigue siendo una prueba de investigación cuyo rendimiento es cuestionable.
La alta proporción de E.coli como causante de las infecciones entéricas en nuestro grupo de pacientes puede deberse a la ingestión de alimentos o agua contaminados23, la inmunosupresión severa y la conducta sexual de riesgo por exposición fecal oral, la cual está relacionada con Campylobacter jejuni24, que fue el segundo tipo bacteria identificado por este método.
El uso del panel GI FilmArray® pudo detectar múltiples tipos de patógenos en una sola prueba, que además de bacterias enteropatógenas, como E.coli o Campylobacter spp., logró identificar a Giardia lamblia como el parásito más frecuente, seguido por Cryptosporidium spp. Nuestros hallazgos se diferencian de un estudio asiático, que encontró a Cryptosporidium spp. como el principal patógeno relacionado con diarrea crónica en pacientes con VIH, por encima de las bacterias enteropatógenas y de los virus25.
En relación con los agentes virales, Norovirus fue el más frecuente, seguido de Sapovirus. La presencia de Norovirus ya había sido identificada como el principal agente infeccioso en el 53% de su población estudiada en pacientes con VIH y diarrea en un estudio realizado en China que utilizó FilmArray® pero no diferenciaron los agentes etiológicos según el tipo de diarrea: aguda y crónica26. Este virus puede producir enfermedad aguda, pero su cronicidad puede deberse al genotipo GII y a la coinfección con otros agentes virales, principalmente rotavirus, sapovirus, astrovirus y adenovirus27.
La presencia de múltiples patógenos infecciosos coexistentes a la vez puede crear un clima de simbiosis, favoreciendo su permanencia, ocasionar efectos en los transportadores celulares similares a los causados por las toxinas, prolongar el efecto inflamatorio y destructivo en las vellosidades intestinales y producir proteínas de unión que faciliten la adherencia de otros patógenos en las membranas apicales de los enterocitos28-29.
En nuestro estudio, dos pacientes presentaron resultado negativo a la prueba GI FilmArray®; por lo tanto, no detecta todo el espectro de patógenos relacionados con la diarrea crónica en pacientes con VIH, por lo que es necesario continuar investigando mediante colonoscopia la presencia de otros patógenos, principalmente si la diarrea persiste.
La limitación de este estudio es que el panel GI FilmArray® no detecta algunos patógenos oportunistas en pacientes con VIH, como Microsporidia, Cystoisospora belli, M.tuberculosis e Histoplasma, por lo que deberían realizarse los estudios convencionales paralelamente al panel GI FilmArray®, como el examen parasitológico con tinciones especiales para detección de M.tuberculosis y Cystoisospora belli (Ziehl-Neelsen modificado), y en pacientes que persistan con el cuadro diarreico a pesar del tratamiento instaurado debería realizarse la toma de biopsia de la mucosa colónica afectada mediante colonoscopia. En este estudio, realizar colonoscopia en pacientes que no respondieron al tratamiento ayudó a identificar otras causas de diarrea crónica, como M.tuberculosis, Histoplasma y mucormicosis.
ConclusiónNuestro estudio sugiere que utilizando el panel GI FilmArray® se pueden identificar en una sola prueba múltiples patógenos asociados a la diarrea crónica en pacientes con infección por el VIH, facilitando el diagnóstico y el tratamiento oportuno, siendo útil en este tipo de pacientes y justificando su costo. Debe mantenerse el estudio de exámenes convencionales, como la tinción Ziehl Neelsen en heces. Sin embargo, si la diarrea crónica persiste, recomendamos que deberían estudiarse mediante colonoscopia otros agentes no identificados, como M.tuberculosis, Histoplasma y Citomegalovirus.
FinanciaciónEl presente trabajo de investigación no ha recibido ayudas específicas provenientes de agencias del sector privado, público o entidades sin ánimo de lucro.
Conflicto de interesesCada autor manifiesta que para la realización de la presente investigación en ningún caso existe conflicto de intereses.