La estadificación de la fibrosis en pacientes con enfermedad por hígado graso no alcohólico (EHGNA) se realiza aplicando distintos algoritmos. Sin embargo, hay pocos reportes de cómo se utilizan en la vida real. Nuestro objetivo fue estimar la proporción de pacientes con EHGNA que teniendo riesgo indeterminado o alto de fibrosis según scores no-invasivos se someten a estudios adicionales de estadificación.
Materiales y métodosEstudio de corte transversal multicéntrico de pacientes con EHGNA evaluados por hepatólogos del 1 de junio del 2018 al 31 de julio del 2018. Se calcularon FIB-4 y NAFLD fibrosis score en todos los pacientes y se consideró que, si al menos uno de los scores sugería riesgo indeterminado o alto de fibrosis, el paciente debería haberse sometido a estudios adicionales de estadificación.
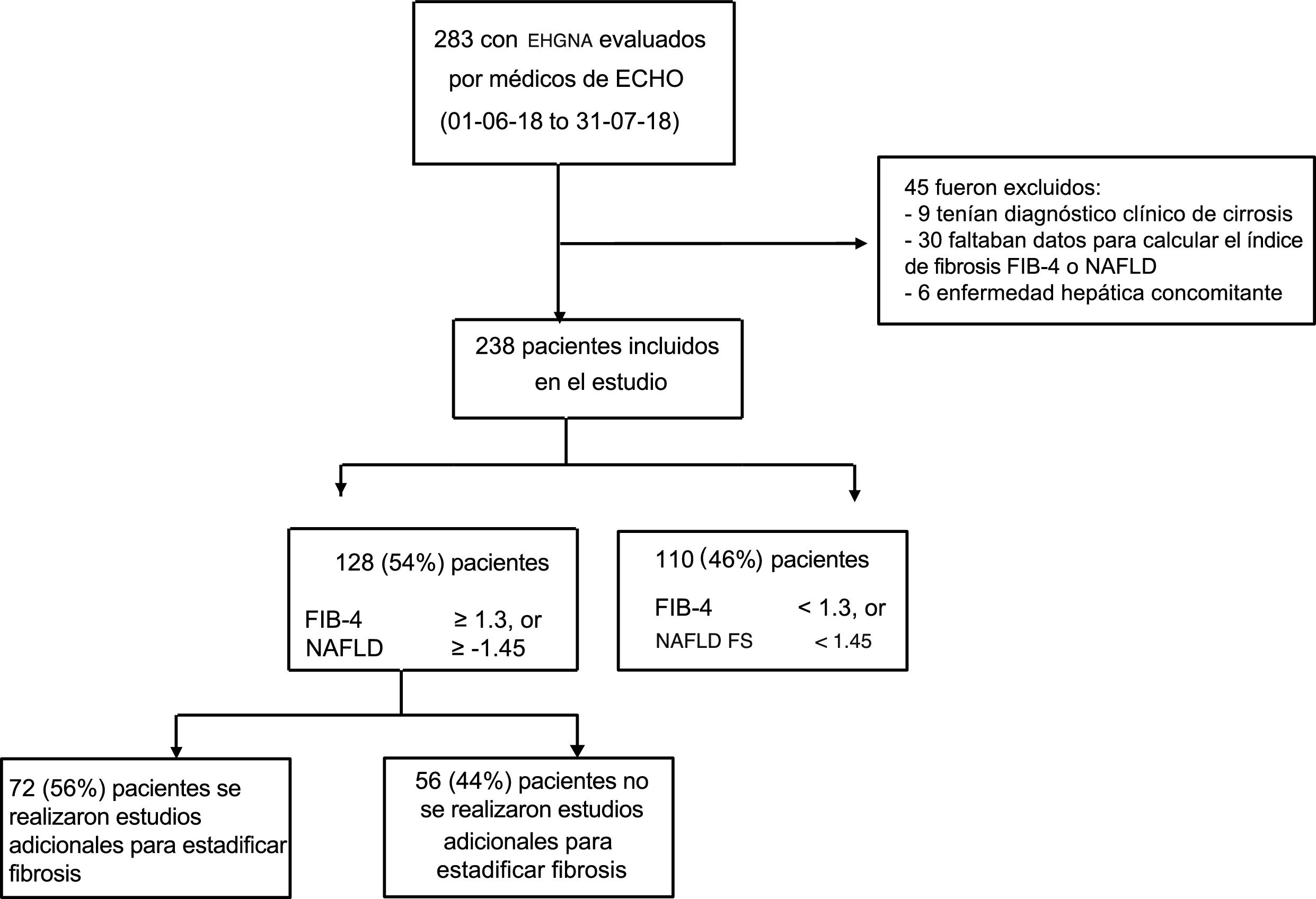
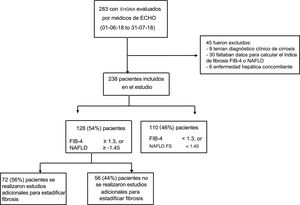
ResultadosSe incluyeron 238 pacientes. La mediana de tiempo entre el diagnóstico de EHGNA y la inclusión en el estudio fue de 12.2 (IQR 3.0-36.5) meses. En total, 128 (54%) pacientes tuvieron al menos una evaluación con score no-invasivo que sugería riesgo indeterminado o alto de fibrosis. Sin embargo, solamente 72 (56%) se realizaron estudios para confirmar el grado de fibrosis (elastografía, biopsia, etc.). Las principales barreras encontradas por los médicos para aplicar los algoritmos de estadificación fueron relacionadas a cobertura de salud y a costos.
ConclusionesUn alto porcentaje de pacientes con EHGNA tiene riesgo indeterminado o alto de fibrosis, de acuerdo con los resultados obtenidos con scores no invasivos. Sin embargo, solamente la mitad se realizó estudios adicionales, evidenciando una baja adherencia a las recomendaciones actuales.
Fibrosis staging in patients with nonalcoholic fatty liver disease (NAFLD) is carried out through the application of stepwise algorithms but there is little real-world data on their use. Our aim was to calculate the number of patients with NAFLD and indeterminate or high risk for fibrosis, assessed through noninvasive scores, that consequently underwent further staging evaluation.
Materials and methodsA cross-sectional multicenter cohort study was conducted on patients with NAFLD evaluated by hepatologists within the time frame of June 1 and July 31, 2018. The FIB-4 and NAFLD fibrosis scores were calculated in all the patients, and if at least one of the scores suggested indeterminate or high risk for fibrosis, we believed the patient should have undergone additional fibrosis staging assessment.
ResultsThe study included 238 patients. The median time interval from NAFLD diagnosis and inclusion in the analysis was 12.2months (IQR 3.0-36.5). A total of 128 (54%) patients had at least one noninvasive score that suggested indeterminate or high risk for fibrosis but studies to confirm the fibrosis grade (elastography, biopsy, etc.) were performed on only 72 (56%). The main barriers encountered by the physicians for applying the staging algorithms were related to health insurance coverage and imaging study costs.
ConclusionsA high percentage of patients with NAFLD were at indeterminate or high risk for fibrosis, according to noninvasive scores, but additional studies were carried out on only half of them, showing low adherence to current recommendations.
La enfermedad por hígado graso no alcohólico (EHGNA) es considerada la causa de enfermedad hepática de mayor prevalencia a nivel mundial1, con una afectación de 25% de la población mundial2. Existen abundantes datos respecto a la epidemiología del EHGNA en países desarrollados, con una prevalencia media del 24% en Europa y en Estados Unidos3,4. La prevalencia de EHGNA en América del Sur parece ser incluso mayor, con afectación de más del 30% de la población3.
El espectro de EHGNA incluye desde esteatosis simple, la cual es una etapa con un pronóstico hepático más favorable, a esteatohepatitis no alcohólica (EHNA), la cual está asociada con fibrosis progresiva y un mayor riesgo de desarrollar cirrosis y carcinoma hepatocelular5. Dado que la EHNA y sus consecuencias solo suceden en una minoría de los pacientes3,5, la identificación de esta población es de gran importancia, para poder ofrecerles la atención y el seguimiento adecuados.
El Gold standard para el diagnóstico de EHNA es la biopsia hepática, pero debido a la dimensión epidémica de la enfermedad, la aplicación de un procedimiento invasivo que conlleva riesgo de complicaciones y de errores de muestreo es poco práctica. En consecuencia, se ha propuesto el uso de herramientas no invasivas para la evaluación de fibrosis, y se ha sugerido el seguimiento de un algoritmo por pasos para simplificar el manejo clínico de pacientes con EHGNA6. Los pasos iniciales del algoritmo incluyen el cálculo de scores no invasivos utilizando características clínicas y en biomarcadores séricos para clasificar el riesgo de fibrosis, y solo los pacientes con riesgo de fibrosis indeterminado o alto son referidos a una segunda evaluación a realizar por medio de otras técnicas de imagen no invasivas, como la elastografía. La biopsia hepática solo se ofrece para pacientes en quienes es imposible excluir la fibrosis avanzada por medio de la evaluación no invasiva6.
La utilización de herramientas no invasivas es recomendada, y ampliamente usada7, pero existe una brecha bien conocida entre las sugerencias de las guías y su implementación en la práctica cotidiana8. Además, otros factores, como las barreras relacionadas con la cobertura de seguridad social o la disponibilidad local de tecnología, pueden impactar el uso de ciertas herramientas, como la elastografía, en países en vías de desarrollo.
La adherencia a algoritmos recomendados para la evaluación de fibrosis en pacientes con EHGNA en Latinoamérica es desconocida. Por este motivo, el objetivo principal del presente estudio fue estimar, en la práctica cotidiana, la proporción de pacientes con EHGNA con riesgo indeterminado o alto de fibrosis, de acuerdo con resultados obtenidos por medio de scores no invasivos, en los que a continuación se realizaron estudios de imagen para evaluar fibrosis. Además, buscamos identificar las barreras que impiden el seguimiento de los algoritmos propuestos para la estadificación de fibrosis.
Materiales y métodosDiseño de estudio y variablesRealizamos un estudio multicéntrico transversal con pacientes con EHGNA utilizando la clínica virtual Extension for Community Healthcare Outcomes (ECHO)-EHGNA. Este modelo utiliza tecnología de videoconferencia como plataforma para proporcionar atención médica de especialidad por medio de capacitación y apoyo para profesionales de la salud, de forma que puedan ofrecer la mejor atención médica en sus comunidades locales9.
La clínica ECHO-EHGNA fue lanzada en febrero del 2018 y consiste en teleconferencias mensuales de 90min dirigidas por un equipo multidisciplinario experto ubicado en el Hospital Italiano de Buenos Aires, Argentina. Durante la teleconferencia, participantes de diferentes regiones de Argentina presentan casos de pacientes con EHGNA al panel multidisciplinario de expertos y demás participantes, quienes a continuación discuten el caso y ofrecen recomendaciones para la atención del paciente.
Todos los médicos participantes en la clínica ECHO-EHGNA fueron invitados a colaborar en el presente estudio.
Entre el 1 de junio y el 31 de julio del 2018, todos los pacientes consecutivos con EHGNA, mayores de 17años, que recibieron atención médica de los médicos participantes en la clínica ECHO-EHGNA fueron invitados a participar en el estudio. Los pacientes con diagnóstico evidente de cirrosis, en base a la combinación de signos clínicos, de laboratorio, endoscopía e imágenes, fueron excluidos del estudio. También se excluyó a pacientes con enfermedades hepáticas concomitantes, con VIH, o si cualquiera de los dos scores de fibrosis —el NAFLD10 o el FIB-410,11— no pudieron ser calculados con los datos disponibles. El EHGNA fue definido como evidencia de esteatosis hepática obtenida por medio de modalidades de imagenología o análisis histológicos, y la falta de causas secundarias de acumulación de grasa hepática, tales como el consumo significativo de alcohol12, el uso prolongado de medicamentos esteatogénicos o trastornos hereditarios monogénicos13. Los criterios de selección fueron verificados utilizando un formulario prediseñado en presencia de los pacientes.
El estudio consistió en una sola visita para cada paciente, en la cual se recolectaron los siguientes datos de historias médicas, estudios complementarios y entrevista:
- •
Determinantes demográficos y sociales: edad, sexo, tipo de seguro social (sistema público, privado, o sistema de asistencia social), nivel educativo (primario, secundario o post-secundario), estatus laboral (empleado vs desempleado) y lugar de residencia en área urbana o no urbana.
- •
Comorbilidades: dislipidemia (pacientes con cualquier tratamiento reductor de lípidos o que presentaran cualquiera de las siguientes situaciones: colesterol LDL >160mg/dl, colesterol HDL <40mg/dl o triglicéridos >200mg/dl), hipertensión arterial (pacientes con medicación antihipertensiva y/o que presentaban una presión sistólica o diastólica en examen >140 o 90mmHg, respectivamente), diabetes (pacientes con medicación oral antidiabética y/o insulina, o que presentaban hemoglobina glicada >6.5g/dl o al menos dos niveles de glucosa en ayuno >126mg/dl), e historia de enfermedad cardiovascular isquémica o enfermedad cerebrovascular graves. El índice de masa corporal (IMC) fue categorizado de acuerdo con la clasificación de la Organización Mundial de la Salud: normal: 15.5-24.9; sobrepeso: 25-29.9; obesidad: 30-34.9; obesidad claseII: 35-39.9; obesidad claseIII: 4014.
- •
Scores no invasivos: los scores para fibrosis FIB-411 y NAFLD10 fueron calculados en todos los pacientes. En cada score se aplicaron puntos de corte predeterminados para clasificar a los pacientes en diferentes categorías, de acuerdo con el riesgo de fibrosis. Para el score FIB-4 se determinó el riesgo indeterminado o alto de la siguiente manera: ≥1.3 para pacientes entre 36 y 64años y ≥ 2 para pacientes mayores de 64años15. Para el score NAFLD de fibrosis el riesgo indeterminado o alto fue determinado como ≥1.45515. El score FIB-4 no se calculó en pacientes menores de 36años15. Esta decisión se basó en datos que desalientan su uso para descartar la fibrosis avanzada en esta población, ya que no logra identificar cuáles de estos pacientes deben someterse a más estudios de estadificación15-17.
- •
Variable de desenlace: para los propósitos del presente estudio, y de acuerdo con las recomendaciones, aceptamos el siguiente algoritmo de estadificación: los pacientes con al menos un score no invasivo que sugiriera riesgo de fibrosis indeterminado o alto deberían haberse realizado estudios de imagenología, como elastografía, entre otros6, para estadificar la fibrosis. En consecuencia, la variable del desenlace fue construida utilizando el número de pacientes que tuvo resultado de riesgo de fibrosis indeterminado o alto en al menos un score no invasivo, como denominador, y el número de pacientes que se realizaron al menos un estudio de imagen (técnicas de imagenología ±biopsia guiada por ultrasonido) para estadificar la fibrosis, como el numerador.
La edad y el sexo de los médicos participantes también fue recopilada, y ellos respondieron una encuesta para evaluar su percepción sobre las potenciales barreras para el acceso a estudios de imagen para estadificar la fibrosis en pacientes con EHGNA. La encuesta consistió en preguntas respecto a cuatro barreras potenciales, las cuales debían ser clasificadas de «más importante» a «menos importante» de acuerdo con su opinión: a)obstáculos relacionados con costo y seguro; b)falta de conocimiento sobre las consecuencias potenciales del EHGNA en pacientes y población en general; c)información insuficiente en la comunidad médica sobre la aplicación de algoritmos para estadificar pacientes con EHGNA, y d)la distancia del lugar de residencia del paciente al centro médico para realizar los estudios de estadificación de fibrosis más cercano.
El presente artículo fue estructurado de acuerdo con las guías de reporte de Refuerzo de Reporte de Estudios Observacionales en Epidemiología (STROBE, por sus siglas en inglés).
Análisis estadísticoLas variables cualitativas son presentadas como números absolutos y porcentajes y las variables cuantitativas como medianas y rango inter cuartil (IQR: percentil 25 y 75). Para comparar variables, se realizó la prueba exacta de Fisher o la prueba de chi-cuadrado para variables categóricas y la prueba de Mann-Whitney para variables numéricas. Al evaluar una variable ordinal se aplicó la prueba de chi cuadrado con una función para tendencia. Las pruebas de dos colas y la significancia fueron aceptadas en p<0:05. Utilizamos software STATA para los cálculos (StataCorp LLC, TX; versión 14.2).
ResultadosUn total de 24 médicos de 12 ciudades en Argentina participaron activamente en la clínica ECHO-EHGNA durante el periodo del estudio, de los cuales 14 aceptaron participar (fig. 1). En total, 238 pacientes con EHGNA fueron evaluados durante el periodo del estudio e incluidos en el análisis (fig. 2).
Distribución de sitios argentinos que participaron en el estudio.
Los sitios de investigación fueron: 1: Esquina, 2: Santa Fe, 3: Mendoza, 4 y 5: Ciudad de Buenos Aires, 6: Coronel Suárez, 7: Mar del Plata, 8 y 9: Neuquén, 10: General Roca, 11: Bariloche, 12: Esquel, 13: Comodoro Rivadavia, 14: Ushuaia.
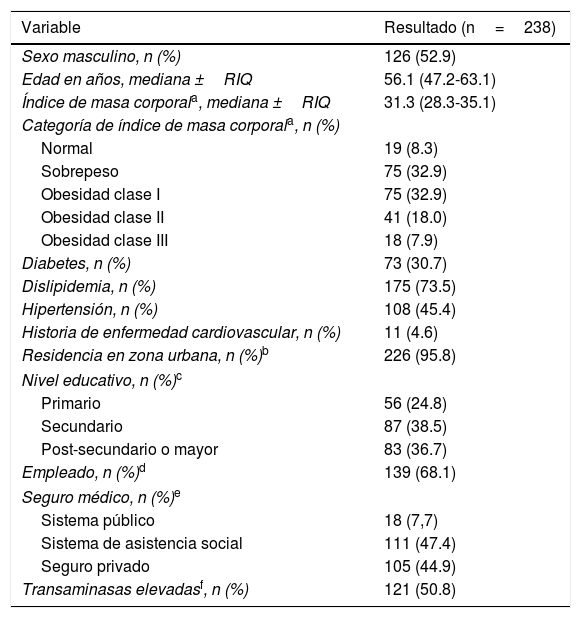
Las características y comorbilidades de los pacientes se detallan en la tabla 1. La mediana del intervalo de tiempo entre el diagnóstico de EHGNA y la inclusión en el estudio fue de 12.2 (3.0-36.5) meses. Ciento veintiséis pacientes fueron hombres (53%) y la edad mediana de los pacientes fue de 56años (47-63). Todos los pacientes tuvieron al menos un factor de riesgo para EHGNA. Se registró dislipidemia, obesidad y diabetes en 175 (73%), 134 (59%) y 73 (31%) pacientes, respectivamente. Respecto a las determinantes sociales, la mayoría de los pacientes vivían en áreas urbanas, estaban empleados, habían terminado al menos educación primaria y tenían seguro de asistencia médica.
Características de los pacientes incluidos de la clínica ECHO-EHGNA del 1 de junio al 31 de julio de 2018 (n=238)
| Variable | Resultado (n=238) |
|---|---|
| Sexo masculino, n (%) | 126 (52.9) |
| Edad en años, mediana ±RIQ | 56.1 (47.2-63.1) |
| Índice de masa corporala, mediana ±RIQ | 31.3 (28.3-35.1) |
| Categoría de índice de masa corporala, n (%) | |
| Normal | 19 (8.3) |
| Sobrepeso | 75 (32.9) |
| Obesidad clase I | 75 (32.9) |
| Obesidad clase II | 41 (18.0) |
| Obesidad clase III | 18 (7.9) |
| Diabetes, n (%) | 73 (30.7) |
| Dislipidemia, n (%) | 175 (73.5) |
| Hipertensión, n (%) | 108 (45.4) |
| Historia de enfermedad cardiovascular, n (%) | 11 (4.6) |
| Residencia en zona urbana, n (%)b | 226 (95.8) |
| Nivel educativo, n (%)c | |
| Primario | 56 (24.8) |
| Secundario | 87 (38.5) |
| Post-secundario o mayor | 83 (36.7) |
| Empleado, n (%)d | 139 (68.1) |
| Seguro médico, n (%)e | |
| Sistema público | 18 (7,7) |
| Sistema de asistencia social | 111 (47.4) |
| Seguro privado | 105 (44.9) |
| Transaminasas elevadasf, n (%) | 121 (50.8) |
La distribución de las categorías de los scores de fibrosis NAFLD y FIB-4 se presentan en la tabla 2. De los 238 pacientes incluidos en el estudio, 128 (54%) tuvieron al menos un resultado de score no invasivo que sugirió el riesgo indeterminado o alto de fibrosis, pero solo 72 (56%) tuvieron estudios de imagen para estadificación de fibrosis. Los estudios realizados más frecuentemente fueron elastografía de transición, radiación acústica de la fuerza del impulso (ARFI por sus siglas en inglés) o elastografía de shear wave, realizados en 30 (42%) pacientes, y elastografía por resonancia magnética, realizada en 14 (19%) pacientes. La biopsia hepática y la combinación de métodos (una o más técnicas de imagen además de biopsia hepática) fueron realizadas para estadificar la fibrosis en 19 (26%) y 9 (13%) pacientes, respectivamente. Considerando los 44 pacientes en los que se realizaron estudios de imagen no invasivos para evaluar la fibrosis (elastografía de transición, ARFI acústica, elastografía de onda de corte, o imagen por resonancia magnética), el 32% presentaron un resultado que sugirió fibrosis F0 a F1, mientras que el 68% presentaron un resultado que sugirió fibrosis F2 a F4. De los 26 pacientes que se realizaron biopsia hepática (como abordaje único o en combinación con estudios de imagen no invasivos), el 78% presentaron un resultado METAVIR de F0 o F1, mientras que el 22% tuvieron resultados de F2 a F4.
Distribución de los resultados de los scores no invasivos (riesgo de fibrosis), recopilados por medio de la clínica ECHO-EHGNA, del 1 de junio al 31 de julio de 2018
| Riesgo de fibrosis | Score NAFLD de fibrosis (n=145) | Score FIB-4 (n=220) |
|---|---|---|
| Riesgo bajo | 51 (35.2) | 140 (63.6) |
| Riesgo indeterminado | 61 (42.1) | 55 (25.0) |
| Riesgo alto | 33 (22.7) | 25 (11.4) |
Los datos se presentan como números absolutos y porcentajes. El score NAFLD de fibrosis pudo ser calculado en 145 pacientes y el score FIB-4 en 220 pacientes.
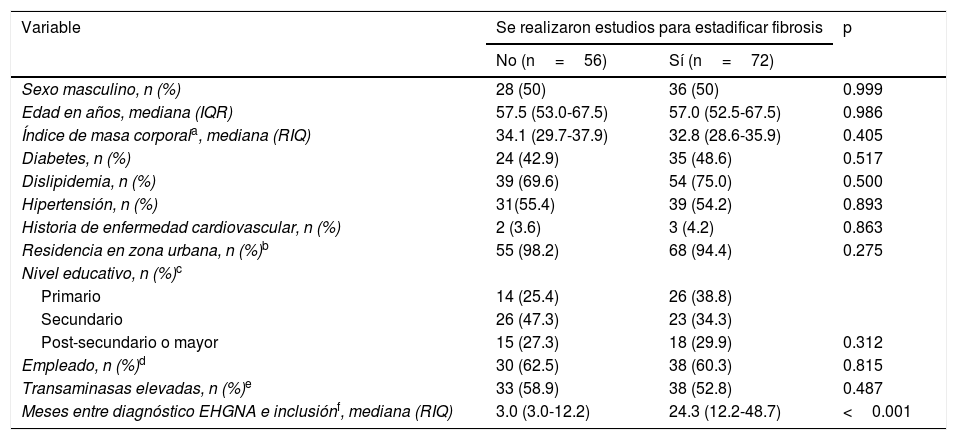
Al evaluar los 128 pacientes con resultados en el score no invasivo que sugirieron riesgo de fibrosis indeterminado o alto, la única variable que presentó diferencias significativas entre los pacientes que se realizaron estudios de imagen para estadificar la fibrosis y aquellos que no los realizaron fue el intervalo de tiempo entre el diagnóstico de EHGNA (tabla 3). Este intervalo fue de 24.3 meses (12.2-48.7) en pacientes que tuvieron un estudio complementario para estadificar la fibrosis vs 3.0meses (3.0-12.2) en pacientes que no lo tuvieron (p<0.001).
Comparación de características de pacientes con riesgo indeterminado o alto de acuerdo con los scores, clasificados por la realización o la ausencia de ella de estudios adicionales para estadificar fibrosis, recopiladas por medio de la clínica ECHO-EHGNA, del 1 de junio al 31 de julio de 2018 (n=128)
| Variable | Se realizaron estudios para estadificar fibrosis | p | |
|---|---|---|---|
| No (n=56) | Sí (n=72) | ||
| Sexo masculino, n (%) | 28 (50) | 36 (50) | 0.999 |
| Edad en años, mediana (IQR) | 57.5 (53.0-67.5) | 57.0 (52.5-67.5) | 0.986 |
| Índice de masa corporala, mediana (RIQ) | 34.1 (29.7-37.9) | 32.8 (28.6-35.9) | 0.405 |
| Diabetes, n (%) | 24 (42.9) | 35 (48.6) | 0.517 |
| Dislipidemia, n (%) | 39 (69.6) | 54 (75.0) | 0.500 |
| Hipertensión, n (%) | 31(55.4) | 39 (54.2) | 0.893 |
| Historia de enfermedad cardiovascular, n (%) | 2 (3.6) | 3 (4.2) | 0.863 |
| Residencia en zona urbana, n (%)b | 55 (98.2) | 68 (94.4) | 0.275 |
| Nivel educativo, n (%)c | |||
| Primario | 14 (25.4) | 26 (38.8) | |
| Secundario | 26 (47.3) | 23 (34.3) | |
| Post-secundario o mayor | 15 (27.3) | 18 (29.9) | 0.312 |
| Empleado, n (%)d | 30 (62.5) | 38 (60.3) | 0.815 |
| Transaminasas elevadas, n (%)e | 33 (58.9) | 38 (52.8) | 0.487 |
| Meses entre diagnóstico EHGNA e inclusiónf, mediana (RIQ) | 3.0 (3.0-12.2) | 24.3 (12.2-48.7) | <0.001 |
Todos los médicos participantes eran hepatólogos, con una edad mediana de 45años (37-59), y 9 (64%) eran mujeres. Respecto al acceso a las guías y recomendaciones actualizadas para la evaluación de EHGNA, 7 (50%) de los participantes declararon que habían asistido a congresos internacionales de hepatología o cursos de posgrado en el periodo entre 2016 y 2018.
Al evaluar su percepción de las barreras potenciales para el acceso a imágenes de estudio para estadificar la fibrosis, 7 (50%) dijeron que la barrera principal estaba relacionada con la cobertura del seguro médico y el costo del estudio, 4 (29%) mencionaron la falta de conocimiento sobre las consecuencias potenciales del EHGNA en pacientes y la población en general, y 3 (21%) declararon que era la distancia del lugar de residencia del paciente al centro más cercano donde se realizaran estudios para estadificar la fibrosis. Ninguno de los médicos participantes mencionó que la barrera principal fuera la falta de información sobre la aplicación de algoritmos para estadificar la fibrosis en pacientes con EHGNA dentro de la comunidad médica.
DiscusiónNuestro estudio presentó varios hallazgos interesantes. Primero, los resultados mostraron que más del 50% de los pacientes con EHGNA atendidos por hepatólogos tenían riesgo de fibrosis hepática alto o indeterminado, de acuerdo con la evaluación por medio de scores no invasivos. Segundo, los estudios de imagen solo fueron realizados en el 50% de los pacientes en quienes los algoritmos indicaron que requerían estudios adicionales para estadificar la fibrosis. Tercero, la principal barrera para estadificar la fibrosis, de acuerdo con la percepción de los hepatólogos, estaba relacionada con los costos del estudio y la cobertura del seguro médico.
Como se mencionó anteriormente, la EHGNA tiene proporciones epidémicas a nivel mundial, y esta tendencia parece crecer rápidamente, de forma concomitante con el incremento en la prevalencia de diabetes tipo2 y obesidad3,18,19. Debido a que la morbimortalidad en pacientes con EHGNA está asociada con el desarrollo de fibrosis, la detección de pacientes con alto riesgo para ese desenlace es crucial13,20. Las recomendaciones recientes para la utilización de scores no invasivos como primera herramienta para la evaluación de la fibrosis en pacientes con EHGNA6,17 parece ser un abordaje razonablemente práctico: estos scores son económicos, ampliamente disponibles, y tienen un valor de predictivo negativo alto para descartar la fibrosis avanzada21. En un metaanálisis reciente se encontró que los scores para fibrosis NAFLD y FIB-4 eran los scores no invasivos con mayor precisión diagnóstica para la fibrosis avanzada, con un area under the curve de aproximadamente 0.8422.
Encontramos en nuestro estudio una alta proporción (54%) de pacientes con riesgo indeterminado o alto de fibrosis, de acuerdo con los scores no invasivos. Este hallazgo fue más alto de lo normalmente esperado debido a que nuestra cohorte estuvo compuesta predominantemente de pacientes latinos con sobrepeso mayores de 50años, con una alta prevalencia de comorbilidades metabólicas y transaminasas alteradas, lo cual muy probablemente refleja la necesidad real de evaluar más profundamente para fibrosis en esos pacientes. Además, todos los pacientes incluidos en el presente análisis fueron referidos con hepatólogos, lo cual refuerza el hecho de que dicha población podría presentar un mayor riesgo de fibrosis que pacientes que reciben atención primaria.
Es difícil comparar nuestros resultados con los de estudios publicados previamente, ya que la prevalencia de EHNA en una población dada varía considerablemente, al igual que los scores y puntos de corte utilizados en cada estudio. Por ejemplo, en un estudio poblacional realizado en el Reino Unido, los resultados del score FIB-4 estuvieron disponibles en el 40% de 176,114 pacientes con EHGNA, de los cuales hasta el 36% tenían riesgo de fibrosis indeterminado o alto22,23. En otro estudio poblacional realizado en una comunidad hispánica en Texas, donde la prevalencia de EHGNA alcanzó el 52%, se observaron hallazgos consistentes en el 17-63% de toda la cohorte, con riesgo de fibrosis indeterminado o alto, utilizando diferentes scores no invasivos24. De manera similar, cuando se evaluó a pacientes obesos para cirugía bariátrica o a pacientes con diabetes tipo2 con esas herramientas, se observaron resultados de riesgo indeterminado o alto en el 60 y el 61% de la población de estudio, respectivamente25,26.
Cuando se obtiene un riesgo de fibrosis indeterminado o alto con los scores no invasivos es necesario realizar una interpretación cuidadosa de los hallazgos, ya que la principal limitación de dichos estudios es su menor precisión para confirmar fibrosis avanzada22. Otras limitaciones son que las condiciones hepáticas y extrahepáticas concomitantes pueden influenciar los resultados, que su precisión es menor en pacientes jóvenes que en pacientes mayores, y que una alta proporción de pacientes son clasificados en una zona indeterminada. Por ende, la evaluación de fibrosis con estudios de imagen es obligatoria en pacientes con riesgo de fibrosis indeterminado o alto6,15,17.
Durante los últimos años, diferentes expertos han propuesto varios algoritmos y guías de práctica para estadificar a pacientes con EHGNA: existe consenso en el reconocimiento de que la combinación de scores no invasivos y técnicas de imagen, tales como la elastografía (en sus diferentes modalidades), es útil para identificar a pacientes con mayor riesgo de fibrosis que podrían beneficiarse de una biopsia hepática6,13,17,27. En un estudio de cohorte prospectivo grande reciente que utilizó un algoritmo de dos pasos (el score FIB-4 combinado con la prueba ELF, en caso de considerarla necesaria), se detectaron 5 veces más casos de fibrosis avanzada, lo cual resultó en un menor número de referencias a atención secundaria, en comparación con la atención estándar, lo cual ofrece nueva evidencia sustancial de los beneficios que un abordaje por pasos proporciona a pacientes y médicos28.
Sin embargo, la forma en la que dichos algoritmos son incorporados en la práctica del mundo real no se conoce bien. La escasa información disponible solo se refiere a la utilización de abordajes de estadificación de fibrosis en el contexto del cuidado primario, pero se ha reportado poco si los hepatólogos siguen dichas estrategias28,29. En nuestro estudio, solo el 56% de los pacientes que estaban en seguimiento por un hepatólogo y tenían indicación de avanzar con estudios de evaluación de la fibrosis, se realizaron estudios adicionales. Una explicación posible para la baja adherencia a los algoritmos recomendados es la falta de conocimiento de ellos, pero el acceso a la información por parte de los hepatólogos argentinos parece ser adecuada, dado que el 50% de los médicos reportaron que habían asistido a congresos internacionales de hepatología o cursado estudios de posgrado en los últimos dos años, en los cuales la evaluación para EHGNA fue un «tema en boga». También es un tema que se discute ampliamente en las guías actuales de práctica13,27,30,31. Además, todos los médicos participantes declararon que estaban familiarizados con los algoritmos de estadificación de fibrosis propuestos y estaban motivados para tratar a pacientes con EHGNA, por estar involucrados en ECHO-EHGNA.
Las barreras percibidas para estadificar la fibrosis estuvieron relacionadas con el costo de los estudios de imagen, la falta de cobertura de seguridad médica y/o la distancia del lugar de residencia de los pacientes del sitio más cercano para realizar la elastografía. Dichos obstáculos podrían explicar el alto porcentaje (26%) de pacientes que se realizaron biopsia hepática sin evaluación previa por medio de imagen no invasiva, dado que la biopsia es un procedimiento ampliamente disponible y que puede ser realizado en cualquier centro de hepatología en todo el país.
En nuestro estudio intentamos identificar características de pacientes que pudieran estar asociadas con el acceso a estudios de imagen para estadificar la fibrosis. A pesar de explorar diferentes variables clínicas y determinantes sociales, la única variable que fue diferente, entre pacientes que se realizaron estudios de imagen para estadificar la fibrosis y los pacientes que no se los realizaron, fue el intervalo de tiempo entre el diagnóstico de EHGNA y la inclusión en el estudio. Los pacientes que tuvieron más visitas de seguimiento después del diagnóstico de EHGNA tuvieron mayor probabilidad de realizarse los estudios de imagen que los pacientes que tuvieron menor cantidad de visitas de seguimiento. Parece ser que es necesaria una mayor interacción entre los pacientes y los médicos para tener acceso a pruebas adicionales, como la elastografía de transición, la cual es considerada una técnica de acceso inmediato en otras regiones6. Este hallazgo podría representar en Argentina un desafío necesario para el uso de los algoritmos de estadificación propuestos, ya que al menos dos meses de seguimiento con un especialista son necesarios para completar la valoración inicial de fibrosis.
Nuestro estudio tuvo varias fortalezas. Primero, a pesar de ser un estudio de corte transversal, los investigadores tenían capacitación en la obtención de datos y toda la información fue obtenida en una sola visita con la participación del paciente, lo cual generó datos consistentes y minimizó la falta de información. Segundo, hasta donde sabemos, este es el primer estudio que trata el tema de la adherencia a algoritmos de diagnóstico en pacientes con EHGNA que están bajo el cuidado de un hepatólogo.
La limitación principal de nuestro estudio fue el hecho de que cuando fue diseñado no existía un algoritmo de dos pasos con amplia aceptación, lo cual resultó en diferentes grados de adherencia, dependiendo de la estrategia elegida. Sin embargo, creemos que dicha situación solo resalta la actual necesidad de estandarizar los algoritmos de diagnóstico para pacientes con EHGNA.
En conclusión, encontramos que un alto porcentaje de pacientes con EHGNA bajo el seguimiento de hepatólogos tenía un riesgo indeterminado o alto de fibrosis, evaluado por medio de scores no invasivos. Sin embargo, solo la mitad de dichos pacientes se realizaron pruebas de diagnóstico adicionales para estadificar la fibrosis. La principal barrera para la adherencia a los algoritmos actuales que identificamos pareció estar relacionada con la falta de acceso a otras herramientas no invasivas, como la elastografía, ya fuera por falta de cobertura de seguro médico o por la lejanía de un centro donde realizar dichos estudios. Es importante que las sociedades científicas y las entidades gubernamentales realicen esfuerzos para resolver esas barreras y poder evaluar adecuadamente a los pacientes con riesgo de fibrosis, utilizando estos algoritmos costo-efectivos. Al igual que con otras enfermedades hepáticas prevalentes, es probable que la mejor forma de superar el actual problema sea por medio de la educación y la implementación de guías multidisciplinarias que sustenten la necesidad y las ventajas de una estadificación adecuada de la fibrosis en pacientes con EHGNA.
Consideraciones éticasEl Comité Institucional de Investigación aprobó el estudio (protocolo número 3559). Todos los procedimientos realizados se realizaron de acuerdo con los estándares éticos del comité responsable de experimentación humana (institucional y nacional) y con la Declaración de Helsinki de 1975, revisión de 2008. Todos los pacientes dieron su consentimiento informado oral y todos los pacientes incluidos en el análisis eran mayores de 17años. Los pacientes del estudio no pueden ser identificados por medio de los datos en el artículo.
FinanciaciónNo se recibió financiación específica del sector público, el sector privado u organizaciones sin fines de lucro con relación a este estudio.
Conflicto de interesesLos autores declaran que no existió conflicto de intereses.
AgradecimientosLos autores desean agradecer a la Fundación Icalma por su apoyo metodológico para la presente investigación, al igual que al Proyecto ECHO y al Departamento de Informática de la Salud del Hospital Italiano de Buenos Aires por posibilitar la actividad de ECHO-EHGNA.
Véase contenido relacionado en DOI: 10.1016/j.rgmx.2021.04.004, Montaño-Loza AJ. Evaluación de la fibrosis en pacientes con enfermedadde hígado graso no alcohólico. Rev Gastroenterol Mex.2022;87:1–3.