La fibrosis quística (FQ) es una enfermedad genética cuya afectación gastrointestinal implica principalmente al páncreas, los conductos biliares y el hígado. El objetivo es analizar los hallazgos ecográficos abdominales.
MétodosEstudio retrospectivo, descriptivo de adultos ≥16 años con diagnóstico FQ, periodo evaluado 2006-2019. Se analizaron los parámetros clínicos, genéticos, el índice de masa corporal, el volumen espiratorio forzado en el primer segundo, insuficiencia pancreática, diabetes relacionada con FQ, cirrosis secundaria a FQ e informes de la ecografía abdominal.
ResultadosSetenta pacientes, 39 (55.8%) varones, mediana de edad: 27 años. Media de índice de masa corporal 21.3 ± 2.8kg/m2 (r: 17-30.9). Insuficiencia pancreática en 47 (67.1%), cirrosis secundaria a FQ en 6 (8.5%), diabetes relacionada con FQ en 21 (30%) pacientes. Mediana volumen espiratorio forzado en el primer segundo 47%. F508del en el 56.1%. Imágenes en páncreas: sin hallazgos patológicos en 49 (70%), aumento de la ecogenicidad en 18 (25.7%) y quistes en 3 (4.3%). Imágenes en vesícula biliar: microvesícula en 3 (4.2%), barro biliar en 2 (2.8%), cálculos biliares en 7 (10%), antecedente de colecistectomía en 4 (5.8%). Imágenes en hígado y bazo: sin hallazgos patológicos en 47 (67.2%) hepatomegalia homogénea con esplenomegalia en 2 (2.8%). Patrón heterogéneo del parénquima en 11 (15.8%), ecogenicidad aumentada en 4 (5.7%) ecoestructura heterogénea, bordes lobulados y esplenomegalia en 6 (8.5%).
ConclusiónLa ecografía abdominal es una técnica segura y de bajo costo que permite identificar algún grado de hepatopatía crónica y pancreática mejorando las decisiones en el abordaje y seguimiento de pacientes adultos con FQ.
Cystic fibrosis (CF) is a genetic disease whose gastrointestinal compromise mainly involves the pancreas, bile ducts, and liver. Our aim was to analyze abdominal ultrasound findings.
MethodsA retrospective, descriptive study was conducted on adults (patients ≥ 16 years of age) diagnosed with CF, within the time frame of 2006-2019. Clinical and genetic parameters, body mass index, forced expiratory volume in one second, pancreatic insufficiency, CF-related diabetes, cirrhosis secondary to CF, and abdominal ultrasound images were analyzed.
ResultsSeventy patients, 39 of whom were men (55.8%), had a mean age of 27 years and a mean body mass index of 21.3 ± 2.8kg/m2 (r: 17-30.9). Forty-seven (67.1%) presented with pancreatic insufficiency, 6 (8.5%) with cirrhosis secondary to CF, and 21 (30%) had CF-related diabetes. Median forced expiratory volume in one second was 47% and the F508del mutation was found in 56.1%. Images of the pancreas: no pathologic findings in 49 (70%), increased echogenicity in 18 (25.7%), and cysts in 3 (4.3%). Gallbladder images: microgallbladder in 3 (4.2%), biliary sludge in 2 (2.8%), gallstones in 7 (10%), and a history of cholecystectomy in 4 (5.8%). Liver and spleen images: no pathologic findings in 47 (67.2%), homogeneous hepatomegaly with splenomegaly in 2 (2.8%), a heterogeneous pattern of the parenchyma in 11 (15.8%), increased echogenicity in 4 (5.7%), and heterogeneous echo patterns, lobulated liver contour, and splenomegaly in 6 (8.5%).
Conclusionabdominal ultrasound is a safe, low-cost technique that enables the identification of some degree of chronic liver and pancreatic diseases, improving the approach and follow-up decisions in adult patients with CF.
La fibrosis quística (FQ) es una enfermedad multisistémica, monogénica de herencia autosómica recesiva que se caracteriza por la presencia de mutaciones en un gen localizado en el cromosoma 7 que codifica una proteína identificada como regulador de la conductabilidad transmembrana de fibrosis quística (CFTR)1.
El ARNm del CFTR fue identificado, por técnicas inmunohistoquímicas, en glándulas submucosas del pulmón humano, glándulas sudoríparas, páncreas, criptas intestinales y conductos biliares2. Hasta el presente se han descrito 2104 mutaciones causantes de FQ enumeradas en el Cystic Fibrosis Genetic Analysis Consortium3.
Mediante la ley 26.279 de pesquisa neonatal se practica en Argentina la determinación de tripsina inmunorreactiva en sangre junto a la búsqueda de otras enfermedades congénitas y/o genéticas. Su incidencia en el país es de aproximadamente 1:7000 nacidos vivos y según el registro nacional de FQ (RENAFQ) hay un total de 1458 casos registrados a 2020, de los cuales 851 (58%) son mayores de 12 años4,5. La sobrevida ha aumentado en los últimos años y la supervivencia media es actualmente cercana a los 50 años6, resultados de la formación de equipos profesionales de atención multidisciplinarios sumado a los avances terapéuticos farmacológicos destacándose en esta última década el surgimiento de los moduladores CFTR que basan su acción en la corrección de la función de la proteína CFTR alterada según los tipos de mutaciones identificadas7.
La ecografía abdominal (EA) constituye un método de diagnóstico seguro y accesible en la caracterización de la patología digestiva asociada a la fibrosis quística. El reemplazo graso completo es la anormalidad pancreática radiológica más común siendo la hiperecogenicidad del páncreas el hallazgo ecográfico más frecuente en pacientes con fibrosis quística e insuficiencia pancreática exocrina. Los quistes pancreáticos son de pequeño tamaño (1 a 3mm de diámetro). Un 12-24% de los pacientes con FQ tienen colelitiasis, con frecuencia en vesículas pequeñas (microvesículas)8. La ecografía abdominal también desempeña un papel fundamental en el diagnóstico de enfermedad hepática asociada a fibrosis quística (EHFQ), dado que puede evaluar cambios en el parénquima hepático compatibles con cirrosis hepática, esteatosis y anomalías del conducto biliar9.
El objetivo del presente trabajo es analizar los resultados de la evaluación ecográfica de la vesícula biliar, páncreas, hígado y bazo en pacientes adultos con diagnóstico de FQ, asistidos en la Unidad de Fibrosis Quística del Hospital.
MétodosSe realizó un análisis retrospectivo y descriptivo de pacientes ≥ 16 años, asistidos en la unidad de FQ, desde enero de 2006 hasta junio de 2019. El diagnóstico de FQ se basó en criterios clínicos, test del sudor y/o detección de dos mutaciones del gen CFTR.
Se analizaron las siguientes variables: edad, sexo, edad al momento del diagnóstico, estudio genético, índice de masa corporal (IMC), volumen espiratorio forzado en el primer segundo (VEF1), elastasa fecal, glucemia en ayunas y a las 2h de una sobrecarga oral de 75g de glucosa.
Se estableció la concentración de elastasa fecal < 200μg/g para diagnóstico de insuficiencia pancreática (IP). El diagnóstico de cirrosis subyacente fue realizado por el hallazgo de cambios histológicos compatibles en tejido hepático, por las características macroscópicas del hígado en el acto operatorio o por las evidencias clínicas y paraclínicas de la enfermedad10. El diagnóstico de diabetes relacionada con la fibrosis quística (DRFQ) se estableció con glucemia en ayunas superior a 126mg/dl y/o a las 2h superior a 200mg/dl.
El IMC se calculó con la fórmula peso/altura2 (kg/m2). La función respiratoria fue evaluada por el volumen espiratorio forzado en el primer segundo (VEF1).
El estudio genético incluyó la búsqueda de mutaciones mediante la metodología PCR ASO reversa; inno-lipa CFTR 19 y 17, innogenetics.
Se revisaron por parte de un especialista en diagnóstico por imágenes, los reportes escritos y las imágenes de los estudios ecográficos abdominales, tanto los efectuados en el servicio de imágenes del hospital, como los realizados en otras instituciones.
Los estudios ecográficos fueron realizados después de un periodo de ayuno de 8 h con un ecógrafo Phillips HD7: transductor convexo (C) y superficial (S), año 2009 y otro ESAOTE MYLAB 40: transductores convexos (C), superficial (S) y endocavitarios (E), año 2007, bajo condiciones estándar. Los signos ecográficos incluyeron la evaluación de 9 parámetros11.
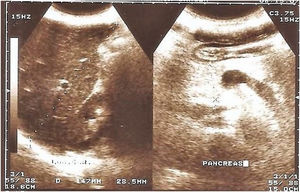
Las imágenes quísticas en páncreas fueron definidas como estructuras anecoicas que generalmente son redondas y ovales con diámetro superior a 1cm (quistes macroscópicos).
La lipomatosis pancreática se definió cuando la ecogenicidad pancreática fue parcial o completamente mayor que la del hígado (o el riñón en caso de hiperecogenidad hepática).
La colelitiasis se demostró mediante una sombra acústica típica en la vesícula biliar.
Barro biliar se definió como un nivel de múltiples ecos finos intravesiculares que se localizan en una posición declive.
La microvesícula biliar se definió como menos de 2-3cm de largo y 0.5–1.5cm de ancho.
La esteatosis hepática se definió a través del hallazgo de un incremento en la ecogenicidad «hígado brillante» en relación con la corteza renal.
Para la cuantificación del tamaño hepático se suele utilizar el diámetro longitudinal del lóbulo derecho. Se consideró como hepatomegalia un valor superior a 15.5cm.
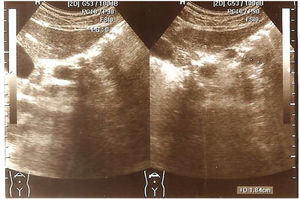
Los parámetros ecográficos utilizados para evaluar cirrosis hepática fueron: tamaño hepático, borde hepático lobulado (irregularidad de la superficie hepática), heterogeneidad del parénquima hepático, nodularidad y esplenomegalia.
Se consideró esplenomegalia cuando el diámetro bipolar fue mayor a 13cm.
Análisis estadísticoSe confeccionó una planilla de recolección de datos con el software Microsoft Excel 2010. Los mismos fueron procesados mediante MedCalc versión 18.9. Los resultados fueron agrupados en tablas para facilitar su tratamiento y los valores se expresaron como media ± 1 DE o mediana y rango. Para la comparación de las variables cualitativas se utilizó el test de Chi2 o Fisher y t de Student para los cuantitativos. Se consideró diferencia significativa a una p < 0.05.
Consideraciones éticasEste manuscrito no contiene información personal que permita identificar a los pacientes, quienes han firmado un consentimiento informado, aceptando ser evaluados y que los datos resultantes de dicha evaluación puedan ser analizados y publicados. El trabajo cumple con la normativa vigente en investigación bioética y obtuvo la autorización del Comité de Ética del hospital.
ResultadosUn total de 70 pacientes adultos (≥ 16 años) con diagnóstico de FQ asistidos por un equipo interdisciplinario de un centro de adultos de La ciudad de La Plata, Argentina, fueron incluidos en el estudio. De ellos, 31 mujeres (44.2%) y 39 varones (55.8%), con una edad mediana de 27 años (rango: 16-65). La mediana de edad al momento del diagnóstico fue de 2 años (rango: 4 meses-26 años).
El estudio genético se realizó en 65 pacientes. La mutación más frecuente fue F508del hallado en 73/130 alelos estudiados (56.1%).
La media del IMC fue 21.3 ± 2.8kg/m2 (rango 17-30.9).
La mediana del VEF1 fue 47% (rango: 11-107).
Las características referidas al estado pancreático muestran que 47/70 (67.1%) presentaban IP y 23/70 (32.9%) tuvieron suficiencia pancreática (SP). Se estableció diagnóstico de DRFQ en 21/70 (30%).
La cirrosis hepática fue diagnosticada en 6 pacientes (8.5%) de nuestra serie. Todos con diagnóstico asociado de insuficiencia pancreática.
En la tabla 1 se detallan las variables analizadas con su distribución absoluta y relativa. El análisis de los hallazgos ecográficos se muestra en la tabla 2.
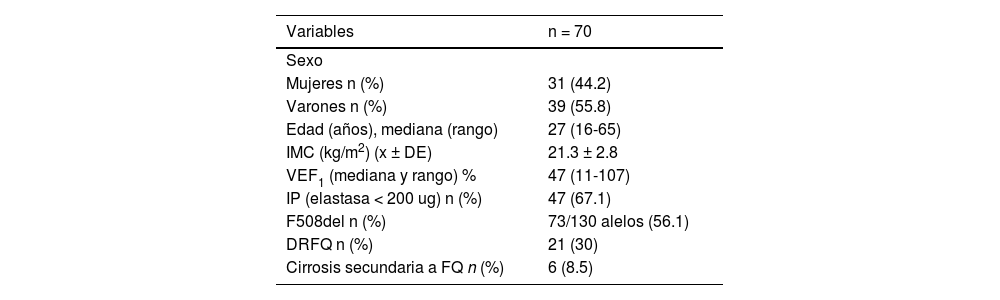
Distribución absoluta y relativa de las variables analizadas en los pacientes incluidos con FQ (n = 70)
| Variables | n = 70 |
|---|---|
| Sexo | |
| Mujeres n (%) | 31 (44.2) |
| Varones n (%) | 39 (55.8) |
| Edad (años), mediana (rango) | 27 (16-65) |
| IMC (kg/m2) (x ± DE) | 21.3 ± 2.8 |
| VEF1 (mediana y rango) % | 47 (11-107) |
| IP (elastasa < 200 ug) n (%) | 47 (67.1) |
| F508del n (%) | 73/130 alelos (56.1) |
| DRFQ n (%) | 21 (30) |
| Cirrosis secundaria a FQ n (%) | 6 (8.5) |
DE: desvío estándar; DRFQ: diabetes relacionada con fibrosis quística; FQ: fibrosis quística; IMC: índice de masa corporal; IP: insuficiencia pancreática; VEF1: volumen espiratorio forzado en el primer segundo.
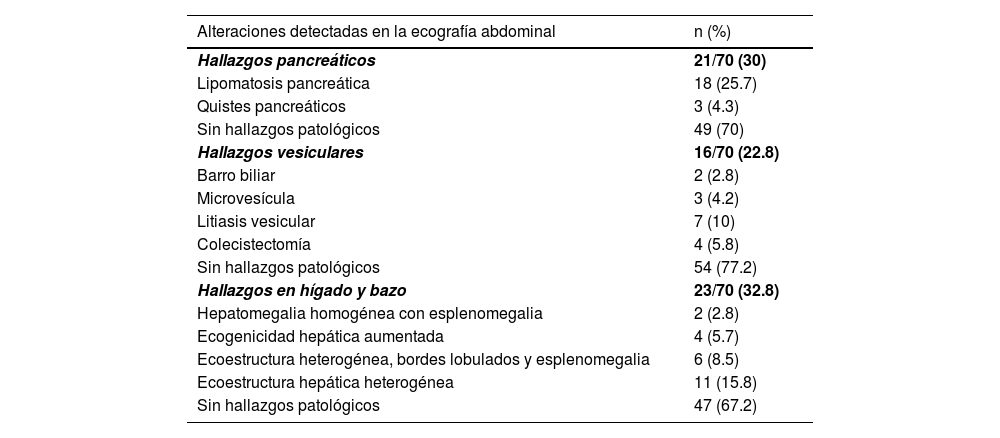
Resultados de la ecografía abdominal en pacientes adultos con FQ
| Alteraciones detectadas en la ecografía abdominal | n (%) |
|---|---|
| Hallazgos pancreáticos | 21/70 (30) |
| Lipomatosis pancreática | 18 (25.7) |
| Quistes pancreáticos | 3 (4.3) |
| Sin hallazgos patológicos | 49 (70) |
| Hallazgos vesiculares | 16/70 (22.8) |
| Barro biliar | 2 (2.8) |
| Microvesícula | 3 (4.2) |
| Litiasis vesicular | 7 (10) |
| Colecistectomía | 4 (5.8) |
| Sin hallazgos patológicos | 54 (77.2) |
| Hallazgos en hígado y bazo | 23/70 (32.8) |
| Hepatomegalia homogénea con esplenomegalia | 2 (2.8) |
| Ecogenicidad hepática aumentada | 4 (5.7) |
| Ecoestructura heterogénea, bordes lobulados y esplenomegalia | 6 (8.5) |
| Ecoestructura hepática heterogénea | 11 (15.8) |
| Sin hallazgos patológicos | 47 (67.2) |
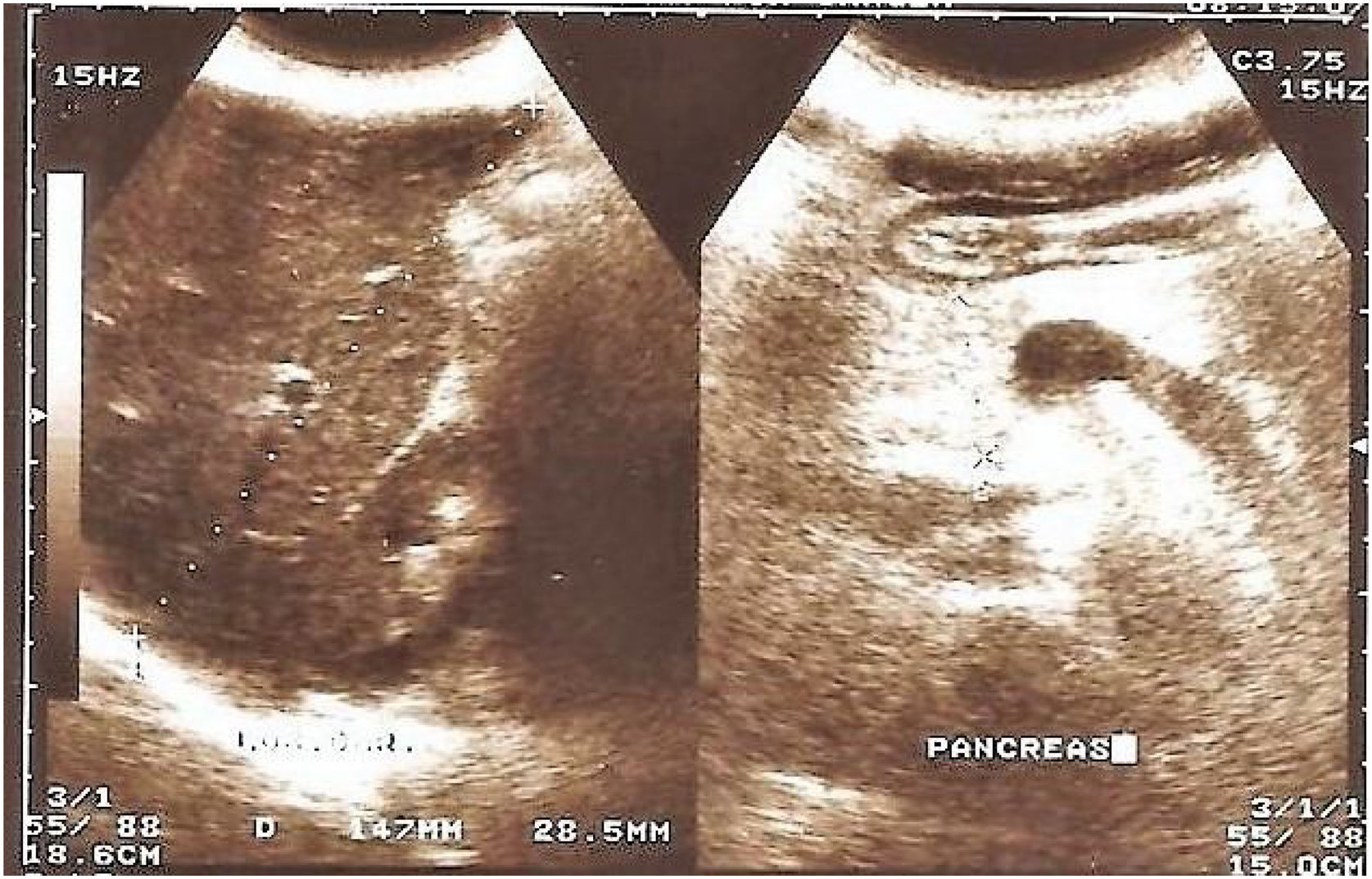
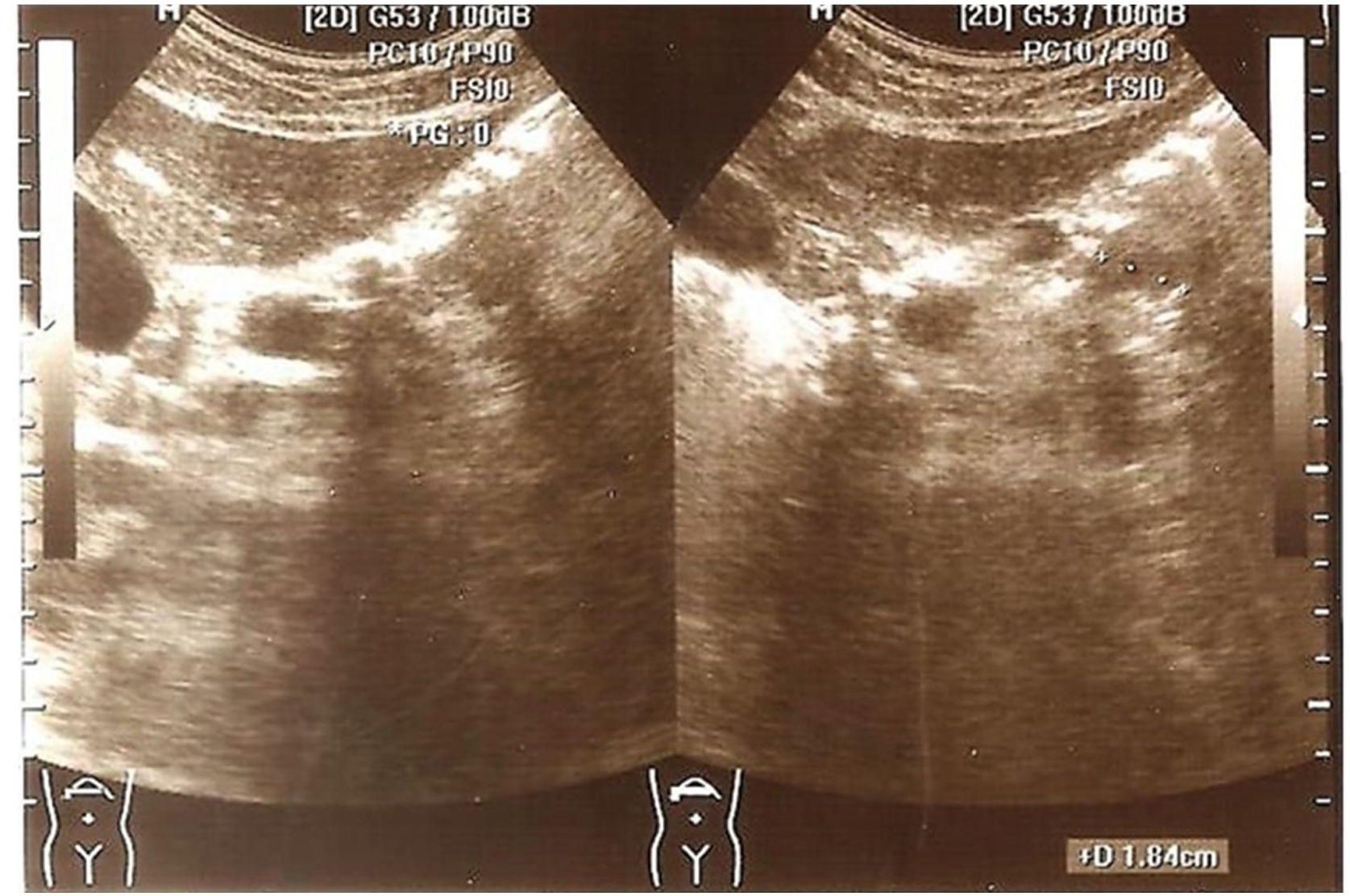
Hallazgos en páncreas. Del total de 70 pacientes, se halló que 21 (30%) tenían alteración ecográfica en páncreas: lipomatosis pancreática 18 (25.7%) y quistes pancreáticos 3 (4.3%) (figs. 1 y 2). En el restante 70% no se hallaron alteraciones ecográficas pancreáticas demostrables.
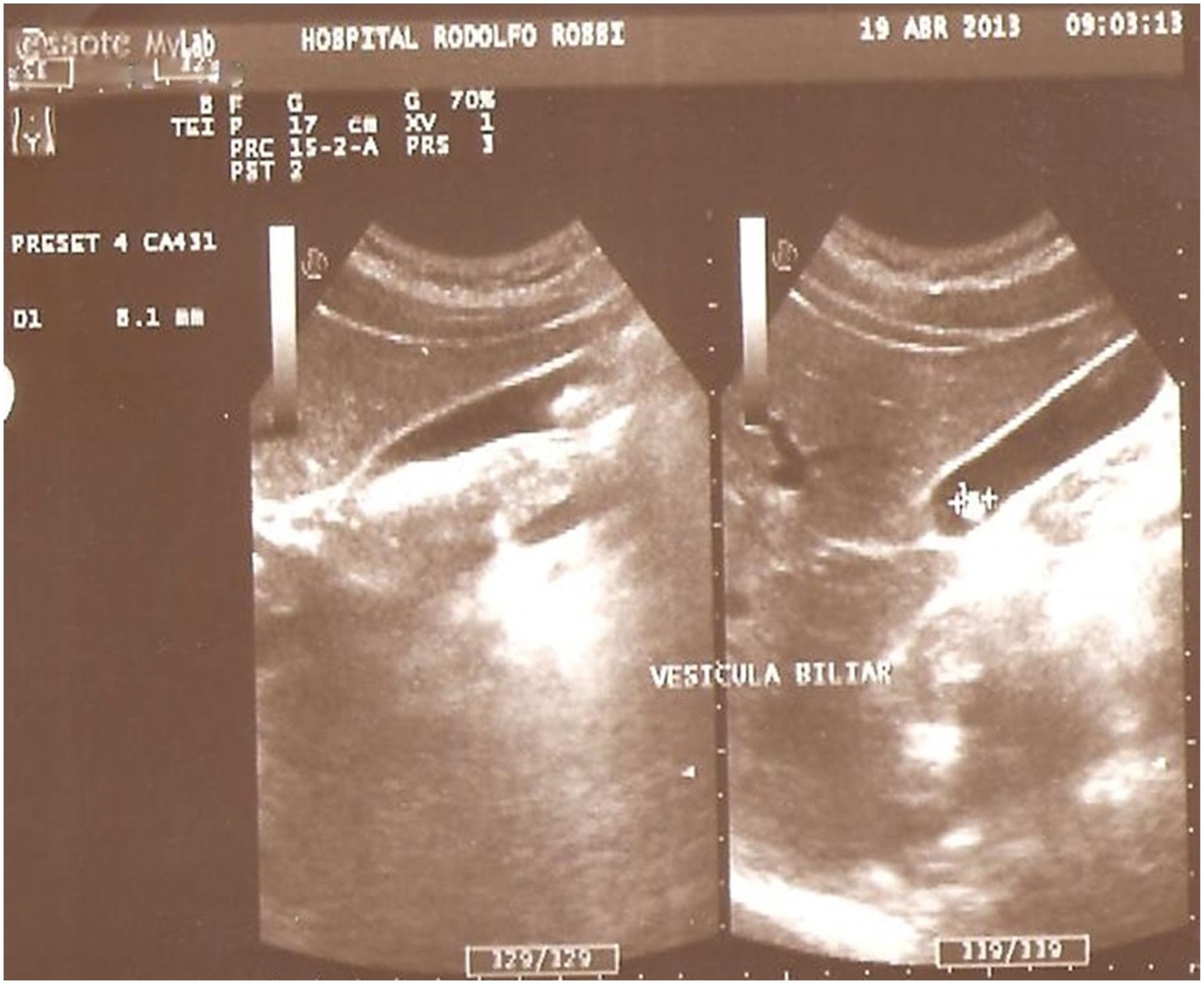
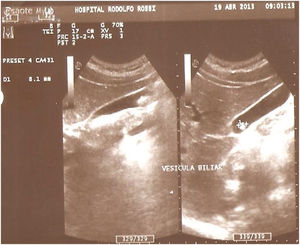
Hallazgos ecográficos en vesícula biliar. En 16/70 (22.8%) presentaron alteraciones ecográficas vesiculares: barro biliar en 2 (2.8%), microvesícula biliar 3 (4.3%), cálculos biliares 7 (10%) y 4 (5.7%) tenían antecedente de colecistectomía (fig. 3). En 54/70 (77.2%) no se hallaron alteraciones patológicas vesiculares demostrables por ecografía.
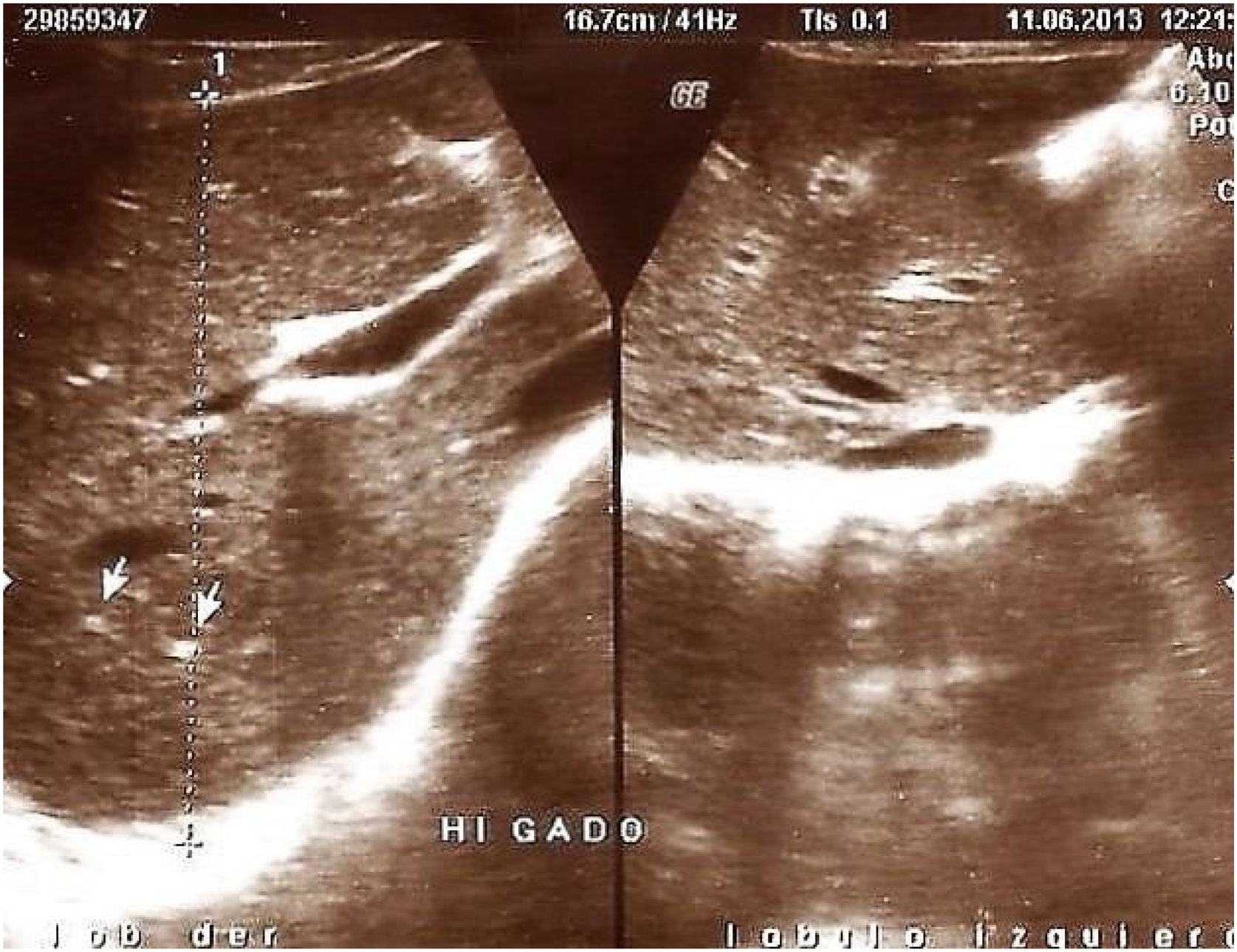
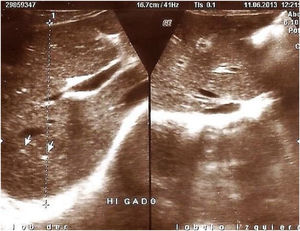
Hallazgos en hígado y bazo. Se presentaron en 23/70 (32.8%): hepatomegalia homogénea con esplenomegalia 2 (2.8%), ecogenicidad hepática aumentada 4 (5.7) %), 6 pacientes (8.5%) presentaron parámetros ecográficos compatibles con cirrosis hepática (parénquima hepático de ecorrespuesta heterogénea, borde hepático lobulado y esplenomegalia) (fig. 4). En 11 (15.8%) se halló ecorrespuesta hepática heterogénea mientras que 47/70 (67.2%) no presentaron hallazgos ecográficos demostrables en hígado y bazo.
Se estableció un análisis comparativo respecto a los hallazgos ecográficos entre los pacientes con diagnóstico de FQ en la edad pediátrica y aquellos diagnosticados en la adultez. No se halló diferencia significativa entre ambos grupos con respecto a alteración pancreática (p=0.4), vesicular (p=0.2) y hepatoesplénica (p=0.2). Al analizar los hallazgos ecográficos entre los pacientes con DRFQ y aquellos no diabéticos, tampoco se halló diferencia significativa entre ambos grupos: alteraciones pancreáticas (p=0.2), alteración vesicular (p=0.3) y alteraciones hepatoesplénicas (p=0.7). Se halló diferencia significativa al analizar la hiperecogenicidad pancreática (lipomatosis) entre los pacientes con función pancreática exocrina normal y aquellos insuficientes pancreáticos (IP) (p=0.002).
DiscusiónLa ecografía abdominal como estudio complementario está contemplada en forma semestral o anual o según criterio médico, de acuerdo a la Guía de diagnóstico y tratamiento de pacientes con diagnóstico de FQ12.
En función de los procesos descritos por la anatomía patológica se establece el aumento de la ecogenicidad del páncreas y la pérdida del fino patrón lobular del páncreas como los hallazgos típicos en la ecografía abdominal8. En nuestra casuística de 70 pacientes, se evidenció hiperecogenicidad pancreática en 21 (30%). Al analizar la hiperecogenicidad pancreática (lipomatosis) entre los pacientes con función pancreática exócrina normal y aquellos insuficientes pancreáticos (IP), se halló diferencia significativa (p=0.002). Engjom et al.13, sobre 21 pacientes mayores de 15 años con diagnóstico de FQ, también detallaron una relación directamente proporcional respecto de la hiperecogenicidad con la pérdida de la funcionalidad pancreática como consecuencia del reemplazo graso de la glándula. Aunque concluyen que la resonancia magnética nuclear evaluó la infiltración grasa pancreática con más precisión superando a la ecografía como marcador más confiable y válido de insuficiencia pancreática exocrina en FQ. Coincidimos con los autores en referencia a la detección de quistes pancreáticos que solo fueron descritos en pacientes con IP y en que tampoco se detectaron calcificaciones pancreáticas en nuestra serie.
Los resultados de nuestra serie difieren con los descritos por Dietrich et al.14 en referencia a los hallazgos en el patrón ecográfico pancreático descrito en 66 pacientes adultos con FQ quienes detallan presencia de signos ecográficos compatibles con lipomatosis pancreática en un 35% de su casuística versus 25.7% de lo observado en nuestra serie. Destacamos también que el autor refiere la detección de quistes pancreáticos en hasta 18% de su serie, a diferencia de nuestros resultados donde se visualizaron solo en el 4.3%.
La expresión del CFTR en la vesícula biliar es uno de los más altos de todos los tejidos humanos15. Desde hace tiempo se reconoce que los pacientes con FQ pueden desarrollar anormalidades en la vesícula biliar pudiendo comprender una vesícula biliar pequeña o ausente, disfunción de la vesícula biliar, colelitiasis sintomática y malignidad16. Tabori et al.17, en referencia a los hallazgos ecográficos en la vesícula biliar de un total de 114 pacientes con diagnóstico de FQ tanto pediátricos como adultos, mostró una frecuencia de 3% de litiasis mientras que la presencia de microvesícula se detectó en un 21%. En el estudio de Dietrich et al.14, se encontró microvesícula en 18/72 (25%) de adultos con FQ, mientras que no se observó ningún sujeto colecistectomizado. Estos hallazgos difieren con aquellos de nuestra serie en relación a que la litiasis vesicular fue la anormalidad ecográfica detectada con mayor frecuencia (10%). Solo 4 de los sujetos de nuestro estudio tenían el antecedente de haber sido colecistectomizados por litiasis biliar y la presencia de microvesícula fue hallada solo en 3 pacientes (4.2%).
La enfermedad hepática asociada a FQ (EHFQ) es una colangiopatía esclerosante inflamatoria crónica que constituye la causa de muerte no pulmonar más importante, representando entre 2.5 a 3.3% de la mortalidad18. Se manifiesta frecuentemente antes de los 20 años y puede evolucionar a enfermedad hepática avanzada, cirrosis biliar, hipertensión portal y descompensación hepática19.
El resultado obtenido de las imágenes ecográficas abdominales (presencia de hepatomegalia y/o esplenomegalia) constituye junto a otros parámetros (examen físico y pruebas de laboratorio), criterios de diagnóstico para EHFQ. Estos fueron establecidos por Debray20 y más recientemente por Koh21.
En cuanto a la enfermedad hepática asociada con FQ, la cirrosis biliar focal (20/30%) es la lesión resultante atribuible a la mutación del CFTR, que en algunos casos puede evolucionar a cirrosis biliar multilobular (10%) con desarrollo de hipertensión portal (HTP) (2-5%), mientras que en el diagnóstico de esteatosis hepática (25-60%) hay que considerar otras variables que pueden contribuir como diabetes, obesidad o déficits nutricionales de ácidos grasos esenciales, carnitina y ologometales20,22.
En referencia a los hallazgos ecográficos hepáticos, Tabori17 halló en su serie de 114 pacientes esteatosis en 42/114 (37%), mientras que se visualizó ecográficamente un parénquima heterogéneo con bordes hepáticos lobulados en 25/114 (22%) de los casos y con esplenomegalia en 12/114 (11%). En la serie de 72 pacientes adultos de Dietrich et al.14, se detectó una ecoestructura irregular en 17/72 (24%), mientras que se observó esteatosis hepática en 16/72 (22%).
Con relación a los hallazgos ecográficos hepáticos visualizados en nuestra serie, se describió un parénquima con ecoestructura hepática heterogénea en 11 (15.8%) casos. Un menor número de pacientes 6 (8.5%) presentó un parénquima heterogéneo con bordes hepáticos lobulados y esplenomegalia, hallazgos ecográficos compatibles con cirrosis hepática e hipertensión portal23,24. Si bien la esteatosis está descrita como la manifestación hepática más común en pacientes con FQ con una prevalencia del 25% al 60%18, en nuestra casuística se halló un aumento difuso de la ecogenicidad hepática ocasionada por infiltración grasa del parénquima solo en 4 (5.7%) de los pacientes estudiados.
ConclusiónLa EA es una técnica segura y de bajo costo que permite identificar algún grado de hepatopatía crónica y pancreática mejorando las decisiones en el abordaje y seguimiento de pacientes adultos con FQ.
A diferencia de numerosos estudios realizados en niños con FQ los datos publicados en Latinoamérica referidos a los hallazgos ecográficos en adultos son limitados por lo cual creemos relevante teniendo en consideración el contexto de la creciente sobrevida de estos pacientes la información aportada por nuestro estudio en el análisis de las comorbilidades digestivas en pacientes con FQ.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.