La intolerancia a la lactosa es un padecimiento con elevada prevalencia a nivel mundial principalmente en países hispanoamericanos, asiáticos y africanos. El objetivo de esta revisión narrativa es destacar la importancia del diagnóstico correcto de intolerancia a la lactosa, que evite el autodiagnóstico que conlleva a la eliminación innecesaria de lácteos de la dieta con la privación de nutrimentos que podrían ser esenciales en algunas etapas de la vida. El mecanismo fisiopatogénico de la absorción deficiente de lactosa en el intestino puede ser primario, secundario a otras enteropatías o coexistir con otras enfermedades intestinales cuyos síntomas son parecidos como en el caso del síndrome de intestino irritable, síndrome de sobrecrecimiento bacteriano o enfermedad celiaca entre otros; provocando confusión en el diagnóstico y tratamiento. La intolerancia a la lactosa constituye un conjunto de síntomas atribuidos al consumo de leche y sus derivados y se asume que se debe a la digestión deficiente de este disacárido. Se han validado una amplia gama de pruebas para detectar digestión deficiente como: exámenes en sangre, análisis de mutaciones genéticas, pruebas en aire espirado y recientemente, una en orina, las mismas que se describen en este artículo. Sin embargo, para la evaluación y medición de los síntomas, existen pocos cuestionarios validados, en parte, debido a la heterogeneidad de conceptos y subjetividad de cada uno de los síntomas.
Lactose intolerance is a condition with an elevated prevalence worldwide, especially in Latin American, Asian, and African countries. The aim of the present narrative review was to highlight the importance of accurately diagnosing lactose intolerance to prevent self-diagnosis that results in the unnecessary elimination of milk and dairy products from the diet and the consequent deprivation of nutrients that could be essential at certain stages of life. The pathophysiologic mechanism of deficient lactose absorption in the intestine can be primary, secondary to other enteropathies, or coexistent with other intestinal diseases with similar symptoms, such as irritable bowel syndrome, bacterial overgrowth syndrome, or celiac disease, causing confusion in relation to diagnosis and treatment. Lactose intolerance consists of a set of symptoms attributed to the consumption of milk and dairy products that are assumed to be due to deficient digestion of that disaccharide. A wide range of tests have been validated to detect deficient digestion that include blood tests, genetic mutation analyses, breath tests, and recently, a urine test, all of which are described in the present article. Nevertheless, there are few validated questionnaires for symptom evaluation and measurement, partly due to the heterogeneity of concepts and the subjectivity of each of the symptoms.
La intolerancia a la lactosa (IL) es un padecimiento con alta prevalencia a nivel mundial cuyas manifestaciones clínicas son variadas y similares a las de otras entidades como enfermedad celiaca, síndrome de sobrecrecimiento bacteriano o síndrome de intestino irritable. Los trastornos funcionales digestivos son un grupo de padecimientos que se definen con base a síntomas gastrointestinales en ausencia de alteraciones estructurales y su prevalencia global también es elevada (10-20%), son variables, puesto que dependen de diversos factores como edad, región geográfica, forma en la que se registre, pruebas y criterios que se utilicen para diagnóstico, carga genética, factores alimentarios, ambientales, psicosociales, culturales, económicos, estado de nutrición y la exposición a agentes infecciosos1–3. Velasco- Benítez describe cómo se comportan dichos padecimientos en adolescentes de Argentina y en América Latina de acuerdo con el país, siendo la migraña abdominal, síndrome de intestino irritable, estreñimiento funcional y aerofagia los más frecuentes en Argentina, mientras que en otros países son estreñimiento funcional, síndrome de intestino irritable y dolor abdominal funcional4. En México Remes-Troche et al. estiman que 7.6% (±6.8- 8.5%) de la población general padece algún tipo de trastorno funcional digestivo siendo el síndrome de intestino irritable uno de los más frecuentes5. Similar a otras publicaciones, la frecuencia medida en México es más en mujeres que en hombres, en profesionistas y nivel socioeconómico medio y alto. En la misma publicación, se describe la sobreposición de otros trastornos digestivos entre los cuales pudiera encontrarse la IL; sin embargo, en muchas ocasiones los médicos la ubican como una consecuencia de otras enfermedades de tubo digestivo y en lugar de confirmarla, se asume como parte de algún otro síndrome y simplemente eliminan los lácteos de la dieta.
El objetivo de esta revisión narrativa es destacar la importancia de contar con un diagnóstico certero de IL, en el contexto de los pacientes que sufren de síntomas gastrointestinales de forma crónica, que evite el autodiagnóstico o diagnóstico erróneo que conlleva a la eliminación de lácteos de la dieta y la privación de nutrimentos que podrían ser esenciales en diferentes etapas de la vida.
Prevalencia de intolerancia y digestión deficiente de la lactosaLa IL es un padecimiento frecuente en el mundo. Existen series reportadas en Europa, América, Asia y África que describen una prevalencia variable de 15%, 50%, 70% y 100% respectivamente6-8. Estudios en México encontraron que casi la mitad de la población adulta refería molestias gastrointestinales relacionadas con el consumo de lácteos y de estos, el 70% tuvieron una prueba positiva que sugería digestión deficiente de lactosa8. Sin embargo, uno de los principales inconvenientes de estos estudios fue la falta de estandarización en la cantidad de lactosa administrada para realizar las pruebas, las condiciones en las que se realizan y su interpretación además de la variabilidad genética de la población estudiada. La tabla 1 muestra los resultados de estudios que se han realizado en México.
Prevalencia de digestión deficiente y de síntomas relacionados con la intolerancia a la lactosa en diferentes estudios en México
| Autores, referencia (año) | Tamaño de muestra | Rangos de edad (zona) | Tipo de prueba | Dosis de lactosa y vehículo | Frecuencia de digestión deficiente (%) | Frecuencia de síntomas de IL (%) |
|---|---|---|---|---|---|---|
| Lisker (1974) | 401 | 13- 72 años (rural/urbana) | Tolerancia a la lactosa | 50g de lactosa en agua | 69- 77 | 40- 66 |
| Lisker (1975) | 105 | 23- 68 años (urbana) | Tolerancia a la lactosa | 50g de lactosa en agua | 73 | 61 |
| Lisker (1976) | 161 | 17- 86 años | Tolerancia a la lactosa | 2g lactosa/kg en agua | 36- 77 | NR |
| Lisker (1978) | 150 | 16- 50 años (urbana) | Tolerancia a la lactosa | 12.5 y 37.5g de lactosa en leche o 50g lactosa en agua | 65 | 25- 57 |
| Lisker (1978) | 200 | 15-50 años (urbana) | Tolerancia a la lactosa | 50g lactosa en agua y 250- 1000ml leche | 66 | 4- 52 |
| Cifuentes (1985) | 110 | 6- 15 años (rural) | Tolerancia a la lactosa | 2g lactosa/kg en agua y 50g en agua | 78 | 75 |
| Lisker (1988) | 102 | 50-90 años (NR) | Hidrógeno espirado | 12.5g en agua | 29- 55 | NR |
| Rosado (1994) | 205 | 15- 100 años (rural/ urbana) | Hidrógeno espirado | 18g lactosa (360ml leche) | 32 | 10 |
| Rosado (1994) | 254 | <4 >13 años (rural/ urbana) | Hidrógeno espirado | 12-18g lactosa (240- 360ml leche) | 2- 43 | 3- 31 |
| Moran (2013) | 138 | 3-17 años (NR) | Hidrógeno espirado y/o metano espirado | 12- 18g lactosa (240- 360ml leche) | 21.4- 46.4 | NR |
| Lisker (1980) | 341 | 5-14 años (NR) | NR | 12- 36g lactosa (240ml leche) | NR | 50- 81 |
| Rosado (1984) | 50 | 19- 53 años (urbana) | NR | 18g (360ml leche) | NR | 30 |
NR:no reportado.
Reproducida con permiso del autor (Rosado8).
La IL es un síndrome caracterizado por borborigmos, meteorismo, dolor abdominal, flatulencia, náusea, vómito y ocasionalmente evacuaciones disminuidas en consistencia ocasionados por el consumo de leche y sus derivados9. Los síntomas son inespecíficos y de intensidad variable lo que depende de la cantidad de lactosa ingerida y la susceptibilidad individual. Por lo general se presentan 30 min a 2 h después de la ingestión de lácteos. En algunos casos, como consecuencia de la producción exagerada de metano en lugar de diarrea puede presentarse estreñimiento. Con poca frecuencia la intolerancia puede ocasionar síntomas extraintestinales como cefalea, mareo, pérdida de concentración, dificultad para la memoria a corto plazo, cansancio intenso, dolor muscular y artralgias. Se ha demostrado que la mayoría de las personas, a pesar de tener digestión deficiente de lactosa, toleran sin ningún problema hasta 240ml de leche o alimentos lácteos a intervalos amplios mientras que una tercera parte de enfermos refieren intolerancia a cantidades mínimas6.
Presentar síntomas al consumir lácteos no es sinónimo de digestión deficiente de lactosa ya que otros componentes de la leche, primordialmente proteínas y péptidos derivados de su digestión (caseínas-casomorfinas) pueden causar molestias similares. Por tanto, debe considerarse digestión deficiente solo cuando exista evidencia de incapacidad funcional de lactasa para hidrolizar lactosa y convertirla en glucosa y galactosa.
La lactosa es digerida por la lactasa, una enzima que se encuentra en el borde en cepillo de los enterocitos, con una expresión máxima en yeyuno medio, en donde está sujeta a poca fermentación debido a que la carga bacteriana en ese nivel es baja. La hidrólisis de la lactosa produce glucosa y galactosa que confiere efectos benéficos; por un lado, la glucosa, es una fuente de energía para diversas funciones del enterocito y por el otro, la galactosa, forma parte de glucoproteínas y de glucolípidos. Cuando la lactosa no se digiere de manera completa llega intacta a las partes distales del intestino delgado y colon donde las bacterias la fermentarán provocando los síntomas ya descritos10.
La lactasa es codificada y sintetizada en el enterocito por el gen MCM6 localizado en la región cromosómica 2q21. Se sabe, que al menos 3 variantes polimórficas de nucleótido único (SNP) regulan la expresión del gen. La sustitución de una timina por citosina en posición 13910 (SNP C/T- 13910) se ha encontrado en personas con persistencia de lactasa (PL) mientras que, SNP C/C- 13910 se ha asociado con no persistencia de lactasa (NPL)11,12. Este hallazgo se ha observado en diferentes regiones del mundo y explica la frecuencia variable de intolerancia y digestión deficiente de lactosa informada en distintas publicaciones7. Desde el punto de vista clínico establecer la mutación responsable de la NPL es poco útil. Por otro lado, aún en muestras de mucosa de intestino delgado la PL no puede determinarse con absoluta certeza debido a la distribución irregular de la enzima a lo largo del tubo digestivo por lo que, la NPL se evalúa de forma indirecta con pruebas en aire espirado en donde la digestión deficiente se infiere por la producción de hidrógeno después de una carga de lactosa por vía oral (tabla 2)10.
Conceptos de digestión deficiente e intolerancia a la lactosa
| Relacionados con persistencia de lactasa | Relacionados con la digestión de lactosa | Relacionados con los síntomas de intolerancia |
|---|---|---|
| Persistencia de lactasa: rasgo de dominio genético, asociado a altos niveles de la producción de lactasa en el adulto11. | Digestión deficiente: falta de capacidad para digerir la lactosa por cualquier causa (genética o secundaria)10 | Intolerancia a la lactosa: síntomas gastrointestinales resultantes de la ingestión de lactosa que van desde gases, distensión, cólicos, diarrea y ocasionalmente vómitos10. |
| No persistencia de lactasa: rasgo genético ancestral recesivo asociado a disminución de la cantidad de lactasa intestinal entre el final del destete y la edad adulta11 | Absorción deficiente: ocurre cuando la lactosa no hidrolizada, pasa a través del intestino sin ser absorbida, actuando como un sustrato para las bacterias intestinales en el colon y frecuentemente causando diarrea osmótica7. La malabsorción no es exclusiva de la lactosa debido a que es una alteración de la superficie de absorción, y por tanto, otros nutrimentos pueden no ser absorbidos10 | Autorreporte de intolerancia a la lactosa: creencia de tener intolerancia a la lactosa sin confirmación diagnóstica. La mayor parte de las personas que presentan síntomas por consumo de leche, se autorreportan intolerantes a la lactosa13 |
| Deficiencia de lactasa o hipolactasia: reducción en la lactasa intestinal por cualquier causa, ya sea genética, por enfermedades o lesiones en la mucosa del intestino14 | Sensibilidad a la lactosa:síntomas adversos con y sin intolerancia ni digestión deficiente de lactosa y pueden incluir depresión, dolor de cabeza, fatiga. Los síntomas se traslapan con los del síndrome de intestino irritable13 |
La digestión deficiente de lactosa puede entenderse como una situación normal y esperada en el ciclo de vida en algunas etnias o como un defecto secundario en la producción o expresión de lactasa15. En general, se aceptan tres tipos de NPL.
La primera se debe a mutaciones genéticas que se presenta en la etapa neonatal, en la cual los recién nacidos no tienen capacidad para digerir lactosa presentando diarrea al consumir leche materna, asociada algunas veces con acidosis e hipercalcemia. La hipolactasia primaria es rara, muestra cierta localización geográfica y puede ser total o parcial7,13.
La segunda, la más común alrededor del mundo, se caracteriza por una reducción gradual de la actividad de lactasa. También obedece a una regulación genética, aunque su distribución depende de la mezcla de poblaciones nativas. Se ha documentado que la migración de pobladores del «viejo mundo» generó una distribución diferente entre PL y NPL, siendo más reciente el fenotipo de no persistencia en el «nuevo mundo», el cual puede iniciar entre los 2 y los 5 años, aunque suele no manifestarse antes de los 8 años. En poblaciones con mezcla de PL/ NPL el fenotipo se expresa en edades más tardías como ocurre en México (tabla 1). Desde el punto de vista funcional se ha demostrado que las personas con PL tanto homocigota como heterocigota expresan niveles de lactasa en el borde en cepillo 10 veces más altas que aquellos con NPL15.
El tercer tipo de hipolactasia es la que se conoce como secundaria y se debe a enfermedades gastrointestinales que causan atrofia de vellosidades, es decir, cualquier daño a la mucosa ocasiona deficiencia temporal de lactasa que mejora al resolver el problema inicial pero que, en caso de predisposición genética, podría causar NPL de manera permanente (tabla 3)11,16.
Agentes identificados como modificadores de la lactosa en el intestino delgado
| Tipo de agente | Agentes identificados |
|---|---|
| Bacterianos y virales | Rotavirus, parásitos unicelulares (Giardia)16 |
| Enfermedades | Gastroenteritis, enfermedad celiaca, enfermedad de Crohn, colitis ulcerativa crónica inespecífica, síndrome de intestino irritable, deficiencias inmunológicas, sobrepoblación bacteriana, desnutrición11,16 |
| Mecánicos, físicos, farmacológicos | Exposición a la radiación, cirugías gastrointestinales16Olmesartán, antibióticos11 |
Los síntomas atribuidos a IL se deben a la propiedad osmótica de la lactosa que atrae agua del espacio intravascular a la luz del intestino y que depende por una parte de la velocidad con la que llega el disacárido al intestino que, a su vez refleja la cantidad de lactosa que no fue hidrolizada. Por otro lado, la fermentación bacteriana de lactosa produce hidrógeno, metano, nitrógeno y ácidos grasos de cadena corta que también contribuyen a los síntomas13. Es conveniente recordar que en la intolerancia, la intensidad de los síntomas depende de la cantidad del nutrimento o sustancia alimenticia que se consume. En ese sentido, se ha demostrado, gracias a las pruebas de hidrógeno en aire espirado, que aún las personas con digestión deficiente y por tanto con NPL son capaces de tolerar la cantidad contenida en un vaso de leche entera (12.5g en 250ml)13.
La NPL no parece asociarse a otras enfermedades digestivas, aunque se ha observado que en individuos con síndrome de intestino irritable la probabilidad de presentar IL es mayor a la de la población general2,3,17. Curiosamente, en personas con enfermedad inflamatoria intestinal en quienes se pensaría que la frecuencia de IL sería alta, se ha descrito una prevalencia similar a la población general y, por tanto, no hay una razón para eliminar de la dieta los lácteos en este grupo de enfermos18,19.
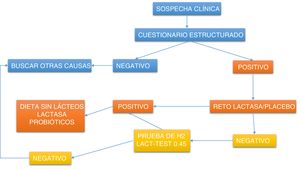
Diagnóstico de intolerancia a la lactosaInicialmente debe realizarse un interrogatorio dirigido para relacionar los síntomas con el consumo de leche y derivados o alimentos elaborados con estos, para posteriormente investigar la coexistencia de digestión deficiente. Una ruta clínica práctica se muestra en la figura 1.
Algoritmo de abordaje diagnóstico para detectar intolerancia a la lactosa.
Lactest:prueba de xilosa en orina que mide de manera indirecta la actividad intestinal de la lactasa, dividiendo un azúcar compuesto de galactosa y xilosa. Reto lactasa:suplementación por 5 días con 10,000 UI de lactasa por comida para evaluar síntomas.
El número de cuestionarios que evalúan síntomas gastrointestinales relacionados con el consumo de lácteos es escaso, de hecho, solo existe uno validado que mide la intensidad de los síntomas utilizando escala visual análoga para calificar la intensidad de diarrea, vómito, cólico, borborigmo y flatulencia o gases. Dicho cuestionario se aplicó antes y después de la prueba de aliento (estándar de referencia) para obtener la validación en una población adulta en España, en donde la prevalencia de IL oscila entre el 36% y 51%. En este grupo se documentó digestión deficiente en un 45%, mostrando sensibilidad de 0.75 y especificidad de 0.67 para un punto de corte de 720.
Otros estudios han explorado los síntomas con preguntas no validadas pero que intencionalmente describen los síntomas relacionados, ya sea de manera simultánea o antes y después de las pruebas de aliento (tabla 4).
Estudios que han evaluado y comparado los síntomas de intolerancia a la lactosa alrededor de las pruebas de hidrógeno espirado
| Autores, referencia (año) | Objetivo | Población y tamaño de muestra | Diseño del estudio | Dimensiones evaluadas | Resultados | Observaciones |
|---|---|---|---|---|---|---|
| Casellas et al.17 (2010) | Determinar si los síntomas que atribuyen usualmente los pacientes a la intolerancia a lactosa son comparables a los síntomas provocados por las pruebas de aliento y si dichos síntomas se relacionan con la capacidad de absorción de lactosa. | 353 Adultos | Cohorte prospectiva | Presencia de síntomas preprueba (en casa) y durante la prueba | Existe sobrepercepción de IL con el consumo de alimentos en casa, comparativamente a cuando se hace durante las pruebas de aliento. Los síntomas cotidianos de IL están poco relacionados a la malabsorción. | La anamnesis convencional puede ser no fidedigna para establecer el diagnóstico de IL |
| Jellema et al.18 (2010) | Resumir la evidencia disponible en el diagnóstico de síntomas gastrointestinales y el autorreporte de intolerancia a la lactosa y la relación entre la malabsorción y la intolerancia a la lactosa | 4539 Adultos derivados de 26 estudios originales | Revisión de la literatura | Presencia de síntomas preprueba, durante la prueba y posprueba de hidrógeno espirado (diarrea, dolor abdominal, distensión, flatulencia y autorreporte de IL) | La evaluación del diagnóstico de los síntomas es altamente variable ya que tanto en malabsorbedores como en absorbedores se presentan los síntomas durante las pruebas. | Urge una definición y estandarización del concepto entre los clínicos de IL |
| Argüelles et al.21 (2015) | Analizar el conocimiento y manejo de la intolerancia a la lactosa en los médicos generales. | 456 médicos generales. | Transversal (encuesta) | Identificación de lácteos y medicinas con contenido de lactosa, poco tolerados.Presencia de síntomas relacionados con la intolerancia a la lactosa (diarrea aguda, flatulencia/distensión, dolor abdominal, constipación, vómito. | Los médicos consideran que la IL es un padecimiento menor y tienden a confundir los síntomas con los del SII. | Los médicos reconocen que las recomendaciones dietéticas son el primer acercamiento terapéutico.Los médicos en general, requieren de mayor sensibilización del tema. |
| Casellas et al.22 (2016) | Determinar el impacto del autorreporte de intolerancia a la lactosa o la medición de la malabsorción, en la salud y la calidad de vida. | 580 adultos con pruebas de hidrógeno espirado que los clasificó como: absorbedores vs. no absorbedores y tolerantes vs. intolerantes. | Transversal | Presencia de síntomas durante el consumo de alimentos lácteos en su dieta habitual. | El 56% se considera IL y esa percepción les hace limitar el consumo de lácteos. La autopercepción de IL se asocia con baja calidad de vida. La malabsorción medida con las pruebas de aliento, no hace que los individuos eviten los lácteos; la calidad de vida en estos, también es baja. | La autopercepción afecta más la decisión de no tomar lácteos que la medición objetiva de la malabsorción. Sin embargo, ambas disminuyen la calidad de vida. |
| Dainese et al.23(2014) | Determinar en un grupo de pacientes con SII si su percepción de IL está condicionada por otros factores alternos a la malabsorción. | 51 adultos con SII. | Cohorte prospectiva | Presencia de síntomas durante las pruebas de hidrógeno espirado.Autopercepción de IL | Los individuos con síntomas severos de intestino irritable, experimentaron síntomas de IL y mayor puntuación de ansiedad, depresión y fatiga. | En individuos con SII, la capacidad de absorción y la severidad del síndrome, así como el estado psicológico o alguna reacción adversa a la leche, pueden ser potenciales cofactores que involucren la percepción de la tolerancia |
IL:intolerancia a la lactosa; SII:síndrome de intestino irritable.
Se dividen en métodos invasivos y no invasivos24. Dentro de los no invasivos se encuentran las pruebas genéticas, medición de hidrógeno en aire espirado (considerada actualmente como la prueba de elección)25,26, curva de glucemia27 y la de 4-galactosil-xilosa. Como prueba invasiva está la determinación de la actividad de la lactasa en fragmentos de mucosa intestinal obtenidos a través de biopsia (estándar de oro para el diagnóstico de hipolactasia). Actualmente no existe una estandarización de las pruebas no invasivas para determinar absorción deficiente, lo cual lleva a falsos negativos (10%) y falsos positivos (20%)28-31 y por lo cual es necesario establecer una dosis de lactosa que semeje condiciones fisiológicas para evaluar de manera certera su hidrólisis.
Debido a su fácil aplicación la titulación de hidrógeno en aire espirado es el método con más aceptación a nivel mundial, sin embargo, consume tiempo (alrededor de 5 h) y expone a las personas a una carga de lactosa que puede desencadenar molestias. Esta prueba tiene una sensibilidad y especificidad del 77.5% y 97.6% respectivamente32. Su principio es simple: la lactosa que no es hidrolizada permanece en la luz del intestino hasta que llega al colon en donde ocurre su fermentación anaeróbica por acción de la microbiota intestinal. Los productos de fermentación son ácidos grasos de cadena corta (metano, ácido acético, ácido propiónico y ácido butírico) e hidrógeno. Tanto el metano como el hidrógeno se absorben y por vía sanguínea llegan a los pulmones donde son eliminados con la espiración donde pueden titularse29.
Otro de los métodos no invasivos es el LacTEST®, prueba que utiliza como sustrato 4-galactosil-xilosa cuya estructura semeja a la molécula de lactosa y que evalúa la actividad de lactasa a lo largo de todo el intestino, es decir, es una evaluación in vivo de la actividad total de lactasa que no presenta limitaciones ni riesgo para el paciente33–37. A diferencia de la prueba de aliento, no presenta las limitaciones asociadas al tránsito intestinal, disbiosis, uso previo de antibióticos o enfermedades pulmonares crónicas. Su aplicación tiene la ventaja de ser más fácil para el médico y el paciente ya que no requiere de mediciones secuenciales y es posible su determinación en una sola medición, es económicamente accesible y sencilla ya que se requiere solo un colorímetro o un espectrofotómetro simple. La sensibilidad, especificidad y valores predictivos son 93.5, 91.8, 92.7 y 92.7% respectivamente, con un área bajo la curva de 0.93, valores que se obtuvieron de una muestra de 205 individuos que se autodefinieron con intolerancia a la lactosa33. Su desventaja principal es que no mide los síntomas y por tanto es inútil para evaluar intolerancia.
El diagnóstico más acertado para corroborar la IL es la prueba de reto, es decir, la presencia secundaria de síntomas inmediatamente después del consumo de lácteos, pero aún existe controversia entre la cantidad que se consume y el mejor método para identificar tanto la deficiencia de lactasa como los síntomas asociados; porque la falta de lactasa no necesariamente produce síntomas ni la presencia de síntomas es sinónimo de intolerancia a la lactosa.
Importancia de un diagnóstico certeroLa eliminación de lácteos de la dieta no parece ejercer efectos deletéreos en la salud, incluso se ha propuesto como un grupo de alimentos no indispensables para la vida adulta. Sin embargo, varios análisis la han asociado con enfermedades como el cáncer o enfermedades autoinmunes. Un metaanálisis constituido por 29 estudios de cohorte con 938,465 participantes, que tuvo por objetivo evaluar el consumo de leche y sus derivados y el riesgo de mortalidad, enfermedad coronaria y enfermedad cardiovascular, concluyó que no hubo asociación entre estas variables; sin embargo, se presentaron asociaciones inversas entre el consumo de lácteos fermentados (20g/día) con la mortalidad (RR=0.98 IC95% 0.97- 0.99 I2=94.4%) y el riesgo de enfermedad cardiovascular (RR=0.98 IC95% 0.97- 0.99 I2=87.5%). Un análisis subsecuente del mismo estudio indicó que el consumo por cada 10g de queso mostró 2% de menor riesgo para enfermedad cardiovascular (RR=0.98 IC95% 0.95- 1.00 I2=82.6%)38. En otro metaanálisis, integrado por 22 estudios se encontró una asociación inversa entre el consumo de lácteos, riesgo total de enfermedad cardiovascular (RR=0.88 IC 95% 0.81- 0.96) y de infarto (RR=0.87 IC95% 9.77- 0.99). Este estudio permitió conocer que el riesgo de infarto disminuye por el consumo de lácteos bajos en grasa (RR=0.93 IC95% 0.88- 0.99) y queso (RR=0.91 IC95% 0.84- 0.98), así mismo, encontraron que el riesgo de enfermedad coronaria disminuye por el consumo de queso (RR=0.84 IC95% 0.71- 1.00). En este estudio se concluye que los lácteos proveen un efecto benéfico en las enfermedades cardiovasculares y en particular los lácteos descremados y el queso protegen contra la incidencia de enfermedad coronaria e infarto39. Una revisión sistemática mostró que el consumo habitual de lácteos está inversamente asociado a la incidencia (RR=0.85 IC95% 0.73- 0.98) y prevalencia (RR=0.88 IC95% 0.82- 0.95) de síndrome metabólico con el incremento de una porción de cualquiera de ellos al día40. Finalmente, un estudio de tipo prospectivo en una cohorte de 1,573 mujeres coreanas en periodo posmenopaúsico en el que se evaluó el consumo de lácteos, leche y yogur y la incidencia de osteoporosis, encontró que aquellas mujeres que tuvieron consumo alto de estos lácteos, tuvieron menor riesgo de osteoporosis en el hueso radial (HR=0.52 IC95% 0.33- 0.80, p=0.0027) comparadas con las que no consumieron. De forma similar el alto consumo de leche y yogur (> 5 veces a la semana) tuvo un efecto protector para la osteoporosis de radio, pero esta relación no fue consistente con las mediciones en la tibia41.
Se conoce poco respecto a las modificaciones en la microbiota por consumo de lácteos, los estudios más recientes indican que se presentan modificaciones en su composición y en diversidad alfa si se adiciona o suprime el consumo de estos alimentos. Los estudios de individuos sanos, que usaron leche fermentada o yogur con o sin lactobacilos adicionados, no asociaron mecanismos patogénicos con desenlaces como distensión abdominal por producción exagerada de gas, aunque sí observaron síntomas en personas expuestas a estrés psicológico o incluso a promover el equilibrio en la microbiota en dietas altas en carnes42–45.
Li et al. evaluaron el efecto de la suplementación con leche sobre la microbiota intestinal y marcadores de riesgo cardiovascular en individuos con y sin digestión deficiente de lactosa. No encontraron diferencias en la producción de ácidos grasos de cadena corta ni en los marcadores de riesgo cardiovascular entre los grupos aunque sí modificaciones en la microbiota en aquellos con digestión deficiente (p<0.01)46; mientras que un elegante ensayo clínico aleatorizado hecho por Odamari et al.47, mostró que la suplementación de un probiótico a un lácteo fermentado (yogur con Bifidobacterium longum) en una dieta basada en carnes rojas, permite a individuos sanos mantener una composición normal de la microbiota.
La pobre concordancia entre los síntomas sugestivos de IL y digestión deficiente así como el hecho de que muchas molestias se compartan con otros padecimientos gastrointestinales (sobrecrecimiento bacteriano, enfermedad celiaca, enteropatía sensible a gluten, síndrome de intestino irritable), el efecto prebiótico de la lactosa, las posibles implicaciones sobre la microbiota, el papel de los lácteos en la salud ósea, gastrointestinal y la salud en general, constituyen una buena razón para promover y confirmar el diagnóstico de digestión deficiente de la lactosa.
Pero más allá de los efectos biológicos de la IL, establecer el diagnóstico preciso permite empoderar al paciente, dándole información que le permita tomar decisiones sobre su alimentación que repercutirán en su calidad de vida. Permitirá, por otro lado, modificar su dieta tomando en cuenta sus gustos y preferencias, pero sobre todo, evitar la eliminación de alimentos sin sustento. Contamos en el mercado mexicano con alimentos modificados en contenido de lactosa, lo cual es una gran ventaja para las personas que toleran al menos de 12g de lactosa por día o suplementos con lactasa que se administran a dosis de 10,000 UI por cada ración de lácteos. En los últimos tiempos, se están realizando estudios usando lactobacilos y otros probióticos con el fin de mejorar la digestión de moléculas como la lactasa y aunque parecen prometedores, todavía no hay resultados concluyentes sobre la cepa, dosis, seguridad y eficacia14.
ConclusionesLa intolerancia y la digestión deficiente de lactosa son frecuentes en México. Es un padecimiento sobrediagnosticado, con síntomas que fácilmente se confunden con otros problemas de tubo digestivo y que con frecuencia conlleva una recomendación poco fundamentada de evitar el consumo de leche o derivados. En el momento actual contamos con métodos de diagnóstico fáciles, baratos y no invasivos, así como productos deslactosados o sin lactosa, también con suplementos enzimáticos a base de lactasa que harán más fácil la vida de las personas que gustan consumir lácteos y derivados pero que han consultado a un especialista eventualmente por problemas digestivos.
Responsabilidades éticasEste documento no requiere de autorización de comités de ética e investigación ya que se constituye de revisión de la literatura que recoge evidencia de estudios tanto observacionales, experimentales, revisiones sistemáticas, metaanálisis, así como de consensos que conforman una revisión narrativa. Tampoco viola ninguna normatividad científica nacional ni internacional vigente.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesM en C. Sophia E Martínez-Vázquez ha sido conferencista para Ferrer, Carnot, Asofarma, Takeda. Asesora científica para Asofarma y Liomont.
El Dr. José Ramón Noguiera-de Rojas ha sido conferencista de Asofarma y Astra Zeneca.
El Dr. José María Remes-Troche es miembro del consejo asesor de Asofarma y Takeda. Ha recibido apoyos para la investigación de Sanfer y Senosian. Ha sido ponente para Asofarma, Alfasigma, Takeda, Sanfer, Johnson & Johnson y Endomédica.
El Dr. Enrique Coss-Adame es miembro asesor de Asofarma, Takeda, Ferrer y Abbott. Es conferencista para Laboratorios Takeda, Asofarma, Ferrer, Carnot, Grunenthal, Alfa- Sigma y Endomédica. Ha recibido apoyos para la investigación de Alfa- Sigma y Bustard S.A. de C.V.
El Dr. Rodolfo Rivas- Ruíz ha sido conferencista para Abbott, Sanofi y Roche.
El Dr. Luis F. Uscanga-Domínguez es miembro del consejo asesor de Asofarma, conferencista de Asofarma y Astra Zeneca.