La pancreatectomía distal es un procedimiento frecuente y la fístula postoperatoria, su complicación más frecuente tiene una incidencia del 30 al 60%. El objetivo de este trabajo fue estudiar el papel de la relación neutrófilos/linfocitos y la relación linfocitos/plaquetas como indicadores de respuesta inflamatoria en el escenario de la fístula pancreática.
MétodosEste trabajo es un estudio observacional retrospectivo que incluye pacientes que fueron sometidos a pancreatectomía distal. El diagnóstico de fístula pancreática postoperatoria se estableció según la definición del Grupo Internacional de Estudio de Fístula Pancreática (ISGPF, por sus siglas en inglés). La asociación entre fístula pancreática posoperatoria, la relación neutrófilos/linfocitos y la relación plaquetas/linfocitos fue determinada en la evaluación posoperatoria. Se utilizó el software SPSS® v.21 para el análisis estadístico y un valor de p inferior a 0.05 se consideró estadísticamente significativo.
ResultadosUn total de 12 pacientes (27.2%) desarrollaron fístula pancreática postoperatoria (POPF, por sus siglas en inglés) grado B o C. Se construyeron curvas ROC y se estableció un umbral de 8.3 (VPP: 0.40; VPN: 0.86) para la relación neutrófilos/linfocitos con un área bajo la curva de 0.71, sensibilidad de 0.81 y especificidad de 0.62; por su parte, para la relación plaquetas/linfocitos se estableció un umbral de 33.2 (VPP: 0.50; VPN: 0.84), con un área bajo la curva de 0.72, sensibilidad de 0.72 y especificidad de 0.71.
ConclusiónLa relación neutrófilos/linfocitos y la relación plaquetas/linfocitos son marcadores serológicos que pueden ayudar a identificar a pacientes que presentarán fístula pancreática postoperatoria grado B o C, y así ayudar a enfocar la atención y los recursos de manera oportuna.
Distal pancreatectomy is a frequent procedure and postoperative fistula, its most common complication, has an incidence of 30 to 60%. The aim of the present work was to study the role of the neutrophil-to-lymphocyte ratio and the platelet-to-lymphocyte ratio, as indicators of inflammatory response in the setting of pancreatic fistula.
MethodsA retrospective observational study was conducted on patients that underwent distal pancreatectomy. The diagnosis of postoperative pancreatic fistula was made according to the definition proposed by the International Study Group on Pancreatic Fistula. The relation of postoperative pancreatic fistula to the neutrophil-to-lymphocyte ratio and the platelet-to-lymphocyte ratio was determined in the postoperative evaluation. SPSS v.21 software was utilized for the statistical analysis and a P<.05 was considered statistically significant.
ResultsA total of 12 patients (27.2%) developed grade B or grade C postoperative pancreatic fistula. ROC curves were constructed and a threshold of 8.3 (PPV 0.40, NPV 0.86) was established for the neutrophil-to-lymphocyte ratio, with an area under the curve of 0.71, sensitivity of 0.81, and specificity of 0.62, whereas a threshold of 33.2 (PPV 0.50, NPV 0.84) was established for the platelet-to-lymphocyte ratio, with an area under the curve of 0.72, sensitivity of 0.72, and specificity of 0.71.
ConclusionThe neutrophil-to-lymphocyte ratio and the platelet-to-lymphocyte ratio are serologic markers that can aid in identifying patients that will present with grade B or grade C postoperative pancreatic fistula, thus helping to provide an opportune focus on care and resources.
La pancreatectomía distal (PD) es un procedimiento realizado comúnmente para tratar lesiones localizadas en el cuerpo o la cola del páncreas. Aunque la tasa de mortalidad en pacientes sometidos a PD ha disminuido en años recientes (reportada entre el 0 y el 5% en centros de gran volumen)1, la tasa de morbilidad permanece elevada (18 al 65%)2,3. La fístula pancreática postoperatoria (POPF, por sus siglas en inglés) es la complicación más común posterior a la PD, con una incidencia del 30-60%4, según la definición propuesta por el Grupo Internacional de Estudio de Fístula Pancreática (ISGPF, por sus siglas en inglés)5, la cual describe una salida de líquido del drenaje con un contenido de amilasa 3 veces mayor al valor normal de amilasa en suero al día postoperatorio (DPO) 3 o después del mismo. El ISGPF también dividió a la POPF en 3 grados: el grado A es una fístula asintomática y el escenario más común en el 31% de los pacientes, mientras que las fístulas grados B y C son entidades clínicamente significativas que requieren intervención terapéutica, y pueden estar asociadas con complicaciones incluso más severas, como abscesos intraabdominales, sepsis, seudoaneurisma, hemorragia o la muerte1,6,7.
Los factores de riesgo para POPF posterior a PD no han sido estudiadas ampliamente, en comparación con la POPF posterior a pancreaticoduodenectomía. Sin embargo, una serie de factores quirúrgicos y no quirúrgicos han sido descritos como predictores de POPF en pacientes de PD, incluidos la edad avanzada, un IMC elevado, antecedentes diabéticos, páncreas blando, transfusión sanguínea, pérdida sanguínea intraoperatoria elevada, tiempo operatorio prolongado, textura pancreática, tipos de cierre del muñón, esplenectomía, resección multiorgánica y linfadenectomía extendida2,8–12.
A la vez, la inflamación sistémica es un componente principal en el desarrollo de complicaciones intraabdominales. Los conteos hematológicos de células son los marcadores bioquímicos más comunes para identificar el grado de inflamación dentro de la cavidad abdominal, específicamente neutrofilia y linfopenia13. En años recientes, la relación neutrófilo/linfocito (RNL) y la relación plaqueta/linfocito (RPL) han sido utilizadas como indicadores de la respuesta inflamatoria para diferentes tipos de cáncer14–18 y otras enfermedades inflamatorias intraabdominales. Sin embargo, el uso de estos biomarcadores para complicaciones postoperatorias a PD, especialmente fístula pancreática, no está bien documentado.
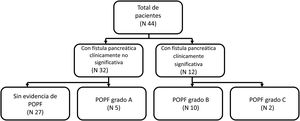
MétodosDiseño del estudioEl presente trabajo es un estudio observacional retrospectivo con pacientes que se sometieron a una PD dentro del periodo de 2014-2018. Se revisaron registros electrónicos y físicos para obtener las características clínicas y patológicas de cada paciente. La colocación de un drenaje de succión cerrado en el sitio quirúrgico, al momento de la cirugía, es una práctica de rutina en nuestro hospital. Definimos la POPF según la definición del ISGPF: salida de drenaje con un contenido de amilasa >3 veces el valor superior normal de amilasa en suero, al DPO 3 o posterior al mismo. Una vez que la POPF fue documentada, se estableció el grado (A, B o C) utilizando la clasificación del ISGPF como referencia. El grado A fue definido como una POPF que no requiere de drenaje percutáneo o endoscópico, angiografía o antibióticos; el grado B fue definido como una POPF que requiere de drenaje percutáneo o endoscópico, angiografía o antibióticos; y el grado C fue definido como una POPF que requiere cirugía o estuvo asociada con la muerte. Los pacientes fueron asignados al grupo con POPF clínicamente no significativa (sin evidencia de POPF o grado A) o al grupo con POPF clínicamente significativa (grados B o C) (fig. 1).
Criterios de inclusión y exclusiónLos pacientes fueron considerados elegibles para el estudio si se sometieron a PD durante el periodo de estudio y tuvieron un seguimiento postoperatorio mínimo de 30 días. Los criterios de exclusión incluyeron PD con resección multiorgánica, pacientes con enfermedades hematológicas concomitantes, uso crónico de esteroides, e información incompleta.
Características clínicas/quirúrgicas y marcador sanguíneoLas características documentadas fueron sexo, edad, IMC, comorbilidades, abordaje quirúrgico, presencia de esplenectomía, clasificación ASA, pérdida sanguínea intraoperatoria, duración de estancia hospitalaria (DEH), tiempo operatorio, presencia de POPF, y otras complicaciones postoperatorias. Los niveles de conteo de células fueron registrados los días postoperatorios 1, 2 y 3, e incluyeron hemoglobina, plaquetas, leucocitos, neutrófilos, linfocitos, RNL y RPL.
El objetivo principal del presente estudio fue evaluar la asociación entre POPF y los diferentes marcadores bioquímicos, como los conteos celulares hematológicos, la RNL y la RPL, a los días postoperatorios 1, 2 y 3.
Análisis estadísticoSe incluyó media y desviación estándar para las variables cuantitativas, y frecuencia y proporciones para las variables cualitativas. Se utilizó la prueba de Chi-cuadrado para analizar las variables categóricas. Para todas las variables cuantitativas se realizó la prueba de normalidad de Kolmogorov-Smirnov y las pruebas t de Student o Mann-Whitney se aplicaron para las muestras independientes, según la distribución de datos de las variables. Las pruebas de Wilcoxon o de Friedman fueron utilizadas para las muestras relacionadas. La precisión diagnóstica y el AUC fueron cuantificados utilizando el análisis de la curva ROC, y el índice Youden fue utilizado para estimar los mejores valores de corte. El análisis estadístico fue realizado utilizando el software IBM® SPSS® Statistics versión 21. Un valor de p≤0.05 fue considerado estadísticamente significativo para la prueba de hipótesis de 2 colas.
Consideraciones éticasInvestigación que involucre participantes humanos y/o animales: El presente artículo no contiene estudios realizados sobre participantes humanos o animales por parte de ninguno de los autores.
El presente trabajo fue revisado y aprobado por el comité de investigación y el comité de ética del Instituto Nacional de Ciencias Médicas y Nutrición «Salvador Zubirán».
Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes. Los autores declaran que el consentimiento informado no fue necesario para esta investigación.
ResultadosCaracterísticas de la población y curso clínicoDentro del marco temporal de 2014 a 2018, un total de 44 pacientes se sometieron a PD. Once (25%) de ellos fueron varones y 33 (75%) mujeres. La edad promedio de los pacientes ±DE fue 44.3±14.6 años. La indicación más frecuente para PD fue tumor neuroendocrino en 18 pacientes (40.9%), seguida de cistoadenoma mucinoso en 9 pacientes (20.5%). Otras indicaciones incluyeron cistoadenoma seroso, pancreatitis crónica, neoplasia sólida seudopapilar, neoplasia papilar mucinosa intraductal y seudoquiste. De los 44 pacientes, 17 (38.6%) desarrollaron POPF; 11.5% fueron grado A, 22.7% grado B y 4.5% grado C. Solo se presentó una muerte en la totalidad de la cohorte y fue secundaria a hemorragia temprana postoperatoria que no estuvo relacionada a POPF. Las tablas 1 y 2 resumen las indicaciones para cirugía y las características quirúrgicas de los pacientes que se sometieron a PD.
Características generales y curso clínico de los pacientes sometidos a pancreatectomía distal
| Variable | Total de pacientes | Con POPF clínicamente significativa | Con POPF clínicamente no significativa | Valor de p |
|---|---|---|---|---|
| Total | 44 (100) | 12 (27.2) | 32 (72.7) | N/A |
| Sexo | ||||
| Varones, n (%) | 11 (25) | 3 (25) | 8 (25) | 0.66 |
| Mujeres, n (%) | 33 (75) | 9 (75) | 24 (75) | 0.64 |
| Edad media, (DE) (años) | 44.3 (14.6) | 43.0 (13.0) | 44.8 (15.4) | 0.72 |
| IMC medio, (DE) (kg/m2) | 26.6 (4.7) | 28.1 (4.9) | 26.1 (4.6) | 0.22 |
| Comorbilidades | ||||
| Tabaquismo, n (%) | 6 (13.6) | 2 (16.6) | 4 (12.5) | 0.52 |
| DM2, n (%) | 5 (11.4) | 1 (8.3) | 4 (12.5) | 0.58 |
| Hipertensión, n (%) | 5 (11.4) | 2 (16.6) | 3 (9.3) | 0.41 |
| Reflujo gastroesofágico, n (%) | 2 (4.5) | 0 (0) | 2 (6.2) | 0.52 |
| Migraña, n (%) | 2 (4.5) | 0 (0) | 2 (6.2) | 0.52 |
| Hipotiroidismo, n (%) | 5 (11.4) | 1 (8.3) | 4 (12.5) | 0.58 |
| NEM1, n (%) | 4 (9.1) | 1 (8.3) | 3 (9.3) | 0.70 |
| Abordaje quirúrgico | ||||
| Abierta, n (%) | 22 (50) | 7 (58.3) | 15 (46.8) | 0.36 |
| Laparoscópica, n (%) | 22 (50) | 5 (41.6) | 17 (53.1) | 0.36 |
| Esplenectomía, n (%) | 40 (90.9) | 12 (100) | 28 (87.5) | 0.26 |
| Clasificación ASA | ||||
| 1, n (%) | 7 (15.9) | 2 (16.6) | 5 (15.6) | 0.62 |
| 2, n (%) | 20 (45.5) | 4 (33.3) | 16 (50) | 0.26 |
| 3, n (%) | 17 (38.6) | 6 (50) | 11 (34.3) | 0.27 |
| Pérdida sanguínea media, (DE) (ml) | 540.2 (802.3) | 805.0 (135.5) | 440.9 (451.2) | 0.38 |
| DEH media, (DE) (días) | 12.2 (9.6) | 22.9 (8.7) | 8.2 (6.4) | 0.00* |
| Tiempo quirúrgico medio, (DE) (min) | 205.9 (76.8) | 206.6 (67.0) | 205.6 (81.1) | 0.92 |
| Fístula pancreática postoperatoria, n (%) | 17 (38.6) | 12 (100) | 5 (15.6) | 0.00* |
| Grado A, n (%) | 5 (11.5) | 0 (0) | 5 (15.6) | 0.18 |
| Grado B, n (%) | 10 (22.7) | 10 (83.3) | 0 (0) | 0.00 |
| Grado C, n (%) | 2 (4.5) | 2 (16.6) | 0 (0) | 0.07 |
| Sepsis abdominal, n (%) | 14 (31.8) | 12 (100) | 2 (6.2) | 0.00* |
| Neumonía, n (%) | 6 (13.6) | 4 (33.3) | 2 (6.2) | 0.42 |
| Tromboembolismo pulmonar, n (%) | 2 (4.5) | 1 (8.3) | 1 (3.1) | 0.47 |
| Infección de conducto urinario, n (%) | 4 (9.1) | 0 (0) | 4 (12.5) | 0.26 |
| Hemorragia, n (%) | 1 (2.3) | 0 (0) | 1 (3.1) | 0.72 |
ASA: Asociación Americana de Anestesiólogos; DE: desviación estándar; DEH: duración de estancia hospitalaria; DM2: diabetes mellitus tipo 2; IMC: índice de masa corporal; NEM1: neoplasia endócrina múltiple tipo 1; POPF: fistula pancreática postoperatoria.
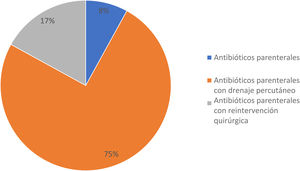
Un total de 12 pacientes (27.2%) desarrollaron POPF clínicamente significativa; 3 de ellos (25%) fueron hombres y 9 (75%) fueron mujeres, con una edad media±DE de 43.0±13.0 años. En la comparación de los 2 grupos de estudio, no existieron diferencias respecto al sexo, edad, IMC, comorbilidades y pruebas de laboratorio preoperatorias; respecto a las características quirúrgicas y postoperatorias, existió una diferencia estadísticamente significativa en la DEH: los pacientes con POPF clínicamente significativa presentaron una media de 22.9±8.7 días y los pacientes con POPF no significativa clínicamente presentaron una media de 8.2±6.4 días (p<0.001; prueba de Mann-Whitney). El tratamiento para los pacientes con POPF clínicamente significativa incluyó antibióticos parenterales en un paciente (8.3%), antibióticos parenterales con drenaje percutáneo en 9 pacientes (75%), y antibióticos parenterales con reintervención quirúrgica debida a sepsis abdominal en 2 pacientes (16.6%) (fig. 2). De manera importante, 5 casos de PD (41.6%) fueron realizadas de manera laparoscópica, mientras que 7 casos (58.3%) fueron procedimientos abiertos, con una media de tiempo quirúrgico de 206.6±67.0min (rango: 140-350min) y una pérdida sanguínea media de 805.0±135.5ml. Todos los procedimientos incluyeron esplenectomía durante la cirugía y en ningún procedimiento se requirió transfusión sanguínea (tabla 2). En el grupo de POPF clínicamente significativa, se presentaron 2 casos de sepsis abdominal debida a la acumulación de líquido infectado y amilasa menor al nivel del criterio para POPF. No existió diferencia entre los grupos respecto a neumonía, tromboembolismo pulmonar, infección de conducto urinario y hemorragia.
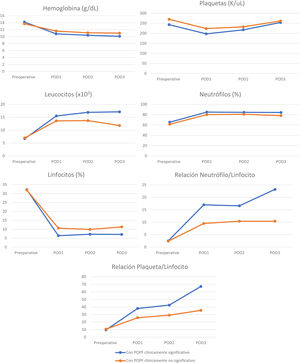
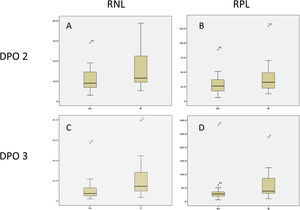
Niveles de marcadores sanguíneos perioperatoriosNo existió una diferencia significativa entre los niveles preoperatorios y postoperatorios de hemoglobina, plaquetas, leucocitos, neutrófilos y linfocitos, en pacientes sin fístula pancreática clínicamente significativa a los DPO 1, 2 y 3. Sin embargo, la RNL y la RPL se incrementaron significativamente al comparar los 2 grupos (tabla 3). El conteo celular normalmente se incrementa posterior al trauma quirúrgico y se espera que se normalice después del día 3, pero existió una diferencia evidente en RNL y RPL entre los pacientes con POPF clínicamente significativa y no significativa (figs. 3 y 4).
Conteo celular a los DPO 1, 2 y 3 de los pacientes sometidos a pancreatectomía distal, con y sin POPF
| Variable | Totalidad de pacientes | Con POPF clínicamente significativa | Con POPF clínicamente no significativa | Valor de p |
|---|---|---|---|---|
| Hemoglobina (g/dl), (media) (DE) | ||||
| Preoperatoria | 13.8 (1.6) | 14.2 (1.3) | 13.7 (1.7) | 0.51 |
| DPO 1 | 11.5 (1.4) | 10.8 (1.3) | 11.6 (1.4) | 0.90 |
| DPO 2 | 11.0 (1.2) | 10.4 (0.8) | 11.1 (1.2) | 0.46 |
| DPO 3 | 10.7 (1.1) | 10.1 (0.7) | 11.0 (1.1) | 0.02 |
| Plaquetas (k/μl), (media) (DE) | ||||
| Preoperatoria | 265.4 (83.8) | 243.1 (52.9) | 270.1 (90.8) | 0.16 |
| DPO 1 | 216.0 (62.8) | 197.5 (53.1) | 223.7 (66.0) | 0.72 |
| DPO 2 | 229.1 (60.2) | 217.3 (45.2) | 232.4 (65.8) | 0.23 |
| DPO 3 | 260.9 (80.4) | 254.0 (63.5) | 261.5 (87.0) | 0.32 |
| Leucocitos (×103), (media) (DE) | ||||
| Preoperatoria | 7.0 (1.9) | 6.7 (1.7) | 7.0 (2.0) | 0.52 |
| DPO 1 | 14.0 (5.4) | 15.5 (5.8) | 13.6 (5.3) | 0.76 |
| DPO 2 | 14.6 (5.1) | 16.9 (6.0) | 13.7 (4.6) | 0.27 |
| DPO 3 | 13.3 (6.1) | 17.1 (8.8) | 11.8 (4.3) | 0.05 |
| Neutrófilos (%), (media) (DE) | ||||
| Preoperatorio | 62.5 (8.6) | 65.4 (7.1) | 61.4 (8.7) | 0.64 |
| DPO 1 | 81.2 (5.7) | 85.0 (3.8) | 80.1 (5.7) | 0.36 |
| DPO 2 | 81.6 (6.0) | 84.5 (4.8) | 80.8 (6.1) | 0.42 |
| DPO 3 | 79.9 (8.0) | 84.3 (7.7) | 78.2 (7.7) | 0.68 |
| Linfocitos (%), (media) (DE) | ||||
| Preoperatorio | 31.8 (15.0) | 32.2 (19.1) | 32.0 (14.0) | 0.48 |
| DPO 1 | 9.6 (4.2) | 6.4 (2.8) | 10.6 (4.1) | 0.19 |
| DPO 2 | 9.2 (4.7) | 7.2 (3.9) | 9.9 (4.9) | 0.67 |
| DPO 3 | 10.2 (5.9) | 7.1 (5.6) | 11.3 (5.8) | 0.68 |
| Relación neutrófilo/linfocito, (media) (DE) | ||||
| Preoperatorio | 2.4 (1.5) | 2.5 (1.2) | 2.4 (1.7) | 0.69 |
| DPO 1 | 11.3 (8.0) | 17.0 (10.7) | 9.5 (6.0) | 0.02* |
| DPO 2 | 11.9 (7.7) | 16.6 (11.3) | 10.4 (5.7) | 0.00* |
| DPO 3 | 13.6 (15.0) | 23.2 (22.4) | 10.4 (10.1) | 0.00* |
| Relación plaqueta/linfocito, (media) (DE) | ||||
| Preoperatorio | 10.5 (7.4) | 9.6 (4.2) | 10.6 (8.2) | 0.23 |
| DPO 1 | 28.6 (18.6) | 38.0 (23.8) | 25.7 (15.7) | 0.26 |
| DPO 2 | 32.3 (22.0) | 42.4 (33.3) | 29.1 (16.3) | 0.03* |
| DPO 3 | 43.5 (53.3) | 67.2 (65.7) | 35.5 (47.6) | 0.03* |
DE: desviación estándar; DPO: día postoperatorio; POPF: fistula pancreática postoperatoria.
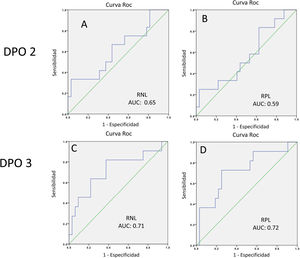
Respecto a la POPF clínicamente significativa, después del análisis de la curva ROC, se estableció un umbral de 8.3 (VPP: 40%; VPN: 86%) para la RNL al DPO 3, con un área bajo la curva de 0.71, sensibilidad del 81% y especificidad del 62%, mientras que el umbral para la RPL al DPO 3 fue 33.2 (VPP: 50%; VPN: 84%), con un área bajo la curva de 0.72, sensibilidad del 72% y especificidad del 71% (tabla 4 y fig. 5).
Área bajo la curva, Índice de Youden, valores de corte, sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de la RNL y la RPL en DPO 2 y 3, para POPF clínicamente significativa
| Variable | AUC | Índice de Youden | Punto de corte | Sensibilidad | Especificidad | VPP | VPN | Razón de probabilidad positiva | Razón de probabilidad negativa |
|---|---|---|---|---|---|---|---|---|---|
| RNL (media) (DE) | |||||||||
| DPO 2 | 0.65 | 0.33 | 20.3 | 0.36 | 0.96 | 0.80 | 0.79 | 9.0 | 0.7 |
| DPO 3 | 0.71 | 0.44 | 8.3 | 0.81 | 0.62 | 0.40 | 0.86 | 2.1 | 0.3 |
| RPL (media) (DE) | |||||||||
| DPO 2 | 0.59 | 0.28 | 21.3 | 0.90 | 0.37 | 0.33 | 0.85 | 1.4 | 0.3 |
| DPO 3 | 0.72 | 0.44 | 33.2 | 0.72 | 0.71 | 0.50 | 0.84 | 2.5 | 0.4 |
AUC: área bajo la curva; DPO: día postoperatorio; POPF: fístula pancreática postoperatoria; RNL: relación neutrófilo/linfocito; RPL: relación plaqueta/linfocito; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La fistula pancreática es aún un problema clínico posterior a la PD, y el retraso en su diagnóstico y tratamiento puede llevar a morbilidad grave e incluso a la muerte. Los pacientes con factores de riesgo para complicaciones quirúrgicas requieren atención especial durante el periodo postoperatorio. En nuestro hospital, el porcentaje de POPF posterior a PD es del 38.6%, similar al 27.2% para POPF grado B o grado C que se ha reportado previamente en la literatura científica18.
Cuando la POPF es identificada, los escenarios clínicos involucrados son de un amplio espectro. En la situación más frecuente asociada con POPF grado A, no hay necesidad de intervención. Sin embargo, un número considerable de pacientes con POPF grados B o C tendrán necesidad de intervenciones, como terapia antibiótica parenteral, drenaje endoscópico/percutáneo, procedimientos angiográficos y/o cirugía, lo cual implica costos para los sistemas de salud. El incremento de costos fue demostrado en la diferencia en nuestra población de estudio en la DEH de 8.2 a 22.9 días, entre pacientes con POPF clínicamente no significativo y pacientes con POPF clínicamente significativo, respectivamente.
El único metaanálisis publicado sobre POPF posterior a PD, de Peng et al., indica que la textura pancreática suave (OR: 1.8; IC 95%: 1.08-3.02; p=0.03), mayor IMC (OR: 2.19; IC 95%: 1.35-3.56; p<0.001), transfusión sanguínea (OR: 1.5; IC 95%: 1.11-2.16; p=0.02), pérdida sanguínea intraoperatoria (OR: 2.25; IC 95%: 1.54-3.29; p=0.0001) y tiempo operatorio prolongado (OR: 1.67; IC 95%: 1.08-2.58; p<0.0001), son factores significativos de riesgo para POPF18. Sin embargo, muchos de los estudios del metaanálisis no incluyeron el grado de POPF, lo cual refleja que los marcadores para la fístula pancreática posterior a PD clínicamente significativa permanecen poco estudiados. Además, la colocación de un drenaje cerrado durante la cirugía, es práctica común, con la finalidad de evacuar jugos pancreáticos postoperatoriamente y reducir la incidencia de acumulación, abscesos o sangrado intraabdominales, al igual que para detectar fugas pancreáticas y hemorragias. Sin embargo, algunos estudios y ensayos clínicos han demostrado que la colocación rutinaria del drenaje, posterior a PD, no está asociada con incremento o disminución de la tasa de complicaciones, o con la disminución de la necesidad de intervenciones postoperatorias5,19,20. También, otros autores han sugerido que los conductos de drenaje podrían favorecer la POPF y el desarrollo de abscesos intraabdominales21. Por lo tanto, un marcador serológico adecuado para identificar pacientes que presentarán POPF grados B o C ayudaría a enfocar la atención y los recursos de manera oportuna, y a distinguir a los pacientes que se beneficiarían de una remoción temprana del conducto de drenaje, de aquellos que no se beneficiarían. La RNL y la RPL podrían ayudar a estratificar pacientes, dado que la inflamación sistémica es un componente principal de las complicaciones intraabdominales posterior a cirugía, y las pruebas de sangre periférica podrían reflejar condiciones inflamatorias en la cavidad abdominal, como lo es el desarrollo de fístula pancreática. La asociación con la complicación intraabdominal, entre RNL y RPL, refleja una respuesta a daño en tejido local22, en el cual la neutrofilia inhibe el sistema inmunológico al suprimir linfocitos, células T activadas y células NK23, y la linfopenia disminuye la respuesta inmunológica celular anti-tumor24. Por lo tanto, la neutrofilia y la linfopenia llevan a una respuesta inflamatoria sistémica. En el presente trabajo, estudiamos la RNL y la RPL como marcadores serológicos para POPF clínicamente significativa, estableciendo un umbral de 8.3 (VPP: 40%; VPN: 86%) para la RNL, un AUC de 0.71, sensibilidad del 81% y especificidad del 62%, mientras que para RPL se estableció el umbral de 33.2 (VPP: 50%; VPN: 84%), con AUC de 0.72, sensibilidad de 72% y especificidad del 71%. Hasta donde sabemos, este es el primer estudio que evalúa el valor pronóstico de la RNL y la RPL para POPF clínicamente significativa.
ConclusiónCon base en nuestros resultados, la RNL y la RPL tienen buen valor pronóstico como marcadores serológicos para POPF clínicamente significativa al DPO 3, con un umbral de 8.3 (VPP: 40%; VPN: 86%) para la RNL, un AUC de 0.71, sensibilidad del 81% y especificidad del 62%, y un umbral de 33.2 (PPV: 50%; NPV: 84%) para la RPL, un AUC de 0.72, sensibilidad del 72% y especificidad del 71%. En un escenario quirúrgico adecuado, recomendamos que los pacientes con los valores de corte antes mencionados para RNL y RPL al DPO 3 sean monitoreados cuidadosamente, evitando la remoción del conducto de drenaje de manera temprana, ya que los marcadores antes mencionados podrían revelar un estado inflamatorio que no sea clínicamente evidente al día 3 postoperatorio.
FinanciaciónNo se recibió financiación alguna con relación al presente estudio/artículo.
AutoríasConcepto y diseño del estudio: Sánchez-Morales y Domínguez Rosado.
Recolección de datos: Cisneros-Correa y Lanzagorta-Ortega.
Análisis de datos e interpretación: Sánchez Morales y Cisneros-Correa.
Borrador del manuscrito: Sánchez Morales y Pérez-Soto.
Aprobación de manuscrito: Domínguez-Rosado y Chan
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.