La pandemia por coronavirus de 2019 (COVID-19) puede causar el síndrome respiratorio agudo grave (SARS-CoV-2), causando la pandemia actual de enfermedad respiratoria aguda llamada COVID-19. La lesión hepática por COVID-19 se define como cualquier daño hepático que ocurra durante el curso de la enfermedad y el tratamiento de pacientes con COVID-19, con o sin enfermedad hepática. La incidencia de transaminasas hepáticas elevadas, alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST) va del 2.5 al 76.3%. El objetivo del estudio fue describir las anormalidades bioquímicas hepáticas posterior a la prueba reacción en cadena de la polimerasa (PCR) positiva para SARS-CoV-2 y mortalidad en el paciente crítico.
Material y métodosEs un estudio retrospectivo, se incluyeron 70 pacientes, la mediana de edad fue de 44.5 años (rango: 37-57.2), siendo del sexo masculino 43 (61.4%), de un hospital privado de la Ciudad de México, se midieron al ingreso hospitalario las pruebas de la función hepática. Período del estudio: febrero-diciembre 2021.
ResultadosEncontrando elevación de gamma-glutamil transferasa (GGT) p 0.032, AST p 0.011 y ALT p 0.021, los pacientes se estratificaron en grupo de edad, 18-35, 36-50 y >50 años. La mayor elevación fue de 18-35 años, entre más joven mayor elevación de transaminasas, debido a la baja mortalidad, un paciente que no coincide con causa hepática, el análisis multivariado explicó una asociación R2 .689 p 0.001, explicado por AST, GGT y proteína C reactiva.
ConclusionesA pesar del incremento de transaminasas durante la infección por COVID-19, en nuestra población no aumentó la mortalidad, si bien debe darse seguimiento continuo durante la evolución hospitalaria.
Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) emerged, causing the current pandemic of acute respiratory disease known as COVID-19. Liver injury due to COVID-19 is defined as any liver injury occurring during the course of the disease and treatment of patients with COVID-19, with or without liver disease. The incidence of elevated liver transaminases, alanine aminotransferase (ALT) and aspartate aminotransferase (AST), ranges from 2.5 to 76.3%. The aim of the present study was to describe the hepatic biochemical abnormalities, after a SARS-CoV-2-positive polymerase chain reaction (PCR) test, and the mortality rate in critically ill patients.
Materials and methodsA retrospective study was conducted that included 70 patients seen at a private hospital in Mexico City, within the time frame of February-December 2021. Median patient age was 44.5 years (range: 37-57.2) and 43 (61.4%) of the patients were men. Liver function tests were performed on the patients at hospital admission.
ResultsGamma glutamyl transferase (GGT) levels were elevated (P=0.032), as were those of AST (P=0.011) and ALT (P=0.021). The patients were stratified into age groups: 18-35, 36-50, and >50 years of age. The 18 to 35-year-olds had the highest liver enzyme levels and transaminase levels were higher, the younger the patient. Due to the low mortality rate (one patient whose death did not coincide with a hepatic cause), the multivariate analysis showed an R2 association of 0.689, explained by AST, GGT, and C-reactive protein levels.
ConclusionsDespite the increase in transaminases in our study population during the course of COVID-19, there was no increase in mortality. Nevertheless, hospitalized patient progression should be continuously followed.
La pandemia por coronavirus de 2019 (COVID-19), causada por el síndrome de dificultad respiratoria aguda grave coronavirus-2 (SARS-CoV-2) está asociada con una morbimortalidad en todo el mundo. La COVID-19 afecta al sistema respiratorio, al sistema gastrointestinal y al sistema nervioso central. Los factores de riesgo asociados a mayor mortalidad por COVID-19 incluyen: edad avanzada, obesidad, sexo masculino, y comorbilidades preexistentes, incluida la enfermedad hepática crónica1,2.
La lesión hepática asociada con COVID-19 se define como cualquier daño hepático que ocurra durante el curso de la enfermedad y el tratamiento de pacientes con COVID-19, con o sin enfermedad hepática preexistente. Esto incluye un amplio espectro de posibles mecanismos patogénicos, incluida la citotoxicidad directa por la replicación viral activa del SARS-CoV-2 en el hígado; causando daño hepático inmunomediado debido a la respuesta inflamatoria severa, y al síndrome de respuesta inflamatoria sistémica (SIRS) en COVID-19, así como cambios hipóxicos inducidos por la insuficiencia respiratoria, cambios vasculares debido a coagulopatía, endotelopatía o congestión cardíaca derecha3.
La incidencia de transaminasas hepáticas elevadas, alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST), en pacientes con COVID-19 varía del 2.5 al 76.3%. En un metaanálisis reciente, la tasa combinada de AST y ALT fuera del rango de referencia fue del 20 al 22.5% y del 14.6 al 20.1%, respectivamente. Estas anomalías pueden acompañarse de un leve incremento de los niveles de bilirrubina total (BT) hasta en un 35% de los casos4,5.
Estudios previos han demostrado anomalías en las enzimas hepáticas en un número considerable de pacientes con COVID-19. La elevación de las enzimas hepáticas se observó con mayor frecuencia en pacientes críticos de COVID-19 en estado crítico. Así como, se ha informado que los pacientes que cursan con incremento de niveles crecientes de transaminasas hepáticas en pacientes con COVID-19 cursan con una enfermedad más grave incluyendo una alta mortalidad6.
En un estudio chino retrospectivo, los niveles elevados de AST y bilirrubina directa (BD) al ingreso del hospital se identificaron como predictores independientes de mortalidad asociada con COVID-197.
El objetivo de este estudio fue describir las anormalidades bioquímicas en pruebas de función hepática (PFH) en pacientes críticos con prueba de reacción en cadena de la polimerasa (PCR) positiva para SARS-CoV-2 y mortalidad.
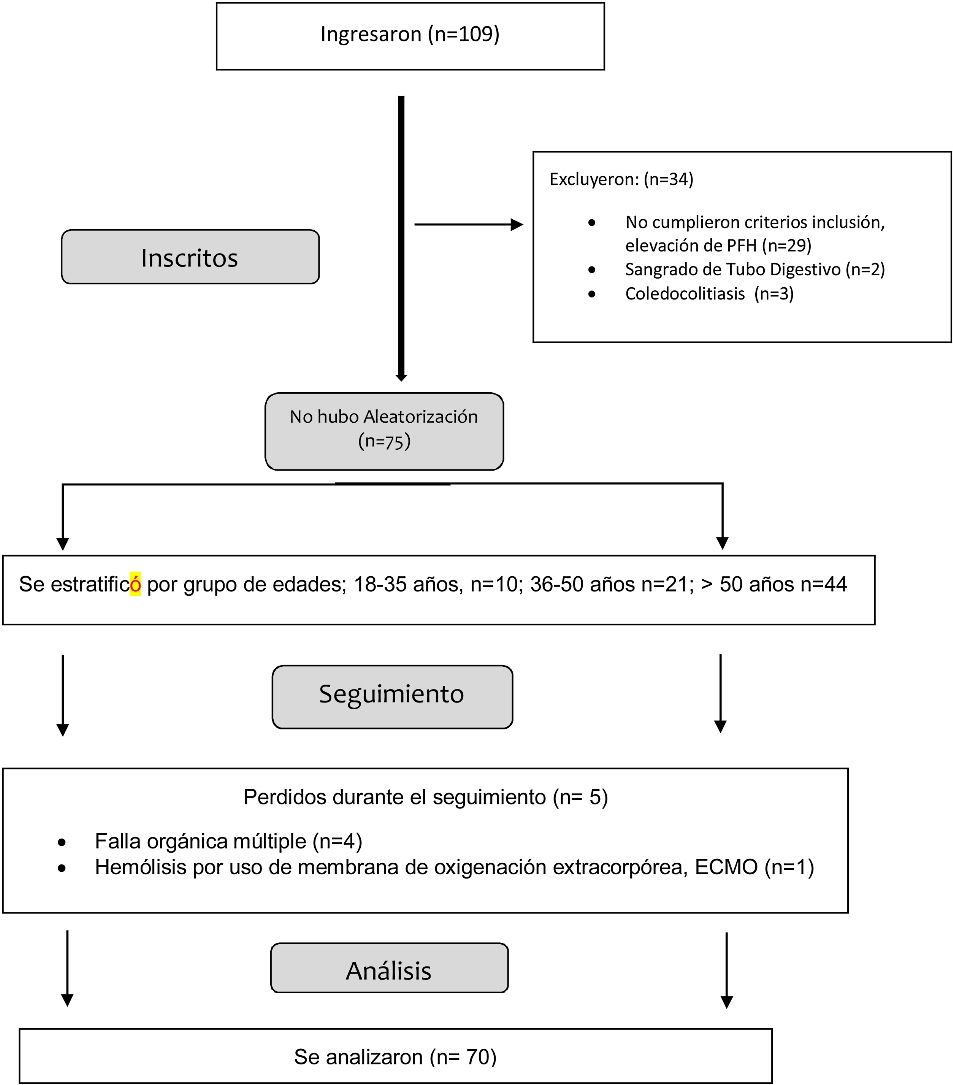
Material y métodosPoblación de estudioEn este estudio retrospectivo se incluyeron pacientes adultos con prueba de PCR SARS-CoV-2 positiva en un hospital privado de la Ciudad de México, entre febrero y diciembre del 2021. Se ingresaron un total de 109 pacientes con diagnóstico de SARS-CoV-2, de los cuales se revisaron todos los expedientes que presentaban a su ingreso elevación de transaminasas. Se excluyeron todos lo que no presentaban perfil hepático elevación (n=34). Se eliminaron aquellos que durante su seguimiento presentaron otras causas de elevación de PFH, como fue; falla orgánica múltiple (n=4), hemólisis por uso de membrana de oxigenación extracorpórea (n=1). Quedando un total de 70 pacientes (flowchart-ANEXA1), se realizó una base de datos con parámetros clínicos y de laboratorio, entre las variables se incluyeron las características demográficas; edad, sexo, índice de masa corporal (IMC); características hospitalarias: días de hospitalización, días de ventilación; características de severidad: evaluación secuencial de insuficiencia orgánica (SOFA) y sistema de clasificación de fisiología aguda y enfermedades crónicas II (APACHE II); comorbilidades: hipertensión arterial, diabetes mellitus, hiperlipidemia, enfermedad hepática crónica, obesidad y mortalidad. Las características bioquímicas: fosfatasa alcalina (ALP), gamma-glutamil transferasa (GGT), AST, ALT y BT, dímero D, fibrinógeno, tiempos de coagulación, procalcitonina, albúmina y proteína C reactiva (PCR), se evaluaron mediante revisión de expedientes. Los pacientes fueron estratificados por grupos de edad (18-35.9 años, 36-50 años, >50 años).
Todos los parámetros se evaluaron mediante ensayos de laboratorio estándar. Los rangos de normalidad fueron los indicados en el hospital donde se llevó a cabo la investigación.
Análisis estadísticoLas variables categóricas se informaron como número (n) y porcentaje (%). Los datos continuos se representaron como mediana y rango intercuartílico (RIC). Se implementaron las pruebas de normalidad, Shapiro-Wilk para probar la distribución normal. Se utilizó la prueba U de Mann-Whitney para comparar variables continuas que no se distribuyen normalmente entre 2 grupos. Para la comparación de variables continuas que no se distribuyen normalmente en 3 grupos, se calculó la prueba de Kruskal-Wallis. Para las comparaciones de grupos de variables categóricas, se utilizó la prueba Chi-cuadrado de Pearson o la prueba exacta de Fisher. Por último, para poder estimar el efecto ajustado de las variables que se asociaron, se realizó un análisis multivariado, a través de una regresión logística, las variables ingresadas fueron definidas a priori con base a la literatura conocida y la significación estadística se introdujeron al modelo. Se probó la interacción con las covariables, se obtuvieron OR ajustados, el modelo de bondad de ajuste se evaluó mediante la prueba de Hosmer-Lemeshow. El tamaño de la muestra fue por proporciones con una prevalencia de desenlace de 76.3%4. n =[EDFF*Np(1-p)]/ [(d2/Z21-α/2*(N-1)+p*(1-p)] resultando de 63 pacientes, se incrementó a 70 pacientes para compensar las pérdidas.
Para el análisis estadístico se utilizó el software estadístico IBM SPSS®. Un valor de p<0.05 se consideró estadísticamente significativo.
Consideraciones éticasEste trabajo cumple con la normativa vigente de la investigación de bioética, y se apega a las guías de buenas prácticas clínicas. Se obtuvo autorización por el comité de ética del Hospital Ángeles Mocel, la cual fue otorgada por escrito, en caso de requerir el autor cuenta con el documento original y puede ser enviado a la revista.
Debido a que se trata de un estudio retrospectivo donde se recabó información de los expedientes, no se solicitó consentimiento informado. Sin embargo, no se mencionan datos vulnerables que logren identificar a los pacientes, sus datos se mantienen en anonimato, y privacidad de los mismos. Por lo tanto, no contiene información personal que permita identificar a los pacientes.
ResultadosEn total se incluyeron 70 pacientes con prueba PCR SARS-CoV-2 positiva. El 43% de los pacientes eran varones, el 27% mujeres. La mediana de edad fue de 44.5 años con 9 (12.8%) pacientes entre 18-35.9 años, 20 (28.5%) pacientes entre 36-50 años y >50 años, 41 (58.5%). Ningún paciente tenía enfermedad hepática como antecedente. Con la edad progresiva, aumentó la prevalencia de comorbilidades, hipertensión arterial, diabetes mellitus, dislipidemia, enfermedad cardiovascular e insuficiencia renal crónica. La tasa de obesidad fue más alta en pacientes de 40 a 61 años. Características demográficas (tabla 1).
Características demográficas de la población
| Variables | n=70 |
|---|---|
| Edad n, mediana (RIC) | 44.5 (37-57.2) |
| Sexo n | |
| M (%) | 43 (61.4) |
| F (%) | 27 (38.6) |
| Talla n, media (±DE) | 1.68 (±.072) |
| Peso n, mediana (RIC) | 78 (70-84.2) |
| IMC n, mediana (RIC) | 26.4 (24.3-30.1) |
| Días de hospitalización n, mediana (RIC) | 17 (14-24.2) |
| Días de ventilación n, mediana (RIC)Días de disminución transaminasas n, mediana (RIC) | 4.19 (2.5-7.25)8.4 (7-16.4) |
| SOFA n, mediana (RIC) | 10 (9-15.25) |
| APACHE II n, mediana (RIC) | 22 (18-29) |
| Intubado n, sí (%) | 29 (41.4) |
| PNAF n, (%) | 37 (52.9) |
| PNC n, (%) | 4 (5.7) |
| Comorbilidades n, (%) | |
| HAS | 20 (28.5) |
| DM | 25 (35.7) |
| Dislipidemia | 10 (14.2) |
| Mortalidad n, (%) | 1 (1.4) |
APACHE II: sistema de clasificación de fisiología aguda y enfermedades crónicas II; DE: desviación estándar; DM: diabetes mellitus; F: femenino; HAS: hipertensión arterial sistémica; IMC: índice de masa corporal; M: masculino; PNAF: puntas nasales de alto flujo; PNC: puntas nasales convencionales; RIC: rango intercuartílico; SOFA: evaluación secuencial de insuficiencia orgánica.
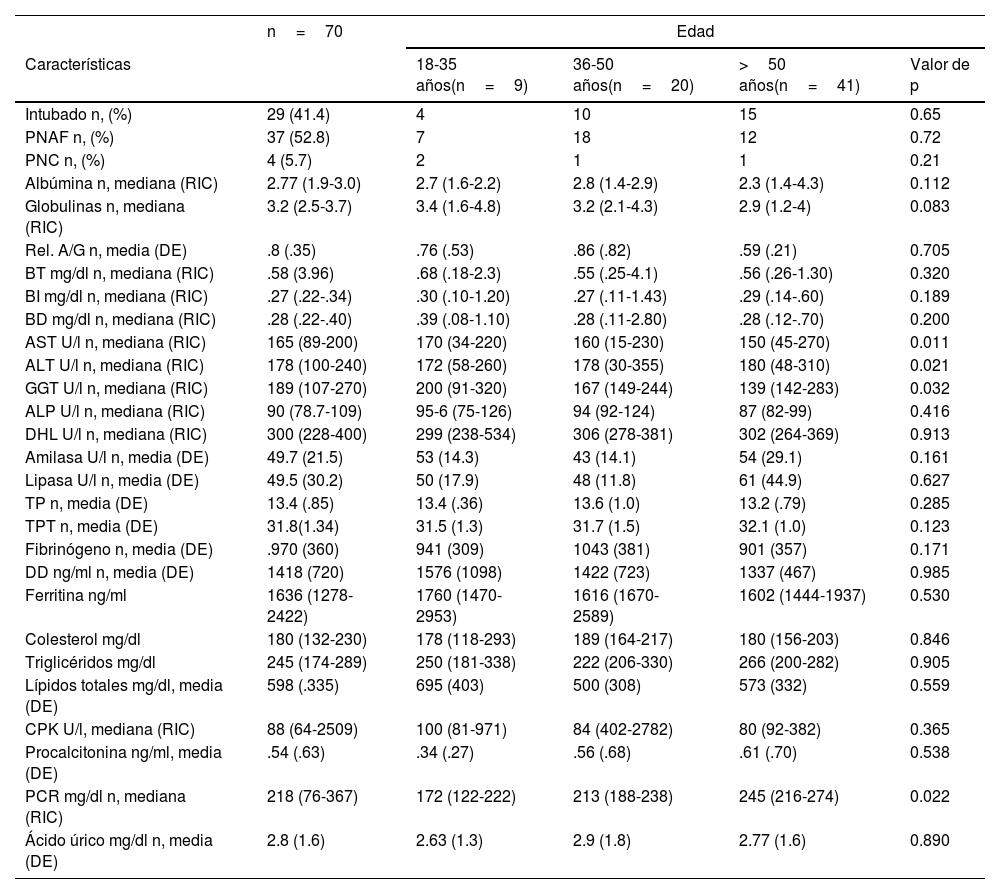
Desde el ingreso hospitalario en el servicio de urgencias se solicitó perfil hepático, posterior a la primera prueba PCR SARS-CoV-2 positiva. Los parámetros de daño hepatocelular (AST/ALT) estaban elevados en el 97.1% (n=68/70) de los pacientes, y los parámetros de daño hepático colestásico (ALP/GGT) en el 40.0% (n=35/70). Las transaminasas presentaron una elevación >3 × el límite superior. Los niveles de albúmina disminuyeron en todos los estratos de edad, pero principalmente en los de >50 años.
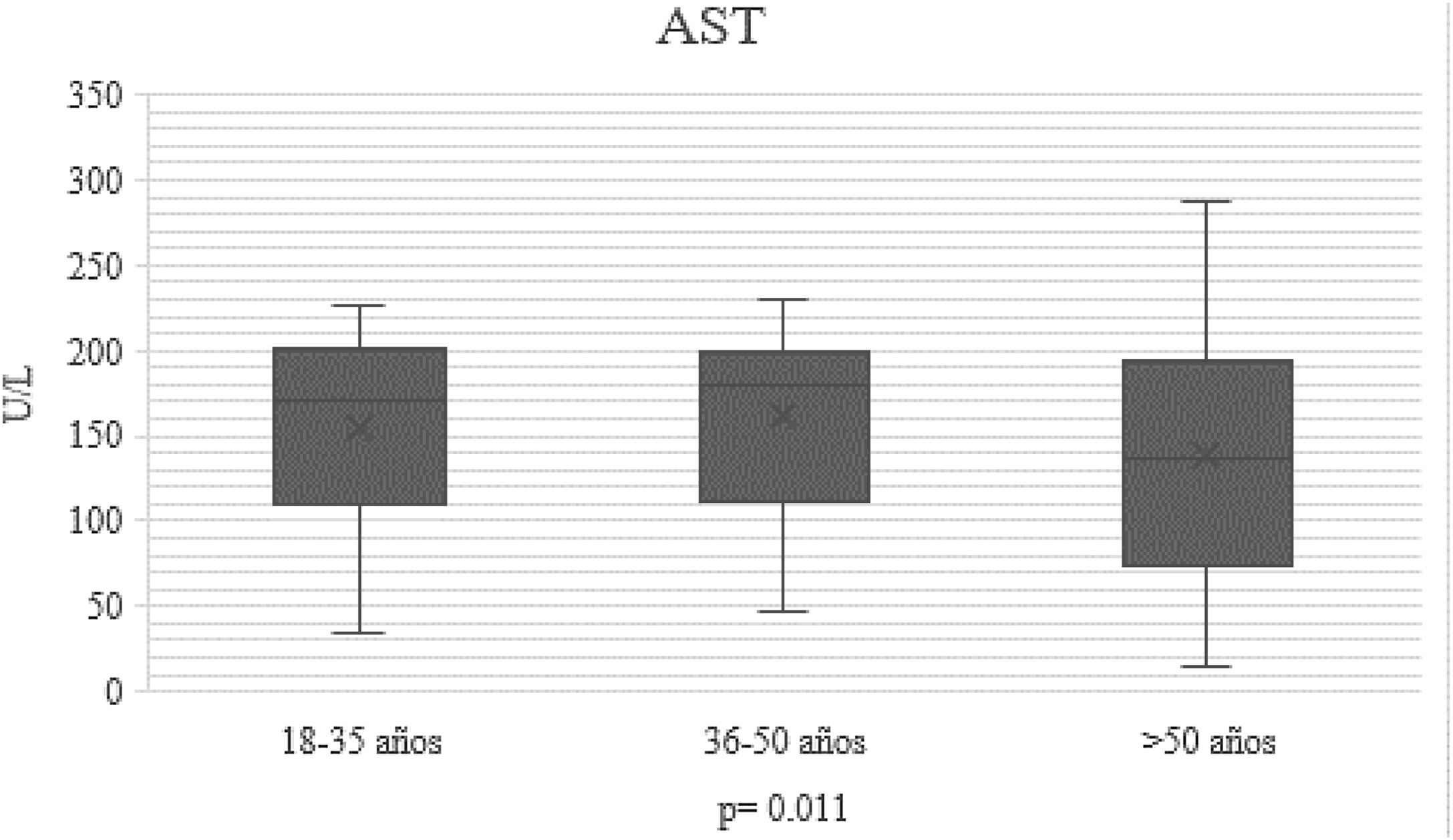
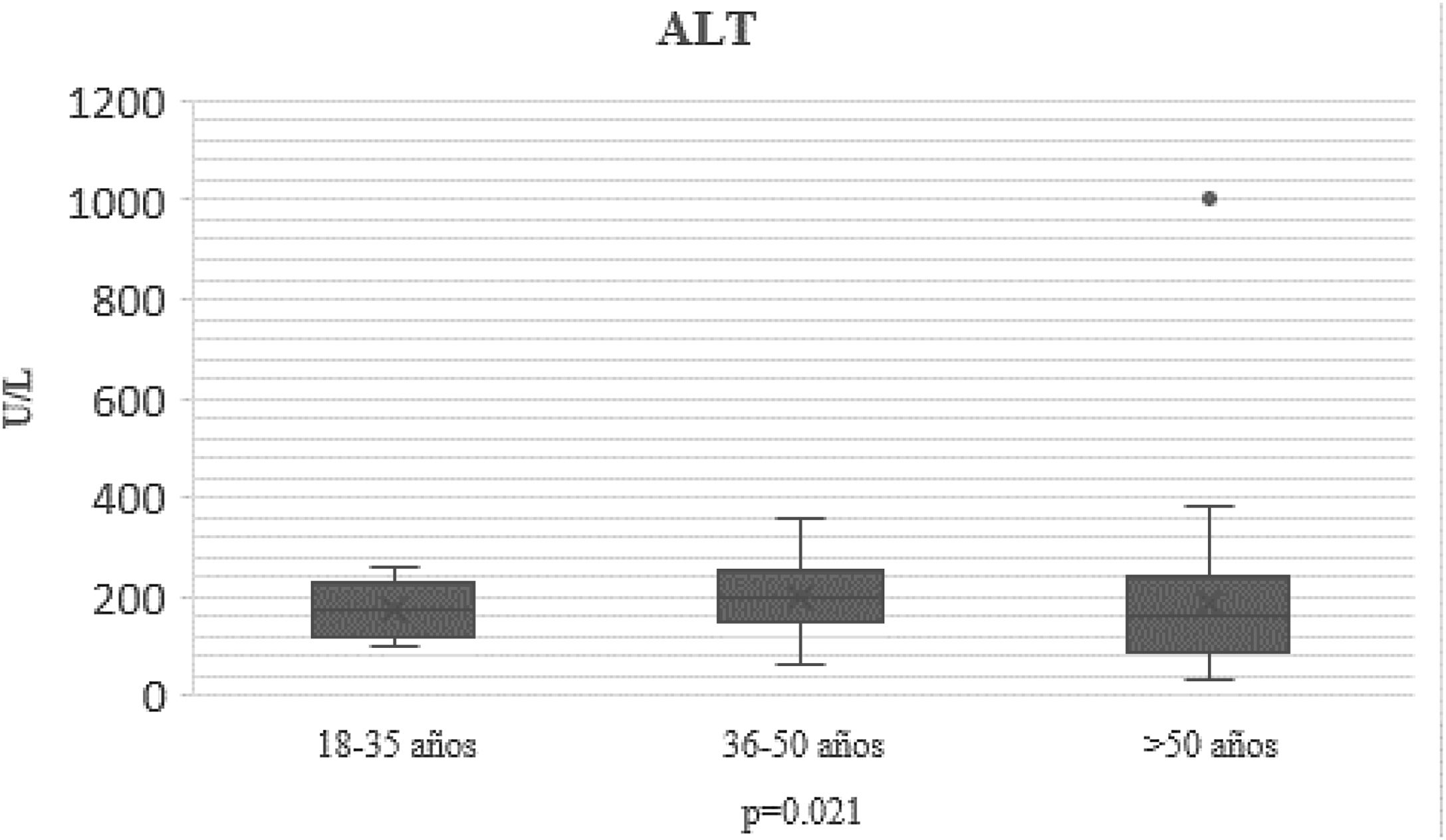
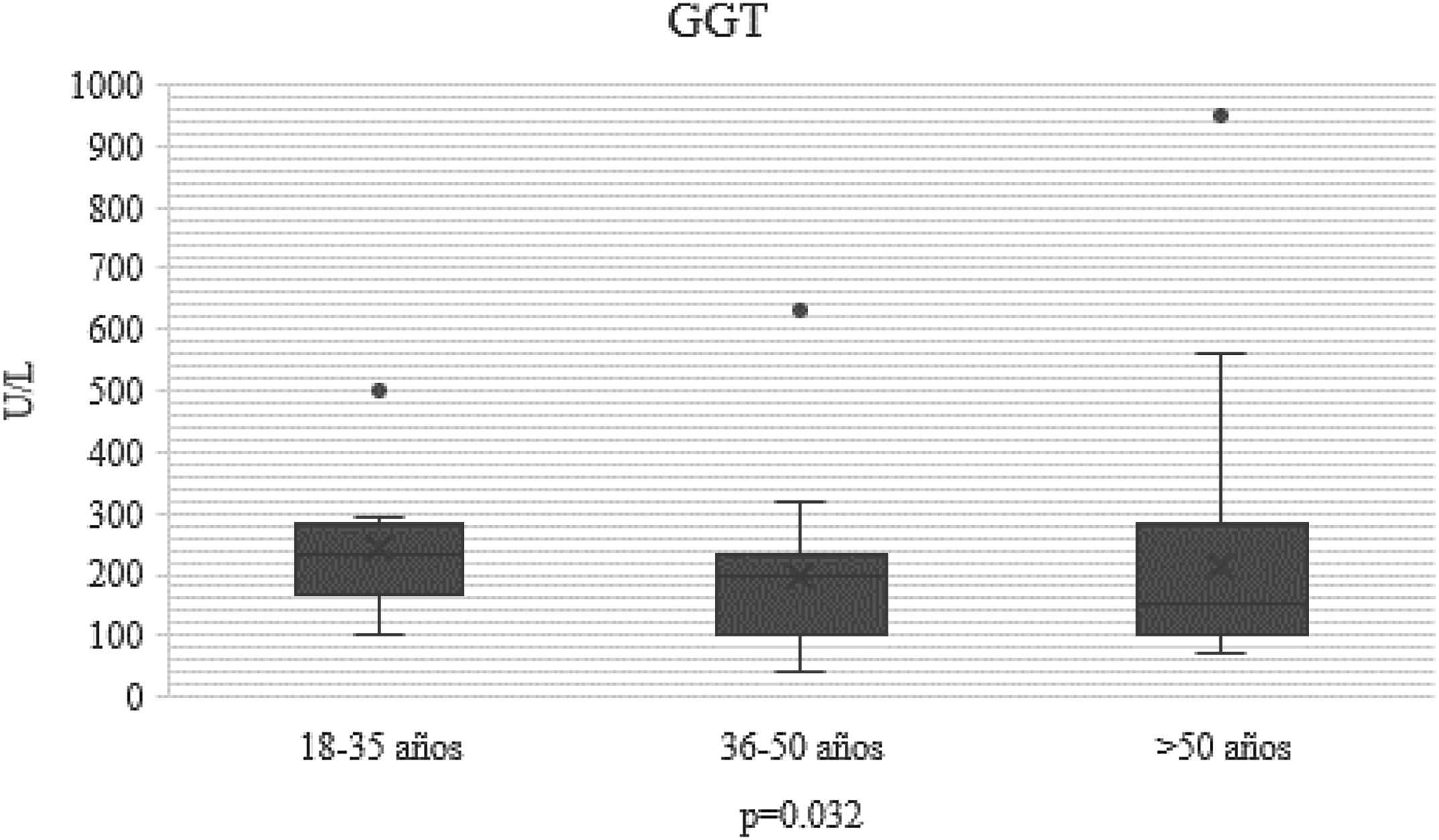
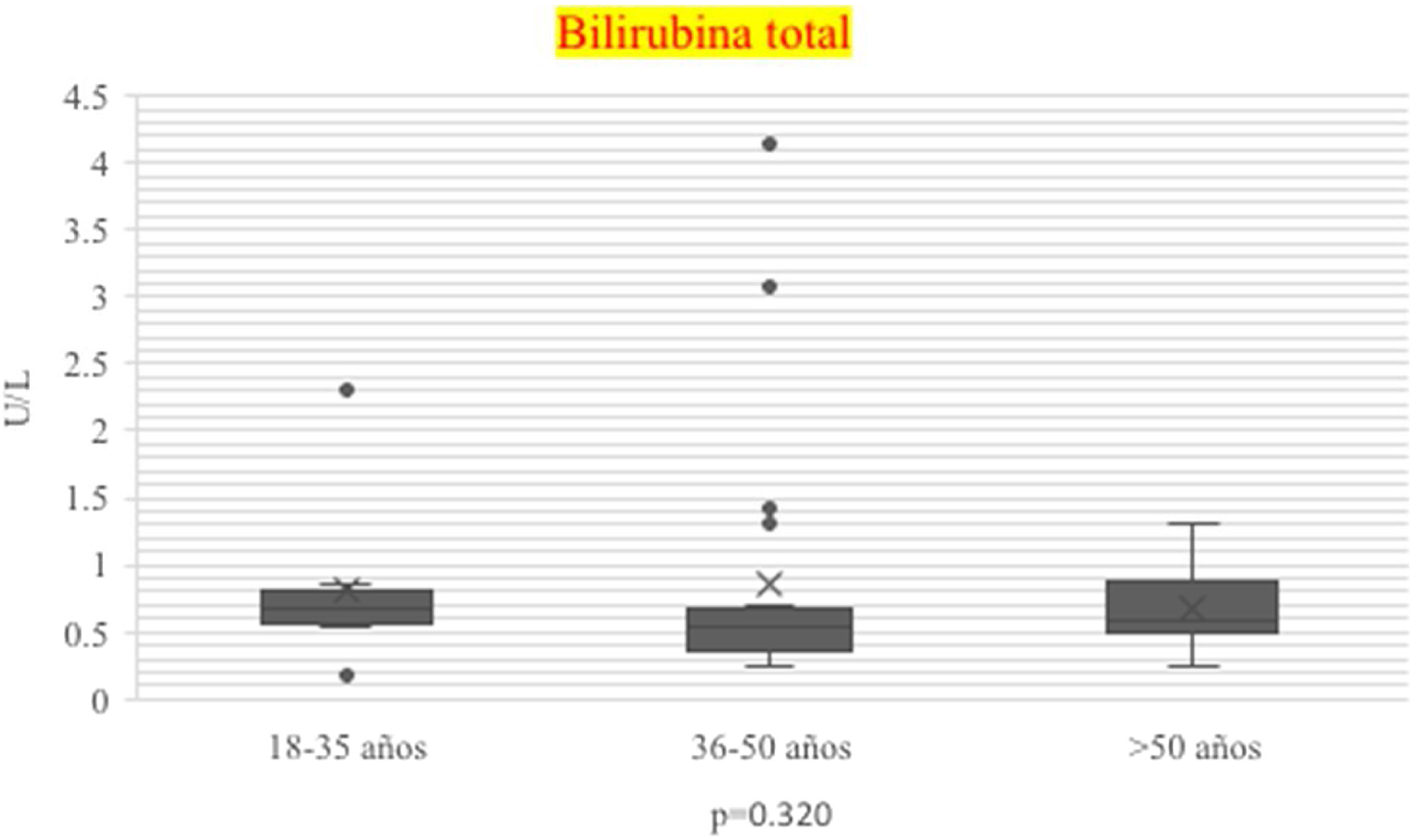
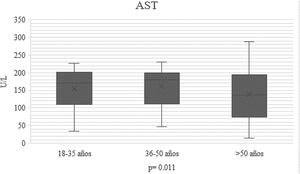
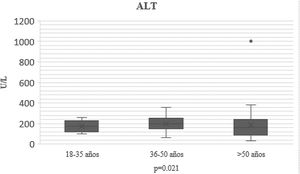
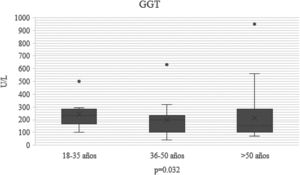
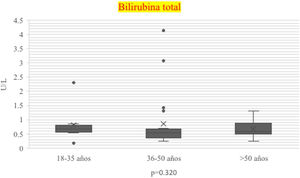
En el transcurso de la infección por SARS-CoV-2, los niveles plasmáticos de parámetros de daño hepatocelular por grupo de edad se compararon (AST: p=0.011; ALT: p=0.021) (figs. 1 y 2); en los de daño colestásico, la ALP (p=0.416) y la GGT (p<0.032) no mostraron significación (fig. 3), y no hubo cambios significativos en BT p=0.320 (fig. 4).
Lesión hepática relacionada con COVID-19 en diferentes estratos de edad se muestra en la tabla 2. La proporción de pacientes con lesión hepática relacionada con COVID-19 fue particularmente alta de los 18 a los 35 años, es decir en esta población entre más joven de edad, mayor inflamación o lesión hepática, en contraste, la albúmina, a mayor edad >50 años, menor el nivel de albúmina, todos los pacientes presentaron proteína C reactiva (PCR) alta, indicando inflamación por COVID-19, esto confirma que a pesar de ingresar con respuesta inflamatoria, algunos presentaron mayor elevación de transaminasas (18-35 años), en comparación con los de mayor edad.
Características y comparación entre pacientes por grupo de edad
| n=70 | Edad | ||||
|---|---|---|---|---|---|
| Características | 18-35 años(n=9) | 36-50 años(n=20) | >50 años(n=41) | Valor de p | |
| Intubado n, (%) | 29 (41.4) | 4 | 10 | 15 | 0.65 |
| PNAF n, (%) | 37 (52.8) | 7 | 18 | 12 | 0.72 |
| PNC n, (%) | 4 (5.7) | 2 | 1 | 1 | 0.21 |
| Albúmina n, mediana (RIC) | 2.77 (1.9-3.0) | 2.7 (1.6-2.2) | 2.8 (1.4-2.9) | 2.3 (1.4-4.3) | 0.112 |
| Globulinas n, mediana (RIC) | 3.2 (2.5-3.7) | 3.4 (1.6-4.8) | 3.2 (2.1-4.3) | 2.9 (1.2-4) | 0.083 |
| Rel. A/G n, media (DE) | .8 (.35) | .76 (.53) | .86 (.82) | .59 (.21) | 0.705 |
| BT mg/dl n, mediana (RIC) | .58 (3.96) | .68 (.18-2.3) | .55 (.25-4.1) | .56 (.26-1.30) | 0.320 |
| BI mg/dl n, mediana (RIC) | .27 (.22-.34) | .30 (.10-1.20) | .27 (.11-1.43) | .29 (.14-.60) | 0.189 |
| BD mg/dl n, mediana (RIC) | .28 (.22-.40) | .39 (.08-1.10) | .28 (.11-2.80) | .28 (.12-.70) | 0.200 |
| AST U/l n, mediana (RIC) | 165 (89-200) | 170 (34-220) | 160 (15-230) | 150 (45-270) | 0.011 |
| ALT U/l n, mediana (RIC) | 178 (100-240) | 172 (58-260) | 178 (30-355) | 180 (48-310) | 0.021 |
| GGT U/l n, mediana (RIC) | 189 (107-270) | 200 (91-320) | 167 (149-244) | 139 (142-283) | 0.032 |
| ALP U/l n, mediana (RIC) | 90 (78.7-109) | 95-6 (75-126) | 94 (92-124) | 87 (82-99) | 0.416 |
| DHL U/l n, mediana (RIC) | 300 (228-400) | 299 (238-534) | 306 (278-381) | 302 (264-369) | 0.913 |
| Amilasa U/l n, media (DE) | 49.7 (21.5) | 53 (14.3) | 43 (14.1) | 54 (29.1) | 0.161 |
| Lipasa U/l n, media (DE) | 49.5 (30.2) | 50 (17.9) | 48 (11.8) | 61 (44.9) | 0.627 |
| TP n, media (DE) | 13.4 (.85) | 13.4 (.36) | 13.6 (1.0) | 13.2 (.79) | 0.285 |
| TPT n, media (DE) | 31.8(1.34) | 31.5 (1.3) | 31.7 (1.5) | 32.1 (1.0) | 0.123 |
| Fibrinógeno n, media (DE) | .970 (360) | 941 (309) | 1043 (381) | 901 (357) | 0.171 |
| DD ng/ml n, media (DE) | 1418 (720) | 1576 (1098) | 1422 (723) | 1337 (467) | 0.985 |
| Ferritina ng/ml | 1636 (1278-2422) | 1760 (1470-2953) | 1616 (1670-2589) | 1602 (1444-1937) | 0.530 |
| Colesterol mg/dl | 180 (132-230) | 178 (118-293) | 189 (164-217) | 180 (156-203) | 0.846 |
| Triglicéridos mg/dl | 245 (174-289) | 250 (181-338) | 222 (206-330) | 266 (200-282) | 0.905 |
| Lípidos totales mg/dl, media (DE) | 598 (.335) | 695 (403) | 500 (308) | 573 (332) | 0.559 |
| CPK U/l, mediana (RIC) | 88 (64-2509) | 100 (81-971) | 84 (402-2782) | 80 (92-382) | 0.365 |
| Procalcitonina ng/ml, media (DE) | .54 (.63) | .34 (.27) | .56 (.68) | .61 (.70) | 0.538 |
| PCR mg/dl n, mediana (RIC) | 218 (76-367) | 172 (122-222) | 213 (188-238) | 245 (216-274) | 0.022 |
| Ácido úrico mg/dl n, media (DE) | 2.8 (1.6) | 2.63 (1.3) | 2.9 (1.8) | 2.77 (1.6) | 0.890 |
ALP: fosfatasa alcalina; ALT: alanino-aminotransferasa; AST: aspartato aminotransferasa; BD: bilirrubina directa; BI: bilirrubina indirecta; BT: bilirrubina total; CPK: creatina-fosfocinasa; DE: desviación estándar; DD: dímero D; DHL: deshidrogenasa láctica; GGT: gamma glutamil transpeptidasa; ng/ml: nanogramos/mililitro; PCR: proteína C reactiva; PNAF: puntas nasales de alto flujo; PNC: puntas nasales convencionales; Rel. A/G: relación albúmina/globulina; RIC: rango intercuartílico; TP: tiempo de protrombina; TPT: tiempo parcial de tromboplastina; U/l: unidades/litro; mg/dl: miligramos/decilitro.
De los 68 pacientes que elevaron al ingreso las transaminasas, posteriormente los otros 2 las elevaron a las 48h de la hospitalización, ninguno refirió dolor abdominal en hipocondrio derecho, tampoco presentó ictericia. En total, 29 pacientes (41.4%) requirieron ventilación mecánica, solo uno (1.4%) falleció por enfermedad renal relacionada con COVID-19, con estancia hospitalaria de 28 días. Con puntas nasales de alto flujo (PNAF) 37 (52.9%) y 4 (5.7%) requirieron puntas nasales convencionales (PNC).
Por estratos de edad, la tasa de ingresos en la unidad de cuidados intensivos (UCI), intubaciones y mediana de estancia hospitalaria fue mayor en pacientes >50 años. De todos los pacientes ninguno tenía antecedente de enfermedad hepática. La estancia hospitalaria, mediana 17 (14-24.2); días de ventilación mecánica, mediana 4.19 (2.5-7.25); comorbilidades 20 (28.5%) pacientes con hipertensión arterial; 25 (35.7%) diabetes mellitus; dislipidemia 10 (14.2%). En este estudio se observó el incremento de parámetros de daño hepático y colestásico, posterior a la infección por SARS-CoV-2, lo cual se menciona con una alta mortalidad, el único paciente que falleció masculino de 48 años con 2 comorbilidades y el descenso fue causa renal. El análisis multivariado explicó una asociación de R2 .628 (IC 95%: 14.1-22.3; p=0.008), así como ALT (OR: 1.50; IC 95%: .91-1.71; p=.695), AST (OR: 1.39; IC 95%: 1.1-1.9; p=.049), GGT (OR: 1.79; IC 95%: 1.3-2.5; p=0.001) y PCR (OR: 1.57; IC 95%: 1.3-2.6; p=.012), lo que explica una asociación moderada, entre la edad de los pacientes y la elevación de PFH ocasionando lesión hepática transitoria durante la infección por COVID-19.
DiscusiónEn el estudio de Yang et al., 2020, de tipo retrospectivo de 710 pacientes, 52 ingresados a terapia intensiva con ventilación mecánica; describieron el daño a otros órganos en una mayoría de la población estudiada; de los cuales el 29% presentó disfunción hepática asociada a neumonía severa por COVID-19, superando la lesión renal aguda que solo se presentó en el 29% de los casos, y similar lesión cardiaca en un 23%. Contrario a nuestro estudio donde el paciente que falleció fue por causa renal y no hepática8.
De acuerdo con Hartl et al., 2022, en su estudio una cohorte retrospectiva, la enfermedad hepática por COVID-19, no tuvo impacto en la mortalidad relacionada con el hígado. Coincidiendo con nuestros resultados, a pesar de tener una muestra más pequeña, solo ocurrió un desenlace fatal y no estuvo relacionado con etiología hepática, la lesión hepática que presenta al ingreso posterior a ser diagnosticados positivos para infección por SARS-CoV-2, no representa mayor mortalidad9.
Mientras que las elevaciones de las enzimas hepáticas colestásicas ALP y GGT inicialmente se consideraron bastante raros, las revisiones sistémicas recientes destacan elevaciones de ALP y GGT en el 6.1 y 21.1% de los pacientes con COVID-19. Nosotros solo encontramos elevación de la GGT desde el ingreso con una p=0.032, no fue así el caso de la ALP que no presentó elevación, tampoco presentó significación estadística, p=0.41610.
En el estudio de Wang et al.11, 2020, encontraron prolongación del tiempo de protrombina (TP) (13.0s) en 80/138 pacientes (58%), Zhou et al.12, 2020, en su estudio que incluyó 191 pacientes, no hubo prolongación, al igual que nosotros, encontramos solo en 5 pacientes TP>13.5 (7.14%), sin ser significativo, p=0.285.
En el estudio de Chao et al., 2020, encontraron que la GGT, no había sido reportado en estudios de COVID-19 sin embargo, estaba elevada en 30 (54%) de 56 pacientes durante su hospitalización. También observaron niveles elevados de ALP en uno (1-8%) de 56 pacientes con COVID-19 durante la hospitalización. Concordando con este estudio, en nuestros pacientes hubo poco o casi nulo aumento de la ALP en los pacientes13.
La elevación de los niveles de ferritina, PCR y deshidrogenasa láctica (DHL), reflejan consecuencias de la liberación de citoquinas inflamatorias. Sin embargo, los casos graves se asocian con una condición hiperinflamatoria. Se ha informado una liberación masiva de interleucina-6 (IL-6), en pacientes con infección por COVID-19. En una serie retrospectiva en 150 pacientes en China, la IL-6 elevada y la ferritina sérica alta se asociaron con mortalidad. En este estudio la limitación fue que no se midió o comparó con IL-6, per se, todos los pacientes presentaron elevación de ferritina, PCR, DHL y fibrinógeno14.
Otras causas de daño hepático deben ser evocadas en estos pacientes como la hepatitis hipóxica cuando hay un repentino aumento de aminotransferasas en pacientes de la UCI. Un aumento en la AST puede estar relacionada con la miocarditis. En un reporte de caso, donde se realizó una autopsia en un paciente con síndrome de dificultad respiratoria, se observó esteatosis microvesicular con inflamación leve en el hígado, aunque no estaba claro si estaba relacionado con el virus u otras condiciones15,16.
Harsh et al., 2020; encontraron en su estudio original, las elevaciones de las pruebas hepáticas fueron predichos por los marcadores inflamatorios. La hiperbilirrubinemia predijo mortalidad al ingreso y en el pico máximo de elevación. La AST y ALT tuvieron un impacto opuesto en la mortalidad con AST positivamente y ALT asociado negativamente con la mortalidad. Por lo tanto, además de la hiperbilirrubinemia, la relación AST:ALT surgió como el mejor marcador de mortalidad entre las PFH17.
La BT≥1mg/dl, al ingreso y el cociente AST:ALT fueron predictores significativos de mortalidad, junto con la edad, lesión miocárdica y enfermedad médica crónica. De acuerdo con sus resultados coincidimos con los encontrados en este estudio, donde la población más joven presentó mayor elevación de AST, no obstante, la bilirrubina en nuestro estudio no se elevó al ingreso ni en el pico, con disminución posterior, concordamos que sería una explicación de la baja mortalidad que presentamos relacionada con el no incremento de bilirrubina17.
ConclusiónLas elevaciones de las PFH entre pacientes que presentan COVID-19 son muy comunes, aunque la mayoría son leves. Se debe estar monitorizando desde el ingreso, el perfil hepático, así como vigilar la elevación de bilirrubinas con la relación AST y ALT que son marcadores predictores de mortalidad en infección por COVID-19.
Queda claro que la patogenia de la COVID-19 es multisistémica, con mecanismos multifactoriales de lesión hepática, que difícilmente evoluciona al fallo hepático agudo, si bien la elevación de transaminasas es un predictor de mortalidad en otras series, la identificación temprana de la gravedad y el soporte multiorgánico oportuno pueden modificar estos desenlaces. Queda por dilucidar el efecto a largo plazo de la función hepática, en pacientes sin lesión hepática con COVID-19.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.