El coronavirus SARS-CoV-2, un nuevo coronavirus, es responsable de la enfermedad infecciosa por coronavirus 19 (COVID-19). A nivel global, esta pandemia va en crecimiento y pudiera afectar al 50-60% de la población mundial en los siguientes meses. Si bien es una enfermedad cuya manifestación más severa es la neumonía atípica y sepsis, recientemente se ha descrito que el tracto digestivo y en particular el hígado, pueden verse afectados por el SARS-CoV-2. Así pues, el objetivo del presente trabajo es revisar la literatura disponible al respecto y emitir algunas recomendaciones del papel que el COVID-19 ejerce sobre el hígado en la salud y la enfermedad. La incidencia de lesión hepática asociada específicamente a COVID-19 varía de 14.8-53%. La mayoría de las series de casos han reportado alteración en ALT y AST, elevación de bilirrubinas totales y albúmina sérica baja. La afectación hepática se ha asociado a casos más graves de COVID-19. Por otra parte, se reconoce que la cirrosis hepática es un estado de disfunción inmune que comprende inmunodeficiencia e inflamación sistémica, lo cual hace razonable que estos pacientes sean más susceptibles a la infección por SARS-CoV-2. Las recomendaciones para estos pacientes, además de las medidas generales para la población (aislamiento social, lavado de manos) incluyen el apoyo social, médico y psicológico durante el período de estancia en el domicilio para evitar transgresiones a la terapia. Es recomendable orientar a los pacientes a mantenerse informados de los cambios en recomendaciones y políticas sociales.
The novel SARS-CoV-2 coronavirus is responsible for the infectious disease caused by coronavirus 19 (COVID-19). The current pandemic is growing worldwide and could affect 50-60% of the world population in the months to come. The most severe disease manifestations are atypical pneumonia and sepsis, but the gastrointestinal tract, particularly the liver, has recently been reported to be affected by SARS-CoV-2. Therefore, the aim of the present work was to review the literature available on the topic and provide information about COVID-19, in both healthy and diseased livers, and issue recommendations. The incidence of liver injury specifically associated with COVID-19 varies from 14.8-53%. The majority of case series have reported altered ALT and AST, elevated total bilirubin, and low serum albumin and liver compromise has been associated with the most severe cases of COVID-19. Cirrhosis of the liver has a recognized immune dysfunction status that includes immunodeficiency and systemic inflammation, making it reasonable for those patients to be more susceptible to SARS-CoV-2 infection. The recommendations for those patients, in addition to the general measures of physical distancing and handwashing for all persons, include social, medical, and psychologic support during the period of home quarantine to prevent lapses in treatment. Patients should be made aware that they need to keep abreast of changes in recommendations and social policies.
Los coronavirus son virus RNA de sentido positivo envueltos que varían de 60 nm a 140 nm de diámetro con proyecciones en forma de espinas en su superficie que le dan una apariencia de corona; de ahí el nombre. Hasta noviembre del 2019 se tenía conocimiento de cuatro virus corona que se presentaban en humanos y causaban infecciones respiratorias leves: HKU1, NL63, 229E y OC431,2. Recientemente se describe la aparición de un nuevo coronavirus humano reportado en la ciudad de Wuhan, China. El nuevo coronavirus, SARS-CoV-2 es un betacoronavirus, subgénero Sarbecovirus, subfamilia de Orthocoronavirinae. La organización del genoma viral del coronavirus de Wuhan Humano-1 se determinó mediante la alineación de secuencia de dos betacoronavirus: Uno asociado con humanos (SARS-CoV Tor2) y otro asociado con murciélagos (bat SL-CoVZC45)3,4.
La enfermedad infecciosa por coronavirus 19 (COVID-19), denominada de esta manera por la Organización Mundial de la Salud (OMS) el pasado 11 de febrero de 2020, es causada por el virus SARS-CoV-2 y representa el agente causante de una enfermedad potencialmente mortal, que se ha convertido en un gran problema de salud pública mundial5. Para el 24 de febrero de 2020, ya existía registro en todo el mundo, al menos 37 países, de más de 80,000 casos confirmados con más de 2,700 muertes, por lo cual la OMS declaró que se trataba de una emergencia sanitaria mundial6.
En México, el primer caso reportado fue el 27 de febrero y dos días después ya se tenía reporte de cuatro casos confirmados por la Secretaría de Salud de México, todos importados por una persona de Bérgamo, Italia7. La evolución de esta pandemia a nivel mundial va en crecimiento y hasta el día 5 de mayo se reportaron 3,525,116 casos confirmados8 con una tasa de letalidad de 3.4%, y en México hasta este día se habían confirmado 24,905 casos y 2,271 defunciones por COVID-199. Si bien es una enfermedad cuya manifestación más grave es la neumonía atípica y sepsis, recientemente se ha descrito que el tracto digestivo y en particular el hígado, pueden verse afectados por el SARS-CoV-210,11.
Así pues, el objetivo del presente trabajo es revisar la literatura disponible al respecto y emitir algunas recomendaciones del papel que la COVID-19 ejerce sobre el hígado en la salud y la enfermedad.
Material y métodosSe realizó una revisión narrativa de la literatura con base en una búsqueda exhaustiva en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, BioMed Central e ICTRP (World Health Organization International Clinical Trials Registry Platform). La búsqueda comprendió el período del 01 de enero de 2020 al 10 de abril de 2020. Los criterios de búsqueda incluyeron los siguientes términos: «coronavirus» combinado con los siguientes términos: «SARS-CoV-2», «liver», «hepatic», «enzymes», «acute», «chronic», «cirrhosis», «liver failure», «hepatitis», «COVID-19» y sus equivalentes en español. De la búsqueda realizada se encontraron 98 trabajos, de los cuales se incluyeron 47 en la presente revisión. Los trabajos que se excluyeron fueron porque se trataban de reportes de casos, publicaciones duplicadas, o que estaban en un idioma diferente al español o al inglés.
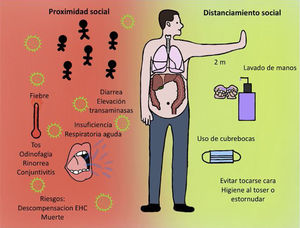
COVID-19 y manifestaciones hepáticasLas manifestaciones clínicas de COVID-19 son variadas, ya que van desde un estado asintomático hasta una forma más grave, el síndrome de insuficiencia respiratoria aguda (SIRA) y la disfunción multiorgánica. Los signos y síntomas comunes son fiebre, tos, dolor de garganta, dolor de cabeza, fatiga, mialgia, disnea, conjuntivitis, pero puede progresar a neumonía, insuficiencia respiratoria y muerte1. Por otro lado, los pacientes infectados con COVID-19 también han mostrado síntomas gastrointestinales como diarrea y un bajo porcentaje de pacientes con MERS-CoV o SARS-CoV presenta malestar gastrointestinal similar. Los síntomas aparecen después de un período de incubación de aproximadamente 5.2 días5.
Una metaloproteinasa denominada la enzima convertidora de angiotensina 2 (ECA2) se ha identificado como el receptor funcional para la entrada celular de los coronavirus. Se ha encontrado micro RNA de ECA2 expresado en múltiples órganos y tejidos humanos como mucosa oral y nasal, nasofaringe, pulmón, estómago, intestino delgado, colon, piel, nódulos linfáticos, timo, médula ósea, bazo, riñón, cerebro, epitelio biliar y en el hígado, por lo anterior la expresión de este, lo hace un blanco potencial de infección1,12–15.
Así pues, el hígado es un órgano afectado por COVID-19. Existe información de que esta familia de coronavirus presenta como blanco fisiopatológico al hígado, tanto sano como con enfermedad hepática preexistente. Se ha demostrado lesión hepática (hepatitis) en pacientes con SARS, manifestada por elevación leve y moderada de alanina aminotransferasa (ALT) y de aspartato aminotransferasa (AST) durante la etapa temprana de la enfermedad, además, se presenta disminución de la albúmina sérica y aumento de los niveles séricos de bilirrubina. Hallazgos en autopsia de pacientes con SARS demuestran un gran número de partículas del virus, no sólo en los pulmones, sino también en las células parenquimatosas y el endotelio vascular de otros órganos, incluido el hígado12.
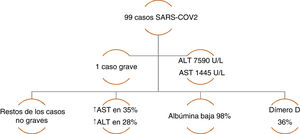
La incidencia de lesión hepática asociada específicamente a COVID-19 varía de 14.8-53%. La mayoría de las series de casos han reportado alteración en ALT y AST, elevación de bilirrubinas totales y albúmina sérica baja12. Chen y cols. reportaron una serie de 99 casos de neumonía por COVID-19, en dicha serie únicamente un paciente presentó una lesión con patrón hepatocelular grave con elevación de ALT y AST, mientras que el resto de los pacientes mostraba elevación moderada de aminotransferasas. La disminución de albúmina se presentó en la mayoría de los casos, en tanto que, respecto al perfil de coagulación, el tiempo de protrombina aumentó en sólo el 5% de los casos, resaltando incremento de niveles de dímero en un tercio de los pacientes (fig. 1)16. De forma similar, Huang y cols. encontraron alteración bioquímica hepática similares, destacando que los niveles de AST se encontraron elevados en 37% y que fue mayor la proporción en aquellos que ingresaron a la unidad de cuidados intensivos (UCI), 62% vs. 25%17. Estos hallazgos son parecidos a los que reportan Wang y cols. en una serie de 138 casos de COVID-19, donde los niveles de AST fueron estadísticamente más elevados en los pacientes que requirieron UCI (p = < 0.001)18.
Serie de casos de COVID-19 con alteración de la química hepática. Datos tomados de: Chen, et al. 16.
Además, hay estudios donde la presencia de alteraciones hepáticas se ha relacionado con mortalidad. Zhang y cols. encontraron en una serie de 82 casos de muerte por SARS-CoV-2 que la mediana del tiempo desde el síntoma inicial hasta la muerte fue de 15 días. Respecto a la elevación de transaminasas se observó una asociación significativa entre AST (p = 0.002), la ALT (p = 0.037) y el tiempo desde el síntoma inicial hasta la muerte19. En otro reporte de Huang y cols. se describen las características clínicas de 36 pacientes que no sobrevivieron a COVID-19. Las alteraciones de la química hepática se comportaron de manera similar a reportes previos con elevación de ALT en 13.3%, de AST en 58%, disminución de albúmina en 80%, aumento de bilirrubinas totales en 13% e incremento de dímero D en 100% de los casos20. Finalmente, el estudio de Zhou y cols. reporta que de 191 pacientes con COVID-19, el 31% presentó elevación de ALT > 40 U/L y el subgrupo que murió la elevó en 48% de los casos vs. 24% del grupo que sobrevivió (p = 0.0050)21. En este contexto, el reporte de un concentrado de 1,099 pacientes con COVID-19 encabezado por Guang y cols. reportaron que la elevación de AST > 40 U/L se observó en 39%, la de ALT > 40 U/L en 28% de la enfermedad grave. La elevación de AST se presentó en más del 50% y de ALT en 28% de los que requirieron UCI, ventilación mecánica y murieron22. En la tabla 1 se resumen las características de alteraciones de la química hepática y sus desenlaces.
Estudios que representan las principales características de alteraciones de la química hepática y desenlaces clínicos asociados
| Estudio /Journal | N = | Predictor de necesidad de UCI-gravedad | Predictor de mortalidad |
|---|---|---|---|
| Chen y cols. Lancet | 99 | AST | --- |
| Wang y cols. JAMA | 138 | AST (p = < 0.001) | --- |
| Guang y cols. NEJM | 1099 | AST (50%) y ALT (28%) | --- |
| Zhang y cols. medRxiv. | 82 | --- | AST (p = 0.002)ALT (p = 0.037) |
| Huang y cols. medRxiv. | 36 | --- | ?ALT en 13.3%?AST en 58%?Albúmina en 80%?Bilirrubinas en 13%?Dímero D en 100% |
| Zhou y cols. Lancet | 191 | --- | ALT >40 U/L en 48% de los que murieron |
Debido al problema de acceso para biopsias o estudios de autopsias, los hallazgos histopatológicos de esta nueva enfermedad aún no se definen del todo. Existe un caso reporte por Xu y cols.23 que presentan resultados de biopsias post-mortem de un hombre de 50 años que murió por síndrome respiratorio agudo grave por coronavirus (SARS-CoV-2). Respecto a las biopsias hepáticas se observó esteatosis micro vesicular y actividad inflamatoria portal y lobular leves, sin embargo queda la inquietud si el daño hepático observado es debido al SARS-CoV-2 o a lesión hepática idiosincrásica por fármacos (DILI), y esta última probabilidad diagnóstica sustentada por el uso de múltiples fármacos que se han utilizado de manera empírica en algunos casos para tratar pacientes graves de SARS-CoV-2 con gran potencial hepatotóxico por ejemplo, remdesivir, tocilizumab, cloroquina, estatinas, lo cual hace propenso al paciente con coronavirus de presentar DILI12. Otra deficiencia de este reporte de caso es que no conocemos ningún otro antecedente de comorbilidad para saber si pudiera tener riesgo de enfermedad hepática preexistente. Así pues, esto lanza la hipótesis de que estas aminotransferasas elevadas pudieran representar el efecto directo al hepatocito mediado por el virus o una lesión hepática mediada por activación inmune e inflamatoria asociada a la infección.
Se ha mencionado que un componente de la fisiopatología de COVID-19 es el trastorno en la coagulación. Las complicaciones trombóticas parecen surgir como un problema importante en pacientes con COVID-19. En informes preliminares iniciales sobre los resultados de esta pandemia se demostró que los pacientes infectados comúnmente desarrollaron trombocitopenia (36.2%) y elevación del dímero D (46.4%), sin embargo, estas cifras son más altas en pacientes con enfermedad grave (57.7% y 59.6%, respectivamente). Los datos anteriores sugieren que estos pacientes tienen el riesgo de desarrollar coagulación intravascular diseminada (CID). El aumento de los niveles de dímero D y de productos de degradación de la fibrina, y el tiempo prolongado de protrombina se han asociado con un mal pronóstico en pacientes afectados por este nuevo coronavirus24. Sin embargo, aún se desconoce si estos cambios hemostáticos son un efecto específico del SARS-CoV-2 o son una consecuencia de la tormenta de citocinas que precipita la aparición del síndrome de respuesta inflamatoria sistémica (SIRS), como se observa en otras enfermedades virales. Otra consideración que aún no se ha investigado es que los cambios hemostáticos observados con la infección por COVID-19 están relacionados con la disfunción hepática. Un estudio reciente informó tres casos con COVID-19 grave e infarto cerebral, uno asociado con isquemia bilateral de extremidades, en el contexto de anticuerpos antifosfolípidos elevados. Las deficiencias nutricionales y la disfunción hepática también pueden interferir con la producción de factores de coagulación25.
COVID-19 en el contexto del paciente con enfermedad hepática crónicaLa cirrosis hepática como un estado de inmunocompromisoEs conocido que los pacientes con cirrosis hepática (CH) están inmunocomprometidos y tienen mayor susceptibilidad de desarrollar infecciones bacterianas espontáneas, algunas de ellas por patógenos poco frecuentes, lo que se refleja en una mayor mortalidad que se aproxima al 30%26. Los pacientes con CH, especialmente en su etapa descompensada, son susceptibles al desarrollo de estas infecciones, cuya prevalencia puede aumentar hasta el 44%27.
De tal manera se reconoce que la CH es un estado de disfunción inmune que comprende inmunodeficiencia e inflamación sistémica. Esto caracteriza al menos dos fenotipos de disfunción inmune en cirrosis conocidos, el proinflamatorio e inmunodeficiente que se caracterizan por las diferencias en actividad de citocinas, actividad fagocítica, expresión de HLA, entre otros, y que se presentan a lo largo de los estadios fisiopatológicos desde etapas compensadas, descompensadas y hasta la insuficiencia hepática aguda sobre crónica (ACLF)28. Además, esta inmunodeficiencia resulta también en una síntesis reducida de receptores de reconocimiento de patrones (PRRs)29. Diferentes clases de PRRs codificados en líneas germinales reconocen patógenos invasores y monitorean los compartimentos extracelular e intracelular de las células huésped para detectar signos de invasión por microorganismos30. El hígado es la fuente principal de PRRs (proteína C reactiva, proteína de unión a lipopolisacáridos [LPS], proteína de reconocimiento de peptidoglicano, CD14 soluble), que activan el complemento, inducen la opsonización y regulan la función celular inmune. Los hepatocitos sintetizan y secretan la mayoría de estas proteínas en respuesta a diferentes citoquinas pro-inflamatorias (TNFa, IL-6), generadas en el curso de una respuesta inflamatoria sistémica. Existen otros PRRs que se expresan para reconocer diferentes moléculas bacterianas y virales, entre los cuales están los receptores endosomales toll-like (TLRs). Los subtipos TLR2, TLR4, TLR5, TLR6 se expresan en todos los tipos de células hepáticas y participan en la captación y eliminación de endotoxinas, así como en la producción de citocinas28,31,32.
Cirrosis hepática e infecciones respiratoriasA lo largo de la historia, han existido brotes y epidemias de enfermedades virales, principalmente respiratorias, causadas por virus. La más reciente de ellas es la pandemia relacionada a COVID-19. Los pacientes con enfermedad hepática crónica (EHC) tienen una disfunción inmune multifactorial33,34. Debido a que el sitio de infección tiene impacto en el pronóstico en pacientes con EHC, las enfermedades respiratorias agudas adquieren gran trascendencia, ya que aumentan casi 40 veces la tasa de hospitalizaciones que en población general34, además incrementan 2.95 veces la mortalidad a 30 días en el contexto comunitario y hasta 11 veces en el contexto intrahospitalario, constituyendo la más alta entre las complicaciones infecciosas aisladas33. La prevalencia reportada en el 2009 en Estados Unidos para neumonía fue de 0.38% y de influenza es de 0.027%34. Como es esperado, los pacientes con mayor grado de descompensación muestran la mayor mortalidad en este tipo de eventos, siendo factores asociados el uso inadecuado de antibióticos, bacteriemia, conteo leucocitario, bilirrubinas totales y edad más avanzada, etiología alcohólica de la enfermedad, además del desarrollo de fallas orgánicas e insuficiencia hepática aguda sobre crónica (ACLF) y ACLF33. Modelos desarrollados durante brotes comunitarios de enfermedad tipo influenza indican aumento en la morbilidad y mortalidad en pacientes con EHC, principalmente relacionados a falla orgánica y complicaciones afines a la enfermedad hepática, como hemorragia digestiva35.
Los pacientes con EHC son propensos al desarrollo de insuficiencia respiratoria por múltiples causas; además pueden contar con modificadores de las enfermedades que agravan su historia natural, tales como tabaquismo, enfermedad pulmonar obstructiva crónica, desnutrición, desacondicionamiento y desgaste muscular, hipoalbuminemia, coagulopatía, requerimientos transfusionales altos, etc. Aunado a ello, la ascitis afecta directamente la mecánica respiratoria y pulmonar al aumentar la presión intraabdominal y la encefalopatía hepática aumenta el riesgo de microaspiraciones y tos inefectiva36. Por lo tanto, hasta 70% de los pacientes con EHC pueden cursar con hipoxemia arterial. Un evento de ventilación asistida en pacientes con cirrosis, especialmente en el contexto de SIRA tiene mortalidad del 59% al 100% en medios hospitalarios sin trasplante36. La mortalidad en pacientes con EHC en unidades de terapia intensiva es de 46-90%. En el contexto de SIRA, tal pronóstico parece estar más relacionado con el desarrollo de falla orgánica extrapulmonar que con la hipoxemia misma37.
Algunos de los factores que modifican el pronóstico de pacientes hospitalizados con enfermedades respiratorias agudas son los inherentes a la EHC, como son las alteraciones en la presión portal que lleva a complicaciones relacionadas con la hipertensión portal, tales como hemorragia digestiva variceal, ascitis y encefalopatía hepática, etc.; además de aumento en la tasa de sobreinfección o reactivación de enfermedades virales hepáticas. La translocación bacteriana del intestino a los ganglios linfáticos mesentéricos y/o extraintestinales es la clave para el desarrollo de infecciones bacterianas espontáneas en cirrosis hepática, incluso en ausencia de infecciones bacterianas clínicamente evidentes, se presenta hasta en el 30% de los pacientes con cirrosis descompensada, empeora el pronóstico y eleva la mortalidad38. La mortalidad acumulada después de cualquier infección en pacientes con cirrosis es del 43.5%, mientras que la mortalidad sin infección es sólo del 13.6%39. A esto se debe aunar los desenlaces a corto y largo plazo que ocurren posteriores a un evento de insuficiencia respiratoria aguda, especialmente cuando existe requerimiento de ventilación mecánica, que en general son más negativos que en pacientes con cirrosis sin estas condiciones40.
COVID-19 en pacientes con EHCLos primeros reportes acerca de las características de los pacientes con COVID-19 surgieron, por cuestiones epidemiológicas, de China. En el reporte inicial de una población de ese país, se reportaron los datos de 1,099 pacientes, de los cuales 23 tenían infección crónica por virus de la hepatitis B (VHB)22. Los casos graves tenían más probabilidad de tener VHB, como antecedente, que casos no graves41. Otro reporte de Wuhan, China, incluyó cuatro pacientes (de 138) con EHC, ninguno de los cuales tuvo requerimiento de ingreso a terapia intensiva. La experiencia más actualizada de pacientes con cirrosis hepática descompensada en el Hospital Renmin de la Universidad de Wuhan, China, reportó datos de 111 pacientes, con media de edad de 58.7 años, de los cuales 82 fueron ambulatorios y 29 hospitalizados42. En los datos publicados hasta ahora, de 1,591 pacientes críticos de Lombardía, Italia, se reportó EHC en 3% de ellos43.
Hasta el 05 de mayo del 2020, en el registro combinado de SECURE-Cirrhosis (una plataforma abierta en la que se reportan los casos de forma voluntaria para China, Japón, Corea y América) y COVID-HEP Registry (capta los casos del resto del mundo), se han reportado 426 casos (64.2% hombres, edad promedio 59 años) de COVID 19 en pacientes con EHC en 25 países. De estos, 185 casos presentaron cirrosis de los cuales 24% tuvieron internamiento en terapia intensiva, 15% requirieron ventilación mecánica y 37% (n = 68) fallecieron. El 82% de las causas de fallecimiento fueron problemas pulmonares, 7% por choque cardiogénico y 11% por descompensación de la hepatopatía. En esta misma base se reportan 176 pacientes con EHC sin cirrosis y COVID19 cuya mortalidad fue de 6% y 58 pacientes trasplantados, en los cuales la mortalidad reportada fue del 22%44,45. En el reporte de morbilidad y mortalidad semanal al 28 de marzo del 2020 emitido por los Centros para el Control y la Prevención de Enfermedades (CDC) se observó que de los 7,162 pacientes con COVID-19 que también tuvieron una enfermedad subyacente, 41 (0.6%) contaban con EHC, 16 de ellos hospitalizados, siete de los cuales ingresaron a terapia intensiva. Cabe destacar que dichos resultados también son considerados como preliminares, ya que no se cuenta aún con la información de todos los contagiados en Estados Unidos46. De igual manera, el reporte del Centro Nacional de Auditoría e Investigación de Cuidados Intensivos (ICNARC) del Reino Unido, reporta al 27 de marzo del 2020, tres de 775 pacientes incluidos en dicha base de datos, con comorbilidad hepática grave47. En México, aún no se ha publicado la epidemiología ni experiencia en pacientes con EHC.
Recomendaciones de cuidado de pacientes con EHCLos pacientes con EHC deben seguir las recomendaciones generales que se han emitido para la población general. Con el objetivo de protegerse y proteger a los demás, se ha recomendado mantenerse en su domicilio en la medida de lo posible y salir sólo ante uno de los siguientes escenarios:
- 1.
Compras de productos de necesidad básica (medicamentos y comida), en intervalos de tiempo lo más prolongados posible. Si existe alguien más en el domicilio capaz de realizar esta acción, se recomienda delegarlo a la persona menos susceptible.
- 2.
Actividad física al aire libre una vez al día, de preferencia solo.
- 3.
Necesidad de recibir o brindar atención de cuidados. Se sugiere, en caso de ser posible, otorgar o recibir atención médica por medios a distancia (teléfono, videollamada, etc.).
- 4.
Desplazarse del domicilio al lugar de trabajo, si no es posible realizarlo desde casa.
Además, se deben seguir recomendaciones de higiene estándar, tales como:
- 1.
Lavado de manos frecuente con agua y jabón por al menos 40 segundos. Como alternativa se pueden utilizar soluciones alcoholadas por 20 segundos en caso de no disponer de jabón y agua.
- 2.
Evitar contacto con personas ajenas, sobre todo si presentan síntomas respiratorios o han estado en contacto con alguien con dichos síntomas.
- 3.
Higiene al toser y estornudar, realizándolo sobre el pliegue del codo o un pañuelo desechable.
- 4.
Evitar contacto con superficies no sanitizadas. También, limpiar frecuentemente superficies y objetos de trabajo o en su domicilio.
- 5.
Uso de cubrebocas casero o desechable simple (fig. 2).
Las recomendaciones acerca del cuidado de la enfermedad se mantienen, haciendo énfasis en no escatimar en la necesidad de acudir a un centro médico de urgencias no respiratorias en caso de requerirlo. Debido al impacto que puede generar el distanciamiento social y el aislamiento en casa, el apoyo social, médico y psicológico durante el período de estancia en el domicilio es de suma importancia, tanto para evitar transgresiones a la terapia, como para evitar que los pacientes con EHC relacionada al consumo de alcohol recaigan en el consumo de esta sustancia. Es recomendable de igual manera, orientar a los pacientes a mantenerse informados de los cambios en recomendaciones y políticas sociales, además de educarlos en no consumir sustancias o medicamentos no prescritos, suplementos o productos alternativos como medida de «prevención» o «reforzamiento del sistema inmune», etc. También es esencial, ya que se desconoce la duración de la pandemia, recomendar que los esquemas de inmunización para influenza sean completados por este tipo de pacientes en los siguientes meses.
Para la práctica médica, el estándar de cuidado de pacientes hospitalizados por causas NO-COVID-19 se mantiene de la misma manera, con algunas recomendaciones en cuanto a la selección de procedimientos para realización urgente o electiva que se resumen en la tabla 2. Asimismo, a pesar de que no se cuenta con un tratamiento estandarizado para el manejo de COVID-19 en pacientes graves, se deben tomar en cuenta las implicaciones para la salud hepática que se resumen en la tabla 3.
COVID-19 y EHC: Procedimientos de urgencia (U) o electivos (E). AFP: alfa feto proteína, TIPS: derivación transyugular intrahepática portosistémica
| Procedimiento | E | U | Sugerencia |
|---|---|---|---|
| Endoscopía de escrutinio para várices esofágicas | x | Conteo de plaquetas y elastografía (Baveno VI), retirar agresor hepático, datos de alarma, considerar iniciar beta-bloqueador | |
| Endoscopía de vigilancia (posterapia de ligadura/inyección/profilaxis secundaria) | x | Datos de alarma, optimización de beta-bloqueador, inhibidor de bomba de protones posterior a la primera ligadura, realizar si hay intolerancia a beta-bloqueador | |
| Endoscopía en un evento de hemorragia digestiva | x | Manejo farmacológico concomitante, manejo hemodinámico, realizar dentro de las primeras 24 horas, antibioticoterapia profiláctica por cinco días, egreso hospitalario oportuno | |
| Ultrasonido abdominal de escrutinio de hepatocarcinoma | x | Medición de AFP | |
| Ultrasonido abdominal en caso de descompensación (ascitis/ictericia nueva) | x | Medidas de distanciamiento, utilización de cubrebocas, lavado de manos, no tocar superficies en la medida de lo posible, realizar en instalaciones extrahospitalarias | |
| Paracentesis diagnóstica (descompensación) | x | Acompañar el resto del abordaje en descompensación | |
| Paracentesis de gran volumen (asintomático/respondedor a diuréticos) | x | Optimizar dosis de diuréticos vigilando función renal y peso | |
| Paracentesis de gran volumen (intratable/restricción respiratoria u otros síntomas) | x | Medidas de distanciamiento, utilización de cubrebocas, lavado de manos, no tocar superficies en la medida de lo posible, realizar en instalaciones extrahospitalarias | |
| Toracocentesis (hidrotórax hepático) | x | Medidas de distanciamiento, utilización de cubrebocas, lavado de manos, no tocar superficies en la medida de lo posible, realizar en instalaciones extrahospitalarias | |
| TIPS | x | Optimización de manejo farmacológico |
Medicamentos en COVID-19 y enfermedad hepática. Fuente: LiverTox.nih.gov
| Grupo | Fármaco | Hepatotoxicidad |
|---|---|---|
| Antivirales | Cloroquina / Hidroxicloroquina | Ocasionalmente se han relacionado con elevación de transaminasas o daño hepático agudo clínicamente aparente. Metabolismo hepático menor al 30%. |
| Lopinavir/ritonavir | Lopinavir: Metabolismo hepático a través del citocromo P450 (CYP3A4). Elevación de aminotransferasas hasta > 5 veces el LSN en 3-10% de los pacientes, con tasas más altas observadas en pacientes con coinfección por VIH-VHC. Usualmente autoilimitado.Ritonavir: Metabolismo hepático a través del citocromo P450 (CYP3A4). Elevación de aminotransferasas hasta >5 veces el LSN en 15% de los pacientes, con tasas más altas observadas en pacientes con coinfección por VIH-VHC.En dosis plenas puede causar agudizaciones de hepatitis crónicas | |
| Remdesivir | No datos en livertox | |
| Antibióticos | Azitromicina | Relacionado con una tasa baja de elevación de aminotransferasas de forma aguda, transitoria y asintomática en pacientes con tratamientos a corto plazo (1-2%) pero elevada en pacientes con tratamientos a largo plazo. El mecanismo de daño es desconocido, pero se sugiere que es por causa de hipersensibilidad, causando un patrón histológico de hepatitis colestásica. |
| Inmunomoduladores | Tocilizumab | Elevación de aminotransferasas en 10-40% de los pacientes incluidos en ensayos clínicos. Las elevaciones fueron de 1-5 veces el LSN, probablemente dosis-dependiente. Posterior a su comercialización se han reportado casos de daño hepático clínicamente aparente con ictericia. El daño es predominantemente hepatocelular sin características inmunoalérgicas ni autoinmunes.Metabolismo hepático mínimo, su mecanismo de daño es desconocido, pero se cree que está relacionado a sus efectos en el sistema inmune o la vía de IL-6 (importante en la regeneración hepática). |
| Sarilumab | Elevación de aminotransferasas 4-5 veces más frecuente que con placebo en ensayos clínicos (4-5% de los pacientes). Elevación leve de bilirrubinas. Sin reporte de daño hepático clínicamente aparente con cuadros autolimitados. Se sospecha que puede predisponer a reactivación de hepatitis. Metabolismo hepático mínimo, su mecanismo de daño es desconocido, pero se cree que es relacionado a su efecto en el sistema inmune o la vía de IL-6. |
De acuerdo con lo que se reporta en la literatura mundial, las manifestaciones hepáticas del SARS-CoV-2 son comunes y alteraciones más graves se asocian con peor pronóstico. Si bien, en nuestro país la presencia de casos graves está iniciando, es importante tomarse en cuenta las manifestaciones hepáticas en la población general para poder reconocer los casos que potencialmente pudieran requerir hospitalización oportuna. Por otro lado, la infección por COVID en pacientes con EHC preexistente implicará un mayor riesgo y probabilidad de disfunción hepática, por lo que se recomienda que los profesionales de la salud a cargo de estos pacientes estén atentos al desarrollo de potenciales complicaciones. Si bien, se podría cuestionar la utilidad de las estrategias propuestas en este documento, sin embargo, en una enfermedad emergente de la envergadura de la actual, sería imposible dar recomendaciones probadas al 100%. La enfermedad, su comportamiento y la información reportada han sido dinámicos en los últimos meses, por lo que no deben considerarse definitivas e inamovibles, haciendo una invitación a la permanente actualización respecto a los temas relacionados en beneficio de los pacientes con cirrosis hepática. También es importante reconocer que se necesitan más estudios y en diversas poblaciones para poder finalmente conocer por completo la morbimortalidad asociada a SARS-CoV-2 en el paciente cirrótico.
FinanciaciónEste documento no recibió ningún tipo de financiamiento.
Conflictos de interesesDr. José Antonio Velarde Ruiz Velasco ha sido ponente de Takeda y Gilead.
Dr. José María Remes-Troche: es miembro del Consejo Asesor de Takeda y Asofarma. Recibió fondos para la investigación por Sanfer y Asofarma. Ponente para Takeda, Asofarma, Alfa-Wassermann, Carnot, Menarini y Astra-Zeneca.
El resto de los autores declaran no tener conflicto de intereses para la realización de este manuscrito.