El linfoma gástrico primario (PGL) es un tumor poco frecuente que representa del 4% al 20% de todos los linfomas no Hodgkin y el 5% de las neoplasias gástricas primarias1. Actualmente la cirugía se recomienda solo como tratamiento urgente para pacientes que presentan perforación o hemorragia grave y como tratamiento paliativo2-5. La perforación gástrica espontánea en ausencia de quimioterapia es extremadamente rara4. Presentamos un caso de linfoma B difuso de células grandes gástrico que requirió tratamiento quirúrgico al reunir 2características que hacían fundamental la intervención quirúrgica: encontrarse perforado y tener obstrucción de la salida gástrica.
Paciente masculino de 36 años de edad, con antecedente de padre finado a los 31 años por cáncer gástrico, sin otros antecedentes personales patológicos de importancia. Inicia su padecimiento actual un mes previo a su ingreso, con intolerancia progresiva a la vía oral, náuseas y vómito de contenido alimentario, además de dolor ocasional de tipo cólico en epigastrio. Por ello, se realizó endoscopia, que reportó gastropatía erosiva crónica, lesión infiltrante en antro, estenosis de píloro debido a lesión; se realizó toma de biopsias.
Sin embargo, 7 días antes de su ingreso presentó dolor abdominal de tipo cólico, en epigastrio, de intensidad 10/10, sin irradiaciones, sin exacerbantes ni atenuantes, motivo por el que se decidió su hospitalización; sus laboratorios reportaron anemia severa y leucocitosis. Como parte de su protocolo de estudio se realizó tomografía abdominal, que reportó presencia de engrosamiento de la pared del antro gástrico de hasta 20mm, adenopatías en el bulbo duodenal y antro gástrico emplastronado hacia hígado y vesícula biliar.
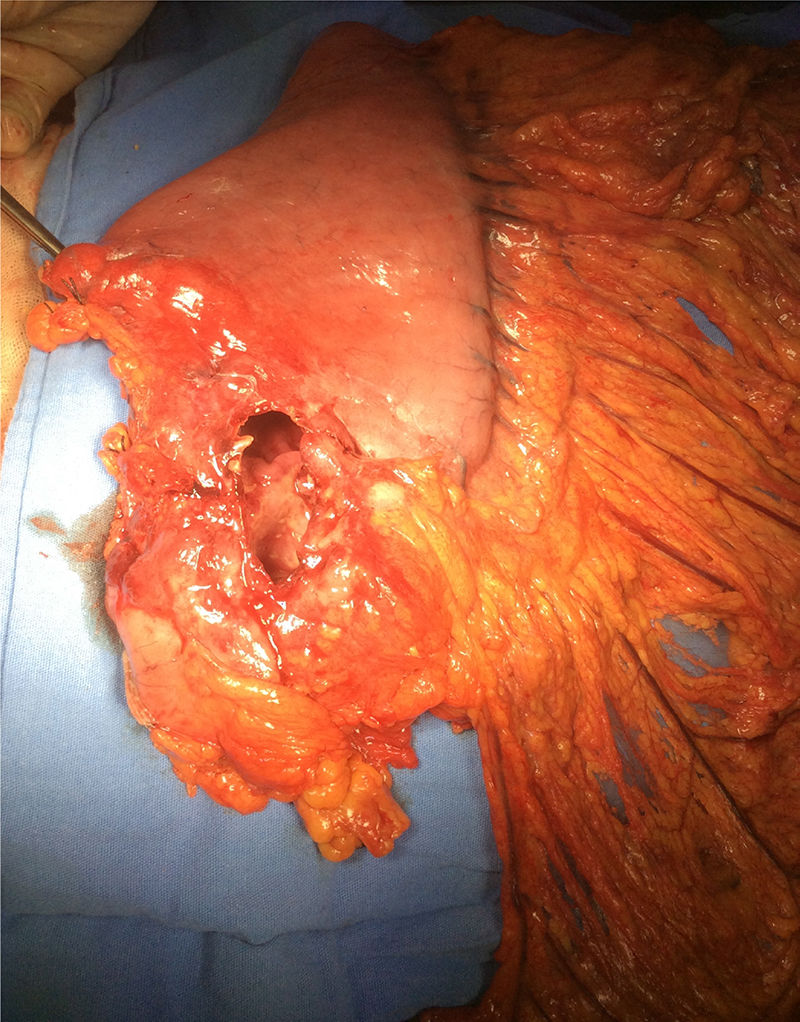
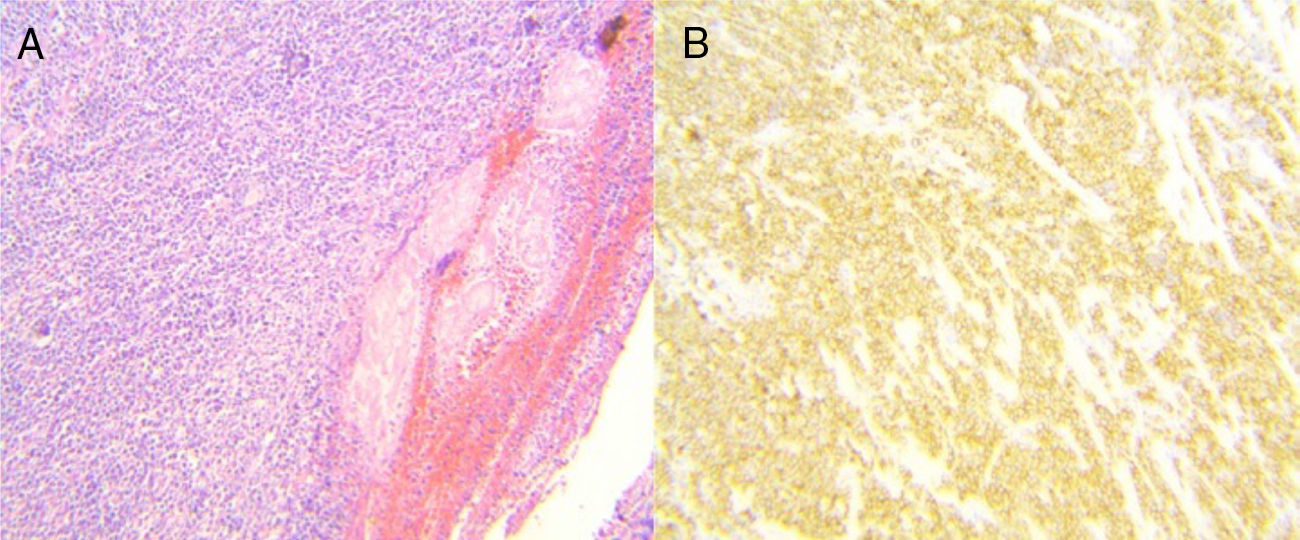
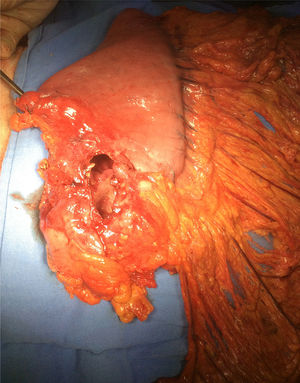
Se programó para procedimiento quirúrgico. Se encontraron los siguientes hallazgos: engrosamiento de la pared de antro gástrico, el cual se encontraba ulcerado, perforado y sellado hacia hígado y vesícula biliar (fig. 1). Se realizó gastrectomía subtotal, colecistectomía y toma de biopsia hepática en sitio de probable invasión tumoral por contigüidad en segmento V. Se envió muestra a transoperatorio y definitivo, con reporte histopatológico de linfoma B difuso de células grandes gástrico ulcerado y perforado (fig. 2 A-B). La adecuada evolución posquirúrgica posibilitó que el paciente fuera egresado para continuar seguimiento y tratamiento por consulta externa.
El sitio más común de linfoma no Hodgkin extranodal primario es el estómago. En el 40% de los casos, se presenta como tejido linfoide asociado a la mucosa de bajo grado (MALT) y en el 60% como linfoma difuso de células B grandes y de alto grado (DLBCL)1,6. El linfoma gástrico primario a menudo se presenta con síntomas inespecíficos, y el diagnóstico a menudo se retrasa. El dolor abdominal inespecífico (50%) y la dispepsia (30%) son las presentaciones más comunes. Los síntomas B (fiebre, sudor nocturno y pérdida de peso) son poco comunes, en contraste con los linfomas ganglionares; por lo tanto, el diagnóstico podría retrasarse7. Los estudios de imagen pueden mostrar engrosamiento en la pared: por lo general, es difícil diferenciarlo por este medio de otros tipos de cáncer gastrointestinal. La endoscopia y la biopsia son los métodos más confiables para confirmar el diagnóstico8.
Hoy en día, el tratamiento del linfoma gástrico primario se ha desplazado de la cirugía hacia los regímenes de quimioterapia. La cirugía ya no es la piedra angular del tratamiento: ahora se limita a casos de perforación, hemorragia u obstrucción debido al tumor1,3,4.
En este contexto, los pacientes con linfoma gástrico primario difuso de células B relacionado con Helicobacter pylori (H. pylori) y características favorables son elegibles para la erradicación de bacterias como tratamiento exclusivo, manteniendo la quimioinmunoterapia convencional para pacientes que no responden3. El tratamiento varía con la histología del linfoma maligno. Se sabe que estas células tumorales son CD20 positivas. Rituximab es un anticuerpo anti-CD20 y es altamente efectivo en DLBCL nodal1. La quimioterapia de primera línea para DLBCL del estómago es CHOP, con rituximab o sin él9.
La causa de la perforación del linfoma gástrico en los casos que reciben quimioterapia es diferente de la de aquellos casos que no la recibieron. Las causas de la perforación en pacientes que reciben quimioterapia son el debilitamiento del tejido gástrico asociado con la necrosis tumoral rápida y la lisis tumoral debida a la quimioterapia. Por otro lado, hay 2patrones diferentes de perforación espontánea. Primero, la perforación espontánea resulta de una úlcera y necrosis tumoral que ha alcanzado la subserosa. En segundo lugar, la perforación es el resultado de una úlcera que tiene un tejido conjuntivo delgado con ausencia de tumor10.
En resumen, el mejor tratamiento debe elegirse de acuerdo con la ubicación, el estadio clínico, el patrón patológico y la presencia o ausencia de complicaciones. La supervivencia global a 5 años entre el 50 y el 70% se informa con terapia multimodal1,7.
La frecuencia de presentación clínica de un linfoma gástrico complicado por obstrucción y perforación es extremadamente baja y, a pesar de que la cirugía ya no constituye un pilar en el tratamiento de esta entidad, en este tipo de complicaciones el realizar una gastrectomía con reconstrucción es lo indicado, además de la terapia médica adyuvante.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos autores declaran que no han recibido financiación para la realización del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés para la realización de este trabajo.