El cáncer colorrectal (CCR) es uno de los más prevalentes en el mundo y contribuye significativamente a las muertes relacionadas con el cáncer. La mayoría de los casos surgen de pólipos adenomatosos. Actualmente, los biomarcadores desempeñan un papel importante en la progresión tumoral. Nuestro objetivo fue identificar mastocitos perivasculares y analizar la expresión de laminina-332, MMP-9 y VEGF en casos humanos de adenoma y CCR.
Materiales y métodosLos pacientes fueron seleccionados en el servicio de coloproctología y las muestras se obtuvieron mediante biopsias. Las laminillas de adenoma y CCR se examinaron mediante inmunohistoquímica para detectar moléculas y se procesaron con azul alcián al 1% (pH 0.5) para la tinción de mastocitos.
ResultadosSe observó una mayor densidad de mastocitos perivasculares en los adenomas. La expresión de laminina-332 reveló discontinuidad de la membrana basal asociada con la invasión tumoral en el CCR. Se detectó inmunotinción de MMP-9 en el adenoma en epitelios glandulares y de revestimiento en áreas cercanas a la membrana basal, mientras que en el CCR la enzima se encontró en el citoplasma de grupos invasivos. La expresión de VEGF se asoció con atipia celular en el adenoma y en áreas de desorganización de la interfaz entre el epitelio y el tejido conectivo en el CCR. Se ha detectado VEGF en células endoteliales de microvasos.
ConclusionesDemostramos los diferentes patrones de mastocitos perivasculares y expresión molecular en neoplasias colorrectales. Estos análisis favorecen el reconocimiento de la predisposición o estadio temprano de la enfermedad y tienen el potencial de definir el perfil molecular de las lesiones.
Colorectal cancer (CRC) is one of the most prevalent cancers worldwide, and significantly contributes to cancer-related deaths. Most cases arise from adenomatous polyps. Biomarkers currently play an important role in tumor progression. Our aim was to identify perivascular mast cells and analyze the expression of laminin-332, MMP-9, and VEGF in cases of adenoma and CRC in humans.
Materials and methodsPatients were selected at the Coloproctology Service and samples were obtained through biopsies. Adenoma and CRC slides were examined, utilizing immunohistochemistry to detect molecules, and were processed, using 1% Alcian Blue (pH .5) for mast cell staining.
ResultsHigher density of perivascular mast cells was observed in adenomas. Laminin-332 expression revealed basement membrane discontinuity associated with tumor invasion in CRC. MMP-9 immunostaining in adenoma was detected in glandular epithelium and lining epithelium, in areas close to the basement membrane, whereas in CRC, the enzyme was found in the cytoplasm of invasive clusters. VEGF expression was associated with cell atypia in adenoma and in areas of disorganization of the epithelium-connective tissue interface in CRC. VEGF has also been detected in endothelial cells from microvessels.
ConclusionsWe demonstrated the different patterns of perivascular mast cells and molecular expression in colorectal neoplasms. Those analyses favor the recognition of the predisposition to the disease, or its early stage, and have the potential to define the molecular profile of the lesions.
El cáncer colorrectal (CCR) es el tercer tipo de cáncer más común en hombres y mujeres1. La mayoría de los casos surgen de pólipos adenomatosos, y en conjunto con aspectos clínicos y nutricionales, la expresión de diferentes moléculas y cambios en el microambiente desempeñan un papel importante en la tumorogénesis del CCR2,3.
El factor de crecimiento endotelial vascular (VEGF por sus siglas en inglés) desempeña un papel crucial en la angiogénesis, lo cual es responsable del suministro nutricional de las células neoplásicas proliferantes, lo que a su vez ofrece condiciones favorables para la diseminación metastásica4,5. En el sistema inmunológico los mastocitos están relacionados con la progresión neoplásica, incluida la promoción de la angiogénesis6. Al ser liberado por células cancerosas, el VEGF estimula la migración de mastocitos hacia zonas hipóxicas y la producción de factores estimula la infiltración de más mastocitos7.
Las metaloproteinasas de la matriz extracelular (MMP, por sus siglas en inglés) son proteinasas que están involucradas en el proceso de remodelación y degradación de la matriz extracelular (MEC). Son liberadas por varias células de defensa y por células tumorales en respuesta a una variedad de estímulos8. Las MMP (como la MMP-2 y MMP-9) están involucradas en el inicio del cáncer, además de invasión y metástasis. La degradación de la membrana basal, con la generación de laminina-332 y fragmentos de colágeno tipo iv, resulta en pérdida de adhesión celular y formación de metástasis9,10. La expresión de MMP-9 aumenta considerablemente en neoplasias, lo cual muestra una importante acción proteolítica11,12.
La laminina-332 es una glucoproteína compuesta de 3 cadenas (α3β3γ2) y ofrece apoyo a las células que son fuente de citocinas y factores de crecimiento. La laminina-332 realiza varias funciones en la homeostasis epitelial normal, como la inducción y manutención de la polaridad, la adhesión, la proliferación y la diferenciación celular, además de apoyar la reparación del tejido epitelial13. Hay estudios que han demostrado la expresión de fragmentos de laminina-332 en cáncer humano, como una indicación de mal pronóstico e inducción de migración14,15.
Por lo tanto, el objetivo de este estudio fue evaluar la presencia de mastocitos perivasculares y la expresión de VEGF, MMP-9 y de cadena γ2 de laminina-332 en adenomas humanos y CCR dentro del proceso de tumorogénesis colorrectal.
Materiales y métodosSe realizó un estudio retrospectivo, descriptivo y comparativo. Los pacientes atendidos en el servicio de coloproctología en un hospital en Brasil entre 2014 y 2016 fueron seleccionados. Todos los pacientes se sometieron a una colonoscopia y no hubo cambios en el protocolo de atención. Las muestras fueron obtenidas de biopsias por incisión y escisión de lesiones en el colon con sospecha de adenoma o CCR. Las laminillas fueron preparadas y asignadas por el laboratorio de anatomía patológica en colaboración con el servicio de coloproctología. Los criterios de inclusión fueron los siguientes: perfil clínico, disponibilidad de datos de la lesión (diagnóstico histopatológico) y tejido suficiente para realizar los análisis.
Análisis histoquímicos e inmunohistoquímicosSe utilizaron anticuerpos de laminina-332 de ratón de cadena anti-γ2 (clon B-2: sc-25341, Santa Cruz Biotechnology, Santa Cruz, CA), a dilución de 1:100, anti-MMP-9 de conejo (molécula completa-ab 38898, Abcam), a dilución de 1:500 y anti-VEGF de conejo (ab46154, Abcam), a dilución de 1:500, para detectar la cadena γ2 de laminina-332, MMP-9 y VEGF, respectivamente. Laminillas de 3μm fueron desparafinadas y rehidratadas, tras lo cual se utilizó un buffer de citrato (pH 6.0) por 30min a 93° para recuperación antigénica inducida por calor de la cadena γ2 de laminina-332 y MMP-9 de las laminillas incubadas. Las laminillas de VEGF fueron pretratadas en buffer Tris-EDTA pH 9.0 a 95° por 20min. Las secciones fueron a continuación tratadas con solución bloqueadora de proteína (DPB-125) (Spring Bioscience, California, EE. UU.) por 10min a temperatura ambiente e incubadas con el anticuerpo primario respectivo en una cámara humidificada a 4°C durante la noche. Las peroxidasas endógenas fueron bloqueadas con bloqueador de peróxido de hidrógeno (DHP-125) (Spring Bioscience) por 10min. La inmunodetección fue realizada con un antígeno inmunoenzimático libre de biotina (Reveal System, SPB-999) (Biogen, Sao Paulo, Brasil). Las secciones fueron incubadas con reactivo de complemento (DCMT-999) (Spring Bioscience) por 10min y después con conjugado de peroxidasa de rábano (HRP) por 15min. La inmunorreactividad fue visualizada utilizando 3.3′-diaminobencidina (DAB) (DABC-004 y DABS-125) (Spring Bioscience) como cromógeno. Finalmente, las laminillas fueron ligeramente contrateñidas con hematoxilina de Mayer. Tras ser lavadas en agua y deshidratadas en series de alcohol, las laminillas se limpiaron con xileno y fueron montadas con dibutilftalato poliestireno xileno (DPX) (Sigma-Aldrich, Darmstadt, DE). Las laminillas fueron completamente lavadas con PBS durante el proceso de inmunohistoquímica, y se realizaron controles negativos omitiendo el anticuerpo primario. Se realizó tinción con azul alcián al 1% (pH 0.5) para el análisis de mastocitos perivasculares. Para el control positivo utilizamos tejido de mucosa colorrectal normal obtenido durante la colonoscopia.
Análisis microscópicoLas secciones fueron analizadas en busca de información clínica y evaluadas en ciego por parte de un solo investigador utilizando un microscopio PrimoStar con una cámara digital Zeiss AxioCam ERC5s (Carl Zeiss Vision GmbH0) (Carl Zeiss, Oberkochen, DE) y software de imagen AxioVision 4.2 versión 4.8.2 (Carl Zeiss Vision GmbH) (Carl Zeiss). Para la tinción de los mastocitos solamente se cuantificaron las células cercanas (<0.5mm) a vasos. Se estableció la densidad de mastocitos por vaso (M/V) y se definieron grupos como<1M/V y ≥1M/V. Se observaron un total de 5 y 10 campos en el adenoma y el CCR, respectivamente. La expresión de la cadena γ2 de laminina-332 fue evaluada de acuerdo con los sitios del tejido: membrana basal y compartimento epitelial. En la tinción de membrana basal se consideró ausencia y continuidad. Respecto a MMP-9 y VEGF el índice de etiquetado fue definido en el parénquima (epitelio glandular o de revestimiento) y células estromales. Todas las laminillas fueron evaluadas a una magnificación de ×40 y ×100.
Análisis estadísticoLa prueba de Chi cuadrado y exacta de Fisher fueron utilizadas para el análisis de mastocitos perivasculares de las células positivas/negativas cercanas a los vasos y M/V. Los resultados fueron considerados significativos con un valor de p<0.05. El software GraphPad Prism 5 (GraphPad Software, San Francisco, CA, EE. UU.) fue utilizado para el análisis estadístico.
Consideraciones éticasEl presente estudio cumplió con todos los códigos de investigación con humanos, de acuerdo con la Declaración de Helsinki y fue aprobado por el Comité de Ética del hospital (número de proceso 406.002). Todos los pacientes estuvieron de acuerdo en participar y firmaron consentimientos informados por escrito.
ResultadosUn total de 66 pacientes fueron seleccionados: 58 casos de adenoma (87.88%) y 8 casos de CCR (12.12%). Respecto al grado tumoral y de displasia, la mayoría de las lesiones por adenoma fueron clasificadas como tubulares (82.92%) y presentaron displasia de bajo grado (85.36%); solamente el 9.75% fue clasificado como tubulopapilar y el 7.33% como serrado.
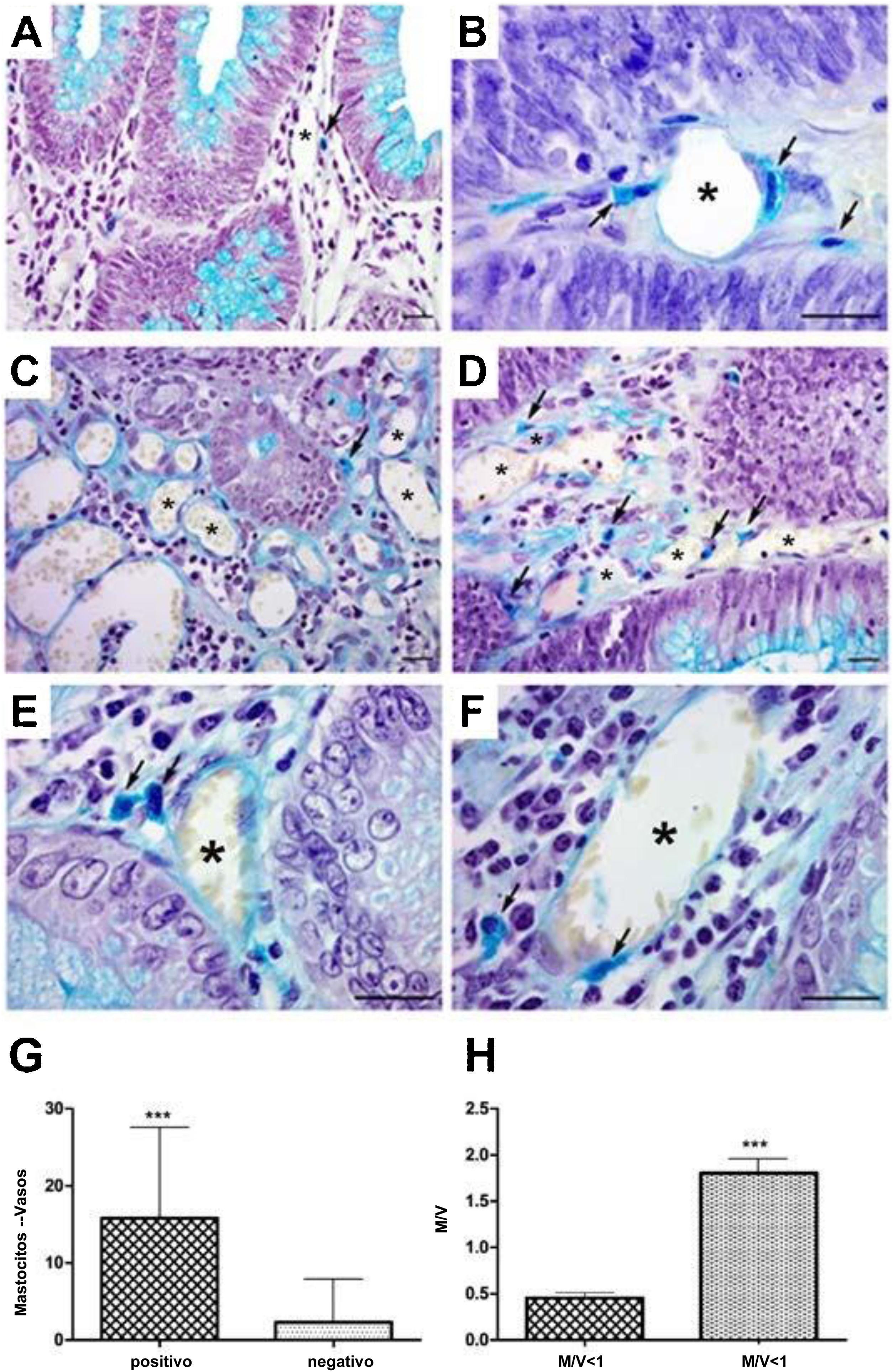
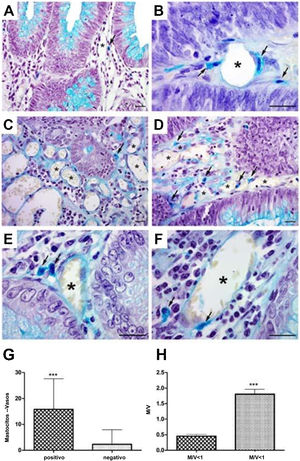
En el análisis de los mastocitos perivasculares las muestras de adenoma mostraron células aisladas en la pared vascular (fig. 1A), al igual que grupos de células alrededor del vaso (fig. 1B [flechas]). En el CCR se pudieron observar mastocitos aislados (fig. 1C [flecha]), en grupos (fig. 1D [flechas]) y en la pared vascular (fig. 1E y 1F [flechas]). El análisis cuantitativo mostró una correlación positiva entre la presencia de mastocitos cercanos a los vasos (p<0.001) (fig. 1G) y alta densidad celular (M/V) (p<0.001) en las muestras de adenoma (fig. 1H).
Mastocitos perivasculares en las neoplasias. A) Mastocitos en vasos pequeños cerca del epitelio glandular. B) Mastocitos cerca y dentro de la pared vascular (flechas) en adenoma. C) Distribución de mastocitos en cáncer colorrectal aislado (flecha) y D) en grupo (flechas). E) Presencia de mastocitos cerca de vasos (flechas) y F) en la pared (flechas).
Tinción azul alcián; barra de escala=20μm.
G) Análisis cuantitativo que muestra correlación positiva entre mastocitos cercanos a vasos y H) densidad de mastocitos en muestras de adenoma.
M/V: mastocito/vaso; media: 0.44 (<1M/V), 1.90 (≥1M/V); desviación estándar: 0.25 (<1M/V), 0.91 (≥1M/V).
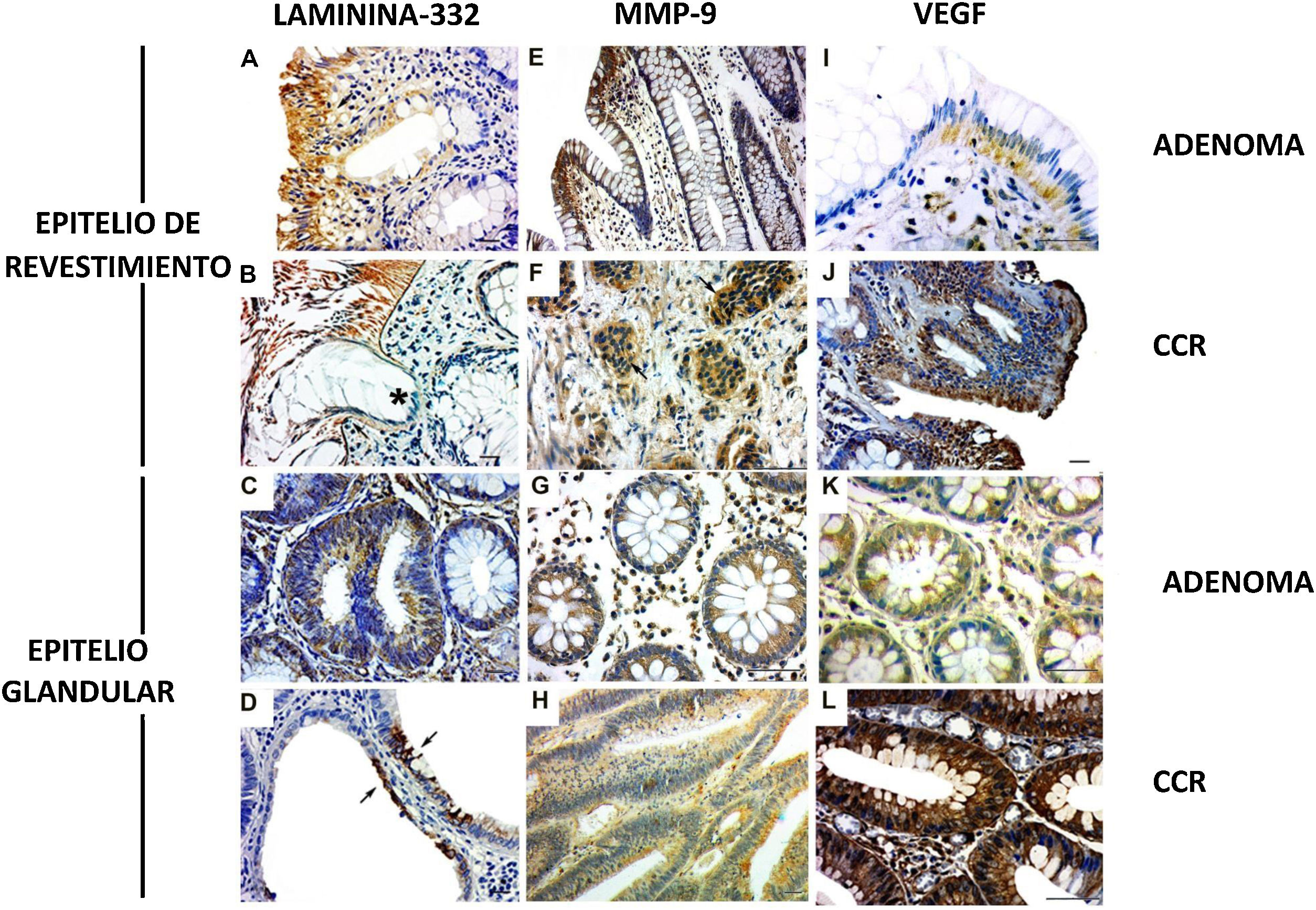
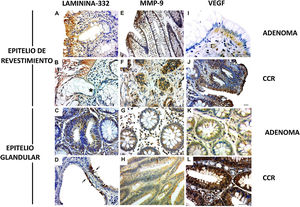
La cadena γ2 de laminina-332ha sido observada en lesiones benignas y malignas. La expresión se presentó en la membrana basal y en el citoplasma del epitelio de revestimiento (figs. 2A yB) y del epitelio glandular (figs. 2C yD [flechas]), aunque se observó mayor expresión en la primera. Además, se observó discontinuidad de la membrana basal en los sitios de invasión del tumor (fig. 2B [*]). Respecto a MMP-9 los casos de adenoma mostraron expresión en el citoplasma en el epitelio de revestimiento y en las células estromales cercanas a la membrana basal (fig. 2E). Las lesiones de CCR mostraron expresión de MMP-9 en el citoplasma de cúmulos de células malignas invasivas (fig. 2F [flechas]). Se observó expresión de MMP-9 en las glándulas (fig. 2G). La expresión de enzimas también fue detectada en el epitelio glandular y en los vasos de los casos de CCR (fig. 2H).
Expresión de laminina-332, MMP-9 y VEGF en neoplasias colorrectales. A) Presencia de cadena γ2 laminina-332 en el citoplasma del epitelio de revestimiento y en la membrana basal en muestra de adenoma. B) En CCR la expresión de laminina demostró la discontinuidad de la membrana basal en los sitios de invasión del tumor (*). C) Expresión discreta de laminina en el citoplasma de glándulas de adenoma. D) Expresión intensa de laminina en epitelio glandular de CCR (flechas). E) Expresión de MMP-9 en el citoplasma del endotelio de revestimiento y estroma, cerca del epitelio. F) En el CCR la expresión de MMP-9 fue en el citoplasma de cúmulos de células malignas invasivos (flechas). G) El citoplasma de glándulas de adenoma mostró expresión de MMP-9 en pocas células. H) La mayoría de las glándulas alteradas en CCR presentaron expresión de MMP-9 en el citoplasma. I) La expresión de VEGF en el adenoma fue observada en el citoplasma del epitelio de revestimiento y en células estromales. El endotelio de los vasos estromales también presentó inmunotinción. J) En el CCR la expresión de VEGF se encontró en áreas de desorganización de la interfaz entre el epitelio y el tejido conectivo. K) El VEGF fue expresado discretamente en glándulas en adenoma al ser comparadas con glándulas en CCR. L) La neoplasia maligna también presentó vasos con expresión de VEGF.
Inmunohistoquímica: barra de escala=20μm.
La expresión de VEGF en adenomas fue observada en el citoplasma del epitelio de revestimiento y en las células estromales. El endotelio de los vasos estromales también presentó inmunotinción (fig. 2I). En el CCR se presentó expresión de VEGF en áreas de desorganización de la interfaz entre el epitelio y el tejido conectivo (fig. 2J). En las glándulas de adenoma la expresión se presentó en el citoplasma, pero no fue evidente en el estroma (fig. 2K). Respecto a las glándulas en las muestras de CCR también se detectó VEGF en el citoplasma (fig. 2J) y el estroma presentó inmunotinción importante en células de endotelio de microvasos (fig. 2L).
Discusión y conclusionesEn el estudio aquí descrito evaluamos la presencia de mastocitos perivasculares y la expresión de la cadena γ2 de laminina-332, MMP-2 y VEGF en lesiones benignas y malignas en el sitio colorrectal. Nuestros datos mostraron que los adenomas presentaban una mayor densidad de mastocitos cercanos a los vasos que el CCR. Aunque las moléculas del estudio se encontraron en ambos grupos, la proteína de la cadena γ2 fue altamente expresada en el citoplasma de células de tumores malignos. También fueron observadas en los frentes invasivos la disrupción de la membrana basal en lesiones de CCR, una asociación entre la expresión de VEGF y atipia celular y la expresión de MMP-9.
El CCR es el tercer cáncer más frecuentemente diagnosticado, y el tercero más letal, en ambos sexos1. La mayoría de los CCR se desarrollan de la secuencia normal epitelio-adenoma-carcinoma2. Ciertos procesos precipitan o influencian a continuación la invasión local y metástasis, las cuales son características relacionadas con un mal pronóstico16. El microambiente tumoral es formado por diferentes células estromales, fibroblastos y el propio tumor. Además del componente celular, también hay estructuras vasculares y de la MEC. Los eventos biológicos que participan, tanto en el progreso del tumor como en los intentos de eliminar las células alteradas, son coordinados por señales del microambiente17. El papel de la inestabilidad microsatelital (IMS) en el cáncer está bien definido como una herramienta de tamizaje para CCR en pacientes con síndrome de Lynch, pero el papel de la IMS en el cáncer esporádico aún no se ha descrito con precisión18. Algunos estudios han indicado que los tumores con el fenotipo de IMS son menos agresivos, predicen sensibilidad a inmunoterapia y están asociados con un buen pronóstico, pero dicho fenotipo no se encuentra en la mayoría de los cánceres18,19.
Los mastocitos son mejor conocidos por su participación en alergias. Sin embargo, en el contexto de la carcinogénesis se ha reportado que son una fuente importante de mediadores proinflamatorios y angiogénicos17. En nuestras muestras observamos una mayor densidad de mastocitos perivasculares y una asociación cercana entre dichas células y vasos sanguíneos en adenomas. Los mastocitos desempeñan un papel importante en el microambiente del tumor, al estimular citocinas proangiogénicas y facilitar la vascularización del tumor y su crecimiento6,20–22. Heijmans et al.20 revisaron la influencia de los mastocitos en el crecimiento de pólipos premalignos en su progreso a CCR. Rios et al.23 demostraron que el contenido de ciertos mediadores de los mastocitos sufre variaciones, lo cual sugiere que la liberación de moléculas relacionadas con la angiogénesis y la metástasis es heterogénea, con diferentes propiedades biológicas para cada tipo de cáncer. Por lo tanto, los mastocitos podrían estar relacionados con eventos que garantizarían el establecimiento y supervivencia de células cancerosas, como la angiogénesis. Además, los mastocitos envían señales a otras células, incluidas células tumorales, y actúan como detonador para la expresión de vías de señal y factores de crecimiento.
Respecto a la laminina-332 la sobreexpresión de la glucoproteína fue reportada como biomarcador del proceso de transición de epitelio mesenquimal y actúa como facilitador de migración de cáncer24. También es un factor importante para mal pronóstico en cáncer de mama y en cáncer gastrointestinal14,15. Se observó discontinuidad en la membrana basal en las muestras de CCR en los sitios de invasión tumoral, demostrada por expresión de la cadena γ2 de laminina-332. Por otro lado, en adenomas se describió una membrana basal continua. La expresión de cadena γ2 de laminina-332 en el citoplasma del epitelio de revestimiento y en el epitelio glandular demostró claramente el cambio en la deposición de laminina, ante la transformación maligna. La expresión de laminina-332 en el borde de la migración de células tumorales y la inmunotinción en el citoplasma en el frente invasivo podrían representar el proceso inicial de movilidad, invasión y metástasis25,26. La MEC se ha vuelto cada vez más importante como un inductor de desarrollo y progreso de cáncer3.
Las MMPs actúan en la remodelación y degradación de la MEC8. Estas enzimas atraviesan diferentes componentes de la matriz y, en consecuencia, regulan el microambiente tumoral. Este proceso ha sido asociado con invasión y metástasis en varias neoplasias, incluido el CCR8,10. Un estudio que utilizó inhibidores de MMP-9 demostró una disminución en el crecimiento e incidencia tumoral de la metástasis en el sitio colorrectal9. Nuestro análisis mostró expresión de MMP-9 en el citoplasma del epitelio glandular y en el epitelio de revestimiento en adenoma y CCR, particularmente en áreas cercanas a la membrana basal. Otros autores han descrito aspectos similares10,11. Además, es importante destacar que la expresión de MMP-9 fue encontrada en el citoplasma de cúmulos malignos invasivos. La correlación entre este patrón de expresión y metástasis distante ha sido reportada en otros estudios10–12.
Otro aspecto asociado con MMP-9 es la habilidad para inducir concentración de VEGF15. La secreción de VEGF es un factor clave en la formación de nuevos vasos sanguíneos, un evento conocido como neoangiogénesis4. Dicho proceso está relacionado con la invasividad, metástasis y mal pronóstico de la enfermedad, dado que las células tumorales utilizan los nuevos vasos para crecer27. De hecho, en modelos experimentales donde el VEGF fue inhibido, resultaron en supervivencia libre de crecimiento en varios tipos de cáncer, incluido el CCR27. En nuestras muestras de adenoma la expresión de VEGF fue detectada en el citoplasma del epitelio de revestimiento y en células estromales adyacentes a la membrana basal, la cual presentaba engrosamiento. En las muestras de CCR, la expresión fue encontrada en las áreas desorganizadas de la interfaz entre el epitelio y tejido conectivo. La sobreexpresión de VEGF en el citoplasma de células tumorales podría estar asociada con mal pronóstico5,28, y creemos que la presencia de este factor es esencial en el favorecimiento de la proliferación celular cuando el cáncer se establece, y después para su diseminación metastásica.
El estudio de la transformación maligna involucra analizar la expresión de varias moléculas que son activadas o inhibidas, lo cual lleva a cambios no solo en el tejido del origen del cáncer, sino también en el estroma, lo cual será de apoyo para el crecimiento de la lesión y servirá como ruta para una metástasis futura. Los mastocitos y todas las moléculas descritas en el presente estudio desempeñan un papel en el proceso de la transformación maligna y pueden estar relacionados con el crecimiento, supervivencia, invasión y metástasis. Por lo tanto, consideramos que la investigación histológica e inmunohistoquímica de lesiones de adenomas y CCR es una herramienta clave para predecir una potencial transformación maligna o determinar el pronóstico de un CCR ya establecido. Esta información es valiosa para guiar el mejor abordaje terapéutico.
Incluso con un número limitado de casos, nuestros datos demostraron un incremento en la densidad de mastocitos perivasculares en adenoma. Además, fue posible observar una asociación cercana entre la célula y los vasos presentes en el estroma en ambos grupos. La expresión de laminina-332 encontrada en las células de los frentes de invasión y el aspecto de discontinuidad de la membrana basal demuestran el cambio en las funciones de dicha molécula en la presencia de cáncer. Respecto a las MMP-9 su expresión epitelial cercana a la membrana basal en ambas neoplasias sugiere un papel de dicha enzima en la alteración de componentes de la MEC. Finalmente, la expresión de la VEGF en el epitelio de revestimiento, en células epiteliales y estroma, podría estar relacionada con la formación de nuevos vasos. Todos estos hallazgos refuerzan la presencia de numerosos cambios que ocurren en el proceso de la transformación maligna.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
FinanciaciónEl presente trabajo fue apoyado por becas del Consejo Nacional Brasileño para el Desarrollo Científico y Tecnológico (CNPq), número de proceso: 479694 2013-3, y por la Fundación del Estado del Espirito Santo (FAPES), número de proceso: 67659870 006/2014.
Contribuciones de los autoresTodos los autores contribuyeron al diseño y concepción del estudio. La preparación del material fue realizada por Luciano Pinto Nogueira da Gama de Souza, Willian Grassi Bautz y Flavya da Silva Souza Ribeiro. La recolección y análisis de los datos fue realizada por Luize Meloti Fiorio, Izabela Silva Sinara Alves, Franciele Rohor de Souza y Letícia Nogueira da Gama-de-Souza. El primer borrador del manuscrito fue escrito por Luize Meloti Fiorio y Letícia Nogueira da Gama-de-Souza. Todos los autores comentaron sobre las versiones previas del manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.
El Laboratorio Histotécnico de la Universidad Federal de Espirito Santo jugó un papel importante en los experimentos histopatológicos. También agradecemos al Dr. Giovanni José Zucoloto Loureiro y al Dr. Rossini Cipriano Gama, del Servicio de Coloproctología del Hospital Vitória Apart.