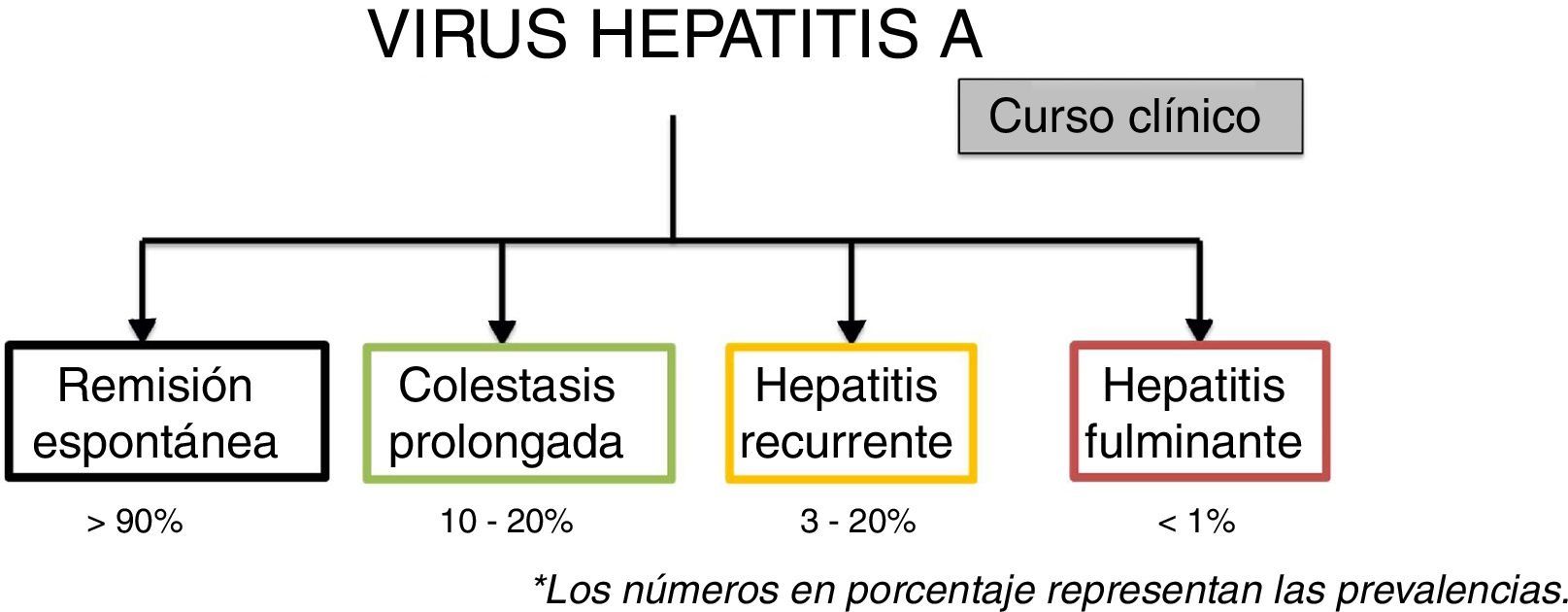
La hepatitis aguda por virus de hepatitis A usualmente sigue un curso corto, benigno y autolimitado sin ocasionar una hepatitis crónica, sin embargo en algunos casos puede manifestarse mediante formas atípicas como son hepatitis recurrente, colestasis prolongada o persistente, falla hepática fulminante o asociada a hepatitis autoinmune. El curso clínico típico de la infección aguda por el virus de hepatitis A es hacia una remisión espontánea en más del 90% de los casos, sin embargo los cursos atípicos presentan una prevalencia que varía de <1 – 20% según la manifestación (global ∼7%). Existe poca información sobre los cursos clínicos atípicos por la infección del virus de hepatitis A y es relevante mencionar que la falta de reconocimiento de estos, a menudo ocasiona en la práctica clínica la realización de múltiples estudios y tratamientos que además de innecesarios pueden resultar perjudiciales. El presente trabajo tiene como objetivo describir 3 casos clínicos representativos de la infección atípica por virus de hepatitis A y una revisión de la literatura sobre los mismos.
Acute hepatitis due to the hepatitis A virus usually has a short, benign and self-limited course, without causing chronic hepatitis. However, some cases have an atypical presentation, such as relapsing hepatitis, prolonged or persistent cholestasis, fulminant hepatic failure, or liver failure associated with autoimmune hepatitis. The typical clinical course of acute hepatitis A virus infection is spontaneous remission in 90% of the cases, but atypical cases have a prevalence that varies from less than 1 to 20%, depending on the manifestation (overall prevalence ∼7%). There is little information on the atypical clinical courses of hepatitis A virus infection and the lack of recognizing those presentations in clinical practice often results in carrying out numerous studies and treatments that not only are unnecessary, but can also be harmful. The aim of the present article was to describe 3 clinical cases of atypical hepatitis A infection and provide a literature review of such cases.
La infección por el virus de la hepatitis A (VHA) generalmente tiene una evolución autolimitante e induce una inmunidad activa permanente. El curso clínico de la hepatitis A fue descrito por MacCallum a mediados del siglo XX1,2. El VHA, es un virus de ácido ribonucléico (ARN) no envuelto perteneciente al orden de los Picornavirales y a la familia Picornaviridae3. El virus se transmite por inoculación oral de heces contaminadas a través del contacto de persona a persona o por la ingesta de agua y/o alimentos contaminados. Tiene un periodo de incubación que puede durar desde 15 hasta 50 días. Las manifestaciones clínicas de la hepatitis A dependen de la edad del paciente, solo el 30% de niños menores de 6 años presentan síntomas inespecíficos sin ictericia y hasta el 70% de adultos presentan síntomas inespecíficos y específicos como ictericia4. El curso clínico habitual de la infección por el virus de la hepatitis A inicia con una fase preictérica que dura de 5-7 días y se caracteriza por síntomas típicos como malestar general, anorexia, náuseas, vómito, fiebre, dolor abdominal y cefalea, y en ocasiones, síntomas atípicos como escalofríos, mialgias, artralgias, tos, diarrea, constipación, prurito y urticaria5. Posteriormente se presenta una fase ictérica que dura de 4-30 días que se caracteriza por coluria, acolia e ictericia6. En la gran mayoría de los casos el curso de la enfermedad presenta remisión espontánea, sin embargo, un 10-20% de casos sintomáticos presentan un curso atípico manifestado como hepatitis recurrente, colestasis persistente, desarrollo de hepatitis autoinmune o falla hepática fulminante. Hasta la fecha no se ha documentado que la infección por el virus de la hepatitis A evolucione hacia la cronicidad4. Existe poca información sobre los cursos clínicos atípicos por la infección del VHA.
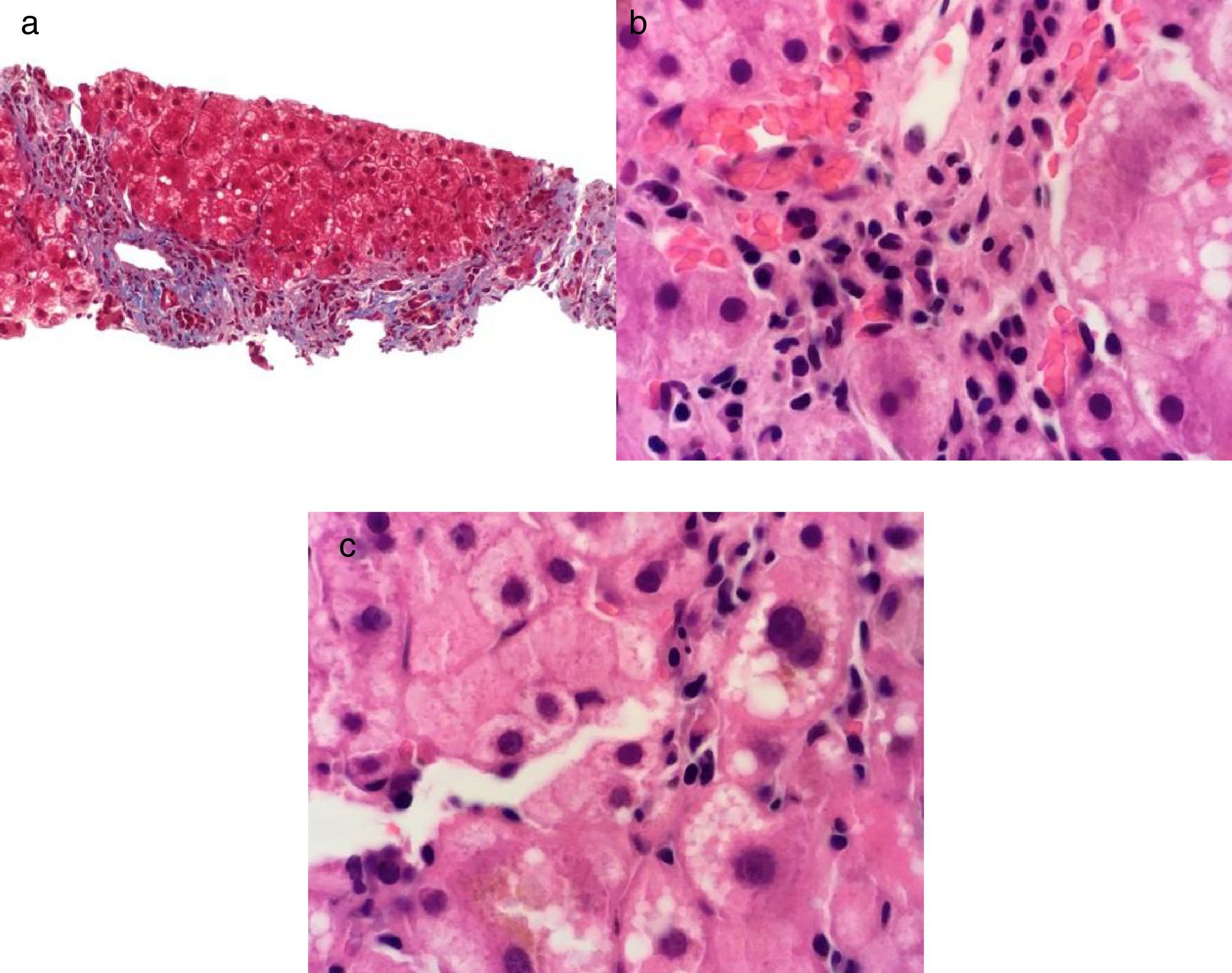
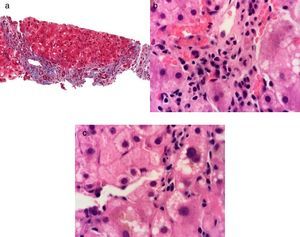
Casos clínicosCaso clínico 1. Falla hepática aguda por virus de hepatitis A, asociado a hepatitis autoinmuneUna mujer de 47 años con historia médica de asma controlada con salbutamol 200 ug por razón necesaria e historia de laboratorios normales (incluyendo PFH) presentó un cuadro de inicio súbito con dolor abdominal, diarrea, náuseas y vómito para el cual recibió tres cursos de tratamiento a base de antibióticos y sintomáticos sin mejoría. A los 7 días presentó coluria, acolia, ictericia, encefalopatía hepática y febrícula. Dentro de su valoración presentó unas pruebas de función hepática (PFH) con bilirrubina total (BT) de 6.8mg/dl, bilirrubina directa (BD) de 3.8mg/dl, ALT de 6,434 U/l, AST de 4,355 U/l, ALP de 208 U/l, INR de 3.1, un perfil de hepatitis viral con anticuerpos anti-VHA IgM positivos y un estudio de imagen de hígado y vías biliares con cambios inflamatorios inespecíficos sin otras alteraciones. Se realizó el diagnóstico de hepatitis A y falla hepática aguda. Se inició vigilancia, medidas de soporte general y se administró vitamina K 10mg c/24h IV durante 3 días. Posteriormente presentó de manera espontánea estabilización y mejoría de su estado general con resolución de la coagulopatía y encefalopatía hepática. A los 30 días en una evaluación subsecuente presentó unas PFH con BT 13.8mg/dl, BD 8.0mg/dl, ALT 251 U/l, AST 149 U/l y ALP 194 U/l e INR 1.3. Presentó anticuerpos antinucleares positivos con patrón citoplásmico con título 1:80, patrón moteado grueso con título 1:160 y patrón de filamentos intermedios con título 1:320, anticuerpos antimúsculo liso positivos e inmunoglobulina G 2628mg/dl. Se le realizó biopsia hepática en la que presentó cambios compatibles con hepatitis autoinmune (fig. 1). Por lo anterior se integró el diagnóstico de hepatitis autoinmune desencadenada por VHA y se inició tratamiento con azatioprina 50mg c/24h VO y prednisona 30mg c/24h VO. en dosis reducción. A los 6 meses de seguimiento se encontró con PFH normales y continuó tratamiento con azatioprina 50mg c/24h VO y prednisona 5mg c/24h VO.
Tinción de Masson a 40X, se observa fibrosis grado III por presencia de algunos puentes de fibrosis del espacio porta-porta a). Tinción de hematoxilina-eosina a 100X, se observa hepatitis de interface por presencia de un infiltrado inflamatorio linfo plasmocitario que sobrepasa la placa limitante b) y hepatitis crónica lobulillar por presencia de un infiltrado inflamatorio linfoplasmocitario, vacuolación de hepatocitos y colestasis intracitoplásmica en el lobulillo hepático c).
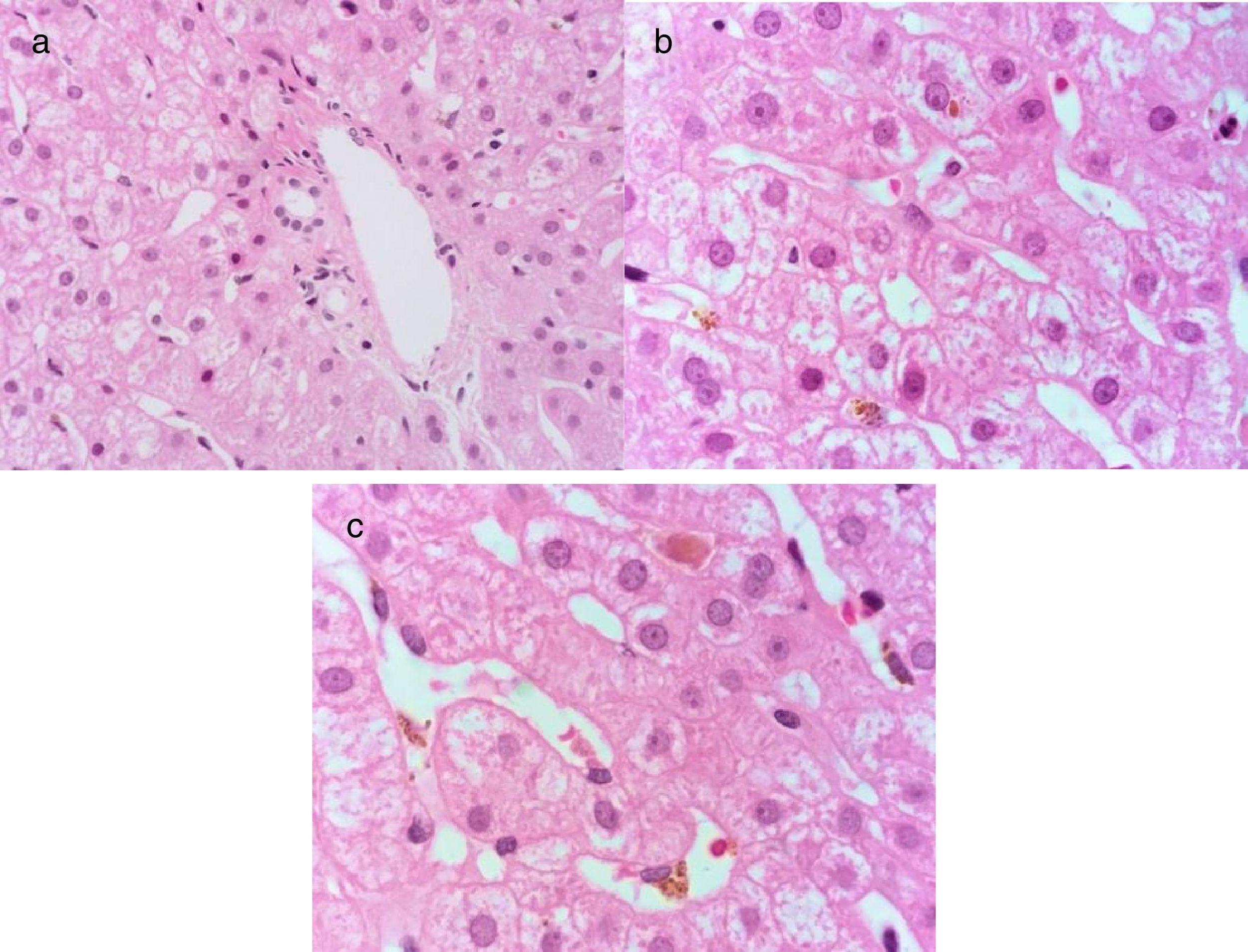
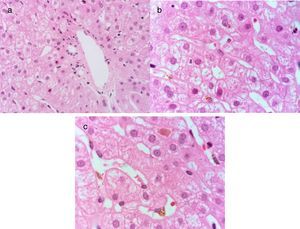
Un hombre de 21 años previamente sano presentó un cuadro de inicio agudo con náuseas y vómito. A los 5 días presentó astenia, adinamia, hiporexia e ictericia. Dentro de su valoración presentó un perfil de hepatitis viral con anticuerpos anti-VHA IgM positivos. Se realizó diagnóstico de hepatitis aguda por VHA y se inició tratamiento sintomático. A los 30 días continuó con ictericia con elevación progresiva de la BT, por sospecha de un cuadro de VHA con colestasis persistente recibió tratamiento con ribavirina 400mg c/8h VO y ácido ursodesoxicólico 250mg c/8h VO, esto previo a que ingresara como paciente en nuestro Instituto. A los 45 días presentó un cuadro de rabdomiólisis con insuficiencia renal aguda por pigmentos que requirió hospitalización, razón por la cual ingresó en nuestro Instituto. Dentro de su seguimiento presentó unas PFH con BT 37mg/dl, BD 23mg/dl, ALT 63, AST 63, ALP 116, hemoglobina 7.6g/dl, creatinina 1.7mg/dl, INR 1.0, un perfil de hepatitis viral con anticuerpos anti-VHA IgM e IgG positivos, perfil viral para VHC, virus de la hepatitis B, citomegalovirus y Epstein-Barr negativos e imagen de hígado y vías biliares con hepatomegalia sin otras alteraciones. Por la alteración de las PFH durante más de 12 semanas se integró el diagnóstico de hepatitis A colestásica persistente y se inició tratamiento con prednisona 40mg c/24h VO. Posterior a los 90 días presentó PFH con BT 3.8mg/dl, BD 1.9mg/dl, ALT 200 U/l, AST 99 U/l, ALP 393 U/l. Se redujo la dosis de prednisona gradualmente a 20mg c/24h VO. Posterior a los 8 meses presentó unas PFH con BT 0.78mg/dl, BD 0.18mg/dl, ALT 87 U/l, AST 42 U/l, ALP 148 U/l y un perfil de hepatitis viral con anticuerpos anti-VHA IgM indeterminado e IgG positivos. Se le realizó biopsia hepática en la que se observó colestasis sin actividad inflamatoria (fig. 2).
Tinción de hematoxilina-eosina a 100X, se observa el espacio porta con arquitectura normal a). En el lobulillo hepático se observa una hepatopatía colestásica leve por presencia de colestasis intracitoplásmica y células de Kupffer con pigmento biliar fagocitado b) así como colestasis intracanalicular c).
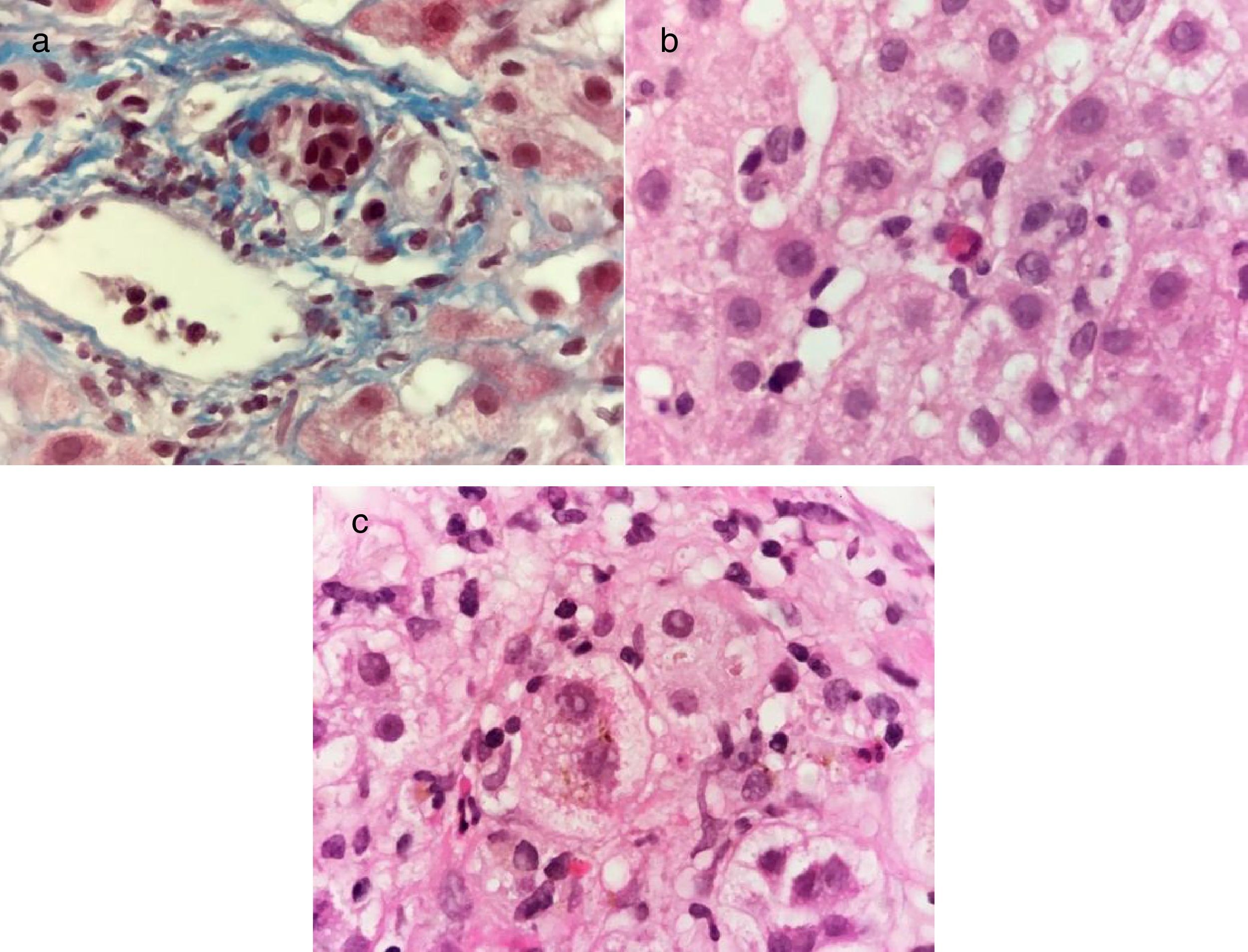
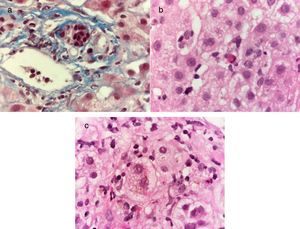
Un hombre de 29 años previamente sano, con antecedente de importancia de un hermano que presentó hepatitis A un mes previo al padecimiento del paciente, presentó un cuadro agudo de malestar general, astenia y adinamia. A los 5 días presentó náuseas, vómitos, coluria, acolia e ictericia. Se realizó diagnóstico de hepatitis aguda por VHA con anticuerpos anti-VHA IgM positivos e inició tratamiento sintomático. A los 30 días presentó resolución completa de los síntomas. Siete semanas después del cuadro inicial presentó nuevamente un cuadro de malestar general, astenia, adinamia, náuseas y vómitos seguidos por coluria, acolia e ictericia. Se integró diagnóstico de hepatitis A colestásica recurrente y nuevamente tratamiento sintomático. A los 30 días del segundo cuadro viral continuó con coluria, acolia e ictericia. Dentro de su valoración presentó unas PFH con BT 43mg/dl, BD 25mg/dl, ALT 1823 U/l, AST 1563 U/l, ALP 122 U/l, INR 1.1, un perfil de hepatitis viral con anticuerpos anti-VHA IgM e IgG positivos e imagen de hígado y vías biliares con hepatoesplenomegalia sin otras alteraciones. Se realizó biopsia hepática en la que presentó cambios compatibles con hepatitis viral (fig. 3). Se confirmó el diagnóstico de infección por VHA colestásica recurrente y se continuó tratamiento sintomático. A los 60 días del segundo cuadro viral presentó unas PFH con bilirrubina total 18mg/dl, bilirrubina directa 9.5mg/dl, ALT 1116 U/l, AST 1171 U/l, ALP 179 U/l, por lo cual se consideró como una hepatitis A colestásica recurrente y persistente y se inició tratamiento con prednisona 40mg c/24h VO en dosis reducción. A los 6 meses del segundo cuadro viral presentó unas PFH normales.
Tinción de Masson a 100X, se observa un infiltrado inflamatorio mononuclear en espacio porta y daño de conductos biliares interlobulillares caracterizado por alteración en la polaridad de los núcleos, irregularidad de los contornos nucleares e hipercromasia a). Tinción de hematoxilina-eosina a 100X, se observa una hepatitis crónica colestásica con actividad lobulillar por la presencia de escasas células inflamatorias mononucleares y hepatocitos apoptóticos b), así como colestasis intracitoplásmica y degeneración balonoide de los hepatocitos c).
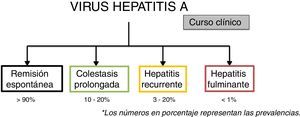
El curso clínico usual o típico de la infección aguda por el virus de hepatitis A es hacia una remisión espontánea hasta en más del 90% de los casos, sin embargo existen cursos atípicos con una prevalencia que varía de <1 – 20% según la manifestación4,7 (fig. 4).
Colestasis persistenteDefiniciónHoy en día no existe un consenso universal para definir a la colestasis persistente secundaria a la infección por el VHA y en los estudios realizados hasta la fecha esta entidad se ha definido de distintas formas. Sin embargo, de manera histórica la colestasis persistente secundaria a la infección por el VHA es aquella en la que la colestasis, con BT > 10mg/dl con niveles de BD mayores al 50% de los niveles de BT, se perpetúa por más de 12 semanas posteriores a la infección inicial8–10.
EpidemiologíaLa colestasis persistente ocurre en menos del 5% de los casos de infección por el VHA. Los factores que se han asociado con esta presentación son la coinfección crónica por el virus de la hepatitis B, mayor edad y mayores niveles de BT y tiempo de protrombina11.
FisiopatologíaLos mecanismos por los cuales se perpetúa la colestasis en estos casos no se encuentran del todo clara. En cultivos celulares linfocitarios de animales infectados por el VHA se ha descrito un aumento en la actividad inmune celular y humoral12. En biopsias hepáticas de pacientes infectados por el VHA se ha descrito obstrucción al flujo biliar con colestasis centro-lobulillar, inflamación portal, necrosis periportal y daño ductular, que pudieran ser más graves en casos de colestasis persistente8,13. Se han descrito en pacientes con colestasis persistente la presencia de polimorfismos procolestásicos de algunos transportadores hepatocanaliculares de sales biliares como la variante c.3084 [GG] del gen codificante para el transportador ABCB11 y la variante c.711 [AT] del gen codificante para la fosfatidilcolina ABCB4, los cuales predisponen una colestasis intrahepática más grave en pacientes infectados por el VHA, esto apuntando a una probable susceptibilidad genética en estos pacientes14.
DiagnósticoEl diagnóstico es clínico y se realiza con la confirmación de un episodio de hepatitis viral aguda por VHA con anticuerpos anti-VHA IgM positivos y un cuadro de ictericia o colestasis que se perpetúa por más de 12 semanas como se presentó en el paciente del caso 2. Las manifestaciones clínicas más comunes son ictericia, prurito, fiebre, pérdida de peso, diarrea y malestar general8,9,15. En las PFH predominan elevaciones de fosfatasa alcalina y BT que alcanzan su pico máximo posterior a la 8.ª semana (generalmente > 10mg/dl) además de discreta elevación de transaminasas y colesterol8. Es recomendable realizar un ultrasonido de hígado y vías biliares para descartar una obstrucción de la vía biliar que pudiese pasar desapercibida8. Durante el periodo de colestasis se ha observado que persiste la eliminación de virus en heces así como la positividad de los anticuerpos IgM9.
TratamientoLa colestasis persistente es un cuadro autolimitante8,9,16. El tratamiento puede limitarse a explicar al paciente la naturaleza y curso clínico favorable de esta variante, vigilancia clínica y soporte. Existen series de casos con resultados contradictorios respecto al uso de glucocorticoides.
El uso de prednisona con un rápido desescalamiento ha demostrado acelerar la resolución de síntomas como ictericia, prurito y malestar general sin presentar efectos adversos relevantes8. En reportes de caso se ha observado que el tratamiento con prednisona a dosis de 1mg/kg o 40mg c/24h VO durante 4 semanas y posteriormente reducción en el transcurso de 12 semanas resulta en mejoría significativa de los síntomas y el patrón colestásico de las PFH desde la primera semana de iniciado el tratamiento y con remisión total de los síntomas y normalización de las PFH a los 6 meses7,17. Sin embargo, también se ha descrito que el uso de glucocorticoides puede incrementar el riesgo de presentar una recurrencia en pacientes que no tienen seroconversión a anticuerpos IgG9. El mecanismo de acción de los glucocorticoides en estos casos es por estímulo del flujo de bilis por vías alternas además de su efecto antiinflamatorio18. En el paciente del caso 2 se decidió el manejo con prednisona por el patrón colestásico persistente asociado a una lesión renal aguda secundaria a pigmentos para poder disminuir el riesgo de mayor daño renal por los niveles elevados de BT. La administración de ribavirina fue previa a la valoración médica realizada por nuestro equipo, se desconoce la razón de su uso y no existe literatura que mencione a la ribavirina como opción terapéutica.
PronósticoLa colestasis persistente resuelve espontáneamente de manera general con recuperación clínica y bioquímica a los 6 meses9,16.
Colestasis recurrenteDefiniciónSe denomina hepatitis recurrente por infección de VHA al cuadro típico inicial de una hepatitis aguda por VHA con resolución de la sintomatología y normalización de los parámetros bioquímicos asociado a un aclaramiento sérico del VHA documentado por reacción en cadena de la polimerasa (PCR, por sus siglas en inglés de «polimerase chain reaction») de VHA, lo cual ocurre usualmente en promedio en 3 a 15 semanas posterior al inicio de los síntomas, con un posterior segundo episodio con manifestaciones clínicas y bioquímicas evidenciado mediante replicación viral por PCR de VHA en suero o heces19.
EpidemiologíaLos datos epidemiológicos actuales son derivados de reportes de caso o series pequeñas en los cuales el diagnóstico no se apoya con evidencia de replicación viral por PCR. No existen muchos estudios que documenten la recurrencia mediante PCR de VHA del aclaramiento viral lo cual dificulta establecer una prevalencia exacta. En estos estudios se estima una prevalencia de 1.5 hasta 20% del total de las infecciones por VHA (series de hasta 200 pacientes)20–26. Por ejemplo en el estudio italiano de Sagnelli27 et al. se mostró en una cohorte de 66 pacientes con infección aguda por VHA, que 5 pacientes (3.3%) presentaron un curso recurrente en los que la viremia detectada por PCR fue paralela al curso clínico y bioquímico de la enfermedad.
FisiopatologíaEl mecanismo fisiopatológico más aceptado mediante el cual se desarrolla una recurrencia es en el cual el VHA no es eliminado completamente en la primera fase de la hepatitis por lo que es capaz de tener una nueva replicación y ocasionar un segundo episodio de enfermedad. Esto podría explicarse en pacientes con alteración de la inmunidad con disminución en la capacidad de generar títulos adecuados de anticuerpos, indispensables para lograr el aclaramiento sérico completo del virus y disminuir el daño hepático que ocasiona19–21,23. Por ejemplo se ha visto en estudios de pacientes con infección por virus de la inmunodeficiencia humana que presentan hepatitis aguda por VHA tienen niveles de transaminasemia menores pero cargas virales de VHA mayores y viremia más prolongada en comparación con pacientes sin virus de la inmunodeficiencia humana, lo cual traduce que probablemente la activación del sistema inmune tiene un rol dentro de la necrosis hepática desarrollada durante la hepatitis aguda27–31.
Una teoría relativamente nueva es en la que se postula que la inmunoglobulina A (IgA) es un transportador hepatotrópico del VHA. En esta teoría se especula que este mecanismo contribuye a que la infección por VHA presente desenlaces clínicos diferentes o atípicos.
En un estudio de Andreas Dotzauer et al.32, 2012 se investigó este mecanismo transportador de IgA en un modelo de ratón con el que se demostró que los inmunocomplejos de VHA-IgA alcanzan el hepatocito de forma eficiente mediante una vía enterohepática mediada por transcitosis reversa por el receptor polimérico de inmunoglobulina (pIgR) a través del epitelio intestinal33, mediante este mecanismo puede existir una reinfección continua endógena del hígado. Este ciclo mediado por IgA es terminado al aumentar los niveles séricos de inmunoglobulina G (IgG), presentes en fases avanzadas de la infección, ya que estos reemplazan a la IgA de forma competitiva en los complejos VHA-IgA, sin embargo en casos en que la inmunidad está comprometida puede contribuir a una menor síntesis de IgG y así a una enfermedad prolongada o cursos recurrentes de infección por VHA32.
DiagnósticoEl diagnóstico se realiza en un paciente que presenta un segundo episodio de hepatitis aguda por VHA, manifestado clínica y bioquímicamente y corroborado mediante PCR de VHA (sérico o en heces). El paciente tendrá el antecedente de un primer episodio con un posterior aclaramiento viral por PCR de VHA y un periodo asintomático de aproximadamente 4 a 10 semanas de duración24,34.
Se debe considerar como potencialmente infecciosos a los pacientes que cursan con una recurrencia5.
Los anticuerpos de inmunoglobulina M (IgM) contra VHA pueden permanecer detectables hasta por 3 a 4 meses después del evento y en ocasiones durar hasta 12 meses22, la presencia de estos anticuerpos no comprueba que las manifestaciones de la recurrencia sean por el VHA.
En el caso 3 se muestra un paciente que presenta una evolución de la infección por VHA de tipo colestásico persistente, sin embargo en su evolución presentó una elevación de las PFH con transaminasemia, se decidió su abordaje con biopsia hepática ya que no se cuenta con PCR para VHA en nuestro medio. En esta biopsia se observaron cambios citopáticos por virus lo cual se atribuyó a una recurrencia de VHA al tener serología negativa para otros virus hepatotrópicos.
TratamientoEl manejo es de medidas generales y soporte, no existe un tratamiento específico.
Existen reportes con uso de ácido ursodesoxicólico para el manejo de la colestasis y prurito, así como del daño hepático mediado por la bilis gracias a los efectos citoprotectores e inmunomoduladores a nivel del hepatocito, sin embargo su uso no se encuentra estandarizado y varía de caso en caso, siendo el prurito la indicación más frecuente quitar frase repetida.
El uso de esteroides es controversial, en la actualidad no hay una indicación para su uso en hepatitis recurrente por VHA, su empleo se ha asociado al desarrollo de un curso prolongado de la infección de VHA35, sin embargo en otros reportes de caso se ha reportado una mejoría de la sintomatología con su uso19,23,36, aún faltan estudios para establecer su utilidad en este escenario. El manejo con esteroides para el paciente del caso 3 se decidió en base a su asociación con un curso persistente, en el cual se ha descrito el uso de esteroides como ya se describió previamente.
PronósticoLa recurrencia de infección por VHA es clínicamente y bioquímicamente de menor intensidad que el episodio inicial y al parecer no altera el pronóstico benigno de la enfermedad, en ocasiones se manifiesta con un cuadro con mayor colestasis en comparación al primer episodio22,23.
Al igual que el curso típico de la enfermedad, no existe cronificación posterior a una recurrencia y las enzimas hepáticas normalizan la mayoría de las veces en aproximadamente 6 meses posterior a la infección37.
Hepatitis fulminanteDefiniciónSe define como la presencia de una falla hepática aguda (FHA) secundaria a una infección por VHA38,39.
EpidemiologíaActualmente la infección aguda por VHA es la etiología más frecuente de FHA en poblaciones en desarrollo con reportes de 3.1 a 26%39–44.
Estudios epidemiológicos de México han reportado una seroprevalencia de VHA de hasta 80%45 y en algunos registros se ha documentado a la infección por VHA hasta en un 81.4% como etiología de la FHA41,42. Sin embargo aunque la infección aguda por VHA es la causa viral más frecuente de FHA, en sí la FHA es infrecuente dentro de la evolución usual de la infección por VHA encontrándose aproximadamente en <1-3% de los casos de infección aguda por VHA38,46–48.
Se ha visto en estudios que la evolución de la infección por VHA hacia FHA es más frecuente en pacientes adultos (mayores de 50 años de edad) en comparación a población pediátrica y más frecuente en pacientes con una hepatopatía crónica subyacente40,46,49,50.
FisiopatologíaLos pacientes que desarrollan una FHA por infección del VHA probablemente es algo secundario a una respuesta inmune exagerada y no al efecto citopático del virus en el hepatocito, este efecto ya se ha observado en estudios in vitro51. Esta teoría se sospecha ya que en algunos estudios se ha demostrado que el ARN viral es frecuentemente indetectable en pacientes con FHA fulminante en el momento de la presentación en comparación con pacientes sin FHA en los que incluso se encuentran cifras de ARN viral más elevadas (47% vs. 16%, p<0.02), así mismo los pacientes que desarrollan enfermedad más grave presentan aclaramiento viral más rápido52–54.
DiagnósticoLa FHA es un deterioro abrupto de la función hepática, con el desarrollo de encefalopatía hepática (o cualquier nivel de alteración del estado de alerta) y coagulopatía, en un lapso menor de 26 semanas desde el inicio de la ictericia en un paciente sin historia previa de enfermedad hepática. Se determina que la infección aguda por VHA fue la causante al encontrar anticuerpos IgM contra VHA positivos y característicamente ausencia de otra causa de FHA55.
TratamientoEl tratamiento principal es el de soporte médico, sin embargo el único manejo curativo en pacientes con falla al manejo de soporte sin evidencia de recuperación espontánea es el trasplante hepático ortotópico (THO). Por su gravedad el manejo siempre deberá ser de manera hospitalaria y si hay posibilidad en una unidad monitorizada (preferentemente una unidad de cuidados intensivos)55.
La N-acetilcisteína (NAC) se ha usado en la FHA gracias a sus diferentes propiedades; facilitar la síntesis de glutatión depletado, mejorar la oxigenación al ser usado como sustrato por la glutatión transferasa microsómica, aumento del flujo sanguíneo vía sistema guanilato ciclasa por un incremento del óxido nítrico y acción antioxidante e inmunomoduladora. En un estudio realizado en 12 pacientes pediátricos con FHA por VHA se siguió la evolución posterior al manejo con N-acetilcisteína. Se administró NAC a dosis de 10mg/kg por día asociado a manejo con lactulosa, neomicina y medidas generales39, en este estudio se describió que el uso de NAC parece una medida efectiva en FHA por VHA ya que al parecer modifica el curso clínico y previene desenlaces fatales. Sin embargo a la fecha no existe evidencia fuerte para su uso ni la duración de su aplicación.
El THO es el manejo de elección en pacientes con FHA que no presentan recuperación espontánea40.
Existen otras alternativas de tratamiento como la L-ornitina L-aspartato, prostaglandina E, sistema de recirculación absorbente molecular y plasmaféresis las cuales no tienen recomendaciones fuertes para su uso en caso de FHA en la actualidad.
PronósticoHasta el 50-65% de los pacientes tienen una recuperación espontánea mediante manejo con terapia de soporte, sin embargo hasta el 50% de los pacientes con FHA por VHA podría llegar a presentar una evolución desfavorable con necesidad de un THO o sin poder lograrse el mismo, la muerte40,54. En un estudio de Taylor et al.40 se observó una recuperación espontánea en pacientes con criterios para THO de hasta el 55% y desenlaces de THO o muerte en 45% (THO en 31% y muerte 14%) durante un seguimiento de 3 semanas, lo cual se reproduce en otros estudios con supervivencia con remisión espontánea de 50 – 70%38,40,43,56.
El hallazgo de factores pronósticos adversos (falla renal, falla respiratoria, falla hemodinámica) son factores con alta mortalidad que indican la necesidad de THO57–62.
Existen estudios en los que aparentemente el aclaramiento viral rápido se ha asociado a peores desenlaces en la FHA por VHA, lo cual se traduce en una mayor activación del sistema inmune con mayor daño citopático al hepatocito y por lo tanto mayor dificultad y tiempo para lograr una regeneración hepática54.
Hepatitis autoinmuneDefiniciónEn pacientes que en el momento del diagnóstico de una infección aguda por VHA se realiza el diagnóstico concomitante o tiempo después de HAI, no existe un criterio que defina el tiempo dentro del cual se pueda asociar una HAI a infección por VHA63.
EpidemiologíaLa hepatitis autoinmune ocurre hasta en el 3% de los casos de infección por el VHA16. La evidencia de estos casos hasta el momento se limita a reportes de caso aislados64.
FisiopatologíaSe ha postulado que la infección por el VHA, así como ocurre con otras infecciones virales, puede ser un factor desencadenante de una HAI latente en individuos susceptibles. En un estudio experimental en pacientes que desarrollaron HAI posterior a una infección subclínica por VHA, se observó que previo a la infección por el virus presentaron un defecto en la inmunotolerancia de los linfocitos T hacia el receptor de asialoglicoproteína presente en la superficie celular de los hepatocitos, el cual se considera el antígeno blanco principal en la HAI tipo 1, y posterior a la infección presentaron una activación de linfocitos T CD4 específicos así como un aumento en los títulos anticuerpos específicos para el receptor de asialoglicoproteína de los hepatocitos. En estos casos la HAI se manifestó dentro de los 5 meses posteriores a la infección por el VHA65. Se ha postulado también la posibilidad de que más casos de HAI hayan sido precedidos por infección por VHA que no son detectados por haber presentado una infección subclínica.
DiagnósticoSe puede determinar los criterios diagnósticos de la HAI de manera más práctica, utilizando la escala simplificada para la HAI en la que se requiere un puntaje ≥ 6 para un diagnóstico probable y un puntaje ≥ 7 para un diagnóstico definitivo con una sensibilidad del 88% y una especificidad del 97%66.
El diagnóstico de VHA asociado a HAI usualmente se realiza en el evento agudo, también existen pacientes a quienes se les realiza el diagnóstico meses después de la infección aguda, no está bien definido un criterio de tiempo para esta asociación por falta de estudios. En el caso 1 se presentó una paciente que sin duda desarrolló una FHA por VHA ya que se encontró serología IgM positiva, sin embargo la biopsia hepática y los anticuerpos específicos para HAI fueron diagnósticos para una HAI. Aquí el cuestionamiento siempre es el mismo, si es que la paciente tenía una HAI subclínica con elevación mínima de transaminasas sin síntomas importantes y presentó una infección aguda por VHA (lo cual favoreció una presentación con FHA) o realmente la HAI se activó directamente con la infección por VHA; la fibrosis avanzada en la biopsia hepática probablemente apoyaría la primera hipótesis pero queda en duda ya que la paciente tenía PFH normales previo al evento.
TratamientoEn los casos reportados que presentan HAI posterior a la infección por VHA se les ha instaurado el tratamiento correspondiente para HAI con buenos resultados65. Recientemente se ha descrito que el tratamiento inicial con prednisona 0.5-1.0mg/kg c/24h VO con reducción gradual en conjunto con mofetil-micofenolato 1.5-2.0g al día en dosis fraccionadas tienen tasas de respuesta equiparables como tratamiento de primera línea67. El objetivo del tratamiento es alcanzar una remisión de los síntomas, una normalización bioquímica de las pruebas de función hepática y los niveles de IgG, y una normalización de los cambios histológicos característicos, para de esta manera, disminuir la progresión del daño hepático y la mortalidad a largo plazo, independientemente de si presentan o no cirrosis68.
PronósticoEn los pacientes en quienes se ha documentado hepatitis autoinmune concomitante con infección por el VHA y han recibido el tratamiento inmunosupresor correspondiente han presentado respuesta clínica y bioquímica apropiada a los 6 meses16.
ConclusionesLos cursos atípicos de la infección por virus de hepatitis A tienen una prevalencia global del 7%, sin embargo esta varía dependiendo de la manifestación.
Es necesario enfatizar la importancia de las campañas de vacunación para poder disminuir los casos de infección grave por VHA y siempre recordar los grupos de alto riesgo como son los pacientes con una hepatopatía crónica subyacente.
Se han investigado algunos determinantes para el desarrollo de un curso atípico los cuales parecen tener una buena asociación, sin embargo aún son pocos estudios para poder realizar recomendaciones que impacten en la vigilancia y manejo de estos pacientes.
Se debe recordar que en el caso de pacientes con infección por VHA que presentan una nueva elevación de transaminasas o bilirrubinas habrá que descartar otras etiologías que expliquen la alteración de estudios de laboratorio (p.ej. autoinmunidad, otras infecciones virales [como virus de hepatitis E], etc.) y siempre considerar la probabilidad de que el paciente curse con un curso atípico para poder disminuir la realización de estudios invasivos innecesarios como la biopsia hepática, la cual habrá que reservar para los casos que no tengan una explicación posterior al abordaje no invasivo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.