La mucosa gástrica ha sido estudiada desde la época anterior al Helicobacter pylori, pero son anecdóticas las descripciones completas del estómago y duodeno, y excepcionales las del duodeno distal. El objetivo fue evaluar diversas características epidemiológicas y el estado inflamatorio gastroduodenal en pacientes con síntomas gastrointestinales altos.
Material y métodosEstudiamos a 138 pacientes divididos en: grupo no ulceroso (dispepsia funcional, n=77 y ERGE, n=27) y grupo ulceroso (úlcera gástrica, n=13 y úlcera duodenal, n=21). En cada paciente se tomaron 10 biopsias (2 en el cuerpo; 3 en el antro, 3 en el duodeno proximal y 2 en el duodeno distal) para estudio histológico o microbiológico.
ResultadosLa prevalencia de dispepsia, dispepsia funcional y H. pylori fue del 80.4%, 69.4% y 82.6%, respectivamente. En el cuerpo se apreció una significativa mayor frecuencia de gastritis crónica superficial en el grupo ulceroso que en el no ulceroso; sin embargo, en el antro, el grupo ulceroso mostró más gastritis crónica atrófica (p<0.05). La duodenitis fue significativamente más frecuente en el grupo ulceroso, tanto en el duodeno proximal como en el distal. La pangastroduodenitis fue un hallazgo significativo en el grupo ulceroso. Todos los grupos mostraron gastritis crónica (cuerpo y antro) y duodenitis (proximal y distal) relacionadas significativamente con la presencia de H. pylori. La duodenitis proximal no es un fenómeno extraño en la dispepsia funcional (37.7%), con una frecuencia que duplica a la de duodenitis distal (16.9%).
ConclusionesEl grupo ulceroso presentó un mapa inflamatorio gastroduodenal diferente al del grupo no ulceroso, caracterizado por una mayor frecuencia de gastritis crónica superficial en cuerpo, atrófica en antro y muy frecuente duodenitis proximal.
The gastric mucosa has been studied since the pre-Helicobacter pylori (H. pylori) era, but the complete descriptions of the stomach and duodenum have been anecdotal, and those of the distal duodenum, exceptional. Our aim was to evaluate the different epidemiologic characteristics and the gastroduodenal inflammatory status in patients with upper gastrointestinal symptoms.
Materials and methodsWe studied 138 patients divided into: the non-ulcer group (functional dyspepsia [n=77] and GERD [n=27]) and the ulcer group (peptic ulcer [n=13] and duodenal ulcer [n=21]). Ten biopsy samples (2 from the corpus, 3 from the antrum, 3 from the proximal duodenum, and 2 from the distal duodenum) were taken in each patient for histologic and/or microbiologic study.
ResultsThe prevalence of dyspepsia, functional dyspepsia, and H. pylori was 80.4%, 69.4%, and 82.6%, respectively. The frequency of superficial chronic gastritis in the corpus was significantly higher in the ulcer group vs. the non-ulcer group, whereas there was more chronic atrophic gastritis in the antrum in the ulcer group (P<0.05). Duodenitis was significantly more frequent in the ulcer group vs. the non-ulcer group, in both the proximal and distal duodenum. Pangastroduodenitis was a significant finding in the ulcer group. In both groups, chronic gastritis (corpus and antrum) and duodenitis (proximal and distal) were significantly related to the presence of H. pylori. Proximal duodenitis is not an uncommon finding in functional dyspepsia (37.7%) and is twice as frequent as distal duodenitis (16.9%).
ConclusionsThe ulcer group presented with a gastroduodenal inflammatory map different from that of the non-ulcer group and was characterized by a higher frequency of superficial chronic gastritis in the corpus, chronic atrophic gastritis in the antrum, and a very high frequency of proximal duodenitis.
En la época previa al Helicobacter pylori (H. pylori), algunos grupos escandinavos estudiaron detalladamente la mucosa gástrica en la población general. Establecieron los conceptos de gastritis crónica (GC) de cuerpo y de antro, demostraron su incremento con la edad (en frecuencia, extensión e intensidad inflamatoria) según la secuencia: mucosa normal, GC superficial (GCS) y GC atrófica (GCA) y comprobaron su frecuente distribución parcheada y la extensión píloro-cardial hasta la pangastritis. Comunicaron las prevalencias de GC-cuerpo (41-62%) y GC-antro (60-68%) y GCA-cuerpo (17-37%) y GCA-antro (28-34%)1-4. Tras descubrirse la infección por H. pylori se comprobó que era la principal causa de GC no autoinmune, úlcera gástrica y duodenal y de adenocarcinoma gástrico1. Desde entonces, fueron incontables las publicaciones relacionadas con estos hallazgos, pero escasas las que describían un mapa inflamatorio completo del tracto gastroduodenal. La evaluación del duodeno es de gran interés, dado su reciente y creciente protagonismo en diversos procesos, su relación con la GC antral y la presencia de H. pylori5,6. El propósito de este estudio fue el análisis de la mucosa gastroduodenal y su relación con el H. pylori en pacientes con síntomas gastrointestinales altos que acudían a nuestro centro para practicarse una gastroscopia diagnóstica.
Pacientes y métodosTras la gastroscopia, se seleccionó a 138 pacientes con síntomas gastrointestinales altos, que pertenecían a 2 grupos diagnósticos: 1) grupo sin úlcera: subgrupos de dispepsia funcional (DF) (criterios de Roma IV) (n=77)7 y enfermedad por reflujo gastroesofágico (ERGE) (criterios de Montreal-Lyon) (n=27)8 y 2) grupo con úlcera: subgrupos de úlcera duodenal (UD) (n=21) y úlcera gástrica (UG) (n=13); se excluyó a los que consumieron IBP, antibióticos o AINE/AAS en las 4 semanas previas. En cada caso, se tomaron 10 biopsias: 2 en el cuerpo (a 10cm del cardias, curvatura mayor), 2 en el antro (a 5cm del píloro, curvatura mayor), 2 en el duodeno proximal (bulbo) (D1) y 2 en el duodeno distal (frente a la papila) (D2), para estudio histológico (H-E, PAS) y de H. pylori (Giemsa). Completaron el muestreo otras 2 biopsias: una de antro y otra de D1 para cultivo/estudio microbiológico. La presencia de GC/duodenitis se evaluó mediante la clasificación de Whitehead et al. para la GC9 y para la duodenitis10. De forma resumida, la GC se dividió en GC superficial (cambios reactivos e infiltrado inflamatorio limitados al epitelio superficial y la lámina propia cercana) y GC atrófica (cambios reactivos e infiltrado inflamatorio que afectaran al lecho glandular con atrofia de los túbulos. La atrofia puede subdividirse en leve, moderada y grave). La duodenitis se dividió en 4 grados: grado 0 o mucosa normal; grado 1 o duodenitis leve, con morfología general y epitelio superficial normales y solo discreto aumento de células inflamatorias (linfocitos, células plasmáticas y, a veces, polimorfonucleares) en la lámina propia; grado 2 o duodenitis moderada, con anomalías en el epitelio superficial y evidente infiltrado inflamatorio y grado 3 o duodenitis intensa o grave, con epitelio superficial erosionado e importante infiltrado inflamatorio y pérdida del patrón velloso. Dados los escasos cambios inflamatorios en la duodenitis leve (D-1), la incluimos como mucosa normal y agrupamos la duodenitis moderada/intensa (D-2/D-3) en un único grupo (DD). Un paciente era positivo para H. pylori cuando esta estaba presente en alguna muestra histológica o el cultivo era positivo en alguna de las biopsias.
Análisis estadísticoLos resultados se expresaron como± DE. Sus relaciones (diferencias) se analizaron estadísticamente mediante el uso de las pruebas del χ2 (o de Fisher, en su caso) y t de Student. Fueron significativos los valores de p<0.05.
Consideraciones éticasEl estudio fue aprobado por el Comité Ético de Investigación Clínica de Granada y todos los pacientes firmaron un documento de consentimiento informado.
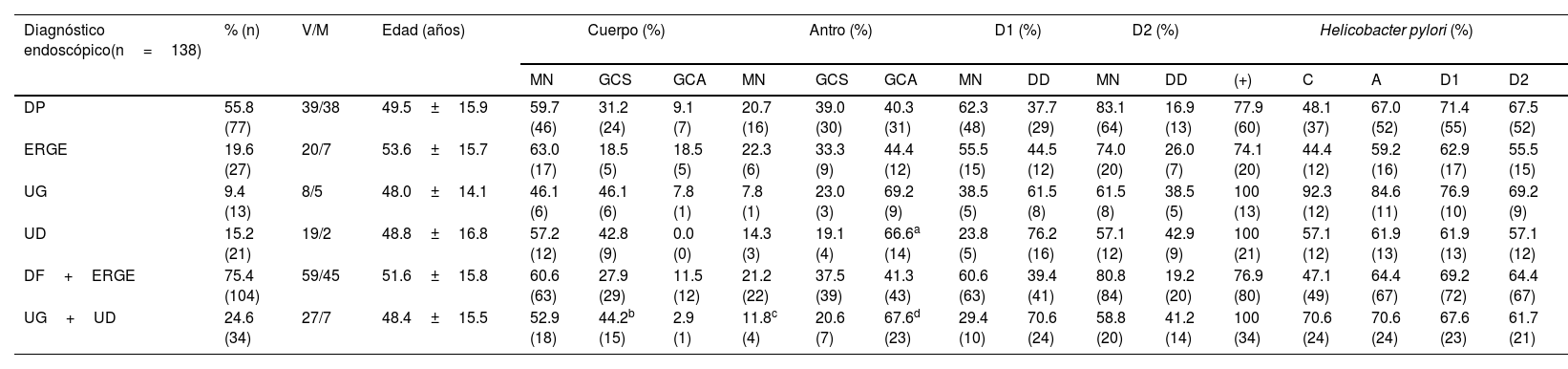
ResultadosLos datos demográficos y el estado inflamatorio o microbiológico de la mucosa gastroduodenal se resumen en la tabla 1. En nuestra muestra, la prevalencia total de dispepsia, DF y H. pylori fue de 80.4%, 69.4% y 82.6%, respectivamente.
Mucosa gastroduodenal en los 138 pacientes
| Diagnóstico endoscópico(n=138) | % (n) | V/M | Edad (años) | Cuerpo (%) | Antro (%) | D1 (%) | D2 (%) | Helicobacter pylori (%) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MN | GCS | GCA | MN | GCS | GCA | MN | DD | MN | DD | (+) | C | A | D1 | D2 | ||||
| DP | 55.8 (77) | 39/38 | 49.5±15.9 | 59.7 (46) | 31.2 (24) | 9.1 (7) | 20.7 (16) | 39.0 (30) | 40.3 (31) | 62.3 (48) | 37.7 (29) | 83.1 (64) | 16.9 (13) | 77.9 (60) | 48.1 (37) | 67.0 (52) | 71.4 (55) | 67.5 (52) |
| ERGE | 19.6 (27) | 20/7 | 53.6±15.7 | 63.0 (17) | 18.5 (5) | 18.5 (5) | 22.3 (6) | 33.3 (9) | 44.4 (12) | 55.5 (15) | 44.5 (12) | 74.0 (20) | 26.0 (7) | 74.1 (20) | 44.4 (12) | 59.2 (16) | 62.9 (17) | 55.5 (15) |
| UG | 9.4 (13) | 8/5 | 48.0±14.1 | 46.1 (6) | 46.1 (6) | 7.8 (1) | 7.8 (1) | 23.0 (3) | 69.2 (9) | 38.5 (5) | 61.5 (8) | 61.5 (8) | 38.5 (5) | 100 (13) | 92.3 (12) | 84.6 (11) | 76.9 (10) | 69.2 (9) |
| UD | 15.2 (21) | 19/2 | 48.8±16.8 | 57.2 (12) | 42.8 (9) | 0.0 (0) | 14.3 (3) | 19.1 (4) | 66.6a (14) | 23.8 (5) | 76.2 (16) | 57.1 (12) | 42.9 (9) | 100 (21) | 57.1 (12) | 61.9 (13) | 61.9 (13) | 57.1 (12) |
| DF+ERGE | 75.4 (104) | 59/45 | 51.6±15.8 | 60.6 (63) | 27.9 (29) | 11.5 (12) | 21.2 (22) | 37.5 (39) | 41.3 (43) | 60.6 (63) | 39.4 (41) | 80.8 (84) | 19.2 (20) | 76.9 (80) | 47.1 (49) | 64.4 (67) | 69.2 (72) | 64.4 (67) |
| UG+UD | 24.6 (34) | 27/7 | 48.4±15.5 | 52.9 (18) | 44.2b (15) | 2.9 (1) | 11.8c (4) | 20.6 (7) | 67.6d (23) | 29.4 (10) | 70.6 (24) | 58.8 (20) | 41.2 (14) | 100 (34) | 70.6 (24) | 70.6 (24) | 67.6 (23) | 61.7 (21) |
A: antro; C: cuerpo; D1: duodeno proximal; D2: duodeno distal; DD: duodenitis II+III; DF: dispepsia funcional; ERGE: enfermedad por reflujo gastroesofágico; GCA: gastritis crónica atrófica; GCS: gastritis crónica superficial; MN: mucosa normal; UC: úlcera gástrica; UD: úlcera duodenal.
Cuerpo gástrico. La frecuencia de mucosa normal (MN), GCS y GCA fue similar en los 4 subgrupos, con escaso componente atrófico. La frecuencia de GCS fue significativamente mayor respecto a la de GCA en el grupo con úlcera que en el de sin úlcera (p<0.05) (tabla 1).
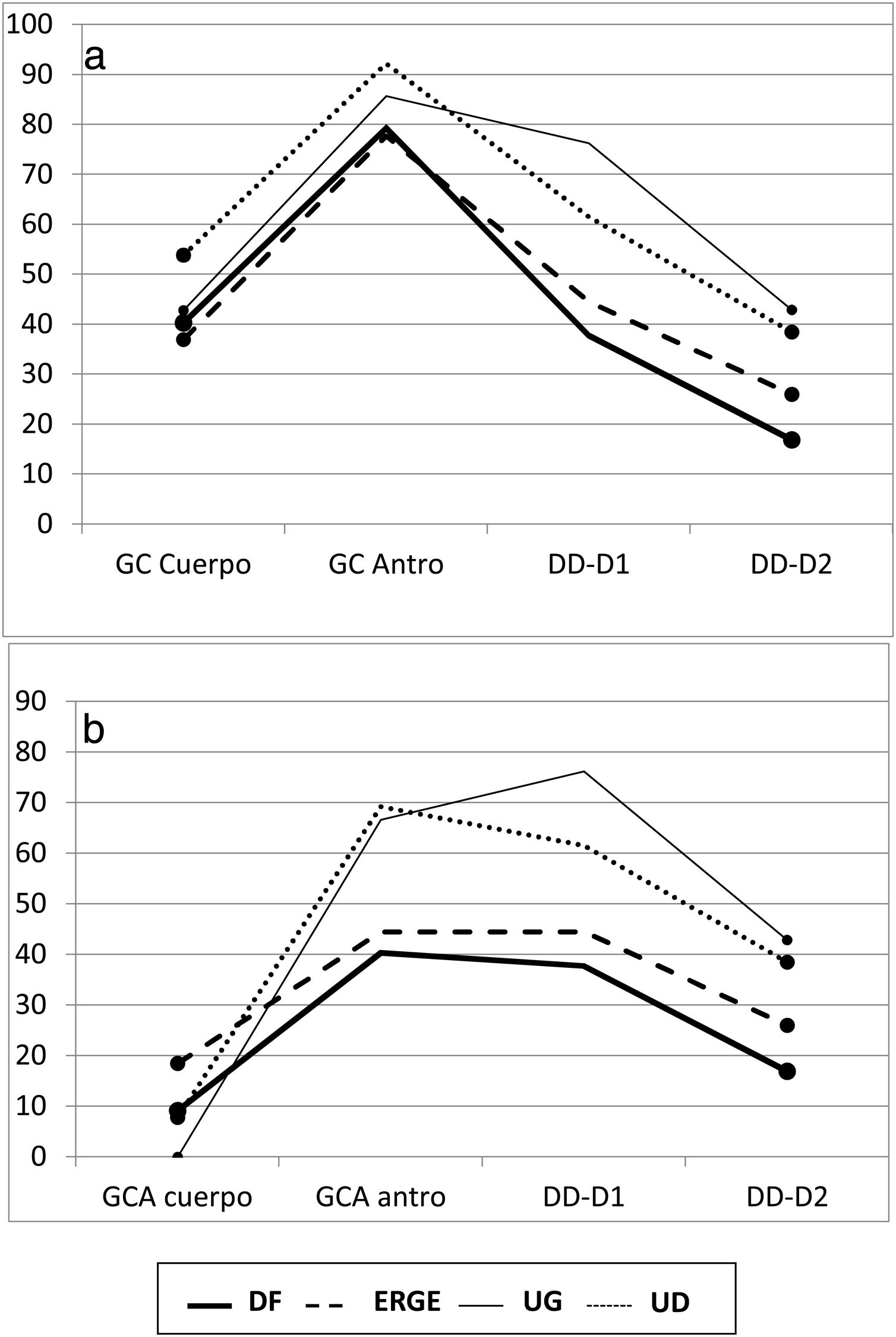
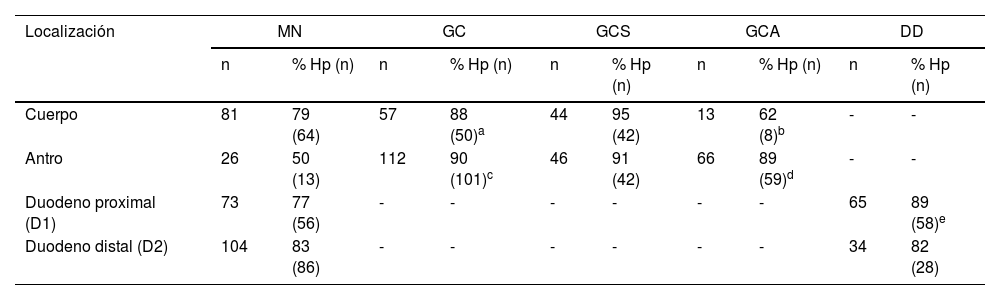
Antro gástrico. En esta localización gástrica existió un aumento en los fenómenos inflamatorios en todos los subgrupos, como se evidenció por el claro predominio de GC vs. MN. En el antro, y en todos los subgrupos, la frecuencia de fenómenos atróficos (GCA) fue mayor que la de GCS, pero esta diferencia solo fue significativa al comparar los subgrupos de DF y UD (p<0.05). Cuando se compararon los grupos con úlcera y sin úlcera, se comprobaron las diferencias entre las frecuencias de MN y GCA (p<0.05) y entre GCS y GCA (p<0.02) (tabla 1). De forma gráfica, el mapa inflamatorio gastroduodenal de todos los subgrupos mostró forma en V invertida, con una mayor elevación en los subgrupos ulcerosos por mostrar un mayor porcentaje de GC en el antro. Al considerar solo la presencia de GCA, tanto del cuerpo como del antro, la imagen de la figura 1a se transformó en una elevación seguida de una «meseta», que fue descendente en el subgrupo de UG y ascendente en el subgrupo de UD como consecuencia del mayor porcentaje de DD-D1 en UD vs. UG (fig. 1b).
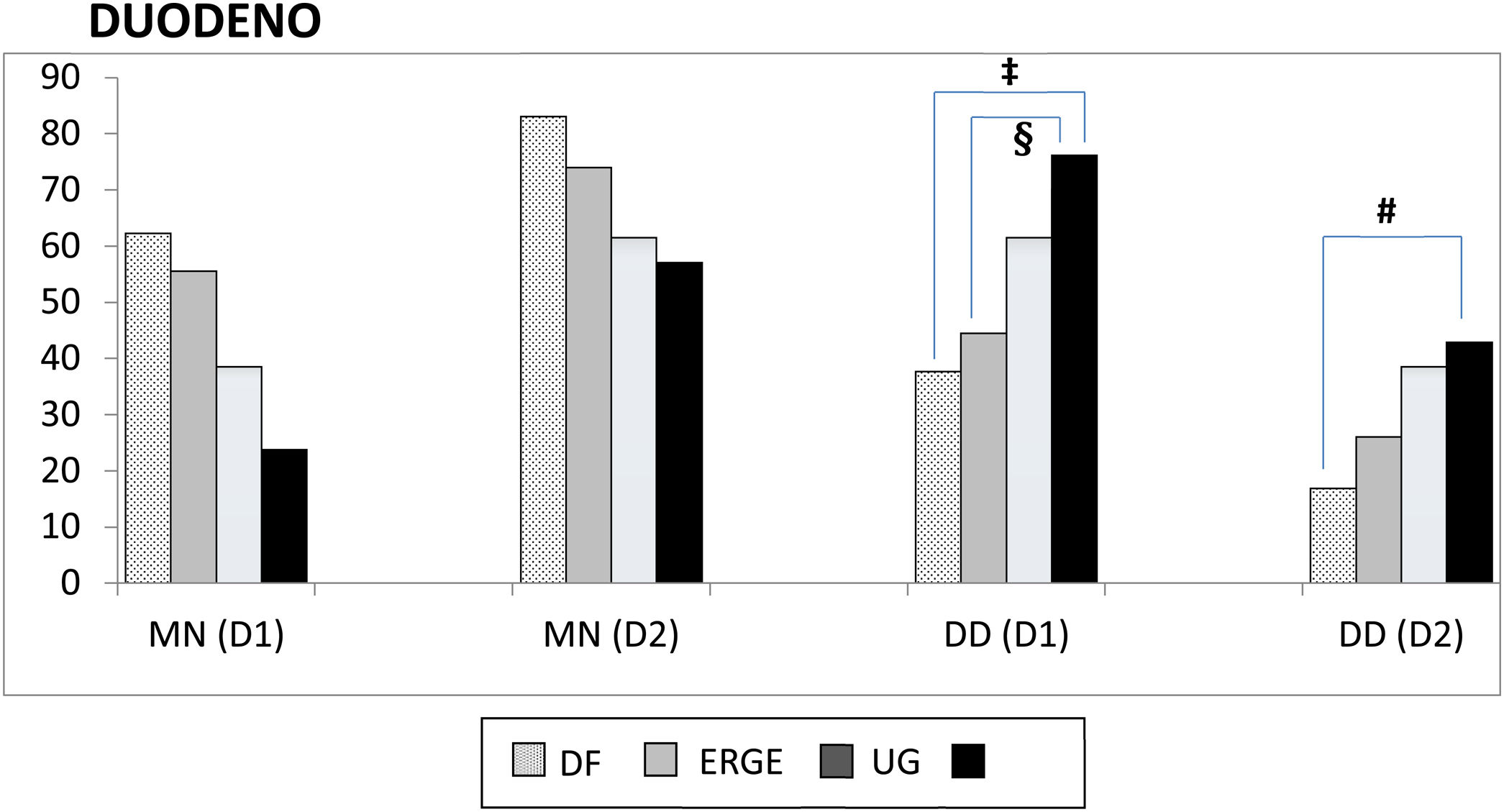
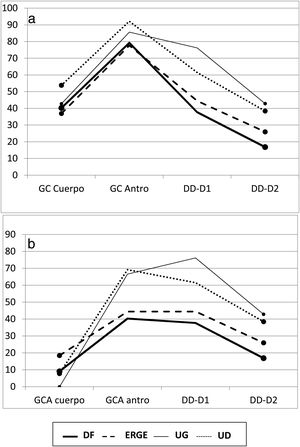
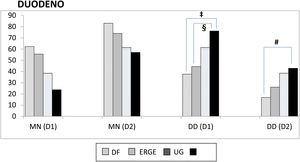
Duodeno proximal y distal. En el duodeno, tanto en D1 como en D2, se apreció una mayor frecuencia de DD que de MN en los pacientes con UG, aunque sin significación estadística al compararla con la de otros subgrupos. Por el contrario, cuando se consideraron los pacientes con UD, se apreciaron varias diferencias con otros subgrupos con relación a la frecuencia de DD vs. MN tanto en D1 (UD vs. DF; p<0.004 y UD vs. ERGE; p<0.05) como en D2 (UD vs. DF; p<0.02) (fig. 2). De forma similar, tanto en D1 como en D2, existió una mayor frecuencia de DD vs. MN al comparar los grupos con úlcera y sin úlcera (en D1: p<0.003 y en D2: p<0.01). La DD fue significativamente más frecuente en D1 que en D2 en los pacientes con DF (p<0.007). Este hallazgo también se apreció en los pacientes con UD (p<0.05), así como en los grupos con y sin úlcera (p<0.002 y p<0.02, respectivamente). Al considerar la totalidad de los 138 pacientes estudiados, se comprobó como la presencia de MN y DD en D1 y D2 estaban muy relacionadas, de forma que cuando en D1 la mucosa era normal también lo era en D2 en el 89% de los casos. Inversamente, cuando existía DD en D1 también se apreciaba en D2 en el 43% de los casos (p<0.0001); hallazgo que también se confirmó al agrupar a los 138 pacientes en los grupos con y sin úlcera (p<0.001).
Mucosa normal duodenal y duodenitis.
D1: duodeno proximal; D2: duodeno distal; DD: duodenitis II+III; DF: dispepsia funcional; ERGE: enfermedad por reflujo gastroesofágico; MN: mucosa normal; UD: úlcera duodenal; UG: úlcera gástrica.
‡ MN vs. DD-D1 entre UD y DF, p<0.004; § MN vs. DD-D1 entre UD y ERGE, p<0.05; # MN vs. DD-D2 entre UD y DF, p<0.02.
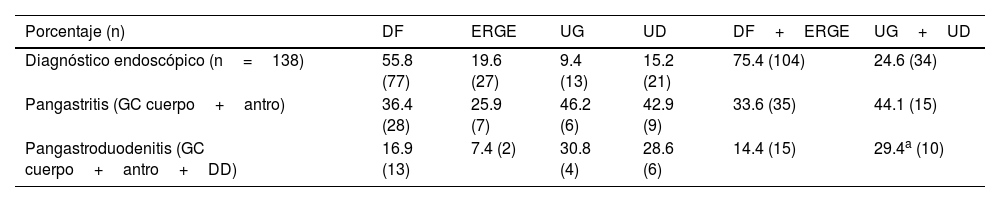
Pangastritis y pangastroduodenitis. La pangastroduodenitis solo fue más frecuente en el grupo con úlcera que en el de sin úlcera (p<0.05) (tabla 2).
Extensión de la inflamación gastroduodenal
| Porcentaje (n) | DF | ERGE | UG | UD | DF+ERGE | UG+UD |
|---|---|---|---|---|---|---|
| Diagnóstico endoscópico (n=138) | 55.8 (77) | 19.6 (27) | 9.4 (13) | 15.2 (21) | 75.4 (104) | 24.6 (34) |
| Pangastritis (GC cuerpo+antro) | 36.4 (28) | 25.9 (7) | 46.2 (6) | 42.9 (9) | 33.6 (35) | 44.1 (15) |
| Pangastroduodenitis (GC cuerpo+antro+DD) | 16.9 (13) | 7.4 (2) | 30.8 (4) | 28.6 (6) | 14.4 (15) | 29.4a (10) |
DD: duodenitis II+III; DF: dispepsia funcional; ERGE: enfermedad por reflujo gastroesofágico; GC: gastritis crónica; MN: mucosa normal; UC: úlcera gástrica; UD: úlcera duodenal.
Helicobacter pylori. En la tabla 3 se muestra el mapa inflamatorio gastroduodenal de los 114 pacientes con H. pylori. En todos los grupos y en todos los niveles evaluados, el mapa inflamatorio estuvo íntimamente relacionado con la presencia de H. pylori. Así, se comprobó que la GC de cuerpo, GC de antro y la DD se relacionaron de forma significativa con la colonización por H. pylori (tabla 3) y, aunque esta no predominó significativamente en ninguna localización, fue más elevada en los pacientes con UG, tanto en el cuerpo (92.3%) como en el antro gástrico (84.6%). Por otra parte, se apreció que la colonización por H. pylori era menos frecuente cuando había GCA en cuerpo que en antro (% H. pylori+ en GCA-cuerpo vs. GCA-antro: p<0.03). Solo entre los grupos con y sin úlcera, y en el antro, se observó una relación entre la presencia de H. pylori, GCA y DD-D1 (p<0.02).
Mapa inflamatorio en pacientes con Helicobacter pylori
| Localización | MN | GC | GCS | GCA | DD | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % Hp (n) | n | % Hp (n) | n | % Hp (n) | n | % Hp (n) | n | % Hp (n) | |
| Cuerpo | 81 | 79 (64) | 57 | 88 (50)a | 44 | 95 (42) | 13 | 62 (8)b | - | - |
| Antro | 26 | 50 (13) | 112 | 90 (101)c | 46 | 91 (42) | 66 | 89 (59)d | - | - |
| Duodeno proximal (D1) | 73 | 77 (56) | - | - | - | - | - | - | 65 | 89 (58)e |
| Duodeno distal (D2) | 104 | 83 (86) | - | - | - | - | - | - | 34 | 82 (28) |
DD: duodenitis II+III; GC: gastritis crónica; GCA: gastritis crónica atrófica; GCS: gastritis crónica superficial; Hp: con Helicobacter pylori; MN: mucosa normal; UC: úlcera gástrica; UD: úlcera duodenal.
Cuerpo:
La prevalencia de DF entre nuestros pacientes con dispepsia fue del 69.4%, similar a lo comunicado11-13, en donde casi 2/3 de los pacientes que se realizan una gastroscopia no muestran lesiones gastroduodenales12. La prevalencia de infección por H. pylori en dispépticos (84.7%) y en la DF (77.9%) mostró valores lógicamente mayores a los encontrados en la población general a la que pertenecían nuestros pacientes (52%)14, aunque dentro del rango de lo descrito15-19. Ello confirma que en la DF la prevalencia de H. pylori es ≈50% más elevada que en la población general, lo que indica un protagonismo del H. pylori sobre algún aspecto de la fisiopatología y síntomas de la DF. Esta suposición, ya comunicada20-24, justifica que hasta un 10% de los pacientes con DF queden asintomáticos tras la erradicación de la bacteria. Esta nueva dispepsia, que ya no sería DF, es la denominada «dispepsia por H. pylori»20-22. Las diferentes prevalencias comunicadas pueden deberse a distintos criterios utilizados para definir al paciente con H. pylori, al variable número de biopsias obtenidas o a investigaciones realizadas sobre poblaciones geográfica o culturalmente diferentes25.
En el cuerpo, en los 4 subgrupos, se apreció una MN en ≈50-60% de los pacientes. Según nuestros datos, alrededor de los 50 años de edad, aproximadamente la mitad de los pacientes con DF/ERGE tienen una MN en el cuerpo y los restantes mostrarán una GC que, generalmente, será GCS. Ello coincide con la hipótesis de que la infección por H. pylori se adquiere en la infancia/adolescencia para, después, desarrollarse una GC en el cuerpo que, lentamente, progresará hacia grados moderado o grave de GC1-4. En el cuerpo, adjunta a la GC, está la presencia de H. pylori en el 45-60% de todos los subgrupos, excepto el de UG (92.3%). Este dato confirma el gran protagonismo de H. pylori en el cuerpo en el desarrollo de la UG1,3, aunque para ello no parece necesaria la existencia de una elevada frecuencia de GCA, que solo se encontró en el 7.8% de los pacientes con UG. Cuando la GCA de cuerpo es extensa, se produce aclorhidria por destrucción masiva de células parietales, lo que cambia el hábitat y hace que disminuya o desaparezca H. pylori1. La baja frecuencia de GCA en la UG favorecería el alto nivel de colonización encontrado1,2. Nuestros hallazgos concuerdan con el patrón descrito en la UG por los grupos escandinavos3,4: marcada GCA en antro/incisura angular con metaplasia intestinal y, en el cuerpo, GCS con ausente o leve GCA (sin aclorhidria). En el cuerpo, podemos considerar el grupo no ulceroso con ≈60% de MN paralela a una menor colonización (<50%) y el grupo ulceroso con alta colonización bacteriana (≥60%) y algo más de inflamación, en donde la GCS fue significativamente más frecuente que la GCA, en la línea de lo referido en otros estudios1,26.
En el antro gástrico hubo un aumento de GC en todos los subgrupos. La presencia de GC fue especialmente elevada en aquellos con UG (92.2%) y UD (85.7%), apreciándose una GCA en más de 2/3 de los casos y H. pylori en más del 60%, sin observarse un significativo predominio de la bacteria en antro vs. cuerpo, hecho referido en algunos estudios2,4,15,26. En el subgrupo de UD, en el antro, las elevadas frecuencias de GCA y colonización por H. pylori se desarrollaron paralelas al patrón ya comentado en el cuerpo (predominio de una MN o GCS y normosecreción por ausencia o escasez de fenómenos atróficos)3,4. De forma resumida, en el antro, se comprobó un grupo no ulceroso con ≈20% de MN, similar proporción de GCS-GCA y ≈65% de colonización, y un grupo péptico con muy escasa MN (<15%), GCA predominante (65-70%) y colonización bacteriana ≈70%. La elevada frecuencia de GCA en el antro en el grupo ulceroso vs. no ulceroso es una característica también apreciada en otros estudios1,3,4,15,26 e indica que la atrofia en el antro es una condición previa para el desarrollo posterior de una UG3,4. Sorprende comprobar que, tanto en el cuerpo como en el antro y en los subgrupos ulcerosos, las frecuencias de infección por H. pylori eran similares y, sin embargo, los porcentajes de GCA eran sensiblemente mayores en el antro que en el cuerpo. Este hallazgo se ha justificado por la existencia de una mayor respuesta inmune y consecuente reactividad inflamatoria frente al H. pylori en el antro, o bien por la presencia preferente de cepas de H. pylori (gen-CagA), que inducirían una mayor producción de citocinas proinflamatorias2,26,27.
Son muy escasos los estudios histológicos gástricos que se complementan con los del duodeno y, excepcionales, los que incluyen la D2. La prevalencia de DD-D1 en los grupos ulcerosos es lógicamente más elevada que en la DF: se han comunicado en esta prevalencias entre 36 y 76%18,25,26,28,29 vs. 37% en controles asintomáticos29. Nuestra prevalencia de DD-D1 en la DF (37.7%) está en el rango inferior de lo comunicado, similar a la de controles asintomáticos y en la línea de lo referido en algunos estudios europeos25,28. Las prevalencias más elevadas se apreciaron en investigaciones que utilizaron métodos semicuantitativos para definir la DD y en poblaciones asiáticas, lejanas culturalmente a la nuestra18,26, lo que podría justificar las diferencias apreciadas. No hemos encontrado estudios con los que comparar la prevalencia de DD-D2 que encontramos en la DF (16.9%), al ser este segmento motivo excepcional de estudio, aunque la justificación de su baja frecuencia se comenta más adelante. Por lo tanto, este sería el primer estudio en comunicar la prevalencia conjunta de la DD en D1 y D2 en la DF. Estos datos deben alertar sobre la posibilidad de la existencia de lesiones inflamatorias moderadas/graves en el duodeno de pacientes sin úlcera, tanto con síntomas (DF) como sin ellos (controles asintomáticos)29.
Ya se ha comentado que más de 2/3 de los pacientes del grupo ulceroso y más de 3/4 del subgrupo de UD se caracterizaron por presentar DD en D1 y ≈40% en D2. En el grupo ulceroso, la presencia de DD se relacionó significativamente con la existencia de H. pylori y GCA en el antro, pero solo en D1. Esta relación es controvertida, pues ha sido comunicada en algunos estudios17,18,27,28 y no ha sido apreciada en otros30. Ante esta relación condicionada antro-duodeno parece lógico pensar que, con la evolución de la infección bacteriana, el estado inflamatorio y atrófico del antro se traspasará a su próximo nivel distal D1, reproduciendo allí los fenómenos acontecidos previamente en el antro. La UG necesita para su desarrollo la existencia previa de una GCA en el antro y la UD la colonización de D1 por H. pylori proveniente del antro y posterior desarrollo de DD. Que esta relación solo aparezca en D1 y no en D2 se podría justificar por los cambios en el hábitat en áreas más distales, que impedirían que la infección por H. pylori se desarrollase en condiciones adecuadas. En todo caso, esta discrepancia podría justificarse por la consideración de grupos muy heterogéneos de pacientes o metodologías diferentes para su clasificación o determinaciones histológicas/bacterianas. El H. pylori, en ambiente adecuado, coloniza el antro e induce una GC. Desde ahí es arrastrado hacia D1, en donde suele haber suficiente carga ácida como para sobrevivir e inducir DD sin UD asociada. Si la sobrecarga ácida en D1 es crónica o intensa, se producen fenómenos adaptativos (metaplasia gástrica), lo que favorece su colonización o infección y predispone al desarrollo de UD. Esta secuencia, no se produce en D2 al quedar «parada» en la fase de DD sin metaplasia gástrica, por lo que a ese nivel es excepcional la existencia de UD3,4,27. La «parada» de la secuencia sería por la dilución del ácido o el continuo peristaltismo, que impediría la acción persistente del ácido sobre la mucosa, la metaplasia gástrica y la colonización bacteriana. Los datos de nuestro estudio se adaptan bien a toda esta secuencia de acontecimientos. La DD en pacientes con H. pylori y sin UD puede ser el paso previo al desarrollo de UD o el siguiente a su reciente curación, lo que explicaría que dichos pacientes fueran calificados como DF si no se tomaran biopsias duodenales que advirtieran sobre la presencia subyacente de una DD. Estos hechos podrían justificar y explicar por qué desaparecen los síntomas dispépticos, en algunos pacientes diagnosticados de DF, tras la erradicación de la bacteria19-21 y señalan, con contundencia, que en este subgrupo de pacientes con DF los síntomas realmente tendrían un origen duodenal más que gástrico5,6,23,25,26. En D2, tras la tormenta inflamatoria en cuerpo-antro-D1, apreciamos una calma inflamatoria, con un aumento en la frecuencia de MN de ≈30% (en el grupo sin úlcera) y ≈100% (en el grupo con úlcera), respecto a lo apreciado en D1. En esta línea está el hallazgo referido de que una MN en D1 condicionaba casi siempre (89%) la normalidad en D2, pero si se encontraba una DD en D1, la DD solo sucedía en D2 en el 43% de los casos. Por último, cabe señalar que solo el grupo con úlcera mostró un estómago con significativas mayores frecuencias de pangastritis, DD-D1 y colonización por H. pylori que el grupo sin úlcera, lo que resultó en un mapa inflamatorio gastroduodenal significativamente más intenso o mayor pangastroduodenitis.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.