La colitis ulcerosa crónica idiopática (CUCI) se caracteriza por una inflamación crónica e incontrolada de la mucosa intestinal. Se ha informado que la disbiosis del microbioma intestinal es un factor de inflamación intestinal. El objetivo del presente trabajo fue estudiar los cambios en el microbioma intestinal en pacientes egipcios con CUCI activa.
Materiales y métodosEn este estudio transversal, se analizó el microbioma intestinal de 21 pacientes con CUCI y de 20 sujetos como grupo de control mediante la técnica de PCR cuantitativa SYBR Green en tiempo real dirigida al ARNr 16S de filos/géneros o especies bacterianas seleccionadas.
ResultadosLos pacientes con CUCI mostraron una marcada disbiosis, evidenciada por una disminución significativa de las bacterias antiinflamatorias Firmicutes y F. prausnitzii. La relación Firmicutes/Bacteroidetes también fue menor en los casos de CUCI (1,65) en comparación con los controles sanos (2,93). Además, los casos de CUCI mostraron una disminución estadísticamente significativa en Ruminococcus en comparación con el grupo de control. Sin embargo, no hubo diferencia estadísticamente significativa entre los pacientes con CUCI y los casos de control en lo que respecta a A. muciniphila, Bifidobacterium, Lactobacillus, Bacteroides y Prevotella. Un caso de CUCI fue positivo a Clostridioides difficile, de baja abundancia relativa.
ConclusiónEl presente estudio mostró diferencias en el microbioma intestinal de los pacientes con CUCI en comparación con los controles sanos. Esto puede ayudar a identificar el microbioma intestinal y los cambios bacterianos específicos que pueden ser objeto de tratamiento de la CUCI.
Ulcerative colitis (UC) is characterized by chronic, uncontrolled inflammation of the intestinal mucosa. Gut microbiota dysbiosis was reported to be a factor in intestinal inflammation. The aim of the present study was to study changes in the gut microbiome in Egyptian patients with active UC.
Materials and methodsIn this cross-sectional study, the gut bacterial microbiome of 21 UC patients and 20 control subjects was analyzed using the quantitative SYBR Green real-time PCR technique, targeting the 16S rRNA gene of selected bacterial phyla/genera and/or species.
ResultsUC patients showed marked dysbiosis evidenced by a significant decrease in the Firmicutes and F. prausnitzii anti-inflammatory bacteria. The Firmicutes/Bacteroidetes ratio was also lower in the UC cases (1.65), compared with the healthy controls (2.93). In addition, the UC cases showed a statistically significant decrease in Ruminococcus, compared with the control group. However, there were no statistically significant differences between UC patients and the controls, regarding A. muciniphila, Bifidobacterium, Lactobacillus,Bacteroides, and Prevotella. One UC case was positive for the pathogenic bacterium, Clostridioides difficile, with low relative abundance.
ConclusionThe current study showed differences in the gut microbiome of UC patients, compared with healthy controls. This may help in identifying the gut microbiome and specific bacterial changes that can be targeted for treatment of UC.
El microbioma intestinal ha sido recientemente reconocido como un importante factor detonador para enfermedades autoinmunes. La disbiosis intestinal desempeña un papel crítico en la desregulación de la respuesta inmune y ha sido ligada a inflamación, daño tisular y pérdida de tolerancia inmune.
Nuevos hallazgosLos pacientes egipcios con colitis ulcerosa crónica idiopática (CUCI) activa presentaron disbiosis del microbioma intestinal. Esto destaca la importante relación entre el microbioma intestinal y la cadena etiopatogénica de la CUCI. Este hallazgo señala los beneficios terapéuticos potenciales de manipular la composición del microbioma intestinal en el manejo de la CUCI, o incluso en la protección contra la enfermedad.
La enfermedad inflamatoria intestinal consiste de 2trastornos principales: colitis ulcerosa crónica idiopática (CUCI) y enfermedad de Crohn. El signo distintivo de la CUCI es la inflamación descontrolada y crónica de la mucosa intestinal1. La etiología y patogénesis de la CUCI es aún confusa, pero involucra una influencia multifactorial genética, ambiental, microbiana e inflamatoria2.
El microbioma intestinal humano es uno de los ecosistemas más densamente poblados que se conocen. Con base en análisis moleculares, la mayoría de las bacterias pertenecen a 2filos, Bacteroidetes y Firmicutes. Faecalibacterium prausnitzii es un miembro muy importante del filo Firmicutes y una de las principales bacterias productoras de butirato en la microbiota humana saludable3,4. La producción de butirato ha sido correlacionada con la capacidad de inducir IL-10, una citocina antiinflamatoria5. También se ha encontrado que la F. prausnitzii es un inductor importante de células T, las cuales secretan IL-106. El ácido butírico refuerza las uniones entre las células epiteliales e induce síntesis de mucina, lo que evita la inflamación y el síndrome de intestino permeable7.
Lactobacilli y Bifidobacteria producen sustancias ácidas bactericidas, como el ácido láctico, bacteriocinas y ácidos grasos de cadena corta. Estos ácidos de cadena corta están involucrados en la estimulación de producción de mucosidad, prevención de inflamación y aumento total y específico para patógenos de la IgA de la mucosa8.
A. muciniphila reside en la capa de mucosa del intestino grueso, en donde se involucra en la manutención de la integridad intestinal al incrementar el grosor mucoso y la función de la barrera intestinal9.
Las respuestas inflamatorias intestinales pueden ser debidas a la disrupción de la microbiota intestinal, conocida como disbiosis. Dicha disrupción lleva a un rápido incremento en la población de bacterias dañinas en el intestino. Además, incrementa la permeabilidad de la mucosa intestinal debido a la liberación de enterotoxina y la producción de proteína inmunosupresora resulta en disfunción inmune. Las poblaciones crecientes de bacterias dañinas invaden directamente las células epiteliales intestinales, lo cual lleva al daño de la barrera de mucosa intestinal10.
El presente estudio fue diseñado para elucidar los cambios en el microbioma intestinal en pacientes egipcios con CUCI activa y para correlacionar dichas bacterias con la gravedad de la CUCI. Esto podría tener impacto en la futura comprensión de la patogénesis de esta enfermedad y en los posibles abordajes de su prevención y tratamiento.
Métodos y participantesParticipantesEste estudio transversal incluyó a 21 pacientes egipcios con CUCI activa que fueron reclutados de la clínica ambulatoria de gastroenterología del Hospital Universitario Principal de Alejandría y del ala de gastroenterología para pacientes internados en dicho hospital y a 20 sujetos saludables egipcios para el grupo control emparejados por edad, sexo e índice de masa corporal. Los hábitos alimentarios de todos los participantes fueron evaluados por medio de un cuestionario de frecuencia de alimentos.
Criterios de exclusiónMalignidad; intervención quirúrgica reciente en intestino delgado o grueso (últimos 6 meses); diarrea infecciosa, incluida diarrea bacteriana, viral y por parásitos, diagnosticada con análisis de heces, cultivo y proteína C reactiva (PCR) para ciertos patógenos; antecedentes de uso prolongado de antibióticos; abuso de fármacos antiinflamatorios no esteroideos; antecedentes de corticoesteroides, metotrexato, azatioprina o 6-mercaptopurina en los últimos 3 meses; terapia biológica; otras enfermedades autoinmunes; embarazo; quemadura grave; sepsis; enfermedades renales y hepáticas graves; diabetes mellitus; vegetarianismo puro; adicción al alcohol u otras sustancias; incapacidad para otorgar el consentimiento informado debido a trastorno mental. También se excluyó a los niños. Se requirió que los pacientes no hubieran tomado medicamentos activos para el tratamiento de la CUCI, como el ácido 5-aminosalicílico o salzosulfapiridina, una semana antes de comenzar el estudio.
Consideraciones éticasEl estudio sigue los principios de la Declaración de Helsinki (1964) y fue aprobado por el Comité de Ética de Investigación Médica de la Facultad de Medicina de Alejandría (Egipto).
Se obtuvieron los consentimientos informados firmados de todos los pacientes, que expresaron su aceptación para participar en el estudio y otorgaron el permiso para la publicación de los resultados.
A todos los pacientes y controles se les hicieron historias médicas completas, además de un examen clínico completo. La CUCI fue diagnosticada con base en exámenes clínicos, radiológicos, endoscópicos e histológicos11. La actividad de la CUCI fue determinada por medio de un compuesto de índices clínicos y endoscópicos (el Índice de Actividad de la Clínico Mayo y el Índice de Gravedad de la Enfermedad), con puntuaciones de 0 a 12 puntos (de actividad nula a la actividad más severa) y subíndices (con la combinación de sangrado rectal, frecuencia de heces y la evaluación global del médico o el subíndice de endoscopia)12.
Pruebas de laboratorio, colonoscopia y estudio histopatológicoSe realizó una preparación de laboratorio de rutina, incluido un conteo sanguíneo completo, función hepática (alanina aminotransferasa y aspartato aminotransferasa), albúmina, bilirrubina, HBsAg y HCVAb, glucemia en ayunas y posprandial, colesterol, triglicéridos, nitrógeno ureico en sangre, creatinina, velocidad de sedimentación globular, PCR, calprotectina fecal y pANCA.
En todos los pacientes se realizó colonoscopia. La preparación intestinal consistió en una dieta baja en fibra el día anterior a la colonoscopia y una dosis dividida de 4 L de solución de polietilenglicol (o una sola dosis en caso de colonoscopia realizada por la tarde), no más de 4h antes de la colonoscopia. Se obtuvieron 4especímenes de biopsia de 5sitios, incluidos el íleon y el recto, tanto de mucosa afectada como de mucosa aparentemente normal; los especímenes de diferentes locaciones fueron etiquetados y manejados por separado.
El espécimen de biopsia fue examinado histopatológicamente.
Estudio del microbiomaLas muestras frescas de heces fueron recolectadas de casos y controles y almacenadas en alícuotas a –80° para su procesamiento.
Extracción de ADNEl ADN fue extraído de muestras de heces de 180-220mg utilizando el QIAamp® Fast DNA Stool Mini Kit (Qiagen, Alemania), según las instrucciones del fabricante. Los extractos de ADN fueron almacenados a –80°C hasta la realización de las pruebas PCR. Dos μl de extracto de ADN fueron utilizados en la reacción PCR.
SYBR Green PCR en tiempo realSe ejecutó el protocolo de PCR en tiempo real, de la manera descrita por Tomova et al. (2015)13. Se utilizaron cebadores específicos para PCR dirigidos a filos, géneros o especies seleccionados constituyentes de la microbiota intestinal (Bacteroides, Prevotella, Ruminococcus, Bacteroidetes, Firmicutes, Bifidobacterium, Lactobacillus, Clostridioides difficile, A. muciniphila y F. prausnitzii), además de un cebador de gama amplia dirigido a las secuencias ARNr 16S conservadas de todas las bacterias, cuya amplificación sirvió como denominador contra el cual se estimó la amplificación de otras bacterias.
La amplificación se hizo en un ciclador PCR en tiempo real, el Rotor-Gene Q (Qiagen, Alemania) utilizando un kit SensiFASTTM SYBR® No-ROX PCR (Bioline Co., Reino Unido). Se utilizaron volúmenes de reacción de 20μl, con 4 pmol de cada cebador. La reacción consistió de una desnaturalización inicial a 95°C por 10min, seguida de 40 ciclos de desnaturalización a 95°C por 30 s, recociendo a 30°C por 30 s y extensión a 72°C por 30 s. El análisis de la curva de fusión sirvió para revisar la especificidad de los productos amplificados. La cuantificación del ADN bacteriano específico fue expresada como cuantificación relativa (el umbral de ciclo [Ct] en el cual se detectó el ADN para un objetivo específico, relativo al Ct en el cual se detectó el ADN bacteriano universal). La cuantificación relativa fue calculada automáticamente por el programa Rotor Gene y expresada como expresión relativa13.
Se determinó el enterotipo de todos los participantes, según el tipo dominante presente en cada una de las 3bacterias: Bacteroides (enterotipo 1), Prevotella (enterotipo 2) o Ruminococcus (enterotipo 3).
Análisis estadístico 2.5Los datos fueron ingresados en la computadora y fueron analizados utilizando el paquete IBM SPSS versión 20.0 (Armonk, NY: IBM Corp., EE.?UU.). La información cualitativa fue descrita utilizando números y porcentajes, y se utilizó la prueba de Kolmogorov-Smirnov para verificar la normalidad de la distribución. La información cuantitativa fue descrita utilizando rango (mínimo y máximo), media, desviación estándar, mediana y rango intercuartílico (RIQ). La significación de los resultados se hizo al 5%.
Para comparar los diferentes grupos, se utilizó la prueba de chi cuadrada para las variables categóricas. Para los 2grupos de estudio, las variables cuantitativas distribuidas de manera normal se compararon utilizando la prueba t de Student y las variables cuantitativas no distribuidas de manera normal fueron comparadas utilizando la prueba U de Mann-Whitney. Para comparar más de 2grupos de estudio, se utilizó la prueba de Kruskal-Wallis para las variables cuantitativas distribuidas de manera anormal. Con el coeficiente de Pearson se correlacionaron 2variables cuantitativas con distribución normal y se utilizó regresión para detectar al factor más independiente que afectó a la Ruminococcus.
Para evaluar el grado de variación de la estructura de la comunidad microbiana dentro de una muestra medimos la diversidad alfa utilizando el índice de diversidad de Shannon14 y para evaluar el grado de similitud entre casos de CUCI y sus pares o controles utilizamos el índice de similitud de Bray-Curtis15.
ResultadosDatos demográficosEl presente estudio fue realizado en 21 pacientes con CUCI; 17 de los pacientes eran hombres y 4 mujeres, con una tasa hombre/mujer de 4.3:1. La edad de los pacientes tuvo un rango de 18-43 años, con una media de 28.90?±?6.55 años. El grupo control estuvo compuesto de 20 casos; 11 hombres y 9 mujeres, y su edad tuvo un rango de 20-42 años, con una media de 29.75 ± 5.17 años.
Datos clínicos y de laboratorioNinguno de los pacientes presentó historia familiar positiva de CUCI. La duración de la enfermedad tuvo un rango de 1-7 años, con una media de 1.86 ± 1.56 años. El índice de Mayo total tuvo un rango de 4-12, con una media de 9.05 ± 2.38, con 2 casos leves (9.5%), 12 moderados (57.1%) y 7 graves (33.4%). En la tabla 1 se muestran los diferentes puntos del índice de Mayo.
Distribución de casos de CUCI, según datos clínicos, de laboratorio, endoscópicos e histopatológicos
| Duración de la enfermedad | |
| Mín-Máx | 1.0-7.0 |
| Media ± DE | 1.86 ± 1.56 |
| Mediana (RIQ) | 1.0 (1.0-2.0) |
| Calprotectina fecal | |
| Mín-Máx | 98-2810 |
| Media ± DE | 533.95 ± 714.20 |
| Mediana (RIQ) | 180 (120-610) |
| PCR | |
| Mín-Máx | 7-102 |
| Media ± DE | 40.43 ± 34.94 |
| Mediana (RIQ) | 20 (12-76) |
| pANCA n (%) | |
| Negativa | 17 (81) |
| Positiva | 4 (19) |
| Hallazgos colonoscópicos n (%) | |
| Extensión de la enfermedad | |
| Pancolitis | 7 (33) |
| Colitis izquierda | 10 (48) |
| Proctitis | 4 (19) |
| Características macroscópicas | |
| Patrón vascular | |
| Disminución | 2 (9.5) |
| Pérdida | 19 (90.5) |
| Eritema de la mucosa | |
| Leve | 2 (9.5) |
| Marcada | 19 (90.5) |
| Sangrado espontáneo y ulceraciones graves | 7 (33) |
| Friabilidad/granularidad | |
| Leve | 7 (33) |
| Grave | 14 (67) |
| Erosiones/ulceración | 12 (57) |
| Pseudopólipos | 3 (14) |
| Características microscópicas | |
| Distorsión de arquitectura de cripta | 21 (100) |
| Atrofia de cripta | 21 (100) |
| Infiltración de cripta | 20 (95) |
| Densidad de cripta disminuida | 12 (57) |
| Absceso de cripta | 21 (100) |
| Criptitis | 13 (62) |
| Linfoplasmacitosis basal | 18 (85.7) |
| Metaplasia de células de Paneth | 16 (76) |
| 20 (95) | |
| Disminución de mucina | |
| Erosión/ulceración de superficie | 7 (33.4) |
| Infiltración de células inflamatorias | |
| Predominancia de neutrófilos (mayor a 70% de las células inflamatorias activas) | 9 (42.8) |
| Predominancia eosinofílica (mayor a 70% de las células inflamatorias activas) | |
| Mixta (neutrófilos y eosinófilos) | 5 (23.8) |
| Índice de Mayo Total/12 | |
| Mín-Máx | 4.0-12.0 |
| Media ± DE | 9.05 ± 2.38 |
| Mediana (RIQ) | 9.0 (8.0-11.0) |
| Frecuencia de heces/día n (%) | |
| 1 | 3 (14.3) |
| 2 | 10 (47.6) |
| 3 | 8 (38.1) |
| Sangrado rectal n (%) | |
| 1 | 2 (9.5) |
| 2 | 8 (38.1) |
| 3 | 11 (52.4) |
| Hallazgos endoscópicos n (%) | |
| 1 | 2 (9.5) |
| 2 | 12 (57.1) |
| 3 | 7 (33.4) |
| Valoración global del médico n (%) | |
| 1 | 3 (14.3) |
| 2 | 13 (61.9) |
| 3 | 5 (23.8) |
También la calprotectina fecal tuvo un rango de 98-2,810, con una media de 533.95 ± 714.20 y la PCR tuvo un rango de 7-102 con una media de 40.43 ± 34.94. Dieron negativo para pANCA 17/21 pacientes (81%) y 4/21 (19%) dieron positivo.
Datos endoscópicos e histológicosEn todos los pacientes se realizó una colonoscopia convencional. Se encontró una disminución en el patrón vascular normal y eritema leve en 2 pacientes y en 19 se encontró una pérdida completa del patrón vascular y eritema marcado. La friabilidad de la mucosa fue leve en 7 pacientes y severa en 14. Se observó erosión en 12 pacientes y ulceraciones graves y sangrado espontáneo en 7. En 3 pacientes se observó la presencia de pseudopólipos. En la tabla 1 se muestran los hallazgos macroscópicos y microscópicos.
Análisis del microbioma intestinalLa cuantificación de ADN bacteriano específico no fue expresada como número absoluto sino relativo al ADN bacteriano total presente en la muestra de heces. La media de los valores de la diferencia relativa de la variedad de bacterias fue mostrada en instancias en las que el valor decimal era bajo, como en E-05 (4.75×10-5 se muestra como 4.75E-05).
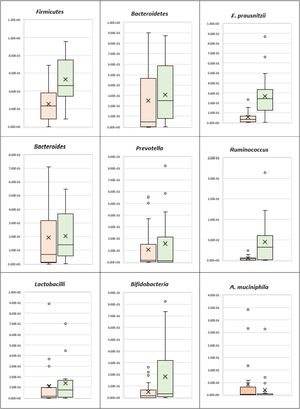
Análisis de filosEl análisis bacteriano de filo mostró que los pacientes con CUCI presentaban una disminución estadísticamente significativa en Firmicutes (p <0.001) y aunque Bacteroidetes presentaba disminución, la diferencia no fue estadísticamente significativa al compararla con el grupo control. Además, aunque la relación Firmicutes/Bacteroidetes fue más baja en los casos de CUCI (1.65), al compararla con los controles saludables (2.93) la diferencia no fue estadísticamente significativa (tabla 2) (fig. 1).
Comparación de la abundancia bacteriana relativa en los grupos de estudio
| Bacteria | Grupo CUCI | Grupo control | Prueba de significación (U) | p |
|---|---|---|---|---|
| A. muciniphila | 2.19E-03(3.96E-04-2.45E-02) | 1.43E-03(7.23E-04-3.29E-03) | 190.0 | 0.602 |
| Bacteroides | 7.0E-02(1.0E-02-2.50E-01) | 1.40E-01(6.0E-02-3.50E-01) | 167.0 | 0.262 |
| Bacteroidetes | 5.0E-02(4.93E-04- 4.50E-01) | 2.50E-01(8.0E-02-5.60E-01) | 159.50 | 0.188 |
| Bifidobacterium | 2.0E-02(3.49E-03-7.0E-02) | 4.0E-02(1.0E-02-2.60E-01) | 143.50 | 0.083 |
| C. difficile | 0.0E+00(0.0E+00-0.0E+00) | 0.0E+00(0.0E+00-0.0E+00) | 200.0 | 0.329 |
| F. prausnitzii | 3.0E-02(1.0E-02-5.0E-02) | 2.40E-01(1.20E-01-3.30E-01) | 44.0* | <0.001* |
| Firmicutes | 2.30E-01(1.00E-01-3.50E-01) | 4.60E-01(3.40E-01-7.50E-01) | 79.0* | <0.001* |
| Lactobacilli | 2.0E-02(3.33E-03-7.00E-02) | 7.0E-02(1.00E-02-1.70E-01) | 160.0 | 0.192 |
| Prevotella | 2.0E-02(3.92E-03-1.40E-01) | 1.0E-02(3.60E-03-1.80E-01) | 204.0 | 0.876 |
| Ruminococcus | 3.31E-03(1.82E-04-1.0E-02) | 3.0E-02(1.79E-03-6.0E-02) | 79.0* | 0.001* |
| Relación F/B | 1.65(0.8-118) | 2.93(1.31-7.96) | 193.50 | 0.657 |
| Relación P/B | 1.44(0.08-4.05) | 0.24(0.02-1.75) | 152.0 | 0.106 |
Se muestra la mediana (rango intercuartílico del percentil 25 al 75) de la abundancia relativa de las bacterias.
Relación F/B: relación Firmicutes/Bacteroidetes; Relación P/B: relación Prevotella/Bacteroidetes; U: prueba de Mann-Whitney.
Los pacientes con CUCI mostraron una disminución estadísticamente significativa en Ruminococcus, en la comparación con el grupo control (p=0.001), mientras que no existió diferencia estadísticamente significativa entre los pacientes con CUCI y los controles, respecto a Bacteroides y Prevotella (tabla 2) (fig. 1). Tampoco se observó diferencia estadísticamente significativa entre el grupo de CUCI y el grupo control respecto a la relación Prevotella/Bacteroides (tabla 2, fig. 1).
Análisis de especiesRespecto a las bacterias benéficas, los pacientes con CUCI mostraron una disminución estadísticamente significativa en F. prausnitzii, en comparación con el grupo control (p <0.001). Sin embargo, no se observó una diferencia estadísticamente significativa entre los pacientes con CUCI y los controles respecto a A. muciniphila, Bifidobacteria y Lactobacilli (tabla 2) (fig. 1).
Para la bacteria patógena Clostridioides difficile, ninguno de los casos controles fue positivo y solamente uno de los casos de CUCI fue positivo, con una abundancia relativa de 2.10E-6.
Respecto a los 3 grupos de gravedad en casos de CUCI, aunque las bacterias benéficas (A. muciniphila, Bifidobacterium, F. prausnitzii, y Firmicutes) fueron más altas en los casos leves que en los casos moderados y graves, la diferencia estadística no fue significativa.
Correlación con parámetros clínicosAl estudiar la correlación entre abundancia relativa de los diferentes componentes de la microbiota intestinal y la duración de la enfermedad, no se detectaron correlaciones estadísticamente significativas en el índice de Mayo total, calprotectina fecal y pANCA, excepto por una correlación positiva significativa entre A. muciniphila y calprotectina fecal (r=0.613, p=0.003). También se observó una correlación positiva significativa entre Ruminococcus y calprotectina fecal (r=0.448, p=0.041) y la duración de la enfermedad (r=0.467, p=0.033).
Un análisis de regresión lineal multivariado de los parámetros que afectan al Ruminococcus en los casos de CUCI mostró una correlación estadísticamente significativa entre el índice endoscópico y la calprotectina fecal, mientras que no se observó correlación estadísticamente significativa con la duración de la enfermedad (tabla 3).
Análisis de regresión lineal multivariado para los parámetros que afectan a Ruminococcus para el grupo CUCI
| Ruminococcus | Multivariadoa | |
|---|---|---|
| p | B (IC 95%) | |
| Duración de la enfermedad | 0.530 | 0.001 (–0.001-0.002) |
| Puntuación endoscópica | 0.008* | 0.007 (0.002-0.012) |
| Calprotectina fecal | 0.049* | 3.442E-006 (0.000-0.000) |
B: coeficientes no estandarizados; IC: intervalo de confianza.
El índice de diversidad de Shannon considera tanto la riqueza de especie como la uniformidad y mostró un nivel de diversidad microbiana más bajo en casos de CUCI que en los controles saludables. El valor mediano del índice de diversidad para CUCI fue 1.41 (casos leves=1.24, moderados=1.42, graves=1.44) y fue de 1.48 en los controles saludables. No se observó diferencia estadísticamente significativa entre los casos de CUCI (tabla 4).
Índice de diversidad de Shannon para el grupo de casos con CUCI
| Índice de diversidad | Leve (2) | Moderada (12) | Grave (7) | Prueba de significación | p |
|---|---|---|---|---|---|
| Mín-Máx | 1.17-1.31 | 0.73-1.76 | 0.38 1.57 | H=1.012 | 0.603 |
| Media ± DE | 1.24 ± 0.099 | 1.33 ± 0.321 | 1.22 ± 0.477 | ||
| Mediana | 1.24 | 1.42 | 1.44 |
H: prueba de Kruskal-Wallis.
Se utilizó el índice de similitud de Bray-Curtis para evaluar la similitud y disimilitud entre los casos de CUCI y los controles saludables. En comparación con los controles saludables, la media de la disimilitud (diferencia) para CUCI fue de 57%, con rango de 20-91%.
Los casos de CUCI leves, moderados y graves mostraron una disimilitud promedio, en relación con los controles saludables, de 41, 60 y 58%, respectivamente. Sin embargo, no se observó una diferencia estadísticamente significativa en gravedad.
Enterotipos de los participantes del estudioDiez (47.6%) de los pacientes con CUCI fueron asignados al enterotipo 1, 10 (47.6%) al enterotipo 2 y solo 1 al enterotipo 3. Por otro lado, 13 (65%) de los casos controles fueron asignados al enterotipo 1, 7 (35%) al enterotipo 2 y ninguno al enterotipo 3. No se detectaron diferencias estadísticamente significativas entre los 2 grupos respecto a la distribución por enterotipo (p=0.436).
DiscusiónSe cree que la colitis ulcerosa es causada por un desequilibrio entre la microbiota intestinal y la inmunidad de la mucosa, lo cual resulta en inflamación intestinal. Una baja presencia de bacterias antiinflamatorias y un incremento relativo de bacterias proinflamatorias desempeñan un papel importante en la patogénesis de la CUCI10.
Según los resultados del presente estudio, los pacientes con CUCI mostraron una disbiosis marcada, evidenciada por una disminución significativa en el filo Firmicutes y la especie F. prausnitzii, productora principal de butirato, con propiedades antiinflamatorias y un papel inmunomodulador en la homeostasis intestinal. A pesar de no haber sido significativa, la relación Firmicutes/Bacteroidetes también fue más baja en los casos de CUCI (1.65), en comparación con los controles saludables (2.93).
Nuestros resultados coinciden con estudios que muestran que el filo Firmicutes y la especie F. prausnitzii fueron significativamente más bajos en pacientes con CUCI que en sujetos saludables16,17. Sin embargo, difieren de estudios que reportan que el filo Bacteroidetes tuvo menor presencia en muestras de mucosa de pacientes con CUCI, en comparación con sujetos saludables16,18.
El Ruminococcus mostró una disminución estadísticamente significativa en los casos con CUCI en comparación con el grupo control (p=0.001). Sin embargo, no hubo diferencia estadísticamente significativa respecto a Prevotella, Bacteroides y la relación entre ambas, lo cual coincide con los resultados de Frank et al. (2007) y Morgan et al. (2012)16,19, que mostraron que el Ruminococcus, en particular la especie productora de butirato, estaba reducida enla enfermedad inflamatoria intestinal.
Respecto a las bacterias benéficas asociadas con un microbioma intestinal saludable (A. muciniphila, Bifidobacteria y Lactobacilli), no se observó diferencia estadísticamente significativa entre los pacientes con CUCI y los controles. Estos resultados contrastan con los hallazgos de otros estudios, que muestran una disminución de Bifidobacteria y A. muciniphila en muestras fecales de pacientes con CUCI, en comparación con sujetos saludables20,21.
En nuestro estudio, la bacteria patógena Clostridioides difficile fue positiva en un caso de CUCI, con abundancia relativa baja (2.10E-6), lo cual coincide con un estudio previo que reclutó casos de pacientes ambulatorios, sin antecedentes recientes de ingesta de antibióticos ni hospitalización22.
Respecto a la relación entre disbiosis y la gravedad de los casos de CUCI en el presente estudio, las bacterias benéficas (A. muciniphila, Bifidobacteria, F. prausnitzii, y Firmicutes) fueron más abundantes en los casos leves que en los casos moderados o graves, pero la diferencia no fue estadísticamente significativa, lo cual era esperable, dado que solo se presentaron 2 casos leves.
Se ha reportado que la diversidad microbiana intestinal es un biomarcador para capacidad metabólica y salud, dado que una mayor diversidad microbiana intestinal supone la capacidad de proteger la microbiota intestinal humana de estresores ambientales23.
Se ha confirmado una diferencia significativa en el microbioma intestinal de individuos saludables y pacientes con enfermedad inflamatoria intestinal en términos de carga y diversidad24. El índice de Shannon demostró que los grupos de nuestro estudio presentaron un grado similar de diversidad alfa, lo cual fue un hallazgo esperado, dado que en el presente estudio se abordó un número limitado de géneros o especies bacterianos.
Se ha propuesto la calprotectina fecal como un marcador sustituto no invasivo para inflamación intestinal en enfermedad inflamatoria intestinal y también se ha correlacionado como un marcador de actividad de la enfermedad. El nivel del marcador inflamatorio, calprotectina fecal, se correlaciona significativamente con la inflamación endoscópica colónica en CUCI. En nuestro estudio no se observó correlación estadísticamente significativa entre la diferente abundancia bacteriana relativa, la duración de la enfermedad, el índice de Mayo total, la calprotectina fecal y pANCA, excepto por una correlación positiva entre A. muciniphila y Ruminococcus con la calprotectina fecal.
Estos resultados contrastan con lo reportado por Chen et al. en 202025, quienes reportaron una asociación negativa de A. muciniphila y Ruminococcus con la calprotectina fecal.
Una limitación de nuestro estudio fue el tamaño pequeño de la muestra, lo cual puede haber llevado a una pérdida de significación estadística en algunos puntos.
ConclusiónEl presente estudio proporciona evidencia de la presencia de cambios en el microbioma intestinal de los pacientes con CUCI en comparación con controles saludables. Estas observaciones destacan la importancia de identificar el microbioma y los cambios bacterianos específicos que pueden ser abordados para tratar la CUCI.
Contribución de los autoresEA y DH diseñaron el estudio y realizaron la recolección de datos y muestras. SA analizó los datos. NZ y NB redactaron el manuscrito. Todos los autores revisaron de manera crítica el manuscrito, aprobaron la versión final para publicación y acordaron ser responsables de todos los aspectos del trabajo.
FinanciaciónNo se recibieron apoyos específicos de agencias del sector público, del sector privado ni de organizaciones sin fines de lucro en relación con el presente estudio.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
Todos los autores desean agradecer a la Dra. Shwikar M. AbdelSalam Ahmed por su apoyo con el análisis de los datos, a la Dra. Nermine Hossam Zakaria y al Dr. Nahed M. Baddour por la redacción del manuscrito, al Dr. Ezzat Ahmed y a la Dra. Doaa Header por el concepto, diseño y recolección de datos.