Una de las estrategias que más impacto y mayor eficacia tiene para la modulación de la microbiota intestinal es el consumo de fibra dietaria, que puede ser digerida por la propia microbiota generando numerosos metabolitos. Entre estos, se encuentran los ácidos grasos de cadena corta (AGCC) con funciones tanto locales como sistémicas, que impactan en la composición y función de la microbiota intestinal y por lo tanto en la salud humana. El objetivo de esta revisión narrativa fue generar un documento que sirva como marco de referencia para conocer acerca de la fibra dietaria y sus efectos directos e indirectos.
Los beneficios directos de la ingestión de fibra dietaria pueden ser dependientes o independientes de la microbiota intestinal. La utilización de la fibra dietaria por esta última depende de varios factores y de sus características fisicoquímicas. La clase de fibra dietaria influye sobre la composición de la microbiota intestinal debido a que no todas las especies tienen la misma capacidad de producir enzimas necesarias para su degradación. El consumo de dietas con bajo contenido de fibra dietaria puede afectar el balance de los AGCC producidos. Los beneficios indirectos de la fibra dietaria impactan sobre la salud cardiometabólica, la salud digestiva, ciertos trastornos funcionales gastrointestinales y enfermedades diversas.
Dietary fiber intake is one of the most influential and efficacious strategies for modulating the gut microbiota. Said fiber can be digested by the microbiota itself, producing numerous metabolites, which include the short-chain fatty acids (SCFAs). SCFAs have local and systemic functions that impact the composition and function of the gut microbiota, and consequently, human health. The aim of the present narrative review was to provide a document that serves as a frame of reference for a clear understanding of dietary fiber and its direct and indirect effects on health.
The direct benefits of dietary fiber intake can be dependent on or independent of the gut microbiota. The use of dietary fiber by the gut microbiota involves several factors, including the fiber's physiochemical characteristics. Dietary fiber type influences the gut microbiota because not all bacterial species have the same capacity to produce the enzymes needed for its degradation. A low-fiber diet can affect the balance of the SCFAs produced. Dietary fiber indirectly benefits cardiometabolic health, digestive health, certain functional gastrointestinal disorders, and different diseases.
Actualmente se reconoce que la microbiota intestinal tiene un papel relevante en la salud humana y se han logrado grandes avances en su estudio y en cómo se puede modular su composición. Así mismo, sobre la función metabólica de las diferentes especies microbianas que colonizan el tracto gastrointestinal, para mejorar la salud humana y potencialmente prevenir o tratar padecimientos en general1. Existen algunas estrategias que pueden modular la microbiota, como el uso de probióticos, prebióticos e incluso el trasplante fecal. Una de las más sencillas y eficaces es el consumo de fibra dietaria metabolizable por la propia microbiota intestinal, generando metabolitos como los ácidos grasos de cadena corta (AGCC), como son el acetato, el propionato y el butirato, con funciones tanto locales como sistémicas. A través del impacto de la fibra dietaria en la composición y función de la microbiota intestinal, se influye en la salud humana en general.
En febrero del 2020 la Asociación Mexicana de Gastroenterología convocó a un grupo multidisciplinario de 17 especialistas (nutriólogas clínicas, químicas con maestría en nutrición, gastroenterólogos, gastroenterólogos y nutriólogos pediatras), con el fin de revisar (previamente) y discutir de forma presencial la evidencia científica sobre el papel de la fibra dietaria en la fisiología digestiva y salud en general del niño y del adulto. El objetivo de esta revisión narrativa fue generar un documento que sirva como marco de referencia para conocer acerca de la fibra dietaria y sus efectos directos e indirectos.
Fibra dietariaA lo largo del tiempo se han dado diferentes definiciones de fibra dietaria basadas en aspectos fisiológicos o en los métodos para su análisis por la AOAC (Association of Official Agricultural Chemists). El Instituto de Medicina de las Academias Nacionales de los Estados Unidos propuso una definición de fibra para distinguir fibra endógena de los alimentos o «fibra dietaria», de la extraída o sintetizada, denominada «fibra funcional» y que en suma integran la fibra total de un alimento2. En 2009, la Comisión del Codex Alimentarius definió fibra dietaria como «polímeros de hidratos de carbono de 10 o más unidades monoméricas, no hidrolizados por enzimas del intestino delgado humano»3; esta es la definición que se utilizará en esta posición técnica. Dependiendo de la reglamentación de cada país, se sugiere que dentro de la definición se incluyan oligómeros de 3 a 9 monómeros4.
La fibra dietaria se puede clasificar de acuerdo a su naturaleza u origen, propiedades coligativas y fermentabilidad5. Por su naturaleza u origen se clasifica en dietaria (intrínseca o intacta, que se encuentra en alimentos) o funcional (extraída o sintética). Por sus propiedades coligativas, su estructura química le confiere dos características relacionadas con sus mecanismos de acción. La primera es solubilidad: la fibra puede ser soluble (con diferente grado de solubilidad) o insoluble en agua. La segunda es su capacidad de gelificación: puede formar una solución viscosa o no viscosa y se clasifica en soluciones de baja, mediana y alta viscosidad. Por su fermentabilidad, puede no fermentarse, fermentarse parcialmente (semifermentable) o ser totalmente fermentable. Las propiedades fisicoquímicas de los diferentes tipos de fibra no son excluyentes. Las principales son: capacidad para reaccionar con agua, propiedad coligativa (solubilidad y gelificación o aumento de consistencia o viscosidad), capacidad de fermentación y quelación. Todas estas propiedades fisicoquímicas sustentan sus funciones en el organismo. La fibra soluble dentro de sus características es más viscosa y fermentable que la insoluble, experimenta pocos cambios y ejerce un efecto mecánico; sin embargo, existen diferentes tipos de fibras que exhiben una combinación diferente de estas propiedades y, por ende, sus efectos en el ser humano son distintos. Igualmente, un mismo alimento puede contener cantidades variables de diferentes tipos de fibra.
Por todo lo anterior, la fibra cuyos ejemplos se dan en las tablas 1 y 2 puede agruparse, de acuerdo a su grado de solubilidad y fermentabilidad, como:
- a)
Fibra soluble, altamente fermentable, de cadena corta: está conformada por oligosacáridos, como fructooligosacáridos (FOS) y galactooligosacáridos (GOS), que estimulan la producción de bifidobacterias. Tiene un efecto laxante débil y no afecta el tiempo de tránsito intestinal, aunque produce muchos gases.
- b)
Fibra soluble, altamente fermentable, de cadena larga: estimula el crecimiento de bacterias en general. Tiene efecto laxante débil, no afecta el tiempo de tránsito intestinal y produce una moderada cantidad de gases.
- c)
Fibra parcialmente soluble medianamente fermentable: tiene un buen efecto laxante, acelera el tránsito intestinal, estimula el crecimiento de bacterias en general y produce una moderada cantidad de gases.
- d)
Fibra insoluble y de lenta fermentación: tiene un buen efecto laxante, acelera el tránsito intestinal y estimula el crecimiento de bacterias y produce una moderada cantidad de gases.
- e)
Fibra insoluble y no fermentable: tiene un buen efecto laxante, acelera el tránsito intestinal y solamente estimula el crecimiento de bacterias específicas que la degradan, como Xylanibacter y Prevotella.
Tipos de fibra según su funcionalidad y ejemplos
| Tipo de fibra | Ejemplos |
|---|---|
| Fibra dietética | Lignina, celulosa, pectinas, gomas, β-glucanos y almidón modificado |
| Fibra soluble | Pectinas, gomas, β-glucanos, dextrinas de trigo, Psyllium e inulina |
| Fibra fermentable | Pectinas, goma guar, β-glucanos, dextrinas de trigo, inulina |
| Fibra viscosa | Pectinas, β-glucanos, algunas gomas (p.ej., guar), Psyllium |
| Fibra funcional | Dextrinas resistentes, Psyllium, fructooligosacáridos, polidextrosa, gomas aisladas, almidón resistente aislado |
| Fibras insolubles | Celulosa, lignina, algunas pectinas y algunas hemicelulosas |
| Fibras no fermentables | Celulosa, lignina |
| Fibras no viscosas | Polidextrosa, inulina |
Fuente: Slavin, 20137.
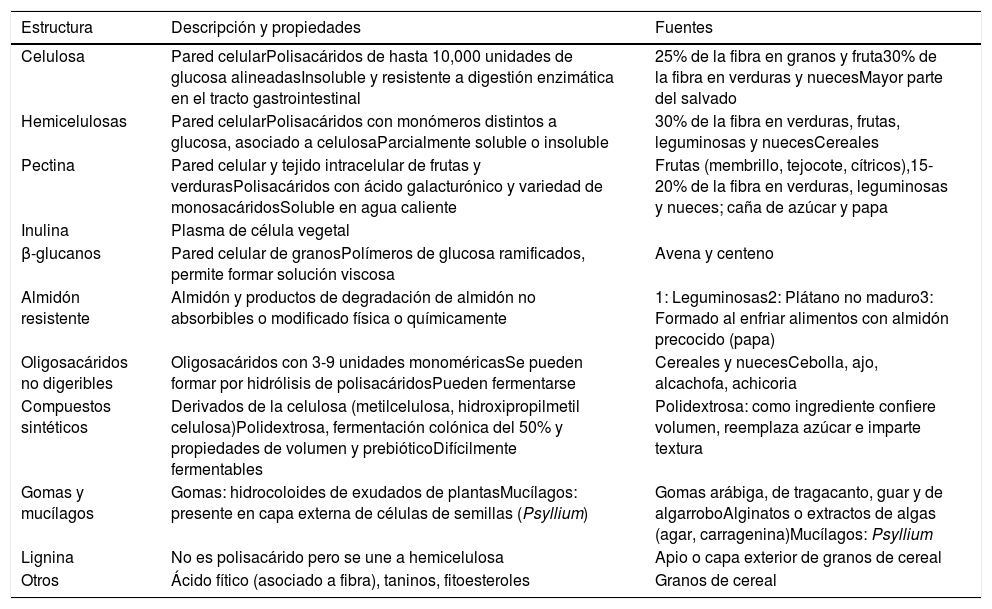
Tipos de fibra, propiedades y fuentes
| Estructura | Descripción y propiedades | Fuentes |
|---|---|---|
| Celulosa | Pared celularPolisacáridos de hasta 10,000 unidades de glucosa alineadasInsoluble y resistente a digestión enzimática en el tracto gastrointestinal | 25% de la fibra en granos y fruta30% de la fibra en verduras y nuecesMayor parte del salvado |
| Hemicelulosas | Pared celularPolisacáridos con monómeros distintos a glucosa, asociado a celulosaParcialmente soluble o insoluble | 30% de la fibra en verduras, frutas, leguminosas y nuecesCereales |
| Pectina | Pared celular y tejido intracelular de frutas y verdurasPolisacáridos con ácido galacturónico y variedad de monosacáridosSoluble en agua caliente | Frutas (membrillo, tejocote, cítricos),15-20% de la fibra en verduras, leguminosas y nueces; caña de azúcar y papa |
| Inulina | Plasma de célula vegetal | |
| β-glucanos | Pared celular de granosPolímeros de glucosa ramificados, permite formar solución viscosa | Avena y centeno |
| Almidón resistente | Almidón y productos de degradación de almidón no absorbibles o modificado física o químicamente | 1: Leguminosas2: Plátano no maduro3: Formado al enfriar alimentos con almidón precocido (papa) |
| Oligosacáridos no digeribles | Oligosacáridos con 3-9 unidades monoméricasSe pueden formar por hidrólisis de polisacáridosPueden fermentarse | Cereales y nuecesCebolla, ajo, alcachofa, achicoria |
| Compuestos sintéticos | Derivados de la celulosa (metilcelulosa, hidroxipropilmetil celulosa)Polidextrosa, fermentación colónica del 50% y propiedades de volumen y prebióticoDifícilmente fermentables | Polidextrosa: como ingrediente confiere volumen, reemplaza azúcar e imparte textura |
| Gomas y mucílagos | Gomas: hidrocoloides de exudados de plantasMucílagos: presente en capa externa de células de semillas (Psyllium) | Gomas arábiga, de tragacanto, guar y de algarroboAlginatos o extractos de algas (agar, carragenina)Mucílagos: Psyllium |
| Lignina | No es polisacárido pero se une a hemicelulosa | Apio o capa exterior de granos de cereal |
| Otros | Ácido fítico (asociado a fibra), taninos, fitoesteroles | Granos de cereal |
Adaptado de Gray8.
Es importante mencionar que a través de la fermentación la fibra dietaria eventualmente aporta energía, sin embargo, la magnitud del aporte dependerá de la clase de fibra y del tipo de microbiota del individuo6–8.
Además de los tipos de fibra comentados, hay otras sustancias que tienen función de fibra dietaria. Tales son: algunos hidratos de carbono sintéticos, como polidextrosa, metilcelulosa, carboximetilcelulosa, hidroximetilpropilcelulosa, curdlano, escleroglucano y análogos. Así también tienen acción de fibra algunos oligosacáridos sintéticos, polioles no absorbibles (sorbitol y manitol), saponinas, taninos, fitatos y sustancias de origen animal como condroitina y quitosano9,10. Este último es un polisacárido de origen natural compuesto por residuos de glucosamina unidos por enlaces α-1,4 y que constituye el exoesqueleto de los crustáceos y la pared celular de hongos.
Algunos tipos de fibra pueden tener un efecto prebiótico porque al fermentarse en el colon promueven selectivamente el crecimiento o actividad de la microbiota, que ejerce efectos funcionales y benéficos para el huésped, pero no toda la fibra dietaria es prebiótica11. Los principales prebióticos utilizados en estudios clínicos son FOS, GOS, transgalactooligosacáridos (TOS), xilooligosacáridos (XOS), isomaltooligosacáridos (IMOS), lactulosa, hemicelulosa (de cebada germinada) e inulina. Esta es un fructano o fructosano, un polisacárido compuesto principalmente por unidades de fructosa12.
Ingestión de fibra dietariaLas recomendaciones de ingestión de fibra dietaria dependen de la edad. En niños mayores de un año se puede calcular su requerimiento (g/día) con una fórmula de edad en años más 5 o 10, o bien 0.5g/kg/día en niños mayores de 2 años13. En adolescentes y adultos es de 14g por cada 1000kcal14. Esta cantidad de fibra alimentaria no está científicamente sustentada, por lo que se habla de una «ingestión diaria recomendada»; hay gran variabilidad entre las diferentes instituciones que dan la recomendación. En México, no se cuenta con tablas completas de contenido de fibra en alimentos, que se obtuvieran sistemáticamente. Las tablas de valor nutrimental que aluden al contenido de fibra hoy día en nuestro país recopilan datos obtenidos de diferentes tablas (por lo general, extranjeras), en las que no se registra el tipo de análisis químico para medirla. Se presume que el consumo de fibra dietaria es mayor en la dieta rural que en la urbana, por la proporción de cereales, leguminosas, verduras y frutas. En la Encuesta Nacional de Salud y Nutrición (ENSANUT) de 2012 se mostró un consumo deficiente de fibra desde edades tempranas15. En la ENSANUT 2016 de medio camino, se mostró que los niños de 24 a 59 meses con inseguridad alimentaria ingerían aún menos fibra que sus contrapartes sin inseguridad. El consumo diario de fibra de los adolescentes fue de 23.7g en hombres y 21.2g en mujeres, en tanto que en adultos mayores fue aún menor: 20.2g en hombres y 17.9g en mujeres16.
La Organización Mundial de la Salud recomienda varias estrategias para incrementar el consumo de fibra dietaria. Dentro de estas, destaca la orientación alimentaria encaminada al cambio de conductas en personas con escaso consumo de fibra o alteración que requiera una mayor ingestión. Así también se sugiere mayor consumo de fuentes naturales de fibra (frutas, verduras, leguminosas, granos integrales), e incluso el uso de suplementos de fibra cuando no se alcanza la recomendación a través de la dieta o hay evidencia del beneficio para una alteración específica de salud17.
Impacto directo de la fibraPropiedades de la fibra dietaria que influyen en la microbiota intestinalLa utilización de la fibra dietaria por la microbiota intestinal depende de su fuente, tipo de moléculas, enlaces, longitud de cadenas, tamaño de partícula y asociación con otros compuestos18,19. Así mismo, depende de las características fisicoquímicas previamente mencionadas de solubilidad, viscosidad y fermentabilidad1. El tamaño de la partícula determina su susceptibilidad a la digestión, unión, retención de agua y tiempo de tránsito intestinal20. La retención de agua puede influir en la capacidad de las bacterias para infiltrase y digerir la fibra, así como la velocidad del transporte a través del intestino21. La viscosidad depende del grado de hidratación, del tamaño de la partícula y del pH22. La fibra muy fermentable también puede tener alta solubilidad y viscosidad, aquí destacan β-glucanos y pectinas. La mayoría de las fibras solubles son muy viscosas en el intestino. Los FOS y la pectina pueden ser metabolizados por bacterias en íleon y colon ascendente, a diferencia de la fibra insoluble como celulosa y hemicelulosa que solo se metaboliza en el colon distal1.
Experimentalmente se ha demostrado que la suplementación de fibra soluble, en comparación con la insoluble, modifica la colonización de bacterias intestinales, impactando en la riqueza de la microbiota intestinal23. El consumo de fibra insoluble genera mayor abundancia relativa de Bacteroidetes, Euryarchaeota y Ruminococcaceae y a nivel de género Prevotella, Phascolarctobacterium, Coprococcus y Leeia. Por el contrario, el consumo de fibra soluble genera mayor abundancia relativa del filo Proteobacteria y menor de Prevotellaceae, y con respecto al género es Blautia, Solobacterium, Syntrophococcus, Weissella, Olsenella, Atopobium y Succinivibrio24. Así, en un estudio con 7% de pectina, una fibra soluble, en modelo murino, incrementaron Anaeroplasma, Anaerostipes y Roseburia, al tiempo que disminuyeron Alistipes y Bacteroides spp.17.
Algunos de los componentes de la fibra, como los oligosacáridos de arabinoxilanosa, pueden incrementar la abundancia de bifidobacterias en colon ascendente, lactobacilos en colon ascendente y transverso, así como Clostridium coccoides y Eubacterium rectale en colon descendente17. La viscosidad de la fibra incrementa el número de bacterias anaerobias y de Clostridium spp. Por el contrario, el número de bacterias aerobias y el género Enterococcus correlacionan negativamente con la viscosidad22. La fermentación de la inulina resulta en una proporción mayor de lactobacilos y bifidobacterias, una menor de Enterobacteriaceae, así como una mayor producción de butirato24.
El consumo de 12g de inulina durante 4 semanas en adultos sanos con estreñimiento leve indujo incremento en la abundancia de Bifidobacterium y Anaerostipes spp., y disminución de la población de Bilophila25. Tal efecto podría atribuirse a la capacidad del género Bifidobacterium para degradar eficientemente FOS y de que Anaerostipes hadrus es productora de butirato26. Un efecto similar se dio en pacientes con colitis ulcerosa activa que recibieron 7.5 o 15g de inulina enriquecida con oligofructosa durante 9 semanas, con incremento en la abundancia de Bifidobacteriaceae y Lachnospiraceae, y aumento en la producción de butirato27.
Se considera también fibra dietaria el almidón resistente, que es una fracción no digestible del almidón de maíz, papas crudas o plátanos verdes. Su consumo se asocia con aumento de Ruminococcus bromii, Faecalibacterium prausnitzii y E. rectale, productores de butirato. R. bromii es una especie clave para la fermentación de almidones en el colon, como se ha demostrado en otros estudios28,29.
Fibra y producción de ácidos grasos de cadena corta (AGCC)Las bacterias anaerobias en el intestino grueso producen los AGCC por fermentación de fibra dietaria30. Los principales AGCC son el acetato, propionato y butirato en una relación 60:20:20. El lactato es la sal de un ácido orgánico muy común en el lumen intestinal, también producido por bacterias; mientras que otro tipo de bacterias lo metabolizan a acetato, propionato y butirato. Así, hay especies que pueden ser degradadoras primarias de la fibra dietaria cuyos productos son degradados por otros microorganismos fermentadores que finalmente producirán acetato, propionato y butirato31,32.
El acetato se produce principalmente vía acetil-CoA. El propionato es sintetizado a partir de dos vías: la de succinato y acrilato, a partir de sustratos de hexosas y pentosas o lactato; y la de propanediol que utiliza desoxihexosas como la fucosa y ramnosa como sustratos31. Los Bacteroidetes producen propionato principalmente a través de la vía de succinato. El butirato también puede ser producido a partir de péptidos o aminoácidos y no solamente derivarse de fuentes de fibra dietaria. Algunas especies productoras de butirato corresponden a las familias de Ruminococcaceae y Lachnospiraceae, ambas Firmicutes, así como por Erysipelotrichaceae y Clostridiaceae. Además, F. prausnitzii (familia Ruminococcaceae) puede utilizar polisacáridos provenientes del almidón, hemicelulosa, inulina y pectina, mientras que E. rectale es capaz de utilizar almidón, arabinoxilanos e inulina, para la producción de AGCC30.
Los AGCC tienen diferentes funciones: regulan tanto la expresión de genes, al actuar como inhibidores de desacetilasas de histonas, como el metabolismo energético. Además, actúan como moléculas de señalización que reconocen receptores específicos y así promueven la regulación del sistema inmune y la inflamación30,31. La función de los AGCC varía dependiendo de los receptores en los tejidos del hospedero en donde pueden ser asimilados, dando lugar a efectos fisiológicos diferentes32. Ejercen parte de su función al ligarse a receptores acoplados a proteína G (GPCRs, por sus siglas en inglés) o también denominados receptores de ácidos grasos, como el GPCR41 (o FFAR3), GPCR43 (o FFAR2) y GPCR109A. El acetato y propionato son potentes activadores de GPCR43, el cual se expresa principalmente en colonocitos, tejido adiposo, células del sistema inmune, sistema nervioso, páncreas y se coexpresa con GLP-1 en las células enteroendocrinas. En esta forma, se relaciona con el metabolismo de lípidos o glucosa, así como con la respuesta del sistema inmune30,31.
El consumo de una dieta con bajo contenido de fibra dietaria puede afectar la producción de AGCC. En contraste, el consumo de fibra dietaria, y su efecto en la síntesis de AGCC, puede estimular la producción y secreción de moco intestinal. Esta sustancia que protege la mucosa intestinal puede darse por el incremento en bacterias que promueven la expresión de genes en las células caliciformes o por estímulo mecánico de la propia fibra dietaria33,34.
Fibra dietaria y su relación con el eje cerebro-intestino-microbiota (ECIM)Existen diferentes vías de comunicación en el ECIM. La principal vía es el nervio vago, seguida de la actividad del sistema nervioso entérico al producir moléculas que actúan como neurotransmisores, tales como el ácido gamma aminobutírico (GABA), serotonina, melatonina, histamina y acetilcolina. Uno de los principales mecanismos que relaciona la fibra dietaria con el ECIM es por la influencia directa de los AGCC y el ácido láctico, que además participan en la modulación de secreción de serotonina enteroendocrina35. El butirato se produce principalmente a partir de almidón resistente. Debido a que una de las funciones del butirato es inhibir las desacetilasas de histonas, se ha identificado que tiene una acción benéfica en diferentes enfermedades neurológicas como el Parkinson, mejora el aprendizaje y la memoria en casos de demencia, incluido el Alzheimer, depresión y adicciones. Además, se ha sugerido que puede ser un sustrato para la producción de energía en el cerebro, aunque se desconoce su magnitud. Se ha observado que disminuye la inflamación cerebral en modelos in vitro e in vivo de enfermedad de Parkinson36.
Los FOS y GOS incrementan la expresión del gen del factor neurotrófico derivado del cerebro (BDNF, por sus siglas en inglés) y de las subunidades NR1 y NR2A de los receptores N-metil-D-aspartato (NMDA), así como del péptido plasmático YY37. Un estudio en ratones mostró que la microbiota modula el comportamiento, tras la recolonización de ratones con concentraciones bajas de BDNF que provocó alteraciones de comportamiento38. Los GOS suprimen la respuesta al estrés neuroendocrino a través de la hiposecreción del cortisol y aumentan la vigilancia de la atención a estímulos positivos versus los negativos39.
Por otro lado, se ha demostrado que la administración farmacológica de butirato sódico tiene efectos antidepresivos40. Existen algunas bacterias asociadas al desarrollo neurológico, respuestas emocionales y producción de GABA, como Lactobacillus y Bifidobacterium spp. Hay otras involucradas en la síntesis de serotonina, como Streptococcus, Escherichia y Enterococcus spp., y finalmente las hay en la producción de dopamina, como Bacillus spp.41. De igual forma, los cambios en las concentraciones de BDNF y NMDA por el metabolismo bacteriano pueden contribuir a los desequilibrios químicos y estructurales asociados con la esquizofrenia y otras psicopatologías42–44.
Efectos directos de la fibra dietaria en la diversidad y abundancia de la microbiotaUna de las características de la microbiota intestinal más consistentemente asociada con un mejor estado de salud es la diversidad bacteriana45. Esta diversidad se afecta en forma importante cuando las dietas son bajas en fibra o hidratos de carbono disponibles para la microbiota46. La clase de fibra dietaria influye sobre el tipo de microbiota debido a que no todas las especies producen las enzimas necesarias para su degradación18.
Diversos miembros de la microbiota intestinal son importantes degradadores de la fibra dietaria. Para ello, cuentan con 130 hidrolasas de glicósidos, 22 liasas de polisacáridos y 16 familias de esterasas, lo cual les provee la flexibilidad de degradar diferentes fuentes de energía a partir de las fibras disponibles. Las principales especies responsables de la degradación de la fibra dietaria son de los filos Firmicutes y Actinobacteria34,47.
En un estudio de mujeres embarazadas con sobrepeso u obesidad en Finlandia, el consumo de granos enteros y vegetales correlacionó con la diversidad de la microbiota. La calidad de la dieta en general en el mismo estudio correlacionó con la abundancia del género Coprococcus de la familia Lachnospiraceae, con la especie F. prausnitzii de la familia Ruminococcaceae y una especie desconocida de la familia Barnesiellaceae48. En general, se han demostrado diferencias en la diversidad de la microbiota intestinal entre la población de países occidentales como los europeos y EUA, y la de habitantes de países africanos y de Papúa Guinea. Así también difiere su alimentación, con la occidentalizada rica en alimentos procesados, carnes, azúcares y grasas saturadas, mientras que la de los habitantes africanos, en especial en zonas rurales, se caracteriza por un importante consumo de vegetales, frutas y cereales en grano entero6,49–52.
Además de la abundancia de la microbiota, los diversos metabolitos que produce son determinantes sobre los efectos fisiológicos del hospedero53. El consumo de fibra soluble como la pectina e inulina, y de fibra insoluble como hemicelulosa, puede incrementar la abundancia de bacterias productoras de AGCC47,54–56. El butirato es la principal fuente de energía de los colonocitos y las bacterias comensales como E. rectale y F. prausnitzii participan en su producción. Este ácido graso participa en la regulación de mecanismos pro- y antiinflamatorios57. Bajo esta premisa, se ha comprobado que induce la apoptosis de células malignas y por lo tanto reduce el riesgo de cáncer colorrectal58. En la tabla 3 se enlistan los tipos de fibra dietética, la fuente alimentaria y los cambios que se producen en la microbiota intestinal y en la producción de AGCC27,55,59–79. Debido a las diferentes capacidades que tienen las bacterias intestinales para producir AGCC, es importante mencionar que ante el consumo de diferentes fuentes de fibra no todos los individuos podrán producir las mismas cantidades de estos metabolitos.
Tipos de fibra dietética, fuente alimenticia y los cambios inducidos en la microbiota intestinal y en la producción de ácidos grasos de cadena corta
| Tipo de fibra, dosis | Clasificación y fuente alimenticia | Cambios en bacterias y sus metabolitos | Referencia |
|---|---|---|---|
| Arabinoxilo-oligosacáridos2.2g/d | Fibra solubleCereales | Incremento de lactobacilos y BacteroidesIncremento de butirato | Walton et al., 201259 |
| Arabinoxilo-oligosacáridos3g/d y 10g/d | Fibra solubleCereales | Incremento de BifidobacteriumDisminución de pHIncremento de AGCC | Francois et al., 201260 |
| Arabinoxilanos | Fibra solubleCereales | Disminución de Clostridium clusters I/XI/XV y VerrucomicrobiaAumento de Actinobacteria | Van den Abbeele et al., 201161 |
| Arabinoxilo-oligosacáridos5g/d | Fibra solubleCereales | Incremento de BifidobacteriumDisminución de ácido isobutírico y ácido isovalérico | Francois et al., 201462 |
| β-glucanos | Fibra soluble y viscosaAvena, cebada, trigo, centeno, algas, champiñones | Aumento de Bacteroides/Prevotella, lactobacilos, bifidobacterias | Hughes et al., 200855Snart et al., 200663Jayachandran et al., 201864 |
| Galactooligosacáridos5.5g/d | Fibra soluble y no viscosaFrijoles, garbanzos, lentejas, cebolla, lechuga, brócoli, alcachofa | Incremento de Bifidobacterium spp. yBacteroides spp.Cambios en marcadores inmunológicos | Vulevic et al., 201565 |
| Inulina | Fibra soluble y no viscosaAgave, alcachofa, espárragos, plátanos, raíz de achicoria, ajo, cebolla, puerros, trigo | Incremento de Bacteroides, Lactobacillus, Bifidobacterium, Clostridium y Lachnospiraceae, y disminución en enterobacteriasIncremento de butirato | Valcheva et al., 201927 |
| Inulina de agave5.0 y 7.5g/d | Fibra soluble no viscosaAgave y subproductos | Incremento de BifidobacteriumDisminución de Ruminococcus, Lachnobacterium, Desulfovibrio | Holscher et al., 201466 |
| Inulina+oligofructosa16g/d | Fibra soluble y no viscosaAchicoria | Incremento de Bifidobacterium longum, Bifidobacterium pseudocatenulatum y Bifidobacterium adolescentisDisminución de acetato y propionato | Salazar et al., 201567 |
| Inulina+goma guar parcialmente hidrolizada15g/d | Fibra soluble y no viscosa/ Fibra soluble y viscosa | Disminución de Clostridium spp.Sin cambios significativos en AGCC | Linetzky et al., 201268 |
| Xilooligosacáridos1.4 y 2.8g/d | Fibra soluble | Incremento de Bifidobacterium, Bacteroides fragilisSin cambios significativos en pH y AGCC y ácido láctico | Finegold et al., 201469 |
| Polidextrosa8g/d | Fibra soluble y no viscosa | Disminución de Clostridiumhistolyticum, lactobacilos/enterococciIncremento en diversidad bacterianaSin cambios significativos en AGCC | Costabile et al., 201270 |
| Polidextrosa21g/d | Fibra soluble y no viscosa | Incremento de la relación Bacteroidetes:FirmicutesIncremento de ParabacteroidesDisminución de Eubacterium,Ruminococcus, Roseburia, DoreaDisminución en el butirato fecal, fenol e indol | Holscher et al., 201571 |
| Pectina | Fibra soluble y viscosaManzana, cereza, naranja, zanahoria, chabacano | Controversial respecto a Bacteroides spp. | Dongowski et al., 200272Licht et al., 201073 |
| Fibra de maíz10 y 20g/d | Fibra soluble y no viscosaMaíz | Incremento de Parabacteroides, BifidobacteriumDisminución de Anaerostipes, Dorea, RuminococcusDisminución del pH fecal y aumento en producción de AGCC | Whisner et al., 201674 |
| Almidón de maíz40g/d | Fibra soluble y no viscosaMaíz | Incremento de Clostridium coccoides,Clostridium leptum, Lactobacillus spp.,Parabacteroides distasonisy Ruminococcus bromiiDisminución de Ruminococcus gnavus, Ruminococcus torques y Escherichia coliIncremento en producción de AGCC | Le Leu et al., 201575 |
| Almidón resistente22-29g/d | Fibra soluble y no viscosaPlátano verde, papa, avena, alubias | Incremento en Oscillospira guilliermondii, R. bromii, Sporobacter termitis, C. leptum, Clostridium cellulosi, Alistipes spp., Eubacterium rectaleDisminución Papillibacter cinnamivorans y diversidad de la microbiotaIncremento de AGCC | Salonen et al., 201476 |
| Almidón de maíz (almidón resistente tipo 2) | Fibra solubleMaíz | Incremento R. bromii y E. rectale,Faecalibacteriumprausnitzii, Roseburia faecis y Akkermansia muciniphila | Martínez et al., 201077 |
| Almidón de papa (almidón resistente tipo 2) | Fibra solublePapa | Incremento B. adolescentis y R. bromii | Martínez et al., 201077 |
| Fibra de residuo de camote | Fibra soluble e insolubleCamote | Aumento Bifidobacterium y Lactobacillus y disminución Enterobacillus, Clostridium perfringens y BacteroidesIncremento índice Bifidobacterium/enterobacteria | Martínez et al., 201077 |
| Fructanos | Fibra solubleAjo, cebolla, trigo, centeno, agave | Aumento de bifidobacterias y lactobacilos, Eubacterium, Roseburia y FaecalibacteriumIncremento en AGCC | Ampatzoglou et al., 201578 |
| Fibra de salvado de trigo | Fibra insoluble y no viscosaSalvado de trigo | Aumento de bifidobacterias, lactobacilos, Atopobium; enterococci; Bacteroides y PrevotellaIncremento en butirato | Freeland et al., 200979 |
AGCC: ácidos grasos de cadena corta.
Hay bacterias especializadas como Clostridium, Lactobacillus y Enterococcus, capaces de adherirse a la a mucosa del tracto gastrointestinal, que se alimentan del moco y se unen a las células epiteliales80. Este tipo de bacterias tiene influencia importante sobre el sistema inmune y la homeostasis intestinal81. La microbiota intestinal también juega un papel importante en el mantenimiento de la integridad de la mucosa47. En modelos experimentales libres de gérmenes disminuyen las células caliciformes productoras de mucinas y en consecuencia la capa mucosa se torna delgada47,82. Se ha identificado que Akkermansia muciniphila es determinante en el mantenimiento de esta barrera mucosa83, que Bacteroides thuringiensis produce una bacteriocina potente contra Clostridioides difficile y que Bacteroides thetaiotaomicron participa en la expresión de metaloproteinasas, para la conversión de pro-defensina a defensina84,85. La microbiota también participa en el mantenimiento de la integridad de las células de Paneth, y consecuentemente en la producción correcta de péptidos antimicrobianos. El aumento de taxones como Enterobacteriaceae, Pasteurellaceae, Veillonellaceae y Fusobacteriaceae, y la disminución de Erysipelotrichales, Bacteroidales y Clostridiales genera defectos en la formación de esos péptidos antimicrobianos, lo que se asocia con enfermedad inflamatoria intestinal (EII)86. En diversas entidades donde hay inflamación de la mucosa con un incremento de la permeabilidad, existe un aumento de Proteobacteria y reducción de Firmicutes87,88.
Impacto indirecto de la fibraFibra dietaria en la salud cardiometabólicaLa diabetes mellitus (DM), obesidad, dislipidemia, hipertensión y síndrome metabólico son los factores de riesgo cardiometabólico más frecuentes. Su aparición implica riesgos de complicaciones futuras e incluso muerte para quienes los presentan, principalmente en forma combinada. Una alimentación correcta contribuye en el mantenimiento de la salud y una dieta no adecuada, balanceada, equilibrada y diversa se asocia con la aparición de alteraciones cardiometabólicas desde la infancia hasta la edad adulta89,90. Los patrones dietéticos menos saludables, caracterizados por incluir poca fibra dietaria, correlacionan con un mayor riesgo cardiovascular91,92. Dos metaanálisis basados en estudios de cohorte encontraron que los individuos que consumen más fibra dietaria tienen menor mortalidad por causas cardiovasculares93,94.
El consumo de fibra dietética puede reducir la glucemia posprandial95, mejorar las concentraciones de lípidos séricos96, prevenir la obesidad y la acumulación de grasa visceral97. Se ha descrito que la fibra dietaria, al ser metabolizada por la microbiota intestinal, genera sustratos con impacto positivo en la salud del hospedero, y en particular en la salud cardiovascular ya que disminuyen el riesgo de enfermedades cardiovasculares y diabetes98–100. En una revisión sistemática con metaanálisis, de 19 estudios se encontró un menor riesgo de enfermedad cardiovascular y enfermedad coronaria asociado con una mayor ingesta de fibra total, fibra insoluble y fibra de cereales y vegetales. Por cada incremento de ingestión de 7g de fibra al día se tiene un RR de 0.91 (IC95%: 0.88-0.94) de enfermedad cardiovascular y un RR de 0.91 (IC95%: 0.87-0.94) de enfermedad coronaria; así como una disminución de la mortalidad (RR 0.59, IC95%=0.44, 0.78)98. En otro estudio similar llevado a cabo por la Sociedad Americana de Nutrición, se observó que el consumo de fibra se asoció con un riesgo bajo e intermedio de enfermedad cardiovascular y diabetes101. Así mismo, el consumo de fibra disminuye el colesterol total, colesterol LDL y triglicéridos102, como ocurre en veganos y vegetarianos, quienes muestran un mejor perfil lipídico que quienes consumen menos fibra y más carne103.
La DM tipo 2 se asocia con disminución de bacterias que degradan la fibra dietaria. En estudios con modelos animales, la administración de fibra soluble como la oligofructosa e inulina de cadena larga corrigió la alteración de la microbiota o disbiosis, redujo la ganancia de peso y la inflamación de bajo grado y mejoró el metabolismo de la glucosa, la permeabilidad intestinal y la endotoxemia, relacionadas en parte con la fisiopatología de la DM104. En un estudio de 16 semanas con dieta suplementada con fibras funcionales, se demostró mejoría de la microbiota colónica, caracterizada por un incremento significativo en las cuentas de bifidobacterias, lactobacilos y Bacteroides, así como una disminución en la cuenta de clostridios, con una reducción del colesterol de LDL y el colesterol total105. Misma reducción indujo un extracto de fibra de salvado de arroz en mujeres posmenopáusicas, además de disminuir TNF-α 106. En individuos con hiperlipidemia, una dieta basada en vegetales redujo la presión arterial y el colesterol de LDL107. Se ha informado también una disminución en la inflamación medida por proteína C reactiva, inflamación global y riesgo cardiovascular108.
La Encuesta Francesa de Nutrición y Salud concluyó que el consumo de fibra dietética y granos enteros se asocia de manera inversa con la presión arterial sistólica109. El consumo de alimentos con alto índice glucémico confiere mayor riesgo de padecer DM cuando se compara con el efecto del consumo habitual de fibra dietaria y cereales110. De hecho, el consumo de fibra ≥20g/día disminuye el riesgo de padecer DM probablemente por su efecto en el estado proinflamatorio111. Se postulan otros mecanismos para la disminución del riesgo de DM, tales como la adsorción de glucosa por la fibra en el tracto gastrointestinal, disminución del vaciamiento gástrico y mejoría en la insulinemia posprandial. Sin embargo, no todos los estudios de intervención han demostrado beneficio112 y el efecto preventivo primario de la fibra en la salud cardiovascular no ha sido tan obvio. Posiblemente esto se debe a que existen múltiples factores genéticos y ambientales difíciles de controlar, y los estudios de intervención aún son pocos, con algunas discrepancias en las definiciones usadas, de corta duración y difíciles de realizar113. Las conclusiones de las revisiones más recientes sobre el tema y las opiniones de expertos coinciden en destacar la necesidad de realizar más estudios con mejor calidad metodológica114.
Fibra dietaria, microbiota y obesidadComo se mencionó anteriormente, el consumo de fibra dietética puede ayudar a prevenir la ganancia de peso, la acumulación de grasa visceral y la obesidad97. El consumo de fibra se asocia con otros factores beneficiosos del estilo de vida, como el consumo de frutas y verduras y los hábitos de ejercicio. Las dietas con alto contenido de fibra son típicamente más bajas en grasa y densidad energética y son útiles para mantener un peso corporal saludable. En una revisión se resumieron los resultados de más de 50 estudios de intervención en los que se evaluó la relación entre el aporte energético de la dieta, el peso corporal y la ingestión de fibra, y estimaron que un aumento en la ingestión de fibra de 14g por día se asoció con una disminución del 10% del aporte energético de la dieta y una pérdida de peso de 2kg durante 4 meses. Los cambios observados en la ingestión y el peso corporal ocurrieron sin considerar si la fuente de fibra dietaria fue a través de la dieta o como suplemento115. En otra revisión, con más de 60 estudios, concluyeron que existe evidencia sólida de que la ingesta de fibra dietaria viscosa (∼7g al día) ayuda a reducir el peso corporal y la masa grasa aun en ausencia de una restricción calórica116.
Dentro de los mecanismos por los cuales el consumo de fibra puede ayudar al mantenimiento del peso corporal está la microbiota intestinal. La microbiota intestinal afecta la absorción de nutrimentos y la homeostasis energética por medio de hormonas que regulan el depósito de grasa en los adipocitos117. Estudios en animales han demostrado que la disbiosis de la microbiota puede inhibir la adenosín-monofosfato cinasa (AMPK), lo que afecta de manera negativa la oxidación de los ácidos grasos, promueve la lipogénesis, la síntesis de colesterol y triglicéridos y el depósito de grasa, generando obesidad118. La microbiota intestinal además tiene efectos sobre el factor adiposo inducido por ayuno (FIAF), modula el metabolismo de los ácidos biliares, modula la saciedad y regula la secreción de hormonas anorexigénicas como GLP1 y el PYY a través de los AGCC119.
Estudios en humanos han mostrado que, a lo largo de diferentes poblaciones, la obesidad y en general un mayor IMC se asocia con una baja diversidad bacteriana120–122. Estudios con poblaciones rurales y migrantes sugieren que la transición a una dieta baja en fibra, derivada de la occidentalización de las poblaciones, coincide con un aumento en el peso corporal así como con una pérdida de la diversidad de la microbiota intestinal123–125. En este sentido, un estudio longitudinal observó que mayor consumo de fibra se asocia con mayor diversidad de la microbiota y de manera concomitante con menor ganancia de peso en el largo plazo126. Lo anterior sustenta que el consumo de fibra a través de su efecto en la diversidad bacteriana podría ayudar a regular el peso corporal.
De manera interesante, intervenciones dietarias con un solo tipo de fibra muestran que, a pesar de observar algunos beneficios sobre la salud metabólica, la intervención no necesariamente aumenta la diversidad bacteriana. En contraste, estudios en humanos y modelos in vitro han encontrado que es la variedad en las estructuras de fibra (a través del consumo de diferentes alimentos o variedades de plantas) lo que se asocia con una mayor diversidad bacteriana127. Por lo cual se sugiere que el consumo de una combinación de diferentes tipos y fuentes de fibra, más que el consumo de fibra per se, puede ayudar a incrementar la diversidad microbiana y con ello ayudar a regular el peso corporal128.
La fibra promueve el crecimiento de géneros, como lactobacilos y bifidobacterias, induciendo un entorno que tradicionalmente se ha comentado como «más saludable»; sin embargo, esto no está totalmente claro ya que se ha descrito en personas con obesidad, que la disbiosis está relacionada con un incremento en el filo Firmicutes, el género Clostridium y en algunas especies de Lactobacillus, por lo que no necesariamente todos los miembros del género Lactobacillus, específicamente en el contexto de la obesidad, tienen una connotación positiva129. Aunque no se cuenta con la definición de lo que es una microbiota normal, el consumo de fibra tiene un efecto protector contra el incremento del peso corporal y la incidencia de DM, que es en parte mediado por la microbiota intestinal130. Llama la atención que múltiples estudios han encontrado una gran variabilidad interindividual en respuesta a las intervenciones con diferentes clases de fibra. Por lo cual se ha sugerido que si bien estas intervenciones pueden inducir cambios en la composición de la microbiota, esta última también puede determinar cómo se metaboliza la fibra y con ello el impacto sobre la salud del individuo131. Estudios en adultos con sobrepeso y obesidad han mostrado que individuos con un perfil particular de microbiota pueden obtener un mayor beneficio sobre la reducción de peso corporal después de intervenciones ricas en fibra. Particularmente, individuos cuya microbiota tiene una mayor abundancia del género Prevotella con relación a Bacteroides parecen perder mayor peso corporal posteriormente a la intervención132–134. Otros géneros asociados con el grado de respuesta a las intervenciones con fibra como inulina son Akkermansia, Butyricicoccus, Anaerostipes y Bifidobacterium135,136. A pesar de que actualmente la caracterización de la microbiota intestinal en pacientes no se hace aún de manera sistemática, la evidencia anterior podría tener implicaciones clínicas, en donde la incorporación de marcadores de microbiota intestinal pudiera ayudar a mejorar la eficiencia de las terapias nutricionales137.
Fibra dietaria y cáncer de colonLa ingestión de proteína en exceso lleva a fermentación en el colon con la producción de compuestos que se han asociado a cáncer colorrectal; sin embargo, no hay evidencia suficiente para afirmarlo. Una estrategia sencilla para contrarrestar efectos adversos, si los hubiera, sería reducir la ingestión proteica o administrar simbióticos138. Independientemente de la etiología del carcinoma colorrectal, con la administración de 55g de fibra al día se revierten los marcadores139.
Los estudios epidemiológicos aportan información importante sobre ingestión de fibra y cáncer colorrectal140. En un metaanálisis de 11 estudios de cohorte prospectivos, se reveló que la ingestión de fibra dietaria se asoció inversamente con el riesgo de cáncer de colon, tanto proximal como distal141. Varios años antes, un metaanálisis de 25 estudios prospectivos había encontrado que una ingestión alta de fibra dietaria total o de la proveniente de cereales y granos integrales se asociaba con un riesgo menor de cáncer colorrectal142. En un metaanálisis muy reciente de 22 estudios, se compararon grupos de adultos con muy alta ingestión de fibra con los de muy baja ingestión. Los resultados del análisis sugieren que la ingestión de fibra dietaria pudiera proteger contra cáncer rectal, con una reducción clínica relevante del riesgo143. El efecto de la fibra no es solo sobre cáncer sino de enfermedades intestinales inflamatorias. En las regiones no industrializadas de África en las que sus habitantes consumen más de 50g/día de fibra, la prevalencia de enfermedades inflamatorias crónicas es muy baja140.
Fibra dietaria y estreñimientoLa relación entre la fibra y la facilidad en la defecación se relaciona con algunas propiedades de la fibra, como la capacidad de retención de agua, el incremento en el volumen fecal, el incremento en la propulsión intestinal y la reducción en el tiempo de tránsito intestinal. Por lo tanto, es importante para mantener la regularidad del hábito intestinal normal. La fibra aumenta el bolo y al distender el intestino genera incremento de la peristalsis144. Dicho incremento del bolo es resultado de la retención de líquido entre la fibra y el aumento de la densidad bacteriana, debido a la fermentación. Habitualmente se considera una suplementación de fibra de 20-30g/día para pacientes adultos con estreñimiento crónico145; el uso de diferentes tipos de fibra para este fin tiene efectividad similar146. Las fibras menos fermentables tienen mayor capacidad de capturar agua en comparación con las más fermentables y mayor resistencia a la degradación bacteriana. Esto es importante ya que se ha considerado que, a mayor peso añadido, el tránsito intestinal se acelera más. Sin embargo, en una revisión a fondo de diversas intervenciones, se encontró que el tránsito solo disminuía en aquellos en donde era mayor de 48h, independientemente del tipo de fibra. En el mismo estudio, se encontró que la fibra dietaria proveniente de cereales y de vegetales, más que la de la fruta, tuvo un efecto similar en cuanto a peso a las heces147.
El efecto benéfico de la fibra en el estreñimiento crónico se ha demostrado en estudios de cohorte y de intervención148. En un estudio realizado en enfermeras se demostró una reducción del 36% de estreñimiento en quienes consumían el percentil más alto de fibra dietaria en comparación con el percentil más bajo, lo que corresponde a una reducción del 1.8% del estreñimiento por cada gramo de fibra extra consumido149. Los efectos adversos potenciales del consumo de fibra dietaria son la flatulencia, distensión y dolor abdominales debido a la fermentabilidad de la fibra, sobre todo tras el consumo de FOS ya que pueden causar síntomas con dosis tan bajas como 10g150. Se debe adaptar el tipo de fibra que tolere de mejor manera el paciente, de tal forma que, en aquellos con síntomas preexistentes asociados a gases y distensión, serán mejor toleradas las fibras de baja fermentabilidad.
Fibra dietaria, microbiota y síndrome de intestino irritableEl efecto de la fibra sobre los síntomas de síndrome de intestino irritable (SII) es variable y específico del tipo de fibra, en donde la soluble, como Psyllium, ha demostrado efectos terapéuticos benéficos, pero no así la fibra insoluble como la de salvado de trigo. La segunda línea de la terapia dietaria para SII es una dieta baja en oligo, mono, disacáridos y polioles fermentables (FODMAP); estos hidratos de carbono fermentables pueden contribuir al incremento en la producción de gas, y exacerbar los síntomas en SII151. La mayoría de las personas no experimentan síntomas importantes tras el consumo de fibra; sin embargo, en otras más estos síntomas de intolerancia desaparecen a lo largo del tiempo mientras la microbiota del huésped se adapta a su consumo152. Sin embargo, en algunos pacientes con hipersensibilidad visceral, se recomienda utilizar fibras de baja fermentabilidad como la metilcelulosa o intermedia solubilidad como el Psylliumplantago y la ispaghula.
Los FODMAP, como la fructosa, la lactosa, los fructanos, el sorbitol y los fructooligosacáridos, se encuentran en alimentos como las frutas, la cebolla, el ajo, las leguminosas y el trigo. Después de varios estudios no controlados sobre el efecto de FODMAP en los síntomas del SII, se demostró con un estudio aleatorizado y cegado la mejoría en la calificación de los síntomas, como la distensión, el dolor y la flatulencia, con el uso de la dieta baja en FODMAP153. Lo mismo ocurrió en un estudio realizado en México154. De acuerdo a otro estudio, la respuesta a la dieta baja en FODMAP depende de la estructura de la microbiota del paciente; cuanto mayor índice de disbiosis, menor respuesta155.
Por otra parte, se han demostrado cambios en la microbiota asociados a la dieta baja en FODMAP, por lo que aún no queda claro si es adecuado su uso a largo plazo y debe indicarse una liberalización de la dieta, cuando se logre el control de los síntomas156. El establecimiento de una dieta baja en FODMAP siempre debe ser bajo la supervisión de profesionales de la salud capacitados para este tipo de recomendaciones, ya que se podrían presentar deficiencias nutricionales y conductas alimentarias desordenadas150.
Con respecto a la población pediátrica, debido a la escasez de ensayos clínicos sobre el uso de fibra en niños con SII, no se puede llegar a una conclusión definitiva. Los profesionales deben ser cautelosos al momento de seleccionar el tipo y la dosis de fibras en niños y adultos con SII para evitar el empeoramiento de los síntomas; el uso de la dieta baja en FODMAP en población pediátrica no es una recomendación actual157.
La composición bacteriana intestinal en paciente con SII difiere de la de sujetos sanos, presentan menor abundancia de Erysipelotrichaceae y Ruminococcaceae, bacterias productoras de butirato, que los sanos. Así también, tienen mayor abundancia de Methanobacteriales (bacterias productoras de metano), Lactobacillus y Ruminococcus, y disminución de Bifidobacterium, Faecalibacterium, Erysipelotrichaceae y metanógenos158–160. Cuando la microbiota del paciente con SII se reequilibra por efecto del tratamiento, los AGCC que produce tienen potencial efecto benéfico, tales como mejoría en recambio epitelial, mejoría en la permeabilidad intestinal y disminución de la inflamación de bajo grado. Sin embargo, faltan estudios que demuestren los mecanismos por los que la fibra mejora aspectos de la fisiopatología del SII. Cada vez hay más pruebas que demuestran que la microbiota intestinal no solo explica los síntomas abdominales del SII, sino también la comorbilidad psiquiátrica que ocurre en un número considerable de estos pacientes.
Fibra dietaria y enfermedad inflamatoria intestinalLa capa de moco rica en glucoproteínas y polisacáridos que recubre la superficie de la mucosa intestinal es la primera línea de defensa entre las células intestinales y la microbiota intestinal161; a su vez es fuente de alimentación de algunas bacterias intestinales162. Se ha demostrado que B. thetaiotaomicron puede metabolizar glucanos del moco a falta de fibra dietaria, adelgazando el grosor de la capa, con el consecuente contacto íntimo de las bacterias con el epitelio163. Esto podría explicar el daño que puede ser causado por deficiencia de fibra en la EII y el cáncer de colon164. Los AGCC tienen propiedades antiinflamatorias sobre los macrófagos y las células dendríticas pues estimulan la diferenciación de las células T reguladoras165. Los pacientes con EII tienen menores concentraciones de AGCC incluyendo ácido butírico y ácido acético en comparación con sujetos sanos. El ácido butírico podría aportar una protección contra la EII166. La evidencia científica para indicar la fibra como tratamiento de la colitis ulcerosa y la reservoritis es aún limitada167.
Fibra dietaria en el manejo de colostomíasPoco se sabe sobre el estado nutricio y los hábitos alimenticios de las personas con estomas intestinales y no se han establecido pautas dietéticas universales. Muchas personas con estomas ajustan su dieta para evitar molestias que interfieren con su vida diaria y les causan temor de salir de casa, como el aumento del olor, de gases o de la producción de heces, estreñimiento o fugas. Algunos pacientes evitan ciertos alimentos, especialmente frutas y verduras168. El incremento en el consumo de fibra y líquidos es una de las medidas más utilizadas en los pacientes con estomas que sufren estreñimiento crónico y logra aliviar a la mayoría169. Los suplementos con fibra soluble se usan frecuentemente si las medidas dietéticas no son suficientes, pero su empleo es empírico, ya que no existen estudios aleatorizados y comparativos al respecto170. La interacción entre la fibra dietaria y la microbiota en pacientes con ileostomía y colostomía no ha sido estudiada en forma específica.
Fibra dietaria y encefalopatía hepática portosistémicaLa reducción de alimentos de origen animal e incremento de proteínas vegetales reduce la encefalopatía hepática (EH), aunque el mecanismo no es claro. Cuando se incrementa la fibra en la dieta, su fermentación disminuye el pH del colon favoreciendo la excreción de amoniaco en vez de su absorción y acelerando el tránsito colónico171. En la cirrosis no se debe reducir el consumo de proteínas sino administrar proteínas de origen vegetal, asociadas naturalmente a la fibra dietaria172. La microbiota es capaz de producir la mayoría de los neurotransmisores que se encuentran en el cerebro humano y es evidente que influyen en la neuroquímica y el comportamiento. La EH se considera el trastorno prototípico del eje cerebro-intestino-microbiota. Los estudios traslacionales indican que ciertas bacterias y su manipulación pueden tener impacto en las respuestas positivas de la función cerebral. El aumento de fibra fermentable podría reducir la absorción de amoniaco en el sistema portal de una manera similar a la suplementación con lactulosa173.
El uso de fibra dietética como medida terapéutica única contra la EH no ha sido estudiado; sin embargo, una dieta alta en fibra permite el incremento concomitante de la ingestión de proteínas. Un estudio mexicano demostró que la suplementación con aminoácidos de cadena ramificada más una dieta con alto contenido de fibra y proteínas es una intervención segura en pacientes con cirrosis, ya que ayuda a aumentar la masa muscular sin elevar la amonemia, ni propiciar el desarrollo de EH174. Por su parte, múltiples estudios bien diseñados han evaluado el beneficio de diferentes probióticos en el tratamiento de la EH. En comparación con placebo o ninguna intervención, los probióticos probablemente mejoran la recuperación y pueden regular las concentraciones de amoniaco en plasma y la calidad de vida en la EH manifiesta, aunque no disminuye la mortalidad175. Hasta ahora, no se han publicado estudios que describan la modificación de la microbiota intestinal en pacientes cirróticos con EH como respuesta a dietas específicas176. Se necesitan ensayos clínicos de alta calidad para aclarar el verdadero potencial de la fibra dietaria, la eficacia de los probióticos y su efecto en la modulación de la microbiota intestinal en la EH.
ConclusionesLa fibra dietaria puede inducir cambios en la salud intestinal, mediado de forma directa e indirecta por la microbiota intestinal. La utilización de la fibra dietaria por esta última depende de varios factores y características de la propia fibra, como son fermentabilidad, solubilidad y viscosidad de la fibra. La clase de fibra dietaria influye sobre la composición de la microbiota debido a que no todas las especies degradan todo tipo de fibra, lo cual puede evidenciarse por cambios a nivel de filo, familia y especies. El consumo de dietas bajas en fibra dietaria puede reducir la producción de AGCC, afectando sus diferentes funciones locales y sistémicas. Los beneficios indirectos de la fibra dietaria tienen un impacto en la salud cardiometabólica y digestiva, incluyendo algunos trastornos funcionales gastrointestinales, así como en enfermedades diversas. La ingestión diaria recomendada en general de fibra dietaria en adolescentes y adultos es de 14g por cada 1000kcal; en casos patológicos, el tratamiento debe de ser individualizado y con seguimiento muy cercano.
FinanciaciónLa agenda científica, la discusión y las conclusiones de esta revisión fueron determinadas autónomamente y redactadas de manera independiente por los integrantes del grupo convocado por la Asociación Mexicana de Gastroenterología (AMG).
Para fines estrictamente logísticos, la AMG solicitó y obtuvo financiamiento no condicionado del Instituto de Nutrición y Salud Kellogǵs® (INSK). Los autores recibieron un honorario por su participación.
Conflicto de interesesMTAA: ha recibido honorarios por consejo asesor y por conferencias para Takeda®, Alfasigma®, Mayoly-Spindler®, Sanofi®, Menarini®, Carnot®, Biocodex®, BioGaia® y Abbott® Farmacéutica.
MPMG: ha recibido honorarios por conferencias para Kellogg's®, Abbott® Farmacéutica, Victus® y Alfasigma®.
GAAA: ha recibido apoyo para acudir a congresos y ha recibido honorarios por conferencias para Nestlé® y Carnot®.
AMCB: sin conflicto de interés.
RICS: ha recibido honorarios por consejo asesor de Asofarma®, ponente para Mayoly-Spindler®, Asofarma® y Chinoin®.
ACS: ha recibido honorarios por conferencias para Sanofi-Aventis®, Mead Johnson®, Takeda® y Alexion Pharma®. Financiamiento para estudios de investigación clínica por Alexion Pharma® y Sanofi-Aventis®.
ECA: consejo asesor de Takeda® de México, Ferrer® de México, Asofarma® de México, Grunenthal® de México, Speaker de: Takeda® de México, Ferrer® de México, Asofarma® de México, Grunenthal® de México, Medtronic® de México, Asofarma® de Centroamérica y el Caribe, Carnot® de México, Siegfried Rhein® de México.
MFGC: ha recibido honorarios por conferencias para Grunenthal® de México.
VHR: ha recibido apoyo para acudir a congresos y ha recibido honorarios por conferencias para Nestlé®.
MEIC: ha recibido apoyo para acudir a congresos y ha recibido honorarios por pláticas para Asofarma®, Takeda® y Chinoin®.
JNMM: sin conflicto de intereses.
SMR: ha recibido honorarios por conferencias para Kellogg's® y PepsiCo®.
EOO: ha recibido apoyo para acudir a congresos y ha recibido honorarios por conferencias y desarrollo de materiales para VitaFlo Argentina®, Nestlé®, Danone ®, Abbott®, Kellogg's®.
MRA: ha recibido apoyo para acudir a congresos de Imed Orphan® y honorarios por consejo asesor por Abbott®.
RLRF: ha recibido apoyo para acudir a congresos por Gilead Sciences®.
FZD: sin conflicto de intereses.
FZM: ha recibido apoyo para asistir a congresos y honorarios por conferencias y por advisory boards de Mead Johnson®.
RVF: ha recibido apoyo para acudir a congresos y ha recibido honorarios por conferencias para Nestlé® y Sanofi®, Carnot®, BioGaia® y Abbott® Farmacéutica. Financiamiento para estudios de investigación clínica por Alexion Pharma® y Sanofi-Aventis®.