Existen controversias sobre la prevalencia del síndrome de intestino irritable (SII)-postinfeccioso (PI), sobrepoblación bacteriana (SPB), alteraciones en la microbiota, inflamación de bajo grado y antibioticoterapia en SII.
ObjetivosRealizar una revisión basada en evidencia de estos factores.
MétodosSe realizó una revisión de la literatura hasta julio del 2012 y se incluyeron artículos adicionales hasta agosto del 2013, los cuales fueron analizados mediante el sistema del Centro para Medicina Basada en Evidencia de la Universidad de Oxford (OCEBM).
Resultados1.Existe mayor probabilidad de SPB mediante pruebas de aliento pero la prevalencia es muy variable (2-84%). 2.La microbiota intestinal es diferente en SII que en sujetos sanos, pero no se ha establecido una característica común presente en todos los pacientes. 3.La incidencia y prevalencia del SII-PI varía del 9-10% y 3-17%, respectivamente; esta última disminuye con el tiempo. La etiología bacteriana es la más frecuente, pero se han reportado casos posvirales y parasitarios. 4.Existe un subgrupo de pacientes con incremento de células enterocromafines, linfocitos intraepiteliales y mastocitos en la mucosa intestinal, pero no se han determinado diferencias entre SII-PI y SII-NoPI. 5.La microbiota metanogénica se asocia con el SII con estreñimiento. 6.La rifaximina en dosis de 400mg TID/10días o 550mg TID/14días es efectiva en la mejoría de síntomas globales y distensión abdominal en SII. La efectividad del retratamiento parece ser similar a la del primer ciclo.
ConclusionesSe requieren más estudios para determinar la microbiota intestinal propia del SII y las diferencias en inflamación de bajo grado entre SII-PI y SII-NoPI. La rifaximina ha demostrado efectividad en el tratamiento del SII independientemente de los factores anteriores.
Post-infectious irritable bowel syndrome (PI-IBS) prevalence, small intestinal bacterial overgrowth (SIBO), altered microbiota, low-grade inflammation, and antibiotic therapy in IBS are all controversial issues.
AimsTo conduct an evidence-based review of these factors.
MethodsA review of the literature was carried out up to July 2012, with the inclusion of additional articles as far as August 2013, all of which were analyzed through the Oxford Centre for Evidence-Based Medicine (OCEBM) system.
Results1.There is greater SIBO probability in IBS when breath tests are performed, but prevalence varies widely (2-84%). 2.The gut microbiota in individuals with IBS is different from that in healthy subjects, but a common characteristic present in all the patients has not been established. 3.The incidence and prevalence of PI-IBS varies from 9-10% and 3-17%, respectively, and the latter decreases over time. Bacterial etiology is the most frequent but post-viral and parasitic cases have been reported. 4.A sub-group of patients has increased enterochromaffin cells, intraepithelial lymphocytes, and mast cells in the intestinal mucosa, but no differences between PI-IBS and non-PI-IBS have been determined. 5.Methanogenic microbiota has been associated with IBS with constipation. 6.Rifaximin at doses of 400mg TID/10days or 550mg TID/14days is effective treatment for the majority of overall symptoms and abdominal bloating in IBS. Retreatment effectiveness appears to be similar to that of the first cycle.
ConclusionsFurther studies are required to determine the nature of the gut microbiota in IBS and the differences in low-grade inflammation between PI-IBS and non-PI-IBS. Rifaximin has shown itself to be effective treatment for IBS, regardless of prior factors.
La fisiopatología del síndrome de intestino irritable (SII) no se conoce a ciencia cierta pero se han propuesto varios mecanismos, como alteraciones de la motilidad gastrointestinal, hipersensibilidad visceral, alteraciones en la comunicación bidireccional cerebro-intestino, alteraciones psicosociales y estrés1. Más recientemente se ha descrito un grupo de pacientes que desarrolla SII posterior a infecciones gastrointestinales, lo cual se conoce como SII-postinfeccioso (PI)2. Así mismo se ha reportado la presencia de sobrepoblación bacteriana (SPB) y alteraciones cuantitativas y cualitativas en la microbiota intestinal y fecal3,4. Además, el SII se ha asociado con la presencia de inflamación de bajo grado en la mucosa intestinal dada por un incremento en el número de linfocitos intraepiteliales, mastocitos y células enterocromafines5, esto sin descontar que se han descrito alteraciones en la inmunidad a nivel periférico como es el caso de bajos niveles de la interleucina (IL)-10 y aumento de algunas interleucinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α), y otros mediadores de la inflamación6. De hecho, se propone que las alteraciones en la microbiota o la SPB en el intestino delgado pudiesen incrementar la permeabilidad intestinal y activar los mecanismos inmunológicos de la submucosa, que a su vez podrían llevar a una inflamación de bajo grado7. Más aún, los mediadores de esta activación inmunológica podrían estimular las terminales del sistema nervioso entérico y aun el sistema nervioso autonómico desencadenando las alteraciones de la motilidad y sensibilidad visceral que han sido descritas en el SII7,8. Por otra parte, la presencia de SII-PI, los cambios en la microbiota y la asociación con SPB en el SII han llevado a la justificación para el uso de antibióticos en el tratamiento del SII8,9.
Sin embargo, a pesar de todo lo anterior, las evidencias resultan en ocasiones controversiales. Por una parte, solo un grupo de pacientes desarrolla SII-PI, y no todos los pacientes presentan SPB9,10. Esto último se ve aún más limitado debido a que las pruebas de aliento para diagnosticar SPB no han sido estandarizadas y varían entre los estudios11. Más aún, las alteraciones en la microbiota son diversas y las técnicas para estudiarlas han variado hasta los más sofisticados estudios genómicos12. Así mismo, la presencia de inflamación de bajo grado no es universal y las alteraciones descritas varían entre los estudios; incluso no sabemos a ciencia cierta si estos cambios que se presentan en todos los pacientes con SII se relacionan solo con el SII-PI13. Finalmente, los estudios con antibióticos en SII han evaluado diferentes dosis, por diferentes períodos de tiempo y diversas variables de desenlace14,15.
Por lo anterior, nuestro objetivo fue hacer una revisión basada en evidencias sobre los siguientes aspectos del SII: 1.La frecuencia de SPB en SII. 2.La incidencia y prevalencia del SII-PI y los factores de riesgo para el mismo. 3.Determinar las alteraciones de la microbiota intestinal y/o fecal en SII. 4.Determinar la presencia de inflamación intestinal en SII analizando las diferencias entre SII-PI y SII-NoPI. 5.Conocer las alteraciones en la función intestinal (motilidad, secreción, sensibilidad visceral) en SII, con relación a SII-PI, SPB y alteraciones de la microbiota. 6.Evaluar el tratamiento con antimicrobianos en el SII.
MétodosCoordinador y revisoresEsta iniciativa fue llevada a cabo por un grupo de gastroenterólogos de México interesados en el tema. El grupo se conformó por un coordinador experto en SII (MS), y los participantes fueron elegidos con base en su experiencia en gastroenterología, antecedentes y entrenamiento en investigación clínica y básica relacionados con el tema. Además, se incluyó un experto en la clasificación de niveles de evidencia y grados de recomendación (MP), quien cuenta con experiencia y entrenamiento en gastroenterología, investigación clínica y estadística, pero no se considera experto en el SII. Esto fue intencional, de manera que se contara con una perspectiva diferente, además de conseguir una evaluación más objetiva de las evidencias. Los 6 temas fueron asignados para ser revisados entre 9 de los participantes (revisores), los cuales se dividieron en 6 grupos de revisores (MB, RC-AH, ALC-JLT, YLV-MAV, MRT y MS).
El coordinador del proyecto realizó inicialmente una revisión de la literatura en PubMed utilizando la base de datos de Medline, hasta julio del 2012. Se utilizaron las siguientes combinaciones de términos para realizar la búsqueda: «IBS» AND «SIBO», «abnormal breath test», «incidence of post infectious IBS», «prevalence of post infectious IBS», «microbiota», «Post infectious IBS» AND «risk factors», «epidemiology», «low grade inflammation», «Microbiota», «dysbacteriosis», «SIBO», «methane» AND «intestinal function», «intestinal motility», «sensory function», «sensory abnormalities», «visceral hypersensitivity».
Una vez identificados, los artículos fueron distribuidos a los responsables de cada tema para llevar a cabo la revisión. Se seleccionaron revisiones sistemáticas con o sin metaanálisis y artículos originales. Es de anotar que no se incluyeron revisiones narrativas. Además, los revisores fueron autorizados a incluir artículos que no fueron identificados durante la revisión previa pero que fueron identificados de otras fuentes, como por ejemplo de las referencias de los artículos originalmente seleccionados o que fueron publicados después de julio del 2012 y hasta el 31 de agosto del 2013, cuando se finalizó la preparación del manuscrito. Todos recibieron por correo electrónico un instructivo sobre los datos que debían obtener de las publicaciones así como de la metodología para clasificar los niveles de evidencia y grados de recomendación.
Calificación de la evidenciaLos revisores analizaron las evidencias y formularon enunciados basados en la información disponible. Los niveles de evidencias y el grado de recomendación fueron evaluados y calificados utilizando el sistema del Centro para Medicina Basada en Evidencia de la Universidad de Oxford (OCEBM)16. Este sistema utiliza números y letras para evaluar la calidad de los estudios clínicos y nivel de evidencia. Así, la calidad y metodología de los estudios se determina utilizando números del 1 al 5, a los que se agrega una letra minúscula, ya sea «a», «b» o «c». Los números indican la calidad de los estudios, mientras que las letras indican la metodología utilizada; así, por ejemplo, un estudio 1a suele ser una revisión sistemática que incluye solo ensayos clínicos controlados homogéneos y de alta calidad (el número 1 indica que solo se incluyeron ensayos clínicos controlados de alta calidad y homogéneos, y la letra «a» se utiliza para indicar que se trata de una revisión sistemática); un estudio 2a representa una revisión sistemática (letra «a») que incluyó estudios de cohorte de diferente calidad, los cuales metodológicamente son considerados de menor calidad y nivel que los ensayos clínicos controlados (el número 2). Un último ejemplo: el caso 2b representa a una sola cohorte individual o un solo ensayo clínico controlado (letra «b») de baja calidad (número 2).
El grado de recomendación se otorga utilizando letras mayúsculas, de la A a la D. La letra A se otorga a enunciados, conclusiones o recomendaciones basadas en información obtenida por estudios de alta calidad o nivel de evidencia 1, mientras que la letra D se otorga a recomendaciones basadas en estudios de baja calidad científica o evidencia de nivel 516.
Análisis de las evidenciasEn agosto del 2012 se llevó a cabo una primera reunión cara a cara del grupo con una duración de 9horas. En esta se discutió inicialmente el sistema del OCEBM y posteriormente los revisores presentaron en tablas un resumen de cada artículo seleccionado, incluyendo autores, revista, año, país, tipo de artículo (revisión sistemática u original) y el diseño del mismo, criterios diagnósticos para SII y otros criterios de selección de los sujetos, métodos de estudio y/o tratamiento evaluado, variables de desenlace y resultados o conclusiones. Además, los revisores responsables de cada tema propusieron un nivel de evidencia para cada uno de los estudios, y al final presentaron los enunciados o declaraciones y grados de recomendación de las mismas. Se discutió cada uno de los niveles de evidencia asignados y se modificaron y aprobaron por consenso, así como los grados de recomendación. Al final, el coordinador presentó un resumen y las tareas pendientes de cada uno. En enero de 2013 se llevó a cabo una segunda reunión de 8horas, en la cual solo se presentaron las 6 revisiones actualizadas. Posteriormente, en marzo del 2013 cada uno envió su parte escrita al coordinador, quien a su vez envió cada una de las secciones a revisión cruzada, es decir, cada revisor o grupo de revisores se encargó de una de las partes. Una vez finalizada esta revisión, el coordinador procedió a la edición del manuscrito, el cual fue luego revisado por todos los participantes.
ResultadosEn la revisión inicial en PubMed se identificaron 183 referencias, de las cuales se eliminaron 60 referencias que se encontraron duplicadas, por lo cual al final se seleccionaron 123 artículos. Además, posteriormente se identificaron 9 artículos adicionales de otras fuentes. Los artículos identificados en la búsqueda inicial, y posteriormente de otras fuentes, se describen en cada sección. A continuación se describen los resultados de los 6 objetivos de la revisión. Cada sección se inicia con las declaraciones con sus respectivos niveles de evidencia y grados de recomendación, seguidas del resumen correspondiente.
1. Frecuencia de sobrepoblación bacteriana (SPB) en el síndrome de intestino irritable- •
Diversos estudios han sugerido que los pacientes con SII tienen una mayor probabilidad de tener SPB, determinada mediante pruebas de aliento de hidrógeno espirado (nivel de evidencia 3, recomendación grado B).
- •
La prevalencia de SPB en pacientes con SII se ha informado en un amplio intervalo cuya variación se debe a los diversos criterios para definir una prueba de aliento positiva y a la metodología empleada (28 a 84% con la prueba de aliento con lactulosa [PAL], 2 a 31% con la prueba de aliento con glucosa [PAG] y 2 a 6% con base en cultivos) (nivel de evidencia 3-4, recomendación grado C).
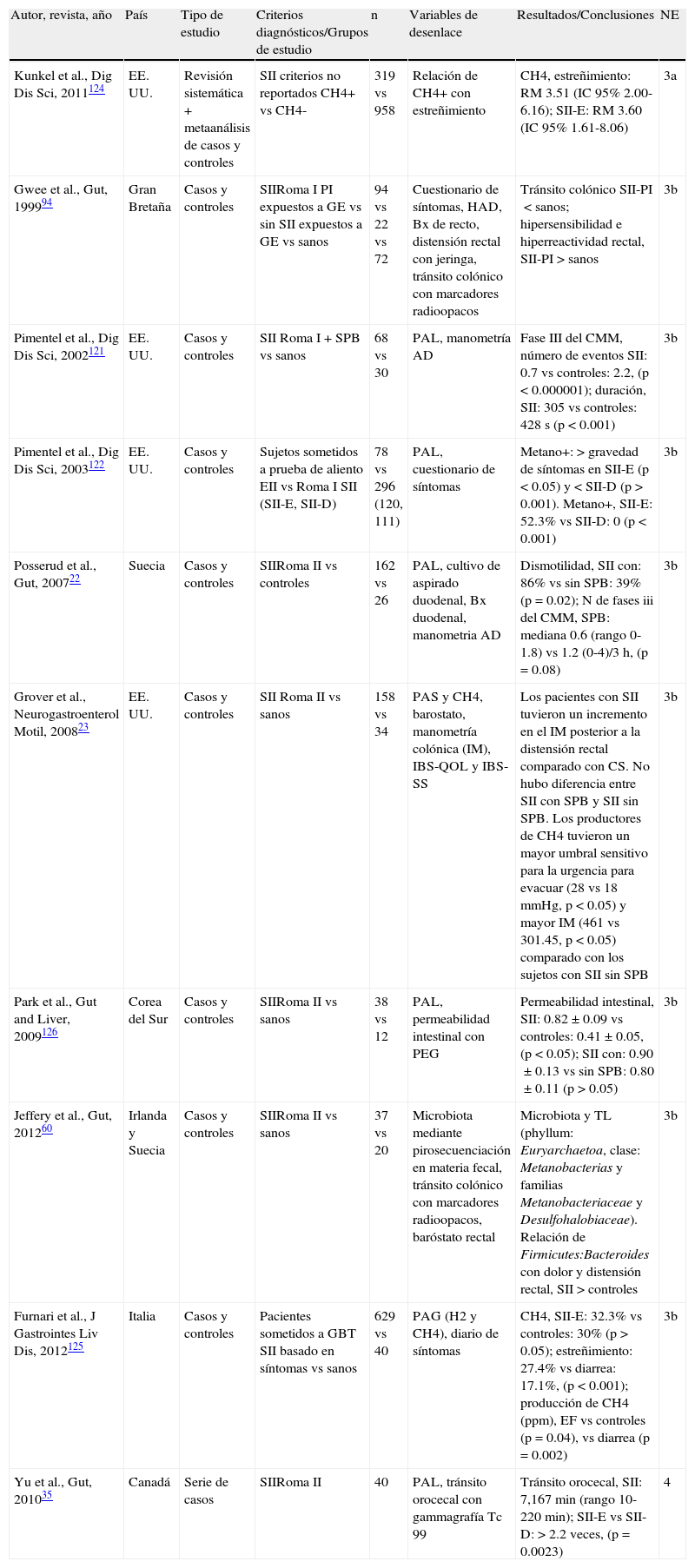
Se identificaron 24 artículos que informaron acerca de la prevalencia de SPB en SII3,11,17-38, 23 artículos durante la búsqueda inicial3,11,17-35,37,38 y posteriormente, durante la preparación del documento, se identificó un artículo adicional mediante búsqueda manual36. Dos revisiones sistemáticas con metaanálisis que incluyeron más de 3,400 sujetos y compararon pacientes con SII y controles sanos demostraron que las pruebas de aliento para SPB fueron anormales en los enfermos, con una probabilidad 4 veces mayor en comparación con los controles3,17. En ambas revisiones se realizó una búsqueda bibliográfica extensa, se seleccionaron adecuadamente los estudios y los autores hicieron una clara referencia a la heterogeneidad de los estudios (tabla 1).
Prevalencia de SPB en SII
| Autor, revista, año | País | Tipo de estudio | Criterios diagnósticos/Grupos de estudio | n | Prueba utilizada | Variables de desenlace | Resultados/Conclusiones | NE |
| Ford et al., Clin Gastroenterol Hepatol, 20093 | Canadá, EE.UU. | Revisión sistemática de series de casos y controles | SIIManning, Kruis, Roma vs sanos | 1,921 vs 326 | PAL, PAG, PAX, Cultivo | Prevalencia de SPB y pruebas positivas | SII, PAL: 54%; PAG: 31%; PAX (un solo estudio): 33%, Cultivo: 4% (un solo estudio). La probabilidad acumulada de una prueba para SPB+ en SII vs controles es de: RM 3.4 (IC95% 0.9-12.7) a RM 4.7 (IC95% 1.7-12.9), dependiendo de los criterios utilizados | 3a |
| Shah et al., Dig Dis Sci, 201017 | EE.UU. | Revisión sistemática + metaanálisis de casos y controles | SIIRoma I, II, III vs sanos | 1,076 vs 509 | PAL, PAG, PAF, PAX | Probabilidad de pruebas anormales | SII vs controles: RM 4.46 (IC95% 1.7-11.8) | 3a |
| Pimentel et al., Am J Gastroenterol, 200318 | EE.UU. | Casos y controles | SIIRoma I vs sanos | 111 vs 15 | PAL | Prevalencia de SPB | SII: 84% vs controles: 20%; (p<0.01) | 3b |
| Pimentel et al., Ann Rheum Dis, 200419 | EE.UU. | Casos y controles | SIIRoma I vs FM ACR 1990 | 111 vs 42 | PAL | Prevalencia de SPB | SII: 84% vs controles: 20% (p<0.01), vs FM: 100% (p<0.05) | 3b |
| Walters et al., Am J Gastroenterol, 200520 | Canadá | Casos y controles | SIIRoma II vs Sanos | 39 vs 20 | PAL, PAX | Prevalencia de SPB | H2>20ppm entre 90 y 180min, SII: 28% vs controles: 30% (p=NS) H2>20ppm en los primeros 90min, SII: 69% vs controles: 75% (p=NS) | 3b |
| Madrid et al., Rev Med Chile, 200721 | Chile | Casos y controles | SIIRoma II vs controles (distensión funcional vs estreñimiento funcional vs diarrea funcional) | 225 vs 83 vs 33 vs 26 | PAL | Prevalencia de SPB | SII: 76% vs controles: 76% (p=NS); SII-E: 73%, SII-D: 76%, SII-A: 79.7% | 3b |
| Posserud et al., Gut, 200722 | Suecia | Casos y controles | SIIRoma II vs sanos | 162 vs 42 | Cultivo | Prevalencia de SPB | SII: 4% vs controles: 4% (p=NS). De los pacientes con SPB, SII-E: 43%, SII-D: 28.5%, SII-A: 28.5% | 3b |
| Bratten et al., Am J Gastroenterol, 200811 | EE.UU. | Casos y controles | SII Roma II vs sanos | 224 vs 30 | PAL | Prevalencia SPB | SII: 20% vs controles: 15% (p=0.79) | 3b |
| Grover et al., J Neurogastro Motil, 200823 | EE.UU., Japón | Casos y controles | SII Roma II vs Sanos | 158 vs 34 | PAX | Prevalencia SPB | SII: 32.9 vs controles: 17.9% (p=no reportada); SPB de acuerdo al subtipo de SII, SII-E: 30.8%, SII-D: 30.8%, SII-M: 38.5% | 3b |
| Scarpellini et al., J Pediatr, 200938 | Italia | Casos y controles | Niños con SIIRoma II vs sanos | 43 vs 56 | PAL | Prevalencia SPB | SII: 65% vs controles: 7%; (RM 3.9, IC95%: 7.3-80.1, p<0.000) | 3b |
| Parodi et al., J Clin Gastroenterol, 200924 | Italia | Casos y controles | SII Roma III vs distensión funcional Roma III vs sanos | 130 vs 70 vs 70 | PAG | Prevalencia SPB | SII: 16.5% vs distensión funcional: 2.8% vs controles: 4.2%; (p=0.0137); SPB de acuerdo al subtipo de SII, SII-D: 52.3%, SII-E y SII-M: no se reporta la frecuencia exacta | 3b |
| Law et al., Dig Dis Sci, 201025 | EE.UU. | Casos y controles | SII Roma I con IBP vs sin IBP | 106 vs 449 | PAL | Prevalencia SPB | SII: 54.4%; SII+IBP: 46.2% vs SII-IBP: 56.3%, (RM 0.67, IC95% 0.436-1.017, p=0.06) | 3b |
| Park et al., Korean J Gastroeterol, 201026 | Corea del Sur | Casos y controles | SII Roma II vs otros TFD Roma II vs sanos | 76 vs 70 vs 40 | PAL | Prevalencia SPB | SII: 45% vs TFD: 41% vs controles: 40% (p=0.97); SII-E: 11.8%, SII-D: 58.8%, SII-M: 29.4% | 3b |
| Ghoshal et al., Neurogastroenterol Motil, 201027 | India | Casos y controles | SII Manning vs DCNE vs sanos | 129 vs 73 vs 51 | PAG | Prevalencia SPB | SII: 8.5% vs DCNE: 21.9% vs controles: 2%; (SII vs DCNE, p=0.007; SII vs controles, p=0.18; DCNE vs controles; p=0.003) | 3b |
| Choung et al., Aliment Pharmacol Ther, 201128 | EE.UU., Australia | Casos y controles | SII vs pacientes de endoscopia | 148 vs 527 | Cultivo de aspirado duodenal | Prevalencia de SPB en SII | SII: 2% vs controles: 10%, (p=no especificada) | 3b |
| Yakoob et al., Saudi J Gastroenterol, 201129 | Pakistán | Casos y controles | SII-DRoma III vs DCNE | 119 vs 115 | PALac | Prevalencia SPB | SII-D: 19% vs DCNE: 9%; (p=0.03). Solo se incluyeron pacientes con SII-D | 3b |
| Rana et al., Digestion, 201230 | India | Casos y controles | SII-DRoma II vs sanos | 175 vs 150 | PAL, PAG | Prevalencia SPB | PAL, SII: 34 vs controles: 30% (p=NS); PAG, SII: 6.2 vs controles: 0.7% (p<0.01) | 3b |
| Pyleris et al., Dig Dis Sci, 201236 | Grecia | Casos y controles | SII, SII-D, SII-No DRoma II sometidos a endoscopia | 42 | Cultivo de tercera porción del duodeno | Prevalencia de SPB en SII y SII-D vs SII-NoD | SII: 37.5%; SII-D: 60% vs SII-NoD 27.3% (p=0.004) | 3b |
| Pimentel et al., Am J Gastroenterol, 200331 | EE.UU. | Serie de casos | SII-DRoma II | 20 | PALac, PAL, concordancia entre las 2 | Prevalencia de SPB | PALac: 53%; PAL: 74%; correlación: kappa=0.29, H+>166ppm en PALac, fue predictor de PAL+ | 4 |
| Esposito et al., World J Gastro, 200732 | Italia | Serie de casos | SIIRoma II | 73 | PAL | Prevalencia de SPB | Prevalencia SPB, SII: 45% | 4 |
| Peralta et al., World J Gastroenterol, 200933 | Italia | Serie de casos | SIIRoma II | 97 | PAL | Prevalencia de SPB | SPB, SII: 55.6% SII-E: 52.2%, SII-D: 61.3%, SII-M: 52% | 4 |
| Reddymasu et al., BMC Gastroenterol, 201034 | EE.UU. | Serie de casos | SIIRoma II | 98 | PAG | Prevalencia de SPB | SPB, SII: 36% (54% SII-E, 43% SII-D, 3% SII-M) | 4 |
| Yu et al., Gut, 201135 | Canadá | Serie de casos | SIIRoma II | 40 | PAL | Prevalencia de SPB | SPB, SII: 63% | 4 |
| Meyrat et al., Aliment Pharmacol Ther, 201237 | Suiza | Serie de casos | SIIRoma III | 150 | PAL | Prevalencia de SPB | SPB, SII: 71% | 4 |
Los estudios están organizados de mayor a menor nivel de evidencia, y dentro de las mismas en orden progresivo de año de publicación. Solo se informa la prevalencia de SPB de acuerdo a los subtipos de SII en los estudios que los reportaron.
ACR: American College of Reumatology; DCNE: diarrea crónica no específica; FM: fibromialgia; H2: hidrógeno espirado; IC95%: intervalo de confianza del 95%; N: número; NE: nivel de evidencia; NS: no significativo; PAF: prueba de aliento con fructosa; PAG: prueba de aliento con glucosa; PAL: prueba de aliento con lactulosa; PALac: prueba de aliento con lactosa; PAX: prueba de aliento con xilosa; ppm: partes por millón; RM: razón de momios; SII: síndrome de intestino irritable; SII-A: síndrome de intestino irritable alternante; SII-D: síndrome de intestino irritable con diarrea; SII-E: síndrome de intestino irritable con estreñimiento; SII-M: síndrome de intestino irritable mixto; SPB: sobrepoblación bacteriana.
Por otro lado, en una serie de casos de pacientes con SII que fueron sometidos a un estudio abierto con rifaximina se demostró una prevalencia de SPB del 71% con PAL en SII37. Además, 16 estudios de casos y controles11,18-30,36,38 ofrecieron información respecto a la prevalencia de SPB en SII, incluyendo el estudio de Pimentel et al.18, un ensayo clínico controlado, comparativo con placebo cuya información referente a prevalencia surge de un subanálisis de la población de estudio. Un segundo estudio, analizó una serie de pacientes consecutivos con padecimientos digestivos diversos enviados a endoscopia superior, en quienes se realizó cultivo de aspirado duodenal para determinar SPB y a posteriori se consideró SII36. En este mismo estudio se comparó además SPB entre aquellos con SII-D y SII-NoD, lo que lo hace un estudio no comparable con todos los demás36. De los 14 estudios restantes, 5 demostraron mayor prevalencia de SPB en SII en comparación con los controles3,17,19,24,38, 7 demostraron igual prevalencia11,20-22,26-27,30, uno mostró menor prevalencia en SII28 y otro no reportó el valor de p, si bien parece haber una mayor prevalencia en SII23 (tabla 1). Entre aquellos con mayor prevalencia en SII, merece una mención aparte el estudio de Pimentel et al.19, ya que en él se analizó la prevalencia de SPB entre pacientes con fibromialgia, SII y controles sanos. Los enfermos con fibromialgia fueron seleccionados sin importar sus síntomas digestivos y fue el grupo con la mayor prevalencia de SPB, por encima de los sujetos con SII y controles sanos (100, 84 y 20%, respectivamente). Vale la pena resaltar que solo se identificó un estudio de Latinoamérica21. En este último, Madrid et al. encontraron en Chile una prevalencia de SPB similar en pacientes con SII en comparación con otros trastornos funcionales digestivos (SII: 76%; estreñimiento funcional: 73%; diarrea funcional: 69%; distensión funcional: 68%)21. Adicionalmente, otro estudio analizó pacientes con SII con uso vs sin uso de inhibidores de bomba de protones (IBP) y al parecer no se encontraron diferencias en la frecuencia de SPB25. Finalmente, otros 2 estudios compararon SII vs otros trastornos funcionales digestivos (TFD)26,29. Así mismo, se analizaron 6 series de casos que conjuntaron 478 pacientes e informaron una prevalencia de SPB en pacientes con SII que varió entre el 36 y el 74%, según los métodos utilizados31-35,37.
El uso de pruebas de aliento para diagnosticar SPB se ha caracterizado por la falta de una metodología estandarizada y criterios validados para definir un examen anormal. La mayoría de los estudios emplearon lactulosa como sustrato pero con una amplia variación en la dosis, los protocolos para la realización de las pruebas e incluso los criterios para considerar una prueba anormal. Walters et al.20 utilizaron la PAL y aplicaron 2 criterios diferentes en su interpretación. Incluyeron 39 pacientes con SII y 20 controles sanos, encontrando una prevalencia de SPB radicalmente distinta en pacientes con SII, aunque sin diferencia en comparación con controles sanos sin importar el criterio: 28% de los enfermos con SII vs 30% de los sujetos controles cuando se empleó el criterio de más de 20ppm de H2 en los primeros 90min de la prueba en comparación con 69% de los enfermos con SII vs 75% de los controles cuando se empleó el criterio de más de 20ppm de H2 en cualquier momento, durante los primeros 180min de la prueba20. Por otro lado, la exactitud de la PAL ha sido puesta en duda debido a que la descomposición de este sustrato por las bacterias del ciego suele producir un segundo pico en la detección de hidrógeno que reduce su especificidad. En cambio, la PAG, sustrato que es completamente absorbido en el intestino delgado proximal (duodeno), ha demostrado una mayor sensibilidad y especificidad para la detección de SPB en comparación con la PAL11. Rana et al.30 encontraron una prevalencia similar de SPB en pacientes con SII y sujetos sanos utilizando PAL (34 vs 30%, p=NS), pero una mayor prevalencia de SPB en SII utilizando PAG (6.2 vs 0.66%, p<0.01). A pesar de ser aparentemente una prueba más precisa, ha sido utilizada en un menor número de estudios24,27,32,36. La sacarosa, otro sustrato que es totalmente absorbido en intestino delgado y por lo tanto teóricamente más preciso, fue utilizado en un solo estudio de los trabajos seleccionados23.
Por otro lado, la presencia de SPB se ha definido también con base en la detección de una cuenta elevada de bacterias en cultivo de líquido obtenido del intestino delgado. El cultivo cuantitativo debería entonces ser considerado como la prueba patrón en SPB, pero ha sido empleado en muy pocos estudios. Por otra parte, dependería del sitio del cultivo, y muchas bacterias no son cultivables. Solo 2 de los trabajos seleccionados emplearon el cultivo para detectar SPB22,28, y como se mencionó anteriormente, uno de ellos reportó menor frecuencia de SPB en SII vs controles con diversas patologías que fueron sometidos a endoscopia28.
Por todo lo anterior, podemos concluir que hay evidencias que sugieren una mayor probabilidad de SPB en SII de acuerdo con pruebas de aliento espirado. Sin embargo, no hay evidencias suficientes para recomendar el uso rutinario de estas pruebas para diagnosticar SPB en SII.
2. Alteraciones de la microbiota intestinal (disbiosis) en el síndrome de intestino irritable- •
La composición de la microbiota en pacientes con SII es diferente que la de sujetos normales (nivel de evidencia 3b, recomendación grado B).
- •
Las alteraciones de la composición microbiana —disbiosis— ocurren tanto en pacientes adultos como pediátricos con SII (nivel de evidencia 3b, recomendación grado B).
- •
Debido a la heterogeneidad del SII y al empleo de diferentes métodos para el estudio de la microbiota intestinal, no es posible establecer una composición microbiana propia del SII (nivel de evidencia 3b, recomendación grado B).
Se identificaron 26 artículos publicados que estudiaron la composición de la microbiota en pacientes con SII: 24 en la búsqueda inicial41-64 y 2 de otras fuentes39,40. Todos son estudios de casos y controles realizados en Europa, Asia y Estados Unidos. Ninguno en América Latina o África. Además, 25 fueron realizados en población adulta39-55,57-64 y solamente uno de ellos en niños56. En 11 trabajos, los casos fueron clasificados de acuerdo al subtipo de SII41,43,46-48,52,55,56,60,62,64. La microbiota fue analizada en la mayoría de los estudios con métodos moleculares, mientras que en 2 estudios se utilizó el cultivo únicamente fecal39,40, y en 4 estudios ambas metodologías42,48,51,58. Aunque en la mayoría de los estudios se analizó la composición de la microbiota solamente en muestras de materia fecal, en 4 se estudió también la composición microbiana en biopsias de mucosa colónica. Los resultados sobresalientes de cada uno de estos estudios y el resumen de la ecología microbiana de la microbiota intestinal en SII se muestran en la tabla 2.
Estudios de la composición de la microbiota intestinal en pacientes con SII
| Autor, revista, año | País | Tipo de estudio | Criterios diagnósticos/Grupos de estudio | n | Muestra | Método | Resultados/Conclusiones | NE |
| Balsari et al., Microbiologica, 198239 | Italia | Casos y controles | SII Criterios no especificados vs controles sanos | 20 vs 20 | Heces | Cultivo | Composición de la microbiota, SII vs controles: <Lactobacillus spp, <Bifidobacterium spp, | 3b |
| Si et al., World J Gastroenterol, 200440 | China | Casos y controles | SII Roma II vs controles sanos | 25 vs 20 | Heces | Cultivo | Número de bacterias, SII vs controles: <Enterobacteriaceae, >Bifidobacterium, (ambos p<0.05) | 3b |
| Malinen et al., Am J Gastroenterol, 200541 | Finlandia | Casos y controles | SIIRoma II vs controles sanos | 27 vs 22 | Heces | qPCR | Bacterias totales, SII vs controles: <C. cocoides (p<0.04) SII-D: <Lactobacillus spp, (p<0.019) SII-E: >Veillonella spp, (p<0.045) | 3b |
| Matto J et al., Immunol Med Microbiol, 200542 | Finlandia | Casos y controles | SIIRoma II vs controles sanos | 26 vs 25 | Heces | Cultivo PCR-DGGE | Composición de la microbiota, SII vs controles: >Coliformes, >Aerobios/anaerobios; estabilidad temporal, SII<controles | 3b |
| Maukonen et al., J Med Microbiol, 200643 | Finlandia | Casos y controles | SII (D, E, M)Criterios no especificados vs controles sanos | 16 (7,6, 3) vs 16 | Heces | PCR-DGGE | Microbiota predominante, en todos: C. cocoides-Eubacterium rectale, SII-E: 30% vs SII-D: 50% vs controles: 43%; estabilidad temporal, SII<controles | 3b |
| Kassinen et al., Gastroenterology, 200744 | Finlandia | Casos y controles | SII (D, E, M)Roma II vs controles sanos | 24 (10, 8, 6) vs 23 | Heces | Secuenciación de 16S rRNA qPCR | Composición de la microbiota, SII: <Lactobacillus (casi inexistentes) y Collinsella (especialmente en SII-D y SII-M) vs controles; SII-D: abundantes Streptococcus y Allisonella | 3b |
| Kerckhoffs et al., World J Gastroenterol, 200945 | Países Bajos | Casos y controles | SIIRoma II vs controles sanos | 41 vs 26 | Heces, mucosa duodenal | FISH qPCR | Composición de la microbiota, SII vs controles: bifidobacterias, 4.2±1.3 vs 8.3±1.9 (p<0.01), Bifidobacterium catenulatum, 6±0.6 vs 19±2.5 (p<0.001) | 3b |
| Krogius-Kurikka et al., BMC Gastroenterol, 200946 | Finlandia | Casos y controles | SII-DRoma II vs controles sanos | 10 vs 23 | Heces | Secuenciación de 16S rRNA | Composición de la microbiota, SII-D vs controles: >Proteobacteria, Firmicutes (familia Lachnospiraceae), | 3b |
| Lyra et al., World J Gastroenterol, 200947 | Finlandia | Casos y controles | SII-ERoma II vs controles sanos | 20 vs 15 | Heces | qPCR | Filotipos característicos, 85%≈C. thermosuccinogenes, IBS-D: -4.08±0.90 vs controles: –3.33±1.16 (p=0.04), vs IBS-M: –3.08±1.38 (p=0.05); 94≈R. torques, IBS-D: –2.43±1.49 vs controles: –4.02±1.63 (p=0.01); 93%≈R. torques, controles: –2.41±0.53 vs SII-M: –2.92±0.56, (p=0.00); R. bromii-like en SII-E: 1.61±1.83 vs controles: –3.69±2.42 (p=0.01) | 3b |
| Carroll et al., Gut Pathog, 201048 | EE.UU. | Casos y controles | SII-DCriterios no especificados vs controles sanos | 10 vs 10 | Heces, mucosa colónica | Cultivo, qPCR | Composición microbiota en heces, SII-D: 1.4×107 vs controles: 8.4×108 UFC/g de heces (p=0.002) >3.6 Lactobacillus spp (p=0.002); mucosa colónica, sin diferencias | 3b |
| Codling et al., Dig Dis Sci, 201049 | Irlanda | Casos y controles | SIIRoma II vs controles sanos | 47 vs 33 | Heces, mucosa colónica | DGGE 16S RNA | Composición microbiota en heces, SII vs controles:<0.001); sin diferencia entre heces y mucosa | 3b |
| Noor et al., BMC Gastroenterol, 201050 | Reino Unido | Casos y controles | SIIRoma II vs CUCI vs controles sanos | 11 vs 13 vs 22 | Heces | PCR-DGGE y secuenciación 16S rRNA | Número de bandas de bacterias, SII: 39±6 vs CUCI: 37±5 vs controles: 45±3, (p=0.01);=0.01) | 3b |
| Malinen et al., World J Gastroenterol, 201064 | Finlandia | Serie de casos | SIIRoma I | 44 | Heces | qPCR | Composición de la microbiota, 94%≈R. torques-like, se asoció con severidad de los síntomas del SII; SII con 94%≈R. torques: < C.cocleatum, C.aerofaciens-like y C.eutactus 97% | 4 |
| Tana et al., Neurogastroenterol Motil, 201051 | Japón | Casos y controles | SIIRoma II vs controles sanos | 26 vs 26 | Heces | Cultivo qPCR | Alteración en la microbiota (log10 bacterias g–1), Veillonella spp, SII: 7.2±0.8 vs controles: 6.8±0.7 (p=0.046), Lactobacilli spp, SII: 5.6±1.9 vs controles: 4.6±1.6 (p=0.031) | 3b |
| Carroll et al., Am J Physiol Gastrointest Liver Physiol, 201152 | EE.UU. | Casos y controles | SII-DRoma III vs controles sanos | 16 vs 21 | Heces, mucosa colónica | Huellas de 16S RNA-PCR | Biodiversidad en heces, SII-D vs controles: <1.2 veces (p=0.008); Mucosa colónica, sin diferencias | 3b |
| Kerckhoffs et al., J Med Microbiol, 201163 | Holanda | Casos y controles | SIIRoma II vs controles | 37 vs 20 | Heces, duodeno | PCR-DGGE | Composición de la microbiota, Pseudomonas 48% de clones duodeno, SII: 8.3±0.9 vs controles: 0.1±0.007 (p<0.001); heces, SII: 2.34±0.31 vs controles: 0.003±0.0027, (p<0.001) | 3b |
| Ponnusamy et al., J Med Microbiology, 201153 | Corea | Casos y controles | SIIRoma II vs controles sanos | 11 vs 8 | Heces | DGGE qPCR de genes 16S RNA | Diversidad bacteriana, SII-D >controles, (p=0.004), <Bifidobacter y C.coccoides; número de bacterias, SII=controles | 3b |
| Rajilic-Stojanovic et al., Gastroenterology, 201154 | Holanda | Casos y controles | SII Roma II vs controles sanos | 62 vs 46 | Heces | Microarreglos filogenéticos 16S y qPCR | Radio Firmicutes-Bacteroides, SII vs controles: ×2 (p=0.0002), ×1.5 Dorea, Ruminococcus y Clostridium spp (p=0.005), ×2 Bacteroidetes (p=0.0001), ×1.5<Bifidobacterium y Faecalibacterium spp (p=0.05); metanógenos, SII: 3.50±107 vs controles: 8.74±106 cels/g fecals (p=0.003) | 3b |
| Rinttila et al., Gut Pathog, 201155 | Finlandia | Casos y controles | SII-DRoma I vs controles sanos | 96 vs 23 | Heces | qPCR | Prevalencia S.aureus, SII: 17% vs controles: 0 (p<0.05), C.perfringes, SII: 13% vs controles: 17% (NS) | 3b |
| Saulnier et al., Gastroenterology, 201156 | EE.UU. | Casos y controles | Niños con SII-ERoma III vs controles sanos | 22 vs 22 | Heces | Secuenciación metagenómica 16S rRNA y microarreglos DNA | Composición de la microbiota, SII-E vs controles: >0.07% Proteobacterias (Haemophilus Parainfluenzae); un nuevo microbio Ruminococcus-like se asoció con SII | 3b |
| Carroll et al., Neurogastroenterol Motil, 201257 | EE.UU. | Casos y controles | SII-DRoma II vs controles sanos | 23 vs 23 | Heces | Secuenciación DNA de alto rendimiento | Composición de la microbiota, SII: >Enterobacteriacea, (p=0.03),=0.04) vs controles | 3b |
| Chassard et al., Aliment Pharmacol Ther, 201258 | Francia | Casos y controles | SII-ERoma II vs controles sanos | 14 vs 12 | Heces | Cultivo y FISH | Composición de la microbiota, Enterobacterias, SII-E: 7.4±0.8 vs controles: 6.4±0.9 (p=0.01), bifidobacterias, 6.8±0.7 vs 7.8±0.5 (p<0.0001), lactobacilos, 5.5±0.9 vs 6.9±0.7 (p=0.0007), utilizadoras de lactato, 7.9±1.2 vs 9.3±0.4 (p=0.0046), Utilizadoras de sulfato, 8.4±0.3 vs 5.9±0.4 (p=0.0002), Roseburia-E. rectale (Lachnospiraceae), (p<0.05) | 3b |
| Duboc et al., Neurogastroenterol Motil, 201259 | Francia | Casos y controles | SIIRoma III vs controles sanos | 14 vs 18 | Heces | qPCR | Número de bacterias, SII-D vs controles: igual número de bacterias, >E. coli (p=0.002), <Leptum (p<0.001) y Bifidobacterias (p=0.007) | 3b |
| Jeffery et al., Gut, 201260 | Suecia | Casos y controles | SII-D vs SII-E vs SII-ARoma II vs controles sanos | 15 vs 10 vs 12 vs 20 | Heces | Pirosecuenciación de 16S rRNA | Se identificaron 3 subgrupos de SII, 1: microbiota parecida a los controles; 2 y 3: >Firmicutes y | 3b |
| Maccaferri et al., Gut Microbes, 201261 | Italia | Casos y controles | SII-D vs SII-M vs SII-E vs controles | 10 vs 5 vs 20 vs 24 | Heces | Microarreglos | Composición de la microbiota, SII vs controles: >Lactobacilos, >B.cereus, >B.clausii, >Bifidobacterias, >Clostridias IX, > E.rectale, Prevotella y <Veillonella | 3b |
| Parkes et al., Neurogastroenterol Motil, 201262 | Reino Unido | Casos y controles | SII-D vs SII-ERoma III vs controles sanos | 27 vs 26 vs 26 | Mucosa colónica | FISH, microscopia confocal | Número de bacterias/mm3 (IQR), SII: 218 (209) vs controles: 128 (121), (p=0.007); Bacteroides, 69 (67) vs 14 (41) (p=0.001), E.rectale–Clostridium coccoides, 52 (58) vs 25 (35) (p=0.03), Bifidobacterias, SII-D: 24±32 vs SII-E: 54±88 vs controles: 32±35 (p=0.011) | 3b |
Los estudios están organizados de mayor a menor nivel de evidencia, y dentro de las mismas en orden progresivo de año de publicación.
A: alternante; CUCI: colitis ulcerativa crónica inespecífica; D: diarrea; DNA: ácido desoxirribonucleico; E: estreñimiento; FISH: hibridación fluorescente in situ; H2: hidrógeno; IQR: rango del cuartil; N: número; NE: nivel de evidencia; PCR-DGGE: reacción de polimerasa en cadena con electroforesis en gel de gradiente; qPCR: Reacción de polimerasa en cadena cuantitativa; RCT: estudio aleatorizado controlado; RNA: ácido ribonucleico; SII: síndrome de intestino irritable; spp: todas las especies del género mencionado; <: disminución; >: aumento.
Los trabajos que utilizaron al cultivo de heces para estudiar la microbiota intestinal han mostrado que los pacientes con SII, en contraste con los sujetos sanos, tienen una población disminuida de bifidobacterias y de lactobacilos y un aumento de los estreptococos, coliformes y especies de Clostridium39,40,42,51. Por otro lado, la mayoría de los trabajos usaron métodos moleculares independientes del cultivo, como son las pruebas basadas en la extracción del DNA y la amplificación de los genes 16S del RNA ribosomal como PCR cuantitativa, los productos de la PCR por electroforesis en gel con gradiente de desnaturalización e hibridación sonda específica in situ con fluorescencia. La diversidad de estrategias moleculares empleadas en estos trabajos (tabla 3) es la explicación de los resultados poco consistentes y aun contradictorios que se han mostrado en cuanto a la composición y a la diversidad de la microbiota de los pacientes con SII, así como una única determinación de la microbiota con la variable tiempo y el limitado conocimiento de nuevas especies bacterianas que aún esperan ser descritas. Por lo anterior, si bien parece que la microbiota intestinal de pacientes con SII es diferente de la de los controles, hasta el momento no es posible establecer una composición microbiana intestinal característica del SII.
Métodos moleculares utilizados en el análisis de la microbiota
| FISH (hibridación in situ con fluorescencia) | Técnica que permite la detección de secuencias de ácidos nucleicos en bacterias o tejidos. La detección in situ provee una visualización directa de la localización espacial de secuencias específicas que es crucial para dilucidar la organización y la función génica, por lo que el método de hibridación in situ es una técnica importante en diagnóstico de rearreglo cromosomal en la detección de microorganismos. La hibridación in situ toma como fundamento la complementariedad de los ácidos nucleicos de DNA y/o RNA a través de los puentes de hidrógeno formados entre las bases: adenina–timina (DNA) o uracilo (RNA) y citosina-guanina (DNA y RNA) |
| PCR-DGGE (amplificación por reacción en cadena de la polimerasa-electroforesis en gel con gradiente desnaturalizante) | La técnica de huella génica es útil para identificar bacteria (única o en comunidad) al término de una amplificación en cadena de la polimerasa de su DNA. La huella génica consiste en un perfil basado en la separación física de secuencia única del gen del RNA ribosomal 16Sa través de la DGGE. Además, permite el análisis simultáneo de múltiples bacterias a partir de una muestra clínica o tejido, por lo que la técnica permite realizar la comparación de la diversidad génica de bacterias y el estudio de su comportamiento en un tiempo |
| 16S rDNA (ácido desoxirribonucleico) | Es el gen que codifica para el RNA ribosomal 16S, es componente de la subunidad pequeña de los ribosomas procarióticos. El gen 16S rDNA es utilizado para estudios filogenéticos, debido a que se encuentra altamente conservado entre las diferentes especies bacterianas y arqueas; además, contiene regiones hipervariables que proveen secuencias específicas de especie que son útiles para la identificación bacteriana. El uso de estas secuencias ha permitido conocer un gran número de géneros y especies |
| 16S rRNA (ácido ribonucleico) | El 16S rRNA es un polirribonucleo¿tido de aproximadamente 1.500nt, codificado por el gen RRS, también denominado DNA ribosomal 16S (16S rDNA), a partir de cuya secuencia se puede obtener información filogenética y taxonómica. El RNA ribosómico (rRNA) 16S es la macromolécula más ampliamente utilizada en estudios de filogenia y taxonomía bacterianas, ya que es considerada como un cronómetro molecular. Esto último debido a que es una molécula muy antigua presente en todas las bacterias, los cambios en su secuencia ocurren de manera lenta y su variabilidad permite distinguir organismos próximos y distantes |
| PCR cuantitativo (ácido desoxirribonucleico) | La reacción en cadena de la polimerasa (PCR) cuantitativa o PCR en tiempo real es una variación de la técnica de la PCR estándar que se emplea para la determinación del número de copias de DNA o mRNA presente en una muestra (medida de la expresión génica). El uso de esta técnica permite la identificación y cuantificación de los microorganismos presentes en una muestra, lo cual es útil en la clínica para el diagnóstico y tratamiento |
| Microarreglo filogenético | Los microarreglos están constituidos por el material biológico o sintético y un soporte solido en el cual se inmovilizan o adsorbe el material biológico. Los microarreglos tienen diferentes aplicaciones como la detección de genes en una muestra (microarreglos de DNA), presencia de polimorfismos o la determinación de la expresión de diversos genes (microarreglos de mRNA). Los microarreglos tienen la ventaja de que se puede analizar la presencia y/o expresión de un gran número de genes de manera simultánea. Mediante el análisis bioinformático se pueden construir dendrogramas, los cuales permiten observar la relación genética que guardan diferentes muestras |
| Pirosecuenciación | La pirosecuenciación es una técnica de secuenciación masiva no fluorescente que permite determinar las secuencias de nucleótidos presentes en una muestra. Una de las ventajas de esta técnica es que, si existe una mezcla de especies bacterianas, mediante el análisis bioinformático de las secuencias podemos identificar las diferentes especies bacterianas presentes en la muestra |
- •
La incidencia del SII-PI se ha reportado en promedio en 9 a 10%, con un intervalo del 4% al 36% (nivel de evidencia 1a, recomendación grado A).
- •
La prevalencia del SII-PI varía del 3 al 17%, y desciende en el curso de los años posteriores a la infección gastrointestinal (nivel de evidencia 3b, recomendación grado B).
- •
La etiología bacteriana es la más estudiada en relación al SII-PI, y aunque las causas viral y parasitaria están poco estudiadas, también parecen ser factores de riesgo para SII-PI (nivel de evidencia 2b, recomendación grado B).
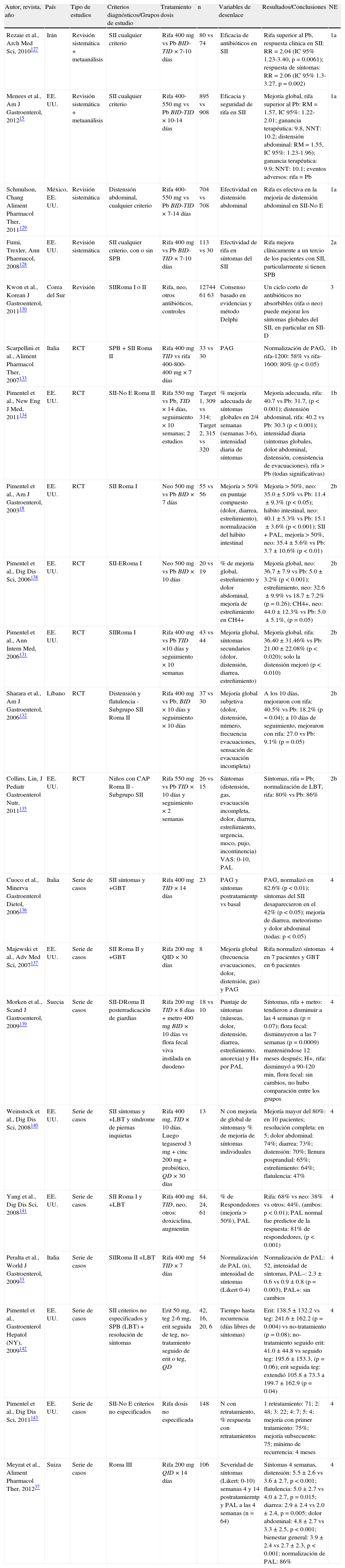
Se revisaron 23 estudios sobre SII-PI, 19 de ellos identificados en la búsqueda inicial10,65-82 y 4 identificados posteriormente de otras fuentes83-86. Doce estudios reportaron la incidencia de SII-PI (aparición de SII de novo)65-67,71,72,75,77,80,83,85, 8 la prevalencia65,69,73,74,78,79,82,84, y 8 analizaron factores de riesgo relacionados con el desarrollo del SII-PI10,66,70,72,82,84,86. Todos los estudios fueron en población adulta excepto uno en población pediátrica71 (tabla 4).
Incidencia, prevalencia y factores de riesgo para el SII-PI
| Autor, revista, año | País | Tipo de estudio | Criterios diagnósticos/Grupos de estudio | n | Variables de desenlace | Resultados/Conclusiones | NE |
| Thabane et al., Aliment Pharmacol Ther, 200786 | Canadá | Revisión sistemática de estudios prospectivos controlados | SIIManning, Roma I, II, III en expuestos a GE aguda bacteriana vs no expuestos | 2,977 vs 586,523 | Riesgo de SII-PI, factores de riesgo | Riesgo global (RM=5.86, IC95% 3.60-9.54); 3 meses: RM=7.58 (IC95% 4.27-13.45); 6 meses: RM=5.18 (IC95% 3.24-8.26); 12 meses: RM=6.37 (IC95% 2.63-15.40); 24-36 meses: RM=3.85 (IC95% 2.95-5.02); factores de riesgo para SII-PI vs SII-NoPI: menor edad, mayor ansiedad y depresión | 1a |
| Schwille-Kiuntke et al., Z Gastroenterol, 201165 | Alemania | Revisión sistemática | Expuestos a diarrea aguda (epidemias, GE individual, diarrea del viajero)SII Manning, Roma I, II | 6,404 (2,414, 3,764, 226) 811 | Incidencia, prevalencia de SII-PI a los 12 meses | Incidencia, postepidemias: 7-32%; post GE individual: 4-36%; postdiarrea del viajero: 4-14%; prevalencia: 7-32% | 1a |
| Dai et al., Hepatogastroenterology, 201266 | China | Revisión sistemática de estudios de casos y controles | SIIRoma, Manning, en expuestos a GE bacteriana vs no expuestos | 2,721 vs 586,297 | Incidencia de SII-PI, factores de riesgo | Global: RM=6.03 (IC95% 3.58-10.13); 3 meses: RM=8.47 (IC95% 4.85-14.76); 6 meses: RM=4.58 (IC95% 2.94-7.14); 12 meses: RM=6.19 (IC95% 2.82-13.58); 24-36 meses: RM=4.05 (IC95% 3.13-5.24); factores de riesgo: género femenino, menor edad, severidad del insulto inicial, duración de la enteritis, factores psicológicos adversos | 3a |
| Haagsma et al., Epidemiol Infect, 201067 | Holanda | Desenlace de casos y controles | SIIRoma, Manning, en expuestos a bacterias vs Campylobacter vs Salmonella vs Shigella vs controles | 318 vs 108 vs 266 vs 322 vs 585,178 | Incidencia de SII-PI a 1 año post GE, RA a 10-12 meses | Incidencia: 4-17%; RA: 8.8% (IC90% 7.2-10.4) | 2b-c |
| Okhuysen et al., Am J Gastroenterol, 200480 | EE.UU. | Estudio de cohorte | SIIRoma II, diarrea del viajero por E.coli enteropatógena y enterotoxigénica en México | 169 | Incidencia de SII-PI a los 6 meses | 10% | 2b |
| Moss-Morris et al., Psychosom Med, 200681 | Nueva Zelanda | Estudio de cohorte | SIIRoma I, II, en expuestos GE por Campylobacter vs mononucleosis infecciosa | 592 vs 243 | Riesgo de SII-PI luego de 3 y 6 meses | Riesgo de SII-PI: Campylobacter >mononucleosis; 3 meses: RM=3.45 (IC95% 1.75-667); 6 meses: RM=2.22 (IC95% 1.11-6.67) | 2b |
| Törnblom et al., Clin Gastroenterol Hepatol, 200784 | Suecia | Estudio de cohorte | SIIRoma II, en expuestos a GE bacteriana, viral, parasitaria | 333 | Prevalencia de SII-PI, factores de riesgo | Prevalencia de síntomas GI, 3 meses: 12%; 5 años: 9% (68% SII); factores de riesgo: género femenino, RM=2.65 (IC95% 1.28-5.50); uso de antibióticos, RM=2.37 (IC95% 1.07-5.25) | 2b |
| Marshall et al., Clin Gastroenterol Hepatol, 200785 | Canadá | Estudio de cohorte | SIIRoma I en expuestos a GE por Norovirus | 135 | Incidencia de SII-PI luego de 3 meses, factores de riesgo | Incidencia en expuestos: 23.6% vs no expuestos: 3.4% (RM 6.9, IC95% 1.0-48.7; p=0.014); factor de riesgo: vómito durante la GE, RM=10.5 (IC95% 1.3-85.5; p=0.028) | 2b |
| Thabane et al., Am J Gastroenterol, 201071 | Canadá | Estudio de cohorte | Niños SIIRoma I, en expuestos a E.coli 0157:H7, Campylobacter spp | 467 | Incidencia de SII-PI | Expuestos: 10.5 vs no expuestos: 2.5%, RM=4.6 (IC95% 1.6-13.3) | 2b |
| Pitzurra et al., J Travel Med, 201172 | Suiza | Estudio de cohorte | SIIRoma III | 2,476 | Incidencia de SII-PI en viajeros europeos a lugares de recursos limitados | SII: 1.0% (IC95% 0.6-1.4); SII-PI: 2.8% (IC95% 1.7-3.9); SII-no seleccionado: 0.9% (IC95% 0.5-1.4); factores de riesgo a los 6 meses luego del viaje: diarrea del viajero RM=3.61 (IC95% 1.74-7.51); eventos adversos en la vida 1 año previo al viaje, RM=2.58 (IC95% 1.09-6.07); diarrea 4 meses antes del viaje RM=2.5 (IC95% 1.19-5.24) | 2b |
| Thabane et al., Am J Gastroenterol, 200910 | Canadá | Estudio de cohorte | SII-PI criterios no especificadosExpuestos vs no expuestos a GE por E.coli 0157:H7, C.jejuni y otros | 1,368 vs 701 | Determinar y validar factores predictores de SII-PI | Predictores: género femenino, edad <60, mayor duración de diarrea, defecaciones más frecuentes, cólico abdominal, heces sanguinolentas, pérdida de peso, fiebre, alteraciones psicológicas (ansiedad y depresión), RM=1.05 (IC95% 1.03-1.06, p<0.0001); estos factores derivan en una escala numérica que permite determinar riesgo bajo, moderado o alto para SII-PI | 1b |
| Schwille-Kiuntke et al., Neurogastroenterol Motil, 20112 | Alemania | Estudio de cohorte | SIIRoma III, en GE por Salmonella vs Campylobacter | 223 vs 249 | Prevalencia de SII-PI, casos moderados a severos | Prevalencia, S.enteritidis: 8.1% vs C.jejuni: 12.8%; SII-PI severos, Salmonella > Campylobacter: X2=3.984, p=0.047; factores de riesgo de SII, Salmonella > Campylobacter: sexo femenino, menor edad | 2b |
| Villani et al., Gastroenterology, 201076 | Canadá | Casos y controles anidados en un estudio de cohorte | SIIRoma I, en expuestos a GE vs expuestos sin SII | 228 vs 581 | Establecer variantes genéticas asociadas con susceptibilidad para SII-PI | Promotores de proteína de las uniones fuertes, CDH1 (rs16260, -C160A, p=0.0352), citocina IL6 (rs1800795, -G174C, p=0.0420), receptor de respuesta innata, TLR9 (rs5743836, -T1237C; p=0 .0250) y codificante (rs352139, P545P, p=0.0059) | 2a |
| Ji et al., J Gastroenterol Hepatol, 200567 | Corea del Sur | casos y controles anidado en estudio de cohorte | SIIRoma I, II, en expuestos a Shigella vs no expuestos | 101 vs 102 | Incidencia de SII-PI luego de 12 meses, Factores de Riesgo | Incidencia en Expuestos: 14.85% vs No expuestos: 5.88, RM=2.9 (IC95% 1.1-7.9); Factor de riesgo independiente: Diarrea | 2b |
| Marshall et al., Gut, 201070 | Canadá | Casos y controles anidado en estudio de cohorte | SIIRoma I, en Expuestos a GE por E.coli 0157:H7 y C.jejuni vs no expuestos | 742 vs 424 | Prevalencia de SII-PI, factores de riesgo | Prevalencia, 2-3 años: 28.3% vs 8 años: 15.4%; riesgo en expuestos vs no expuestos RM=3.12 (IC95% 1.99-5.04); factores de riesgo independientes a los 8 años: género femenino, menor edad, ansiedad/depresión previas, fiebre, pérdida de peso durante la infección aguda | 2b |
| Kim et al., Korean J Gastroenterol, 200677 | Corea del Sur | Casos y controles anidado en estudio de cohorte | SIIRoma II, en expuestos Shigella spp vs no expuestos | 95 vs 105 | SII-PI a los 3 años | Incidencia, 1 año: 13.8% vs: 1.1%, RM=11.9 (IC95% 1.49-95.58); 3 años: 14.9% vs 4.5% RM=3.93 (IC95% 1.20-12.86); recuperación a 3 años del SII PI: 25% | 2b |
| Morgan et al., Gastroenterol Res Pract, 201273 | Nicaragua | Casos y controles anidado en estudio de cohorte | SIIRoma II | 163 vs 194 | Prevalencia de SII de acuerdo a carga parasitaria | Con parasitosis: 16.6% vs controles: 15.4%, (p= NS); SII-D: 25%; SII-E: 32%; SII-M: 43% | 2b |
| Zanini et al., Am J Gastroen-terol, 201275 | Italia | Casos y controles anidado en estudio de cohorte | SIIRoma III expuestos a Norovirus vs no expuestos | 186 vs 198 | Incidencia de SII-PI luego de 1 año | Expuestos: 21.5% vs no expuestos: 1.5%, RM=11.40 (IC95% 3.44-37.82), p<0.0001; SII-E: 10%; SII-D: 17.5%; SII-M: 40%; SII-U: 32.5% | 2b |
| Soyturk et al., Am J Gastroenterol, 200783 | Turquía | Casos y controles anidado en estudio de cohorte | SIIRoma II, expuestos a GE por Trichinella britovi vs no expuestos | 72 vs 27 | Incidencia de SII-PI a 2 meses, persistencia de síntomas a 4, 6, 12 meses | Incidencia a los 2 meses en expuestos: 13.9% vs no expuestos: 0; persistencia, 4 meses: 13.9%; 6 meses: 13.9%; 12 meses: 7% | 2b |
| DuPont et al., Am J Trop Med Hyg, 201069 | EE.UU. | Casos y controles | SIIRoma II PI, No PI (luego de cuadro agudo)a | 221 | Prevalencia de SII-PI y SII-No PI, antecedente de diarrea del viajero en SII | Prevalencia, SII-PI: 11.4% vs SII-No PI: 24.9%; diarrea del viajero, SII-PI: 14.0% vs SII-No PI: 4.5 (p=0.006) | 3b |
| Porter et al., Dig Dis Sci, 201178 | EE.UU. | Casos y controles | TFGI ICD-9 564.1 en soldados desplegados en Afganistán vs soldados desplegados sin TFGI | 129 vs 396 | Prevalencia de diarrea; determinar si diarrea, vómito y estrés por la guerra fueron factores de riesgo para SII-PI | Prevalencia de SII: 17%; factores de riesgo, diarrea: RM 5.27 (IC95% 2.28-12.21, p<0.001); vómito: RM 7.00 (IC95% 2.70-18.14, p<0.001); estrés: RM 2.30 (1.06-4.96, p<0.05) | 3b |
| Wensaas et al., Gut, 201274 | Noruega | Casos y controles | SIIRoma III, en expuestos giardiasis vs no expuestos | 817 vs 1,128 | Prevalencia de SII-PI vs SII-No PI, luego de 3 años | SII-PI: 46.1% vs SII-No PI: 14%, RR=3.4 (IC95% 2.9-3.8) | 3b |
| Rodríguez-Fandiño et al., Neurogastroenterol Motil, 201379 | México | Casos y controles en un estudio experimental | SIIRoma II PI-cuestionario de Spiller | 20 | Prevalencia de SII-PI | 5.0% | 3b |
Los estudios están organizados de mayor a menor nivel de evidencia, y en orden progresivo de año de publicación.
CDH1: cadherina 1; D: diarrea; E: estreñimiento; GE: gastroenteritis; IC95%: intervalo de confianza del 95%; M: mixto; N: número; NE: nivel de evidencia; NS: no significativo; PBMC: células mononucleares de sangre periférica; PI: postinfeccioso; RA: riesgo atribuible; RM: razón de momios; RR: riesgo relativo; SII: síndrome de intestino irritable; spp: especies; TLR9: receptor tipo Toll-9; U: no clasificable.
La incidencia de datos clínicos de SII posterior a una infección gastrointestinal se ha informado en promedio en 9-10% basado en 2 revisiones sistemáticas, pero varía según el caso del 4 al 36%65,67. No hay diferencias si el SII se desarrolla después de una gastroenteritis aguda durante epidemias, por infecciones aisladas o posterior a diarrea del viajero65. Así mismo, la probabilidad de desarrollar SII es 6 veces mayor en sujetos expuestos a infección gastrointestinal que en sujetos no expuestos66.
En cuanto a la prevalencia del SII-PI, esta se ha informado en 7 a 33%, pero hay grandes variaciones dependiendo de la casuística y sobre todo del tiempo de observación65. Además, la prevalencia varía según la región geográfica, y México parece tener una de las menores del mundo, siendo de solo el 5.0%79. Además, la prevalencia es mayor si se valora en un tiempo cercano posterior al brote infeccioso que si se evalúa tiempo después. Por ejemplo, 2años después de un brote de gastroenteritis bacteriana en Walkerton (Canadá) se informó una prevalencia de SII-PI del 30.4% en los sujetos expuestos a gastroenteritis aguda87. En contraste, en los años siguientes la prevalencia había disminuido y a los 8años era del 15.4%88,70. En forma similar, en Suecia la prevalencia de SII-PI inicial del 12% se redujo al 9% 5años más tarde84. En grandes revisiones se ha reportado que la probabilidad (razón de momios: RM) de desarrollar SII a los 3meses posteriores a una diarrea infecciosa fue 7.58-8.47 veces mayor que la población control, pero a los 24 a 36meses la RM había descendido a 3.85-4.0510,66.
En cuanto al agente causante del SII-PI, en general los estudios de incidencia y prevalencia se refieren a cuadros de SII posteriores a infecciones bacterianas, o bien no se especifica la causa. Las bacterias más frecuentemente identificadas han sido E.coli, Campylobacter, Shigella y Salmonella10,67,68,77,80. La mayoría de los pacientes con SII-PI posterior a un episodio de diarrea del viajero adquirida en México fueron por E.coli80. En un grupo de pacientes de Houston (Texas) el antecedente de un viaje al extranjero se encontró en el 16.1% de los pacientes con SII-PI y solamente en el 7.5% de aquellos con SII-NoPI69. Un estudio en niños informó SII-PI en el 10.5% posterior a infección por Campylobacter, en comparación con SII en el 2.5% de los niños no expuestos71. Por otra parte, la gastroenteritis bacteriana por Campylobacter es seguida de SII con mayor frecuencia que en enfermedades infecciosas que no afectan el tubo digestivo, como por ejemplo la mononucleosis infecciosa81. Con respecto a las gastroenteritis de etiología viral, se ha descrito que Norovirus puede causar SII-PI, pues los 2 estudios publicados75,85 coinciden con el 21.5 y el 23.6% de SII-PI, mientras que solo el 1.5 y el 4.4% de los controles tuvieron SII. En cuanto al papel de las parasitosis intestinales, los resultados son menos conclusivos. Un estudio en Centroamérica no encontró diferencias en la prevalencia de SII según criterios de RomaII en individuos con antecedentes de parasitosis vs sujetos sin dicho antecedente (16.6% vs 15.4%)73. En cambio, después de un brote de giardiasis que infectó a un gran número de sujetos en Noruega, la prevalencia de SII según criterios de RomaIII fue notablemente mayor que en la población control (46 vs 14%).74 Así mismo, en un brote de 72 casos de infección por Trichinella britovi en Turquía, 10 casos desarrollaron SII (13.9%)83.
En cuanto a los factores de riesgo para desarrollar SII-PI, se han descrito el sexo femenino, la gravedad de la gastroenteritis y la presencia de ansiedad y depresión10. Además, Villani et al.76 analizaron a los sujetos que desarrollaron SII-PI 2 a 3años posteriores a la epidemia de Walkerton, encontrando que variaciones genéticas relacionadas con la expresión del receptor tipo Toll (TLR)-9 relacionado con la inmunidad innata, interleucina (IL)-6, relacionado con la activación inmune y cadherina-1 (CDH1) involucrada en las uniones fuertes del epitelio, fueron factores de riesgo independientes para el SII-PI.
Lo anterior nos permite concluir que la incidencia y la prevalencia del SII-PI son variables, y si bien la etiología bacteriana ha sido la más estudiada, parece que los virus como Norovirus y parásitos como Giardia también pueden estar relacionadas con el SII-PI. Por otra parte, se han determinado factores de riesgo relacionados con el SII-PI, como el sexo femenino, la gravedad de la gastroenteritis y la ansiedad y depresión previas, así como factores genéticos relacionados con la inmunidad.
4. Inflamación intestinal de bajo grado en relación con síndrome de intestino irritable-postinfeccioso y no postinfeccioso- •
Existen evidencias que sugieren la presencia de inflamación intestinal de bajo grado en un subgrupo de pacientes con SII, la cual comprende un incremento en los linfocitosT intraepiteliales (LIE), mastocitos y células enterocromafines (nivel de evidencia 3a, recomendación grado B).
- •
El incremento de LIE y mastocitos parece observarse más comúnmente en pacientes con SII-D en comparación con SII-E y SII-M. Sin embargo, no se puede concluir si hay diferencias entre SII-PI en comparación con SII-NoPI (nivel de evidencia 3a-b, recomendación B).
- •
No hay evidencias suficientes para determinar si hay diferencias en células enterocromafines entre SII-PI y SII-NoPI (nivel de evidencia 5, recomendación D).
Se identificaron un total de 29 artículos, de los cuales 2 fueron revisiones sistemáticas89,90 y el resto originales91-117. En la búsqueda inicial se identificaron 27 estudios90-115,117, y posteriormente 289,116 de otras fuentes. Todos los estudios fueron en población adulta y solo uno en población pediátrica. Veinticuatro estudios analizaron la presencia de células inflamatorias crónicas (linfocitosT, mastocitos y células enterocromafines) en la mucosa del colon y recto de pacientes con SII y controles89,91,94-104,107,108,110-118 (tabla 5).
Inflamación de bajo grado en SII-PI y SII-No PI
| Autor, revista, año | País | Tipo de estudio | Criterios diagnósticos/Grupos de estudio | n | Sitio de la biopsia | Células inflamatorias investigadas | Resultados/Conclusiones | NE |
| Matricon et al., Aliment Pharmacol Ther, 201289 | Francia | Revisión sistemática de casos y controles y EAC | SIIManning, Roma I, II, III vs sanos | 1,282 vs 789 | Íleon terminal, ciego, colon y recto | Mastocitos, LIE, linfocitos T, CEC | Mastocitos, LIE, mucosa de íleon, ciego, colon y en menor grado en recto: SII >controles; CEC: resultados discrepantes | 3a |
| Ortiz-Lucas et al., Rev Esp Enferm Dig, 201090 | España | Revisión sistemática de casos y controles y EAC | SIIManning, Roma I, II, III vs controles (sanos, CUCI, colitis microscópica, DF, DTNC, EC, depresión) | 999 vs 706 | Intestino delgado, colon | LIE, mastocitos | LIE: existe evidencia de incremento en SII vs controles, aunque los resultados son contradictorios; mastocitos: existen evidencias de un aumento en el íleon terminal y colon ascendente en SII vs controles | 3a |
| Klooker et al., Gut, 201091 | Holanda | EAC | SIIRoma II (hipersensibles y normosensibles) vs sanos | 60 (30, 30) vs 22 | Descendente, recto | Mastocitos | Mastocitos triptasa+, SII<0.05); mastocitos CD117 SII normosensibles=0.001) y tendencia en hipersensibles (p=0.06) | 2b |
| De Silva et al., Scand J Gastroenterol, 201292 | Sri Lanka | Casos y controles anidado en estudio de cohortes | SIIRoma III (SII-PI) vs historia familiar de cáncer de colon | 49 (16) vs 14 | Íleon, colon | Mastocitos, eosinófilos, neutrófilos | Mastocitos/media (rango), íleon, SII: 14.67 (8-24) vs controles: 5.75 (4-8) (p<0.001); ciego, SII: 8.71 (2-14) vs controles: 4.00 (2-6) (p<0.001); ascendente, SII: 5.54 (3-8) vs controles: 3.20 (1-5) (p=0.012); descendente, SII: 8.67 (4-20) vs controles: 3.50 (3-4) (p=0.042); recto, SII: 10.08 (7-16) vs controles: 4.13 (2-7), (p<0.001); sin diferencias en eosinófilos, neutrófilos; no se analizó SII-PI vs SII-NoPI | 2b |
| Weston et al., Dig Dis Sci, 199393 | EE.UU. | Casos y controles | SIIManning vs sanos | 20 vs 15 | Íleon terminal | Mastocitos | Células/HPF, SII: 23.3±3.1 vs controles: 6.8±1.1, (p=0.0001); mayor número en SII-D (sin especificar si fueron SII-PI o no-PI) | 3b |
| Gwee et al., Gut, 199294 | Gran Bretaña | Casos y controles | SIIRoma I PI vs expuestos sin SII vs sanos | 10 vs 19 vs 18 | Recto | Células mononucleares | SII-PI: 105.7±23.3 vs expuestos sin SII: 83.2±29.4 vs controles: 79.1±16.9 (p<0.05) | 3b |
| Spiller et al., Gut, 200095 | Gran Bretaña | Casos y controles anidado en estudio de cohortes | SII Roma I PI vs GE por Campylobacter vs sanos | 10 vs 21 vs 12 | Recto | CEC, LIE | CEC, SII-PI: 12.7±0.4 vs GE: 5.7±1.0 12 semanas vs controles: 1.8±0.4 (p<0.001); LIE CD8, SII-PI 1.8±0.3 vs GE: 0.9±0.2 12 semanas vs controles: 0.5±0.2, (p<0.001); los cambios pueden persistir hasta por 1 año | 2b |
| Walker et al., Aliment Pharmacol Ther, 2009109 | Suecia | Casos y controles anidado en estudio de cohorte | SII-D, SII-E vs DF Roma I vs sanos | 41 vs 51 vs 48 | Duodeno | Mastocitos, eosinófilos, LIE | LIE/medianas, SII-E: 18 vs controles: 14, (p=0.005), vs DF: 14 (p=0.003); mastocitos/medianas: SII-E: 255 vs IBS-D: 233, vs controles: 145, (SII-E vs controles p<0.001, SII-D vs controles p=0.004); eosinófilos/medianas, DF: 31 vs controles: 17, SII-E: 17.5, SII-D: 14, (DF vs controles p<0.001, vs SII-E p=0.001 vs SII-D p<0.001); No se especificó SII-PI vs SII-NoPI | 2b |
| O'Sullivan et al., Neurogastro-enterol Motil, 200096 | Irlanda | Casos y controles | SIIRoma I vs sanos | 14 vs 7 | Ciego, colon ascendente, descendente, recto | Mastocitos | Ciego, SII: 0.91±0.18 (IC95% 0.79-1.0) vs controles: 0.55±0.14 (IC95% 0.40-0.69); no diferencias en ascendente, descendente, recto | 3b |
| Chadwick, Gastroenterology, 2002117 | Nueva Zelanda | Casos y controles | SIIRoma I vs controles | 77 vs 28 | Biopsias colon | Determinar histología | Se encontraron 3 grupos de SII, G1: histología normal y >LIE, LLP-CD3, CD25 G2: >neutrófilos, mastocitos; G3: colitis microscópica linfocítica | 3b |
| Törnblom et al., Gastroenterology, 200297 | Suecia | Casos y controles | SIIRoma I vs neuropatía visceral degenerativa vs controles sometidos a colonoscopia vs autopsias | 10 vs 10 vs 20 vs 15 | Biopsia de pared intestinal en yeyuno proximal y colon | Linfocitos T y LIE | Mayor número de LIE en yeyuno de SII vs controles 13.9±4.0 en controles. En SII los LIE tenía localización peri e intraganglionar; no se especificó SII-PI o NoPI. | 3b |
| Park et al., J Korean Med Sci, 200398 | Corea del Sur | Casos y controles | SIIRoma II vs sanos | 14 vs 14 | Ciego, recto | Mastocitos | Ciego, SII-D: 262.7±35.5/mm2 vs controles: 165.1±25.3/mm2,(p<0.05); Recto, SII-D: 184.1±27.0/mm2 vs controles: 124.6±10.7/mm2,(p<0.05); Incremento de mastocitos degranulados en proximidad con nervios entéricos; No se especificó SII-PI o No PI | 3b |
| Dunlop et al., Gastroenterology, 200399 | Gran Bretaña | Casos y controles | SII Roma I PI vs GE por Campylobacter vs Sanos | 28 vs 28 vs 34 | Recto | CEC, LIE Mastocitos | CEC/HPF, SII-PI: 35.8±1.2 vs GE: 30.6±1.9 (p=0.022) vs controles: 29.1±1.8 (p=0.006); LIE/HPF, SII-PI: 127.1±8.7 vs GE: 113.4±6.2 (p=0.006) vs controles: 97.1±5.7 (p=0.058); No diferencias en Mastocitos; CEC fueron predictoras de SII-PI | 3b |
| Dunlop et al., Am J Gastroenterol, 2003100 | Gran Bretaña | Casos y controles | SII Roma II PI Cuestionario de Spiller vs No PI vs Sanos | 23 vs 52 vs 36 | Recto | CEC, LLP, LIE, Mastocitos | CEC/HPF, SII-PI: 39.4±2.9 vs SII-No PI: 31.1±1.5 vs controles: 31.8±1.6, (p=0.012); LLP/HPF, SII-PI: 120.5±6.8 vs SII-No PI: 118.5 ±4.6 vs controles: 101.6±5.9, (p=0.042); LIE Superficie/500 cels, SII-PI: 41.4±4.3 vs SII-No PI: 32.8 ±2.7 vs controles: 43.1±3.1, (p=0.036); Mastocitos/HPF, SII-PI: 41.9±3.0 vs SII-No PI: 53.0±2.4 vs controles: 45.9±2.8, (p=0.017) | 3b |
| Barbara et al., Gastroenterology, 2004101 | Italia | Casos y controles | SIIRoma II vs sanos | 44 vs 22 | Colon descendente proximal | Mastocitos degranulados | Mastocitos, SII: 9.2±2.5 vs controles: 3.3±0.8 (p<0.001); SII mayor númeroo de mastocitos degranulados, aumento en actividad de histamina y triptasa; no se diferenció SII-PI vs SII-NoPI | 3b |
| Wang et al., World J Gastroenterol, 2004106 | China | Casos y controles | SII-D vs SII-E Roma III NoPI vs sanos | 20 vs 18 vs 20 | Duodeno, yeyuno, ileon terminal | Mastocitos, CEC | CEC, SII=controles; mastocitos/HPF en íleon terminal, SII-C: 38.7±9.4 vs SII-D: 35.8±5.5 vs controles: 29.8±4.4, (p<0.001); sin diferencias en duodeno y yeyuno | 3b |
| Ohman et al., Clin Gastroenterol Hepatol, 2005102 | Suecia | Casos y controles | SIIRoma II (SII-PI) vs CUCI vs sanos | 33 (5) vs 23 vs 15 | Colon ascendente y sigmoides | LLP, CD4, CD8 | LLP CD8 ascendente: SII: 16.9±5.9 vs CUCI; remisión: 20.4±5.1 vs CUCI; activo: 16.4±6.9 vs controles: 10.6±4.4 (SII, CUCI; remisión vs controles, p=0.01; activo vs controles p=0.05); no diferencias en sigmoides ni en CD4 en ascendente o sigmoides; no se analizó SII-PI vs NoPI | 3b |
| Tunc et al., Acta Medica, 2005103 | Turquía | Casos y controles | SII criterios no especificados vs EII vs sanos | 11 vs 5 vs 5 | Ciego | Mastocitos | SII: 39.3±11.2 vs EII: 22.2±4.2 (p<0.01) vs controles: 13.2±1.9 (p<0.001); no se especificó SII-PI o NoPI | 3b |
| Park et al., Gastroenterol Hepatol, 2006104 | Corea del Sur | Casos y controles | SII-DRoma II NoPI vs sanos | 18 vs 15 | Íleon terminal, colon ascendente, recto | Mastocitos | Íleon terminal, SII: 49.1±7.4 vs controles: 37.9±5.8 (p<0.01); colon ascendente, SII: 47.7±7.1 vs controles: 37.4 ±6.2 (p<0.01); recto, SII: 47.8±7.6 vs controles: 37.3±6.0 (p<0.01) | 3b |
| Guilarte et al., Gut, 2007105 | España | Casos y controles | SII-DRoma II (SII-PI) vs sanos | 20 (6) vs 14 | Yeyuno | LIE, mastocitos | LIE CD3+ SII-D: 15.3±5.5 (IC95% 12.7-17.9) vs controles: 10.3±3.9 (IC95% 8.0-12.5) (p=0.006); mastocitos/HPF, SII-D: 34±9.3 vs controles: 15.3±4.4, p<0.001; mayores niveles de triptasa; mastocitos, SII-PI: 32.3±5.9 (IC95% 26.0-38.5) vs SII-NoPI: 34.7±10.2 (IC95% 28.8-0.6) (p=NS) | 3b |
| Piche et al., Gut, 2008107 | Francia | Casos y controles | SIIRoma II NoPI vs sanos vs depresión/fatiga | 50 vs 21 vs 11 | Ciego | Celularidad, LIE, mastocitos | Celularidad/HPF, SII: 94.5 (IC95% 48-110) vs controles: 68 (IC95% 58-82) (p=0.005), vs depresión: 78 (IC95% 87-90) (p=0.05); mastocitos, SII: 9.3 (IC95% 5.6-11.7) vs controles: 4.0 (2.7-6.8), (p=0.001) vs depresión: 4.3 (IC95% 2.8-7.8) (p=0.005) | 3b |
| Lee et al., Gastroenterol Hepatol, 2008108 | Corea del Sur | Casos y controles | Roma III (SII-PI) vs sanos | 42 (5) vs 12 | Recto | CEC, mastocitos, LLP | CEC/HPF, SII: 10.9±4.5 vs SII-PI: 16.8±0.8 vs SII-NoPI: 10.1±4.1 vs controles: 8.0±3.9 (SII vs controles p<0.05, SII-PI vs controles p<0.01); mastocitos/HPF, SII: 8.6±2.6 vs SII-PI: 10.6±3.8 vs SII-NoPI: 8.3±2.8 vs controles: 6.8±2.0, (todos vs controles p≤0.05); LLP/HPF, SII: 34.0±12.2 vs SII-PI: 43.4±8.7 vs SII-NoPI: 32.7±12.2 vs controles: 30.2±12.6 (SII-PI vs controles p<0.05); mastocitos, SII-D NoPI: 8.8±2.2 vs controles: 6.8±2.0; p<0.05) | 3b |
| Cremon et al., Am J Gastroenterol, 2009113 | Italia | Casos y controles | SII Roma II vs Sanos | 25 vs 12 | Colon | CEC (5-HT+), mastocitos | CEC, mayor área del epitelio de las criptas ocupada por estas en SII: 0.56±0.26% vs controles: 0.37±0.16%, (p=0.039), y mayor en SII-D: 0.69±0.24% vs SII-E: 0.44±0.22%, (p=0.34); mastocitos, mayor área de la lámina propia ocupada por estas en SII: 9.8±2.9% vs 4.5±2.8% (p<0.01), sin diferencias en SII-D vs SII-E; no se especificó SII-PI vs SII-NoPI | 3b |
| Bhuiyan et al., Mymensingh Med J, 2010110 | Bangladesh | Casos y controles | SII Roma II PI vs SII-NoPI vs sanos | 18 vs 32 vs 10 | Sigmoides | LIE, mastocitos | LIE: SII>controles (p<0.001), folículos linfoides: SII>controles (p<0.05); mastocitos: SII>controles (p<0.05) y en SII-PI vs SII-NoPI (p<0.001) | 3b |
| Kim et al., Yonsei Med J, 2010111 | Corea del Sur | Casos y controles | SII-PI post Shigellosis vs SII-NoPI vs SII-D Roma II vs sanos | 4 vs 7 vs 7 vs 10 | Colon descendente, sigmoides, recto | CEC, LIE, LLP, mastocitos | LIE/HPF, sigmoides, SII-PI: 13.41±5.57 vs SII-NoPI: 7.22±1.20 vs SII: 11.491.31 vs controles: 5.91±0.82, (p=0.024); recto, SII-PI: 11.40±4.17 vs SII-NoPI: 5.83±0.73 vs SII: 8.19±0.73 vs controles: 4.77±0.85 (p=0.033); CD3, descendente, SII-PI: 30.4±3.09 vs SII-NoPI: 25.97±4.57 vs SII: 25.90±3.77 vs controles: 17.69±5.82, (p=0.024); sigmoides, SII-PI: 29.80± 7.37 vs SII-NoPI: 24.09±3.07 vs SII: 25.51±3.20 vs controles: 13.82±2.83, (p= 0.039); recto: SII-PI: 25.0±2.96 v SII-NoPI: 25.31±3.57 vs SII: 20.67±1.29 vs controles: 14.89±1.53 (p=0.013); CD8/HPF, descendente, SII-PI: 69.00±10.87* vs SII-NoPI: 36.11±3.91 vs SII: 35.00±5.37 vs controles 32.56±18.57 (p=0.031) (*SII-PI vs SII-NoPI, p<0.05). Mastocitos, sin diferencias, solo en descendente SII-PI: 105.3±13.3 vs SII-NoPI: 52.8±13.44 (p<0.05) | 3b |
| Goral et al., Hepatogastroenterology, 2010112 | Turquía | Casos y controles | SII-E, SII-D, Roma III vs Sanos | 32, 40 vs 50 | Recto | Mastocitos | Mastocitos presentes en pacientes con SII-D: 77.5% vs SII-E: 59.4% vs controles: 56.0% (p<0.0001); no se especificó SII-PI vs SII-NoPI | 3b |
| Arévalo et al., Rev Gastroenterol Perú, 2011114 | Perú | Casos y controles | SII Roma III vs sanos | 16 vs 9 | Colon ascendente, descendente | LIE, mastocitos, eosinófilos CEC | LIE/100 células epiteliales, SII: 9.81 vs controles: 4.66 (p=0.002); sin diferencias en mastocitos, eosinófilos y CEC, o ente SII-D vs SII-E; no se especificó SII-PI vs SII-NoPI | 3b |
| Braak et al., Am J Gastroenterol, 2012115 | Holanda | Casos y controles | SII Roma II (SII-PI) vs sanos | 66 (9) vs 20 | Descendente, sigmoides | Mastocitos, linfocitos T | Descendente LT-CD3, SII: 493±34 vs controles: 587±66, (p=NS); LT-CD8, SII: 388±28 vs controles: 526±50 (p=0.02); mastocitos, SII: 370±39 vs controles: 186±10 (p<0.001); macrófagos, SII: 729±64 vs controles: 1,261±146 (p<0.003); ascendente, sin diferencias; no se analizó SII-PI vs SII-NoPI solo que SII de aparición aguda <macrófagos vs SII aparición gradual, (p=0.02) | 3b |
| Chang et al., Am J Gastroenterol, 2012116 | EE.UU. | Casos y controles | SIIRoma II NoPI vs sanos | 45 vs 41 | Sigmoides | Células inmunes | Linfocitos CD3, CD4, CD8, CEC, CEE, mastocitos, SII=controles (p=0.059-0.892) | 3b |
Los estudios están organizados de mayor a menor nivel de evidencia, y dentro de las mismas en orden progresivo de año de publicación. En los casos de revisiones sistemáticas, el país corresponde al de los autores que realizaron dicho trabajo. En las columnas de grupos de estudio/criterios diagnósticos y n, lo que se encuentra entre paréntesis corresponde a un subgrupo de aquellos con SII.
CEC: células enterocromafines; CUCI: colitis ulcerativa crónica idiopática; D: diarrea; DF: dispepsia funcional; DTNC: dolor torácico no cardiaco; E: estreñimiento; EAC: estudio aleatorizado controlado; EC: enfermedad celíaca; EII: enfermedad inflamatoria intestinal; GE: gastroenteritis; HPF: campo de alta potencia; LIE: linfocitos intraepiteliales; LLP: linfocitos en lámina propia; N: número; NE: nivel de evidencia; No-PI: no postinfeccioso; PI: postinfeccioso; SII: síndrome de intestino irritable.
Lo que se encuentra entre paréntesis corresponde a subgrupos que fueron analizados.
Desde hace varios años se ha reportado el incremento en el número de células enterocromafines en biopsias rectales de pacientes SII-PI99,100,106. Spiller et al.95 reportaron un incremento hasta de 5 veces en el número de células enterocromafines positivas a sinaptofisina en pacientes con infección por C.jejuni. En estos pacientes se observó una disminución gradual del número de células enterocromafines en las biopsias tomadas a las 6 y 12semanas posterior a la infección, pero en el subgrupo de pacientes que permaneció sintomático, un año después de la infección aguda, es decir aquellos con SII-PI, el número de células enterocromafines permaneció elevado en rango similar a lo observado a las 2semanas postinfección con C.jejuni. El incremento en el número de células enterocromafines puede tener importancia fisiopatológica, ya que estas células constituyen la fuente principal de almacenamiento de serotonina (5-HT) en el organismo, y existe evidencia que los pacientes con SII presentan incremento en la liberación de 5-HT119,120. El efecto procinético y secretorio de la 5-HT puede estar relacionado con la presencia de diarrea o heces líquidas que acompañan al SII-D. Una reciente revisión sistemática89 concluye que, a pesar de que algunos investigadores han observado un incremento en el número de células enterocromafines y en la producción de serotonina en mucosa de colon y recto de pacientes con SII en comparación con controles sanos, muchos otros no han confirmado dichos hallazgos. Los resultados muestran que estos cambios no son consistentes.
Por otra parte, algunas investigaciones han demostrado un incremento en el número de LIE tanto en SII-D como en SII-PI, principalmente posterior a gastroenteritis aguda por Campylobacter jejuni o Shigella95,111,117. Sin embargo, se desconoce a ciencia cierta si el incremento de linfocitosT se presenta también en el SII-NoPI. De hecho, solamente 7 estudios establecen una comparación entre SII-PI y SII-NoPI con respecto a los cambios inflamatorios encontrados por histología92,94,99,100,108,110,111. Dunlop et al.99,100 encontraron mayor número de células enterocromafines y LIE en el SII-PI que en SII-NoPI y en controles en 2 estudios, de tal manera que proponen que estas pueden ser marcadores para SII-PI. De igual manera, Lee et al.108 observaron mayor número de células enterocromafines, LIE y mastocitos en biopsias rectales de pacientes con SII-PI en comparación con SII-NoPI y controles sanos. En SII-NoPI observaron incremento en el número de mastocitos solamente en aquellos con SII-D, mas no en los pacientes con SII-E o SII-M. El incremento en mastocitos había sido descrito previamente por Weston et al.93 en biopsias de íleon terminal de pacientes con SII comparado con el grupo control; sin embargo, no se hacía la diferenciación entre SII-PI y SII-NoPI. Otros investigadores confirmaron posteriormente el incremento de estas células en SII96,98,101,106, principalmente en el subgrupo con SII-D, tanto en aquellos con SII-PI como en SII-NoPI. Además, los mastocitos95,96,98,101,106 parecen estar en proximidad con las neuronas sensoriales, y una menor distancia entre ambos se correlaciona positivamente con la gravedad y la frecuencia del dolor y/o malestar abdominal101.
En contraste, Braak et al.115 reportaron disminución en la cuenta de LIE, macrófagos y mastocitos en mucosa colónica de 66 pacientes con SII comparado con 20 controles sanos. En dicho estudio no se analizó específicamente la diferencia entre SII-PI y SII-NoPI pero sí el SII de aparición aguda, que presentaron menor número de macrófagos en comparación con aquellos con SII de aparición global115. Es probable que el grupo de aparición aguda corresponda a SII-PI, pero no lo podemos concluir. Previamente otro estudio del mismo grupo en Holanda no solo habían encontraron menor número de mastocitos en biopsias de recto y colon descendente en SII, sino también una disminución en la liberación de triptasa, en comparación con los controles91. Finalmente, Chang et al.116 no encontraron diferencias en el número de células inmunes en mucosa colónica entre pacientes con SII-NoPI y controles.
Lo anterior sugiere que en un grupo de pacientes con SII existe un incremento en LIE, mastocitos y células enterocromafines en la mucosa intestinal, lo cual parecer ser más frecuente en aquellos con SII-D. Sin embargo, no se puede determinar si esta inflamación de bajo grado es propia del SII-PI o SII-NoPI.
5. Alteraciones en la función intestinal en el síndrome de intestino irritable, con relación a síndrome de intestino irritable-postinfeccioso, SPB y/o alteraciones de la microbiota- •
Las evidencias sugieren que las diferencias en la composición de la microbiota en sujetos con SII se relacionan con alteraciones en la sensibilidad visceral y función motora del tracto gastrointestinal (nivel de evidencia 1b, recomendación grado A).
- •
La presencia de microbiota metanogénica se asocia de forma significativa con el SII con estreñimiento (SII-E) (nivel de evidencia 3a, recomendación grado B).
En la búsqueda inicial se identificaron 8 artículos22,23,35,60,94,121-123 relacionados con la función intestinal, y 3 artículos adicionales104,124,125 se identificaron por otras fuentes (tabla 6). Las evidencias sugieren que los cambios de la microbiota en los pacientes con SII influyen sobre la sensibilidad visceral y la motilidad gastrointestinal, especialmente a nivel antroduodenal y colorrectal22,23,35,60,94,121-126. En cuanto a las alteraciones sensoriales, los estudios han mostrado que algunos pacientes con SII y disbiosis (SII-PI y SII con SPB) desarrollan hipersensibilidad rectal, uno de los hallazgos fisiopatológicos más característicos del SII94.
Alteraciones de la fisiología colónica en relación con el SII-PI, SIBO y alteraciones de la microbiota
| Autor, revista, año | País | Tipo de estudio | Criterios diagnósticos/Grupos de estudio | n | Variables de desenlace | Resultados/Conclusiones | NE |
| Kunkel et al., Dig Dis Sci, 2011124 | EE.UU. | Revisión sistemática + metaanálisis de casos y controles | SII criterios no reportados CH4+ vs CH4- | 319 vs 958 | Relación de CH4+ con estreñimiento | CH4, estreñimiento: RM 3.51 (IC95% 2.00-6.16); SII-E: RM 3.60 (IC95% 1.61-8.06) | 3a |
| Gwee et al., Gut, 199994 | Gran Bretaña | Casos y controles | SIIRoma I PI expuestos a GE vs sin SII expuestos a GE vs sanos | 94 vs 22 vs 72 | Cuestionario de síntomas, HAD, Bx de recto, distensión rectal con jeringa, tránsito colónico con marcadores radioopacos | Tránsito colónico SII-PI<sanos; hipersensibilidad e hiperreactividad rectal, SII-PI > sanos | 3b |
| Pimentel et al., Dig Dis Sci, 2002121 | EE.UU. | Casos y controles | SII Roma I + SPB vs sanos | 68 vs 30 | PAL, manometría AD | Fase III del CMM, número de eventos SII: 0.7 vs controles: 2.2, (p<0.000001); duración, SII: 305 vs controles: 428s (p<0.001) | 3b |
| Pimentel et al., Dig Dis Sci, 2003122 | EE.UU. | Casos y controles | Sujetos sometidos a prueba de aliento EII vs Roma I SII (SII-E, SII-D) | 78 vs 296 (120, 111) | PAL, cuestionario de síntomas | Metano+: > gravedad de síntomas en SII-E (p<0.05) y <SII-D (p>0.001). Metano+, SII-E: 52.3% vs SII-D: 0 (p<0.001) | 3b |
| Posserud et al., Gut, 200722 | Suecia | Casos y controles | SIIRoma II vs controles | 162 vs 26 | PAL, cultivo de aspirado duodenal, Bx duodenal, manometria AD | Dismotilidad, SII con: 86% vs sin SPB: 39% (p=0.02); N de fases iii del CMM, SPB: mediana 0.6 (rango 0-1.8) vs 1.2 (0-4)/3h, (p=0.08) | 3b |
| Grover et al., Neurogastroenterol Motil, 200823 | EE.UU. | Casos y controles | SII Roma II vs sanos | 158 vs 34 | PAS y CH4, barostato, manometría colónica (IM), IBS-QOL y IBS-SS | Los pacientes con SII tuvieron un incremento en el IM posterior a la distensión rectal comparado con CS. No hubo diferencia entre SII con SPB y SII sin SPB. Los productores de CH4 tuvieron un mayor umbral sensitivo para la urgencia para evacuar (28 vs 18mmHg, p<0.05) y mayor IM (461 vs 301.45, p<0.05) comparado con los sujetos con SII sin SPB | 3b |
| Park et al., Gut and Liver, 2009126 | Corea del Sur | Casos y controles | SIIRoma II vs sanos | 38 vs 12 | PAL, permeabilidad intestinal con PEG | Permeabilidad intestinal, SII: 0.82±0.09 vs controles: 0.41±0.05, (p<0.05); SII con: 0.90±0.13 vs sin SPB: 0.80±0.11 (p>0.05) | 3b |
| Jeffery et al., Gut, 201260 | Irlanda y Suecia | Casos y controles | SIIRoma II vs sanos | 37 vs 20 | Microbiota mediante pirosecuenciación en materia fecal, tránsito colónico con marcadores radioopacos, baróstato rectal | Microbiota y TL (phyllum: Euryarchaetoa, clase: Metanobacterias y familias Metanobacteriaceae y Desulfohalobiaceae). Relación de Firmicutes:Bacteroides con dolor y distensión rectal, SII>controles | 3b |
| Furnari et al., J Gastrointes Liv Dis, 2012125 | Italia | Casos y controles | Pacientes sometidos a GBT SII basado en síntomas vs sanos | 629 vs 40 | PAG (H2 y CH4), diario de síntomas | CH4, SII-E: 32.3% vs controles: 30% (p>0.05); estreñimiento: 27.4% vs diarrea: 17.1%, (p<0.001); producción de CH4 (ppm), EF vs controles (p=0.04), vs diarrea (p=0.002) | 3b |
| Yu et al., Gut, 201035 | Canadá | Serie de casos | SIIRoma II | 40 | PAL, tránsito orocecal con gammagrafía Tc 99 | Tránsito orocecal, SII: 7,167min (rango 10-220min); SII-E vs SII-D: >2.2 veces, (p=0.0023) | 4 |
Los estudios están organizados de mayor a menor nivel de evidencia, y dentro de las mismas en orden progresivo de año de publicación.
CH4: metano; CMM: complejo motor migratorio; CS: controles sanos; D: diarrea; E: estreñimiento; EF: estreñimiento funcional; EII: enfermedad inflamatoria intestinal; H2: hidrógeno espirado; HAD: cuestionario ansiedad y depresión hospitalaria; IBS-QOL: cuestionario de calidad de vida IBS-QOL; IBS-SS: cuestionario de severidad de SII;IC: intervalo de confianza; IM: índice de motilidad; PAG: prueba de aliento con glucosa; PAL: prueba de aliento con lactulosa; PAS: prueba de aliento con sacarosa; ppm: partes por millón; PEG: polietilenglicol; RM: razón de momios; SII: síndrome de intestino irritable; SPB: sobrepoblación bacteriana; TL: tránsito lento; TN: tránsito normal.
Por otra parte, varios estudios han descrito que los pacientes con SII-PI tienen un tránsito colónico más acelerado. Por ejemplo, Gwee et al.94 demostraron que sujetos con antecedente de gastroenteritis y SII tuvieron un tránsito colónico más acelerado que un grupo control de sujetos sanos (mediana de tránsito colónico de 34.4 vs 55.2min, p=0.01). En contraste, Yu et al.35 encontraron que el tiempo de tránsito orocecal se correlaciona con el subtipo de SII. Así pues, en pacientes con SII-E el tránsito orocecal es más prolongado que en pacientes con SII-D (p=0.0023).
Además, en pacientes con SII y evidencia de SPB se han descrito alteraciones en el número y en la frecuencia de la faseiii del complejo motor migratorio (CMM)22,23,121. Por ejemplo, Pimentel et al., en un grupo de pacientes con SII de acuerdo con los criterios de RomaI y SPB con base en la PAL positiva, demostraron que el número de eventos de la faseiii del CMM fue menor en pacientes con SII y SPB que en controles sanos (0.7 vs 2.2, p<0.001), al igual que la duración de la faseiii (305 vs 428s, p<0.001)121.
Múltiples estudios plantean que los pacientes con SII tienen cambios cualitativos en la flora colónica, y por ejemplo se describe que existen pacientes que pueden desarrollar proliferación de especies bacterianas que producen más gas, específicamente metano. La presencia de flora metanogénica en pacientes con SII se ha asociado con un tránsito colónico más lento, hiposensibilidad rectal y la presencia de alteraciones de la motilidad intestinal122-125. Recientemente, Jeffery et al.60, en un análisis de la microbiota de pacientes con SII mediante la técnica de pirosecuenciación, demostraron que 17 taxas se asociaron con un tránsito colónico lento (incluyendo las de los siguientes filotipos: Euryarchaetoa, las de la clase: Metanobacterias y las de las familias: Metanobacteriaceae y Desulfohalobiaceae). De igual forma se describe que la presencia de Proteobacterias se asocia con un incremento en el umbral del dolor durante la distensión rectal, evaluado mediante barostato. Así mismo, se han reportado la primeras evidencias en SII, de detección de niveles distintos de ácido acético, ácido propiónico y ácidos grasos totales. Los niveles más altos se asociaron al SII de peor pronóstico.
En resumen, las evidencias sugieren que cambios en la composición de la microbiota o su inestabilidad (disbiosis) influyen en la fisiología gastrointestinal produciendo anormalidades de la sensibilidad visceral y motilidad gastrointestinal. Sin embargo, se requiere de más estudios para determinar el efecto de la microbiota sobre dichas alteraciones sensitivas y motoras. Por otra parte, se desconoce si estas alteraciones contribuyen a la generación de síntomas o son consecuencia de trastornos primarios de la motilidad. Finalmente, hay que destacar que existen otros factores que influyen en la microbiota de los pacientes con SII, como el tipo de dieta (p.ej., FODMAPS: oligosacáridos, disacáridos, monosacáridos y polioles fermentables) y el uso de antibióticos.
6. Antimicrobianos en el tratamiento del síndrome de intestino irritable- •
En pacientes con SII-NoE, la rifaximina en dosis de 400mg TID por 10días o 550mg TID por 14días es superior al placebo en la respuesta adecuada de los síntomas globales del SII y en distensión abdominal. Además mejora el dolor y el malestar abdominal, así como la consistencia de las evacuaciones sueltas/líquidas durante el tratamiento y hasta por 10 semanas postratamiento (nivel de evidencia 1b, recomendación grado A).
- •
La rifaximina en dosis de 400mg TID por 7días puede negativizar la PAL en aproximadamente la mitad de los pacientes con SII, lo cual se asocia con una reducción en la severidad de los síntomas del SII (nivel de evidencia 4, recomedación grado C).
- •
La frecuencia de eventos adversos es similar entre la rifaximina y el placebo, siendo los más frecuentes: cefalea, infecciones del tracto respiratorio superior, náuseas, nasofaringitis, diarrea y dolor abdominal (nivel de evidencia 1b, recomendación grado A).
- •
En los pacientes que requieren retratamiento con rifaximina, la efectividad parece ser similar a la presentada con el primer tratamiento; sin embargo, se requieren más estudios para determinar la efectividad del retratamiento y el intervalo para realizarlo (nivel de evidencia 4, recomendación grado C).
- •
Se requieren estudios para evaluar la efectividad y la seguridad de la rifaximina a largo plazo en SII (nivel de evidencia 5, recomendación grado D).
Se identificaron 20 artículos que analizaron la antibioticoterapia en SII, 5 revisiones15,127-130 y 15 artículos originales18,33,131-143, todos estudios en adultos, excepto uno solo en población pediátrica135. Posteriormente se identificó un artículo original adicional que había sido publicado en diciembre de 201337 (tabla 7).
Antibioticoterapia en el SII
| Autor, revista, año | País | Tipo de estudios | Criterios diagnósticos/Grupos de estudio | Tratamiento dosis | n | Variables de desenlace | Resultados/Conclusiones | NE |
| Rezaie et al., Arch Med Sci, 2010127 | Irán | Revisión sistemática + metaanálisis | SII cualquier criterio | Rifa 400 mg vs Pb BID-TID × 7-10 días | 80 vs 74 | Eficacia de antibióticos en SII | Rifa superior al Pb, respuesta clínica en SII: RR=2.04 (IC95% 1.23-3.40, p=0.0061); respuesta de síntomas: RR=2.06 (IC95% 1.3-3.27, p=0.002) | 1a |
| Menees et al., Am J Gastroenterol, 201215 | EE.UU. | Revisión sistemática + metaanálisis | SII cualquier criterio | Rifa 400-550 mg vs Pb BID-TID × 10-14 días | 895 vs 908 | Eficacia y seguridad de rifa en SII | Mejoría global, rifa superior al Pb: RM=1.57, IC95%: 1.22-2.01; ganancia terapéutica: 9.8, NNT: 10.2; distensión abdominal: RM=1.55, IC95%: 1.23-1.96); ganancia terapéutica: 9.9; NNT: 10.1; eventos adversos: rifa=Pb | 1a |
| Schmulson, Chang Aliment Pharmacol Ther, 2011129 | México, EE.UU. | Revisión sistemática | Distensión abdominal, cualquier criterio | Rifa 400-550 mg vs Pb BID-TID × 7-14 días | 704 vs 708 | Efectividad en distensión abdominal | Rifa es efectiva en la mejoría de distensión abdominal en SII-NoE | 1a |
| Fumi, Trexler, Ann Pharmacol, 2008128 | EE.UU. | Revisión sistemática | SII cualquier criterio, con o sin SPB | Rifa 400 mg vs Pb BID-TID × 7-10 días | 113 vs 30 | Efectividad de rifa en síntomas del SII | Rifa mejora clínicamente a un tercio de los pacientes con SII, particularmente si tienen SPB | 2a |
| Kwon et al., Korean J Gastroenterol, 2011130 | Corea del Sur | Revisión | SIIRoma I o II | Rifa, neo, otros antibióticos, controles | 12744 61 63 | Consenso basado en evidencias y método Delphi | Un ciclo corto de antibióticos no absorbibles (rifa o neo) puede mejorar los síntomas globales del SII, en particular en SII-D | 3 |
| Scarpellini et al., Aliment Pharmacol Ther, 2007133 | Italia | RCT | SPB + SII Roma II | Rifa 400mg TID vs rifa 400-800-400mg × 7 días | 33 vs 30 | PAG | Normalización de PAG, rifa-1200: 58% vs rifa-1600: 80% (p<0.05) | 1b |
| Pimentel et al., New Eng J Med, 2011134 | EE.UU. | RCT | SII-NoE Roma II | Rifa 550 mg vs Pb, TID × 14 días, seguimiento × 10 semanas; 2 estudios | Target 1, 309 vs 314; Target 2, 315 vs 320 | % mejoría adecuada de síntomas globales en 2/4 semanas (semanas 3-6), intensidad diaria de síntomas | Mejoría adecuada, rifa: 40.7 vs Pb: 31.7, (p<0.001); distensión abdominal, rifa: 40.2 vs Pb: 30.3 (p<0.001); intensidad diaria (síntomas globales, dolor abdominal, distensión, consistencia de evacuaciones), rifa>Pb (todas significativas) | 1b |
| Pimentel et al., Am J Gastroenterol, 200318 | EE.UU. | RCT | SII Roma I | Neo 500 mg vs Pb BID × 7 días | 55 vs 56 | Mejoría >50% en puntaje compuesto (dolor, diarrea, estreñimiento), normalización del hábito intestinal | Mejoría >50%, neo: 35.0±5.0% vs Pb: 11.4±9.3% (p<0.05); hábito intestinal, neo: 40.1±5.3% vs Pb: 15.1±3.6% (p<0.001); SII + PAL, mejoría >50%, neo: 35.4±5.6% vs Pb: 3.7±10.6% (p<0.01) | 2b |
| Pimentel et al., Dig Dis Sci, 2006138 | EE.UU. | RCT | SII-ERoma I | Neo 500mg vs Pb BID × 10 días | 20 vs 19 | % de mejoría global, estreñimiento y dolor abdominal, mejoría de estreñimiento en CH4+ | Mejoría global, neo: 36.7±7.9 vs Pb: 5.0±3.2% (p<0.001); estreñimiento, neo: 32.6±9.9% vs 18.7±7.2% (p=0.26); CH4+, neo: 44.0±12.3% vs Pb: 5.0±5.1%, (p=0.05) | 2b |
| Pimentel et al., Ann Intern Med, 2006131 | EE.UU. | RCT | SIIRoma I | Rifa 400mg vs Pb TID ×10 días y seguimiento × 10 semanas | 43 vs 44 | Mejoría global, síntomas secundarios (dolor, distensión, diarrea, estreñimiento) | Mejoría global, rifa: 36.40±31.46% vs Pb: 21.00±22.08% (p<0.020); solo la distensión mejoró (p<0.010) | 2b |
| Sharara et al., Am J Gastroenterol, 2006132 | Líbano | RCT | Distensión y flatulencia -Subgrupo SII Roma II | Rifa 400mg vs Pb, BID × 10 días y seguimiento × 10 días | 37 vs 30 | Mejoría global subjetiva (dolor, distensión, número, frecuencia evacuaciones, sensación de evacuación incompleta) | A los 10 días, mejoraron con rifa: 40.5% vs Pb: 18.2% (p=0.04); a 10 días de seguimiento, mejoraron con rifa: 27.0 vs Pb: 9.1% (p=0.05) | 2b |
| Collins, Lin, J Pediatr Gastroenterol Nutr, 2011135 | EE.UU. | RCT | Niños con CAP Roma II -Subgrupo SII | Rifa 550mg vs Pb TID × 10 días y seguimiento × 2 semanas | 26 vs 15 | Síntomas (distensión, gas, evacuación incompleta, dolor, diarrea, estreñimiento, urgencia, moco, pujo, incontinencia) VAS: 0-10, PAL | Síntomas, rifa=Pb; normalización de LBT, rifa: 80% vs Pb: 86% | 2b |
| Cuoco et al., Minerva Gastroenterol Dietol, 2006136 | Italia | Serie de casos | SII síntomas y +GBT | Rifa 400mg TID × 14 días | 23 | PAG y síntomas postratamientp vs basal | PAG, normalizó en 82.6% (p<0.01); síntomas del SII desaparecieron en el 42% (p<0.05); mejoría de diarrea, meteorismo y dolor abdominal (todas: p<0.05) | 4 |
| Majewski et al., Adv Med Sci, 2007137 | EE.UU. | Serie de casos | SII Roma II y +GBT | Rifa 200mg QID × 30 días | 8 | Mejoría global (frecuencia evacuaciones, dolor, distensión, gas) y PAG | Rifa normalizó síntomas en 7 pacientes y GBT en 6 pacientes | 4 |
| Morken et al., Scand J Gastroenterol, 2009139 | Suecia | Serie de casos | SII-DRoma II posterradicación de giardias | Rifa 200mg TID × 8 días + metro 400mg BID × 10 días vs flora fecal viva instilada en duodeno | 18 vs 10 | Puntaje de síntomas (náuseas, dolor, distensión, diarrea, estreñimiento, anorexia) y H+ por PAL | Síntomas, rifa + metro: tendieron a disminuir a las 4 semanas (p=0.07); flora fecal: disminuyeron a las 7 semanas (p=0.0009) manteniéndose 12 meses después; H+, rifa: disminuyó a 90-120min, flora fecal: sin cambios, no hubo comparación entre los grupos | 4 |
| Weinstock et al., Dig Dis Sci, 2008140 | EE.UU. | Serie de casos | SII síntomas y +LBT y síndrome de piernas inquietas | Rifa 400mg, TID × 10 días. Luego tegaserod 3mg + cinc 200mg + probiótico, QD × 30 días | 13 | N con mejoría de global de síntomasy % de mejoría de síntomas individuales | Mejoría mayor del 80%: en 10 pacientes; resolución completa: en 5; dolor abdominal: 74%; diarrea: 73%; distensión: 70%; llenura posprandial: 65%; estreñimiento: 64%; flatulencia: 47% | 4 |
| Yang et al., Dig Dis Sci, 2008141 | EE.UU. | Serie de casos | SII Roma I y +LBT | Rifa 400mg TID, neo, otros: doxiciclina, augmentin | 84, 24, 61 | % de Respondedores (mejoría >50%), PAL | Rifa: 68% vs neo: 38% vs otros: 44%, (ambos: p<0.01); PAL normal fue predictor de la respuesta: 81% de respondedores, (p<0.001) | 4 |
| Peralta et al., World J Gastroenterol, 200933 | Italia | Serie de casos | SIIRoma II +LBT | Rifa 400mg TID × 7 días | 54 | Normalización de PAL (n), intensidad de síntomas (Likert 0-4) | Normalización de PAL: 52, intensidad de síntomas, PAL–: 2.3±0.6 vs 0.9±0.8 (p=0.003), PAL+: sin cambios | 4 |
| Pimentel et al., Gastroenterol Hepatol (NY), 2009142 | EE.UU. | Serie de casos | SII criterios no especificados y SPB (LBT) + resolución de síntomas | Erit 50mg, teg 2-6mg, erit seguida de teg, no-tratamiento seguido de erit o teg, QD | 42, 16, 20, 6 | Tiempo hasta recurrencia (días libres de síntomas) | Erit: 138.5±132.2 vs teg: 241.6±162.2 (p=0.004) vs no-tratamiento (p=0.08); no-tratamiento seguido erit: 41.0±44.8 vs seguido teg: 195.6±153.3, (p=0.06); erit seguida teg: extendió 105.8±73.3 a 199.7±162.9 (p=0.04) | 4 |
| Pimentel et al., Dig Dis Sci, 2011143 | EE.UU. | Serie de casos | SII-NoE criterios no especificados | Rifa dosis no especificada | 148 | N con retratamiento, % respuesta con retratamientos | 1 retratamiento: 71; 2: 48; 3: 22; 4: 7; 5: 4; mejoría con primer tratamiento: 75%; mejoría subsecuente: 75; mínimo de recurrencia: 4 meses | 4 |
| Meyrat et al., Aliment Pharmacol Ther, 201237 | Suiza | Serie de casos | Roma III | Rifa 200 mg QID × 14 días | 106 | Severidad de síntomas (Likert: 0-10) semanas 4 y 14 postratamierntp y PAL a las 4 semanas (n=64) | Síntomas 4 semanas, distensión: 5.5±2.6 vs 3.6±2.7, p<0.001; flatulencia: 5.0±2.7 vs 4.0±2.7, p=0.015; diarrea: 2.9±2.4 vs 2.0±2.4, p=0.005; dolor abdominal: 4.8±2.7 vs 3.3±2.5, p<0.001; bienestar general: 3.9±2.4 vs 2.7±2.3, p<0.001; normalización de PAL: 86% | 4 |
Los estudios están organizados de mayor a menor nivel de evidencia, y dentro de las mismas en orden progresivo de año de publicación.
BID: 2 veces al día; CAP: dolor abdominal crónico; CH4: metano; D: diarrea; Erit: eritromicina; H+: hidrógeno espirado; IC95%: intervalo de confianza del 95%; N: número; NE: nivel de evidencia; Neo: neomicina; NNT: número necesario de tratar; PAG: prueba de aliento con glucosa; PAL: prueba de aliento con lactulosa; Pb: placebo; QD: una vez al día; QID: 4 veces al día; RCT: estudio aleatorizado controlado; Rifa: rifaximina; RM: razón de momios; RR: riesgo relativo; SII: síndrome de intestino irritable; SPB: sobrepoblación bacteriana; Teg: tegaserod; TID: 3 veces al día; VAS: escala visual análoga.
Dos antibióticos han sido estudiados primordialmente en SII: rifaximina y neomicina. La rifaximina es un antibiótico semisintético, análogo de la rifamicina, diseñado para tener poca absorción gastrointestinal. Inhibe la síntesis bacteriana de RNA al unirse a la subunidad β de la RNA polimerasa dependiente del DNA bacteriano144. Tiene una absorción menor del 0.4%, lo cual lo hace casi por completo un antibiótico de acción luminal y la mayoría se excreta en la materia fecal sin cambios. Posee actividad de amplio espectro contra enteropatógenos grampositivos y gramnegativos, aerobios y anaerobios145,146, con baja probabilidad de resistencia bacteriana147,148. In vitro induce el CYP3A4 pero tiene casi nula interacción con otros medicamentos129.
En las revisiones seleccionadas15,127-131 se ha recomendado que un ciclo corto de antibióticos no absorbibles como la rifaximina puede mejorar los síntomas globales del SII131. Una revisión sistemática con solo 3 artículos originales del tratamiento con rifaximina en SII con o sin SPB concluyó que la rifaximina en dosis de 400mg BID por 7 a 10días mejora los síntomas del SII independientemente de la presencia o no de SPB129. Posteriormente, 2 revisiones sistemáticas con metaanálisis publicadas con 2años de diferencia y 10 veces más el número de pacientes tratados con rifaximina vs placebo en la segunda, concluyeron con buen nivel de evidencia que el antibiótico en dosis de 400 a 550mg de 2 a 3 veces/día fue 2 veces superior al placebo en la mejoría de los síntomas del SII15,127. Además, la rifaximina mostró una ganancia terapéutica de 9.8 sobre el placebo y un número necesario de tratar (NNT) de 10.2 para la mejoría global del SII y valores muy similares para la mejoría de la distensión abdominal15,127. Por otra parte, una revisión sistemática sobre el tratamiento de la distensión abdominal concluyó que la rifaximina fue superior al placebo en la proporción de pacientes con SII-NoE que reportaron mejoría de la distensión abdominal subjetiva129.
En cuanto a los artículos originales, estos han analizado tanto la rifaximina como la neomicina, pero también algunos otros antibióticos. Sin embargo, los estudios comprenden diferentes tipos de diseño desde estudios retrospectivos, series de casos, estudios aleatorizados controlados con placebo u otros antibióticos y diferentes dosis. Por ejemplo, en rifaximina se ha estudiado desde 200mg QID137, 400mg BID o TID por 7 a 14días, hasta 550mg TID por 14días15. Así mismo, las variables de desenlace que se estudiaron fueron muy diferentes en cada uno de los estudios desde la mejoría global del SII o mejoría de síntomas secundarios como dolor y/o distensión abdominal subjetiva, o la frecuencia y consistencia de las evacuaciones131,132,134. También se ha evaluado el efecto de la rifaximina sobre la PAG136,137 o la PAL33. Estas diferencias en los estudios dificultan el llegar a una conclusión. Sin embargo, las mejores evidencias provienen de los recientes Target 1 y 2 de Pimentel et al.134, con más de 1,200 pacientes entre los 2 estudios. En estos se demostró que la rifaximina en dosis de 550mg TID por 14días en pacientes con SII-NoE mediante los criterios de RomaII resultó en una mayor proporción con mejoría adecuada de los síntomas del SII, distensión abdominal, intensidad de síntomas diarios, dolor abdominal y consistencia de las evacuaciones134. En el seguimiento a 10semanas postratamiento, la mejoría adecuada definida como el reporte subjetivo de mejoría de los síntomas en al menos una de cada 2 semanas, la rifaximina se mantuvo significativamente superior al placebo. Es de notar que previamente se había reportado que en dosis menores, como 400mg BID o TID por 10días, también la rifaximina es superior al placebo en el porcentaje de pacientes que presenta mejoría global del SII131,132. En cuanto a los efectos secundarios, en el Target 1 y 2, que son los estudios más grandes, se encontraron en frecuencia similar al placebo (1.6% con rifaximina y 2.4% con placebo), siendo en orden de frecuencia la cefalea, seguida de infecciones del tracto respiratorio, dolor abdominal, náuseas y diarrea, principalmente134.
Por otra parte, la rifaximina puede negativizar la PAL en el 52% de los pacientes con SII-RomaII, y en este subgrupo mejoró la intensidad de los síntomas, pero dicho estudio no fue controlado33, como no lo fueron los que evaluaron el efecto sobre la PAG136,137. En cuanto al efecto en niños, 550mg TID por 10días no mostró diferencias con el placebo ni en la normalización de la PAL la cual solo se logró en el 20%135. Lo anterior sugiere que los niños requieren probablemente dosis más altas o diferente tipo de antibiótico probablemente por una microbiota más resistente. En cuanto al retratamiento con rifaximina, solo un estudio retrospectivo analizó esta modalidad, encontrando pacientes tratados hasta 5 veces con intervalos medios de recurrencia de síntomas de 4meses143. La efectividad fue del 75% similar a la encontrada con el primer tratamiento. Sin embargo, se requieren estudios bien diseñados para determinar cada cuánto se puede repetir la rifaximina143. Finalmente, no existen estudios que hayan evaluado el efecto a largo plazo de la rifaximina en SII.
En cuanto a la neomicina, es un aminoglucósido sistémico que ha sido evaluada en 2 estudios originales en SII18,138, ambos aleatorizados, controlados con placebo. En dosis de 500mg BID por 7 a 10días en pacientes con SII en general en uno y SII-E por criterios de RomaI, la neomicina fue superior al placebo en el porcentaje que reportó mejoría de la calificación compuesta de síntomas, incluyendo dolor abdominal, diarrea, distensión y hábito intestinal, principalmente en aquellos con PAL positiva18. La neomicina solo normalizó la PAL en el 20% de los pacientes. Sin embargo, en los pacientes positivos a metano el porcentaje que reportó mejoría del estreñimiento fue 9 veces mayor con neomicina que con placebo138. A pesar de lo anterior, las características de la neomicina lo hacen un antibiótico no ideal para el SII, debido a su absorción sistémica y su espectro de seguridad.
En cuanto a otros antibióticos, la rifaximina ha sido comparada en un estudio retrospectivo contra neomicina, doxiciclina y amoxicilina-ácido clavulánico, que fueron utilizados en el manejo del tratamiento y retratamiento de SPB en pacientes con SII141. Sin embargo, la efectividad de estos agentes fue menor que la de rifaximina. La eritromicina también ha sido estudiada para evaluar el número de días hasta la recurrencia de síntomas del SII luego de la negativización de la PAL, pero mostró ser mucho menos efectiva que el tegaserod142. Finalmente, la rifaximina, junto con el metronidazol, se ha evaluado en el SII postgiardiasis, pero no se puede llegar a ninguna conclusión de este estudio139.
FinanciaciónLas reuniones que se llevaron a cabo para la realización de este documento, el transporte y el hospedaje fueron posibles gracias al apoyo económico de Alfa-Wasserman. Todos los autores recibieron un honorario por su participación.
Conflictos de interesesMax Schmulson ha sido consultante para Procter and Gamble, Novartis, Schering-Plough, Alfa-Wasserman, Janssen, Nestle Ltd y Almirall. Ha sido ponente para Takeda México SA de CV, Schering-Plough, Mayoli-Spindler, Alfa-Wasserman, Janssen y Novartis. Ha recibido fondos de investigación de Takeda México SA de CV y Nestlé Ltd.
María Victoria Bielsa ha sido consultante de Alfa-Wasserman, Takeda México SA de CV y Astra Zeneca. Ha sido ponente para Takeda México SA de CV, GlaxoSmithKline México, Mayoli-Spindler y Alfa-Wasserman.
Ramón Carmona-Sánchez es miembro del Consejo Asesor de Takeda Pharmaceuticals, Alfa-Wasserman y Mayoly-Spindler. Ponente para Nycomed-Takeda, Mayoly-Spindler, Asofarma y Janssen-Cilag.
Angélica Hernández ha sido consultante para Alfa-Wasserman, Astra Zeneca y ponente para Astra Zeneca, Menarini, Boston Scientific, Olympus y Ferring.
Aurelio López-Colombo ha sido consultante para Novartis y ponente para Takeda, Alfa Wasserman, Janssen y Novartis.
Yolanda López-Vidal ha sido consultante para Alfa Wasserman, ha recibido fondos de investigación y ha sido ponente de Nestlé Ltd.
Mario Peláez-Luna no tiene conflictos de intereses que declarar.
José María Remes Troche es miembro del Consejo Asesor de Takeda Pharmaceuticals, Alfa-Wasserman, Almirall y Janssen. Ponente para Nycomed-Takeda, Advance Medical, Endomedica, Astra-Zeneca y Bristol-Myers-Squibb. Apoyo para la Investigación por parte de Sanofi-Pasteur, Asofarma y Astra Zeneca.
José Luis Tamayo es miembro del Consejo Asesor de Alfa-Wasserman, Malloly-Spindler y Takeda. Ha sido ponente para Astra Zeneca, Malloly-Spindler, Janssen y Takeda Pharmaceuticals.
Miguel A. Valdovinos ha sido miembro de los Consejos Consultivos de Takeda, Malloly-Spindler, Almirall, Sanofi, Danone. Ha sido ponente para Takeda, Almirall, Merck, Almirall, Ferrer, Janssen, Endomédica, Novartis, Danone, y ha recibido fondos de investigación de Endostim Inc, Ferrer y Danone.
A Lenin Mejía-López por su ayuda en la contabilización de las referencias seleccionadas para la revisión. A la Ingeniera Angélica L. Serrano Ahumada, del Departamento de Medicina Experimental de la Facultad de Medicina de la UNAM, por su invaluable ayuda en la edición de este manuscrito.