Helicobacter pylori (Hp) es reconocido como carcinógeno tipo 1 para cáncer gástrico, ya que se asocia a lesiones preneoplásicas (atrofia y metaplasia intestinal (MI)), y su relación con el p53, quien interviene en el ciclo celular, ha tenido resultados contradictorios.
ObjetivosAnalizar la expresión del p53 en la mucosa gástrica y su relación con la infección por Hp.
MétodosEstudio prospectivo, transversal y observacional, de 3 meses de duración. A pacientes sin evidencia de afección aguda o clínicamente significativa del Hospital Juárez de México se les tomó una biopsia según el sistema de Sydney y se realizó el estudio histopatológico en Hospital Español de México.
ResultadosLa prevalencia del Hp fue del 32,7% en 104 pacientes. Ningún caso de atrofia ni displasia. El 91% de los infectados tuvieron p53+. De los no infectados, el 14% presenta p53+; el 60% de estos tienen MI. De los pacientes con MI, el 75% presentó p53+. De los pacientes sin MI, el 31% presentó p53+; en el 85% se encontró Hp+. Se encontró asociación entre Hp y p53 (p<0.0001) y entre p53 y MI (p<0.0006).
ConclusionesSe demuestra asociación significativa entre Hp y la expresión de p53, incluso en pacientes con lesiones preneoplásicas y ya sin la presencia del Hp. Ya que la identificación de lesiones preneoplásicas es importante para la prevención del cáncer; la toma de biopsias rutinarias durante la endoscopia para la detección de Hp podría verse beneficiada de la inmunohistoquímica, identificando a pacientes con expresión de p53, un importante oncogén regulador.
Helicobacter pylori (Hp) is recognized as a type 1 carcinogen for gastric cancer associated with pre-neoplastic lesions (atrophy and intestinal metaplasia [IM]). Its relation with p53, which intervenes in the cell cycle, has had contradictory results.
AimsTo analyze p53 expression in gastric mucosa and its relation with Hp infection.
MethodsA 3-month prospective, observational, cross-sectional study was conducted. Patients that had no evidence of acute or clinically significant gastric pathology had biopsies taken according to the Sydney system at the Hospital Juárez de México and the histopathologic studies were done at the Hospital Español de México.
ResultsHp prevalence was 32.7% in 104 patients. There were no cases of atrophy or dysplasia. A total of 91% of the infected patients were positive for p53. Of the non-infected patients, 14% were positive for p53 and 60% of them had IM. Of the IM patients, 75% presented with positive p53. Of the patients without IM, 31 presented with positive p53, and Hp was positive in 85% of them. There was association between Hp and p53 and between p53 and IM (P<.0001 and P<.0006, respectively).
ConclusionsSignificant association was shown between Hp and p53 expression, even in patients with pre-neoplastic lesions that no longer presented with Hp. Given that the identification of pre-neoplastic lesions is important for the prevention of cancer, immunohistochemistry could benefit routine biopsy carried out during endoscopy for the detection of Hp, by identifying patients with expression of the important oncogene regulator, p53.
La gastritis se define como una respuesta inflamatoria de la mucosa gástrica hacia un estímulo nocivo, siendo un problema a nivel mundial de magnitud considerable. Con el uso de la endoscopia y la posibilidad de tomar biopsias de manera dirigida, se incrementó su prevalencia mundial. La infección por Helicobacter pylori (Hp) es la mayor causa de inflamación crónica de la mucosa antral gástrica humana.
El desarrollo de atrofia se debe a la desaparición de glándulas y su último estadio es la gastritis crónica (GC) atrófica1. La GC antral con o sin atrofia claramente se relaciona con la presencia de Hp. En cambio, si la GC se presenta exclusivamente en el cuerpo es poco probable que se deba a la presencia de Hp1, ya que el microorganismo disminuye su presencia de manera paralela al desarrollo de la atrofia de la mucosa1. Las poblaciones con una alta prevalencia de GC muestran una edad de infección por Hp más temprana1,2. Algunas áreas del estómago, como la curvatura menor y la incisura angularis, son más propensas al desarrollo de la misma1,2 y de la metaplasia intestinal (MI), así como la zona prepilórica es la mejor para la detección del Hp.
Existen múltiples clasificaciones de la gastritis; cada una de ellas utiliza sus propios términos, lo cual produjo dificultad y confusión para referirse al mismo tipo de gastritis, por lo que en 1990 se creó el sistema Sydney (SS) para contar con una sola clasificación. Un apartado de especial importancia para el presente trabajo es el de las especificaciones de las biopsias, donde se menciona que se deben tomar un mínimo de 2 biopsias por cada sitio, además de todas las lesiones sospechosas identificadas, tomando biopsias de la pared anterior y posterior, del antro entre 2 y 5cm del píloro y del cuerpo gástrico a unos 10cm del cardias. El SS fue revaluado en Houston en 1994 y, entre otras cosas, se concluyó que las biopsias del cuerpo son particularmente útiles, ya que es ahí donde se localiza el Hp después de que se han utilizado inhibidores de la bomba de protones. Sin embargo, el grado máximo de atrofia y MI es encontrado en la incisura angularis, y también es el sitio de mayor prevalencia de displasia. Es por eso que se propone que el quinto lugar de biopsias que se incluya en el protocolo debe ser la incisura angularis2.
La infección ocurre en el antro al menos en un 85% de los casos, pero hasta un 15% solamente infectará al cuerpo, lo cual es la razón de la toma de biopsias propuesta por el SS1,2.
Las tinciones de rutina que deben ser utilizadas son hematoxilina/eosina (H/E), de Giemsa y tinción de ácido peryódico de Schift/azul alciano (PAS/AA), cada una necesaria para valorar el SS como está descrito2.
Para valorar la presencia de Hp cuando se encuentra MI, se debe evaluar en otras muestras donde no exista MI, ya que el Hp no coloniza esta mucosa2. La MI se reconoce morfológicamente y se ha logrado subclasificarla en completa e incompleta2, siendo que el tipo completo tiene bajo riesgo de progresión a cáncer gástrico (CG) y el tipo incompleto tiene mayor riesgo.
El Hp es una bacteria grammnegativa que coloniza el estómago humano; es causante de la gastritis antral y representa la principal causa de úlcera péptica, linfoma gástrico y adenocarcinoma3. El Hp coloniza el estómago desde la infancia y persiste a lo largo de la vida si no se le da tratamiento. Su forma espiral y con flagelos le permite atravesar la barrera de moco de la mucosa y unirse a las células3. Cabe mencionar que evade la respuesta inmunitaria del huésped, pero a pesar de ello logra despertar una reacción que produce inflamación en la mucosa gástrica, induciendo así la gastritis3.
El Hp posee factores genéticos cuyas funciones e interacciones con el huésped es importante destacar:
- –
Uno de ellos, el CagA, puede estar presente, ausente o ser no funcional; lo más común es que se encuentre presente y funcional3,4. Al menos el 60% de las cepas aisladas en EE. UU. son de este tipo y en otros países llegan a ser hasta el 90%4; también se encuentra más a menudo en los pacientes que desarrollan CG4; provoca una mayor inflamación de la mucosa gástrica y niveles de proliferación de la misma. Algunos estudios han demostrado que funciona como una oncoproteína, promoviendo el crecimiento de las células epiteliales gástricas5. También induce la producción de citocinas3. Los factores de transcripción inducidos producen mutación del gen p53.
- –
La proteína vacuolizante o VacA se encuentra presente en prácticamente todos los bacilos. Es una exotoxina resistente a la degradación por la pepsina. Sus efectos se dan sobre los linfocitos T e inhibe la activación de su transcripción, lo que induce una detención del ciclo celular3: Por lo anterior, se la ha considerado también como asociado a lesiones precancerosas.
- –
Existen ocasiones en que su componente genético se modifica y se repara por sí mismo, creando cepas CagA y VacA mutantes.
La infección por Hp se asocia a alteraciones estructurales1, como lo son la pérdida de uniones intercelulares entre las células de la mucosa gástrica, la pérdida de la forma y uniformidad de las células de la mucosa, la pérdida del citoesqueleto, la pérdida del contenido de moco, la fuerte adherencia del Hp a las células epiteliales y el edema intracelular. Posterior al tratamiento, todas estas alteraciones desaparecen y la mucosa vuelve a la normalidad1.
La carcinogénesis gástrica es considerada un proceso multipasos y multifactorial que afecta a la expresión de oncogenes, genes supresores, moléculas de adhesión intercelular e inestabilidad microsatelital que producen una cadena que va desde la gastritis del cuerpo o pangastritis1-3 hasta la GC atrófica, la MI, la displasia y, finalmente, el CG3; dicha cadena puede tardar décadas. En la mayoría de los casos, la existencia de un tumor se presenta en un estómago con atrofia severa y MI. El paso crucial es la atrofia; el Hp aparenta tener el paso de inducción de la misma. Una hipótesis de cómo la atrofia evoluciona a CG es que la hipoclorhidria permite un aumento de la colonización del Hp, lo que conlleva un mayor daño al ADN3; otra teoría es que los radicales libres producidos por la respuesta inflamatoria pueden actuar como agentes cancerígenos3 y, finalmente, se ha hablado de que la hipergastrinemia produce un aumento de la proliferación celular hasta el punto en que se pierde el control de la misma3.
El Hp es el mayor factor causal identificado para el desarrollo de gastropatías como la GC, la enfermedad ulcerosa, el CG de tipo intestinal y el del linfoma tipo MALT. Solo una pequeña proporción de pacientes infectados va a desarrollar enfermedad clínica. Alrededor de 1 en 5 o 6 casos desarrollará enfermedad ulcerosa durante toda su vida y menos del 1% desarrollará CG6. Se le ha atribuido un riesgo del 50-60% de CG7 y la Agencia Internacional para la Investigación del Cáncer definió al Hp como un carcinógeno definitivo en el CG, enlistándolo en el grupo 1 de los carcinógenos reconocidos por la Organización Mundial de la Salud7,8.
La literatura ha sido inconsistente con los efectos del Hp sobre la proliferación de las células gástricas, incluso los hallazgos hasta cierto punto han sido contradictorios y hacen evidente que muchas señales y cascadas de las mismas pueden afectarse con la presencia del Hp.
Se ha demostrado ya que la erradicación del Hp conlleva a una reducción de la incidencia del CG, siempre y cuando no haya ya lesiones premalignas8.
Los resultados de los estudios indican que el Hp inhibe el ciclo celular en G1 e impide que entre a la fase S; esta inhibición se asocia a alteraciones genéticas, como la del p53, y eventualmente a la apoptosis9.
Desde 1979, el p53 ha sido llamado como un antígeno tumoral, un oncogén o un gen supresor de tumor. Se han hecho estudios de inmunohistoquímica que han encontrado un incremento de los niveles de p53 en pacientes infectados por Hp; sin embargo, en otros estudios se ha reportado que no hay diferencia ni en los niveles ni en la actividad del p53 asociado. Actualmente, se considera que es un factor de transcripción cuyo incremento en la expresión o mutación se asocia a la inhibición del ciclo celular, predominantemente con la detención en la fase G0 o G1 del ciclo celular7, impidiendo que entre a la fase S y, secundariamente, no permitiendo la reparación del genoma dañado. La inducción de la detención del ciclo y de la consiguiente apoptosis puede ser consecuencia de la activación y estabilización del p53, el mismo que inhibe la proliferación celular4.
Muchos estudios han mostrado que las lesiones precancerosas gástricas, como la atrofia o metaplasia, tienen alteraciones de la expresión del p53, las mismas que pueden ser producidas como un intento por frenar el ciclo celular de la célula dañada10, y su acumulación indica la pérdida de la función supresora. Cambios similares se han reportado en el esófago de Barrett.
El aumento de la expresión de p53 puede ser un mecanismo protector del huésped que resulta en la detención del ciclo celular para permitir la reparación del genoma. La ausencia de este mecanismo protector incrementaría el riesgo de CG en las personas infectadas. La ausencia de la activación del p53 puede reducir la sensibilidad de las células epiteliales gástricas a la apoptosis inducida por el Hp.
En el estudio de Unger et al.11, en los casos con gastritis relacionada con Hp sin presencia de MI, se halló una sobreexpresión de p53, que en los casos con MI no se encontró tan elevada. Sin embargo, en los casos sin MI el índice de apoptosis estaba incrementado, no así en el caso de los pacientes con MI, donde el índice de apoptosis se encontró sin cambios en relación con el grupo control. Se comprueba que la infección por Hp incrementa la expresión de p53 y la tasa de apoptosis, siempre que no haya MI. Lo anterior se explica porque el Hp no puede colonizar la MI, por lo que sus efectos sobre la apoptosis desaparecen, como lo haría si se erradicara.
En el estudio de Ozturk et al.12 en población pediátrica, se observaron alteraciones de p53 en el 20% de los niños con GC y la infección por Hp se encontró en el 91% de los pacientes con alteraciones del p53. Aunque la MI fue más común en los pacientes con Hp, no hubo diferencia en la expresión de p53 de acuerdo con su presencia. El estudio está acorde con la hipótesis de que el Hp asociado a la respuesta inflamatoria que produce daña el ADN en una secuencia de múltiples pasos, a la que se le agregan las mutaciones del p53 para iniciar la carcinogénesis gástrica.
Debido a que la asociación del Hp con las alteraciones del p53 aún no está clara, varios autores han investigado, concluyendo algunos que no hay relación, como en el caso de Craanen et al.13, que no encuentran alteraciones de p53 en la GC atrófica ni en la MI.
Wei et al.14 encontraron que los niveles de p53 antes de la infección por Hp son bajos o indetectables; sin embargo, al exponer las células a la infección por Hp se observó un patrón de 2 picos de los niveles de p53, uno de ellos a las 4-8h de la inoculación de Hp, disminuyendo posteriormente, pero a las 12 semanas se encontraron nuevamente elevados y se acompañaban de una intensa inflamación. Experimentalmente, se erradicó el Hp y se observó que estos 2 picos de p53 no se producían, por lo que se asume que es necesario que el Hp esté vivo para inducir los cambios. La habilidad del Hp para afectar al p53 se comprometió significativamente con la pérdida de CagA o de CagE, ya que se observó que los niveles de p53 eran mayores en las cepas CagA que en las que no lo eran. La regulación a la baja del p53 demostrada también puede ayudar con la carcinogénesis, ya que permitiría la acumulación de los cambios genéticos en las células. Los resultados del estudio también demuestran un equilibrio de los niveles de p53 en las células infectadas por Hp entre su degradación y su activación como parte de una respuesta celular para protegerse del estrés al que se está exponiendo la célula. La interacción entre estos procesos puede explicar los cambios dinámicos en los niveles de p53 durante la infección por Hp. Los autores creen que el primer pico de p53 potencialmente se relaciona con un fallo de la célula para protegerse; la disminución de los niveles serían parte de una adaptación de las células a la infección y, finalmente, el segundo pico se puede deber a un daño prematuro del ADN asociado a la misma inflamación y que desencadena la apoptosis y los cambios en el ciclo celular.
Shibata et al.15 investigaron la prevalencia de mutaciones del p53 en diferentes localizaciones de CG. Los tumores asociados a la cepa CagA presentaron una mayor prevalencia de mutaciones del p53; dichas mutaciones fueron más frecuentes en el sexo masculino y con predominio en el subtipo intestinal del adenocarcinoma.
Según el estudio de Ahmed et al.7, las células cultivadas con Hp se encuentran en fase G1 del ciclo celular, observando la sobreexpresión de p53, siendo lo contrario en las células cultivadas sin Hp. Los resultados sugieren que la detención del ciclo celular en G1 se asocia a una reducción de los niveles de ciclina E, con un aumento de la expresión de p53 y de p21. La presencia de la cepa CagA no modificó los resultados.
Como se ha visto, el Hp es un agente que puede inducir estrés celular, reducir la habilidad de reparar células dañadas e incrementar cambios en el genoma que conllevan a inestabilidad genética y finalmente a CG. No está claro cómo los factores bacterianos inducen la apoptosis. Los productos bacterianos han sido relacionados con la producción de gastritis y apoptosis; se cree que es la combinación de los mismos, junto con la respuesta inmunitaria del huésped, la responsable de las consecuencias.
El Hp puede alterar el ciclo en varios pasos y por varias maneras. La apoptosis es un componente normal del ciclo celular, pero los efectos del Hp no son uniformes en toda la mucosa gástrica. Las cepas específicas de Hp pueden contribuir a esta heterogeneidad de resultados.
Es particularmente importante reconocer y definir las características de las lesiones benignas de las premalignas. No es posible concluir en el momento actual si la expresión del p53 es producida por una reacción inflamatoria o perdurará en el tiempo como parte de la cadena de la carcinogénesis.
ObjetivoAnalizar la expresión del gen p53 en un muestreo de mucosa gástrica y su relación con la presencia de Hp.
MétodosSe trata de un estudio prospectivo, transversal, comparativo y observacional de 13 semanas de duración.
Los pacientes enviados a la realización de una endoscopia alta al Servicio de Endoscopia del Hospital Juárez se sometían a los criterios de inclusión (mayores de 18 años, ambos sexos, que se sometan a una endoscopia alta y firmen el consentimiento informado; cuya indicación sea enfermedad por reflujo gastroesofágico, enfermedad ácido péptica, dispepsia, disfagia o escrutinio de CG) y a los criterios de exclusión (pacientes con antecedente de CG, con hemorragia activa, con hipertensión portal, que no cooperen durante el estudio para la toma de biopsias, que no autoricen la toma de biopsias o con gastropatía de otra etiología que amerite la toma de biopsia de manera rutinaria), se les tomaron los datos clínico-demográficos y las biopsias, siguiendo lo establecido por el SS. Las biopsias se etiquetaron y se transportaron al Servicio de Patología e Inmunohistoquímica del Hospital Español, donde fueron procesadas y sometidas a las tinciones: H/E, PAS/AA, de Giemsa e inmunohistoquímica para p53. Las 2 patólogas participantes del protocolo no tuvieron acceso a los datos clínico-demográficos.
Definición de variablesExpresión de p53: se midió por inmunohistoquímica la coloración café en el núcleo celular y se expresó como positiva (presente) o negativa (ausente). Presencia de Hp: se midió con la tinción de Giemsa y se expresó como positiva o negativa. Presencia de MI: se midió con las tinciones de H/E y PAS/AA, se expresó como positiva o negativa. Se especifica si es de tipo completo o incompleto.
Análisis estadísticoCálculo del tamaño de la muestra: este es el primer estudio en México que relaciona la expresión de p53 en los pacientes infectados por Hp, por lo tanto, no hay información previa y, debido a los resultados contradictorios en los estudios revisados en la literatura, una diferencia de proporción con un Δ de 0.4 fue considerada para obtener un error tipo α de 0.5 y un error tipo β de 0.2; fue calculado un total de 50 pacientes.
Para variables nominales se utilizó la prueba exacta de Fisher, con significación estadística de p<0.05.
ResultadosSe incluyó a 104 pacientes en el tiempo de estudio que cumplieron los criterios de inclusión del protocolo.
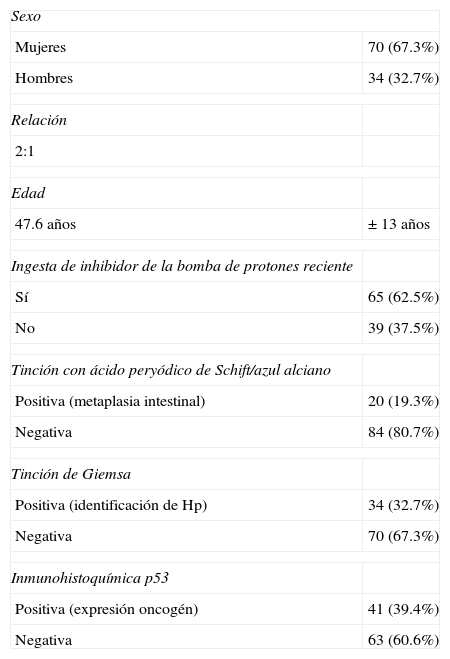
De estos, fueron 70 (67.3%) pacientes del sexo femenino y 34 (32.7%) pacientes del sexo masculino, con una relación de 2:1. La edad promedio ± desviación estándar fue de 47.6 ± 13 años, con un rango de 18 a 80 años. Los resultados generales se resumen en la tabla 1.
Características clínico-patológicas (n=104)
| Sexo | |
| Mujeres | 70 (67.3%) |
| Hombres | 34 (32.7%) |
| Relación | |
| 2:1 | |
| Edad | |
| 47.6 años | ± 13 años |
| Ingesta de inhibidor de la bomba de protones reciente | |
| Sí | 65 (62.5%) |
| No | 39 (37.5%) |
| Tinción con ácido peryódico de Schift/azul alciano | |
| Positiva (metaplasia intestinal) | 20 (19.3%) |
| Negativa | 84 (80.7%) |
| Tinción de Giemsa | |
| Positiva (identificación de Hp) | 34 (32.7%) |
| Negativa | 70 (67.3%) |
| Inmunohistoquímica p53 | |
| Positiva (expresión oncogén) | 41 (39.4%) |
| Negativa | 63 (60.6%) |
En ningún caso se encontró la presencia de atrofia de la mucosa gástrica ni evidencia de displasia, y todos los casos de MI se clasificaron como de tipo completo.
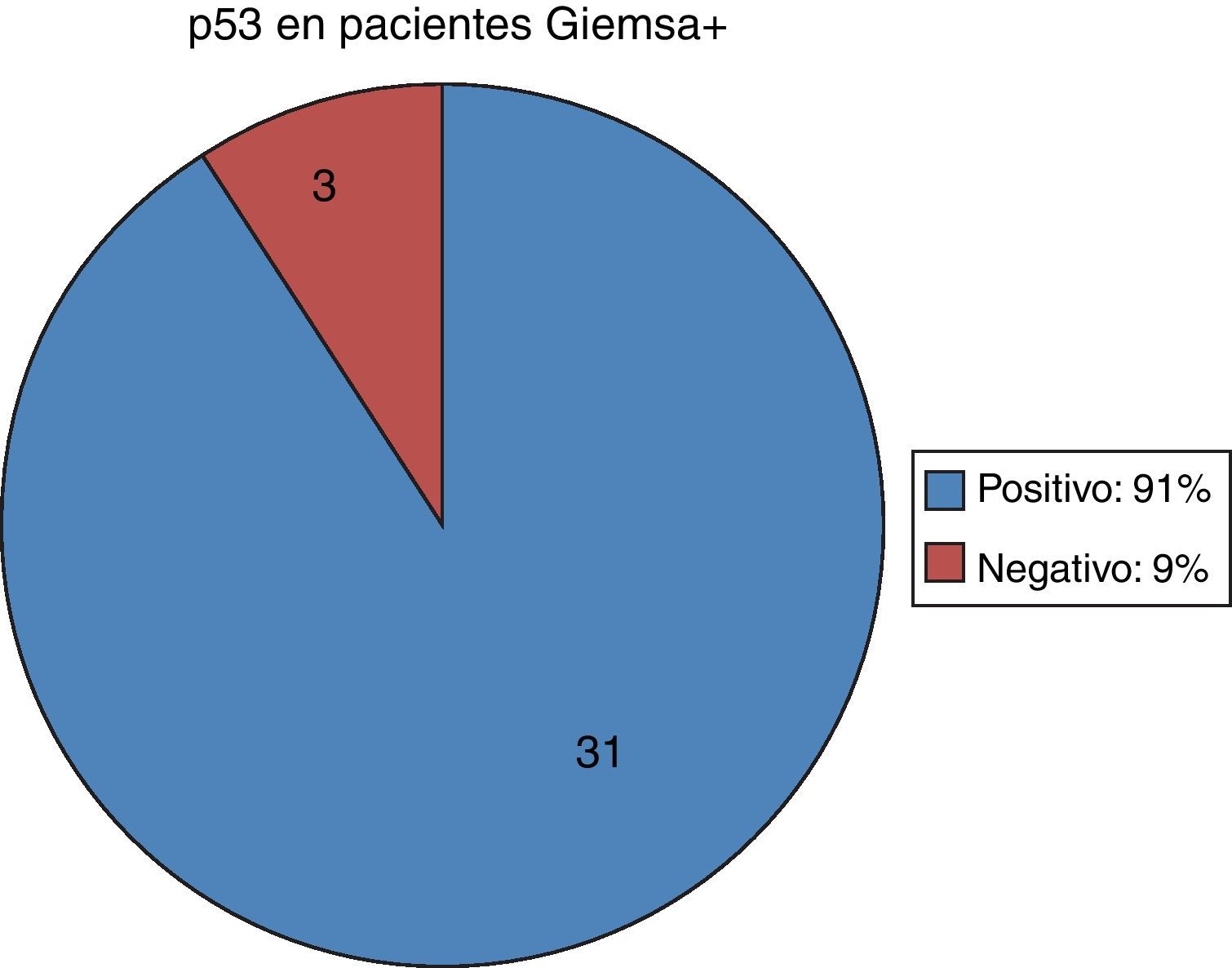
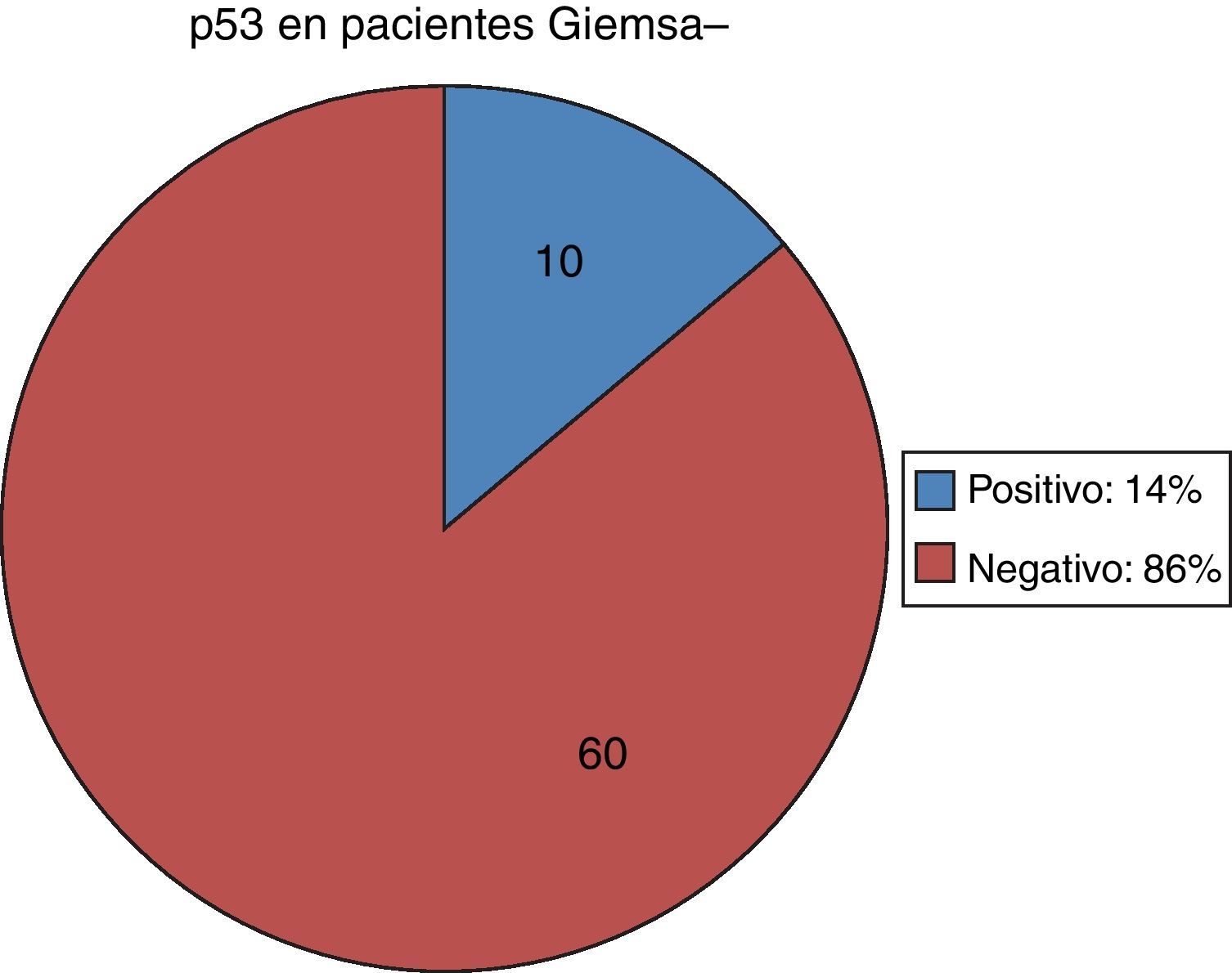
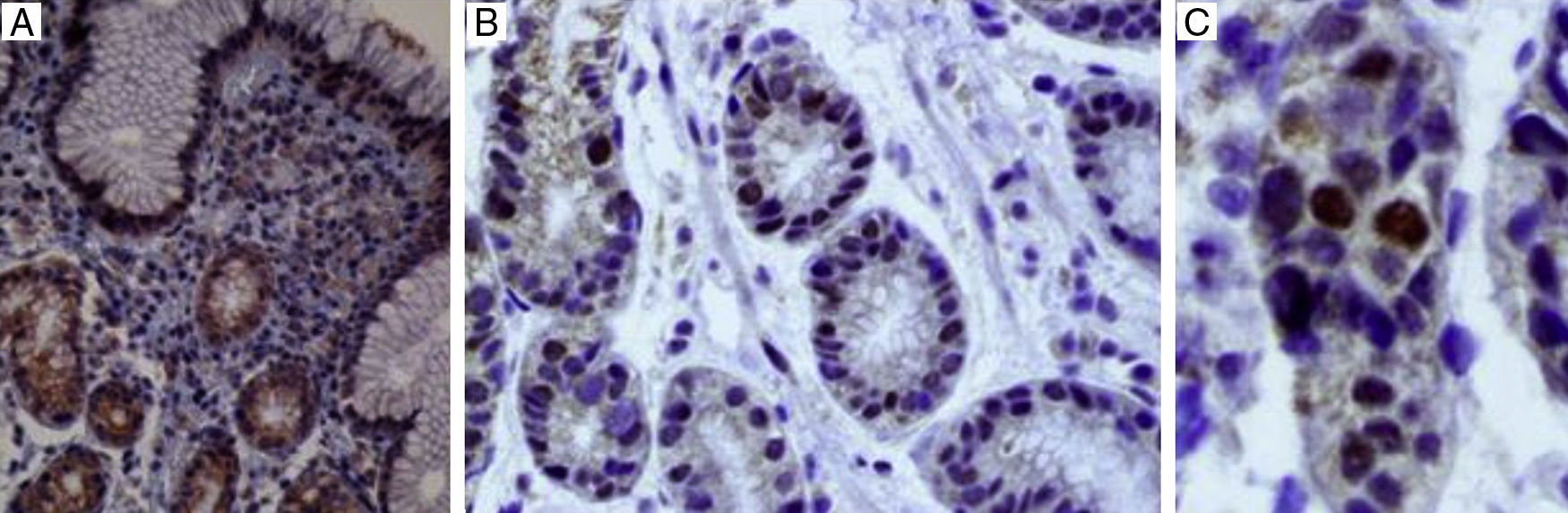
De los 34 pacientes positivos para la infección por Hp con la tinción de Giemsa, 31 (91%) resultaron positivos también con la inmunohistoquímica para p53 y solamente 3 (9%) tuvieron resultados negativos para p53 (fig. 1). De los 70 pacientes negativos en la tinción de Giemsa, 10 (14%) tuvieron p53 positivo y en 60 (86%) se encontró el p53 negativo (fig. 2).
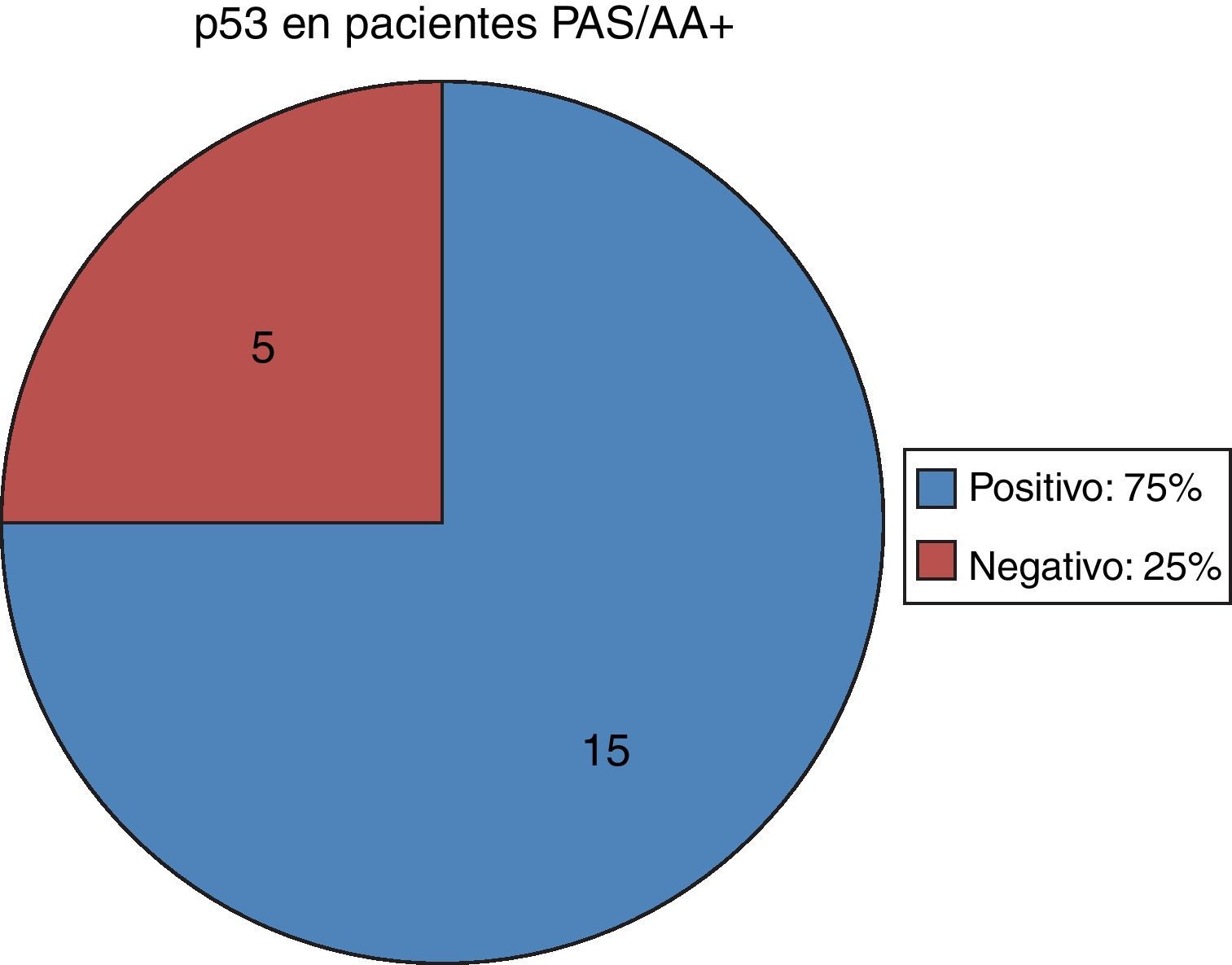
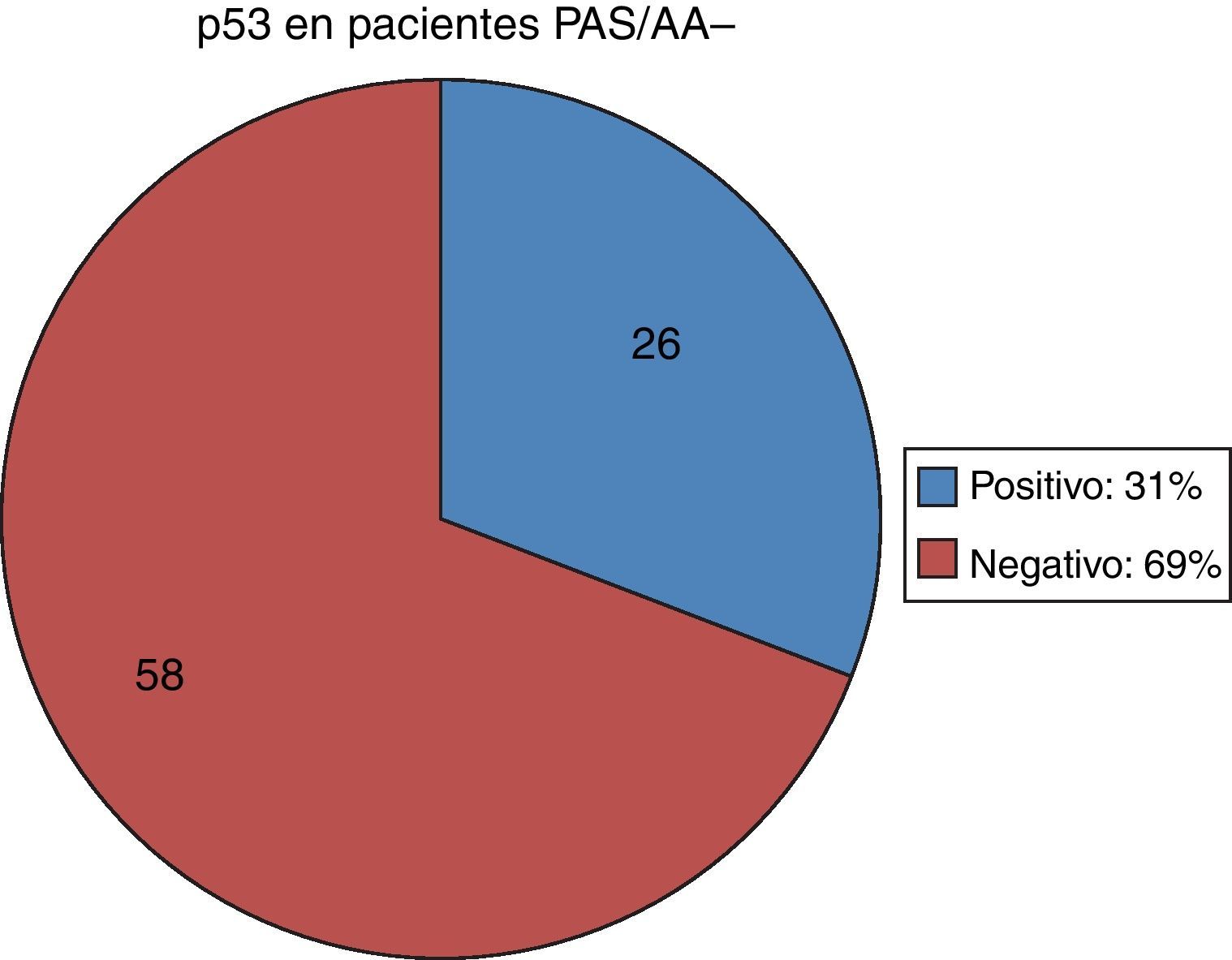
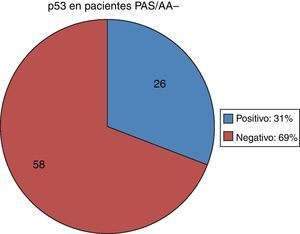
Ahora bien, en cuanto a los 20 pacientes que resultaron PAS/AA+, es decir, con MI, en 15 (75%) el p53 fue positivo y en 5 (25%) el p53 fue negativo (fig. 3). De los 84 pacientes con PAS/AA–, en 26 (31%) el p53 se encontró positivo y en 58 (69%) el p53 fue negativo (fig. 4).
Cabe señalar que en 9 de los 20 pacientes PAS/AA+ se obtuvieron las 3 tinciones positivas, es decir, con infección por Hp, con MI completa y con expresión nuclear de p53. De los otros 11 pacientes PAS/AA+, solo en 5 se encontró la tinción PAS/AA+, sin infección por Hp ni expresión de p53, y en los otros 6 pacientes se encontró expresión de p53 con ausencia de positividad en la tinción de Giemsa, es decir, que no se comprobó la presencia de Hp.
Se utilizó la prueba exacta de Fisher para la positividad de la tinción de Giemsa para Hp y la presencia de p53 nuclear en la tinción de inmunohistoquímica, resultando una p<0.0001 (OR = 62; IC del 95%, 15.8-241.8), lo que quiere decir que la asociación es estadísticamente significativa. También se utilizó la prueba para analizar la asociación entre otras 2 variables, la expresión de p53 y la positividad con PAS, es decir, en los pacientes con MI, y la p<0.0006 (OR = 6.69; IC del 95%, 2.1-20.3), lo que traduce que esta asociación también tiene significación estadística (tabla 2).
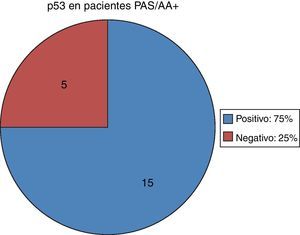
Relación entre parámetros estudiados y expresión de p53
| Parámetro | p53 positivo | p53 negativo | Valor de p/OR |
| Giemsa (Helicobacter pylori) | |||
| Positivo | 31 | 3 | < 0,0001 |
| Negativo | 10 | 60 | OR = 62; IC del 95%, 15.8-241.8 |
| PAS/AA (metaplasia intestinal) | |||
| Positivo | 15 | 5 | < 0,0006 |
| Negativo | 26 | 58 | OR = 6,69; IC del 95%, 2.1-20.3 |
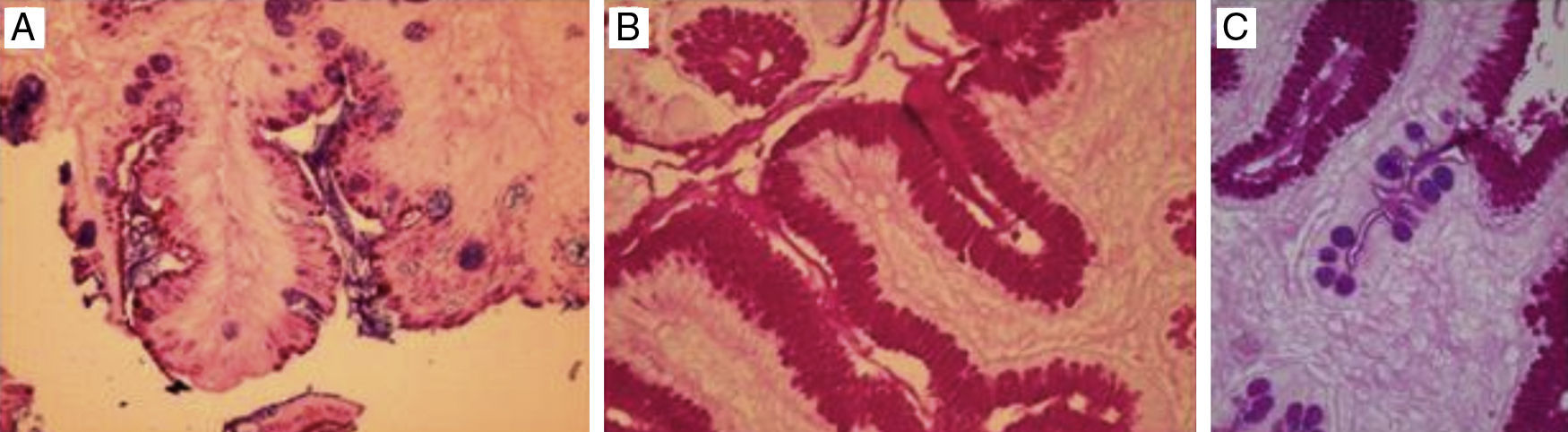
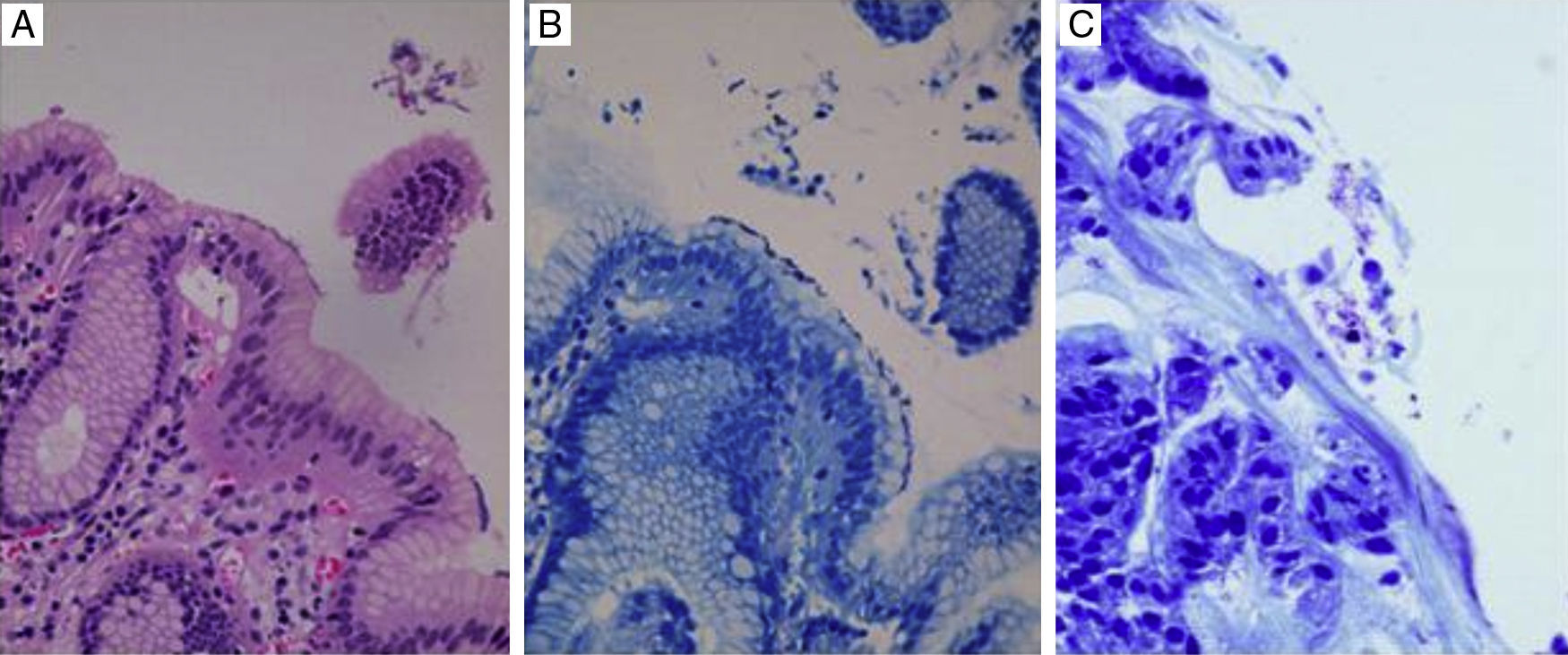
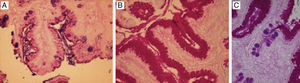
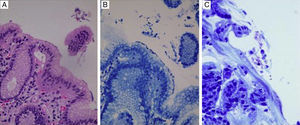
En la figura 5 se observa la tinción con PAS/AA, en donde el AA tiñe de azul/morado las glándulas caliciformes con mucinas ácidas, indicando la presencia de MI; la tinción color magenta indica la presencia de células seudocaliciformes propias del epitelio gástrico, productoras de mucina básica.
La figura 6 es una foto microscópica a 40× teñida con H/E, donde se observa el epitelio de superficie glandular gástrico con bacilos que indican Hp, se confirma con la tinción de Giemsa.
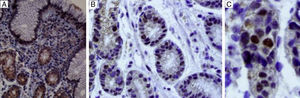
En la figura 7, foto microscópica a 40×, tinción de inmunohistoquímica para la proteína p53, la positividad se expresa tiñendo el núcleo e indica la expresión del gen. La presencia de la tinción en el citoplasma celular se considera como «tinción de fondo» y no tiene valor diagnóstico.
DiscusiónLos datos obtenidos de nuestra mayor población fueron pacientes del sexo femenino, de los cuales el 62% se encontraba consumiendo inhibidores de la bomba de protones o los habían consumido recientemente, ya sea por decisión propia o por indicación médica.
Los hallazgos endoscópicos en orden de frecuencia fueron GC en el 44%, gastritis aguda en el 17%, gastritis reactiva en el 12% y la gastritis nodular en el 12%; otros hallazgos, como gastritis superficial, gastritis atrófica y estudio normal, se presentaron en menor frecuencia. Observamos que la GC es el hallazgo encontrado casi en la mitad de nuestros pacientes, donde no se especificaron las características propuestas por el SS, y es importante resaltar la presencia de la gastritis nodular como hallazgo debido a que implica ya una alta sospecha desde la endoscopia de la presencia de Hp en el paciente.
Los diagnósticos histopatológicos fueron dados según lo propone el SS, siendo la GC moderada el más predominante, con un 31% de los casos, seguido por mucosa histológicamente normal en el 13%, GC superficial con el 12% y GC activa y folicular activa, ambas con un 10%. El resto de los diagnósticos incluyen la GC superficial con componente reactivo, la GC moderada con componente reactivo, la GC reactiva, la GC leve, la GC folicular activa con componente reactivo y la GC folicular moderada. Vemos que en el 87% de los casos se encontró GC y las subdivisiones de la misma dependieron del grado de actividad y de su penetración en la mucosa, con la característica que en algunos pacientes se encontraron datos de gastritis reactiva. La presencia de folículos linfoides, es decir, la GC folicular, altamente indicativa de la infección por Hp, no fue un diagnóstico predominante. En ningún caso se encontró atrofia de la mucosa o displasia.
Cabe recordar que las biopsias se tomaron de mucosa sin lesiones macroscópicas aparentes con la endoscopia convencional.
En cuanto al uso de las tinciones, el PAS/AA fue positivo en 19% de los pacientes, y en todos ellos el tipo de metaplasia que se encontró fue de tipo completa. Hay que recordar que dentro del SS se toma la biopsia de la incisura angularis, que es donde se encuentra la mayor prevalencia de esta lesión preneoplásica, y que existe una alta probabilidad de no identificarla endoscópicamente con el endoscopio convencional.
Con la tinción de Giemsa se confirmó la presencia de infección por Hp en el 32.7% de los pacientes, lo cual se encuentra por debajo de lo reportado en la literatura en México. Hay que recordar que la gran mayoría de los pacientes había estado tomando inhibidor de la bomba de protones recientemente o se encontraba bajo ese régimen, lo que produce la migración del Hp hacia el cuerpo y el fondo gástrico desde su localización habitual en el antro y la región prepilórica, por lo que no se le habría tomado biopsia.
En cuanto a la inmunohistoquímica para p53, se encontró positiva en el 39.4% de los pacientes del protocolo. Como ya se mencionó anteriormente, el p53 es un oncogén que se expresa una vez que ha sido mutado, también llamado «gen salvaje» y traduce que el ciclo celular se encuentra alterado, teniendo tasas de proliferación celular y de apoptosis alteradas también, lo que condiciona la acumulación de mutaciones y de daño al ADN que provocaría que se inicie una cadena de sucesos que terminaría en la aparición de CG. La expresión del p53 se ha estudiado y relacionado en algunos estudios in vivo con la infección por Hp; en estudios in vitro se ha comprobado que la infección por Hp aguda produce expresión de p53.
En cuanto a la relación entre las variables, se comprueba que en el 91% de los pacientes con Giemsa+, es decir, con infección por Hp, el p53 se encuentra mutado y se está expresando, no así en el restante 9% de los pacientes Giemsa+, ya que tiene el p53 negativo.
De los pacientes Giemsa–, es decir, donde no se logra comprobar la infección por Hp, el 14% (10 pacientes), sin embargo, presenta expresión del p53 y lo expresa; el 60% de estos pacientes (6 pacientes) tuvieron positividad para PAS/AA, o sea que tienen diagnóstico de MI completa y, como ya se mencionó, el Hp no coloniza la MI. También otros factores que pueden influenciar en este resultado son que el paciente tenga otros factores que muten al p53, como puede ser genéticos o ambientales, y dentro de estos últimos, la gastritis reactiva encontrada puede ser un factor que se debe estudiar en este rubro en otros estudios posteriores.
La relación entre la tinción de Giemsa y la inmunohistoquímica con p53 tiene una asociación estadísticamente significativa.
De los pacientes con MI comprobada, el 75% presentó positividad para p53, indicando según los demás resultados que la infección por Hp pudo ser un factor predisponente para la mutación del p53 y, al cambiar el epitelio hacia MI, el Hp ya no fue capaz de colonizarlo, pero el daño genético inducido permanecería y continuaría en la cadena oncogénica del CG, ya que la MI es considerada como una lesión preneoplásica. Sin embargo, el 25% de los pacientes con MI no presentan reactividad para p53.
Finalmente, de los pacientes PAS/AA–, el 31% (26 pacientes) tuvo expresión de p53, de los cuales en el 85% (22 pacientes) se encontró Giemsa+, por lo que la expresión de p53 podría ser explicada por la presencia de Hp; en el restante 15%, la expresión de p53 nuevamente sería debida a otros factores, como genéticos o externos. De los pacientes PAS/AA–, el 69% (58 pacientes) no presenta reactividad para p53 y el 95% de ellos (55 pacientes) serían considerados como sin ningún hallazgo, debido a que en el restante 5% (3 pacientes) se encontró Hp en la tinción de Giemsa y ausencia de expresión del p53.
La relación entre la tinción de PAS/AA y la inmunohistoquímica con p53 también tiene una asociación estadísticamente significativa y, tomando en cuenta lo comentado anteriormente, puede explicarse que la relación se confirma con la tinción de Giemsa.
Cabe recalcar que la mayoría de los estudios realizados han sido in vitro o en modelos animales donde se ha tenido control sobre el tiempo de infección por el Hp e incluso de una cepa específica; no hay en el momento actual estudios epidemiológicos que indiquen la incidencia real de las mutaciones del p53 en pacientes asintomáticos o sin lesiones macroscópicas durante la endoscopia.El estudio es llevado a cabo por primera vez en población mexicana, donde se presentan altas tasas de prevalencia de Hp, dependiendo de la zona geográfica, lo que da una buena oportunidad para el estudio de la cadena de origen del CG. Este estudio es un primer paso enfocándose en lo que se cree puede ser de los primeros en llevarse a cabo. Una de las limitaciones del estudio es el tipo de diseño, que no permite evaluar el seguimiento clínico en relación con la presencia o no de la expresión del p53 y su progresión a cáncer, además del tamaño de la muestra estudiada. En el presente trabajo, no se llevaron a cabo estudios genéticos para la detección de la mutación del gen p53, simplemente se consideró positiva su expresión.
ConclusionesEl estudio presenta una fuerte asociación entre la presencia de Hp y la expresión del gen p53 que lo hace visible a la inmunohistoquímica. Incluso en pacientes que ya presentan lesiones preneoplásicas consecuencia de la infección por el Hp, como lo es la MI, y ya sin la presencia del bacilo, se detecta la expresión del mismo gen.
La sobreexpresión de p53, como cualquier otro oncogén, pueden deberse a factores genéticos o externos, como son los factores infecciosos, lo cual es encontrado en este estudio en relación con la infección por el Hp. Es interesante el hallazgo acerca de la gastritis reactiva como una posible causa de afección del p53; en pacientes con cirugía gástrica, el reflujo biliar en la anastomosis ha sido relacionado a una mayor probabilidad de cáncer, pero no ha sido estudiado el posible papel que desempeñe el gen p53 en esta cadena de CG.
La identificación del CG temprano es de vital importancia para su adecuado tratamiento y curación. Actualmente, se han identificado la atrofia gástrica y la MI como lesiones preneoplásicas que deben ser vigiladas por su potencial de malignización. Además de la toma de biopsias de manera rutinaria durante las endoscopias superiores para la detección del Hp por medio de la tinción de Giemsa, el uso de la inmunohistoquímica para p53 como complemento puede identificar a la población que presenta expresión del mismo, que en su papel como oncogén traduce alteración del ciclo celular.
Queda pendiente el seguimiento de estos pacientes que presentan p53 para conocer realmente el alcance de la expresión o mutación y su predisposición real a CG; se sabe que todos los cánceres de estómago presentan alteraciones genéticas, pero no se sabe cuál de estas son las primeras en ocurrir, el tiempo que transcurre entre cada evento y cómo es que el Hp las produce. Debido a la alta prevalencia de la expresión del p53 en estos pacientes, y tomando en cuenta que en México la prevalencia del Hp es variable pero constantemente elevada, los pacientes detectados con esta prueba serían muchos, por lo que es necesario conocer qué otros factores conllevan al desarrollo de cáncer, posiblemente a partir de un paso inicial como sería la expresión del p53.
Por lo pronto, debe considerarse la expresión del p53 como un marcador de alteraciones del ciclo celular en los pacientes con infección activa o pasada por Hp, al igual que en los pacientes con consecuencias histológicas de la misma.
FinanciaciónInterno: el Servicio de Endoscopia del Hospital Juárez de México colaboró con el equipo endoscópico necesario.
Externo: el Servicio de Patología del Hospital Español de México absorbió los costos del procesamiento de las biopsias.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Un agradecimiento a los servicios de Endoscopia del Hospital Juárez por la recolección de las muestras y de Patología del Hospital Español de México por el procesamiento de las biopsias.