La enfermedad celíaca (EC) es una condición compleja cuyo principal determinante genético implica las moléculas HLA, específicamente los heterodímeros HLA-DQ2 y/o HLA-DQ8. No obstante, la frecuencia de los alelos codificantes de estas moléculas no ha sido reportada en pacientes celíacos venezolanos; por lo tanto, el objetivo de nuestro estudio fue evaluar la frecuencia de los alelos HLA-DQB1 en individuos con clínica sugestiva de EC y definir los marcadores de diagnóstico de esta condición en la población venezolana.
Material y métodosEstudio transversal, que incluyó 516 individuos con clínica sugestiva de EC. La tipificación molecular del locus HLA-DQB1 se realizó con la técnica de reacción en cadena de la polimerasa e hibridación con oligonucleótidos de secuencias específicas (PCR-SSO).
ResultadosEl 58.3% de los individuos con manifestaciones clínicas compatibles con EC presentaban por lo menos un alelo de riesgo (DQB1*0201 y/o DQB1*0302), y en 40 de ellos se confirmó el diagnóstico. Los pacientes con EC presentaron una mayor frecuencia del alelo de riesgo DQB1*0201 (26.25%), seguido por el alelo DQB1*0302 (17.5%). Se observó la asociación entre la presencia de alelos de riesgo y la presencia de lesiones características de la EC (p=0.001) y se halló una correlación entre la predisposición genética a desarrollar EC y la presencia de anticuerpos anti-transglutaminasa (p=0.0127).
ConclusionesLos resultados apoyan el papel de los alelos DQB1*02 y DQB1*0302 en la susceptibilidad y las alteraciones histológicas de la mucosa intestinal de la EC en la población venezolana.
Celiac disease (CD) is a complex condition, whose main genetic determinant involves HLA molecules, specifically the HLA-DQ2 and/or HLA-DQ8 heterodimers. Nevertheless, the frequency of the alleles encoding those molecules has not been reported in Venezuelan celiac patients. Therefore, the aim of our study was to evaluate the frequency of the HLA-DQB1 alleles in individuals with symptoms suggestive of CD and define the diagnostic markers of the condition in a Venezuelan population.
Material and methodsA cross-sectional study included 516 individuals with symptoms suggestive of CD. Molecular typing of the HLA-DQB1 locus was performed using a polymerase chain reaction-sequence-specific oligonucleotide procedure (PCR-SSO).
ResultsA total of 58.3% of the individuals with clinical manifestations consistent with CD presented with at least one risk allele (DQB1*0201 and/or DQB1*0302), and the diagnosis was confirmed in 40 of them. The patients with CD had a higher frequency of the DQB1*0201 risk allele (26.25%), followed by the DQB1*0302 (17.5%) allele. There was an association between the presence of risk alleles and the presence of lesions characteristic of CD (P=.001), and a correlation was found between the genetic predisposition to develop CD and the presence of anti-tissue transglutaminase antibodies (P=.0127).
ConclusionsThe results support the role of the DQB1*02 and DQB1*0302 alleles in CD susceptibility and the histologic alterations of the intestinal mucosa, in a Venezuelan population.
La enfermedad celíaca (EC) es una enfermedad autoinmune en la que el factor genético clave (antígeno leucocitario humano [HLA]-DQ2 y HLA-DQ8), el autoantígeno involucrado (transglutaminasa tisular [tTG]) y el desencadenante ambiental (gluten) han sido bien definidos1. Esta condición se caracteriza clínicamente por diversas manifestaciones intestinales y extraintestinales, histológicamente por el daño de la mucosa del intestino delgado, y serológicamente por la presencia de anticuerpos contra la enzima transglutaminasa tisular2 (anti-tTG2), anticuerpos anti-endomisio y/o péptido de gliadina desamidado2.
Como es bien sabido, el principal determinante genético en la EC involucra las moléculas HLA, específicamente los heterodímeros HLA-DQ2 y/o HLA-DQ83. El heterodímero HLA-DQ2, consiste de una subunidad α y una subunidadβ codificadas por los alelos HLA-DQA1*05 y HLA-DQB1*02, respectivamente, diferenciándose dos tipos de heterodímeros DQ2: el DQ2.5 (DQA1*0501/DQB1*0201) y el DQ2.2 (DQA1*0201/DQB1*0202). Por otra parte, el heterodímero HLA-DQ8 consiste de una cadenaα y una cadenaβ, codificadas por los alelos HLA-DQA1*0301 y HLA-DQB1*0302, respectivamente4. Estas moléculas HLA-DQ juegan un papel clave en la EC debido a sus propiedades fisicoquímicas y a la unión de péptidos específicos, que han sido desamidados por la enzima transglutaminasa tisular 2 (tTG2), desencadenando una respuesta inmunitaria, innata y adaptativa, contra el gluten. En la respuesta inmunitaria innata son activados neutrófilos, eosinófilos, mastocitos y proteínas del complemento, contribuyendo potencialmente en la patogénesis de la enfermedad. En la respuesta inmunitaria adaptativa, los péptidos derivados del gluten y modificados por la tTG2 son presentados, en los ganglios linfáticos mesentéricos, por células presentadoras de antígeno en el contexto de HLA-DQ2 y/o DQ8 a las célulasT CD4+. La respuesta tipo Th1 resultante conlleva la producción de IFN-γ y a la inflamación intestinal. La inflamación crónica conduce a la expansión y persistencia de las célulasTγδ, que también contribuyen a la producción de IFN-γ. Además, los péptidos de gluten inducen la expresión de IL-15 y moléculas de estrés en los enterocitos. Estas concentraciones elevadas de IL-15 promueven en las célulasT CD8+ un fenotipo similar a NK, contribuyendo directamente con la muerte de los enterocitos. Por otra parte, las células plasmáticas, también abundantes en la lesión, van a expresar el péptido inmunodominante del gluten y son inducidas a secretar anticuerpos dirigidos contra la tTG2 y otras dianas. Sin embargo, otros mecanismos menos caracterizados pueden participar en el desarrollo de la lesión5. Considerando que la EC es un trastorno complejo que involucra tanto factores genéticos como ambientales, así como la desregulación de la respuesta inmunitaria, el objetivo de nuestro estudio fue evaluar la frecuencia de los alelos HLA-DQB1 en individuos con clínica sugestiva de EC y definir los marcadores de diagnóstico de esta condición en la población venezolana.
Material y métodosPacientesSe realizó un estudio exploratorio y correlacional que incluyó 516 individuos mestizos venezolanos procedentes de distintos centros de salud del Distrito Capital-Venezuela, quienes acudieron a la Sección Inmunogenética del Centro de Medicina Experimental del Instituto Venezolano de Investigaciones Científicas (IVIC) para realizarse la determinación molecular de los alelos HLA-DQB1 por presentar clínica sugestiva de EC.
Mestizo venezolano se define como alguien nacido en Venezuela que es descendiente de indígenas habitantes del país y de individuos de origen caucásico, principalmente españoles.
Las características clínicas, las serológicas y los resultados de la biopsia duodenal se registraron en el momento de la genotipificación HLA-DQB1. Se incluyeron los individuos con manifestaciones generales (cansancio, pérdida de peso, problemas de crecimiento), manifestaciones gastrointestinales (dispepsia, náuseas, vómitos, dolor abdominal, diarrea, estreñimiento) y la presencia de manifestaciones extraintestinales (manifestaciones cutáneas).
El diagnóstico de EC se realizó en base a «la regla cuatro de cinco», que indica que cuatro de los cinco criterios siguientes son suficientes para establecer el diagnóstico de esta patología: 1)signos y síntomas típicos (diarrea y malabsorción); 2)positividad de anticuerpos; 3)positividad para HLA-DQ2 y/o HLA-DQ8; 4)daño intestinal (atrofia de vellosidades y lesiones menores), y 5)respuesta clínica a una dieta libre de gluten (DLG)6.
Estudios genéticosEl ADN genómico fue extraído de las células blancas de sangre venosa utilizando el protocolo de Bunce7, y el polimorfismo del locus HLA-DQB1 se determinó mediante el método de reacción en cadena de la polimerasa (PCR) e hibridación con oligonucleótidos de secuencia específica (SSO), utilizando el kit Dynal RELI™ SSO HLA-DQB1 (Dynal Biotech Ltd, Invitrogen, Reino Unido).
Estudios histológicosLas muestras de biopsia duodenal fueron analizadas histopatológicamente por un anatomopatólogo y se evaluó el daño en la mucosa en relación con la clasificación de Marsh: tipo0, mucosa normal; tipo1, lesión infiltrativa; tipo2, lesión hiperplásica; tipo3, lesión destructiva, siendo 3a leve (atrofia parcial), 3b marcada (atrofia subtotal) y 3c atrofia total.
Clasificación de los individuos con clínica sugestiva de ECBasados en los genotipos HLA-DQB1, es decir, en la ausencia o en la presencia de uno o dos alelos de riesgo (HLA-DQB1*0201, *0202, *0301 y *0302), en forma homocigota o heterocigota, los individuos se clasificaron en grupos de ninguno, bajo, intermedio y alto riesgo de padecer EC8.
TratamientoA todos los individuos participantes se les consultó si seguían una DLG, que es el único tratamiento recomendado en los pacientes que padecen EC. Dicho tratamiento fue prescrito por el médico tratante y monitoreado por un médico especialista en nutrición, quien evaluó la adherencia mediante un cuestionario en el que se indicaban los alimentos consumidos por el paciente, así como por la determinación de los anticuerpos para EC. Los individuos que seguían la DLG y que después de 6meses presentaron mejoría clínica y serología negativa para anticuerpos anti transglutaminasa se consideraron individuos respondedores a la dieta.
Análisis estadísticoLas frecuencias alélicas y genotípicas fueron calculadas por contaje directo. Las diferencias de frecuencias entre los grupos fueron estimadas por la prueba de ji cuadrado (χ2), usando tablas de contingencia, y la significancia estadística se consideró cuando el valor de p fue menor a 0.05. Para estimar las asociaciones entre los alelos de riesgo con la ocurrencia de enfermedad y la presencia de lesiones histológicas características de la enfermedad, se calculó la razón de probabilidades (odds ratio [OR]), con el correspondiente intervalo de confianza (95%). Las correlaciones entre la variabilidad de los genes estudiados y las distintas variables se realizaron utilizando el paquete estadístico SPSS versión 209, determinando el coeficiente de correlación de Pearson.
Consideraciones éticasEl protocolo del estudio fue aprobado por el Comité de Ética Institucional (Oficio N.° 4300) y se llevó a cabo de acuerdo con las directrices de la Declaración de Helsinki. Todos los participantes firmaron un consentimiento informado.
ResultadosCaracterísticas demográficas, clínicas y diagnósticas de los individuos con clínica sugestiva de ECTodos los individuos que asistieron presentaban síntomas relacionados con la EC, incluyendo manifestaciones gastrointestinales, siendo los síntomas más frecuentes diarrea, estreñimiento, dispepsia y flatulencia, así como la presencia de síntomas no gastrointestinales, destacando el déficit pondoestatural y dermatitis, principalmente en niños. Las características demográficas, el diagnóstico y los principales síntomas de los individuos con clínica sugestiva de EC se muestran en la tabla 1. De los 516 individuos incluidos, 251 (48.6%) eran del sexo femenino y 265 (51.4%) del sexo masculino, 328 (63.6%) eran adultos y 188 (36.4%) menores de 18años, con un rango de edad comprendido entre 1 y 67años. De los individuos con clínica sugestiva de EC, 87 (16.8%) se habían realizado el estudio serológico (IgA e IgG anti-transglutaminasa e IgA e IgG anti-gliadina) y 99 (19.2%) la biopsia duodenal.
Características demográficas, diagnósticas y sintomatología de los individuos con clínica sugestiva de enfermedad celíaca
| Individuos con clínica EC (n=516) | |
|---|---|
| Sexo | |
| Femenino | 48.6 (251) |
| Masculino | 51.4 (265) |
| Rango de edad (años) | 1-67 años |
| Edad promedio±DE | 11.4±13.94 |
| Ac anti-gliadina (n=87) | |
| Positivo | 51.7 (45) |
| Negativo | 48.3 (42) |
| IgA anti-gliadina positivo | 66.7 (30) |
| IgG anti-gliadina positivo | 86.7 (39) |
| Ac anti-transglutaminasa (n=86) | |
| Positivo | 39.5 (34) |
| Negativo | 60.5 (52) |
| IgA anti-transglutaminasa | 73.5 (25) |
| IgG anti-transglutaminasa | 58.8 (20) |
| Ac anti-endomisio (n=17) | |
| Positivo | 35.3 (6) |
| Negativo | 64.7 (11) |
| Biopsia | |
| Sí | 19.2 (99) |
| No | 80.8 (417) |
| Síntomas | |
| Diarrea | 64.7 (334) |
| Dolor abdominal | 67.8 (350) |
| Distensión abdominal | 49.6 (256) |
| Estreñimiento | 24.4 (126) |
| Vómitos | 28.7 (148) |
| Flatulencia | 11.8 (61) |
| Déficit pondoestatural | 47.3 (244) |
| Dermatitis herpetiforme | 10.5 (54) |
Ac: anticuerpo; DE: desviación estándar; EC: enfermedad celíaca; Ig: inmunoglobulina.
Las frecuencias se muestran en porcentajes, y entre paréntesis se indica el número de individuos.
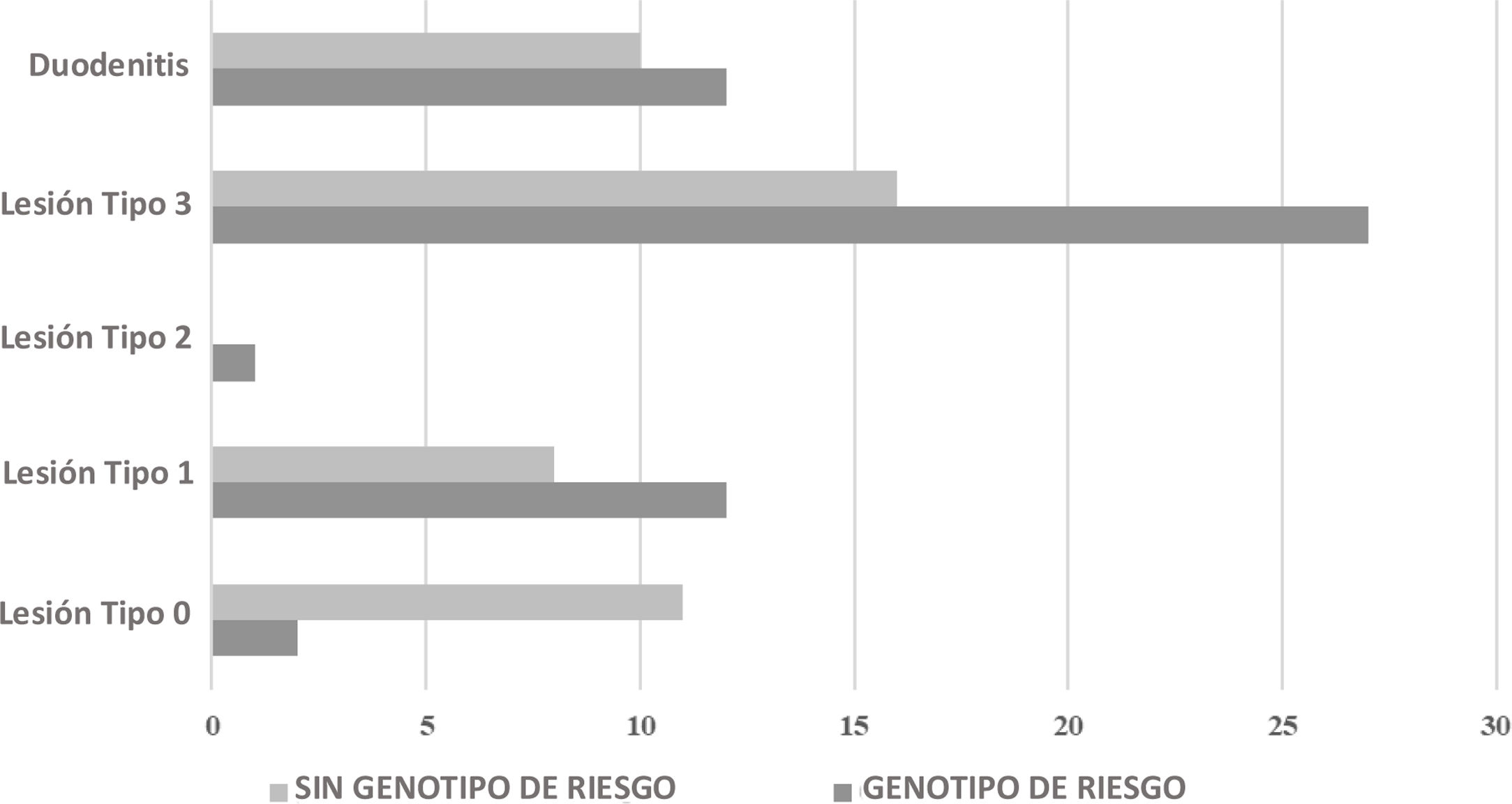
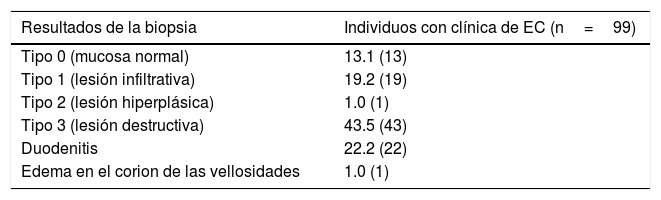
En la tabla 2 se muestran los resultados de la biopsia de los 99 individuos con clínica sugestiva de EC. Como se puede observar, 63 (63.6%) de los individuos presentaban hallazgos histológicos compatibles con EC. Al evaluar el daño en la mucosa en relación a la clasificación de Marsh, 13 (13.1%) presentaban mucosa normal (tipo0), 19 (19.2%) lesión infiltrativa (tipo1), 1 (1%) lesión hiperplásica (tipo2) y 43 (43.5%) lesión destructiva (tipo3). Basados en el grado de atrofia en las vellosidades, 16 (37.2%) presentaban atrofia parcial (3a), 8 (18.6%) subtotal (3b) y 19 (44.2%) total (3c).
Hallazgos histológicos de la biopsia intestinal realizada en individuos con clínica sugestiva de enfermedad celíaca
| Resultados de la biopsia | Individuos con clínica de EC (n=99) |
|---|---|
| Tipo 0 (mucosa normal) | 13.1 (13) |
| Tipo 1 (lesión infiltrativa) | 19.2 (19) |
| Tipo 2 (lesión hiperplásica) | 1.0 (1) |
| Tipo 3 (lesión destructiva) | 43.5 (43) |
| Duodenitis | 22.2 (22) |
| Edema en el corion de las vellosidades | 1.0 (1) |
EC: enfermedad celíaca.
Las frecuencias se muestran en porcentajes, y entre paréntesis se indica el número de individuos.
Entre los 516 individuos con clínica sugestiva de EC, solo 77 (14.9%) seguían una DLG, manifestando 35 (45.6%) de ellos una respuesta clínica satisfactoria después de seguir la dieta. Por otra parte, 43 (43.4%) de los individuos con biopsia duodenal iniciaron una DLG y 28 (65.1%) de ellos manifestaron una mejoría en los síntomas gastrointestinales y serología negativa a los 6meses de iniciada la dieta.
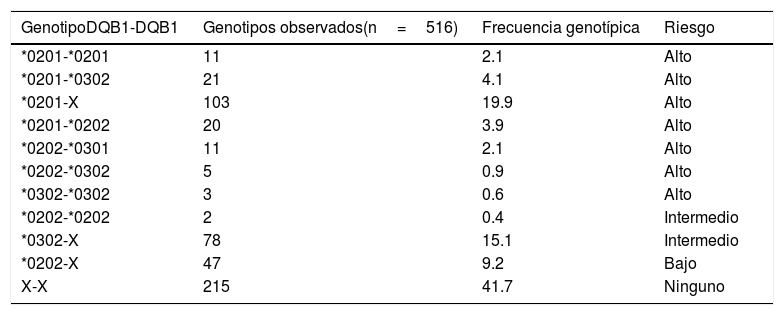
Polimorfismo HLA-DQB1Al analizar la distribución de los genotipos HLA-DQB1 se observó que 301 (58.3%) de los individuos con manifestaciones compatibles con la EC mostraban genotipos de riesgo, presentando 155 (51.5%) por lo menos un alelo DQB1*0201 y 107 (35.5%) por lo menos un alelo DQB1*0302. Finalmente, 215 (41.7%) de los individuos con clínica compatible con celiaquía no presentaban genotipos de riesgo (tabla 3).
Distribución de frecuencia de los genotipos HLA-DQB1 en individuos con clínica sugestiva de enfermedad celíaca
| GenotipoDQB1-DQB1 | Genotipos observados(n=516) | Frecuencia genotípica | Riesgo |
|---|---|---|---|
| *0201-*0201 | 11 | 2.1 | Alto |
| *0201-*0302 | 21 | 4.1 | Alto |
| *0201-X | 103 | 19.9 | Alto |
| *0201-*0202 | 20 | 3.9 | Alto |
| *0202-*0301 | 11 | 2.1 | Alto |
| *0202-*0302 | 5 | 0.9 | Alto |
| *0302-*0302 | 3 | 0.6 | Alto |
| *0202-*0202 | 2 | 0.4 | Intermedio |
| *0302-X | 78 | 15.1 | Intermedio |
| *0202-X | 47 | 9.2 | Bajo |
| X-X | 215 | 41.7 | Ninguno |
X: alelos HLA-DQB1 distintos a los alelos asociados con EC (HLA-DQB1*0201, *0202, *0301, *0302).
Las frecuencias se muestran en porcentajes.
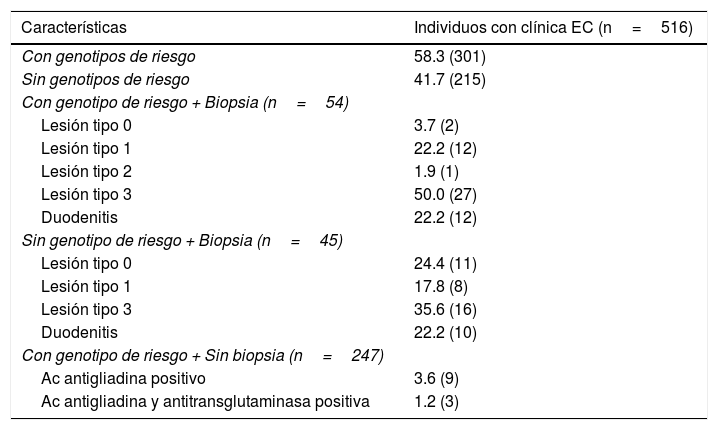
En esta población, si bien la frecuencia de genotipos relacionados con un aumento del riesgo a padecer celiaquía fue del 58.3% (301 individuos), el análisis de los 99 pacientes con biopsia intestinal mostró que solo 54 (54.5%) presentaban genotipo de riesgo, confirmándose el diagnóstico de EC en 40 (74.1%) de ellos. En los pacientes con EC se observó una mayor frecuencia del alelo de riesgo DQB1*0201 (0.2625), seguido por el alelo DQB1*0302 (0.175).
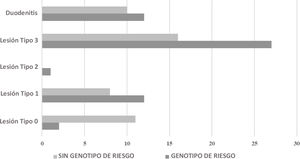
En los 45 (45.5%) individuos que no presentaban el genotipo de riesgo, la biopsia duodenal mostró lesiones características de EC en 24 (53.3%) de ellos. Con respecto a los 417 individuos sin biopsia intestinal, 247 (59.2%) portaban un genotipo de riesgo, observándose en tres individuos la presencia de anticuerpos IgA antigliadina e IgA anti-transglutaminasa (tabla 4). Al comparar los individuos con biopsia, agrupados con y sin alelos de riesgo, observamos una asociación entre la ausencia de los alelos de riesgo y la ausencia de lesiones en la mucosa (OR: 0.11; IC95%: 0.02-0.56; p=0.001). Asimismo, observamos una asociación entre la presencia de alelos de riesgo y la presencia de lesiones características de EC, independientemente del tipo de lesión (OR: 9.2; IC95%: 1.87-44.92; p=0.001) (fig. 1).
Características histológicas y serológicas de los individuos con clínica sugestiva de enfermedad celíaca, clasificados de acuerdo al genotipo HLA-DQB1
| Características | Individuos con clínica EC (n=516) |
|---|---|
| Con genotipos de riesgo | 58.3 (301) |
| Sin genotipos de riesgo | 41.7 (215) |
| Con genotipo de riesgo + Biopsia (n=54) | |
| Lesión tipo 0 | 3.7 (2) |
| Lesión tipo 1 | 22.2 (12) |
| Lesión tipo 2 | 1.9 (1) |
| Lesión tipo 3 | 50.0 (27) |
| Duodenitis | 22.2 (12) |
| Sin genotipo de riesgo + Biopsia (n=45) | |
| Lesión tipo 0 | 24.4 (11) |
| Lesión tipo 1 | 17.8 (8) |
| Lesión tipo 3 | 35.6 (16) |
| Duodenitis | 22.2 (10) |
| Con genotipo de riesgo + Sin biopsia (n=247) | |
| Ac antigliadina positivo | 3.6 (9) |
| Ac antigliadina y antitransglutaminasa positiva | 1.2 (3) |
Ac: anticuerpo; EC: enfermedad celíaca.
Las frecuencias se muestran en porcentajes, y entre paréntesis se indica el número de individuos.
Al establecer las correlaciones, se halló una correlación entre la predisposición genética a desarrollar EC y la presencia de anticuerpos IgG anti-transglutaminasa (r: 0.2574; p=0.0127). Basados en esta correlación, se comparó la frecuencia de pacientes con EC y con genotipos de riesgo entre los individuos seropositivos y negativos para anticuerpos anti-transglutaminasa (IgA e IgG), observándose una frecuencia significativamente incrementada de individuos con EC en el grupo de pacientes seropositivos con respecto al grupo de pacientes seronegativos (86.7% versus 57.9%, respectivamente; OR: 4.7; IC95%: 0.825-27.069; p=0.03).
DiscusiónEl presente estudio es el primero en evaluar la frecuencia de los alelos HLA-DQB1 en individuos venezolanos con clínica sugestiva de EC, observándose los siguientes hallazgos principales.
Nuestros resultados mostraron una asociación positiva entre los alelos de riesgo (HLA-DQB1*0201, *0302) y la presencia de lesiones en la mucosa intestinal, independientemente del tipo de lesión (infiltrativa, hiperplásica, destructiva). Algunos estudios han sugerido que el alelo HLA-DQB1*02, que codifica para la molécula DQ2, determina la severidad del daño a la mucosa intestinal y su progresión hacia la aparición de posibles complicaciones. Específicamente, los pacientes homocigotos para este alelo no solo presentan síntomas clínicos más graves, en particular diarrea y anemia, sino que también desarrollan lesiones intestinales más graves que tardan más en sanar después de la ausencia de gluten en la dieta10. En nuestro estudio observamos que, dentro del grupo de pacientes con atrofia de las vellosidades, el 74% presentaban por lo menos un alelo DQB1*02 y un 26% el alelo DQB1*0302, sugiriendo que la presencia de los alelos DQB1*02 y DQB1*0302 no solo está asociada con predisposición a desarrollar EC, sino también con la presencia de lesiones en la mucosa intestinal. Sin embargo, los pacientes con diagnóstico de EC y que seguían una DLG mostraron mejoría clínica y ninguno presentó linfoma intestinal o EC refractaria.
Al considerar los criterios de la «regla cuatro de cinco», que incluye las manifestaciones clínicas, la serología, el genotipo de riesgo, los resultados de la biopsia intestinal y la respuesta clínica a una DLG, confirmamos el diagnóstico de EC en 40 de los individuos con clínica compatible con esta patología. Al comparar las frecuencias de los alelos HLA-DQB1 de los pacientes con diagnóstico de EC y las frecuencias descritas en pacientes celíacos de otras poblaciones, observamos una frecuencia incrementada de los alelos de riesgo DQB1*0201 y DQB1*0302, similar a lo descrito en poblaciones europeas11 y mestizas latinoamericanas, como Argentina12,13, Brasil14-17, Chile18,19, Uruguay20 y Cuba21, poblaciones caracterizadas por tener un componente caucásico mayor del 50%. Por otra parte, observamos una menor frecuencia del alelo HLA-DQB1*0302 con respecto a la frecuencia descrita en poblaciones con una mayor prevalencia de genes amerindios22,23. Recientemente, Mejía-León y Calderón-de la Barca24 resaltaron que en la población mexicana las moléculas DQ2 y DQ8 contribuyen con el riesgo genético de EC, riesgo que no se debe mayoritariamente al DQ2, como en europeos, o en mayor parte al DQ8, como se observa en poblaciones con mayor prevalencia de genes amerindios.
En individuos sin genotipos de riesgo y clínica sugestiva de EC, la presencia de lesiones intestinales características de EC podría explicarse por la existencia de otras causas de atrofia de las vellosidades intestinales, incluida la enteropatía autoinmune, inmunodeficiencia común variable, enteropatía asociada a olmesartán, trastornos linfoproliferativos del intestino delgado y atrofia de origen infeccioso25, o por la presencia de otras variantes no HLA asociadas con EC. Estudios de asociación de genoma completo han identificado más de 40 genes no HLA asociados con EC26,27, que, si bien pueden conferir un riesgo genético limitado, son de relevancia ya que permiten el descubrimiento de vías potencialmente claves involucradas en la patogénesis de la enfermedad.
El 1% de los individuos con manifestaciones clínicas compatibles con EC que portaban genotipo de riesgo pero no se habían realizado biopsia intestinal presentaban anticuerpos IgA anti-gliadina e IgA anti-transglutaminasa, así como mejoría clínica al seguir la DLG. Los integrantes de este grupo, conformado solo por niños, con una edad promedio de 3.6±2.8años, podrían clasificarse como pacientes con diagnóstico presuntivo de EC, a pesar de no habérseles realizado la biopsia intestinal. Si bien continúa el debate para definir si las pruebas no invasivas podrían usarse como pruebas únicas para el diagnóstico de EC, en los niños la positividad para dos pruebas serológicas distintas y la presencia de los genotipos de riesgo (HLA-DQ2 y/o HLA-DQ8) se han sugerido como posible prueba en el algoritmo diagnóstico de la EC, evitando así la necesidad de realizar la endoscopia digestiva con biopsia3.
Finalmente, los individuos con genotipos de riesgo y la presencia de anticuerpos anti-transglutaminasa (IgA-IgG) son 4.7 veces más propensos a desarrollar EC, confirmándose al observar en el grupo de pacientes con el genotipo de riesgo y seropositividad para anticuerpos anti-transglutaminasa una frecuencia incrementada de individuos con diagnóstico de EC. Aunque los anticuerpos específicos de la EC se utilizan para el diagnóstico presuntivo de EC, se ha planteado que estos anticuerpos cumplen funciones importantes en la progresión de la enfermedad, a nivel de la mucosa del intestino delgado, y en el desarrollo de manifestaciones extraintestinales relacionadas con la EC.
ConclusionesLa investigación de la EC en la población venezolana es escasa, y en este sentido, uno de los principales aportes en este estudio es que los resultados apoyan el papel de los alelos DQB1*02 y DQB1*0302 en la susceptibilidad y las alteraciones histológica de la EC en esta población. Por lo tanto, la tipificación de estos genes en la población venezolana será de utilidad para el cribado de sujetos incluidos en grupos de riesgo de EC, discriminando los individuos con baja probabilidad para desarrollar la enfermedad de los individuos que deben ser monitoreados por un posible desarrollo futuro de EC.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo/estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.