La resistencia antimicrobiana se ha convertido en un problema a nivel mundial debido a su incremento excesivo en los últimos años. El objetivo de esta revisión narrativa es conjuntar los datos obtenidos de distintos artículos que demuestran grados de resistencia a antimicrobianos en las infecciones más comunes del tracto digestivo reportadas en el mundo.
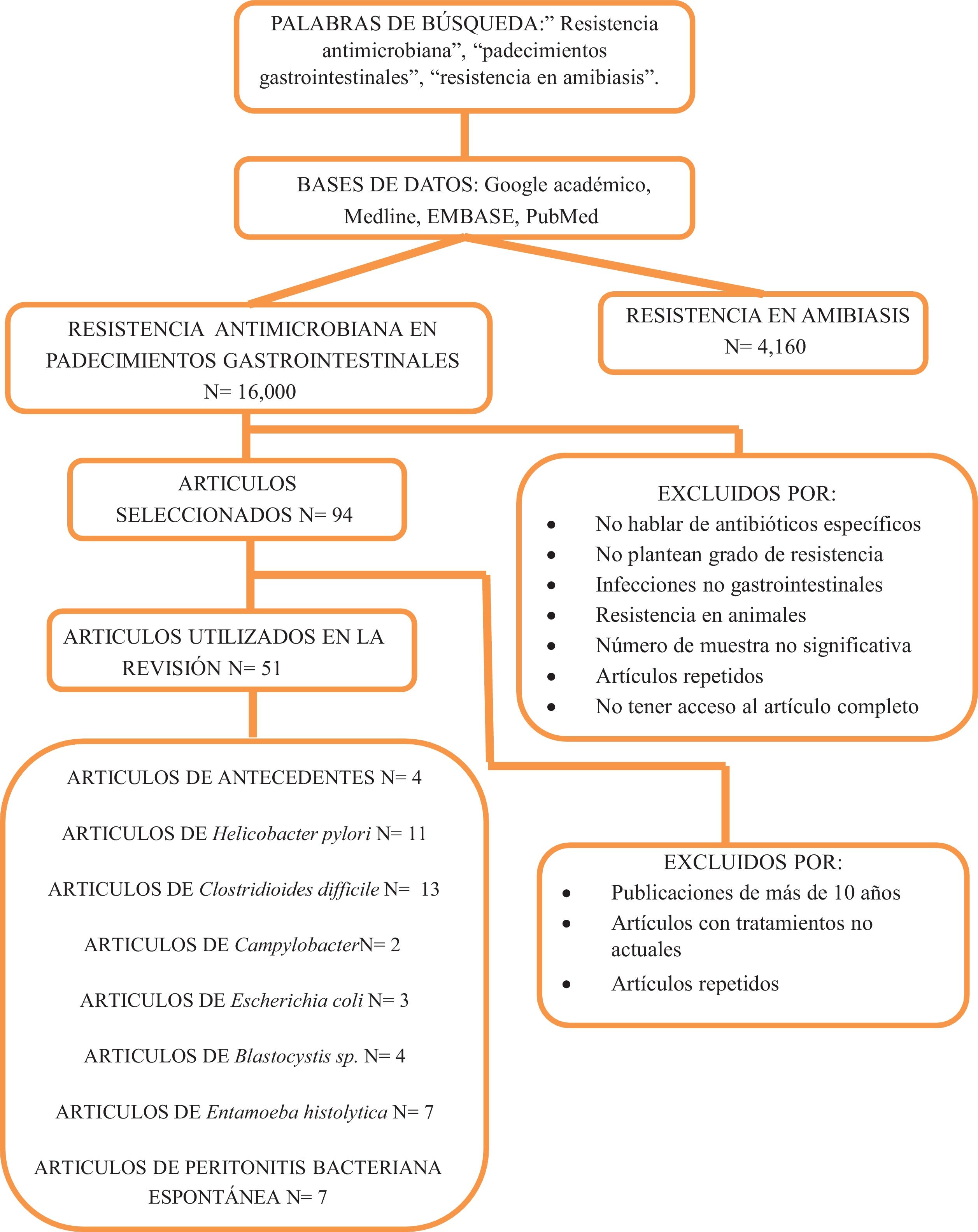
La búsqueda de la literatura se realizó a través de las plataformas Google Académico, Medline, Embase y Pubmed con los términos resistencia antimicrobiana, resistencia en padecimientos gastrointestinales y resistencia en amibiasis, tanto en español como en inglés. Se utilizaron guías de tratamiento y consensos mexicanos sobre el tratamiento actual de las infecciones desde 2017 a la fecha. Se incluyeron publicaciones de los últimos 10 años para describir el grado de resistencia, con adecuado número de muestra, descripción precisa de material y métodos, estudios multicéntricos, consensos nacionales e internacionales, metaanálisis, revisiones sistemáticas y textos en extenso con un total de 51 artículos finales.
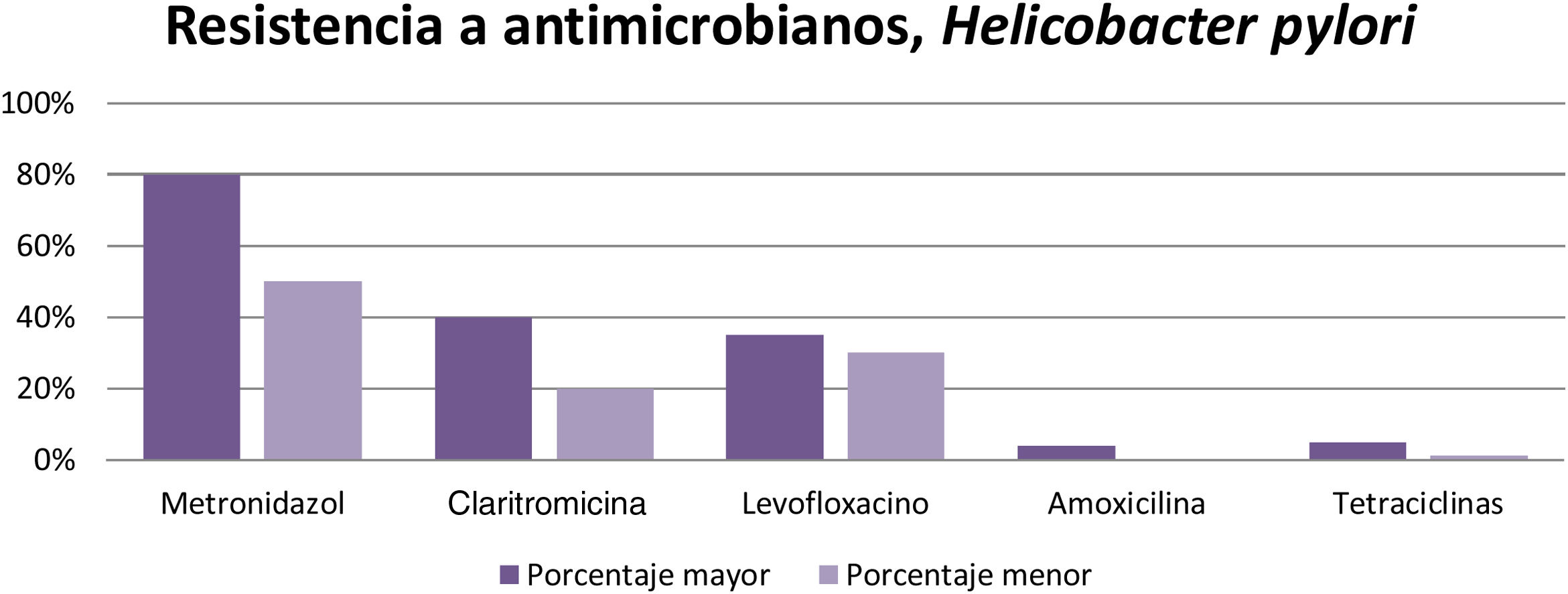
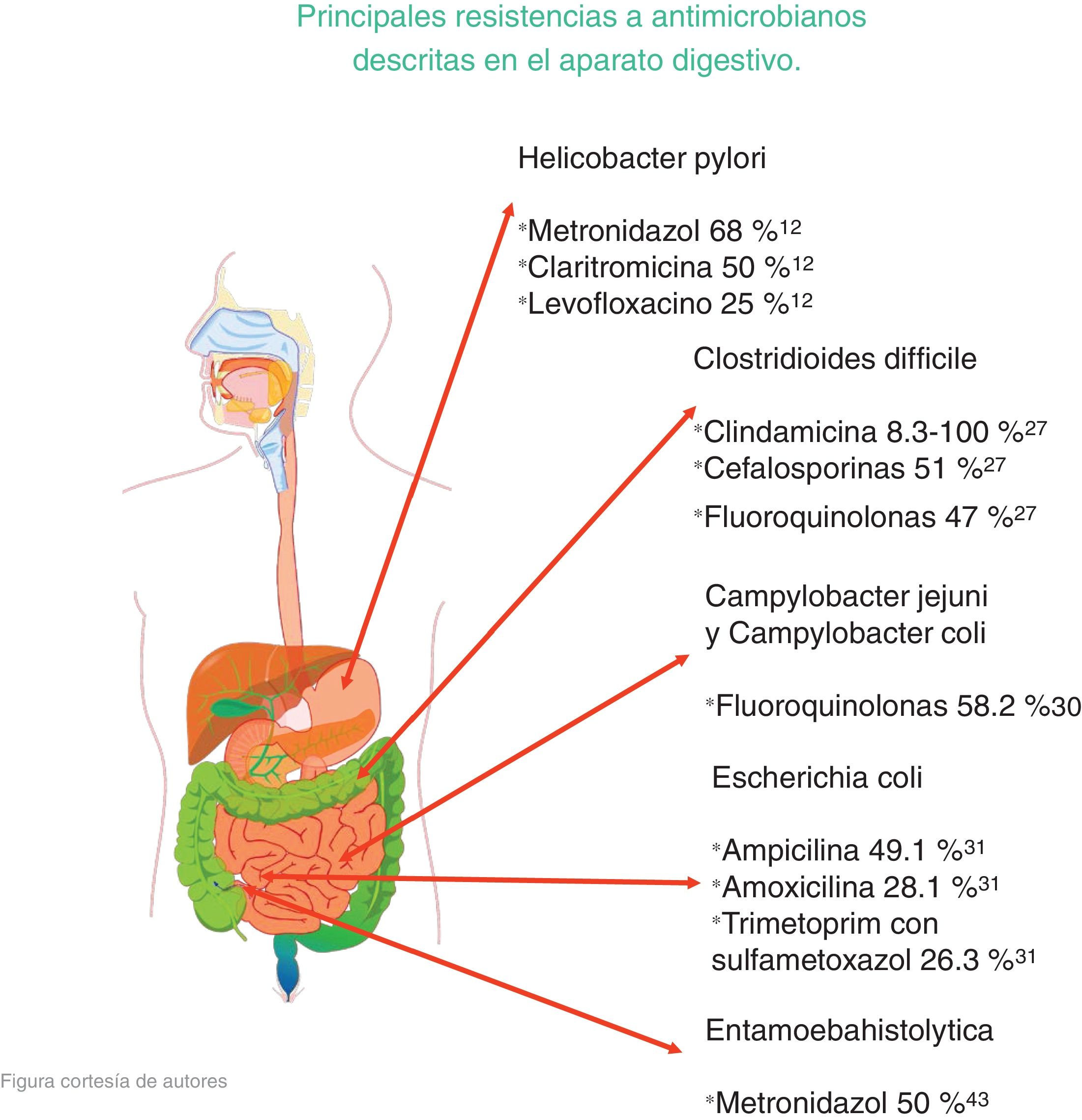
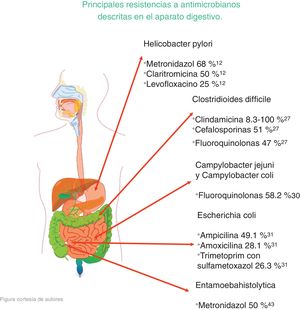
Los microorganismos que demostraron mayor porcentaje de resistencia son Helicobacter pylori (metronidazol 50-80%, claritromicina 20-40% y levofloxacino 30-35%), Clostridioides difficile (clindamicina 8.3-100%, cefalosporinas 51%), Campylobacter jejuni y coli (fluoroquinolonas 85%), Escherichia coli (ampicilina 76.5%), Entamoeba histolytica (metronidazol 50%) y peritonitis bacteriana (cefalosporinas de tercera generación 40%, meticilina 85%).
La resistencia a antimicrobianos está alcanzando porcentajes elevados, por lo que es necesario evaluar la situación de cada paciente para tener éxito en los tratamientos de infecciones gastrointestinales.
Antimicrobial resistance has become a worldwide problem due to its excessive increase in recent years. The aim of the present review was to bring together data from different articles describing the levels of antimicrobial resistance in the most common gastrointestinal infections reported across the globe.
The literature search was carried out in Google Scholar, Medline, Embase, and Pubmed, with the terms “antimicrobial resistance”, “resistance in gastrointestinal disorders”, and “resistance in amoebiasis”, in Spanish and English. Mexican treatment guidelines and consensuses from 2017 to the present were utilized. Publications from the last ten years were chosen to describe the level of resistance. They had adequate sample sizes, the Material and Methods sections were precise, and they included multicenter studies, national and international consensuses, meta-analyses, systematic reviews, and extensive texts. The final number of articles was 51.
The microorganisms that demonstrated the highest percentage of resistance were Helicobacter pylori (metronidazole 50%-80%, clarithromycin 20%-40%, and levofloxacin 30%-35%), Clostridioides difficile (clindamycin 8.3%-100%, cephalosporines 51%), Campylobacter jejuni and Campylobacter coli (fluoroquinolones 85%), Escherichia coli (ampicillin 76.5%), Entamoeba histolytica (metronidazole 50%), and bacterial peritonitis (third-generation cephalosporines 40%, methicillin 85%).
Antimicrobial resistance is reaching elevated percentages, making it necessary to evaluate the situation of each patient, to successfully treat gastrointestinal infections.
Las enfermedades infecciosas son responsables de una alta morbimortalidad en el mundo, los antibióticos cambiaron la perspectiva y pronóstico de este tipo de enfermedades, dándose el periodo dorado de los antibióticos que abarcó de 1930 a 1960. Los primeros en advertir y estudiar la resistencia a los antibióticos fueron Alexander Fleming y Howard Walter Florey en 1945, con su descubrimiento de la penicilina1. Los microorganismos mutan más rápido de lo que se descubren nuevos antibióticos, por lo tanto el mismo uso de los antibióticos impulsa la aparición, amplificación y diseminación de la resistencia, y como resultado se acortan los intervalos de la susceptibilidad. Para que los antibióticos sigan siendo útiles se deberán usar menos antibióticos o antibióticos nuevos2. Actualmente nos enfrentamos a nuevas mutaciones que no solo se dan por el uso de antibióticos. En un estudio de Diagnostic Microbiology and Infectious Disease se demostró que las bacterias captan e incorporan a su genoma los genes de resistencia de otras bacterias que liberan su ADN al morir, proceso al que llamaron «transformación natural».
La creciente resistencia a los antibióticos en los últimos años se debe al mal uso y abuso de los mismos, representando un problema que de no combatirse a tiempo puede comprometer la vida de generaciones futuras. Se estima que para 2050 ocurrirán 10 millones de muertes anuales3. Debido a esta situación, en México el 27 de mayo de 2010 se publicó en el Diario Oficial de la Federación la Ley «para que únicamente se administren antibióticos cuando estos sean prescritos mediante receta emitida por los profesionales de la salud autorizados por ley, a fin de controlar su uso y abuso y limitar las consecuencias negativas de una prescripción inadecuada y contribuir a preservar la salud de los mexicanos»4. Sin embargo, aun limitando el uso inapropiado de los antibióticos, la resistencia seguirá ocurriendo, aunque con menor frecuencia. Es importante mencionar que el uso inapropiado de los antibióticos también afecta la microbiota del organismo, que desempeña un papel muy importante para mantener las funciones del cuerpo humano. No hay que perder de vista que los antibióticos atacan por igual, tanto a la biota fisiológica como a los microorganismos en la enfermedad.
La resistencia antimicrobiana no solo afecta directamente al usarse en tratamientos para enfermedades, también encontramos uso de antibióticos en la agricultura y la ganadería; la calidad en la manufactura de los medicamentos y la inestabilidad del medio ambiente, todos estos factores afectan a la salud de una manera indirecta4. Por estas razones es importante crear conciencia del problema actual que se está desarrollando continuamente, ya que es uno de los retos más importantes de la salud pública, como se mencionó antes, y debe ser atendido para no tener repercusiones mucho más graves en las siguientes generaciones.
El objetivo de esta revisión es mostrar el impacto que tiene la resistencia antimicrobiana en la gastroenterología, mencionando los patógenos que han desarrollado resistencia a antibióticos específicos, las posibles causas de esta y cómo está afectando a quienes padecen enfermedades infecciosas, así como los retos a los que se enfrenta todo el personal de salud para tratar dichas infecciones.
Helicobacter pyloriLa infección por Helicobacter pylori (Hp) es una de las más prevalentes a nivel mundial; se estima que un 80% de la población ha sido infectada por este microorganismo, principalmente en países en vías de desarrollo. Es importante erradicarla, ya que desde 1994 fue catalogado como cancerígeno tipo 1 por la Organización Mundial de la Salud5. Se relaciona con cáncer gástrico y con otras enfermedades como linfoma de tejido linfoide asociado a mucosas, enfermedad ulcerosa péptica y gastritis crónica. Para que un esquema de tratamiento se considere efectivo debe presentar el 80% de éxito en la erradicación, la cual en los últimos años se ha visto afectada por la resistencia a los antibióticos. El iv consenso mexicano sobre Hp establece que la triple terapia de erradicación con amoxicilina, claritromicina y un inhibidor de la bomba de protones (IBP) ya no debe ser considerada la primera línea de tratamiento; propone 2 opciones de tratamiento: la terapia cuádruple con bismuto (IBP, subcitrato de bismuto, tetraciclina y metronidazol) y la terapia cuádruple sin bismuto (IBP, amoxicilina, claritromicina y metronidazol)6.
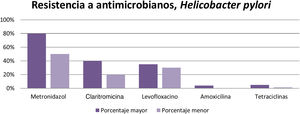
Se hizo un estudio en México por Cano Contreras et al. en el que se evalúo el conocimiento de los médicos generales sobre el diagnóstico y tratamiento de Hp. Los resultados demuestran que 31% de los médicos utilizan más de una prueba para el diagnóstico, y la más utilizada es la prueba serológica. El esquema de tratamiento más empleado es el de claritromicina más amoxicilina (63.8%) y en segundo lugar el de metronidazol más tetraciclina (16%), por lo cual es importante reconocer la resistencia que presentan los antibióticos y así prescribir el esquema más adecuado para lograr la erradicación de la infección7 (fig. 1).
En un estudio realizado en México en el Centro Médico Issemym se dieron los siguientes resultados: el triple esquema convencional (amoxicilina 1g bid cada 12horas, claritromicina 500mg bid cada 12horas e IBP: omeprazol 20mg bid cada 12 horas por 14 días) tiene una frecuencia de erradicación del 65.50%, el esquema cuádruple (tetraciclina 500mg qid cada 6horas, metronidazol 500mg bid cada 12horas, subsalicilato de bismuto 525mg qid cada 6horas y omeprazol 20mg bid cada 12horas por 14 días) erradicó la infección en un 45.45%, para una erradicación total del 67.70%8 (fig. 2).
En México Ladrón de Guevara et al. compararon el esquema basado en levofloxacina (levofloxacina 500mg, pantoprazol 80mg y azitromicina 500mg) contra la triple terapia estándar (claritromicina 500mg bid cada 12horas, lansoprazol 30mg y amoxicilina 1g), ambos dados por 10 días. Los resultados que obtuvieron: la tasa de erradicación del tratamiento con levofloxacino fue del 63% y la de la triple terapia estándar del 58.5%. La resistencia a la claritromicina fue del 28.2% y los eventos adversos fueron mayores en el grupo tratado con la triple terapia estándar9.
Otro estudio publicado por Selgrad et al. comparó la resistencia antibiótica de acuerdo con cuántos esquemas de tratamientos recibieron los pacientes para erradicar la infección. Los resultados generales son los siguientes: de 66 pacientes ninguno demostró resistencia a amoxicilina y a las tetraciclinas, 34 pacientes (51.5%) tuvieron resistencia a metronidazol, 29 pacientes (43.9%) a la claritromicina, 15 pacientes (22.7%) al levofloxacino y 3 pacientes (4.5%) a la rifabutina. En aquellos que estaban recibiendo por primera vez terapia antibiótica los resultados tuvieron algunas variaciones: de 29 pacientes el 6.9% tuvo resistencia a claritromicina, 17.2% a metronidazol y 13.8% a levofloxacino. Los pacientes que ya habían recibido terapia una vez: de 13 pacientes el 69.2% demostró resistencia a metronidazol, el 53.8% a claritromicina y 23.1% a levofloxacino. Hubo 24 pacientes que ya se habían tratado con antibióticos 2 veces o más y la resistencia aumenta considerablemente, el 83.3% a claritromicina y metronidazol, el 33.3% a levofloxacino y el 12.5% a rifabutina10.
Un estudio realizado por Silveira Vianna et al. investigó la resistencia antimicrobiana, dando importancia a las distintas mutaciones de Hp; cagA, 23S rRNA, gyrA. De las 80 muestras que recabaron para el estudio 7 presentaron mutaciones en 23S rRNA, relacionada con la resistencia a claritromicina (8.7%). En 18 muestras se encontraron mutaciones en gyrA relacionada con la resistencia a levofloxacino (22.5%)11.
Mascellino et al. publicaron un estudio realizado en pacientes con gastritis, estudiando la resistencia a los siguientes antibióticos: metronidazol, levofloxacino, tetraciclina, claritromicina y amoxicilina. Se tomaron en cuenta otros factores ambientales de cada persona como el consumo de alcohol, tabaco y uso de antiinflamatorios no esteroideos (AINE), entre otros. Posterior a corroborar que tuvieran la infección por Hp se les dio tratamiento, mostrando los siguientes resultados: de 30 pacientes la resistencia a claritromicina fue del 50%, al metronidazol del 68%, la amoxicilina fue el más efectivo, ya que solo presentó una resistencia del 4% y la tetraciclina de 6%; para el levofloxacino la resistencia fue del 25%12.
Se evaluó la resistencia a antibióticos en América Latina por Camargo et al. y se obtuvieron los siguientes resultados: 12% de resistencia a claritromicina, 53% a metronidazol, 4% a amoxicilina, 6% a tetraciclina, 3% a furazolidona, 15% a fluoroquinolonas y 8% a terapia dual con claritromicina y metronidazol13.
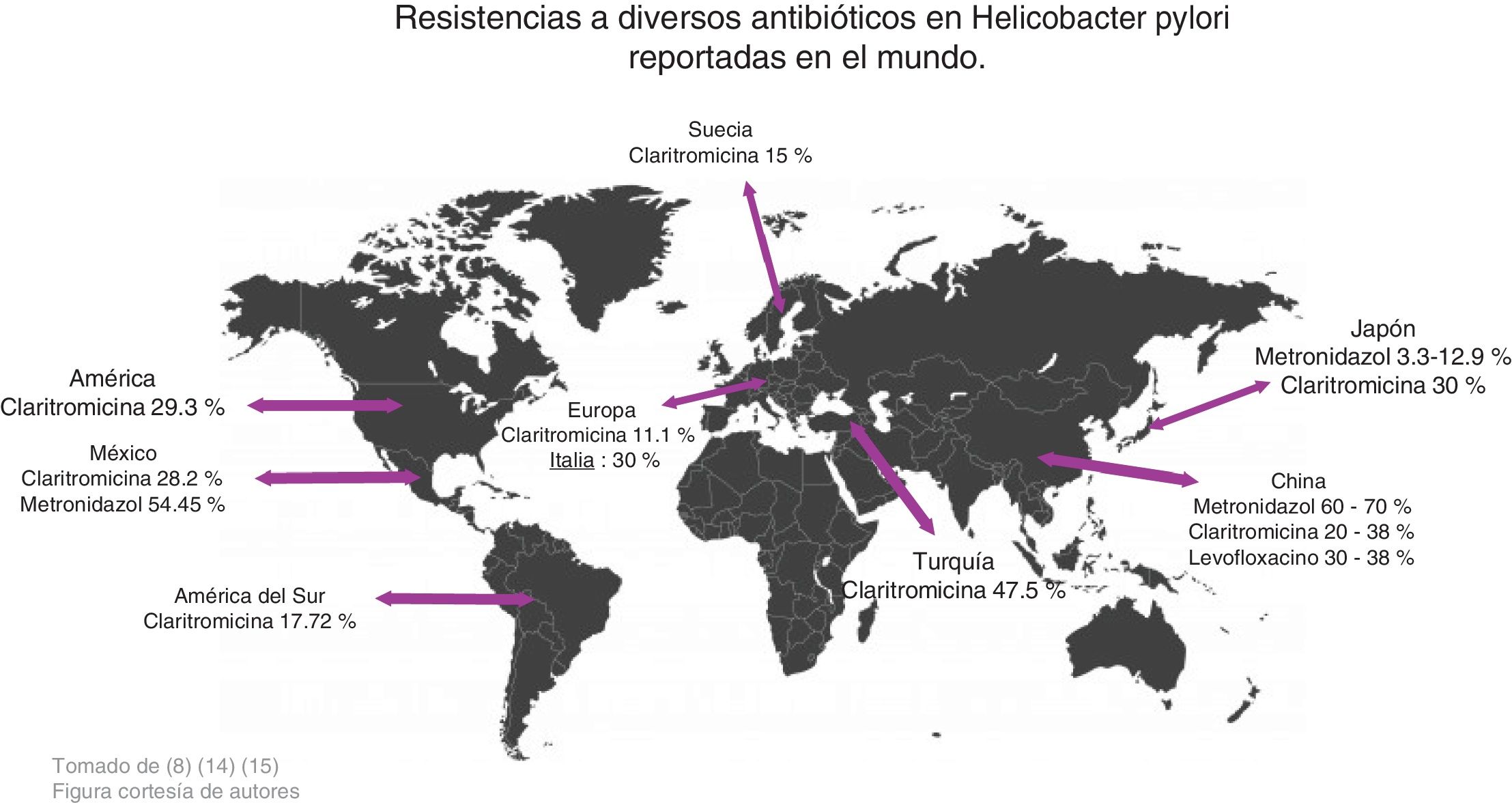
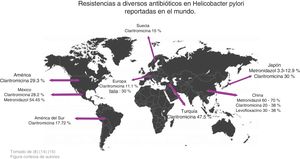
Zhang realizó un estudio comparando la resistencia antimicrobiana en distintos lugares en el mundo, y encontró los siguientes datos: en China el metronidazol tiene una resistencia del 60-70%, la claritromicina del 20-38%, el levofloxacino del 30-38%, mientras que la amoxicilina, la furazolidona y la tetraciclina mantienen porcentajes muy bajos, entre el 1-5% de resistencia. Respecto a la claritromicina el porcentaje de resistencia en América es del 29.3%, en Europa del 11.1%, en Turquía del 47.5% y en América del Sur del 17.72%. La resistencia al metronidazol en China va desde el 75.6% hasta el 95.4% en algunas regiones, en Japón es muy bajo, del 3.3% al 12.9%. La resistencia aumentó cuando se evaluó la resistencia a una terapia con más de un antibiótico; en general la resistencia es del 34.5%, para la combinación de levofloxacino con metronidazol fue del 16.9% y para la claritromicina con metronidazol fue del 7%14 (fig. 2).
Un estudio realizado por Malfertheiner et al. reporta que la resistencia a claritromicina es del 30% en Italia y Japón, del 40% en Turquía, del 50% en China y del 15% en Taiwán y Suecia; por lo tanto, proponen que cuando la resistencia a claritromicina sea>15% no se administre la triple terapia convencional en dichas regiones. En su lugar recomiendan la terapia cuádruple con bismuto y sin bismuto por 14 días para aumentar su eficacia15 (fig. 2).
Se puede concluir, de acuerdo con los resultados obtenidos, que la resistencia al metronidazol (50-80%), claritromicina (20-40%) y levofloxacino (30-35%) es elevada en distintas partes del mundo, por lo que al querer erradicar la infección resulta ineficiente. En cambio, la amoxicilina (4%), la furazolidona (1-5%) y las tetraciclinas (1-5%) tienen un bajo porcentaje de resistencia, por lo tanto pueden seguirse utilizando para erradicar esta infección que afecta a gran parte de la población en el mundo (fig. 3).
Clostridioides difficileClostridioides difficile (Cd), anteriormente denominado Clostridium difficile, es un bacilo grampositivo que en los últimos años se ha convertido en uno de los principales patógenos que infectan el tracto gastrointestinal en el ambiente hospitalario. Es el agente causal del 15-25% de los casos de diarrea asociada a antibióticos, del 50-75% de colitis asociada a antibióticos y del 90-100% de colitis pseudomembranosa asociada a antibióticos. Los principales factores de riesgo para adquirir la infección incluyen la edad avanzada en conjunto con hospitalización prolongada16, el uso de bloqueadores H2, el uso previo de cefalosporinas y fluoroquinolonas, la estancia en la unidad de terapia intensiva y el empleo de antibióticos antes del diagnóstico17. Se ha reportado como factor de riesgo la insuficiencia renal crónica, ya que son más susceptibles a infecciones y a complicaciones18. Morfin-Otero et al. investigaron la asociación de Cd en pacientes quirúrgicos en México. La mayoría de los casos con esta infección se obtuvo en los servicios de neurocirugía, cirugía cardiaca, ortopedia y cirugía general, el 53% de los casos fueron asociados con la cepa Cd NAP1/027, los factores en común de estos pacientes fueron leucocitosis (>12,000cél./mm), albúmina<3g/dl, la hospitalización mayor a 7 días en las últimas 12 semanas, el uso de inmunosupresores y antibióticos (meropenem y fluconazol)19.
Un estudio realizado por Rodríguez et al. reportó que al encontrar la cepa NAP/BI/027 de Cd hubo un aumento en el número de casos, los cuales fueron tratados con ceftriaxona (70.3%), con vancomicina oral y metronidazol intravenoso (44.4%) y solo con vancomicina oral (37%). El 77.7% de pacientes tuvo cura clínica, el 14.8% murió y el 7.4% desarrolló infección recurrente. Sin embargo no hubo incremento en las complicaciones asociadas con esta cepa, como se reporta en distintos artículos20.
El tratamiento de esta infección se basa en retirar el antibiótico precipitante e implementar medidas para corregir el desbalance hidroelectrolítico. Posteriormente se debe administrar antibiótico para erradicar la infección; está indicado el uso de metronidazol vía oral 500mg cada 8horas por 10 a 14 días en un cuadro leve; vancomicina vía oral 125mg cada 6horas por 10 a 14 días en un cuadro severo; la combinación de ambos antibióticos se prescribirá ante un cuadro severo y complicado21.
En el consenso sobre prevención, diagnóstico y tratamiento de la infección por Cd realizado por Abreu y Abreu et al. indican que una vez hecho el diagnóstico se debe retirar todo tratamiento antimicrobiano; el tratamiento médico se indicará solo ante la presencia de síntomas: en la infección leve-moderada se recomienda vancomicina 125mg cada 6horas (alternativo: metronidazol), en la infección grave se emplea vancomicina por 14 días y en la grave complicada se deberá emplear vancomicina oral asociada a metronidazol vía intravenosa. Ante la primera recurrencia si el paciente fue tratado con metronidazol se cambia por vancomicina, si recibió vancomicina como primer tratamiento se vuelve a tratar con vancomicina con dosis decrecientes y pulsos al final. El trasplante de microbiota fecal es una opción segura y efectiva en pacientes con 2 recurrencias o episodios graves con fallo en el tratamiento22. Es importante reconocer que un 28-30% de los pacientes tendrá una recurrencia, requiriendo nuevamente tratamiento antibiótico, una alternativa es administrar rifaximina 400mg 3 veces al día por 20 días después de completar en retratamiento con vancomicina vía oral23.
Se estudió el efecto inhibitorio de la fidaxomicina en la biopelícula del Cd por Masakaze et al., y encontraron que su efecto es dosis dependiente, al contrario de la vancomicina, que no tiene este mecanismo de acción24. Srisharan comparó los distintos antimicrobianos utilizados en esta infección, reporta que el teicoplanina y fidaxomicina son superiores que la vancomicina, metronidazol y ácido fusídico25.
Un estudio realizado por Johnson et al. comparó la efectividad de los tratamientos con vancomicina y metronidazol en la infección por Cd; obtuvieron los siguientes resultados: el éxito de los pacientes tratados con metronidazol fue del 66.3%, mientras que los tratados con vancomicina tuvieron un 78.5% de éxito26.
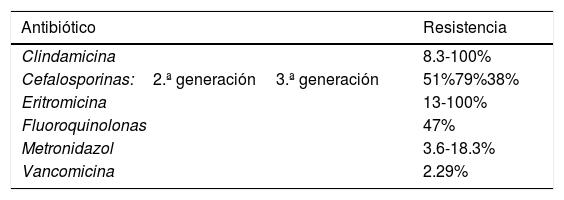
El trabajo de investigación realizado por Peng et al. hace énfasis en la formación de esporas que caracteriza al Cd; estas esporas sobreviven a algunos antibióticos, entre el año 2012 y 2015 se reveló que la resistencia a la clindamicina es de 8.3% a 100%, a las cefalosporinas de manera general es de 51%, a las cefalosporinas de segunda generación, como cefotetán y cefoxitina es del 79% y a las cefalosporinas de tercera generación como ceftriaxona y cefotaxima es del 38%; a la eritromicina del 13% al 100% y a las fluoroquinolonas del 47% (tabla 1). Respecto a la primera línea de tratamiento para esta infección metronidazol y vancomicina reportan distintos grados de resistencia en el mundo. En Europa se reporta una resistencia al metronidazol del 0.11%, en Irán del 5.3%, en China del 15.6%, en Israel del 18.3% y en Estados Unidos del 3.6%. En cuanto a la vancomicina la resistencia reportada es la siguiente: en Israel del 47% y en Europa del 2.29%. Por último reporta ciertos grados de resistencia a otras alternativas de tratamiento, para la rifampicina la resistencia fue del 57% en países como Italia, República Checa, Dinamarca y Hungría, en Norte América se reportó un grado menor, del 7.9%; para las tetraciclinas se reportó un porcentaje de resistencia del 2.4% al 41.67% y de cloranfenicol un 3.7%27.
Un estudio realizado por Martínez et al. reporta 2 ribotipos muy resistentes a los antimicrobianos, el 027 y 001; se encontró una susceptibilidad reducida a vancomicina (40.3%) y a fidaxomicina (3.2%)28.
A pesar de los grados de resistencia en los antibióticos de primera línea para tratar esta infección (metronidazol con un 3.6-18.3% y vancomicina con 2.29%) son los que mejores tasas de éxito demuestran en cuanto a erradicación de Cd, sin embargo no hay que perder de vista que la resistencia va en aumento en distintos lugares el mundo, por lo que la elección del tratamiento debe hacerse de acuerdo a la zona geográfica y su relación con la resistencia.
Campylobacter jejuni y Campylobacter coliEstos microorganismos han adquirido gran importancia en la salud pública, ya que causan diarrea infecciosa en el ser humano. Campylobacter jejuni (Cj) es la que se ha aislado con mayor frecuencia en países en vías de desarrollo y en desarrollados. Campylobacter coli (Cc) se ha aislado en el 25% de los casos de diarrea infecciosa en Sudamérica. El tratamiento de elección para esta infección es la eritromicina y las fluoroquinolonas.
Un estudio realizado por Simaluiza et al. demostró el grado de resistencia a distintos antibióticos para Cj y Cc; en cuanto a gentamicina y amoxicilina con ácido clavulánico ambas cepas fueron susceptibles en todos los casos; un 7.7% de Cj fue resistente a ampicilina; se encontró una alta resistencia a ciprofloxacina, de 76.9% en Cj y 100% en Cc; por último al administrar eritromicina se encontró un grado menor de resistencia para Cj de 7.7% y para Cc de 33.2%29.
Se ha estudiado que la resistencia a las fluoroquinolonas tiene relación con la ingesta de productos de origen animal, ya que son reservorios de este microorganismo y a la vez este medicamento tiene uso veterinario. Fernández et al. estudiaron los distintos grados de resistencia en América del Sur, los resultados son los siguientes: en Chile se reportó una resistencia a ciprofloxacino del 50% en Cj, en Argentina se reportó un 59.9% en Cj y un 49.1% en Cc a ciprofloxacino y norfloxacino, en Perú existe un 89.9% de resistencia a ciprofloxacino en Cj, en Brasil se reporta una resistencia del 25% a norfloxacino y un 18.2% a ciprofloxacino y en México se encontró un 58.2% de resistencia a ciprofloxacino en Cj30.
La resistencia a las fluoroquinolonas (85-100%) es muy alta en países de Latinoamérica, como se reporta en ambos estudios mencionados anteriormente, por lo tanto será más eficaz el tratamiento con otros antibióticos como amoxicilina con ácido clavulánico y eritromicina (7.7-36%), ambos reportando susceptibilidad eficiente y bajos grados de resistencia respectivamente.
Escherichia coliEscherichia coli (Ec) es el responsable de las diarreas agudas en países en vías de desarrollo, donde la falta de higiene y el poco acceso a la sanidad básica se hacen presentes. Afecta principalmente a niños y se estima que es la causa del 10% de las muertes en menores de 5 años.
Se han identificado distintos patotipos de Ec, los más comunes son la E. coli enterotoxigénica (ETEC), que provoca una diarrea acuosa, coloniza el epitelio del intestino delgado y produce enterotoxinas que interfieren con los procesos de absorción y secreción intestinal. Por otro lado, la E. coli enteropatogénica (EPEC) provoca lesiones distintivas en el epitelio intestinal (adhesión y eliminación), destruyendo las microvellosidades y generando también una diarrea acuosa. El tratamiento para esta infección se basa en hidratación y uso de antibióticos, sin embargo esto último depende de distintos factores como el grado de severidad del cuadro, las condiciones inmunológicas del paciente y la transmisión de la infección. La resistencia a los antibióticos utilizados ha aumentado en los últimos años como en el resto de las infecciones.
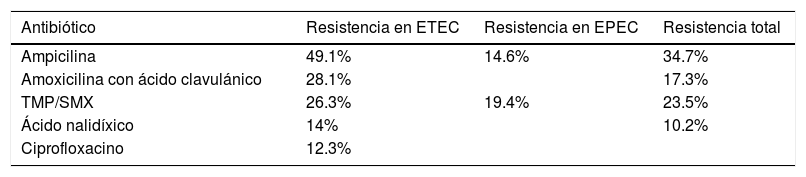
Un estudio realizado por Oliveira et al. indagó acerca de los grados de resistencia en distintos antibióticos utilizados para la infección por Ec. En las infecciones por ETEC ampicilina mostró una resistencia de 49.1%, amoxicilina con ácido clavulánico 28.1%, trimetoprim con sulfametoxazol 26.3%, ácido nalidíxico 14% y ciprofloxacino 12.3%. En las infecciones causadas por EPEC los porcentajes más altos de resistencia fueron observados con el uso de trimetoprim con sulfametoxazol con 19.4% y ampicilina con 14.6%. De manera general, considerando todas las muestras, la resistencia reportada fue la siguiente: ampicilina con 34.7%, trimetoprim con sulfametoxazol 23.5%, amoxicilina con ácido clavulánico 17.3% y ácido nalidíxico 10.2%. Todas las muestras fueron susceptibles a cefotaxima y ceftriaxona31 (tabla 2).
Resistencia a antibióticos en Escherichia coli
| Antibiótico | Resistencia en ETEC | Resistencia en EPEC | Resistencia total |
|---|---|---|---|
| Ampicilina | 49.1% | 14.6% | 34.7% |
| Amoxicilina con ácido clavulánico | 28.1% | 17.3% | |
| TMP/SMX | 26.3% | 19.4% | 23.5% |
| Ácido nalidíxico | 14% | 10.2% | |
| Ciprofloxacino | 12.3% |
ECEP: Escherichia coli enteropatogénica; ECET: Escherichia coli enterotoxigénica; TMP/SMX: trimetoprim con sulfametoxazol.
Otro estudio realizado por Uddin Rasheed et al. demostró resistencia a diferentes antibióticos: ampicilina y amoxicilina 13.3%, tetraciclinas 12.6%, trimetoprim con sulfametoxazol 11.3%, estreptomicina 8%, ciprofloxacino y ofloxacino 6.6%, cefotaxima 5.3% y gentamicina en el 4.6%32.
Miranda et al. estudiaron la contaminación de Ec en alimentos y su resistencia a antibióticos. Los alimentos que reportaron mayores niveles de contaminación fueron los vegetales y la carne de ave. Las resistencias reportadas fueron para ampicilina 76.5%, doxiciclina 56.3%, sulfisoxazol y ciprofloxacino 77.3% y cloranfenicol 58%33.
La ampicilina ya no es un antibiótico útil para erradicar la Ec, su resistencia va de 13.3-76.5%, se sugiere utilizar antibióticos con menor grado resistencia como ciprofloxacino (6.6-12.3%), amoxicilina (13.3-28.1%), cefotaxima (5.3%) o gentamicina (4.6%).
Blastocystis sp.El Blastocystis sp. (Bs) es un parásito protozoario de distribución mundial; más de un billón de personas albergan este organismo y existe una mayor prevalencia en países en vías de desarrollo que en países desarrollados. Produce una serie de síntomas gastrointestinales inespecíficos como diarrea, flatulencias, cólicos abdominales e incluso anemia por deficiencia de hierro y urticaria34. El tratamiento de primera línea empleado en esta infección es el metronidazol con dosis de 250-800mg, 3 veces al día por 10 días. En pacientes pediátricos la dosis se pondera por kg de peso 20-30mg/kg/día35.
Un estudio realizado por Rajamanikam et al. reporta ciertos grados de resistencia constante a diferentes dosis de metronidazol en cultivos de Bs36.
Batista et al. demostraron la baja eficacia del metronidazol en la erradicación de Bs, el 79.5% de los tratados tuvo respuesta clínica y el 48.4% respuesta microbiológica. La respuesta al metronidazol es variable37.
Entamoeba histolyticaEntamoeba histolytica (Eh) es un protozoo de distribución mundial, y afecta particularmente a países en vías de desarrollo, infecta aproximadamente a 500 millones de personas y anualmente causa 110,000 muertes por complicaciones; esto le confiere el tercer lugar en cuanto a las parasitosis que causan mortalidad38. Del total de personas que adquieren la infección hasta un 90% pueden cursar asintomáticos. Algunos factores que favorecen su transmisión son la pobreza, la sobrepoblación, la falta de higiene y la malnutrición39. Se han identificado 2 cepas: E. histolytica patogénica y E. dispar no patogénica. Esta última es responsable de infecciones asintomáticas y no requiere tratamiento antimicrobiano. En cambio, la E. histolytica patogénica sí requiere tratamiento antimicrobiano y puede causar colitis fulminantes con manifestaciones que pueden incluir síndrome disentérico, megacolon tóxico y peritonitis. De manera extraintestinal se relaciona con el absceso hepático o amebiasis hepática40.
Dar tratamiento incluso a las infecciones asintomáticas puede llevar al aumento de la resistencia antimicrobiana. El tratamiento de primera elección es el metronidazol, también se puede utilizar el tinidazol, secnidazol y ornidazol.
Estudios recientes han demostrado diferencias en la sensibilidad de la Eh a distintos medicamentos, demostrando que existe un pequeño porcentaje de resistencia a ciertos antimicrobianos41.
Bansal et al. compararon distintos estudios acerca de la susceptibilidad in vitro a antimicrobianos usados contra la Eh obteniendo distintos resultados. Se reporta una concentración mínima inhibitoria en un rango de 12.5-15μm de metronidazol, otro estudio reporta que el 50% de la concentración mínima inhibitoria al metronidazol es de 18.47μm para los cultivos más susceptibles, hasta>30μm como valor de corte para la resistencia. También se han reportado mayores concentraciones mínimas inhibitorias hacia cloroquina, tinidazol y emetina42.
Wassmann et al. realizaron cultivos in vitro de Eh evaluando su susceptibilidad al metronidazol; en el cultivo con 5-7% de oxígeno la concentración de 12μm de metronidazol eliminó el 50% de las células a las 24horas y a las 72horas eliminó todas las células. En cambio, aquellos cultivos anaerobios demostraron tener menor susceptibilidad al metronidazol, con la misma dosis solo el 28% de las células fueron eliminadas en las primeras 24horas y a las 72horas solo llegó al 50%43.
Rossignol et al. estudiaron el efecto de la nitazoxanida en la infección por Eh y obtuvieron los siguientes resultados: hubo un 94% de respuesta clínica y repuesta microbiológica, solo un paciente (2%) mostró reinfección al día 14 de acuerdo a la muestra de materia fecal44.
La resistencia al metronidazol en amebiasis intestinal aún reporta una baja resistencia, sin embargo, en ciertos lugares puede llegar a ser del 50%, por lo que es recomendable tener tratamientos alternativos como la nitazoxanida, que reporta buenos resultados y el tiempo de administración es menor (3 días) que el usado en el metronidazol (7 días).
Peritonitis bacterianaLa peritonitis bacteriana espontánea es la complicación infecciosa más frecuente en pacientes cirróticos, causando una mortalidad del 32%. Actualmente se han observado algunas variaciones en la microbiota intestinal de estos pacientes y ha aumentado la prevalencia de estas infecciones. El frecuente uso de quinolonas como profilaxis en la peritonitis bacteriana, más las modificaciones antes mencionadas, ha llevado al desarrollo de resistencia bacteriana.
El uso de cefalosporinas de tercera generación se ha implementado como tratamiento empírico para tratar la peritonitis bacteriana45. Alves de Mattos et al. estudiaron la eficacia de distintos antimicrobianos para tatar la peritonitis bacteriana, haciendo énfasis en el origen de la infección, ya sea adquirida en la comunidad o nosocomial. En las infecciones de origen nosocomial las terapias clásicas recomendadas solo tienen eficacia en un 40% de los casos. La completa resolución de las infecciones ocasionadas por bacterias multirresistentes ocurre en un 72% de los casos y las infecciones ocasionadas por otro tipo de bacterias se resuelven en el 90% de los casos. Para las infecciones adquiridas en la comunidad sugieren el uso de betalactámicos como primera elección, en caso de no obtener respuesta favorable a las 48horas se opta por el uso de carbapenémicos y piperacilina-tazobactam; en infecciones de origen nosocomial se recomienda su uso como primera elección46.
Lutz et al. estudiaron la resistencia antimicrobiana en peritonitis bacteriana de origen nosocomial y obtuvieron los siguientes resultados: los gérmenes cultivados fueron E. coli (14% vs. 11%), Klebsiella species (14% vs. 8%), enterococci (14% vs. 5%) y streptococci (10% vs. 6%), el primer porcentaje corresponde a peritonitis asociada al cuidado sanitario y el segundo a la nosocomial. La resistencia a antibióticos varía de acuerdo a la etiología, el primer porcentaje corresponde a las asociadas al cuidado sanitario y el segundo a nosocomiales: quinolonas 50% vs. 18%, piperacilina-tazobactam 30% vs. 11% y cefalosporinas de tercera generación 30% vs. 33%. Los únicos microorganismos que no fueron sensibles a la terapia con carbapenémicos son el Enterococcus faecium y Candida albicans en peritonitis bacteriana de origen nosocomial47.
Fiore et al. realizaron una revisión acerca del tratamiento para la peritonitis bacteriana de origen nosocomial causada por patógenos multirresistentes. Los resultados que se obtuvieron fueron que la etiología por bacterias grampositivas ha aumentado de 29.3% a 62.5%48, solo el 60% de las bacterias gramnegativas fueron susceptibles a las cefalosporinas de tercera generación. Enterococci (24%) y staphylococci (19%) son las bacterias grampositivas que más comúnmente han sido cultivadas49. La prevalencia de Staphylococcus aureus resistente a meticilina es de 85.7%, la resistencia del Enterococcus spp. a ampicilina va de 37.5% a 75%, la prevalencia de Enterobacteriaceae es desde 28% hasta 51.2% y de E. coli de 66.7%, ambas asociadas a betalactamasa de espectro extendido50.
Es muy importante determinar la etiología de las peritonitis bacterianas, ya que de esto depende su tratamiento y la eficacia del mismo, la resistencia a distintos antibióticos como cefalosporinas de tercera generación (40%), quinolonas (50%) y meticilina (85%) es mayor en infecciones de origen nosocomial que en las adquiridas en la comunidad. Se recomienda establecer una terapia antibiótica empírica con altas dosis de daptomicina 8-12mg/kg/24horas más meropenem 1g cada 8horas más un betalactámico activo contra Staphylococcus aureus resistente a meticilina51.
ConclusionesDe acuerdo con esta revisión narrativa se concluye que los microorganismos que demostraron mayor porcentaje de resistencia son Helicobacter pylori con grados de resistencia a metronidazol de 50-80%, a claritromicina de 20-40% y levofloxacino de 30-35%; Clostridioides difficile a clindamicina de 8.3-100% y a cefalosporinas de 51%; Campylobacter jejuni y coli a fluoroquinolonas de 85%; Escherichia coli a ampicilina de 76.5%; Entamoeba histolytica a metronidazol de 50% y peritonitis bacteriana a cefalosporinas de tercera generación de 40% y meticilina de 85%.
La resistencia a los antimicrobianos en los últimos años ha aumentado exponencialmente, y cada vez son menos los antibióticos que tienen eficacia frente a infecciones del tracto digestivo (fig. 4). Se requiere un análisis continuo de los pacientes infectados, evitando así el fracaso al tratamiento, disminuyendo la exposición innecesaria a antibióticos, y por ende la resistencia a los mismos.
Para preservar el uso y funcionamiento adecuado de los antibióticos en el futuro es necesario crear nuevos medicamentos que sean útiles contra los microorganismos ya resistentes, y lograr que la resistencia antimicrobiana disminuya la velocidad con la que se está presentando. Es indispensable que de forma continua se realicen actualizaciones en las guías de tratamiento, haciendo énfasis en la correcta prescripción de antibióticos y puntualizando los criterios específicos para hacerlo.
El uso correcto de los antibióticos siempre permitirá tratar de manera adecuada las infecciones gastrointestinales, reduciendo el impacto en la microbiota, con el mínimo de efectos adversos y disminuyendo así la resistencia antimicrobiana.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.