El esófago de Barrett es una condición que predispone al adenocarcinoma esofágico. Nuestro objetivo fue establecer la prevalencia de esófago de Barrett en nuestro centro, así como los factores asociados a esta condición.
Material y métodosEvaluamos retrospectivamente los reportes de 500 endoscopias superiores de pacientes ambulatorios de nuestro Servicio de Gastroenterología entre noviembre del 2014 y abril del 2016. Se determinó la prevalencia de esófago de Barrett y se analizaron los datos demográficos, clínicos y endoscópicos asociados a esta patología.
ResultadosLa prevalencia de esófago de Barrett fue del 1.8%. La edad media en los pacientes con esófago de Barrett fue de 58.7 años (rango: 45-70), con predominancia del sexo masculino (66%). En el subgrupo de pacientes con síntomas de reflujo gastroesofágico (n=125) la prevalencia de esófago de Barrett fue del 7.2%. En el análisis multivariado los factores asociados a esófago de Barrett de forma independiente fueron: síntomas de reflujo gastroesofágico (p=0.005) y hernia hiatal (p=0.006).
ConclusiónLa prevalencia global de esófago de Barrett es del 1.8% en nuestra población, con una prevalencia del 7.2% en pacientes con síntomas de reflujo gastroesofágico.
Barrett's esophagus is a condition that predisposes to esophageal adenocarcinoma. Our aim was to establish the prevalence of Barrett's esophagus at our center, as well as determine its associated factors.
Materials and methodsWe retrospectively assessed the endoscopic reports of 500 outpatients seen at our Gastroenterology Service from November 2014 to April 2016. We determined the prevalence of Barrett's esophagus and analyzed the demographic, clinical, and endoscopic findings associated with that pathology.
ResultsThe prevalence of Barrett's esophagus was 1.8%. The mean age of the patients with Barrett's esophagus was 58.7 years (range: 45-70) and there was a predominance of men (66%). In the subgroup of patients with symptoms of gastroesophageal reflux (n=125), Barrett's esophagus prevalence was 7.2%. In the multivariate analysis, the factors that were independently associated with Barrett's esophagus were gastroesophageal reflux (P=.005) and hiatal hernia (P=.006).
ConclusionsThe overall prevalence of Barrett's esophagus was 1.8% in our population, with a prevalence of 7.2% in patients that had symptoms of gastroesophageal reflux.
El esófago de Barrett (EB) es una consecuencia de la enfermedad por reflujo gastroesofágico (ERGE) crónica que predispone al desarrollo de adenocarcinoma esofágico (ACE)1-4. El EB se define como la presencia de metaplasia columnar de por lo menos 1cm que sustituye al epitelio escamoso estratificado normal del esófago distal2. El incremento en la incidencia de ACE en las últimas décadas5,6, así como su mal pronóstico con supervivencia de 5 años <15%7, ha motivado la implementación de programas de cribado con el objetivo de detectar el ACE en etapas tempranas y mejorar la supervivencia8,9.
La prevalencia de EB es variable, según la población y la definición utilizada. En la población general, la prevalencia de EB es del 1.6%10, mientras que en la población con síntomas gastrointestinales se reportó desde el 2.411 al 4.4%12. En México, estudios realizados hace más de una década reportaron una prevalencia del 0.2613 al 9.2%14. Un estudio reciente de un centro de referencia en endoscopia en la Ciudad de México reportó una prevalencia de EB del 0.96%15. Sin embargo, estos estudios tienen una variación importante en su metodología para obtener biopsias. Por tanto, es necesario conocer la epidemiología de esta entidad basado en las definiciones de las guías actuales y recomendaciones2, para así establecer un plan de cribado y monitorización en nuestra población.
En este estudio observacional y descriptivo, nuestro objetivo principal fue determinar la prevalencia de EB en una población de pacientes ambulatorios atendidos en nuestra Clínica de Gastroenterología e identificar los factores de riesgo asociados con esta entidad.
Materiales y métodosLlevamos a cabo un estudio descriptivo y retrospectivo, revisando los registros médicos de pacientes vistos en la consulta externa del Servicio de Gastroenterología en el Hospital Universitario «Dr. José E. González» que se sometieron a endoscopia gastrointestinal superior entre noviembre del 2014 y abril del 2016. Se recolectó la información respecto a la edad, el sexo, la indicación endoscópica y los diagnósticos del estudio endoscópico de los pacientes. Todos los pacientes fueron sometidos a endoscopia de alta resolución con el endoscopio FUJI-EG-590ZW (Tokio, Japón).
Los casos con sospecha de EB se identificaron mediante la presencia de una mucosa color salmón de más de 1cm proximal a la unión gastroesofágica observada durante el estudio endoscópico. La unión gastroesofágica se definió como la región anatómica donde la extensión distal del esófago entra en contacto con el pliegue gástrico proximal2. El diagnóstico definitivo de EB se basó en la presencia de los hallazgos endoscópicos compatibles con el epitelio columnar en el esófago distal y se confirmó por la presencia de metaplasia intestinal especializada en las biopsias. Finalmente, el EB se caracterizó como segmento corto (< 3cm) o segmento largo (≥ 3cm)16.
Se obtuvieron biopsias en todos los casos con sospecha de EB, de acuerdo con el protocolo de Seattle17. También obtuvimos biopsias de las áreas con sospecha de displasia, siguiendo las guías actuales2. El diagnóstico definitivo de EB se confirmó sobre la base de los reportes histopatológicos. El mismo patólogo gastrointestinal analizó las muestras histopatológicas. En los casos de EB con displasia de cualquier grado, se consultó a un segundo patólogo para el diagnóstico definitivo.
Además, se determinó la presencia de esofagitis, la cual se calificó utilizando la clasificación de Los Ángeles18. Se estableció endoscópicamente la presencia de una hernia hiatal al observar la discordancia entre el pinzamiento diafragmático y la unión gastroesofágica19. La presencia de síntomas de reflujo gastroesofágico se definió como acidez y regurgitación dentro de los últimos 3 meses.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS Statistics Versión 20.0 (IBM Corp, Armonk, NY, EE. UU.). Analizamos las características basales de los pacientes a través de estadística descriptiva (valores absolutos, porcentajes, promedios y desviación estándar). Determinamos la distribución de las variables con la prueba de Kolmogorov-Smirnov. En los análisis comparativos, utilizamos la prueba de la χ2 para las variables categóricas y la prueba de la t de Student para las variables continuas. Se realizó un análisis multivariado para determinar las variables asociadas independientemente con el riesgo de EB. Determinamos la razón de momios y el intervalo de confianza del 95% de las variables de interés. Se consideró estadísticamente significativo un valor p<0.05.
ResultadosAnalizamos a un total de 500 pacientes, de los cuales 312 eran mujeres (62.4%) y 188 eran hombres (37.6%), con una edad promedio de 54±16.5 años. Las indicaciones principales para la endoscopia gastrointestinal superior fueron dispepsia en 131 pacientes (26.2%), síntomas de reflujo gastroesofágico en 125 (25%), anemia inexplicable en 62 (12.4%), disfagia en 52 (10.4%) y pérdida de peso en 45 (9%).
Los diagnósticos endoscópicos principales fueron: gastritis en 296 (59.2%), hernia hiatal en 83 (16.6%), duodenitis en 40 (8%), esofagitis en 38 (7.6%) (grado A: 23; grado B: 8; grado C: 2; grado D: 5), úlcera gástrica en 17 (3.4%), várices esofágicas en 11 (2.2%) y úlcera duodenal en 9 (1.8%). Dos pacientes presentaron un tumor esofágico con un diagnóstico histopatológico de ACE y carcinoma pobremente diferenciado.
Basado en los hallazgos endoscópicos, 15 pacientes (3%) se clasificaron como EB probable. De esos 15 pacientes, 9 se confirmaron histológicamente como EB (metaplasia intestinal especializada con la presencia de células caliciformes), conllevando una prevalencia total del 1.8%. De los 9 casos de EB, 6 se clasificaron como segmento largo y 3 como segmento corto. Únicamente un caso de los 9 pacientes con EB presentó displasia de alto grado (11.1%).
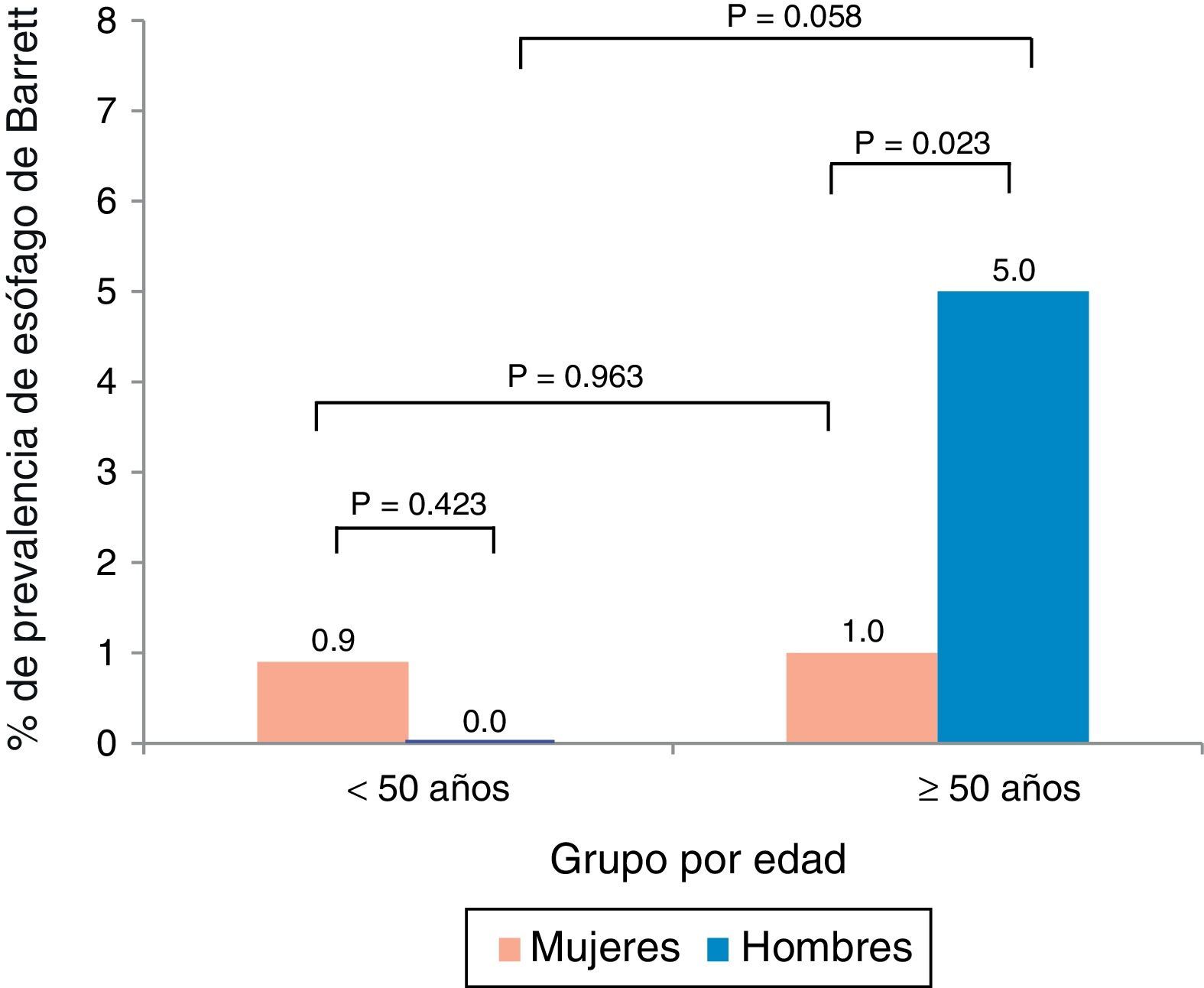
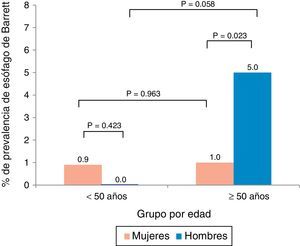
La edad promedio de los pacientes con EB fue de 58.7±7.5 años y hubo una predominancia de hombres (66%). El análisis por edad y sexo mostró que el EB fue más prevalente en hombres mayores a los 50 años de edad (fig. 1). Asimismo, la prevalencia de EB en el subgrupo de pacientes con síntomas de reflujo gastroesofágico (n=125) fue del 7.2%.
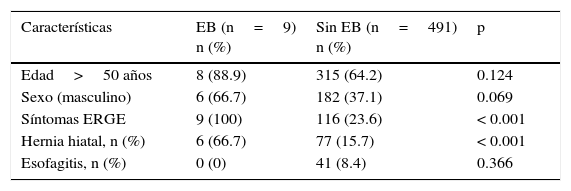
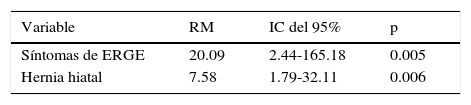
En el análisis univariado, la presencia de síntomas de reflujo gastroesofágico (p < 0.001) y hernia hiatal (p < 0.001) se asoció al EB (tabla 1). En el análisis multivariado, los síntomas de reflujo gastroesofágico y hernia hiatal permanecieron asociados, independientemente con la presencia de EB (tabla 2).
Características clínicas de los pacientes con esófago de Barrett
| Características | EB (n=9) n (%) | Sin EB (n=491) n (%) | p |
|---|---|---|---|
| Edad>50 años | 8 (88.9) | 315 (64.2) | 0.124 |
| Sexo (masculino) | 6 (66.7) | 182 (37.1) | 0.069 |
| Síntomas ERGE | 9 (100) | 116 (23.6) | < 0.001 |
| Hernia hiatal, n (%) | 6 (66.7) | 77 (15.7) | < 0.001 |
| Esofagitis, n (%) | 0 (0) | 41 (8.4) | 0.366 |
EB: esófago de Barrett; ERGE: enfermedad por reflujo gastroesofágico.
La actual prevalencia reportada de EB es variable, dependiendo de la población y la definición empleada2,20. La prevalencia que se observó en la población de nuestra Clínica de Gastroenterología fue del 1.8%. En la última década, nuestro estudio es el único que reporta sobre la prevalencia de EB en la población del noreste de México y encontramos que estaba de acuerdo con la prevalencia reportada a nivel mundial10.
En el 2008, Fan y Snyder realizaron un estudio retrospectivo en los Estados Unidos que evaluó los registros médicos y reportes endoscópicos de 4,500 pacientes. Reportaron una prevalencia de EB del 4.4% y del 1.5% en aquellos con y sin síntomas de reflujo gastroesofágico, respectivamente12. En México, la prevalencia de EB no es clara. Los datos que se reportaron hace más de una década varían ampliamente, con una prevalencia del 0.2613 al 9.2%14. En el estudio llevado a cabo por Pena Alfaro et al.13, el cual consideraba al EB como la presencia de metaplasia intestinal con células caliciformes, no especificaron qué tipo de protocolo de biopsia se utilizó. Trujillo-Benavides et al.14 basaron sus resultados en una población pequeña (n=109) y la metodología con la cual obtuvieron las biopsias fue también variable. Bernal-Mendez et al.15 presentaron un resumen en la Digestive Disease Week en el 2015. Revisaron 43,639 endoscopias de un centro de referencia de la Ciudad de México durante un periodo de 10 años, identificando a 420 pacientes con diagnóstico histológico de EB (9.6 casos/1,000 endoscopias), pero tampoco especificaron el protocolo de biopsia utilizado.
Hay controversia en cuanto al diagnóstico de EB, dado que la definición utilizada en Gran Bretaña20 establece solamente la presencia de metaplasia como una condición para el diagnóstico de EB, contrario a las guías norteamericanas, en las cuales se requiere de la presencia de metaplasia intestinal con células caliciformes para realizar el diagnóstico2.
Los síntomas de reflujo gastroesofágico se han identificado como el factor de riesgo principal asociado con el EB (RM: 12, IC del 95%: 7.64-18.7)21, con una alta prevalencia en la población mexicana (19.6-40%), comparado con reportes en los Estados Unidos (18.1-27.8%) y Europa (8.8-25.9%)22. En nuestro estudio, el 25% de los pacientes presentaron síntomas de reflujo gastroesofágico, el cual también fue el factor de riesgo principal asociado a EB (RM: 20.09, IC del 95%: 2.44-165.18). La prevalencia de EB en los pacientes con síntomas de reflujo gastroesofágico fue del 7.2%.
En relación con la ERGE, se ha observado que los pacientes con EB de segmento corto no presentan síntomas de reflujo gastroesofágico. Asimismo, hasta un 40% de pacientes con ACE no reportan un historial previo de ERGE23. Un estudio que utilizó la impedancia esofágica demostró un incremento en los episodios de reflujo con y sin acidez en los pacientes con EB de segmento corto y largo, comparado con individuos sanos24. En nuestro estudio, el 100% de los pacientes con EB de segmento corto y largo presentaron síntomas de reflujo. Sin embargo, un metaanálisis evaluando a 26 estudios mostró una asociación sintomática significativa con EB en aquellos pacientes con EB de segmento largo (RM: 4.92, IC del 95%: 2.01-12.0, p=0.30), pero no en aquellos con EB de segmento corto (RM: 1.15, IC del 95%: 0.763-1.73, p=0.84)25. En este aspecto, la exposición a la acidez en la parte más distal del esófago es una teoría propuesta para explicar el desarrollo de EB de segmento corto, un fenómeno demostrado en individuos sanos que no presentan evidencia endoscópica de esofagitis o de hernia hiatal26.
Las guías clínicas actuales recomiendan el cribado de los pacientes con ERGE crónica y factores de riesgo adicionales, como la obesidad, tabaquismo, edad>50 años, sexo masculino, etc.2. A lo largo de las últimas décadas, se ha implementado un plan de cribado y monitorización en los pacientes con ERGE en búsqueda de EB, con el propósito principal de prevenir la muerte por ACE, a través de la detección de neoplasia en etapa temprana27. Sin embargo, la calidad de la evidencia disponible sobre la efectividad de esta estrategia no es contundente8,9. Por otra parte, el incremento en la incidencia de ACE en las últimas décadas28, la baja incidencia de ACE en pacientes con EB sin displasia reportada en estudios recientes29, así como la baja frecuencia de EB (< 10%) en los pacientes con ACE30,31, levantan dudas sobre la rentabilidad de las estrategias de cribado y monitorización actuales.
En nuestro estudio, encontramos solo a un paciente con EB con displasia de alto grado (11.1%), lo cual es más bajo que la prevalencia de displasia/cáncer en EB previamente reportada en México (15.1-19.3%)13,15. Bernal-Mendez et al.15 reportaron que 81 de los 420 pacientes con EB presentaron algún grado de displasia o cáncer (11.4% con displasia de bajo grado, 4.8% con displasia de alto grado y 3.1% con cáncer esofágico). Esta información, además del conocimiento sobre la epidemiología de EB que hay en nuestro centro, podría ayudar al desarrollo de estrategias rentables para la identificación y la monitorización de pacientes con EB.
En conclusión, la prevalencia de EB en nuestra Clínica de Gastroenterología es del 1.8%, con una prevalencia del 7.2% en pacientes con síntomas de reflujo gastroesofágico. Se requiere de estudios multicéntricos para determinar con mayor claridad la epidemiología de EB en México, después de lo cual se puede desarrollar una estrategia rentable para el cribado y la monitorización de EB.
Responsabilidades éticasProtección de sujetos humanos y animales. Los autores declaran que no se realizaron experimentos en humanos o animales para este estudio.
Confidencialidad de datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos del paciente.
Derecho a la privacidad y consentimiento informado. Los autores declaran que no aparece información de los pacientes en este artículo.
FinanciaciónNingún apoyo financiero se recibió en relación a este artículo.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
Los autores desean agradecer a Sergio Lozano-Rodríguez, M.D., por su ayuda en la traducción y edición del artículo.