La enfermedad celíaca (EC) es un proceso de base autoinmune que afecta al intestino delgado y se desencadena por la ingesta de gluten en sujetos genéticamente susceptibles. Se han descrito múltiples complicaciones asociadas a la EC, dentro de las cuales destaca por su rareza el síndrome del nódulo mesentérico cavitado (SNMC). Su etiopatogenia es poco conocida, siendo conveniente reconocerla de forma precoz y diferenciarla fundamentalmente de las infecciones y el linfoma. Presentamos el caso de una EC con esta complicación asociada a otras enfermedades concomitantes con base autoinmune.
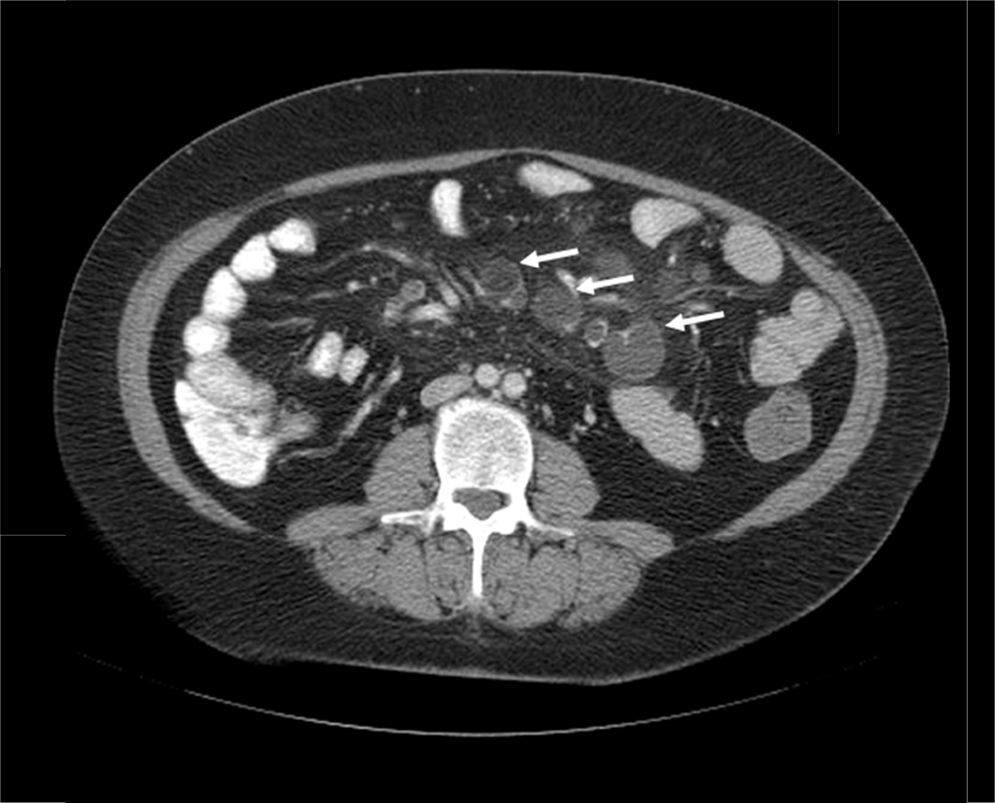
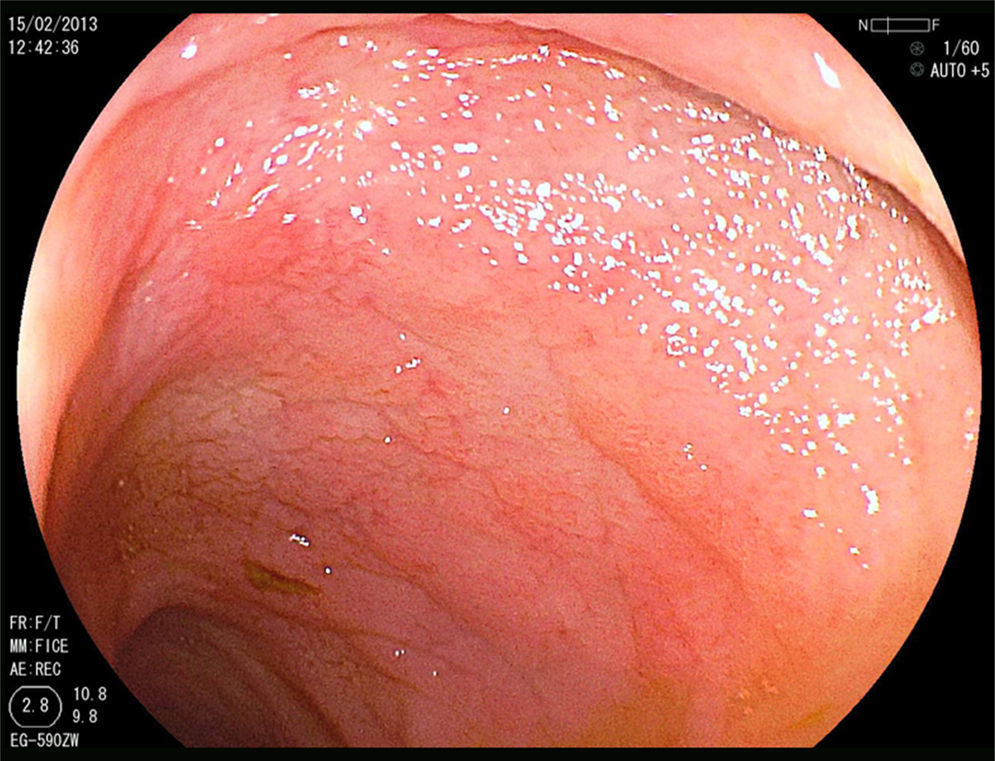
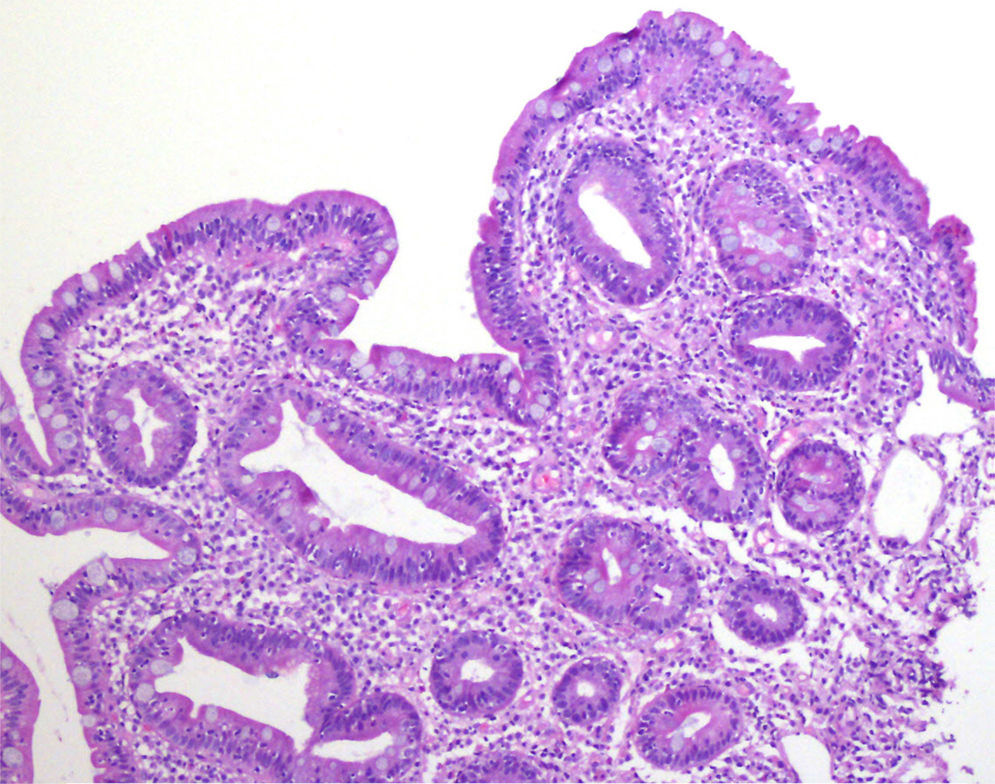
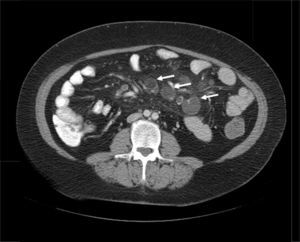
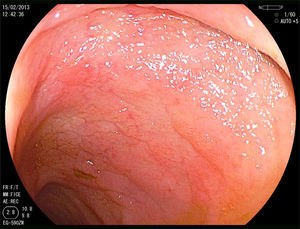
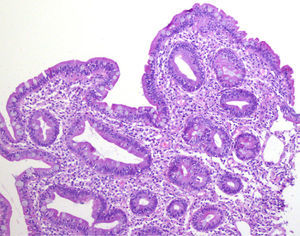
Mujer de 52 años, que tras diagnóstico de síndrome de Sjögren consultó por alteración de las transaminasas y enzimas de colestasis, y AMA positivo con M2 positivos e IgM elevada; se solicitó ecografía abdominal (US) y biopsia hepática y se comenzó tratamiento con ácido ursodesoxicólico a dosis de 14mg/kg/día ante el diagnóstico de colangitis biliar primaria (CBP). La paciente refería evacuaciones pastosas 4-5 veces al día, sin sangre, a lo largo de los últimos 6 meses, con una pérdida de 8kg durante este periodo. La exploración física fue normal. Peso: 65 kg y talla: 167cm. Índice de masa corporal: 23,3. Analíticamente destacaba: alanina aminotransferasa: 68 (0-31) U/l; aspartato aminotransferasa: 113 (0-55) U/l; fosfatasa alcalina: 264 (5-36) U/l; GGT: 341 (35-104) U/l; inmunoglobulinas: IgM: 624mg/dl (40-230); AMA: 1/604; AMA-M2: positivo; antitransglutaminasa: 160 U (0-20). En la US se observaban adenopatías mesentéricas patológicas de aspecto quístico. Los marcadores tumorales fueron normales. El estudio microbiológico fue negativo para virus de la inmunodeficiencia humana y tuberculosis. Se realizó una tomografía axial computarizada (TC) toracoabdominal, observando en el mesenterio la presencia de múltiples adenopatías>1cm, de aspecto quístico redondeado, con área central de baja atenuación (fig. 1). Se realizó una colonoscopia que fue normal y una gastroscopia, observándose un patrón mucoso nodular duodenal de aspecto atrófico con una histología compatible con un estadio Marsh IIIa (figs. 2 y 3). La biopsia hepática fue compatible con una CBP estadio ii.
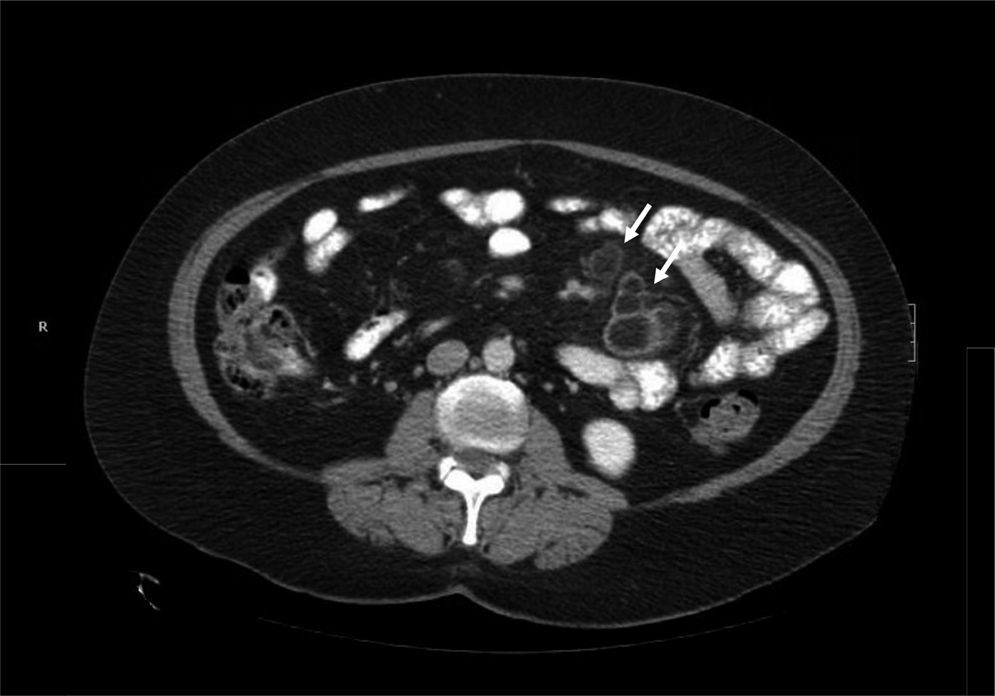
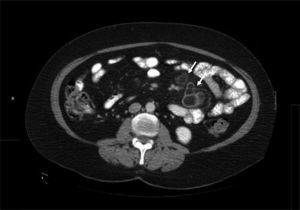
Una vez descartadas infecciones (tuberculosis y enfermedad de Whipple) y una enfermedad de Crohn, se planteó el principal diagnóstico diferencial con el linfoma. Dado el diagnóstico de EC, las características radiológicas de las adenopatías y la localización exclusivamente mesentérica, no se realizó estudio histológico debido a la baja probabilidad de linfoma. Se interpretaron los hallazgos como un SNMC y se decidió dieta sin gluten (DSG) y control radiológico precoz. A los 3 meses, la paciente había ganado 3kg de peso y la TC de control presentó cavitación y reducción de tamaño de las adenopatías, lo que corroboró el diagnóstico (fig. 4).
El SNMC es una complicación muy rara de la EC, siendo su patogenia desconocida. Se postula que una alteración de la permeabilidad intestinal podría favorecer la exposición masiva y crónica a determinados antígenos, lo que provocaría, por el depósito de inmunocomplejos en el endotelio vascular del ganglio, un daño isquémico y una consiguiente necrosis del mismo1.
Esta entidad se manifiesta con síntomas habituales de la EC, adenopatías mesentéricas y, en ocasiones, signos de hipoesplenismo, debiendo sospecharse siempre en pacientes celíacos con pobre respuesta a la DSG.
Los datos clínicos y radiológicos son esenciales en el diagnóstico, siendo la principal herramienta el TC2. El hallazgo inicial por TC es la presencia de múltiples adenopatías localizadas exclusivamente en el meso yeyuno-ileal, de tamaño variable (2-7cm) y con áreas centrales de baja atenuación (densidad en torno a 30-40 UH o inferior) producida por la presencia de líquido y/o grasa.
Ocasionalmente, se observan en las adenopatías niveles líquido-grasa, siendo este signo radiológico típico del SNMC. La RM puede ser útil para apreciar estos niveles líquido-grasa utilizando secuencias ponderadas en T1 y T2 con técnicas de saturación de la grasa, incluso si los niveles de líquido-grasa no se ven en la TC3. Algunos autores afirman que la demostración de estos cambios en las adenopatías mediante RM puede obviar la utilización de otras técnicas diagnósticas más invasivas, como la punción de las mismas4.
El SNMC plantea el principal diagnóstico diferencial con infecciones y el linfoma. Las adenopatías del linfoma presentan una atenuación de tejido blando sin presencia de cavitación y afectan a varias cadenas ganglionares, siendo habitual la esplenomegalia. Las infecciones, como la tuberculosis y enfermedad de Whipple, pueden ocasionalmente presentar adenopatías abdominales de baja atenuación no cavitadas, siendo muy importantes los datos de laboratorio, endoscópicos, clínicos y radiológicos para su diagnóstico5.
Los pacientes que no mejoran clínicamente con la DSG o cuando los hallazgos radiológicos no son característicos es necesario el estudio histológico de adenopatía mediante biopsia guiada radiológicamente o quirúrgica.
Posterior al inicio de la DSG se observa una progresiva cavitación de las adenopatías y reducción de su tamaño, lo que constituye un signo patognomónico del SNMC. Además de las restricciones dietéticas típicas de la EC, en ocasiones es necesario el uso intensivo de corticoides sistémicos6. En relación con el pronóstico de esta entidad, si bien publicaciones iniciales describían una mortalidad elevada en pacientes con SNMC, nuevos trabajos han reportado evoluciones similares al resto de pacientes celiacos7.
En conclusión, el SNMC constituye una complicación rarísima de la EC que debe ser diferenciado de otras entidades clínicas al diagnóstico y durante su evolución. El diagnóstico puede ser realizado por la combinación de datos clínicos y radiológicos.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses por la realización de este trabajo.
Agradecemos a los gastroenterólogos que participaron en el estudio.