El adenocarcinoma esofágico (ACE) ha incrementado su incidencia, y aunque existen programas de cribado y vigilancia, especialmente para pacientes con esófago de Barrett (EB), su efectividad en la detección temprana es limitada. El cáncer de esófago postendoscopia (CEPE), diagnosticado tras endoscopias negativas previas, pone en duda la precisión de estas prácticas en pacientes de alto riesgo.
ObjetivosObjetivo principal: Estimar la tasa de CEPE y analizar sus características en pacientes de 3centros en Medellín, Colombia.
Objetivos específicos- •
Comparar características entre pacientes con CEPE y aquellos con diagnóstico en la primera endoscopia.
- •
Evaluar la prevalencia de EB en ambas cohortes y su relación con CEPE.
- •
Analizar la localización anatómica del CEPE.
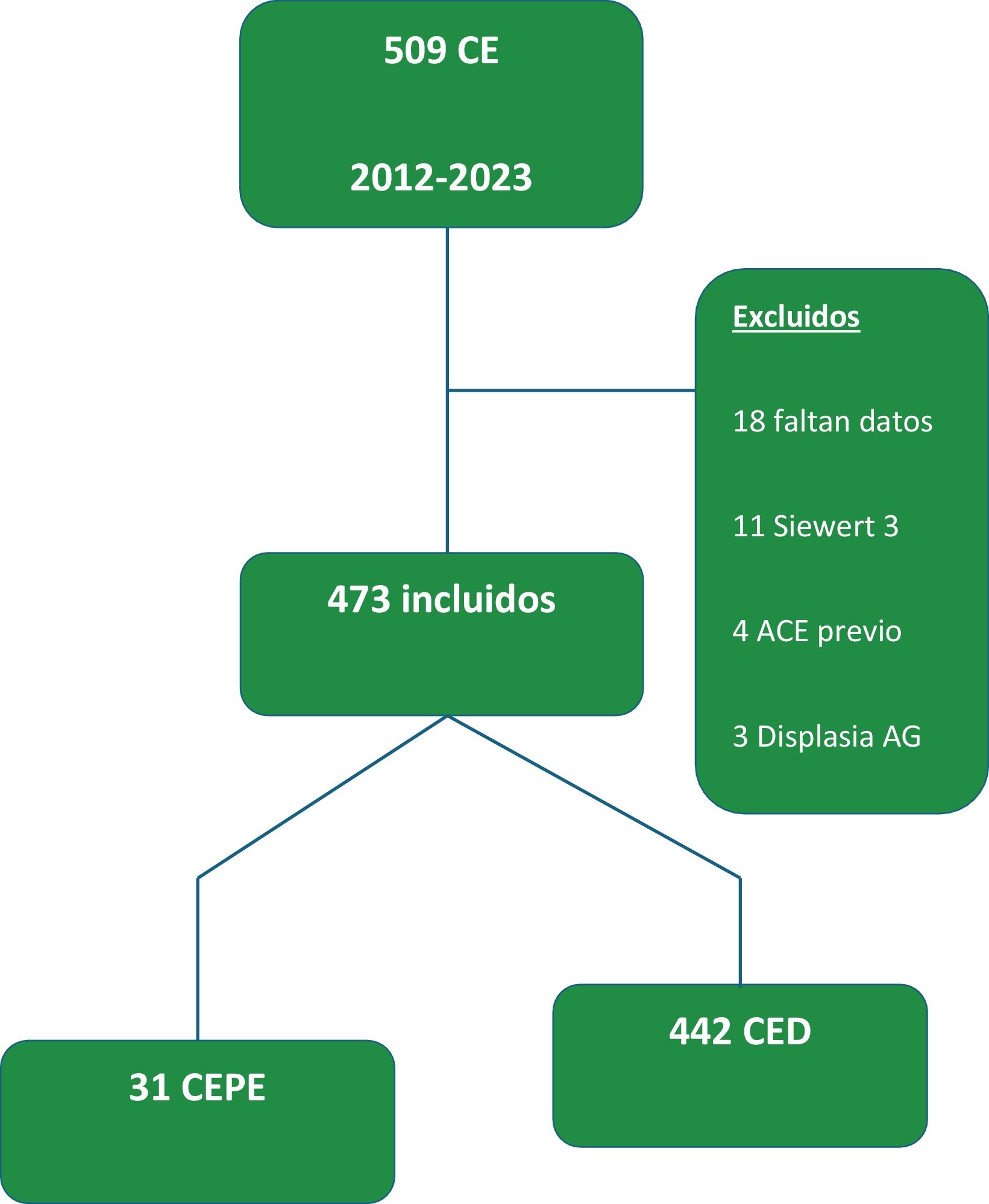
Estudio observacional de cohortes con pacientes diagnosticados con cáncer de esófago entre 2012 y 2023 en 3centros de Medellín. Se incluyó a 473 pacientes (31 con CEPE), evaluando datos clínicos, demográficos y de supervivencia. Para su elaboración se utilizó la lista de comprobación STROBE: cohortes (pág. 22-26).
ResultadosLa tasa de CEPE fue del 6,6%. Estos pacientes presentaron menos síntomas de alarma (35% vs. 63%, p=0,002), mayor prevalencia de EB (42% vs. 23%, p=0,016) y diagnóstico más temprano. Las endoscopias previas fallaron en detectar lesiones, especialmente en el esófago proximal.
ConclusionesEl CEPE es frecuente, sobre todo en pacientes con EB y lesiones proximales. Se requiere optimizar la endoscopia mediante técnicas de imagen avanzadas y protocolos estrictos de vigilancia.
The incidence of esophageal adenocarcinoma (EAC) has increased. Although there are screening and surveillance programs, especially for patients with Barrett's esophagus (BE), they have limited effectiveness in detecting early disease. Post-endoscopy esophageal adenocarcinoma (PEEC), diagnosed after previous negative endoscopies, raises concerns about the accuracy of current endoscopic practices in high-risk patients.
AimsPrimary aim: to estimate the rate of PEEC and analyze its characteristics in patients at 3hospital centers in Medellín, Colombia.
Specific aims- •
To compare characteristics between patients with PEEC and those diagnosed at the first endoscopy.
- •
Evaluate the prevalence of BE in the 2cohorts and its relation to PEEC.
- •
Analyze the anatomic location of PEEC.
An observational cohort study was conducted that included 473 patients diagnosed with esophageal cancer between 2012 and 2023 at 3centers in Medellín, Colombia, 31 of whom had PEEC. Their demographic, clinical, and survival data were evaluated using the STROBE guidelines for cohort studies (pages 22-26).
ResultsThe PEEC rate was 6.6%. Patients with PEEC presented with fewer alarm symptoms (35% vs. 63%, P=.002), a higher prevalence of BE (42% vs. 23%, P=.016), and were diagnosed at an earlier stage of disease. The previous endoscopies failed to detect lesions, especially in the proximal esophagus.
ConclusionsPEEC is a frequent entity, especially in patients with BE and proximal lesions. Optimizing endoscopy through advanced imaging techniques and strict surveillance protocols is required.
El cáncer de esófago (CE), en particular el adenocarcinoma esofágico (ACE), ha incrementado su incidencia de forma significativa en las últimas décadas, multiplicándose por 7 en los últimos 50 años. A pesar de los avances en el manejo del esófago de Barrett (EB) y de los programas de cribado endoscópico, la supervivencia a 5 años sigue siendo inferior al 20%1. El CE ocupa el séptimo lugar mundial en incidencia y el sexto en mortalidad, afectando predominantemente a hombres, que representan el 70% de los casos2.
Dado que el estadio tumoral al momento del diagnóstico determina el pronóstico, las guías recomiendan el cribado selectivo en pacientes con reflujo gastroesofágico crónico y factores de riesgo adicionales como edad mayor de 50 años, sexo masculino, obesidad central, tabaquismo y antecedentes familiares de CE o EB3,4. Sin embargo, más del 90% de los pacientes con ACE no tienen diagnóstico previo de EB, y la mayoría de quienes presentan EB no desarrollan cáncer, lo que cuestiona la eficacia y costo-beneficio de estos programas5-7.
Además, más de la mitad de los ACE se diagnostican en estadios avanzados, lo que evidencia las limitaciones de las estrategias actuales de vigilancia8. La literatura también reporta casos de CE detectados poco tiempo después de endoscopias negativas, situación similar a lo observado en el cáncer colorrectal poscolonoscopia9-12. Para estandarizar este fenómeno, se han propuesto los términos carcinoma esofágico postendoscopia (CEPE) y neoplasia esofágica postendoscopia (NEPE), siendo la displasia de alto grado y el ACE no detectados sus principales causas13-15.
Diversos factores técnicos pueden contribuir a estos errores diagnósticos: un tiempo de inspección insuficiente del segmento de Barrett, el incumplimiento del protocolo de biopsias de Seattle, el muestreo incompleto de la mucosa o la dificultad para identificar lesiones sutiles14-16. Sin embargo, la información disponible sobre CEPE es limitada y proviene de series pequeñas, sin claridad sobre el estadio tumoral al diagnóstico15,17,18. Pero, si los cánceres de esófago precoces tienen una larga historia natural17,19, entonces cualquier cáncer detectado en los 3 años siguientes a la endoscopia podría haberse pasado por alto, como lo han mostrado estudios anteriores15,18,20,21.
Este estudio busca comparar las características clínicas, endoscópicas y la supervivencia de pacientes con CE detectados en su primera endoscopia, frente a aquellos diagnosticados tras estudios endoscópicos normales realizados en los 3años previos, para aportar evidencia sobre la magnitud y características del CEPE.
MétodosFuentes de los datosEste estudio observacional, analítico, longitudinal, ambispectivo de cohortes para el cual se utilizó la lista de cotización STROBE: cohortes y se fundamentó en un grupo de pacientes con diagnóstico histológico de CE y tratados mediante un seguimiento prospectivo, atendidos por cirujanos oncólogos o gastrointestinales, entre julio del 2012 y junio del 2023. Los datos fueron obtenidos de los registros clínicos de 3instituciones de tercer nivel, las cuales son centros de referencia para el cáncer, como son el Instituto de Cancerología-Clínica las Américas, Clínica el Rosario y Centro Oncológico de Antioquia (COA) en la ciudad de Medellín-Colombia.
Población de estudio y procedimientosEl criterio de inclusión para el estudio fue el de paciente con histología probada de CE, diagnosticado durante el periodo de estudio en los 3centros participantes.
Los criterios de exclusión fueron: 1) diagnóstico previo y seguimiento por EB con displasia en cualquier grado o CE; 2) acalasia; 3) adenocarcinomas de la unión esofagogástrica con mayor componente gástrico (Siewert 3); 4) pacientes sin seguimiento en los centros participantes, y 5) pacientes con más del 10% de las variables con valores perdidos. Diagrama CONSORT (fig. 1).
Se revisaron las historias clínicas de todos los sujetos con ACE en cada institución. Esta búsqueda incluyó las endoscopias negativas realizadas en otros hospitales. Se incluyeron datos demográficos (edad y sexo) y clínicos (consumo de cigarrillo y alcohol como categorías binarias, antecedente de EB antes del diagnóstico de ACE, obesidad [definida como de índice de masa corporal> 30kg/m2]), indicación de la endoscopia (disfagia, hematemesis, melena, vómitos y síndrome constitucional se consideraron síntomas de alarma) y tratamiento con inhibidores de la bomba de protones (IBP), tanto en la endoscopia diagnóstica como en la endoscopia falsamente negativa.
ObjetivosEl objetivo principal del estudio es determinar la tasa de CEPE.
Los objetivos secundarios son: comparar las características demográficas, clínicas, endoscópicas y la sobrevida en los pacientes con CEPE y cáncer de esófago detectado (CED). Evaluar la prevalencia de EB en las 2cohortes. Analizar la tasa de detección del CEPE en diferentes ubicaciones anatómicas del esófago.
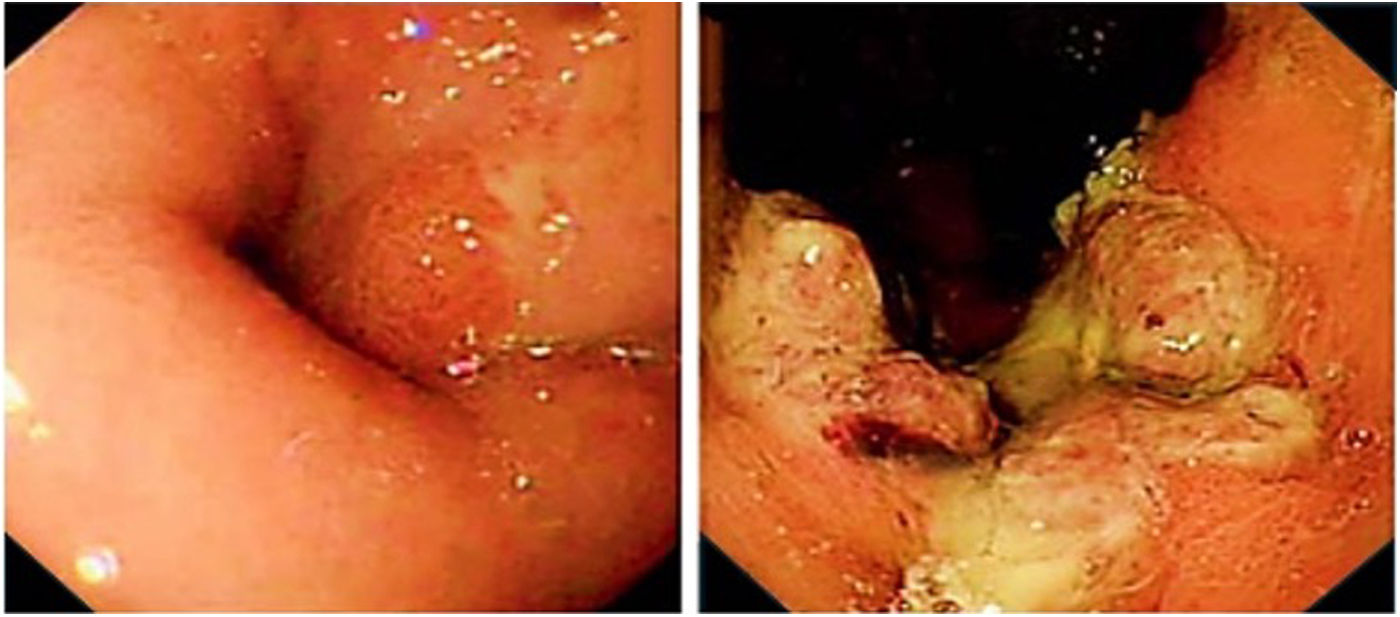
Aspectos endoscópicosLa fecha y el diagnóstico principal se recogieron de los registros de las endoscopias negativos y diagnósticas. El presencia de ulceración, la localización (alto, medio o distal que incluye el cardias) se obtuvieron del informe de la endoscopia. Cuando se disponía de más de una endoscopia negativa, se seleccionó la más reciente para el análisis. El subtipo histológico (carcinoma escamocelular, adenocarcinoma intestinal o difuso) y el grado de diferenciación (indiferenciado pobre o moderadamente bien diferenciado), la presencia de EB, también se obtuvieron de los informes de patología (fig. 2).
El estadificación tumoral se determinó según el American Joint Committee on Cancer cTNM system 8th ed22. El tratamiento oncológico se registró como resultados binarios: terapia neoadyuvante, cirugía con intención curativa, terapia adyuvante y quimioterapia paliativa. El estado de supervivencia se estableció utilizando la fecha de diagnóstico del ACE y la fecha de fallecimiento. Los supervivientes fueron censurados por la derecha en la fecha de la última visita médica (hospitalaria o de atención primaria).
Esófago de Barrett y adenocarcinoma de esófagoPara efectos del presente estudio se tuvieron en cuenta pacientes que no estaban en un seguimiento previo por EB con algún grado de displasia. Los ACE diagnosticados en el intervalo comprendido entre el día del diagnóstico de EB y el día 60 tras el diagnóstico de EB se consideraron ACE prevalentes. El intervalo de 30 días tras el diagnóstico de EB se incorporó a la definición para tener en cuenta los procedimientos adicionales necesarios para estadificar adecuadamente la neoplasia identificada en el momento del diagnóstico de EB. Los ACE diagnosticados entre los 30 y 365 días después de la endoscopia índice que diagnosticó el EB se consideraron CEPE (es decir, ACE que pueden haber sido prevalentes y no se detectaron en el momento del diagnóstico de EB)13. Los ACE diagnosticados más de 365 días después del diagnóstico de EB se consideraron incidentales (es decir, ACE que probablemente no estaban presentes en el momento del diagnóstico de EB). El estudio de estos pacientes con Barret en seguimiento y el hallazgo de cáncer será motivo de otra investigación.
Análisis estadísticoSe calcularon la media, la desviación estándar, la mediana y el intervalo para las variables continuas y el recuento de frecuencias y los porcentajes para los datos categóricos. Los datos se analizaron mediante métodos paramétricos para datos continuos distribuidos normalmente (prueba t) y métodos no paramétricos (prueba de Mann-Whitney U) para distribuciones continuas no normales. Para los datos categóricos se utilizaron las pruebas de la chi al cuadrado y exacta de Fisher.
Además, se compararon los cánceres no diagnosticados en el primer año y entre 1 y 3 años antes de la endoscopia diagnóstica. Se calcularon las probabilidades de supervivencia a un año y a 5años para CEPE y no CEPE mediante el método de Kaplan-Meier. Se utilizó la prueba de log-rank para evaluar las diferencias de supervivencia global. Todos los análisis fueron de 2colas y los valores de p inferiores a 0.05 se consideraron significativos. Todos los cálculos estadísticos se realizaron en SPSS (Statistics for Windows, Version 26.0. Armonk, NY, Estados Unidos, IBM Corp).
Consideraciones éticasEl protocolo del estudio se diseñó en estricta conformidad con los principios establecidos en la Declaración de Helsinki y las normativas de buenas prácticas clínicas, asegurando el respeto a los derechos y bienestar de los participantes. El estudio fue revisado y aprobado por el Comité de Ética de Investigación Clínica del Rosario, garantizando que todas las prácticas cumplieran con los estándares éticos nacionales e internacionales.
Dado que el estudio tiene un diseño observacional y se basa en la revisión de datos previamente recopilados durante procedimientos clínicos rutinarios, se solicitó y obtuvo una exención de consentimiento informado individual para la inclusión de los participantes en la investigación. Esta exención fue justificada por la nula intervención directa en los pacientes y el uso exclusivo de información histórica, minimizando los riesgos para los participantes (Resolución 8430 de 1993, Ministerio de Salud).
No obstante, en todos los casos se había obtenido previamente el consentimiento informado para los procedimientos endoscópicos realizados como parte de la atención clínica. Asimismo, se implementaron medidas estrictas para el manejo seguro y ético de los datos, incluyendo la anonimización de la información y la limitación del acceso a datos sensibles únicamente al personal autorizado, asegurando así el cumplimiento con las normativas de protección de datos personales.
ResultadosLa cohorte inicial de datos vinculados incluyó a 509 pacientes diagnosticados con ACE entre julio del 2012 y junio del 2023, de los cuales solo 473 cumplieron con los criterios de inclusión (fig. 1). Las características demográficas y clínicas de la totalidad de la cohorte se resumen en la tabla 1.
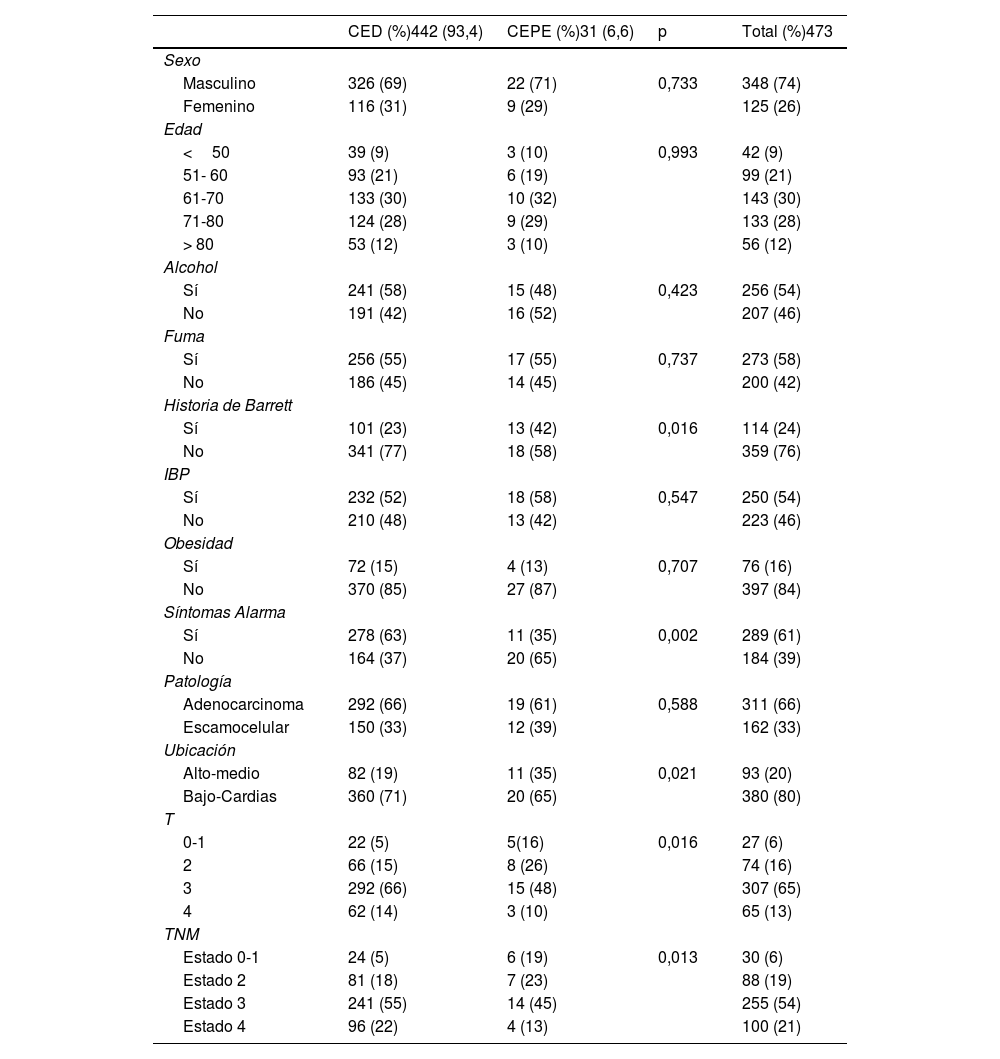
Características demográficas, clínicas y endoscópicas de los pacientes
| CED (%)442 (93,4) | CEPE (%)31 (6,6) | p | Total (%)473 | |
|---|---|---|---|---|
| Sexo | ||||
| Masculino | 326 (69) | 22 (71) | 0,733 | 348 (74) |
| Femenino | 116 (31) | 9 (29) | 125 (26) | |
| Edad | ||||
| <50 | 39 (9) | 3 (10) | 0,993 | 42 (9) |
| 51- 60 | 93 (21) | 6 (19) | 99 (21) | |
| 61-70 | 133 (30) | 10 (32) | 143 (30) | |
| 71-80 | 124 (28) | 9 (29) | 133 (28) | |
| > 80 | 53 (12) | 3 (10) | 56 (12) | |
| Alcohol | ||||
| Sí | 241 (58) | 15 (48) | 0,423 | 256 (54) |
| No | 191 (42) | 16 (52) | 207 (46) | |
| Fuma | ||||
| Sí | 256 (55) | 17 (55) | 0,737 | 273 (58) |
| No | 186 (45) | 14 (45) | 200 (42) | |
| Historia de Barrett | ||||
| Sí | 101 (23) | 13 (42) | 0,016 | 114 (24) |
| No | 341 (77) | 18 (58) | 359 (76) | |
| IBP | ||||
| Sí | 232 (52) | 18 (58) | 0,547 | 250 (54) |
| No | 210 (48) | 13 (42) | 223 (46) | |
| Obesidad | ||||
| Sí | 72 (15) | 4 (13) | 0,707 | 76 (16) |
| No | 370 (85) | 27 (87) | 397 (84) | |
| Síntomas Alarma | ||||
| Sí | 278 (63) | 11 (35) | 0,002 | 289 (61) |
| No | 164 (37) | 20 (65) | 184 (39) | |
| Patología | ||||
| Adenocarcinoma | 292 (66) | 19 (61) | 0,588 | 311 (66) |
| Escamocelular | 150 (33) | 12 (39) | 162 (33) | |
| Ubicación | ||||
| Alto-medio | 82 (19) | 11 (35) | 0,021 | 93 (20) |
| Bajo-Cardias | 360 (71) | 20 (65) | 380 (80) | |
| T | ||||
| 0-1 | 22 (5) | 5(16) | 0,016 | 27 (6) |
| 2 | 66 (15) | 8 (26) | 74 (16) | |
| 3 | 292 (66) | 15 (48) | 307 (65) | |
| 4 | 62 (14) | 3 (10) | 65 (13) | |
| TNM | ||||
| Estado 0-1 | 24 (5) | 6 (19) | 0,013 | 30 (6) |
| Estado 2 | 81 (18) | 7 (23) | 88 (19) | |
| Estado 3 | 241 (55) | 14 (45) | 255 (54) | |
| Estado 4 | 96 (22) | 4 (13) | 100 (21) | |
CED: cáncer de esófago detectado; CEPE: cáncer de esófago postendoscopia; IBP: inhibidor de bomba de protones.
La edad media (± DE) de estos pacientes en el momento del diagnóstico fue de 69,3±10,4 años, y 7 de cada 10 pacientes eran hombres. Tres cuartas partes de los cánceres (74%) se localizaban en la parte inferior del esófago. En el momento del diagnóstico, el 24% de la cohorte tenía EB. Entre los pacientes con estadio TNM conocido en el momento del diagnóstico, el 75% presentaban cánceres en estadio 3 o 4, mientras que solo el 6% fueron diagnosticados de cáncer en estadio 0 (carcinoma in situ) o estadio 1.
Aspectos demográficos y clínicosEl CEPE no se asoció con el sexo, los grupos de edad, antecedentes de alcohol o cigarrillo, la obesidad, el consumo de IBP o la histología del cáncer (tabla 1). Sin embargo, la tasa de CEPE se asoció significativamente con la ausencia de síntomas de alarma (p=0.002), la presencia de EB (p=0.016) y el estado temprano de T y por supuesto el estado tumoral precoz (p=0.01).
Tasa y porcentaje de cáncer postendoscopiaEntre los 473 pacientes considerados para el estudio, 31 sujetos (6,6%) se habían sometido al menos a una endoscopia en los 3 años anteriores al diagnóstico de su cáncer (tasa de cáncer no diagnosticado del 6.1%), 166 (35%) se sometieron a una endoscopia entre 3 y 12 meses antes del diagnóstico, y 307 (64%) tuvieron la endoscopia entre 1 y 3 años antes del diagnóstico. No se evidenciaron diferencias significativas entre los 3centros en este rubro. La mediana del intervalo de tiempo entre el diagnóstico de ACE negativo y el de CEPE fue de 18.6 meses (rango: 3.2-34.1), y fue inferior a 2 años en el 84% de los pacientes. La mediana del número de endoscopias negativas en el grupo de CEPE fue de 1 (rango: 1-2).
Hallazgos endoscópicos más frecuentes en CEPEEl hallazgo endoscópico más frecuente en la endoscopia previa al diagnóstico de cáncer fue la esofagitis (12/31, 39%): 4eran esofagitis pépticas grado A de la Clasificación de Los Ángeles, 2grado B, 3grado C, 2 de grado D y un caso de candidiasis esofágica, seguido por la estenosis esofágica de aspecto péptico (4/31, 13%). A ninguna de estas estenosis o esofagitis péptica se le realizó biopsia o un seguimiento endoscópico adecuado. El motivo más plausible de CEPE fue una lesión no vista o inadvertida (19/31, 61%), seguido de un seguimiento inadecuado (7/31, 23%) y el error de muestreo con la biopsia (5/31, 16%).
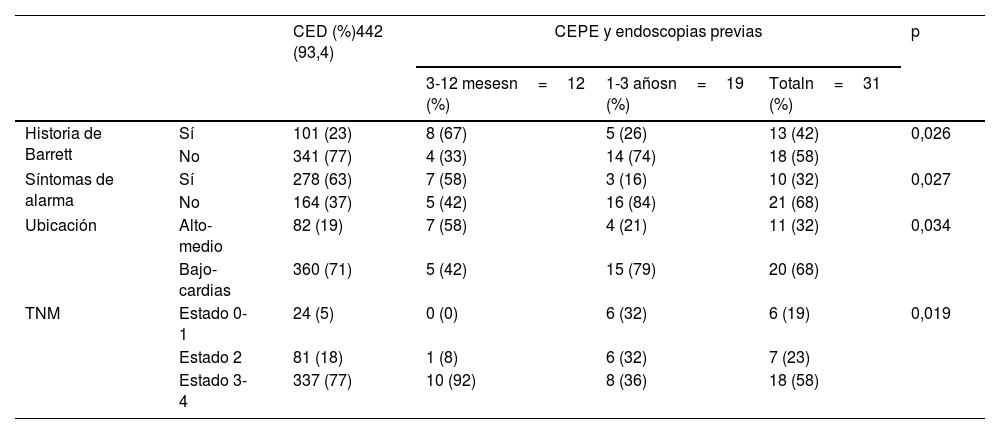
En la tabla 2 se discrimina en la cohorte de CEPE las endoscopias realizadas de acuerdo con el período de tiempo (1 o 3 años) previos al diagnóstico de ACE, encontrado en los pacientes diagnosticados en el último año de la endoscopia negativa más estudios por EB (42%, IC del 95%: 24.56% a 59.31%, vs. 23%, IC del 95%: 18.94% a 26.77%, p=0.026), menos síntomas de alarma (65% versus 85%), más ubicaciones proximales (32%, IC del 95%: 18.64% a 52.33%, versus 19%, IC del 95%: 14.93% a 22.18%, p=0.034) y la tendencia a presentar un cáncer en estadio temprano 0-1 (19%, IC del 95%: 18.64% a 52.33%, versus 5%, IC del 95%: 14.93% a 22.18%)
Caracterización de los hallazgos relevantes en las endoscopias realizadas antes de 1 y 3 años
| CED (%)442 (93,4) | CEPE y endoscopias previas | p | ||||
|---|---|---|---|---|---|---|
| 3-12 mesesn=12 (%) | 1-3 añosn=19 (%) | Totaln=31 (%) | ||||
| Historia de Barrett | Sí | 101 (23) | 8 (67) | 5 (26) | 13 (42) | 0,026 |
| No | 341 (77) | 4 (33) | 14 (74) | 18 (58) | ||
| Síntomas de alarma | Sí | 278 (63) | 7 (58) | 3 (16) | 10 (32) | 0,027 |
| No | 164 (37) | 5 (42) | 16 (84) | 21 (68) | ||
| Ubicación | Alto-medio | 82 (19) | 7 (58) | 4 (21) | 11 (32) | 0,034 |
| Bajo-cardias | 360 (71) | 5 (42) | 15 (79) | 20 (68) | ||
| TNM | Estado 0-1 | 24 (5) | 0 (0) | 6 (32) | 6 (19) | 0,019 |
| Estado 2 | 81 (18) | 1 (8) | 6 (32) | 7 (23) | ||
| Estado 3-4 | 337 (77) | 10 (92) | 8 (36) | 18 (58) | ||
La cohorte total mostró una prevalencia de EB del 24%. La proporción de pacientes con EB en la cohorte con CEPE fue mayor en forma significativa a los pacientes con CED (42%, IC del 95%: 24.56% a 59.31%, vs. 23%, IC al 95%: 18.94% a 26.77%, p=0,026). En el 26% de los pacientes el diagnóstico de CEPE asociado a EB se hizo en el primer año postendoscopia negativa, lo que contrasta con el 13% de endoscopias negativas en el primer año en el paciente sin EB (p=0.040).
En conformidad con la clasificación propuesta por AGA referente al ACE postendoscopia y su relación con el Barrett, se encontró que el 88% era un ACE prevalente, el 7% CEPE y un el 5% un ACE incidental.
Frecuencia de las endoscopias previasDe los 473 pacientes que se sometieron a endoscopias en los 3 años previos al diagnóstico, 361 (76%) recibieron solo una endoscopia durante ese período. La proporción de pacientes con una única endoscopia previa fue menor entre aquellos que la realizaron entre 3 y 12 meses antes del diagnóstico (56%) en comparación con quienes la realizaron entre 1 y 3 años antes (81%). De los pacientes que se sometieron a una endoscopia entre 3 y 12 meses antes del diagnóstico, 32 (17,0%) habían tenido 3o más endoscopias en los 3 años previos.
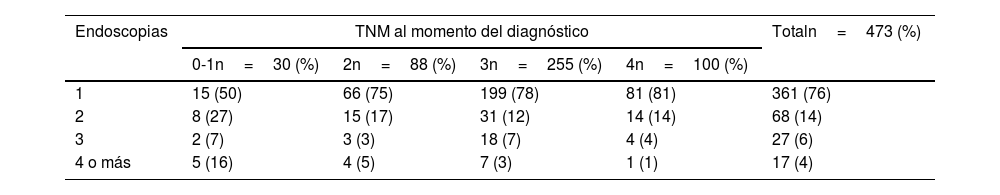
Estadio del tumor TNMEl estadio TNM al momento del diagnóstico mostró una asociación significativa con el número de endoscopias previas realizadas en los 3 años anteriores (p=0.014) (tabla 3). El 81% de los pacientes con cáncer en estadio 4 habían recibido solo una endoscopia en los 3 años previos, en comparación con el 50% de los pacientes con cáncer en estadio 0/1. Solo el 23% de los cánceres en estadio 0-1 fueron diagnosticados después de 3 o más endoscopias en los 3 años anteriores.
Número de endoscopias realizadas antes del diagnóstico, estratificadas por el estado del tumor al momento del diagnóstico
| Endoscopias | TNM al momento del diagnóstico | Totaln=473 (%) | |||
|---|---|---|---|---|---|
| 0-1n=30 (%) | 2n=88 (%) | 3n=255 (%) | 4n=100 (%) | ||
| 1 | 15 (50) | 66 (75) | 199 (78) | 81 (81) | 361 (76) |
| 2 | 8 (27) | 15 (17) | 31 (12) | 14 (14) | 68 (14) |
| 3 | 2 (7) | 3 (3) | 18 (7) | 4 (4) | 27 (6) |
| 4 o más | 5 (16) | 4 (5) | 7 (3) | 1 (1) | 17 (4) |
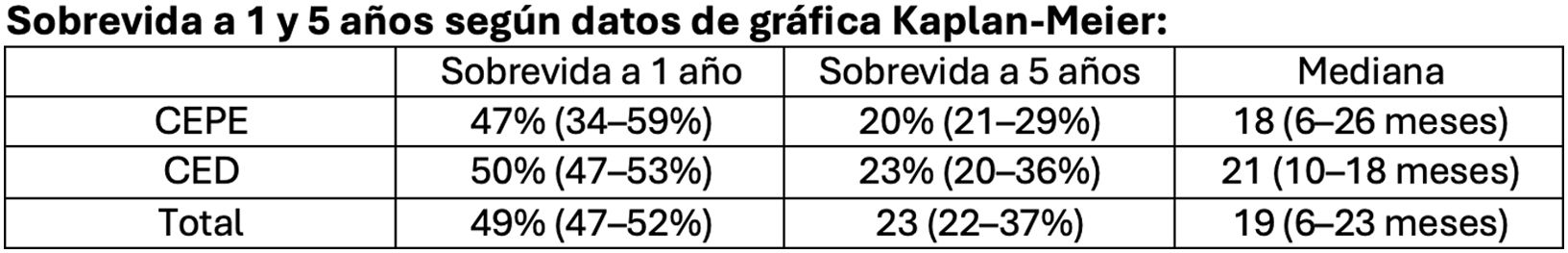
La mediana de seguimiento fue de 5,2 años (rango intercuartílico [IQR], 3,5-8,6 años). El análisis de supervivencia no mostró diferencias significativas entre ambos grupos y se resume en la figura 3.
DiscusiónEn este estudio de cohorte poblacional, el 6.6% de los pacientes diagnosticados con cáncer de esófago se habían sometido a una endoscopia entre 3 y 36 meses antes del diagnóstico. Esto resulta en una tasa global estimada de diagnósticos erróneos del 6.1% en la cohorte estudiada (proporción de cánceres de intervalo=número de cánceres de intervalo/número de cánceres de intervalo + total de cánceres detectados×100). Esta cifra se sitúa en el rango inferior de las estimaciones de estudios previos, que han notificado tasas del 4,0 al 14,3%15,18,19,21,23,24. Además, se encontró una asociación entre los pacientes que se habían sometido a una endoscopia previa y el estadio en el momento del diagnóstico, siendo más frecuente la endoscopia negativa en pacientes con enfermedad en estadio 0/1. Los pacientes con EB, síntomas de alarma y cáncer de esófago en el tercio superior también tenían más probabilidades de haberse sometido previamente a una endoscopia.
Los estudios sugieren que, o bien algunos cánceres de esófago no se detectan en la endoscopia, o bien la evolución natural de un número significativo de cánceres es lo suficientemente rápida como para evolucionar de una lesión temprana endoscópicamente invisible a un cáncer avanzado en un plazo relativamente corto. Si se considera este último escenario, una interpretación alternativa sería que solo los cánceres en estadio 2-4 diagnosticados en los 3-36 meses siguientes a la endoscopia son potencialmente pasados por alto. Esto correspondería a una proporción estimada de omisión más conservadora del 5,6%. Sin embargo, consideramos que la cifra global puede ser más exacta. Aunque los estudios sobre la historia natural del cáncer de esófago precoz no tratado son escasos, 2pequeños estudios de cohortes sugieren que algunos pacientes con cáncer precoz sobreviven más de 5 años25,26, y cada vez hay más pruebas de la lenta progresión de la displasia visible endoscópicamente en pacientes con EB27,28.
Las endoscopias previas negativas fueron más frecuentes entre los pacientes con cánceres tempranos, y algunos de estos pacientes pueden haber estado bajo vigilancia regular. Esto se ve respaldado por el hallazgo de que el EB era más frecuente entre estos pacientes (42% vs. 58%, p=0.026).
Se han propuesto varias razones para no diagnosticar un cáncer en la endoscopia inicial29,30. Entre ellas se incluye el hecho de que el endoscopista no identifique una posible lesión o, en caso de que la vea, no reconozca su importancia y decida no realizar una biopsia o tomar un número insuficiente de biopsias17. La apariencia endoscópica de un cáncer incipiente puede ser muy sutil y el único signo pueden ser pequeños cambios en el color o el contorno de la mucosa4. Esto hace que estas lesiones sean difíciles de detectar y refuerza la necesidad de hacer una endoscopia de luz blanca con alta resolución y sumar técnicas de imagen mejorada (NBI, BLI, i scan), pueden considerarse una alternativa, pero actualmente su uso con preferencia a la endoscopia convencional con luz blanca no se recomienda en las guías, ni siquiera en poblaciones de alto riesgo.
El uso de inhibidores de la bomba de protones antes de la endoscopia también puede aumentar las probabilidades de que no se detecte una lesión31, al favorecer la cicatrización de la mucosa. Lo ideal sería que las endoscopias se realizaran antes de la prescripción de medicación antiácida. Se ha sugerido que el esófago medio y superior pueden ser mal inspeccionados, ya que el endoscopio puede retirarse rápidamente durante las fases finales del procedimiento, reduciendo así la posibilidad de visualizar lesiones sutiles29. En consonancia con otros estudios30,32, en el estudio actual se observó una mayor proporción de pacientes con lesiones esofágicas inadvertidas del tercio superior que se habían sometido a una endoscopia en el año anterior al diagnóstico que entre los pacientes con lesiones del tercio inferior o de la unión gastroesofágica.
En más de una tercera parte de las endoscopias inadvertidas se realizaron por síntomas de alarma como la disfagia, mientras que estos síntomas fueron más frecuentes en los pacientes con CED (37% versus 63%, p=0.027). Esto concuerda con el hecho de que los síntomas de alarma suelen asociarse a una enfermedad avanzada y con la menor tasa de endoscopias previas entre los pacientes con estadios T3 y T4.
Especial atención merece la relación EB y CEPE; si la proporción de CEPE se calculara sin tener en cuenta los 114 pacientes con EB, la tasa de CEPE caería del 6,6 al 5,3%, y el porcentaje de CEPE con antecedente de EB a un año mostró un 63% versus un 37% de ACE sin Barrett. Esta es una cifra alarmantemente alta de ACE no detectados y merece particular atención. Estos resultados ponen de relieve la necesidad de un cumplimiento más estricto de las directrices de los protocolos diagnósticos en EB, de una mayor atención al diagnóstico por imágenes avanzadas, en el protocolo de toma de biopsias y de una actitud más proactiva en el tratamiento de la enfermedad por reflujo gastroesofágico (ERGE). Incluso en diferentes series se excluyen los pacientes con EB al momento de realizar el análisis del CEPE18,21,32-34 o los Barrett sin displasia23,35,36, mientras el estudio de Yalamarthi et al.37 llama la atención sobre el papel inductor de error de la interpretación histológica (27%) al momento del diagnóstico.
Los puntos fuertes del estudio están en ser un estudio multicéntrico. Además, el estudio es único al explorar las características del paciente (clínicas y endoscópicas) y del tumor, como el estadio en el momento del diagnóstico, y su relación con la realización de endoscopias previas. Se excluyeron las endoscopias previas en los 3 meses anteriores al diagnóstico de cáncer para reducir el riesgo de incluir pacientes que estaban en seguimiento tras un hallazgo inicial preocupante.
El estudio tiene algunas limitaciones que podrían sesgar los resultados por su carácter retrospectivo y con una cohorte no muy grande de pacientes, con un seguimiento a mediano plazo. No hubo una estandarización en las ejecuciones de las endoscopias, así como tampoco se ha estandarizado la interpretación de los estudios histopatológicos.
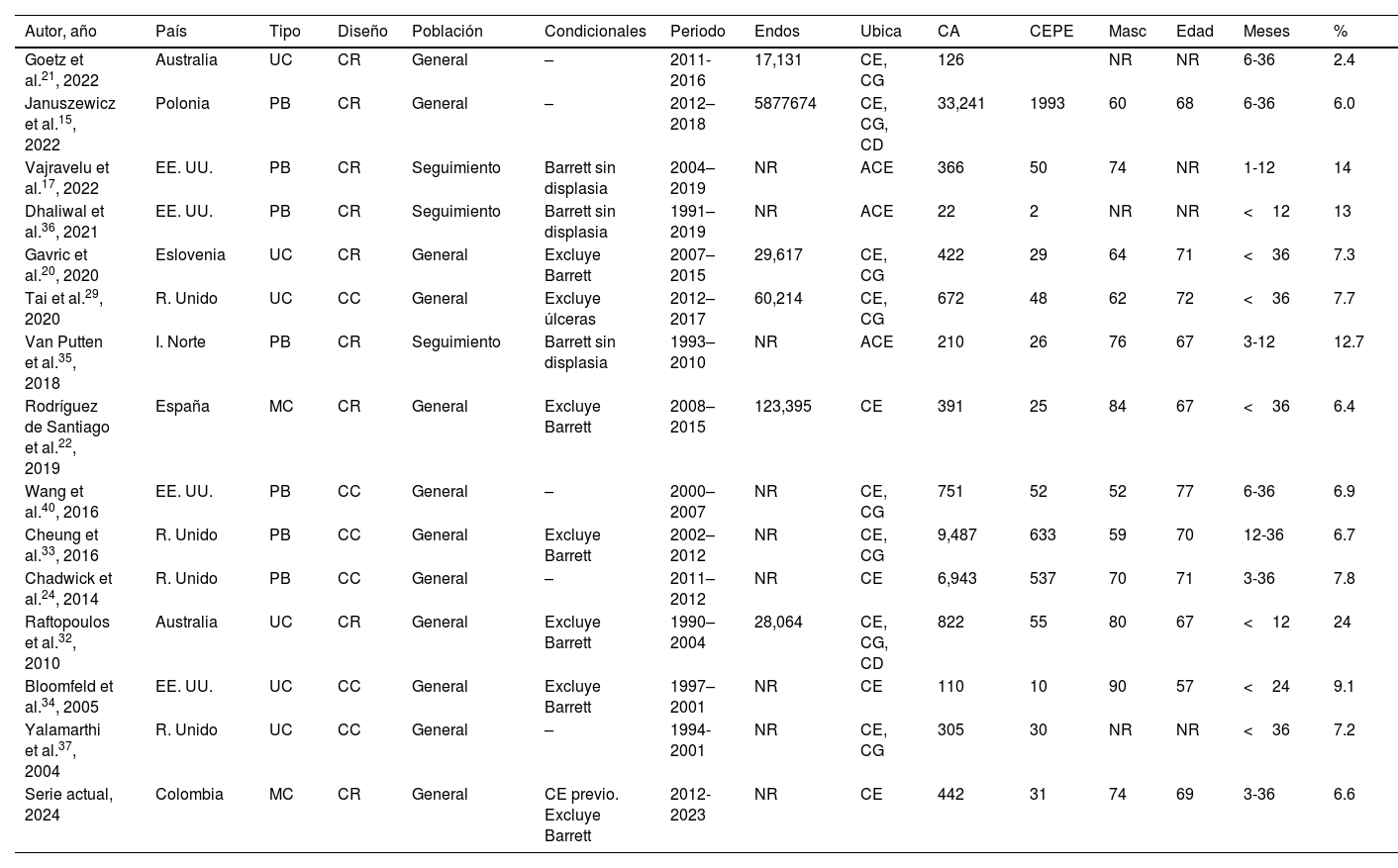
La evaluación inadecuada de las lesiones premalignas o focales, la calidad inadecuada de la endoscopia y biopsia y la mala toma de decisiones en torno a los planes de vigilancia o seguimiento se han identificado como las explicaciones más comunes del CEPE30. La tasa de CEPE no ajustada fue del 6,6%, que se situaba dentro del objetivo de <10% propuesto en una declaración de posición sobre las normas de calidad de la endoscopia en el Reino Unido38. Una visión más global del problema se recoge en la tabla 4 donde se recogen las diferentes series revisadas y publicadas al respecto, donde se hace evidente lo heterogéneo de los estudios.
Características de las diferentes publicaciones que hacen referencia al cáncer de esófago postendoscopia
| Autor, año | País | Tipo | Diseño | Población | Condicionales | Periodo | Endos | Ubica | CA | CEPE | Masc | Edad | Meses | % |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Goetz et al.21, 2022 | Australia | UC | CR | General | – | 2011- 2016 | 17,131 | CE, CG | 126 | NR | NR | 6-36 | 2.4 | |
| Januszewicz et al.15, 2022 | Polonia | PB | CR | General | – | 2012–2018 | 5877674 | CE, CG, CD | 33,241 | 1993 | 60 | 68 | 6-36 | 6.0 |
| Vajravelu et al.17, 2022 | EE. UU. | PB | CR | Seguimiento | Barrett sin displasia | 2004–2019 | NR | ACE | 366 | 50 | 74 | NR | 1-12 | 14 |
| Dhaliwal et al.36, 2021 | EE. UU. | PB | CR | Seguimiento | Barrett sin displasia | 1991–2019 | NR | ACE | 22 | 2 | NR | NR | <12 | 13 |
| Gavric et al.20, 2020 | Eslovenia | UC | CR | General | Excluye Barrett | 2007–2015 | 29,617 | CE, CG | 422 | 29 | 64 | 71 | <36 | 7.3 |
| Tai et al.29, 2020 | R. Unido | UC | CC | General | Excluye úlceras | 2012–2017 | 60,214 | CE, CG | 672 | 48 | 62 | 72 | <36 | 7.7 |
| Van Putten et al.35, 2018 | I. Norte | PB | CR | Seguimiento | Barrett sin displasia | 1993–2010 | NR | ACE | 210 | 26 | 76 | 67 | 3-12 | 12.7 |
| Rodríguez de Santiago et al.22, 2019 | España | MC | CR | General | Excluye Barrett | 2008–2015 | 123,395 | CE | 391 | 25 | 84 | 67 | <36 | 6.4 |
| Wang et al.40, 2016 | EE. UU. | PB | CC | General | – | 2000–2007 | NR | CE, CG | 751 | 52 | 52 | 77 | 6-36 | 6.9 |
| Cheung et al.33, 2016 | R. Unido | PB | CC | General | Excluye Barrett | 2002–2012 | NR | CE, CG | 9,487 | 633 | 59 | 70 | 12-36 | 6.7 |
| Chadwick et al.24, 2014 | R. Unido | PB | CC | General | – | 2011–2012 | NR | CE | 6,943 | 537 | 70 | 71 | 3-36 | 7.8 |
| Raftopoulos et al.32, 2010 | Australia | UC | CR | General | Excluye Barrett | 1990–2004 | 28,064 | CE, CG, CD | 822 | 55 | 80 | 67 | <12 | 24 |
| Bloomfeld et al.34, 2005 | EE. UU. | UC | CC | General | Excluye Barrett | 1997–2001 | NR | CE | 110 | 10 | 90 | 57 | <24 | 9.1 |
| Yalamarthi et al.37, 2004 | R. Unido | UC | CC | General | – | 1994- 2001 | NR | CE, CG | 305 | 30 | NR | NR | <36 | 7.2 |
| Serie actual, 2024 | Colombia | MC | CR | General | CE previo. Excluye Barrett | 2012- 2023 | NR | CE | 442 | 31 | 74 | 69 | 3-36 | 6.6 |
ACE: adenocarcinoma de esófago; CA: cáncer; CC: casos y controles; CD: cáncer de duodeno; CE: cáncer de esófago; CG: cáncer gástrico; CR: cohorte retrospectiva; MC: multicéntrico; PB: poblacional; UC: unicéntrico; NR: no reporta.
La inteligencia artificial (IA) está emergiendo como una herramienta poderosa en la gastroenterología, especialmente en la detección precoz de lesiones neoplásicas y preneoplásicas. Un estudio multicéntrico realizado en China demuestra el potencial de la IA para mejorar la detección de carcinomas escamosos superficiales del esófago y lesiones precancerosas, en áreas donde los métodos convencionales, como la endoscopia con luz blanca (WLE) y la imagen de banda estrecha no magnificada (NBI), pueden tener limitaciones. Los resultados del ensayo mostraron que la IA redujo la tasa de lesiones no detectadas, con una tasa de fallos por lesión del 1.7% en el grupo asistido por IA, comparado con el 6.7% en el grupo de rutina. Aunque la diferencia no fue estadísticamente significativa, la tendencia sugiere un beneficio clínico potencial de la IA, especialmente en términos de sensibilidad diagnóstica. Además, la IA podría ayudar a reducir la variabilidad en la interpretación entre endoscopistas, un desafío conocido en la detección de estas lesiones sutiles. Sin embargo, es crucial considerar la evaluación a largo plazo del costo-beneficio y la efectividad en escenarios clínicos reales. La integración de la IA en la práctica diaria debe ser cuidadosamente sopesada contra el costo adicional y la necesidad de entrenamiento del personal39.
Es necesario realizar estudios adicionales para determinar si una detección endoscópica mejorada mediante técnicas de imagen avanzadas (NBI, BLI, i scan), un mayor tiempo de inspección, un mayor número de biopsias y una aplicada repetición de la endoscopia en los plazos definidos) permitirían que la vigilancia del EB alcanzará un real impacto en la disminución de la incidencia y prevalencia del ACE; y los análisis de costo-efectividad de la propuesta deben soportarse con base en las implicaciones de estos hallazgos.
Para finalizar, basados en nuestros hallazgos y en la literatura existente, sugerimos que la implementación de las siguientes estrategias podría contribuir a reducir la tasa de CEPE: 1) cumplimiento estricto del protocolo de biopsias: es imprescindible adherirse rigurosamente a protocolos establecidos, como el protocolo de biopsias de Seattle para pacientes con EB, garantizando un muestreo adecuado de la mucosa para la detección temprana de displasia o neoplasia; 2) uso de técnicas de imagen avanzadas y fotodocumentación: la incorporación de técnicas de imagen mejoradas, como la imagen de banda estrecha (NBI, BLI, o iScan) o cromoendoscopia, aumenta la sensibilidad en la detección de lesiones sutiles, especialmente en el esófago proximal, donde estas pueden pasar desapercibidas; además, es recomendable la fotodocumentación con al menos 4imágenes del esófago (regiones alta, media, cardias y retrovisión); 3) aumento del tiempo de inspección y uso de sedación: es esencial dedicar un tiempo adecuado a la inspección endoscópica, sugiriéndose un mínimo de 7 min para la endoscopia, o un minuto por cada centímetro de EB, para minimizar el riesgo de pasar por alto lesiones neoplásicas; la sedación puede ser una herramienta valiosa para asegurar la colaboración del paciente y reducir el malestar durante el procedimiento; 4) seguimiento proactivo en pacientes de alto riesgo: los pacientes con tumores de cabeza y cuello, EB o antecedentes familiares de adenocarcinoma esofágico deben estar bajo vigilancia endoscópica regular, con un enfoque proactivo en la detección temprana de cambios malignos), y 5) revaluación de endoscopias negativas: en casos de endoscopias previamente negativas, especialmente en pacientes sintomáticos, de alto riesgo, o con hallazgos endoscópicos equívocos, se debe considerar una reevaluación temprana utilizando técnicas avanzadas y, posiblemente, repetir la endoscopia para asegurar que no se hayan omitido lesiones importantes.
ConclusiónEste estudio demuestra que el 6.6% de los cánceres de esófago se diagnosticaron después de una endoscopia previa negativa, una omisión diagnóstica que fue significativamente más común en pacientes con esófago de Barrett, tumores proximales, enfermedad asintomática y estadios iniciales. Estos resultados subrayan la necesidad de optimizar la práctica endoscópica, enfocándose en una inspección meticulosa del esófago proximal y en la adherencia estricta a los protocolos de biopsia en los grupos de alto riesgo identificados, para así reducir la tasa de cáncer postendoscopia.
Uso de inteligencia artificialEn esta investigación científica no se utilizó inteligencia artificial en ninguna etapa del proceso, incluyendo el diseño, recolección de datos, análisis o interpretación de resultados. Todos los procedimientos y análisis fueron realizados de manera manual por el equipo de investigación, garantizando que las conclusiones se basen únicamente en métodos tradicionales de investigación científica y el juicio médico.
FinanciaciónLa financiación del estudio se hizo con base en los recursos propios de los autores.
Conflicto de interesesLos autores manifiestan no tener ningún conflicto de interés.