La hiperglucemia es un fenómeno frecuente en los pacientes hospitalizados asociado a desenlaces negativos, y es frecuente en los pacientes trasplantados de hígado como un fenómeno de estrés y asociada a medicamentos inmunosupresores. Aunque los estudios son escasos, el antecedente de diabetes, así como la hiperglucemia durante el trasplante hepático, se han asociado con mayor riesgo de rechazo.
ObjetivoEstudiar si la hiperglucemia durante las primeras 48h después de un trasplante hepático se asocia a un mayor riesgo de infección, rechazo o estancia hospitalaria.
MétodosEstudio de cohorte de tipo retrospectivo en pacientes mayores de 15años que recibieron un trasplante hepático. Se definió la hiperglucemia como un valor superior a 140mg/dl y se midió de 3 maneras diferentes (como un valor aislado, como la media de los valores y como un valor ponderado en el tiempo) y se analizó su relación con el riesgo de rechazo agudo, infección y tiempo de estancia hospitalaria.
ResultadosUn 94% de los pacientes presentó alguna forma de hiperglucemia durante las primeras 48h postrasplante independientemente de cómo esta fue definida, y no hubo un mayor riesgo de rechazo (OR: 1.49; IC95%: 0.55-4.05), infección (OR: 0.62; IC95%: 0.16-2.25) o tiempo de estancia hospitalaria entre los pacientes que la presentaron y los que no.
ConclusiónLa hiperglucemia durante las primeras 48h después de un trasplante pareciera ser un fenómeno esperable en la mayoría de pacientes y no se asocia a un mayor riesgo de rechazo, infección y no impacta en el tiempo de estancia hospitalaria.
Hyperglycemia is a frequent phenomenon in hospitalized patients that is associated with negative outcomes. It is common in liver transplant patients as a result of stress and is related to immunosuppressant drugs. Although studies are few, a history of diabetes and the presentation of hyperglycemia during liver transplantation have been associated with a higher risk for rejection.
AimsTo analyze whether hyperglycemia during the first 48hours after liver transplantation was associated with a higher risk for infection, rejection, or longer hospital stay.
MethodsA retrospective cohort study was conducted on patients above the age of 15years that received a liver transplant. Hyperglycemia was defined as a value above 140mg/dl and it was measured in three different manners (as an isolated value, as a mean value, and as a weighted value over time). The relation of hyperglycemia to a risk for acute rejection, infection, or longer hospital stay was evaluated.
ResultsSome form of hyperglycemia was present in 94% of the patients during the first 48 post-transplantation hours, regardless of its definition. There was no increased risk for rejection (OR: 1.49; 95%CI: 0.55-4.05), infection (OR: 0.62; 95%CI: 0.16-2.25), or longer hospital stay between the patients that presented with hyperglycemia and those that did not.
ConclusionsHyperglycemia during the first 48hours after transplantation appeared to be an expected phenomenon in the majority of patients and was not associated with a greater risk for rejection or infection and it had no impact on the duration of hospital stay.
La hiperglucemia se define como cualquier valor de glucemia >140mg/dl1. Ocurre en el 32 al 38% de todos los pacientes hospitalizados, en el 41% de los críticamente enfermos, en el 44% de los pacientes con falla cardiaca y hasta en el 80% de los pacientes después de cirugía cardiaca. Entre el 30 y el 80% de esos individuos no tiene antecedente de diabetes2. La hiperglucemia de estrés es la que se presenta en pacientes sin antecedente de diabetes y usualmente es transitoria, es causada por hormonas contrarreguladoras (como el cortisol y la adrenalina) y por el incremento en la resistencia a la insulina3,4, pero el factor más importante pareciera ser la gluconeogénesis hepática5. La hiperglucemia en un paciente hospitalizado, especialmente en los trasplantados, también puede ser consecuencia del uso de diferentes tipos de medicamentos, como glucocorticoides y otros inmunosupresores6,7.
Los efectos deletéreos de la hiperglucemia en el largo plazo son bien conocidos, especialmente los relacionados con el daño micro y macrovascular8,9. En el contexto del paciente agudo la hiperglucemia produce cambios en el sistema inmune10 y la coagulación11. Además, las fluctuaciones en los niveles de glucosa inducen apoptosis en las células endoteliales, causando disfunción endotelial12.
En pacientes sin antecedentes de diabetes la hiperglucemia es un marcador de mortalidad, especialmente en aquellos en unidades de cuidados intensivos (UCI), y también se asocia a mayores tiempos de estancia hospitalaria y mayor riesgo de infección postoperatoria13-15. La hiperglucemia también se ha asociado a eventos adversos en pacientes con infarto agudo de miocardio16-19 y con enfermedad cerebrovascular (ECV)20,21.
La diabetes, por otra parte, es una comorbilidad frecuente en los pacientes en lista de espera para trasplante hepático, presentándose hasta en el 65% de ellos22. A pesar de lo anterior, la evidencia que existe acerca de la hiperglucemia como un factor de riesgo para desenlaces negativos en pacientes trasplantados es escasa, aunque en general la diabetes se asocia a un peor pronóstico en los pacientes trasplantados de hígado. La prevalencia de la diabetes en el postrasplante es tan alta como 31-38%23, y estos pacientes tienen un mayor riesgo de complicaciones cardiovasculares, como hipertensión arterial y enfermedad coronaria, al igual que mayor mortalidad en comparación a aquellos que no desarrollan diabetes24,25. Así mismo, los pacientes que desarrollan diabetes postrasplante tienen un mayor número de episodios de rechazo agudo, complicaciones infecciosas y neurológicas26-28.
Se han propuesto diferentes mecanismos por los cuales la hiperglucemia podría producir daño del injerto e incrementar el riesgo de rechazo. La hiperglucemia incrementa la coestimulación y la presentación de antígenos, incrementa el daño isquémico29 y la reacción inflamatoria asociada a la reperfusión30, aumenta la producción de citoquinas y la expresión de moléculas de adhesión, así como la activación de células dendríticas31,32.
Algunos estudios observacionales han evaluado el impacto de la diabetes en la supervivencia de los pacientes y el riesgo de complicaciones en el postrasplante inmediato26,33, mientras que otros han reportado asociación entre la hiperglucemia durante el intraoperatorio y el riesgo de infección postoperatoria y mortalidad a un año de seguimiento34,35, pero en ninguno se tuvo en cuenta el control metabólico durante el postrasplante inmediato, que ha sido evaluado solo en pacientes sometidos a trasplante de médula ósea y renal36-39.
Basado en lo anterior, decidimos realizar un estudio observacional para determinar si existe asociación entre los valores aumentados de glucemia durante las 48h posteriores al trasplante de hígado y el riesgo de rechazo temprano, infecciones bacterianas o un mayor tiempo de estancia hospitalaria. Nuestra hipótesis fue que la presencia de hiperglucemia sostenida en ese periodo de tiempo se asocia con mayor riesgo de rechazo temprano, mayor riesgo de infección hospitalaria y mayor tiempo de estancia.
Materiales y métodosDiseño y población de estudioSe diseñó un estudio de cohorte de tipo retrospectivo en el cual se analizaron todos los registros de los pacientes trasplantados de hígado durante los años 2006 a 2011 en el Hospital Pablo Tobón Uribe, un hospital universitario de alto nivel de complejidad y centro de trasplantes en la ciudad de Medellín. Incluimos pacientes mayores de 15años que tuvieran por lo menos una determinación de glucemia en las primeras 48h después del trasplante y se excluyeron todos los que murieron como consecuencia de complicaciones quirúrgicas en las primeras 24h del postrasplante.
MedicionesSe documentaron todos los valores de glucemia registrados en las primeras 48h postrasplante desde el ingreso del paciente a la UCI y se emplearon 3 medidas diferentes para determinar la hiperglucemia: a)al menos un valor >140mg/dl; b)la media o la mediana de todas las mediciones >140mg/dl), y c)el valor ponderado en el tiempo (equivalente a un área bajo la curva de todas las mediciones) de la glucosa >140mg/dl. Para esta última medición se asumió una relación lineal entre los valores de mediciones realizadas con intervalos de 2 o más horas, y el resultado que se obtiene es el porcentaje de tiempo de las primeras 48h postrasplante en el cual el paciente tuvo valores de glucosa >140mg/dl40. Se discriminaron los pacientes de acuerdo con el antecedente de diabetes mellitus. La infección se estableció como probada o probable en los primeros 30días postrasplante de acuerdo con las definiciones del Center for Diseases Control (CDC)41 y con los registros de la historia clínica. Se definió el rechazo celular agudo temprano del injerto hepático por el equipo médico encargado del tratamiento del paciente en aquellos casos en los cuales se detectaron anormalidades bioquímicas acompañadas de cambios histológicos de rechazo en los primeros 90días después del trasplante. La mortalidad hospitalaria fue definida como la muerte del paciente por causas diferentes a complicaciones inherentes al acto quirúrgico en la misma hospitalización.
Dentro de las variables de confusión para el riesgo de rechazo del injerto se tuvieron en cuenta la sensibilización previa de acuerdo con la presencia de anticuerpos preformados dirigidos al complejo mayor de histocompatibilidad (MHC) anti-HLA registrados en la historia clínica, el inicio de tratamiento con inhibidores de la calcineurina 72h después del trasplante hepático y la condición que llevó al paciente a requerir un trasplante, cirrosis alcohólica, criptogénica, de origen viral, autoinmune u otras causas. Las variables de confusión consideradas para el riesgo de infección fueron el uso de nutrición parenteral, la estancia en la UCI, la necesidad de transfusión después del trasplante42, la edad y el sexo femenino43.
Plan de análisisLas variables continuas se presentan como medianas con rangos intercuartílicos o como medias con desviaciones estándar. Las variables nominales se presentan como proporciones con intervalos de confianza. La exploración de asociación para variables dicotómicas se hizo por medio de las pruebas de Chi cuadrado o la prueba exacta de Fisher, de acuerdo con el valor esperado de las celdas, y la magnitud de asociación se estableció por medio de un riesgo relativo indirecto (odds ratio) obtenido por la aproximación de Woolf con intervalo de confianza del 95%. La exploración de asociación para variables continuas se hizo por medio de la prueba t de Student asumiendo varianzas desiguales.
ResultadosSe recogieron los datos de 316 pacientes sometidos a trasplante hepático y se excluyeron del análisis 152 por carecer de resultados de glucemia en las primeras 48h postrasplante (n=142) y por fallecimiento en el mismo procedimiento o en el postoperatorio inmediato (n=10). La proporción de rechazos en estos excluidos fue del 10.5% (n=16). De los 164 pacientes analizados, 108 (66%) eran hombres y el promedio de edad fue de 51±12.3años. En la tabla 1 se muestra la información general de la población.
Características generales de la población
| Variable | n=164 |
| Edad (rango) | 51±12.3 (15-70) |
| Sexo, n (%) | |
| Hombres | 108 (65.8%) |
| Diabetes mellitus | |
| Antecedente de diabetes mellitus, n (%) | 48 (28%) |
| Desarrollo de diabetes postrasplante, n (%) | 35 (30%) |
| Estancia hospitalaria en días (rango) | 20±19.9 (4-139) |
| Estancia en UCI en días (rango) | 5.5±9.1 (1-100) |
| Uso de NPT (porcentaje), n (%) | 13 (8%) |
| Transfusión de glóbulos rojos (porcentaje), n (%) | 120 (74%) |
| Inicio tardío de los anticalcineurínicos, n (%) | 12 (7.3%) |
| Causa del trasplante, n (%) | |
| Cirrosis alcohólica | 33 (20%) |
| Cirrosis criptogénica | 23 (14%) |
| Hepatitis viral (virus B y C) | 33 (20%) |
| Hepatitis autoinmune | 33 (20%) |
| Otras | 42 (25.6%) |
| MELD (rango) | 18.6±5.5 (8-39) |
| Inmunosupresión | |
| Esteroides | 164 (100%) |
| Azatioprina | 152 (92.6%) |
| Ciclosporina | 158 (96.3%) |
| Rechazo celular agudo temprano, n (%) | 33 (20%) |
| Infección, n (%) | 12 (7,3%) |
| Infección urinaria | 4 |
| Neumonía | 4 |
| Infección abdominal | 2 |
| Flebitis | 1 |
| Fungemia | 1 |
| Muerte, n (%) | 26 (16%) |
UCI: unidad de cuidados intensivos; NPT: nutrición parenteral.
De acuerdo con las definiciones establecidas, el 94% de los pacientes analizados presentó por lo menos una forma de hiperglucemia: al menos un valor por encima de 140mg/dl en 154 pacientes y la media de todas las mediciones >140mg/dl en 140 pacientes. El promedio de la glucemia al momento de ingreso en la UCI fue de 182±55mg/dl, y los pacientes analizados permanecieron un 30% del tiempo de las primeras 48h, en promedio, con valores de glucemia por encima de 140mg/dl. En el análisis bivariado la hiperglucemia, independientemente de su definición, no se asoció con un mayor riesgo de rechazo, infección o más tiempo de estancia hospitalaria (tabla 2). Al realizar el análisis en los pacientes sin antecedente de diabetes o en los que tuvieron más de una medición de glucosa en las primeras 48h, los resultados no variaron (tablas 3 y 4). Ninguno de los factores considerados como potenciales variables de confusión (inicio tardío de los anticalcineurínicos, la histocompatibilidad HLA, la causa por la cual los pacientes requirieron el trasplante, sexo, edad, necesidad de transfusión, uso de NPT o tiempo de estancia en la UCI) se asoció con el riesgo de rechazo o de infección (datos no mostrados).
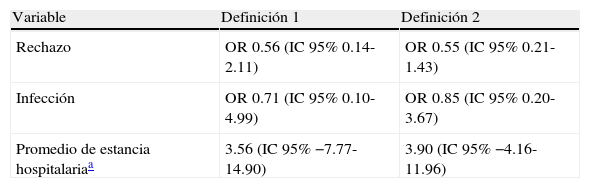
Asociación entre rechazo agudo, infección nosocomial o tiempo de estancia hospitalaria y diferentes definiciones de hiperglucemia (n=164)
| Variable | Definición 1 | Definición 2 |
| Rechazo | OR 0.56 (IC95% 0.14-2.11) | OR 0.55 (IC95% 0.21-1.43) |
| Infección | OR 0.71 (IC95% 0.10-4.99) | OR 0.85 (IC95% 0.20-3.67) |
| Promedio de estancia hospitalariaa | 3.56 (IC95% −7.77-14.90) | 3.90 (IC95% −4.16-11.96) |
| Definición 3 | |
| Rechazo | 8.05 (IC95% −0.31-16.42) |
| Infección | 6.57 (IC95% −13.30-26.46) |
| Promedio de estancia hospitalariaa | −4.42 (IC95% −1.71-2.32) |
Definiciones de hiperglucemia: 1) por lo menos un valor >140mg/dl; 2) media de todas las mediciones >140 mg/dl, y 3) valor ponderado en el tiempo.
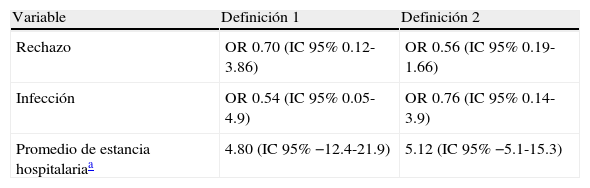
Asociación entre rechazo agudo, infección nosocomial o tiempo de estancia hospitalaria y diferentes definiciones de hiperglucemia en los pacientes no diabéticos (n=116)
| Variable | Definición 1 | Definición 2 |
| Rechazo | OR 0.70 (IC95% 0.12-3.86) | OR 0.56 (IC95% 0.19-1.66) |
| Infección | OR 0.54 (IC95% 0.05-4.9) | OR 0.76 (IC95% 0.14-3.9) |
| Promedio de estancia hospitalariaa | 4.80 (IC95% −12.4-21.9) | 5.12 (IC95% −5.1-15.3) |
| Definición 3 | |
| Rechazo | 6.27 (IC95% −1.6-14.16) |
| Infección | 16.6 (IC95% 10.95-22.2) |
| Promedio de estancia hospitalariaa | −6.4 (IC95% −16.0-3.4) |
Definiciones de hiperglucemia: 1) por lo menos un valor >140 mg/dl; 2) media de todas las mediciones >140 mg/dl, y 3) valor ponderado en el tiempo.
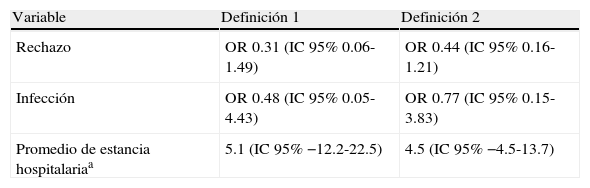
Asociación entre rechazo agudo, infección nosocomial o tiempo de estancia hospitalaria y diferentes definiciones de hiperglucemia en los pacientes con más de una medición de glucosa en las primeras 48 horas (n=153)
| Variable | Definición 1 | Definición 2 |
| Rechazo | OR 0.31 (IC95% 0.06-1.49) | OR 0.44 (IC95% 0.16-1.21) |
| Infección | OR 0.48 (IC95% 0.05-4.43) | OR 0.77 (IC95% 0.15-3.83) |
| Promedio de estancia hospitalariaa | 5.1 (IC95% −12.2-22.5) | 4.5 (IC95% −4.5-13.7) |
| Definición 3 | |
| Rechazo | 8.9 (IC95% 0.26-17.5) |
| Infección | 8.6 (IC95% −11.2-28.5) |
| Promedio de estancia hospitalaria* | −4.9 (IC95% −11.7-1.79) |
Definiciones de hiperglucemia: 1) por lo menos un valor >140 mg/dl; 2) media de todas las mediciones >140 mg/dl, y 3) valor ponderado en el tiempo.
En los pacientes diabéticos no se encontró mayor riesgo de infección (OR: 2.3; IC95%: 0.48-10.9) ni diferencia en el tiempo de estancia hospitalaria (20.7 días vs 19 días) al compararlos con los no diabéticos. La proporción de pacientes diabéticos en lista de espera de estos pacientes es alta (28%), y la cantidad de pacientes que desarrollaron diabetes después del trasplante es considerable (30%).
DiscusiónEn nuestro estudio tratamos de esclarecer si la hiperglucemia, definida bien sea como un valor aislado, promedio o ponderado en el tiempo, se asocia con un mayor riesgo de rechazo, infección o mayor tiempo de estancia hospitalaria. Los resultados encontrados muestran que una gran proporción de pacientes sometidos a trasplante hepático presentan algún grado de hiperglucemia durante las primeras 48h después del trasplante, y que un número importante de estos tiene valores elevados durante la mayor parte de este tiempo. Sin embargo, estos valores elevados de glucosa, independientemente de que se consideren valores aislados, promedio o ponderados, no se asocian a un mayor riesgo de infección o de rechazo, o a mayor tiempo de estancia. Adicionalmente, cuando se consideró el antecedente de diabetes tampoco se encontró mayor riesgo de infección durante el postoperatorio.
De acuerdo con investigaciones previas en modelos animales y algunas observaciones clínicas, la hiperglucemia se asocia con alteraciones inmunes y no inmunes que pudieran incrementar el riesgo de rechazo e infección en los pacientes trasplantados. Estas incluyen una mayor respuesta inflamatoria asociada a la isquemia por reperfusión, la cual parece estar mediada por una adhesión leucocitaria exagerada al endotelio30,44. Adicionalmente, la hiperglucemia en el postoperatorio refleja un estado de resistencia a la insulina, el cual se asocia valores más altos de factor de necrosis tumoral alfa y de interleucina1, 6 y 12, todo lo cual favorece un estado de inflamación sistémica que pudiera incrementar la respuesta inmunológica contra el injerto45. Finalmente, los niveles elevados de glucemia incrementan la expresión de las moléculasi y ii del complejo mayor de histocompatibilidad, con el subsecuente incremento potencial de los mecanismos de activación de la respuesta inmune innata46. Desde el punto de vista clínico, en un análisis realizado en 184 pacientes en quienes se evaluaron los niveles intraoperatorios de glucemia34, los autores reportaron que valores superiores a 150mg/dl se asociaban con un mayor riesgo de infección en los 30días siguientes a la cirugía, y también con una mayor mortalidad a un año.
Por otra parte, se han realizado múltiples estudios para evaluar el impacto que tiene la hiperglucemia en los pacientes hospitalizados. En un estudio publicado por Umpierrez et al.13, en el cual la hiperglucemia se definió de acuerdo con sus valores aislados, esta se asoció con un mayor tiempo de estancia hospitalaria. En otro estudio14, donde se consideraron también valores aislados en el postoperatorio inmediato, la hiperglucemia se asoció a un riesgo 5 veces mayor de presentar infecciones nosocomiales durante la misma hospitalización. Cuando se han evaluado desenlaces en pacientes hospitalizados críticamente enfermos teniendo en cuenta el tiempo que permanecen elevados los niveles de glucosa, se ha encontrado que puede existir algún beneficio en la mortalidad si los valores se mantienen en un rango entre 144-200mg/dl40. Así como se ha descrito en otras series22, la proporción de pacientes diabéticos en lista de espera en nuestro estudio es alta, y una cantidad considerable, también similar a la descrita en otros estudios23, de los pacientes no diabéticos desarrollaron diabetes mellitus después del trasplante.
La mayoría de estudios que han evaluado la glucemia en los pacientes hospitalizados la definen usualmente como uno o varios valores alterados en un periodo de tiempo. Pero es importante considerar no solamente valores aislados o promediados, sino también el tiempo al cual el paciente está sometido a estos valores elevados de glucosa, ya que estas diferencias en la medición pudieran explicar en parte los resultados contradictorios encontrados en los diferentes estudios donde se ha intervenido el control glucémico40,47-51.
Una de las limitaciones importantes de este estudio es el elevado número de pacientes que fueron excluidos por no contar con el registro adecuado de la medición de glucosa en las primeras 48h postrasplante, y la consiguiente disminución del tamaño de muestra efectivo para detectar diferencias. Sin embargo, todas las medidas de hiperglucemia parecían favorecer a la misma como un «factor protector» de eventos adversos, y la proporción de rechazos fue incluso menor en los pacientes no incluidos (10% vs. 20%). Una fortaleza importante del estudio es su detallada exploración de la variable de exposición, con las diferentes maneras como se definió la hiperglucemia buscando asociación no solo con valores aislados sino considerando también el tiempo que estos valores permanecen elevados.
A pesar de las limitaciones correspondientes a un estudio observacional en términos de confusión residual y tipo de población, esta investigación muestra que probablemente la hiperglucemia es un fenómeno frecuente en el postoperatorio inmediato de los pacientes sometidos a trasplante hepático, y que las complicaciones como rechazo e infección dependen fundamentalmente de otro tipo de factores, como los medicamentos inmunosupresores, la histocompatibilidad y la edad, entre otros. Un ensayo clínico podría confirmar si realizar alguna forma de control metabólico en los pacientes trasplantados de hígado proporciona algún beneficio en términos de rechazo o infección. No obstante, en los pacientes sometidos a trasplante renal en quienes se realiza control estricto de la glucemia los riesgos parecen superar los beneficios39, y en pacientes críticamente enfermos atendidos en la UCI esta misma intervención parece acarrear también un alto riesgo de hipoglucemia y una mayor mortalidad51. Los anteriores hallazgos, y los resultados de nuestro estudio, sugieren que el control glucémico aporta poco en términos de complicaciones en los pacientes sometidos a trasplante hepático.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
a) Corticosteroides
Metilprednisolona 500mg i.v. en la fase anhepática. Se continuará en el postoperatorio de la siguiente manera:
- -
Día 1: metilprednisolona 200mg, vía i.v., en 4 dosis de 50mg/6h.
- -
Día 2: metilprednisolona 160mg, vía i.v., en 4 dosis de 40mg/6h.
- -
Día 3: metilprednisolona 120mg, vía i.v., en 4 dosis de 30mg/6h.
- -
Día 4: metilprednisolona 80mg, vía i.v., en 2 dosis de 40mg/12h.
- -
Día 5: metilprednisolona 40mg, vía i.v., en una dosis.
- -
A partir del día 6: prednisona oral a dosis de 20mg/día en las mañanas.
b) Azatioprina
1-2mg/kg desde el postrasplante inmediato por sonda nasogástrica y luego por vía oral. En caso de disfunción renal, o cualquier otra contraindicación para la utilización del inhibidor de la calcineurina, se iniciará micofenolato 1.5g por vía oral cada 12h.
c) Inhibidores de la calcineurina
Ciclosporina o tacrolimus: se iniciarán una vez el paciente esté estable hemodinámicamente, con buena diuresis y sin disfunción renal.
El medicamento de elección es la ciclosporina por vía oral o sonda gástrica a dosis crecientes hasta obtener los niveles terapéuticos o se presenten efectos colaterales.
d) Terapia de inducción
Solo se utilizará basiliximab o daclizumab en pacientes con disfunción renal preoperatoria o en los pacientes a quienes se les practique trasplante de hígado y riñón. Se colocaran 2 dosis, una en las primeras 6h postrasplante, y la segunda el día 3 postrasplante.