Existen discrepancias en el diagnóstico y el manejo de la alergia a las proteínas de la leche de vaca (APLV) en Iberolatinoamérica. El objetivo del estudio fue conocer la forma como el gastroenterólogo pediatra en Iberolatinoamérica realiza el diagnóstico y el tratamiento de la APLV.
Material y métodosSe invitó a los gastroenterólogos pediatras miembros de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición a contestar una encuesta estructurada y se comparó con las pautas de diagnóstico y tratamiento expresadas en el consenso y la guía publicadas en 2012 y 2014, respectivamente.
ResultadosEl 17% sigue las recomendaciones diagnósticas basadas en la evidencia del consenso y guía publicada. Para la APLV no mediada por IgE, el 15% utiliza pruebas cutáneas IgE específicas vs. el 57% en las mediadas por IgE; el 22 vs. 83% realiza determinación de IgE específica en sangre, respectivamente. La confirmación diagnóstica con prueba de reto oral es realizada por el 45 vs. el 22%, respectivamente. Una vez confirmado el diagnóstico, el 98% entrega recomendaciones dietarias. En niños no alimentados con leche materna, el 89% inicia con fórmula extensamente hidrolizada, el 9% con aminoacídica, el 1% con fórmula de soja y el 1% con fórmula de arroz hidrolizada. La prueba de tolerancia en APLV-IgE se realiza en el 34% una vez cumplido el tiempo de tratamiento, en el 39% según la gravedad de los síntomas, y en 27% con la negativización de test IgE específicos.
ConclusiónExiste mucha diversidad en el manejo de la APLV y una pobre adherencia a las guías de práctica clínica.
There are discrepancies in the diagnosis and management of cow's milk protein allergy (CMPA) in Spain and Latin America. The aim of the present study was to find out how Spanish and Latin American pediatric gastroenterologists diagnose and treat CMPA.
Material and methodsPediatric gastroenterologists, members of the Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición, were invited to fill out a structured survey, the results of which were then compared with the 2012 and 2014 diagnosis and treatment guidelines, respectively.
ResultsThe survey results showed that 17% of the participants follow the diagnostic recommendations based on the published consensus and guidelines. To diagnose non-IgE-mediated CMPA, 15% of the participants utilize IgE-specific skin prick tests, 22% use IgE-specific blood tests, and 45% employ oral food challenges. To diagnose IgE-mediated CMPA the percentages for the same diagnostic methods were 57, 83 and 22%, respectively. Once diagnosis is confirmed, 98% of the participants provide dietary recommendations. In children that are not breastfed, 89% of the participants prescribe an initial extensively hydrolyzed formula, 9% an amino acid formula, 1% a soy formula, and 1% a hydrolyzed rice formula. In patients with IgE-mediated CMPA, 34% of the participants carry out an oral challenge once treatment is completed, 39% according to symptom severity, and 27% in relation to IgE-specific testing.
ConclusionCMPA management is diverse and there is poor adherence to the clinical practice guidelines.
Las alergias alimentarias incluyen un amplio espectro de trastornos que resultan de respuestas inmunes adversas a antígenos alimentarios. La alergia a las proteínas de la leche de vaca (APLV) se define como una reacción adversa a alguna de las proteínas de la leche de vaca (PLV), las cuales se agrupan en 2 grupos: a) caseínas, y b) proteínas del suero, destacando en este último la alfa-lactoalbúmina y la beta-lactoglobulina, a través de una respuesta inmunológica específica mediada o no por inmunoglobulina E (IgE). Las PLV habitualmente son las primeras proteínas alimentarias, de origen no humano, ingeridas por los lactantes y, por lo tanto, la APLV es la forma de alergia alimentaria más frecuente en los primeros meses de la vida1–3. La prevalencia de APLV en Latinoamérica es desconocida, aunque parece estar incrementándose siguiendo el mismo comportamiento que en el resto de los países del mundo.
El cuadro clínico de presentación en la APLV es muy variable y el diagnóstico de esta enfermedad se basa fundamentalmente en el conocimiento de su expresión clínica. Puede incluir manifestaciones en más de un sistema: gastrointestinal (50 a 60%), tegumentario (30 a 50%) y aparato respiratorio (20 a 30%)4. Las manifestaciones clínicas pueden clasificarse: 1) por la temporalidad en la aparición de la sintomatología (inmediatas o retardadas), ya que las reacciones alérgicas a alimentos están caracterizadas por una relación temporal entre la reacción y la previa exposición al alimento; 2) por el órgano o sistema que afecta, por lo que la alergia se presenta como síndromes, y 3) por el mecanismo inmune involucrado: mediadas por la IgE, no mediadas por IgE o mixtas. El conocimiento de la presentación clínica de la APLV permite sospechar el diagnóstico5.
El término APLV no mediada por IgE incluye todas las reacciones adversas a PLV en las que no se ha comprobado la existencia de IgE frente a estas proteínas. Los síntomas suelen aparecer después de una hora e incluso después de varios días. Las reacciones pueden ser generalizadas, síntomas solo digestivos, síntomas digestivos y cutáneos y pocas veces respiratorios, siendo frecuente la afectación nutricional. Los síntomas son leves o moderados. El diagnóstico se basa en la provocación oral (enfrentamiento o prueba de exposición oral controlada) y normalmente se resuelve alrededor del año de edad1–3. En el caso de la APLV mediada por IgE, la aparición de síntomas se da entre unos minutos y una hora tras la exposición a PLV, y la gravedad de los síntomas puede ser desde formas leves a cuadros graves de anafilaxia. El diagnóstico se basa en la provocación o prueba de reto, la cual está contraindicada en las formas graves. La cuantificación de la IgE específica sérica contribuye en el seguimiento y es de ayuda para decidir el momento del enfrentamiento para medir la tolerancia a la proteína en caso de APLV mediada por IgE, que puede lograrse habitualmente pasado el año de edad1,2.
La historia clínica con un interrogatorio dirigido a la historia alimentaria, con la introducción detallada de los distintos alimentos en relación con la aparición de los síntomas, permitirá identificar el potencial alérgeno y detectar el mecanismo fisiopatológico5. La estricta suspensión de las PLV es el paso inicial hacia el diagnóstico de alergia2,6. La mejoría clínica con la resolución de los síntomas, junto con una fuerte sospecha por la historia clínica y la recaída de la enfermedad con el enfrentamiento o reto, constituyen el único elemento diagnóstico de confirmación en el caso de la APLV no mediada por IgE. El enfrentamiento provee una fuerte evidencia en ausencia de pruebas de laboratorio en el caso de la APLV no mediada por IgE, tanto al diagnóstico como posteriormente, para valorar la adquisición de tolerancia; en la APLV mediada por IgE, la cuantificación de IgE específica o las pruebas cutáneas son confirmatorias del diagnóstico y sirven evolutivamente para valorar la reintroducción de la PLV o la adquisición de la tolerancia2,7–9.
El tratamiento de la APLV consiste en la restricción de las PLV. Se debe suspender la PLV de la dieta de la madre en aquellos niños alimentados con leche materna y se deben utilizar fórmulas con proteínas extensamente hidrolizadas (HE) o a base de aminoácidos en aquellos niños alimentados con fórmula. Se debe suspender totalmente la PLV de la dieta en aquellos niños con alimentación complementaria. Los niños que cursan APLV con compromiso intestinal o enteropatía por APLV presentan con frecuencia síntomas de malabsorción de nutrientes, manifestada con diarrea crónica, dolor abdominal, cólicos, vómitos, esteatorrea o fallo en el crecimiento. En estos casos la lesión intestinal se puede acompañar además de déficit de lactasa y la consecuente intolerancia a la lactosa, por lo que esos casos podrán requerir al inicio del tratamiento y hasta la normalización de la lesión intestinal la restricción de lactosa7–9. Sin embargo, esto no significa que todos los pacientes con APLV requieran la restricción de lactosa.
En Latinoamérica expertos en APLV se reunieron en 2012 con el fin de elaborar un consenso10 y en 2014 para confeccionar una guía para el diagnóstico y el tratamiento de la APLV11. El objetivo del estudio fue conocer de qué forma el gastroenterólogo pediatra realiza el diagnóstico y el tratamiento de APLV en Iberolatinoamérica y comparar con las pautas de diagnóstico y tratamiento expresadas en el consenso y la guía publicadas en 2012 y 2014, respectivamente.
Material y métodosSe realizó un estudio observacional, transversal, tipo encuesta exploratoria, multicéntrico, en profesionales de la salud de países que forman parte de la Sociedad Latinoamericana de Gastroenterologí, Hepatología y Nutrición Pediátrica (SLAGHNP). La encuesta fue elaborada por los investigadores (MCT, ERR y RVF) del Grupo de Trabajo de Alergia alimentaria de la SLAGHNP y consistió en 22 preguntas sobre procedimientos diagnósticos y terapéuticos sobre la APLV. Se aplicó entre junio de 2016 y junio de 2017. La encuesta se envió de forma inicial vía correo electrónico y posteriormente se colocó en la web de la SLAGHNP para su cumplimentación en línea, accesible a todos los gastroenterólogos y nutricionistas pediatras socios de esta.
El cuestionario sobre la APLV para gastroenterólogos pediatras de la SLAGHNP constó de los siguientes ítems: para el abordaje de esta afección, ¿qué guías o recomendaciones de referencia utiliza? ¿Conoce el Consenso Iberoamericano en el Diagnóstico y Tratamiento de la APLV? ¿Utiliza algún sistema de puntuación o registro de síntomas para el diagnóstico? En su país, ¿se realizan a nivel público pruebas para medición/cuantificación de IgE específicas? En el abordaje diagnóstico de APLV, ¿realiza algún procedimiento endoscópico? Ante la sospecha de APLV no mediada por IgE, ¿realiza pruebas cutáneas para el diagnóstico? Ante la sospecha de APLV no mediada por IgE, ¿realiza dosaje/cuantificación en sangre de IgE específica para el diagnóstico? ¿Realiza provocación/reto/enfrentamiento diagnóstico? Si se realiza, ¿dónde la lleva a cabo? Una vez confirmado el diagnóstico, ¿se entregan recomendaciones sobre la diversificación alimentaria? En los niños con diagnóstico de APLV alimentados con fórmula láctea, ¿qué tipo de fórmula indica inicialmente para el tratamiento? En su país, ¿está financiado este tratamiento? ¿Hay dificultad para acceder a este tipo de fórmulas? ¿Cuánto tiempo mantiene la exclusión de las PLV de la dieta? ¿Dispone de un protocolo para la prueba de exposición oral controlada (provocación, reto o enfrentamiento) para valorar la adquisición de tolerancia? Si no se logró la tolerancia y reaparecen los síntomas, ¿cuánto tiempo continúa el tratamiento hasta la siguiente prueba? ¿Quién sigue la APLV mediada por IgE? Ante la sospecha de APLV mediada por IgE, ¿realiza pruebas cutáneas para el diagnóstico? Ante la sospecha de APLV mediada por IgE, ¿realiza dosaje/reto/cuantificación en sangre de IgE específica para el diagnóstico? ¿Realiza provocación o enfrentamiento diagnóstico? Si se realiza, ¿dónde la lleva a cabo? ¿Cuáles son los criterios para realizar la prueba de exposición oral controlada (provocación/reto/enfrentamiento)?
Análisis estadísticoSe realizó estadística descriptiva, utilizando frecuencias y proporciones para las variables cualitativas.
Consideraciones éticasDadas las características del estudio, estuvo exento de la necesidad de revisión por parte del comité de ética y se realizó de acuerdo con los principios de la Declaración de Helsinki.
ResultadosLa encuesta fue respondida por 121 gastroenterólogos pediatras de 15 países que forman parte de la SLAGHNP: Argentina 51, Bolivia 6, Chile 9, Colombia 2, Cuba uno, República Dominicana uno, Ecuador uno, Brasil 4, España 2, México 26, Nicaragua uno, Paraguay 3, Perú 2, Uruguay uno y Venezuela 11. Del total que respondieron la encuesta, el 79% (n=86) conocen las pautas recomendadas por el consenso o la guía iberolatinoamericana para el diagnóstico y el tratamiento de la APLV, aunque solo el 17% las utiliza; el 42% utiliza guías de las sociedades europea o norteamericana de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN o NASPGHAN, respectivamente), y el 30%, guías nacionales propias.
El 69% de los encuestados respondió que el diagnóstico habitualmente es realizado por el pediatra o el médico de familia, antes de la consulta del especialista gastroenterólogo. El 15% utiliza algún sistema de puntuación o registro de síntomas para el diagnóstico. Frente a la pregunta de si en su país se realizan a nivel público pruebas para la medición/cuantificación de IgE específicas, la respuesta fue afirmativa para pruebas en sangre en el 20%, para pruebas en sangre y cutánea en el 5% y para pruebas cutáneas en el 19%. En el abordaje diagnóstico, el 25% realiza algún estudio endoscópico: endoscopia alta 12%, rectosigmoidoscopia 5%, colonoscopia 1% y endoscopia alta y baja 7%.
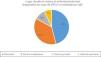
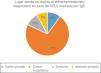
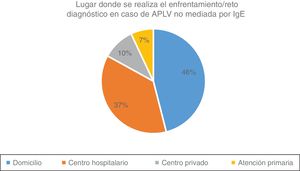
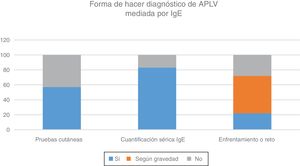
Ante la sospecha de diagnóstico de APLV no mediada por IgE, el 15% utiliza pruebas cutáneas y el 22% realiza determinación de IgE específica en sangre. La prueba de provocación, reto o enfrentamiento diagnóstico es realizada por el 85% de los encuestados, pero de estos, el 47% las realiza de acuerdo con la gravedad de la sintomatología (fig. 1). De entre aquellos que utilizan esta prueba, el 46% la indican en el domicilio del paciente, el 37% de forma controlada en un centro hospitalario y de forma controlada en una consulta privada o centro de atención primaria por el 17% de los encuestados (fig. 2).
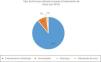
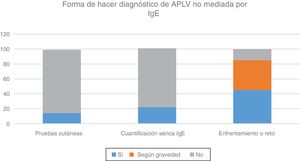
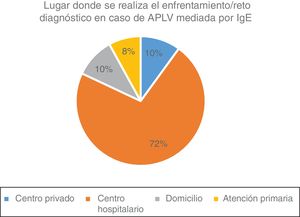
Ante la sospecha de diagnóstico de APLV mediada por IgE, el 66% realiza el seguimiento junto con un alergólogo, el 22% hace el seguimiento solo y el 22% lo deriva para que lo haga el especialista en alergia. Asimismo, el 57% realiza pruebas cutáneas y el 83% realiza dosaje/cuantificación en sangre de IgE específica para el diagnóstico. El 22% realiza provocación, reto o enfrentamiento diagnóstico, el 28% nunca realiza la prueba de enfrentamiento en APLV mediada por IgE y el 50% la realiza según la gravedad de la sintomatología (fig. 3). Esta prueba la realizan el 72% de forma controlada en un centro hospitalario, el 10% en el domicilio del paciente y el 18% de forma controlada en un consulta privada o centro de atención primaria (fig. 4).
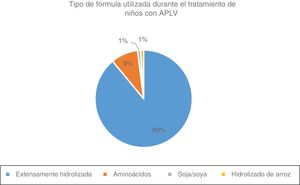
Cuando se ha confirmado el diagnóstico, el 98% entrega recomendaciones sobre la diversificación alimentaria a los padres o cuidadores del niño con diagnóstico de APLV. Luego de la confirmación diagnóstica, en los niños alimentados con fórmula láctea, para iniciar el tratamiento, el 89% utiliza fórmula con PLV HE, el 9% fórmula con aminoácidos, el 1% fórmula con proteína de soja y el 1% fórmula a base de proteínas de arroz hidrolizadas (fig. 5). Los tratamientos son financiados totalmente en un 32% de los países encuestados, parcialmente en un 33% y sin ninguna financiación en un 35% de ellos. El 49% de los encuestados refirió que sus pacientes con APLV tienen dificultades para acceder a las fórmulas HE.
Una vez cumplido el tiempo de exclusión, y con el fin de valorar la adquisición de tolerancia, el 54% dispone de un protocolo para la prueba de exposición oral controlada (provocación, reto o enfrentamiento).
En cuanto a los criterios que se tienen en cuenta para realizar la prueba de exposición oral en pacientes con diagnóstico de APLV mediada por IgE, el 34% lo hace según el tiempo de tratamiento, el 39% según la gravedad de los síntomas y el 27% según pruebas IgE específicas (un 8% utiliza pruebas cutáneas y un 19% medición en sangre de IgE específica). Si la prueba muestra que no se logró la tolerancia, el 68% continúa el tratamiento durante 6 meses más hasta la siguiente prueba, el 24% prolonga el tratamiento por 12 meses más y el 8% por más de 12 meses. El 71% de los encuestados respondieron que en su lugar de trabajo no se realizan tratamientos de desensibilización.
DiscusiónComo se puede observar, los resultados indican una gran dispersión en el enfoque diagnóstico. Una pequeña minoría (17%) sigue las recomendaciones diagnósticas basadas en la evidencia del consenso y guía publicada, si bien el 79% las conoce. En cuanto al tratamiento, las respuestas fueron más uniformes y acordes a las recomendaciones. Hay que tener en cuenta la variabilidad en el número de respuestas según el país, lo que refleja en gran parte de los casos el número variable de especialistas en Gastroenterología Pediátrica según aquel.
En el diagnóstico, el conocimiento de la presentación clínica de la APLV aumenta la posibilidad de sospecha diagnóstica12–15. Aunque el 15% de los encuestados utiliza un sistema de puntuación de registro de síntomas, que aparentemente puede facilitar el proceso diagnóstico, hasta la fecha no hay todavía un sistema de puntuación validado y recomendado en las actuales guías. La guía latinoamericana recomienda realizar una historia clínica con un interrogatorio dirigido a la historia alimentaria, especialmente con la introducción detallada de los distintos alimentos en relación con la aparición de los síntomas, y detectar el mecanismo fisiopatológico11.
En cuanto a la utilización de métodos diagnósticos, los estudios específicos de IgE están disponibles para un tercio de los profesionales encuestados; será fundamental la correcta utilización de pruebas de provocación o enfrentamiento para la confirmación diagnóstica.
Llama la atención que hasta un cuarto de los gastroenterólogos utilice estudios endoscópicos para la confirmación diagnóstica, situación que no está sustentada en las guías; además, no se recomienda la utilización de la endoscopia como método diagnóstico en la APLV por ser invasiva, costosa y reemplazable por otros métodos más sencillos, sensibles y específicos.
Para el diagnóstico de APLV no mediada por IgE, una proporción considerable utiliza pruebas cutáneas o determinación de IgE específicas en sangre, las cuales no están indicadas ni en el consenso ni en la guía iberolatinoamericana debido a un bajo rendimiento diagnóstico, con altas probabilidades de resultados falsos positivos y falsos negativos. La guía latinoamericana no recomienda realizar estas pruebas (nivel de evidencia 2 b; grado de recomendación B).
Tanto el consenso como la guía recomiendan como prueba definitiva y patrón de oro el test de provocación, reto o enfrentamiento con PLV, si bien la guía latinoamericana reconoce que aún hay controversias en cuanto a qué niños deben ser sometidos a esta prueba y cómo debe realizarse (nivel de evidencia 2 b, grado de recomendación B). Sin embargo, el 15% de los encuestados aún no realiza la prueba de enfrentamiento diagnóstico. El 46% realiza esta prueba en el domicilio del paciente, siguiendo la recomendación del consenso para pacientes sin riesgo de reacciones severas. El 17% realiza la prueba en consultorio para pacientes sin riesgo, siguiendo recomendación de la guía LA (nivel de evidencia 4, grado de recomendación C).
En cuanto a las pruebas cutáneas y la medición de IgE específica para el diagnóstico de APLV mediada por IgE, son utilizadas por el 88% de los gastroenterólogos; es importante comentar que pueden ser de utilidad, según el consenso, para el seguimiento del paciente marcando el momento para realizar prueba de provocación para valorar recuperación de tolerancia (nivel de evidencia 3 a, grado de recomendación B). La prueba de provocación es frecuentemente poco utilizada por los gastroenterólogos en este grupo de pacientes, si bien el consenso y la guía latinoamericana la recomiendan cuando no existe riesgo de reacciones graves, pero siempre bajo supervisión médica en un centro hospitalario (nivel de evidencia 4, grado de recomendación C).
El tratamiento tiene un acuerdo del 89% con la utilización de fórmulas con PLV HE, acordes con la recomendación del consenso y la guía latinoamericana (nivel de evidencia 4, grado de recomendación C), así como la utilización de fórmulas con aminoácidos en formas graves o en aquellas que no responden con fórmulas HE (nivel de evidencia 4, grado de recomendación C). Según la guía latinoamericana, las fórmulas de arroz hidrolizado han mostrado utilidad en el tratamiento de APLV; sin embargo, el número de estudios en la actualidad son escasos para aportar una recomendación con un nivel de evidencia alto.
La fórmula a base de soja no es una fórmula recomendada por las guías para el tratamiento de la APLV. Se considera que podría ser utilizada en niños con APLV mayores de 6 meses, con formas mediadas por IgE, en quienes el EH no fue aceptado o tolerado, cuando no existe la posibilidad económica de comprar la fórmula hipoalergénica o si existen preferencias fuertes de los padres, por ejemplo, hacia una dieta vegetariana (nivel de evidencia 4, grado de recomendación C).
La respuesta al tratamiento dependerá del cumplimiento de la dieta sin PLV, por ello son necesarias las recomendaciones de cómo seguir una dieta estricta libre de PLV; el 98% de los gastroenterólogos informa a los padres qué alimentos deben suspender y el inconveniente de evitar otros nutrientes innecesariamente. Otro factor fundamental es el costo de estas fórmulas, con un bajo porcentaje de financiación en la mitad de los países encuestados, lo que hace que se refuercen, por esta y por múltiples razones, entre las que se destacan los factores inmunológicos, afectivoemocionales, nutricionales, etc., el beneficio de la alimentación con leche materna.
En cuanto al tiempo de tratamiento, las respuestas fueron muy diversas, lo que seguramente está en relación con las distintas recomendaciones publicadas, con bajos niveles de evidencia. La guía latinoamericana recomienda que la dieta de eliminación se mantenga 12 meses para la APLV no mediada por IgE y hasta 18 meses para la APLV mediada por IgE; sin embargo, la sintomatología del paciente marcará esta duración. El consenso recomienda hasta los 12 meses de edad y cumplir al menos 6 meses de tratamiento. Es importante señalar que, debido a la falta de evidencia, el consenso y la guía latinoamericana dan esta recomendación con base en el consenso de expertos.
ConclusionesEn este estudio se analizó por primera vez el conocimiento y la aplicación de guías para diagnóstico y tratamiento de APLV en países de Latinoamérica. Los resultados muestran mucha diversidad en el manejo de la APLV y pobre adherencia a las guías. Desde la SLAGHNP debemos comprometernos a actualizar la guía, unificar criterios, difundir las recomendaciones con el fin de mejorar la utilización de los recursos de salud, evitar sobrediagnósticos y asegurar un adecuado tratamiento a todos los niños con APLV.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores públicos, comercial o sin ánimo de lucro.
Conflicto de interesesMCT: He recibido apoyo para acudir a congresos y he formado parte del comité de asesores de Nutricia Bagó y de Sanofi.
ERR: He participado en actividades docentes subvencionadas por Casen Fleet, Ferrer Internacional, Ferring, Mead Johnson y Nestlé.
RVF: He recibido apoyo para acudir a congresos y he recibido honorarios por pláticas para Nestlé y Sanofi, he recibido honorarios por pláticas por Carnot, BioGaia y NutriCare.
MBdM: He recibido honorarios por pláticas y por desarrollo de materiales científicos por parte de Danone, Nestlé, Biolab, Aché/BioGaia.
PS: He recibido honorarios por pláticas y asesoramiento para Nutricia Medical Care.
CBM: He recibido apoyo para acudir a congresos y he recibido honorarios por disertaciones como KOL para Nutricia, Mead Johnson, Nestlé, Sanofi y Biocodex.
El resto de los autores declara no tener ningún conflicto de intereses.
Agradecemos a los miembros de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición Pediátrica por su ayuda en contestar la encuesta.
Véase contenido relacionado en DOI: https://10.1016/j.rgmx.2020.03.005, Larrosa-Haro A. Alergia a proteínas de leche de vaca en pacientes pediátricos: visión de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición Pediátrica. Rev Gastroenterol Mex.2020;85:379–81.