La enfermedad por hígado graso no alcohólico (EHGNA) afecta prácticamente a un tercio de la población mundial. México es uno de los países cuya población reúne varios factores de riesgo para esta enfermedad y su prevalencia podría superar el 50%; es por eso que el panorama a mediano plazo es muy pesimista si no se toman acciones inmediatas para contrarrestar lo que ya se considera un problema de salud nacional.
De ahí el interés de la Asociación Mexicana de Gastroenterología y de la Asociación Mexicana de Hepatología para realizar el Consenso mexicano de EHGNA, en el cual se hizo una revisión actualizada y a fondo de temas como epidemiología, fisiopatología, formas clínicas, diagnóstico y tratamiento, con el objetivo de ofrecer al médico mexicano una herramienta útil para la prevención y el manejo de esta enfermedad.
Nonalcoholic fatty liver disease (NAFLD) affects nearly one third of the population worldwide. Mexico is one of the countries whose population has several risk factors for the disease and its prevalence could surpass 50%. If immediate action is not taken to counteract what is now considered a national health problem, the medium-term panorama will be very bleak.
This serious situation prompted the Asociación Mexicana de Gastroenterología and the Asociación Mexicana de Hepatología to produce the Mexican Consensus on Fatty Liver Disease. It is an up-to-date and detailed review of the epidemiology, pathophysiology, clinical forms, diagnosis, and treatment of the disease, whose aim is to provide the Mexican physician with a useful tool for the prevention and management of nonalcoholic fatty liver disease.
La enfermedad por hígado graso no alcohólico (EHGNA) es un trastorno metabólico que se caracteriza por la acumulación de grasa en los hepatocitos de individuos sin consumo significativo de alcohol, de medicamentos hepatotóxicos, ni otras causas conocidas de esteatosis secundaria. En la actualidad es la enfermedad hepática crónica más común a nivel mundial1. Su espectro clínico y patológico puede evolucionar de la esteatosis simple a la esteatohepatitis, a la cirrosis y al carcinoma hepatocelular (CHC). La EHGNA se considera el componente hepático del síndrome metabólico (SMet) y su prevalencia se ha incrementado a la par de la obesidad, la diabetes mellitus tipo2 (DM2), la dislipidemia y el propio SMet2. Debido a la creciente epidemia mundial de obesidad y diabetes, se espera que en breve la EHGNA será la principal causa de CHC y la primera indicación de trasplante hepático.
En el 2008, la Asociación Mexicana de Gastroenterología elaboró las guías de diagnóstico y tratamiento de la hepatopatía grasa no alcohólica3-5. Desde entonces han surgido nuevos conceptos sobre esta enfermedad en áreas como su correcta definición, la epidemiología, la fisiopatología, el diagnóstico y la prevención, y se han abierto múltiples líneas de investigación en busca de alternativas terapéuticas efectivas. Todos estos avances justifican la generación de un documento actualizado que complemente las guías de diagnóstico y tratamiento del 2008.
En agosto de 2017 la Asociación Mexicana de Gastroenterología y la Asociación Mexicana de Hepatología acordaron llevar a cabo el Consenso mexicano sobre la enfermedad por hígado graso no alcohólico no alcohólico y convocaron a 6 coordinadores y 29 participantes adicionales que integraron el grupo de consenso; ellos realizaron una revisión actualizada del tema, evaluaron la evidencia, elaboraran enunciados y los discutieron hasta alcanzar acuerdos.
El objetivo de este documento es presentar una revisión consensuada del estado actual de la EHGNA que permita actualizar las guías de diagnóstico y tratamiento publicadas en 2008, integrando las nuevas evidencias científicas publicadas a nivel mundial.
MétodoEn la elaboración de este consenso se utilizó el método Delphi6. Los coordinadores realizaron una revisión de la bibliografía utilizando como criterios de búsqueda las palabras «nonalcoholic fatty liver disease», «nonalcoholic steatohepatitis», «hepatic steatosis», «steatohepatitis» y «fatty liver hepatitis» combinados con los términos: «epidemiology», «incidence», «prevalence», «pathophysiology», «inflammation», «microbiota», «diagnosis», «differential diagnosis», «treatment», «therapy», «management», «review», «guidelines» y «meta-analysis», así como los términos equivalentes en español. La búsqueda se realizó en PubMed de noviembre de 2012 a octubre de 2017. Se incluyeron publicaciones en inglés y en español. Se dio preferencia a los consensos, guías, revisiones sistemáticas y metaanálisis, pero no se limitó a este tipo de artículos. También se realizaron búsquedas electrónicas y manuales complementarias en todas las publicaciones que los coordinadores consideraron relevantes hasta octubre de 2017. Toda la bibliografía se puso a disposición de los miembros del consenso para su consulta en cualquier momento a lo largo de todo el proceso.
Se conformaron seis mesas de trabajo para abordar los principales temas de la EHGNA:
- 1.
Generalidades: definición, nomenclatura, epidemiología.
- 2.
Historia natural y fisiopatología.
- 3.
Manifestaciones clínicas y afectación a otros órganos.
- 4.
Diagnóstico y evaluación de esteatosis y fibrosis.
- 5.
Tratamiento I: dieta y ejercicio, fármacos de utilidad limitada, fármacos aceptados y cirugía.
- 6.
Tratamiento II: fármacos emergentes y trasplante hepático.
Luego de realizar la revisión, se elaboraron 90 enunciados, los cuales se sometieron a una primera votación anónima vía electrónica que se realizó del 22 de diciembre del 2017 al 7 de enero de 2018. Los participantes del consenso emitieron su voto considerando las siguientes respuestas: a)totalmente de acuerdo; b)parcialmente de acuerdo; c)incierto; d)parcialmente en desacuerdo, y e)totalmente en desacuerdo. En caso de un acuerdo igual o superior al 75%, se determinó que el enunciado quedaría sin cambios para la siguiente ronda de votación. Los enunciados con 75% o más de desacuerdo se eliminaron. Los enunciados con menos del 75% de acuerdo o menos del 75% de desacuerdo fueron replanteados por el coordinador de cada mesa tomando en cuenta los comentarios emitidos por los participantes. La segunda ronda de votación electrónica a distancia incluyó 57 enunciados (del 22 al 29 de enero del 2018) siguiendo el mismo sistema. La votación presencial y definitiva se llevó a cabo en Puerto Vallarta, Jalisco, México el 16 y 17 de febrero del 2018, en la que 55 enunciados fueron votados por el grupo de consenso y finalmente se aceptaron un total de 54 enunciados.
Una vez que se contó con los enunciados finales consensuados, los coordinadores determinaron el nivel de evidencia que sustentaba cada enunciado y otorgaron un grado de recomendación en los casos que aplicara, empleando el sistema Grading of Recommendations Assessment, Development, and Evaluation (GRADE) para todos los enunciados que implicaran alguna intervención diagnóstica o terapéutica7. Este sistema surgió con el fin de superar las limitaciones de los sistemas previos, optimizando la evaluación de la calidad de la evidencia y la graduación de la fuerza de las recomendaciones, y ha sido utilizado en los más recientes consensos de la Asociación Mexicana de Gastroenterología. En el sistema GRADE la calidad de la evidencia no se establece solo por la metodología del estudio analizado, sino que se clasifica con base en el diseño utilizado para responder una pregunta específica que se ha planteado previamente7,8. Sobre estas bases, la calidad de la evidencia se define como «alta» cuando la publicación de nuevos resultados de estudios de investigación no modificará nuestra confianza en la estimación del efecto, «moderada» cuando la publicación de nuevos resultados de estudios de investigación puede modificar nuestra confianza en la estimación del efecto, «baja» cuando muy probablemente la publicación de nuevos resultados de estudios de investigación va a tener un efecto importante en nuestra confianza en la estimación del efecto y «muy baja» cuando cualquier estimación del efecto es incierta. El sistema GRADE establece adicionalmente la fuerza de las recomendaciones como fuerte o débil, a favor o en contra de la intervención o del enunciado. Existe un código definido para expresar los resultados de este sistema, en el que se usan letras mayúsculas para hablar de la calidad de la evidencia, seguidas de un índice numérico para indicar la fuerza de la recomendación a favor o en contra de la intervención o enunciado7,8. En los enunciados referentes a la definición, epidemiología, historia natural, fisiopatología y afectación a otros órganos, solo se calificó el nivel de la evidencia.
Definiciones, epidemiología y factores de riesgoCoordinador: Dr. Raúl Bernal Reyes
Integrantes: Dr. Heriberto Rodríguez Hernández, Dr. José Antonio Chávez Barrera, Dr. Mauricio Castillo Barradas, Dr. Javier Lizardi Cervera
1. A la fecha se han utilizado diversos términos para denominar a la misma enfermedad. Esto ha generado confusión entre médicos y pacientes. Es por esto que este consenso propone el nombre de enfermedad por hígado graso no alcohólico (EHGNA).
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
2. La EHGNA es un trastorno metabólico que se caracteriza por esteatosis macrovesicular en más del 5% de los hepatocitos en individuos sin consumo significativo de alcohol, medicamentos hepatotóxicos ni otras causas conocidas de esteatosis secundaria. Su espectro clínico-patológico puede evolucionar de la esteatosis simple a esteatohepatitis, a cirrosis y a CHC.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
La EHGNA se relaciona estrechamente con el SMet. Un dato que la caracteriza es la esteatosis macrovesicular, aunque eventualmente pueden observarse también microvesículas de grasa9. Se le considera una esteatosis primaria, y es por eso que deben excluirse otras causas de esteatosis secundaria, en especial el consumo significativo de alcohol, el cual se entiende como un consumo mayor de 30g/día en hombres y 20g/día en mujeres. También deben excluirse otras enfermedades, como hepatitisC, enfermedad de Wilson, lipodistrofia, secuelas de ayuno prolongado, cirugía bariátrica, nutrición parenteral o bien toxicidad por fármacos como amiodarona, metotrexato, tamoxifeno o esteroides, entre los más comunes10.
La EHGNA tiene algunas variantes clínico-patológicas, siendo la forma más común la esteatosis simple. En menor proporción se puede presentar la esteatohepatitis no alcohólica (EHNA), en la cual, además de la esteatosis, hay inflamación y daño hepático. Casi una tercera parte de estos casos pueden llegar a desarrollar cirrosis11 y una minoría pueden complicarse con CHC12.
3. Se denomina hígado graso no alcohólico al acúmulo de vacuolas de grasa en más del 5% del parénquima hepático sin daño hepatocelular aparente en personas sin consumo significativo de alcohol ni otras causas de esteatosis secundaria. Puede corroborarse por biopsia, métodos bioquímicos o de imagen.
Nivel de acuerdo: totalmente de acuerdo, 88.23%; parcialmente de acuerdo, 8.82%; incierto, 2.94%.
El hígado graso no alcohólico se caracteriza por la presencia de esteatosis simple sin cambios inflamatorios, fibrosis o necrosis. Habitualmente tiene un curso asintomático y se considera reversible si se logra corregir el estilo de vida que la promueve. Este se caracteriza por un sedentarismo extremo y una dieta abundante en grasas saturadas y azucares refinados13. Aunque el diagnóstico puede realizarse con biopsia hepática, esta no se justifica en la mayoría de los casos debido al riesgo inherente del procedimiento. Hay otras alternativas no invasivas, como el ultrasonido (US), el cual es accesible, de bajo costo y con una alta certeza diagnóstica, o los biomarcadores séricos (fatty liver index [FLI] y SteatoTest ®). Hay otros menos accesibles y de costo más elevado, como el parámetro de atenuación controlada (controlled attenuation parameter [CAP]) y la 1H-MRS (hepatic magnetic resonance spectroscopy), que serán detallados más adelante14.
4. Se denomina esteatohepatitis no alcohólica (EHNA) a la progresión de esteatosis no asociada a la ingesta de alcohol u otras causas de esteatosis secundaria, que en la biopsia muestra inflamación y degeneración balonoide de los hepatocitos y puede haber fibrosis.
Nivel de acuerdo: totalmente de acuerdo, 91.17%; parcialmente de acuerdo, 8.82%.
Desde el punto de vista clínico, bioquímico o de imagen no es posible distinguir la EHNA de una esteatosis simple, y aunque existen algunos marcadores bioquímicos de inflamación y fibrosis, estos no son superiores a la biopsia hepática, la cual es indispensable para el diagnóstico15.
Se considera que en algunos casos la EHNA puede ser reversible si se logra un buen control metabólico particularmente con dieta y ejercicio y eventualmente con algunos medicamentos. En otros casos la enfermedad puede progresar al aumentar la fibrosis, lo cual determina un mal pronóstico, ya que puede conducir a la cirrosis16.
5. Se denomina EHGNA en no obesos a la presencia de esteatosis en más del 5% del parénquima hepático con o sin esteatohepatitis en personas con un índice de masa corporal (IMC) menor de 25kg/m2, sin un consumo significativo de alcohol ni otra causa de esteatosis secundaria.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
La obesidad es el fenotipo clínico que comúnmente se asocia a la EHGNA y al resto de las comorbilidades del SMet; sin embargo, algunos pacientes no obesos también pueden desarrollar EHGNA en rangos de prevalencia del 3 al 30%9.
El punto de corte para determinar sobrepeso u obesidad ha mostrado variaciones entre diferentes poblaciones. En los países occidentales la EHGNA en no obesos se determina cuando el IMC es menor a 25kg/m29, mientras que en algunos países asiáticos se consideran un IMC<23kg/m2 y reportan cifras crecientes de casos17.
A diferencia de los obesos, la prevalencia del SMet es menor en este grupo de pacientes, aunque la resistencia a la insulina y/o la dislipidemia suelen ser comunes18.
6. Se denomina cirrosis por EHGNA a una fase avanzada de la enfermedad caracterizada por el desarrollo de fibrosis que daña la arquitectura funcional del hígado. Esto ocurre en pacientes con uno o más componentes del SMet y que no han sido expuestos al daño por alcohol, drogas, virus u otros reconocidos agentes hepatotóxicos.
Nivel de acuerdo: totalmente de acuerdo, 91.17%; parcialmente de acuerdo, 5.88%; incierto, 2.94%.
La EHNA representa un riesgo mayor de progresión a fibrosis y es el principal factor de riesgo asociado a progresión a cirrosis y muerte por causas hepáticas. Aproximadamente el 40.75% (IC95%: 34.69-47.13) de los pacientes con EHNA pueden presentar progresión de la fibrosis hepática, con una tasa media anual de progresión de 0.09% de un estadio a otro (IC95%: 0.06-0.12); es decir, en promedio la tasa de progresión tomaría aproximadamente 10años para evolucionar de un estadio de fibrosis hepática a otro19.
Algunos estudios en pacientes con cirrosis criptogénica han mostrado que más del 60% tienen componentes del SMet, tal como ocurre en pacientes con EHGNA, y el SMet es mucho más frecuente que en pacientes con cirrosis de otras etiologías, como virus o autoinmunidad20,21. Por otra parte, la prevalencia de EHNA en receptores de trasplante de hígado por cirrosis criptogénica es muy alta22. Esto hace suponer que muy probablemente un alto porcentaje de pacientes con cirrosis criptogénica originalmente fueron portadores de EHGNA que progresó a cirrosis. Desafortunadamente, una vez instalada la cirrosis es difícil confirmar desde el punto de vista histológico si la etiología está relacionada o no con EHGNA.
En México, en 2004, un estudio de las principales causas de cirrosis ubicó a la cirrosis criptogénica en tercer lugar, después del alcohol y el virusC, por lo que también en la población mexicana existe la posibilidad de que un porcentaje importante de individuos catalogados originalmente como de origen criptogénico fueron en realidad casos de cirrosis secundaria a la EHGNA23. A nivel mundial los casos de cirrosis secundaria a EHGNA muestran una tendencia creciente24.
7. El carcinoma hepatocelular por enfermedad por hígado graso no alcohólico es una complicación que se caracteriza por el desarrollo de una neoplasia maligna que se origina en los hepatocitos en un paciente con esteatohepatitis no alcohólica y no necesariamente es precedido de cirrosis hepática.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
El desarrollo de CHC en pacientes con EHGNA se asocia a mayor edad, obesidad, DM2, polimorfismo PNPLA3 I148M, malos hábitos dietéticos y algunos fármacos25,26. Se estima la incidencia anual de CHC en pacientes con EHGNA en 0.44 por 1,000 personas/año, mientras que en pacientes con EHNA es de 5.29 por 1,000 personas/año19. Un estudio reciente reportó un aumento anual del 9% en el número de casos de CHC atribuidos a EHGNA en el período 2004-2009. Estos pacientes tuvieron una supervivencia menor, más eventos cardiovasculares y más probabilidades de muerte relacionada con el cáncer de hígado que los pacientes sin EHGNA27. El CHC puede presentarse en pacientes con EHGNA en ausencia de fibrosis o cirrosis28,29.
8. La prevalencia de la enfermedad por hígado graso no alcohólico es variable debido a la diversidad étnica y a los diferentes métodos de diagnóstico utilizados. Se estima que hasta un tercio de la población mundial puede estar afectada.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
La EHGNA es la enfermedad hepática crónica más frecuente en el mundo y su prevalencia en la población general se estima entre el 17 y el 46%, con algunas diferencias dependiendo de variables como el método de diagnóstico que se utilice, la edad, el sexo y el origen étnico de los grupos estudiados.
Se ha observado que es más frecuente en el sexo masculino, en mayores de 50años y en población de origen mexicano30.
Los reportes sobre la incidencia de la EHGNA son escasos. Se ha estimado una cifra de 20-86/1,000 personas-año basada en la elevación de las enzimas hepáticas y/o en US y de 34/1,000 por año por 1H-MRS14.
En México, un estudio en población derechohabiente de compañías aseguradoras que acudió a una revisión clínica reportó una prevalencia de esteatosis hepática del 14.4%31, y recientemente, en un estudio en voluntarios convocados por internet se encontraron datos de esteatosis en el 62.9%32. En ambos casos el método de diagnóstico utilizado fue el US.
9. La EHGNA es la manifestación a nivel hepático del SMet y el riesgo de desarrollarla es mayor en la medida en que un paciente tiene más componentes del síndrome. La obesidad es el más común, seguido de DM2 y dislipidemia. Otros factores de riesgo conocidos son sexo masculino, edad avanzada y el polimorfismo PNPLA3 en población mexicana.
Nivel de acuerdo: totalmente de acuerdo, 91.17%; parcialmente de acuerdo, 8.82%.
La prevalencia de la EHGNA aumenta a la vez que lo hace la de los componentes del SMet, muy particularmente la obesidad; de hecho, algunos consideran que la EHGNA es un componente más del SMet14.
Hay una relación directa entre el IMC, el grado de esteatosis y la gravedad de la lesión hepática. Todo indica que la distribución de grasa a nivel visceral es más importante que la cantidad de grasa corporal total para determinar el daño hepático33.
En pacientes con obesidad mórbida sometidos a cirugía bariátrica la prevalencia de EHGNA puede exceder el 90%, y más del 5% pueden tener una cirrosis inesperada14. Las cifras en México revelan que en pacientes obesos sometidos a cirugía bariátrica la prevalencia de EHGNA es del 82%34. En mujeres obesas llega al 36%35, y en pacientes con diabetes la EHNA se confirmó con biopsia en el 18.5%36.
Los niveles altos de triglicéridos y niveles bajos de HDL son muy comunes en EHGNA, con una prevalencia de hasta el 50%. La obesidad, la DM2 y la resistencia a la insulina son los principales factores de riesgo metabólicos para el desarrollo de EHGNA14.
Historia natural y fisiopatologíaCoordinador: Dr. Norberto Chávez Tapia
Integrantes: Dra. Ylse Gutiérrez Grobe, Dra. Fátima Higuera de la Tijera, Dr. Nahúm Méndez Sánchez, Dr. Francisco Bosques Padilla
10. Los pacientes con EHGNA presentan un incremento en la mortalidad general, cardiovascular y la relacionada con enfermedades hepáticas, así como una mayor incidencia de neoplasias malignas, incluyendo CHC (incluso en ausencia de cirrosis hepática), y el riesgo de DM2.
Nivel de acuerdo: totalmente de acuerdo, 100%.
En el estudio de cohorte que ha incluido hasta ahora a la mayor cantidad de pacientes con EHGNA diagnosticada por biopsia y con el seguimiento más largo, con una media de 20años (rango 0 a 40años), la presencia de EHNA no incrementó la mortalidad general ni la mortalidad relacionada con enfermedad hepática; sin embargo, la severidad de la fibrosis sí fue un determinante relacionado con un menor tiempo para desarrollar enfermedad hepática descompensada (22 a 26años en F0-F1, 9.3años en F2, 2.3años en F3 y 0.9años en F4)37.
Los pacientes con EHGNA presentan alteraciones en el remodelamiento cardiaco, manifestado por un incremento en el índice de masa del ventrículo izquierdo, el diámetro del ventrículo izquierdo al final de la diástole y el índice de volumen auricular izquierdo. Tanto la presencia de esteatosis como de fibrosis en pacientes con EHGNA se han correlacionado con disfunción diastólica y deterioro de la captación de glucosa por el miocardio38,39. Las alteraciones morfológicas y funcionales cardiacas son más importantes a mayor severidad de la fibrosis hepática40. La presencia de fibrosis avanzada es el predictor más importante relacionado con un incremento en la mortalidad cardiovascular en estos pacientes41.
En el estudio de Allen et al.42 la mortalidad general a 10años fue mayor entre pacientes diagnosticados con EHGNA (19.2%) que en controles (7.6%; p<0.0001). El riesgo relativo de fallecer asociado a la presencia de EHGNA fue de 2.16 (IC95%: 1.41-3.31). Además, la EHGNA fue un factor de riesgo independiente asociado al desarrollo de otras comorbilidades metabólicas y eventos cardiovasculares.
En otro estudio que incluyó 4,406 casos de CHC se reportó que la incidencia anual de esta neoplasia fue de 0.4/1,000. La presencia de EHGNA/EHNA fue el factor etiológico más frecuente para desarrollar CHC, seguido de la presencia de DM2 y luego de la infección crónica por virus de hepatitisC (59, 36 y 22%, respectivamente)43.
El CHC usualmente ocurre en pacientes con cirrosis, aunque puede desarrollarse también en ausencia de ella. Un estudio en 1,221 pacientes con CHC sin cirrosis mostró que los factores más frecuentemente asociados fueron sexo femenino y EHGNA. El CHC sin cirrosis subyacente con mayor frecuencia fue unifocal, pero de mayor tamaño en comparación con el desarrollado en pacientes con cirrosis. La posibilidad de resección y supervivencia fue mejor comparativamente que en los pacientes con cirrosis44, aunque el riesgo de recurrencia del CHC es también mayor45.
La presencia de EHGNA en el US, así como la alteración en las enzimas hepáticas, son factores predictivos del desarrollo de DM2, así como de SMet, independientemente de la edad y del IMC46,47. Aunque el riesgo de desarrollar DM2 en pacientes con EHGNA afecta a ambos sexos, en las mujeres el riesgo es mayor: 4.8 (IC95%: 3-7.8) en hombres y 14.5 (IC95%: 7-30.1) en mujeres48. En otro estudio prospectivo, con seguimiento a 5años, tanto la incidencia de DM2 como de prediabetes fue mayor entre los pacientes que presentaban EHGNA en comparación con los que no la padecían, registrándose en 20.6 y 51.6 por 1,000 personas-año, versus 4.9 y 29.2 por 1,000 personas-año, respectivamente, aunque en el modelo multivariado ajustado la presencia de EHGNA solo se relacionó como factor predictivo para el desarrollo posterior de DM2 (HR4.5; IC95%: 1.9-10.7; p<0.001)49.
11. La presencia de EHGNA en edad pediátrica se asocia con el desarrollo de DM2 y obesidad en la edad adulta.
Nivel de acuerdo: totalmente de acuerdo, 100%.
Hay pocos estudios epidemiológicos que hayan evaluado la historia natural de la EHGNA en pacientes pediátricos, pero se sabe que los adolescentes que padecen EHGNA tienen cifras más elevadas de glucosa en ayuno y deterioro de la sensibilidad a la insulina comparado con controles50. Un estudio que incluyó 66niños con EHGNA encontró que de forma basal 55 de ellos (83%) presentaban al menos una característica del SMet como obesidad, hipertensión, dislipidemia y/o hiperglucemia. Cuatro niños desarrollaron DM2 de 4 a 11años después. En 4 de 5 que tenían biopsia hepática basal y seguimiento con una media de 41.4±28.8meses se encontró progresión del estadio de fibrosis. Dos niños fallecieron y dos fueron trasplantados por cirrosis descompensada y ambos tuvieron recurrencia de la EHGNA postrasplante. La supervivencia libre de trasplante fue menor en niños con EHGNA en comparación con la población general pareada por edad y sexo, p<0.0000151. En otro estudio longitudinal en niños con EHGNA el desarrollo de DM2 en la juventud ocurrió en el 30% de los pacientes y el 78% permaneció obeso52. A dos años de seguimiento, el 10% de niños con EHNA desarrollaron DM2. También se ha observado que los niños que padecen obesidad tienen mayor riesgo de desarrollar CHC en la edad adulta53.
12. La cantidad de grasa intrahepática en pacientes con EHGNA puede variar dependiendo del cambio en el perímetro abdominal, las características de la dieta, la actividad física y el control de comorbilidades metabólicas.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; incierto, 2.94%.
La combinación de dieta más ejercicio es más efectiva que la dieta por sí sola para reducir los triglicéridos intrahepáticos, de acuerdo con los hallazgos de una revisión sistemática54.
Tanto el ejercicio aeróbico moderado como el ejercicio intenso constante por un periodo mínimo de 6 a 12meses son estrategias efectivas para reducir el contenido intrahepático de triglicéridos y la cantidad de grasa abdominal y para mejorar la presión arterial55-60. Un metaanálisis evaluó la intervención del ejercicio en pacientes con sobrepeso y EHGNA. Se incluyeron 21 ensayos controlados aleatorios con un total de 1,530 participantes. Los estudios de intervención con ejercicio con una carga de trabajo total en el programa de ejercicio >10,000kcal demostraron una mejoría significativa en el contenido de grasa intrahepática, −3.46% (IC95%: −5.20 a −1.73%, p<0.0001 I2=73%; tamaño del efecto (SMD) −1.77 (IC95%: −3.11 a −0.42, p=0.01, I2=77%61.
La cantidad y la calidad de la dieta y el tipo de nutrientes ingeridos también han demostrado influir en el desarrollo de EHGNA y en la cantidad de grasa intrahepática62. La presencia de EHGNA se relaciona con el consumo de dietas hipercalóricas y con alto contenido de ácidos grasos saturados y ácidos grasos poliinsaturados63. La fracción hepática de grasa y el contenido intrahepático de lípidos, determinados por 1H-MRS, se asocia con el total de energía o calorías ingeridas y con el total de grasa ingerida64. Las dietas con alto contenido de hidratos de carbono también se relacionan con mayor contenido de grasa intrahepática, pues los hidratos de carbono promueven la lipogénesis mediante la activación de factores de transcripción como la «proteína de unión del elemento sensible a hidratos de carbono» (ChREBP) y la «proteína de unión del elemento esterol-regulador-1c» (SREBP-1c)65. Otros azúcares, como la sucrosa y la fructosa, también se asocian con un mayor contenido de grasa intrahepática66-68; por el contrario, las dietas isocalóricas y con alto contenido de proteína, ricas en metionina y aminoácidos de cadena ramificada, se asocian a reducción en el contenido de grasa intrahepática69. Las dietas bajas en hidratos de carbono se asocian con una disminución de la grasa intrahepática en pacientes con EHGNA hasta en −11.53% (IC95%: −18.1 a − 4.96; I2=83.2%70.
El contenido intrahepático de triglicéridos se relaciona con diversas alteraciones metabólicas. Bril et al.62, en un estudio que incluyó a 352 pacientes con EHGNA, demostraron que la sensibilidad hepática a la insulina se afecta tempranamente cuando el contenido de grasa intrahepática es ∼1.5%. La sensibilidad a la insulina del músculo esquelético también se deteriora tempranamente en pacientes con EHGNA. Cuando el contenido intrahepático de triglicéridos alcanzó ∼6±2%, otras alteraciones como la hipertrigliceridemia y un perfil con colesterol HDL bajo también fueron relevantes. El deterioro de la sensibilidad a la insulina en el tejido adiposo fue la alteración más significativa, y además mostró un deterioro continuo y progresivo que se correlacionó directamente con el incremento en el contenido de grasa intrahepática (r=−0.38; p<0.001). Estos hallazgos confirman la estrecha asociación entre la resistencia a la insulina en el tejido adiposo y la teoría de la lipotoxicidad como factor que regula el depósito de grasa en el parénquima hepático.
En pacientes diabéticos con EHGNA el control glucémico reduce significativamente el contenido de lípido intrahepático, independientemente del hipoglucemiante indicado para el control de la diabetes63,71-74.
13. La progresión de la fibrosis en los pacientes con EHGNA está influenciada de manera dosis-respuesta por los componentes del SMet.
Nivel de acuerdo: totalmente de acuerdo, 85.29%; parcialmente de acuerdo, 11.76%; incierto, 2.94%.
La asociación entre la EHGNA y el SMet se ha reportado en múltiples estudios. El riesgo de EHGNA se incrementa significativamente de acuerdo con el número de componentes. Los pacientes con solo un componente del SMet tienen un riesgo 3.6 veces mayor de tener EHGNA comparado con pacientes sin componentes de SMet (HR3.64; IC95%: 1.5-8.88%)75. En relación con la fibrosis, estudios previos han mostrado que los pacientes con SMet tienen puntuaciones de fibrosis más altas en comparación con pacientes sin el síndrome (3.3 vs 1.6, p=0.01); así, existe un aumento significativo de fibrosis en relación con el número de componentes del SMet (p=0.014)76.
14. El pronóstico de los pacientes con EHGNA está determinado por el grado de fibrosis.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
Según diversos estudios poblacionales, el pronóstico a largo plazo de pacientes con EHGNA no es el mismo a lo largo del espectro de la enfermedad, ya que se ha observado que los pacientes con esteatosis mínima, sin otras alteraciones histológicas de lesión hepática, siguen un curso más benigno77. Angulo et al78. siguieron a 619 pacientes durante un promedio de 12.6años y observaron que la fibrosis era la única variable histológica asociada independientemente a mortalidad y trasplante hepático, y este efecto se observó desde estadios tempranos de fibrosis. De acuerdo con los resultados, el riesgo acumulado para mortalidad o trasplante en fibrosis grado1 fue del 29.8%, en fibrosis grado2 del 42.3%, en fibrosis grado3 del 50.9% y en fibrosis grado4 del 77.8%. También observaron que la fibrosis, independientemente del diagnóstico de EHNA, se asocia a mayor de mortalidad y eventos relacionados con la enfermedad hepática.
15. En pacientes con EHGNA el avance de un estadio de fibrosis a otro puede ocurrir en un lapso de entre una y dos décadas.
Nivel de acuerdo: totalmente de acuerdo, 79.41%; parcialmente de acuerdo, 14.70%, incierto, 5.88%.
Un metaanálisis publicado recientemente por Singh et al.79, enfocado a estimar la tasa de progresión de fibrosis en pacientes con EHGNA y EHNA, mostró que hasta el 36.1% de los pacientes tienen fibrosis progresiva. También observó que la tasa de progresión de fibrosis anual en los pacientes con EHGNA con un estadio basal de fibrosis de 0 es de 0.07 estadios (IC95%: 0.02-0.11), encontrando una progresión promedio de un estadio en aproximadamente 14.3años (IC95%: 9.1-50.0). Se observó además que aproximadamente el 20% del subgrupo que desarrolla fibrosis tendrán fibrosis rápida, progresando de fibrosis 0 a fibrosis avanzada en un promedio de 5.9años.
16. En la población adulta y pediátrica con EHGNA se estima una reducción en la expectativa y de la calidad de vida.
Nivel de acuerdo: totalmente de acuerdo, 85.29%; parcialmente de acuerdo, 14.70%.
En estudios realizados en población general la prevalencia de EHGNA en niños es del 7.6% (IC95%: 5.5-10.3%)80 y hasta del 2.6% al 3.2% en adolescentes81. En un estudio de seguimiento a 20años con un total de 409.6 personas-año de seguimiento, realizado en 66niños con EHGNA, se observaron 4 pacientes con progresión de fibrosis; de estos, 2 requirieron trasplante hepático y 2 fallecieron. Al comparar la cohorte de EHGNA con población general de la misma edad y sexo se observó un número significativamente mayor de eventos de progresión calculando una tasa de mortalidad estandarizada de 13.6 (IC95%: 3.8-34.8)51.
Estudios poblacionales de seguimiento a largo plazo han mostrado que en pacientes adultos que progresan hacia EHNA se incrementa la morbimortalidad asociada. En una cohorte de 256 pacientes suecos en seguimiento a 28años se observó una mortalidad del 40% en pacientes con un diagnóstico de EHGNA82. Por otro lado, en un seguimiento promedio de 12.3años Angulo et al.78 reportaron que las muertes causadas por complicaciones de cirrosis, CHC o trasplante hepático ocurrieron en el 9.3% de 619 pacientes con EHGNA.
17. En la EHGNA la respuesta inflamatoria y fibrogénica está regulada por mecanismos endocrinos, primordialmente resistencia a la insulina. Pero también está determinada por mecanismos inmunológicos, endoteliales, hormonas sexuales, endotoxemia y variabilidad génica.
Nivel de acuerdo: totalmente de acuerdo, 88.23%; parcialmente de acuerdo, 5.88%; incierto, 5.88%.
A través de la búsqueda de blancos genéticos que expliquen a la EHGNA se ha determinado que los genes de la colágena alfa tipo1, la globulina fijadora de hormonas sexuales y la proteína precursora de beta-amiloide pueden participar en el desarrollo de la enfermedad83. En población mexicana el gen PNPLA3 es el más reportado en asociación con EHGNA84. Sin embargo, se debe considerar que se requieren validaciones locales, así como la determinación del impacto de las variantes génicas en el desarrollo de la EHGNA.
Si bien la resistencia a la insulina determina mecanismos que favorecen la acumulación de grasa al interior del hepatocito, también influyen la respuesta local y sistémica85, además de la respuesta inmunológica determinada por una alteración en el balance de las citocinas producidas por células Th17 y célulasT reguladoras86. Por medio de la modificación en la actividad física se ha demostrado que las hormonas sexuales pueden influenciar la respuesta inflamatoria y la respuesta inflamatoria determinada por endotoxemia87.
18. Las alteraciones cardiovasculares observadas en la EHGNA están determinadas parcialmente por la respuesta del hígado a la presencia de grasa, a la actividad inflamatoria y a la respuesta fibrogénica.
Nivel de acuerdo: totalmente de acuerdo, 85.29%; parcialmente de acuerdo, 8.82%; incierto, 5.88%.
Es claro que el peso corporal, la actividad física y las características de la dieta pueden ser factores de riesgo per se para el desarrollo de la enfermedad cardiovascular. Este riesgo clásicamente se ha relacionado con el aumento en la adiposidad, particularmente visceral, y por los mecanismos humorales en el tejido adiposo88. Pero también existe una colaboración hepática en sujetos con EHGNA89, lo cual multiplica los riesgos cardiovasculares ya descritos en estos pacientes y se relaciona con la gravedad de la enfermedad. Incluso la EHGNA puede ocasionar alteraciones estructurales en las lipoproteínas de alta densidad que afecten negativamente sus funciones90, lo cual confirma que las alteraciones a nivel hepático tienen un papel independiente en el desarrollo de la enfermedad cardiovascular.
19. La lipotoxicidad participa en la respuesta inflamatoria y fibrogénica dependiente del hepatocito y otras células residentes en el hígado (p.ej., células de Kupffer y células estelares).
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
Los ácidos grasos en las células residentes en el hígado tienen impacto a distintos niveles. Uno de los efectos más importantes es la producción de especies reactivas de oxígeno que promueven el daño hepático a través de apoptosis. Por otra parte, se suma la producción de citocinas inflamatorias por parte de células de Kupffer y hepatocitos, lo cual activa las células estelares y promueve la formación de fibrina. Finalmente, los ácidos grasos pueden ocasionar la producción de citocinas que favorecen la fibrogénesis no solo por parte de las células estelares, sino también por las células de Kupffer y del hepatocito91-94.
Manifestaciones clínicas y afectación a otros órganosCoordinadora: Dra. Graciela Castro Narro
Participantes: Dr. Rafael Trejo Estrada, Dr. Diego García Compeán, Dr. Carlos Aguilar Salinas, Dr. David Kershenobich Stalnikowits, Dr. José Antonio Velarde-Ruiz Velasco
20. En pacientes con EHGNA se deberá investigar la presencia de SMet, y en pacientes con SMet se deberá investigar EHGNA.
Nivel de acuerdo: totalmente de acuerdo, 88.23%; parcialmente de acuerdo, 11.76%.
La evidencia apoya los mecanismos patogénicos comunes para EHGNA y SMet que se asocian con el desarrollo de DM2, enfermedad cardiovascular y formas graves de enfermedad hepática, incluyendo cirrosis y CHC.
La primera opinión aceptada sostenía que la EHGNA era simplemente «la manifestación hepática del SMet». Actualmente la evidencia respalda que la EHGNA puede aparecer como parte de una serie de eventos biológicos, culminando en el desarrollo de SMet o sus características clínicas, particularmente DM2. Este nuevo paradigma es clínicamente relevante e implica que la EHGNA puede ser un determinante patogénico del SMet, y también que el tratamiento de la EHGNA será una vía importante para prevenir el desarrollo del SMet y sus complicaciones cardiometabólicas asociadas95.
En una serie de 304 pacientes con EHGNA96 se encontró que la prevalencia de SMet en pacientes con EHGNA aumenta con un mayor IMC: del 18% de EHGNA en no obesos al 67% de EHGNA en obesos. Por otro lado, la presencia de SMet se asocia con un mayor riesgo de EHNA y fibrosis grave. El 88% de los pacientes con EHNA cumplen criterios para SMet, en comparación con el 53% de los pacientes con esteatosis simple.
Según los datos del NASH Clinical Research Network, el SMet confiere un aumento de 40% en el riesgo de EHNA confirmado por histología, y los valores más altos del índice de actividad de EHGNA (NAS, acrónimo de NAFLD Activity Score) se asocian con niveles más altos de alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST), mientras el diagnóstico de EHNA se asocia con características del SMet97.
Un metaanálisis reciente (2016) en el que se analizaron 117,020 pacientes de 20 estudios concluyó que la EHGNA, diagnosticada mediante la determinación de enzimas hepáticas o por ultrasonografía, aumenta significativamente el riesgo de DM2 y SMet en un seguimiento medio de 5años, con un riesgo relativo de 1.80 para la ALT (último frente al primer cuartil o quintil), 1.98 para la gamma glutamil transferasa (GGT) y 3.22 para la ecografía98. Kwon et al.99 informaron una asociación más fuerte para SMet y EHGNA en pacientes no obesos que para EHGNA en obesos. Los pacientes con EHGNA no obesos tenían índices de prevalencia ajustados más altos para ciertos componentes de SMet (triglicéridos altos para ambos sexos y presión arterial elevada, glucosa alterada en ayunas y colesterol HDL para mujeres) que aquellos con EHGNA obesos.
Finalmente, las características del SMet no solo son altamente prevalentes en pacientes con EHGNA, sino que también el riesgo y la gravedad del EHGNA aumentan con el número de componentes del SMet.
21. La resistencia a la insulina y la distribución anormal de la grasa corporal son comunes en pacientes con EHGNA.
Nivel de acuerdo: totalmente de acuerdo, 82.35%; parcialmente de acuerdo, 14.70%; incierto, 2.94%.
La obesidad está relacionada con un mayor riesgo de enfermedades metabólicas, como resistencia a la insulina, DM2, dislipidemia y EHGNA100. La esteatosis hepática es una consecuencia de la alteración del metabolismo de los lípidos en el hígado. Los principales factores que contribuyen son la resistencia a la insulina hepática y la mayor afluencia de ácidos grasos libres en el hígado. La fisiopatología de la esteatohepatitis señala la hipótesis original de 2 golpes en la que un primer golpe, como la resistencia a la insulina, da como resultado la esteatosis hepática, y un segundo golpe, como el estrés oxidativo, el desarrollo de la esteatohepatitis101,102.
Recientemente se ha propuesto la teoría multigolpe para explicar la fisiopatología de la EHGNA. La resistencia a la insulina es uno de los factores clave en el desarrollo de la esteatosis/esteatohepatitis y da como resultado un aumento de la lipogénesis hepática de novo y la inhibición de la lipólisis del tejido adiposo, con el consiguiente aumento del flujo de ácidos grasos al hígado. La resistencia a la insulina también promueve la disfunción del tejido adiposo con la consecuente producción alterada y secreción de adipocinas y citocinas inflamatorias103,104.
La resistencia a la insulina es una característica cardinal de la EHGNA y es más prevalente en esteatohepatitis en comparación con la esteatosis simple105. Sabemos que juega un papel importante en la patogénesis de la EHGNA106.
Por otro lado, se cree que la disfunción del tejido adiposo juega un papel fundamental en el desarrollo de trastornos metabólicos, como la resistencia a la insulina y la EHGNA. En los pacientes con EHGNA la distribución de grasa corporal es un factor de mayor importancia que la cantidad adiposa total. Las personas con exceso de tejido adiposo visceral u obesidad abdominal tienen un mayor riesgo de tener componentes del SMet que aquellas cuya grasa se encuentra predominantemente en la parte inferior del cuerpo, por vía subcutánea. Además, los pacientes delgados con esteatohepatitis generalmente tienen obesidad abdominal o más tejido adiposo visceral107,108. El área de tejido adiposo visceral está aumentada en pacientes con EHGNA (con y sin fibrosis significativa) y se asocia de forma independiente con un mayor riesgo de esteatohepatitis33.
En otro estudio de cohorte con 2,017 sujetos con una mediana de tiempo de seguimiento de 4.4años el área de tejido adiposo visceral se asoció con mayor incidencia de EHGNA, con una HR de 1.36 (IC95%: 1.16-1.59). Por el contrario, áreas más grandes de tejido adiposo subcutáneo se asociaron longitudinalmente con la regresión de EHGNA. Estos datos indican que ciertos tipos de grasa corporal son factores de riesgo para EHGNA (tejido adiposo visceral), mientras que otros tipos podrían reducir el riesgo de EHGNA (tejido adiposo subcutáneo)109.
22. La EHGNA es un factor de riesgo para el CHC que también puede aparecer en ausencia de cirrosis y en presencia del gen PNPLA3.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
El desarrollo de CHC complica la enfermedad hepática crónica. La asociación de DM2 y obesidad con un aumento en el riesgo de desarrollo de CHC se ha demostrado en estudios epidemiológicos110. La aparición de CHC se ha reportado también en EHGNA y en cirrosis criptogénica27.
En el Reino Unido la mortalidad relacionada con CHC aumentó 1.8 veces en 10años (de 2.0 a 3.7 por 100,000). En un estudio que evaluó la demografía de los pacientes referidos por cáncer en Inglaterra se demostró un aumento de 2 a 3 veces en la referencia de pacientes con CHC asociado a hepatitisC, hepatopatía alcohólica o ausencia de enfermedad hepática crónica, pero un incremento mayor a 10veces en CHC asociado a EHGNA110.
La EHGNA es la tercera causa de CHC en Estados Unidos y la segunda indicación en frecuencia para trasplante hepático relacionado con CHC111. Se calcula que la incidencia de CHC asociada a EHGNA aumenta con una tasa del 9% cada año27.
En el momento del diagnóstico, los pacientes con CHC asociado a EHGNA son de edad más avanzada y tienen más comorbilidades extrahepáticas pero menor frecuencia de cirrosis cuando se comparan con pacientes con CHC no asociado a hígado graso. En los Hospitales de Veteranos, hasta un 13% de los pacientes con CHC no tenían cirrosis. La EHGNA se reconoció como un factor asociado independiente112.
Los pacientes con CHC asociado a EHGNA probablemente mueren con mayor frecuencia del CHC con respecto a pacientes cirróticos por otra etiología. En el estudio del Reino Unido, sin embargo, la supervivencia de estos pacientes fue similar a la de otras etiologías. Esto se atribuyó a una presentación incidental significativamente mayor y una menor prevalencia de cirrosis110.
La variación genética y factores ambientales pueden combinarse para determinar la progresión de la enfermedad en EHGNA. El gen PNPLA3 rs 738409 C>G se ha asociado con un mayor riesgo de esteatohepatitis progresiva y fibrosis, pero también con un aumento en el riesgo de CHC. En un estudio reciente, el gen PNPLA3 rs 738409 fue determinado por discriminación alélica en 100 pacientes europeos caucásicos con CHC asociado a EHGNA y 275 controles con características histológicas de EHGNA sin CHC. Las frecuencias genotípicas fueron significativamente diferentes entre los casos con CHC y los controles. En el análisis multivariado ajustado para edad, sexo, diabetes, IMC y presencia de cirrosis, ser portador del alelo menor (G) del rs 738409 confirió un riesgo aditivo para CHC. Estos resultados sugieren que la genotipificación podría proveer una estratificación del riesgo que permitiera una vigilancia para el CHC en pacientes con EHGNA, aunque esta estrategia no se considera aún costo-efectiva113.
23. Se recomienda identificar casos de EHGNA con fibrosis, sobre todo en los pacientes de alto riesgo (edad >40 años, DM2, SMet, AST/ALT>1).
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
La característica histológica más importante de la EHGNA asociada al riesgo de mortalidad a largo plazo es la fibrosis. Los diferentes estadios, F2 a F4, son predictores independientes de la mortalidad relacionada con enfermedad hepática114.
El IMC y la circunferencia de cintura aumentados, reflejo de la adiposidad visceral, están relacionados con la EHGNA y predicen enfermedad más grave, particularmente en personas de edad avanzada. La DM2 se relaciona con la progresión de la EHGNA, el desarrollo de esteatohepatitis y la presencia de fibrosis avanzada y de CHC115.
El hígado graso acompañado por cambios necroinflamatorios se define por el puntaje de actividad de la EHGNA (NAS). En un estudio reciente se determinó la mortalidad específica por enfermedad en la EHGNA y se evaluaron el NAS y el estadio de fibrosis como marcadores pronósticos de mortalidad general y específica por enfermedad. En este estudio se evaluaron los datos de 229 pacientes con EHGNA demostrada por biopsia y se compararon contra una población de referencia. El seguimiento promedio fue de 26años. Los pacientes con EHGNA tuvieron mayor mortalidad, con incremento en el riesgo de enfermedad cardiovascular, CHC, enfermedades infecciosas y cirrosis. La mortalidad general no se incrementó en pacientes con fibrosis estadio 0-2, mientras que los pacientes con fibrosis en estadios 3-4, independientemente del NAS, tuvieron una mayor mortalidad114.
24. Los pacientes con EHNA y fibrosis tienen un riesgo elevado de cirrosis y mortalidad relacionada con el hígado.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
La EHGNA es, por lo general, una enfermedad relativamente benigna, pero algunos individuos desarrollan complicaciones hepáticas y cardiovasculares. La EHGNA puede afectar del 17 al 46% y la EHNA del 3 al 5% de la población general. Sin embargo, hasta el 30% de los pacientes con EHGNA pueden tener EHNA al momento de su detección116. Los pacientes con EHNA tienen un incremento en el riesgo de progresión hacia cirrosis hepática en comparación con pacientes sin EHNA, ya que una gran parte tiene algún grado de fibrosis. La progresión a cirrosis de la EHNA con inflamación aislada es de aproximadamente el 5 al 18%, mientras que la presencia de fibrosis incrementa esta progresión al 38%79,117. Evidencia reciente en estudios prospectivos de cohortes de pacientes con EHGNA sugiere que la fibrosis predice la enfermedad hepática crónica en forma más confiable que la sola inflamación. Un estudio reciente demostró que una puntuación de actividad inflamatoria de la EHGNA (NAS) >4 (punto de corte utilizado para definir EHNA en los estudios clínicos) no tuvo correlación con la mortalidad relacionada con enfermedad hepática118. En contraste, otro estudio prospectivo de 209 pacientes con EHGNA, seguidos durante 12años, demostró que la fibrosis avanzada fue la única lesión histológica independientemente asociada con mortalidad hepática. En este estudio, al igual que en el anterior, los pacientes con NAS>4 sin fibrosis significativa no mostraron un incremento en la mortalidad hepática en comparación con la población de referencia119.
Las complicaciones hepáticas de la EHGNA incluyen enfermedad hepática progresiva, cirrosis y CHC. La mortalidad relacionada con enfermedad hepática (encefalopatía hepática, ascitis, hemorragia por varices esofágicas y síndrome hepatorrenal) tiene una prevalencia variable. Un estudio en población general realizado en Estados Unidos de 1988 a 1994, con una cohorte de 4,083 pacientes con EHGNA seguida hasta el año 2006, con un promedio de seguimiento de 14.5años, mostró que 779 habían fallecido. La causa más frecuente fue enfermedad cardiovascular (37%), seguida de CHC (21%) y enfermedad relacionada con el hígado (2.4%)41. En otro estudio con seguimiento de 8 a 18.5años la mortalidad relacionada con el hígado fue más alta: del 11 al 18% en comparación con el 2 y al 3% de pacientes sin EHNA ni fibrosis, respectivamente120,121. Lo anterior indica que la búsqueda de fibrosis en pacientes con EHGNA es fundamental para estimar el pronóstico y decidir un tratamiento preventivo y correctivo.
25. En caso de cirrosis criptogénica se recomienda investigar SMet, sobrepeso u obesidad, ya que pueden corresponder a EHGNA.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
Al parecer la cirrosis criptogénica tiene relación causal con la EHGNA. En un estudio realizado en México se reportó que representa el 10.4% de las causas de cirrosis23. Un estudio realizado en Japón reportó una prevalencia similar122. Esta prevalencia puede variar hasta un 30% en relación con la presencia de factores de riesgo.
Histopatológicamente, la asociación de EHGNA con cirrosis criptogénica no ha sido fácil de demostrar, ya que no se encuentran datos claros de EHNA en las biopsias, particularmente esteatosis hepática, por lo que se considera como una esteatohepatitis «quemada». No obstante, en un análisis histológico de pacientes con cirrosis catalogada como criptogénica que tenían biopsias previas identificadas como EHNA se demostraron cambios residuales consistentes con esteatohepatitis (degeneración balonoide, cuerpos de Mallory-Denk y megamitocondrias), los cuales reflejan una relación fisiopatogénica entre ambas entidades patológicas123.
Un estudio japonés122 reportó en 404 pacientes con cirrosis criptogénica más obesidad y DM2 en comparación con controles (53 vs 20% y 40 vs 18%, respectivamente). Un estudio en población mexicana con 134 pacientes con cirrosis criptogénica mostró significativamente mayor prevalencia de SMet (29.1 vs 6%), obesidad (16.4 vs 8.2%) y DM2 (40 vs 22.4%) que los sujetos controles124.
Con base en lo anterior, en todo paciente con cirrosis de etiología indefinida se deberá buscar SMet, obesidad, dislipidemia y DM.
26. La EHGNA puede asociarse a otras enfermedades endocrinas, como síndrome de ovario poliquístico, hipotiroidismo, osteopenia, osteoporosis, deficiencia de hormona de crecimiento o hipercortisolismo.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
La EHGNA se asocia con varias enfermedades multisistémicas extrahepáticas125. Esto se debe a que la EHGNA comparte mecanismos fisiopatológicos con enfermedades relacionadas al SMet, como las enfermedades cardiovasculares relacionadas con la aterosclerosis, DM2, el síndrome de ovario poliquístico, la enfermedad renal crónica, algunos tumores y la osteoporosis126. La relación con la enfermedad ósea fue identificada en estudios epidemiológicos que mostraron una menor densidad mineral ósea en personas con EHGNA, aun al ajustar por variables de confusión. La evidencia más sólida ha sido publicada en población pediátrica. No existe predominio con alguna región del esqueleto. Los mecanismos involucrados en la asociación son la deficiencia de vitaminaD y la inflamación crónica. Sin embargo, otras asociaciones tienen explicaciones alternas. Algunas enfermedades endocrinas pueden ser causa de EHGNA. Este es el caso del hipotiroidismo, el hipogonadismo, la deficiencia de hormona de crecimiento y el hipercortisolismo127. Estas condiciones pueden ser causa de una menor acción sistémica de la insulina o de un incremento de la lipogénesis. La deficiencia de estrógenos y de andrógenos se asocia a la esteatosis hepática. La evidencia sobre el efecto de la sustitución hormonal sobre la progresión de la EHGNA es insuficiente. No existe consenso sobre si la evaluación de las enfermedades antes mencionadas debe incluir el escrutinio de la EHGNA. Sin embargo, el profesional de la salud debe estar alerta sobre la existencia de estas asociaciones.
27. La apnea obstructiva del sueño se asocia a obesidad y es un factor de riesgo para EHGNA.
Nivel de acuerdo: totalmente de acuerdo, 85.29%; parcialmente de acuerdo, 11.76%; incierto, 2.94%.
La asociación entre la EHGNA y la apnea obstructiva del sueño ha sido documentada en estudios de casos y controles. Varios estudios han reportado una mayor gravedad de la fibrosis en los casos con apnea; sin embargo, deficiencias metodológicas de los reportes limitan las implicaciones clínicas de los hallazgos. La asociación ha sido descrita aun en casos con adiposidad normal. Ambas condiciones comparten la menor acción de la insulina en tejidos periféricos y un estado de inflamación crónica128. Además, la hipoxia repetida facilita la activación de la subunidad alfa del factor1 inducible por hipoxia (HIF1 alfa), lo que agrava la inflamación crónica y la disfunción mitocondrial129. El tratamiento de la apnea mediante presión positiva continua en vías aéreas, o CPAP (por sus siglas en inglés) no modifica las alteraciones metabólicas, y la evidencia es de calidad insuficiente para hacer una recomendación clínica.
28. La EHNA está asociada con un incremento en la prevalencia de enfermedad renal crónica (ERC).
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
La evidencia asocia la EHGNA y la ERC, sugiriendo un rol de la EHGNA en el desarrollo y progresión de la ERC. La participación del sistema renina-angiotensina-aldosterona (SRAA) merece ser mencionado. Los estudios experimentales han demostrado la presencia de elementos clave del SRAA en el hígado normal y su aumento en la EHGNA. En particular, la activación excesiva del SRAA ocurre no solo en el daño renal progresivo, sino también en la fibrogénesis hepática, relacionando el daño hepático y el renal. La gravedad del daño hepático se asoció con un mayor deterioro en la función renal. Esta asociación parece ser independiente a la resistencia a la insulina, la obesidad, la diabetes y la hipertensión130.
La EHGNA parece estar asociada a mayor riesgo de prevalencia (OR2.12; IC95%: 1.69-2.66) e incidencia (HR1.79; IC95%: 1.65-1.95) para ERC. Los pacientes con EHNA aumentaron aún más el riesgo de ERC prevalente (OR2.53; IC95%: 1.58-4.05) e incidente (HR2.12; IC95%: 1.42-3.17) en comparación con aquellos con esteatosis simple, pero el mismo riesgo puede duplicarse en EHNA con fibrosis avanzada en comparación con aquellos con fibrosis leve/ausente, y la gravedad del daño hepático se asocia positivamente con las etapas de ERC. En todos los análisis estas asociaciones no se vieron afectadas por el estado de diabetes, obesidad abdominal/cuerpo entero, resistencia a la insulina u otros factores de riesgo cardiometabólico131.
Escrutinio y diagnósticoCoordinador: Dr. René Malé Velázquez
Participantes: Dr. Miguel Stoopen Rometti, Dr. Mario Arturo Ballesteros Amozurrutia, Dr. Paris Ramos Martínez, Dr. Ignacio Aiza Haddad, Dr. Jorge Luis Poo Ramírez, Dr. Misael Uribe Esquivel, Dra. Laura Ladrón de Guevara
29. Se recomienda escrutinio para la detección de EHGNA en pacientes con obesidad y/o SMet mediante la determinación de enzimas hepáticas y/o métodos de imagen.
Nivel de la evidencia y fuerza de la recomendación: GRADE A2, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 76.47%; parcialmente de acuerdo, 8.82%; incierto, 2.94%; parcialmente en desacuerdo 5.88%; totalmente en desacuerdo 5.88%.
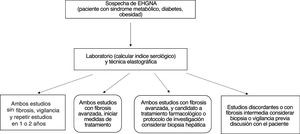
En pacientes con factores de riesgo a desarrollar EHGNA (obesidad, DM2 y/o SMet) se recomienda escrutinio mediante US abdominal y/o pruebas de función hepática (AST, ALT, GGT y fosfatasa alcalina) como una estrategia valiosa para el diagnóstico temprano de esteatosis hepática. Una vez establecido el diagnóstico de EHGNA se recomienda evaluar el grado de fibrosis hepática mediante índices biológicos y/o estudios de elastografía por US o resonancia magnética (RM)14,15,132. La determinación de niveles de enzimas hepáticas (ALT, AST, GGT) presenta limitaciones para establecer el diagnóstico de EHGNA (tabla 1), ya que estos niveles pueden ser normales aun en pacientes con EHGNA y fibrosis avanzada; sin embargo, la EHNA suele asociarse a niveles elevados de ALT133,134. Existe un debate en cuanto a la implementación del escrutinio para el diagnóstico de EHGNA, ya que no hay estudios que validen su utilidad o que valoren el costo-beneficio del diagnóstico temprano de EHGNA en población de riesgo135,136. Por un lado, al realizar escrutinio se corre el riesgo de saturar los sistemas de salud con pacientes con EHGNA, y por otro lado es importante diagnosticar los pacientes con EHNA avanzada y/o fibrosis de manera oportuna, sobre todo en poblaciones de riesgo14,15,132. Los integrantes de este Consenso consideran necesario realizar el escrutinio de EHGNA en la población mexicana de riesgo (pacientes con SMet, obesidad y/o DM2).
Utilidad de las enzimas hepáticas y ultrasonido para establecer el diagnóstico de EHGNA
| Estudio | Sensibilidad/especificidad | Comentarios |
|---|---|---|
| Pruebas de función hepática ALT/AST/GGT | Baja | Poco confiables para el diagnóstico; sin embargo, ALT puede elevarse en pacientes con EHNA |
| Ultrasonido abdominal | Baja sensibilidad para detectar grasa <20% pero alta especificidad >90% | Estudio accesible; depende del operador, con dificultad para diagnosticar fibrosis |
30. Los biomarcadores serológicos únicos o combinados no son lo suficientemente precisos para distinguir la EHGNA de la EHNA, ni logran detectar de manera precisa estadios tempranos de fibrosis.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 2.94%; incierto, 2.94%.
Se ha intentado realizar el diagnóstico de la EHNA mediante pruebas serológicas no invasivas (citokeratina18, pruebas de metabolómica, péptido terminal de procolágenaIII, NASH test, etc.), pero dichas pruebas no son lo suficientemente confiables, ni reproducibles, por lo que la biopsia hepática sigue siendo la herramienta principal para el diagnóstico certero de EHNA15,137,138.
31. Se recomienda una biopsia hepática para establecer con precisión el diagnóstico de esteatohepatitis no alcohólica, el grado de fibrosis y para descartar otras patologías. Su realización debe ser considerada caso por caso, sobre todo en pacientes candidatos a tratamiento farmacológico.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 91.17%; parcialmente de acuerdo, 5.88%; incierto, 2.94%.
La EHGNA afecta entre del 17 al 46% de la población general, por lo que realizar una biopsia hepática en todos los pacientes con sospecha de EHNA o fibrosis hepática no es posible, debido no solo a la falta de recursos económicos y humanos, sino también a las limitaciones de dicho procedimiento, como el riesgo de complicaciones, la variabilidad del grado de fibrosis en el mismo paciente entre diferentes regiones del hígado y la variabilidad en la lectura de la biopsia entre diferentes observadores139-143.
El hallazgo histológico más significativo en pacientes con EHGNA es la fibrosis hepática, debido a que se asocia a un incremento en la mortalidad por enfermedad hepática y a la necesidad de trasplante hepático78,144. La biopsia hepática, a pesar de sus limitaciones, continúa siendo el estándar de oro, pero se debe considerar su realización caso por caso cuando existe duda del diagnóstico o cuando es necesario establecer el diagnóstico de certeza de EHNA o de fibrosis hepática (utilización de fármacos para tratamiento o protocolos de investigación)145.
32. El ultrasonido hepático es el método radiológico de primera línea para la detección de EHGNA, no solo por su amplia disponibilidad, sino porque provee información complementaria de otras posibles patologías hepatobiliares.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; incierto, 2.94%.
El US hepático es una herramienta básica para el escrutinio de EHGNA. Entre sus ventajas están su naturaleza no invasiva, la ausencia de radiación, su amplia disponibilidad y su bajo costo146,147. En casos de hígado sin esteatosis la textura del parénquima es homogénea y con una densidad óptica parecida a la de la corteza renal o bien del parénquima esplénico. En cambio, cuando existe esteatosis la ecogenicidad (brillantez) del hígado aumenta y es mayor a la del riñón, y la nitidez de la pared de la vesícula biliar, de los vasos intrahepáticos y del diafragma disminuyen. La sensibilidad del US para detectar esteatosis varía entre el 60 y el 94%, y la especificidad, entre el 84 y el 95%148-153.
En un metaanálisis de 49 estudios se evaluaron la sensibilidad y la especificidad del US para detectar hígado graso moderado a severo (>30%) comparado con biopsia154. La sensibilidad fue del 84.8% (IC95%: 79.5-88.9) y la especificidad del 93.6% (IC95%: 87.2-97.0). Este mismo estudio destaca que la sensibilidad y la especificidad del US abdominal son similares para el diagnóstico de hígado graso comparado con otras técnicas de imagen (tomografía axial computarizada y RM). Si bien el US es altamente sensible para el diagnóstico de esteatosis moderada a severa, en casos de esteatosis >5% y <30% la sensibilidad disminuye al 53.5-66.6% y la especificidad oscila entre el 77 y el 93.1%146.
El US sin elastografía puede sugerir la presencia de fibrosis avanzada (cirrosis) al determinar la irregularidad y la nodularidad de la superficie hepática; de hecho, se ha descrito como un estudio complementario a las técnicas elastográficas155,156.
33. Se recomienda un escrutinio para enfermedades cardiovasculares en pacientes con EHGNA, de acuerdo a factores de riesgo individuales.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 91.17%; parcialmente de acuerdo, 5.88%; incierto, 2.94%.
Los pacientes con EHGNA con o sin fibrosis no solo tienen el riesgo a desarrollar inflamación y fibrosis hepática, sino también a presentar una mayor mortalidad por enfermedad cardiovascular157.
La EHGNA contribuye a una aterogénesis acelerada, lo cual sugiere una relación bidireccional entre la EHGNA y las enfermedades cardiovasculares158. La EHGNA es un factor de riesgo independiente para eventos cardiovasculares159. Se recomienda instruir a los pacientes en las modificaciones en el estilo de vida para el control del SMet, incluyendo el control de hipertensión arterial y la dislipidemia acorde a las guías internacionales de prevención de enfermedad cardiovascular160-163.
34. La determinación de esteatosis hepática por técnicas basadas en RM tiene una alta precisión diagnóstica (similar a la biopsia). En México su disponibilidad es limitada.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
Para la determinación de la EHGNA con técnicas no invasivas se pueden utilizar la RM y técnicas basadas en US. Las técnicas basadas en RM, ya sea por espectroscopia164 o por la determinación de la fracción de la densidad protónica de grasa (PDFF), son las más precisas para el diagnóstico de EHGNA165,166. La RM por espectroscopia, debido a su dificultad y a su poca disponibilidad, se ha utilizado preferentemente en estudios de investigación.
Un metaanálisis reciente de 28 publicaciones muestra que la PDFF por RM tiene una mayor precisión y reproducibilidad para medir el contenido de grasa en el hígado y para el seguimiento del paciente167. La determinación del grado de esteatosis hepática por RM clasifica adecuadamente los diferentes grados de esteatosis de manera similar a la biopsia hepática, y de hecho se ha utilizado para el seguimiento en la respuesta a terapia farmacológica. Sin embargo, su disponibilidad es limitada en nuestro país.
35. Es posible determinar simultáneamente la rigidez* y la grasa** del hígado por técnicas ultrasonográficas mediante la determinación del parámetro de atenuación controlada (elastografía transitoria).
Nivel de la evidencia y fuerza de la recomendación: GRADE *A1, fuerte a favor del enunciado, **B2, débil a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 88.23%; parcialmente de acuerdo, 11.76%.
La técnica de imagen acoplada al equipo de elastografía de transición (FibroScan®) denominada CAP, o «parámetro de atenuación controlada» (en inglés, controlled attenuation parameter) es una buena herramienta diagnóstica para cuantificar la esteatosis hepática. Al ser integrada a la medición de la rigidez hepática permite clasificar simultáneamente el grado de fibrosis y esteatosis en un solo procedimiento. El CAP cuantifica la grasa hepática con menor precisión que la PDFF por RM168. El CAP fue evaluado en 5,323 pacientes por De Ledinghen et al.169, quienes detectaron mediante esta técnica esteatosis hepática, sobre todo en pacientes con un IMC mayor de 25kg/m2, o con SMet, en alcohólicos y en pacientes con rigidez hepática mayor a 6kPa. En 440 de estos se realizó una biopsia hepática. En los pacientes con una esteatosis hepática >10% el AUROC del CAP fue de 0.79 (IC95%: 0.74-0.84; p=0.001); en esteatosis >33% fue de 0.84 (IC95%: 0.80-0.88; p=0.001), y en esteatosis >66% fue de 0.84 (IC95%: 0.84-0.88; p=0.001).
36. Los índices serológicos para la determinación de esteatosis hepática son una alternativa aceptable cuando no se encuentran disponibles estudios de imagen (resonancia o parámetro de atenuación controlada).
Nivel de la evidencia y fuerza de la recomendación: GRADE B2, débil a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 82.35%; parcialmente de acuerdo, 14.70%; totalmente en desacuerdo 2.94%.
Los índices serológicos o biológicos como el índice de hígado graso (IHG), el SteatoTest® y la puntuación de esteatosis se han utilizado como alternativa para la detección y el escrutinio de EHGNA, sobre todo cuando no se encuentran disponibles otras técnicas como la PDFF por RM o el CAP. Esto índices han sido validados en la población general y valoran la presencia de esteatosis, mas no la severidad.
El IHG, descrito en 2006, se calcula mediante una fórmula que incorpora el IMC, la circunferencia de la cadera, los triglicéridos y los niveles de GGT. Este índice ha sido de utilidad en estudios epidemiológicos para el escrutinio de EHGNA y ha sido validado en diferentes poblaciones170,171.
El SteatoTest® es una prueba con 12 variables serológicas en una fórmula patentada. Tiene una desventaja: el costo extra para la obtención de los resultados172.
La puntuación de esteatosis se describió en una población finlandesa y posteriormente fue validado en otros grupos. El índice incorpora variables simples como son la presencia de SMet, DM2, insulina sérica en ayuno y la relación AST/ALT173,174.
37. Se recomienda el uso combinado y/o simultáneo y/o secuencial de pruebas serológicas y elastográficas para establecer el grado de fibrosis, con el fin de disminuir el uso de la biopsia hepática.
Nivel de la evidencia y fuerza de la recomendación: GRADE B2, débil a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 91.17%; parcialmente de acuerdo, 5.88%; incierto, 2.94%.
La elastografía por US o RM son modalidades sensibles a la rigidez de los tejidos. Imajo et al.168 compararon la elastografía por RM (ERM) vs elastografía transitoria (ET) en 142 pacientes identificados por biopsia y encontraron que la AUROC para establecer fibrosis hepática >F2 fue de 0.82 para la ET y de 0.91 para la ERM. Park et al.175 confirmaron que la ERM es más precisa que la ET para detectar fibrosis en pacientes con EHGNA.
El principal componente de la «rigidez hepática» es la fibrosis; sin embargo, otros factores, como la inflamación y la congestión hepática, la colestasis y el grado de esteatosis, sobrevaloran el grado de la rigidez del hígado por elastografía basada en US176. Los métodos elastográficos por US se basan en la determinación de la elasticidad de los tejidos, lo cual permite estimar el grado de fibrosis. Las características de los diferentes métodos elastográficos basados en US se describen en la tabla 2 y los detalles específicos sobre su sensibilidad y especificidad, en la tabla 3176-180.
Métodos físicos de medición de la elasticidad del hígado por ultrasonido de acuerdo a Sigrist et al.179
| Método | Elastografía de transición, unidimensional (1D-TE) | Elastografía con onda de corte puntual (pSWE) | Elastografía con onda de corte bi-dimensional (2D-SWE) |
|---|---|---|---|
| Método elastográfico | Pistón mecánico o vibración controlada | Transductor convexo | Transductor convexo |
| Método de US | Modo A, fijo | Modo B, ajustable | Modo B, ajustable |
| Disponibilidad actual a nivel nacional | Amplia | Baja | Muy baja |
| Unidades de medición | Kilopascales | Metros/segundo | Kilopascales y metros/segundo |
| Visualización de la zona a evaluar | Limitada | 100% | 100% |
| Uso en paciente con ascitis | Imposible | Posible | Posible |
Sensibilidad (Se) y especificidad (Es) de los métodos elastográficos basados en ultrasonido
| Prueba diagnóstica | Autor | Año | n | Valor de corte (kPa) | AUROC | Se (%) | Es (%) |
|---|---|---|---|---|---|---|---|
| TE | Tapper et al.180 | 2016 | 164 | 9.9 | 0.93 | 95 | 77 |
| pSWE/ARFI | Ferraioli et al.178 | 2014 | 134 | 7.2 | 0.95 | 90 | 88.6 |
| 2D-SWE | Dhyani et al.177 | 2017 | 277 | 7.29 | 0.84 | 95.4 | 50.5 |
| MRE | Singh et al.296 | 2015 | 697 | NA | 0.93 | 85 | 85 |
2D-SWE: 2D-shear wave elastography; MRE: magnetic resonance elastography; NA: no aplica, porque los valores son en metros/segundo y no en kilopascales; pSWE/ARFI: point shear wave elastography (pSWE) utilizando acoustic radiation force impulse (ARFI); TE: transient elastography.
Los índices biológicos para establecer la fibrosis hepática en la EHNA se determinan en suero y tienen una confiabilidad diagnóstica aceptable. Estos índices son útiles para establecer la fibrosis avanzada o la ausencia de fibrosis. Los grados intermedios de fibrosis son difíciles de determinar por las técnicas no invasivas, particularmente por los índices serológicos15,181-183. Los índices serológicos más estudiados para determinar fibrosis en pacientes con EHGNA son (tabla 4):
- 1.
El puntaje de fibrosis para hígado graso (NFS, acrónimo en inglés de NAFLD fibrosis score)184.
- 2.
Calculador de fibrosis 4 (FIB-4, acrónimo en inglés de fibrosis 4 calculator)183.
- 3.
Fibrosis hepática incrementada (ELF, acrónimo en inglés de enhanced liver fibrosis)181.
- 4.
Fibrotest®182.
- 5.
La relación AST/plaquetas (APRI, acrónimo en inglés de AST to platelet ratio index)185.
Índices serológicos más estudiados para determinar fibrosis en pacientes con EHGNA
| Índice biológico | Variables | Cálculo | Utilidad | Limitaciones |
|---|---|---|---|---|
| NAS | Edad, IMC, glucosa, plaquetas, albúmina, AST/ALT | nafldscore.com | Predice ausencia o presencia de fibrosis, así como mortalidad general y por enfermedad hepática | Valores intermedios en un gran número de pacientes |
| FIB-4 | Edad, ALT, AST, plaquetas | www.hepatitisc.ux.edu/page/clinical-calculator/fib-4 | Desarrollado para pacientes coinfectados HIV/HCV y validado y comparado con otros índices en EHGNA, siendo un marcador discretamente superior a NAS y APRI | Valores intermedios en un gran número de pacientes |
| Fibrotest | GGT, bilirrubina, haptoglobulina, apolipoproteína A1, alfa 2 macroglobulina | Fórmula patentada, por lo que se requiere pagar una cuota para obtener el resultado | Validada principalmente en población francesa, útil para diagnosticar fibrosis avanzada | Costo, valores intermedios en un gran número de pacientes |
| ELF | Ácido hialurónico, inhibidor tisular de metaloproteinasa, polipetido amino-terminal de colágena tipoIII | Fórmula compleja y análisis inmunoquímicos no disponibles en nuestro medio | Predice pacientes con fibrosis avanzada | No existe disponibilidad en nuestro medio |
| APRI | ALT/AST, plaquetas | www.hepatitisc.uw.edu/page/clinical-calculator/apri | Fácil de calcular, disponible en la mayoría de los caso, útil para identificar fibrosis avanzada | No identifica enfermedad hepática significativa |
Diferentes autores han sugerido la realización combinada de pruebas serológicas y elastográficas al inicio de la evaluación de pacientes con EHGNA para establecer la ausencia y/o la presencia de fibrosis. En caso de concordancia de ambos estudios se evitaría la realización de una biopsia hepática. Sin embargo, en caso de discrepancia se puede considerar la realización de la biopsia hepática139,186-189. En pacientes sin fibrosis o con duda diagnóstica se sugiere vigilancia con pruebas no invasivas para evaluar la progresión de la enfermedad187,189 (fig. 1).
38. La biopsia hepática con EHNA se debe clasificar de acuerdo a la gravedad de la inflamación (leve, moderada o severa) y de acuerdo con los sistemas de puntaje validados previamente (NAS y SAF).
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 100%.
La biopsia hepática es el estándar de oro en el diagnóstico de la EHNA. Permite evaluar un grupo de alteraciones histológicas: esteatosis, esteatohepatitis, fibrosis y cirrosis, con y sin esteatohepatitis. En caso de que sea necesaria la biopsia deberá ser evaluada de acuerdo a los esquemas de puntaje previamente validados.
La biopsia hepática distingue a los pacientes con esteatohepatitis de aquellos con «solo» esteatosis (el cual incluye un espectro llamado esteatosis con inflamación)190. La EHNA es definida histopatológicamente por la presencia de esteatosis, inflamación (lobulillar y portal) y daño a los hepatocitos (degeneración balonoide). En fases iniciales la degeneración balonoide y la fibrosis inician en la zona3 (cerca de la vena central/sitio con menor oxigenación). En fases avanzadas, esta degeneración balonoide desaparece190.
La escala histológica más usada para la EHNA es la NAS (non-alcoholic fatty liver disease activity score). Esta fue diseñada para evaluar la respuesta al tratamiento97. La escala conocida como SAF (steatosis, activity, fibrosis) incluye esteatosis, degeneración balonoide e inflamación lobulillar y fibrosis191.
39. En caso de presentar fibrosis o cirrosis por EHNA deberá hacerse un seguimiento clínico y US hepático cada 6meses con el fin de detectar CHC en forma oportuna.
Nivel de la evidencia y fuerza de la recomendación: GRADE B1, débil a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 85.29%; parcialmente de acuerdo, 14.70%.
El CHC es la quinta causa de cáncer más prevalente y la segunda en mortalidad192. Los nuevos casos de CHC han aumentado debido a la alta prevalencia de EHGNA y el SMet. Los enfermos con fibrosis o cirrosis por EHGNA tienen un mayor riesgo de desarrollar CHC. Una tercera parte de los pacientes con cirrosis desarrollarán CHC, y estudios de seguimiento han encontrado que aproximadamente el 1-8% de los pacientes con cirrosis desarrollan CHC por año, por lo que se recomienda el US hepático cada 6meses193. Esto permitirá la detección de estadios tempranos, y de ser así, un tratamiento oportuno como resección, trasplante hepático o ablación que de esta manera resultará en una mayor supervivencia. Por lo tanto, la implementación de este seguimiento para identificar de manera temprana el CHC en estas poblaciones en riesgo contribuirá a disminuir las muertes asociadas al CHC.
Tratamiento ICoordinadora: Dra. Saraí González Huezo
Participantes: Dr. Francisco Sánchez Ávila, LN Sophia Martínez Vázquez, Dr. Jorge Alejandro López Cossio, Dr. Ernesto Márquez Guillén, Dra. Laura Cisneros Garza
40. La disminución de peso a través de una dieta y ejercicio es la estrategia terapéutica más efectiva en la EHGNA. Una reducción de peso de al menos el 7% disminuye la actividad histológica, y una de más del 10% disminuye la fibrosis.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 88.23%; parcialmente de acuerdo, 11.76%.
Diversos metaanálisis y ensayos clínicos aleatorizados señalan que una disminución de peso corporal de al menos el 5% del peso inicial produce cambios en los marcadores bioquímicos de la enfermedad y del SMet, específicamente en la sensibilidad a la insulina, las transaminasas y en el perfil de lípidos14,194,195. Una reducción de peso >7% produce cambios histológicos especialmente del grado de esteatosis, la balonización, la inflamación y, por lo tanto, en el puntaje NAS196-198. Una reducción del 10% en el peso corporal produce remisión de la esteatohepatitis hasta en el 90% de los pacientes y una reducción de la fibrosis hasta en el 45%199.
Se han propuesto y estudiado diversos tipos de dieta para el tratamiento de la EHNA y se ha observado que el común denominador es la reducción calórica. Algunos estudios y guías de práctica clínica recomiendan una reducción del 25% de la energía habitual que consume una persona200,201. La distribución de macronutrientes también es importante, y una dieta baja en hidratos de carbono (50-60%) puede ser benéfica si el paciente tiene datos de resistencia a la insulina o diabetes, y una dieta baja en grasas (20-25%) si el paciente tiene dislipidemia197,202,203. Se recomienda también que se eviten los alimentos altos en fructosa, así como los alimentos altos en grasas trans.
41. Se recomienda una dieta personalizada implementada por un profesional de la nutriología para contribuir a la pérdida de peso en el tratamiento de la EHGNA.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
La cantidad de energía que una persona debe ingerir debe ser individualizada por un profesional de la nutriología200. Debe realizarse una evaluación completa del estado nutricional y preferentemente de la composición corporal201,204.
El profesional de la nutriología debe considerar el gasto energético, ya sea por composición corporal o por fórmulas de predicción (tabla 5) como las usadas para el tratamiento de la obesidad205, en donde al menos se deben proporcionar 16-17kcal/kg de peso ajustado (tabla 6). Se recomienda la distribución de nutrimentos en la dieta como sigue: 20% proteínas, 30% grasas y 50% hidratos de carbono, y más grasas mono y poliinsaturadas con respecto a las saturadas (10:13:7, respectivamente), menos del 10% de hidratos de carbono simples, preferentemente derivados de frutas201, y consumo de fibra dietética de 25-35g/día, además de agua natural: 2.5 a 3l/día206. Debe reducirse el consumo de bebidas endulzadas, refrescos y productos con alto contenido de fructosa14,204. También se recomienda eliminar productos con alto contenido de grasas saturadas, como los alimentos fritos, empanizados y los altamente procesados que contengan grasas trans o grasas saturadas como ingredientes o vehículos para su conservación14,201.
Fórmulas de predicción para el cálculo del gasto energético validadas para personas con sobrepeso y obesidad297
| Nombre de la fórmula | Fórmula |
|---|---|
| Mifflin St. Jeor | Hombre: 10 (peso)+6.25 (tallaa)−5 (edad)+5 |
| Mujer: 10 (peso)+6.25 (tallaa)−5 (edad)−161 | |
| Valencia | Hombre: |
| 10-30 años: (13.37×peso)+747 | |
| 30-60 años: (13.08×peso)+693 | |
| >60 años: (14.2×peso)+429 | |
| Mujer: | |
| 10-30 años: (11.02×peso)+679 | |
| 30-60 años: (10.92×peso)+677 | |
| >60 años: (10.98×peso)+520 | |
| Estimación rápida (Carrasco) | Hombre: 17 kcal×kg peso |
| Mujer: 16.2 kcal×kg peso | |
| Livingston | Hombre: 293×peso0.4330− (edad×5.92) |
| Mujer: 248×peso0.4356− (edad×5.09) |
42. El ejercicio disminuye la grasa corporal y con ello la resistencia a la insulina, por lo que se recomienda como parte fundamental del tratamiento de la EHGNA.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
El ejercicio, independientemente de la dieta, favorece la disminución de grasa hepática. En diversos estudios se ha visto que promueve la reducción de triglicéridos hepáticos y del tejido adiposo visceral14,201,204. La recomendación actual es de 150 a 200min de ejercicio aeróbico o anaeróbico a la semana, menor a la indicada para el tratamiento de la obesidad. Dicha cantidad es suficiente para reducir la esteatosis, aunque no se han visto modificaciones en la fibrosis. El ejercicio debe ir a la par con otras intervenciones en el estilo de vida. El ejercicio en esa misma cantidad, pero sobre todo de tipo aeróbico, disminuye la resistencia a la insulina14,59,201.
43. La cirugía bariátrica mejora la histopatología en pacientes con obesidad mórbida y EHGNA, por lo que puede ser considerada en este tipo de pacientes.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 5.88%.
Con anterioridad se consideró prematuro que la cirugía bariátrica fuera una opción terapéutica para el tratamiento de la EHNA, debido a que estudios previos tenían muestras muy pequeñas y no fueron diseñados prospectivamente con un programa de biopsias pareadas que permitieran la evaluación de este objetivo207-209.
Por lo anterior se llevó a cabo un estudio prospectivo en 109 pacientes con obesidad mórbida y EHNA documentada con biopsia. Los pacientes fueron sometidos a cirugía bariátrica y a biopsias pareadas durante un período de 19años (1994-2013)210. Los pacientes presentaban obesidad mórbida con un IMC mayor a 40kg/m2 u obesidad grave (IMC 35-40kg/m2) y comorbilidades asociadas (hipertensión arterial o diabetes por un mínimo de 5años, refractarios a tratamiento médico). Fueron sometidos a un programa de nutrición y posteriormente a manejo quirúrgico entre 1994 y 2001. Los procedimientos incluyeron bypass biliointestinal o banda gástrica, y a partir de 2001, bypass gástrico en Y de Roux. Las variables evaluadas incluyeron: IMC, peso, presión arterial, ALT, GGT, triglicéridos, colesterol, glucosa e insulina, además de una biopsia hepática al inicio de la cirugía y otra al año posterior a la cirugía.
Evaluaron el grado de esteatosis; la gravedad de la actividad necroinflamatoria con el puntaje de Brunt211 como leve (grado1), moderada (grado2) y grave (grado3); el puntaje NAS196, que incluye esteatosis (0-3), inflamación lobular (0-3) y degeneración balonoide (0-2) con un rango de 0-8, y el grado de fibrosis de acuerdo a la escala de Kleiner97 y METAVIR212. Al comparar las biopsias se observó que la cirugía bariátrica induce mejoría significativa en todos los componentes de la EHNA (tabla 7).
Cambios en las características clínicas, bioquímicas e histológicas basales al año de cirugía bariátrica
| Características | Antes de cirugía | 1 año post-cirugía | Valor de p |
|---|---|---|---|
| IMC, media±DE | 49.2±8.2 | 37.4±6.9 | <0.0001 |
| Características bioquímicas | |||
| Colesterol HDL, mmol/l, media±DE | 1.08±0.27 | 1.29±0.35 | <0.0001 |
| Colesterol LDL, mmol/l, media±DE | 2.78±0.98 | 2.67±0.90 | 0.4 |
| Triglicéridos, mmol/l, mediana (RIQ) | 1.63 (1.31-2.54) | 1.24 (0.92-1.73) | <0.0001 |
| Colesterol total, mmol/l | 4.81±1.17 | 4.64±1.06 | 0.12 |
| ALT, UI/l, media±DE | 52±26 | 25±19 | <0.0001 |
| GGT UI/l, mediana (RIQ) | 51 (34-87) | 23 (14-33) | <0.0001 |
| Glucosa en ayunas, mg/dl, mediana (RIQ) | 130 (100-181) | 94 (87-113) | <0.0001 |
| Índice de resistencia a la insulina, media±DE | 3.58±0.50 | 2.94±0.47 | <0.0001 |
| Características histológicas | |||
| Balonización, n (%) | <0.0001 | ||
| 0 | 1 (1.2) | 66 (80.5) | |
| 1 | 51 (62.2) | 10 (12.2) | |
| 2 | 30 (30.6) | 6 (7.3) | |
| Inflamación lobular, n (%) | <0.0001 | ||
| 0 | 1 (1.2) | 50 (61.0) | |
| 1 | 60 (73.2) | 28 (34.1) | |
| 2 | 20 (24.4) | 3 (3.7) | |
| 3 | 1 (1.2) | 1 (1.2) | |
| Fibrosis (Kleiner), n (%) | <0.0001 | ||
| 0 | 8 (9.9) | 26 (32.1) | |
| 1a | 10 (12.3) | 7 (8.6) | |
| 1b | 6 (7.4) | 4 (4.9) | |
| 1c | 9 (11.1) | 13 (16.1) | |
| 2 | 26 (32.1) | 15 (18.5) | |
| 3 | 19 (23.5) | 14 (17.3) | |
| 4 | 3 (3.7) | 2 (2.5) | |
| Fibrosis (Metavir), n (%) | 0.003 | ||
| 0 | 22 (27.5) | 35 (43.8) | |
| 1 | 32 (40) | 26 (32.5) | |
| 2 | 17 (21.3) | 11 (13.7) | |
| 3 | 6 (7.5) | 6 (7.5) | |
| 4 | 3 (3.7) | 2 (2.5) | |
ALT: alanina aminotransferasa; DE: desviación estándar; GGT: gamma glutamil transferasa; HDL: lipoproteína de alta densidad; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad; RIQ: rango intercuartil.
Modificada de Lassailly et al.210.
La EHNA desapareció en el 85% de los pacientes (IC95%: 75.8-92.2%). Los pacientes tuvieron una reducción significativa en la media del IMC de 49.3±8.2 a 37.4±7 (p<0.0001) y en los niveles de ALT (52.1±25.7UI/l a 25.1±20UI/l, p<0.0001). La media de los niveles de GGT se redujo de 51UI/l a 23UI/l (p<0.0001) y la media de la glucosa en ayuno (130mg/dl, rango 100-181) disminuyó a 94mg/dl (rango 87-113) con valores significativos (p<0.0001). Finalmente, la resistencia a la insulina también disminuyó de 3.58±0.50 a 2.94±0.47 (p<0.0001). El mayor porcentaje de mejoría se observó en los pacientes con EHNA leve comparado con aquellos con EHNA moderada a grave (94.2 vs 70%, p=0.007). El puntaje NAS mejoró de una mediana basal de 5 (4-5) a 1 (1-2) (p<0.0001). La esteatosis disminuyó del 60 al 10%; la balonización disminuyó un 84.2% (n=69 pacientes, IC95%: 74.4-91.3%) y la inflamación lobular un 67.1% (n=55 pacientes, IC95%: 55.8-71%). Se observó mejoría en el grado de fibrosis evaluada tanto con los puntajes de Kleiner como de METAVIR (p<0.0001 y p<0.003, respectivamente). Por puntaje de METAVIR la fibrosis disminuyó un 33.8% (IC95%: 23.6-45.2) en el total de los casos y un 46.6% (IC95%: 33.3-60.1) de los casos cuando el METAVIR tenía fibrosis >1. Hubo concordancia con el puntaje de Kleiner, con mejoría en la fibrosis en el 46.3% de la población total (IC95%: 35.8-55.8) y en el 51.4% (IC95%: 39.3-63.4) de los pacientes con fibrosis basal >1. Cuando se compararon la banda gástrica y el bypass gástrico se observó que la EHNA persistente fue más frecuente en el grupo tratado con banda gástrica (30.4 vs 7.6%, p=0.015)
Se concluyó que la cirugía bariátrica induce la desaparición de la EHNA en cerca del 85% de los pacientes y mejora sus condiciones clínicas, bioquímicas e histológicas. Debe ser considerada una opción en un grupo selecto de pacientes con obesidad mórbida con EHNA que no responden a modificaciones del estilo de vida.
44. Actualmente no existe una terapia farmacológica efectiva y segura para el manejo de la EHNA. Las opciones disponibles son de utilidad en contextos específicos.
Nivel de la evidencia y fuerza de la recomendación: GRADE C1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 82.35%; parcialmente de acuerdo, 11.76%; incierto, 2.94%; parcialmente en desacuerdo, 2.94%.
La EHNA es una enfermedad heterogénea con una fisiopatología compleja. Esta complejidad ha dificultado encontrar un solo agente que sea eficaz y seguro para la mayoría de los pacientes213. A lo anterior se suma la dificultad para la inclusión de sujetos (muchos de ellos asintomáticos) en los ensayos clínicos, ya que involucra la realización de biopsias hepáticas seriadas y la consecuente demostración de una mejoría histológica214,215. Por otro lado, los diseños de los protocolos de investigación para cada fármaco difieren en la población evaluada, lo que complica su aplicabilidad en forma generalizada. Los resultados prometedores obtenidos en los estudios iniciales con varios agentes no fueron confirmados al compararlos posteriormente contra placebo. Si bien es cierto que dos opciones terapéuticas (vitaminaE y pioglitazona) se recomiendan en las guías de manejo internacionales14,135, los beneficios histológicos se obtienen solo en aproximadamente el 50% de los tratados a mediano y largo plazo216-220 y ninguno de ellos ha sido aprobado por las principales agencias regulatorias215. Además, hay preocupación relacionada con la seguridad a largo plazo de estos medicamentos135. Por lo anterior, el uso de estos fármacos debe limitarse a los pacientes con riesgo de progresión a enfermedad hepática avanzada y solamente en escenarios muy específicos.
45. En la actualidad el tratamiento farmacológico se reserva para pacientes con EHNA con evidencia de fibrosis (F≥2) o en los que tienen un mayor riesgo de progresión (DM2, SMet, aumento persistente de ALT).
Nivel de la evidencia y fuerza de la recomendación: GRADE B1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 85.29%; parcialmente de acuerdo, 11.76%; parcialmente en desacuerdo, 2.94%.
Los avances en el manejo farmacológico de la EHNA han ocurrido con lentitud. Se han evaluado múltiples opciones terapéuticas dirigidas a los diversos mecanismos fisiopatológicos de la enfermedad con el objetivo de prevenir complicaciones como la cirrosis y el CHC; sin embargo, la evidencia sobre una terapia farmacológica efectiva es escasa. Actualmente ningún fármaco se considera terapia estándar en la EHNA. Solo algunos fármacos son de utilidad en contextos específicos, tales como antidiabéticos e hipolipemiantes en caso de coexistencia de estos componentes del SMet con la EHNA.
El mayor predictor de morbimortalidad en la EHNA es la fibrosis. Los pacientes sin inflamación o fibrosis tienen un buen pronóstico, en tanto que los sujetos con inflamación y fibrosis F≥2 tienen un mayor riesgo de progresión y son quienes más pueden beneficiarse de las estrategias farmacológicas potencialmente efectivas.
El tratamiento farmacológico se debe enfocar en la enfermedad hepática y las alteraciones metabólicas asociadas como DM2, obesidad y dislipidemia; estas comorbilidades confieren un mayor riesgo de progresión de la enfermedad. Idealmente, el fármaco debe reducir la inflamación hepática, el daño hepatocelular, corregir la resistencia a la insulina y tener efectos antifibróticos214,221,222.
46. El uso prolongado de pioglitazona en la EHNA ha demostrado una disminución de la actividad inflamatoria y posiblemente de la fibrosis. Deben considerarse los efectos secundarios relacionados con el fármaco.
Nivel de la evidencia y fuerza de la recomendación: GRADE B2, débil a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 88.23%; parcialmente de acuerdo, 8.82%; incierto, 2.94%.
La pioglitazona se utiliza en el tratamiento de la DM2. Pertenece al grupo de las tiazolidinedionas y tiene un efecto sensibilizador de la insulina, además de mejorar el metabolismo de los lípidos.
En la EHNA, el estudio de prueba de concepto incluyó 55 pacientes con EHNA y prediabetes o DM2, los cuales fueron aleatorizados a recibir pioglitazona (45mg/día) o placebo por 6meses. En el grupo con pioglitazona se observó una mejoría estadísticamente significativa en la resistencia a la insulina y una disminución de las transaminasas; a nivel histológico se asoció con disminución de la esteatosis, de la degeneración balonoide y de la inflamación, observándose reducción de la necroinflamación (85 vs 38%, p=0.001). En cuanto a la fibrosis, solo mostró una tendencia a la mejoría (p=0.08)218.
Otro estudio incluyó 101 pacientes con EHNA y prediabetes o DM2, todos con una dieta hipocalórica; fueron aleatorizados a pioglitazona (45mg/día) o placebo por 18meses, seguidos de una fase abierta por otros 18meses con pioglitazona. El objetivo primario fue la reducción de al menos 2puntos en el puntaje de NAS en dos categorías histológicas sin empeoramiento de la fibrosis. De los pacientes que recibieron pioglitazona, el 58% lograron el objetivo primario (diferencia del 41%; IC95%: 23-59%) y el 51% tuvo una resolución de la EHNA, así como una mejoría en la fibrosis (p=0.039). La tasa de efectos adversos no fue diferente entre grupos, aunque hubo una mayor ganancia de peso con pioglitazona (2.5kg vs placebo)219.
La pioglitazona también ha sido estudiada en pacientes con EHNA sin diabetes. En un estudio de 74 pacientes con EHNA sin diabetes, aleatorizados a pioglitazona (30mg/día) o placebo por 12meses, la terapia con pioglitazona disminuyó significativamente la fibrosis y el daño hepatocelular217. En el estudio PIVENS, que incluyó 247 pacientes con EHNA sin diabetes aleatorizados a recibir pioglitazona (30mg/día) o vitaminaE (800UI/día) o placebo por 24meses, el objetivo primario fue la mejoría histológica, definida como reducción del NAS de 2 o más puntos, con al menos 1punto de mejoría en la balonización y mejoría de 1punto tanto en la inflamación lobular o esteatosis y sin incremento en la fibrosis. El objetivo primario se alcanzó en el 19% del grupo placebo en comparación con el 34% del grupo de pioglitazona (p=0.04) y el 43% en el grupo de vitaminaE (p=0.001 vs placebo). Aunque la pioglitazona no logró el objetivo primario, la resolución de la EHNA se logró en un porcentaje significativamente mayor en los que recibieron pioglitazona vs placebo (47 vs 21%, p<0.001)220.
La pioglitazona es bien tolerada y el aumento de peso es el efecto secundario más frecuente. Está en controversia una supuesta asociación con cáncer de vejiga. Resultados en algunas poblaciones sugieren que la pioglitazona sí incrementa dicho riesgo223, mientras que en una cohorte con seguimiento de 193,099 personas no se confirmó el riesgo224. Por otro lado, las tiazolidinedionas pueden promover la pérdida ósea y se asocian a fracturas osteoporóticas en mujeres posmenopáusicas225.
47. La vitamina E puede utilizarse en pacientes con EHNA sin diabetes ni cirrosis. Deben considerarse los efectos secundarios relacionados.
Nivel de la evidencia y fuerza de la recomendación: GRADE B2, débil a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 82.35%; parcialmente de acuerdo, 14.70%; incierto, 2.94%.
La vitamina E reduce el estrés oxidativo, el cual es un reconocido mecanismo fisiopatológico en la EHNA226. Varios estudios han mostrado mejoría en la esteatosis e inflamación; sin embargo, otros han arrojado conclusiones contradictorias. Esto posiblemente se debe a que se han utilizadas diferentes dosis y presentaciones; además, la diversidad metodológica y los criterios de inclusión hacen difícil la comparación de resultados en los distintos ensayos.
El mayor de los estudios realizados es el ya referido PIVENS220 en pacientes sin diabetes mellitus y con EHNA confirmada por biopsia; en él se observó una mejoría de esteatosis, inflamación y degeneración balonoide con una dosis de 800UI/día vs placebo (43 y 19%) durante 96semanas; no se observó mejoría en la fibrosis.
En niños, el estudio TONIC216 utilizó una dosis de 800UI/día vs placebo, sin efecto en nivel de aminotransferasas, esteatosis o inflamación, solo mejoría en la balonización.
Una preocupación que surge con el uso prolongado de vitaminaE proviene de un metaanálisis que relaciona un aumento de la mortalidad por cualquier causa con una dosis >400UI220; sin embargo, otros estudios no lo han confirmado227. Otro estudio controlado aleatorizado evidenció un incremento en el riesgo de cáncer de próstata en sujetos sanos (1.6 por 1,000 personas-año)228 y de evento cerebrovascular hemorrágico229. Se puede resumir que el uso de vitaminaE está asociado a una disminución en los niveles de aminotransferasas en sujetos con EHNA, y sus efectos a largo plazo como prevención de cirrosis y sobrevida aún no han sido evaluados.
48. El ácido ursodesoxicólico, la metformina y los ácidos grasos omega-3 no se recomiendan para el tratamiento en EHNA.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 85.29%; parcialmente de acuerdo, 5.88%; incierto, 5.88%; parcialmente en desacuerdo, 2.94%.
El ácido ursodesoxicólico ha sido investigado como tratamiento para la EHGNA en diversos estudios230-234. Un estudio piloto con 40 pacientes demostró un beneficio potencial; sin embargo, estudios posteriores controlados, aleatorizados y prospectivos no lo han confirmado.
La metformina235-237 reduce los niveles de glucosa en sangre, disminuye la gluconeogénesis hepática, aumenta la captación de glucosa en el músculo y la oxidación de ácidos grasos en el tejido adiposo. Sin embargo, los estudios con metformina realizados en pacientes con EHNA no han arrojado resultados favorables. Un metaanálisis con tres ensayos aleatorizados controlados con placebo no mostró mejoría en aminotransferasas o histología hepática en un periodo de 6-12meses, independientemente de la presencia de diabetes mellitus.
Los ácidos grasos omega-3 se han estudiado en modelos animales y humanos238-244. Inicialmente se encontró evidencia que sugería que reducían la grasa hepática; sin embargo, dos ensayos clínicos controlados no demostraron evidencia suficiente para documentar el beneficio con su uso en EHGNA o EHNA.
Tratamiento IICoordinador: Dr. Ignacio García Juárez
Participantes: Dra. Rosalba Moreno Alcantar, Dra. Judith Flores Calderón, Dr. Gonzalo Torres Villalobos, Dr. Aldo Torre Delgadillo
49. Algunos fármacos emergentes, como ácido obeticólico, cenicriviroc, elafibranor, liraglutide y selonsertib, se encuentran actualmente en investigación y han mostrado resultados favorables en inflamación y fibrosis. En un futuro pueden ser una opción de tratamiento en pacientes seleccionados.
Nivel de la evidencia y fuerza de la recomendación: GRADE B1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 82.35%; parcialmente de acuerdo, 14.70% incierto, 2.94%.
La patogénesis de la EHGNA es compleja y con múltiples vías metabólicas. Es por eso que a la fecha no ha sido posible establecer un tratamiento estándar para esta enfermedad245. Hasta ahora la mayoría de las intervenciones para EHGNA se han enfocado en controlar las comorbilidades metabólicas asociadas246. Uno de los principales problemas es la larga duración para que los desenlaces clínicos sean visibles, razón por la cual los cambios a corto plazo en la histología han sido aceptados como una alternativa para evaluar la respuesta terapéutica247. Estos incluyen la resolución de la esteatohepatitis, la disminución en la actividad de la enfermedad y/o la mejora en el estadio de la fibrosis14,245,247. Por lo anterior se recomienda que los tratamientos farmacológicos se limiten a pacientes con una enfermedad hepática progresiva, es decir, esteatohepatitis y/o fibrosis246.
En el grupo de los agonistas del receptor farnesoideX (FXR) tenemos al ácido obeticólico (OCA), el cual es un derivado semisintético del ácido quenodeoxicólico (un potente activador de FXR)14,245,247,248.
En el estudio FLINT (fase2) se comparó OCA a dosis de 25mg/día con placebo en pacientes con EHNA sin cirrosis por 72semanas249. El desenlace primario fue la mejoría histológica, sin empeorar la fibrosis desde la medición basal al final de tratamiento249. Un análisis interino planificado demostró que el OCA fue superior a placebo (p=0.0024), por lo que no se realizaron biopsias al final de tratamiento y se cumplió el criterio para la finalización temprana del tratamiento en 64 pacientes247. La mejoría histológica se obtuvo en el 45% (n=50/110) vs el 21% (n=23/109) en los que recibieron placebo (RR1.9; IC95%: 1.3-2.8; p=0.0002). El efecto adverso más significativo fue prurito en el 23% (n=33/141) con el OCA vs el 6% (n=9/142) en placebo249. Otro efecto a considerar es un incremento en la LDL y una baja en la HDL, hallazgos que aún no se han asociado a un significado clínico. Actualmente, dos estudios: REGENERATE (NCT02548351) y REVERSE (NCT03439254) (fase3) buscan la mejoría en fibrosis en por lo menos un estadio250,251.
Elafibranor (GFT-505) es un agonista del receptor de peroxisoma-proliferador-activador alfa y delta (PPARαδ) que mejora la sensibilidad a la insulina, la homeostasis de glucosa y el metabolismo de lípidos, además de reducir la inflamación252. En el estudio GOLDEN-505 un total de 276 pacientes con EHNA sin cirrosis fueron asignados a 80 o 120mg de elafibranor o placebo por 52semanas. Se buscó la mejoría en la EHNA, sin empeorar la fibrosis. El desenlace primario se consiguió en el 23% de los pacientes en el grupo de 80mg/día, en el 21% del grupo de 120mg/día y en el 17% del grupo placebo247,252. En un análisis posterior se demostró que la reversión de la EHNA llegó a un desenlace significativo en aquellos con un NAS basal de 4 o más para el grupo de 120mg247,252. En este mismo grupo hubo una reducción significativa en el estadio de fibrosis y una mejoría en las enzimas hepáticas, lípidos, homeostasis de glucosa y marcadores sistémicos de inflamación. Entre los efectos adversos solo hubo un incremento transitorio en la creatinina sérica (4.31±1.19μmol/l; p<0.001)252.
Cenicriviroc (CVR) antagoniza los receptores 2 y 5 de la quimiocinaCC. En modelos animales y estudios fase2 en humanos ha mostrado una interesante actividad antiinflamatoria y antifibrótica247,253,254. En el estudio CENTAUR se incluyeron 289 pacientes con EHNA sin cirrosis y un NAS>4; se administró CVR 150mg/día, cambio de placebo a CVR, o solo placebo. Al primer año se evaluó la mejoría en inflamación sin empeorar la fibrosis, y al segundo se evaluó la resolución completa de la EHNA sin empeorar la fibrosis253. Los resultados finales mostraron mejoría en fibrosis pero no demostraron cambios en la esteatosis o en la degeneración balonoide247.
Otro grupo de fármacos son las drogas antidiabéticas que actúan en el antagonista del receptor de péptido de glucagón tipo1 (GLP-1Ras) como liraglutide (LI)247. Este fármaco se ha estudiado tanto en pacientes diabéticos como en no diabéticos y se ha comparado con intervenciones como ejercicio. Los resultados iniciales mostraron un buen efecto en pacientes con EHNA, con buenos rangos de seguridad y tolerancia254-256. En el estudio Lira-NAFLD255 se utilizó una dosis de 1.2mg/día durante 6meses en 80 pacientes con diabetes mal controlada. En el análisis de 68 pacientes hubo una reducción de la hemoglobina glucosilada (9.8 a 7.3%), una reducción de peso (de 99.5 a 95.9kg), del IMC, de la grasa visceral y de marcadores serológicos. En el caso de la grasa hepática se observó una reducción del 17.3%±10.9 al 11.9%±9.3 (p<0.0001).
Se esperan resultados del estudio CGH-LiNASH (NCT02654665) comparando LI vs cirugía bariátrica257.
Selonsertib (SEL) es un inhibidor de la quinasa-1 que señala la apoptosis (ASK-1), la cual es clave en la activación de la inflamación asociada a estrés247,258. En modelos murinos, al inhibir ASK-1 mejoraron parámetros metabólicos y fibrosis asociados a la EHNA258. En humanos se evaluó el uso de SEL con y sin simtuzumab (anticuerpo monoclonal humanizado que se dirige contra la molécula lisil 2 tipo oxidasa (LOXL2). SEL 18mg por 24semanas redujo en ≥1 el estadio de fibrosis en el 43% de pacientes (n=13/30) y en el 30% en el grupo de 6mg (n=8/27)258. La mejoría se evaluó por biopsia, RM y marcadores serológicos de apoptosis.
50. Medicamentos como silimarina, silibina-fosfatidilcolina, pirfenidona, ademetionina y probióticos, entre otros, han mostrado algunos resultados alentadores en estudios preliminares; sin embargo, por ahora no hay evidencia sólida de su utilidad clínica, por lo que se requieren ensayos clínicos controlados con mejoría histológica que sustente su recomendación.
Nivel de la evidencia y fuerza de la recomendación: GRADE B2, débil a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 79.41%; parcialmente de acuerdo, 14.70% incierto, 5.88%.
La silimarina (SIL) es un extracto flavonoide del cardo mariano que pertenece a la familia Asteraceae/Compositae. Posee cuatro isómeros (silibina, isosilibina, silidianina y silicristina) y se le atribuyen efectos antioxidantes, antiinflamatorios y antifibróticos259. Se ha evaluado como monoterapia y asociada a otros suplementos259,260.
Un estudio multicéntrico evaluó la SIL a dosis de 700mg por 48semanas de tratamiento contra placebo (n=99 pacientes). No hubo una mejoría en el NAS con respecto al grupo placebo, aunque por biopsia se observó una mejoría en el grado de fibrosis en el grupo de SIL (p=0.023)261. Aún se requieren estudios con un número mayor de pacientes. En un metaanálisis que involucró 8 ensayos clínicos controlados (n=587) se observó que la SIL produce un cambio en los valores de transaminasas, pero no se reportó un cambio en fibrosis o mortalidad262.
El estrés oxidativo inducido por los ácidos grasos libres y la resistencia a la insulina son fundamentales para la generación y la perpetuación del daño en EHGNA263, y es por eso que las terapias antioxidantes representan una opción razonable preventiva y terapéutica263-265. El efecto antioxidante del complejo silibina, fosfatidilcolina y ácido alfa lipoico, dada su mejor biodisponibilidad, mejora la tasa de glutatión reducido sobre el oxidado, favorece la función mitocondrial, evita la formación de radicales libres y la activación de mecanismos apoptóticos y fibrogénicos264,266,267. Esto ha sido demostrado en algunos estudios in vitro263, en estudios experimentales263,265 y en ensayos clínicos264,265,268,269 que sugieren que el complejo puede mejorar la histología, los marcadores de fibrosis (TGF-b y MMP-2) y el perfil metabólico266,267,269, sobre todo en pacientes con DM2 e intolerancia a hidratos de carbono. Consideramos que se requieren más ensayos clínicos que confirmen estos resultados270,271.
La pirfenidona (PFD) se ha usado en el tratamiento de la fibrosis pulmonar272, aunque su mecanismo de acción no es claro. Hay algunos reportes de su uso en pacientes con virus de hepatitisC (VHC) con una disminución de la esteatosis en el 61% de los pacientes y una disminución de niveles de IL-6, TGF-β1 y TNF-α. Al igual que los anteriores, se requieren más estudios que confirmen estos hallazgos273.
La S-adenosil metionina es un donador de metilos y es sintetizado de la metionina y ATP por una reacción catalizada por la metionina adenosiltransferasa (MAT)274. En modelos murinos a dosis elevadas no se ha observado el beneficio esperado274,275.
Los probióticos son microorganismos vivos no patogénicos que se han utilizado en algunas enfermedades. Pueden mejorar el sistema microecológico intestinal implicado en la patogénesis de la resistencia a la insulina y la EHGNA276,277. Entre los mecanismos propuestos se encuentra una inhibición de TNF-α y la mejora en la adiponectina, lo que cambiaría la regulación en la glucosa sanguínea, el metabolismo de lípidos, así como una modulación en la microbiota, la permeabilidad intestinal y la respuesta inflamatoria278,279. En un metaanálisis de 7 estudios con una duración de 2 a 7meses de tratamiento se observó una reducción en IMC, en ALT, en AST, en HOMA-IR y en el grado de esteatosis por US, aunque hay que reconocer que existe una gran heterogeneidad entre ellos278. Tienen ventajas que hay que reconocer: bajo costo, amplia disponibilidad y la ausencia de efectos adversos serios278.
51. La cirrosis hepática asociada a la EHGNA es una de las principales indicaciones de trasplante hepático en el mundo.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 94.11%; parcialmente de acuerdo, 2.94%; incierto, 2.94%.
Durante los años ochenta y noventa se consideraba a la EHGNA como una causa poco frecuente de trasplante hepático ortotópico (THO)280; sin embargo, en los últimos años se ha convertido en la causa más común de CHC y la segunda más común para THO14,247,281. Del año 2000 al 2014, los pacientes en lista de espera por EHGNA aumentaron en 410%282. Se estima que para el año 2030 la cirrosis se incrementará en un 168% y la incidencia de CHC en un 137%280,283.
En 2013 la EHNA se convirtió en la segunda etiología más frecuente de THO en Estados Unidos (por encima del alcohol). De 63,061 adultos con THO, el 18.25% (n=8,266) estuvieron asociados a hígado graso284; la incidencia anual se ha estimado en el 14%285. Con los nuevos tratamientos para VHC y las altas tasas de curación se estima que los THO por esta etiología van en decremento280,283, lo que en pocos años convertirá a la EHGNA en la principal indicación para THO.
Los pacientes con THO asociado a EHGNA tienden a ser mayores, con IMC más alto y con más comorbilidades como DM2 e hipertensión280. Esto incrementa la tasa de mortalidad en la lista de espera y obliga a una selección más cuidadosa de casos286.
52. Los factores de riesgo para la recurrencia o la EHGNAde novoen los trasplantados de hígado son semejantes a los que operan antes del trasplante.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 91.17%; parcialmente de acuerdo, 5.88%; incierto, 2.94%.
Entre los factores de riesgo de recurrencia que se encuentran presentes desde el pre-trasplante están la obesidad (hasta el 30% de los candidatos a THO), la edad, la hipertensión arterial (prevalencia 10-15%), la DM2, la enfermedad renal y la arteriopatía periférica, entre otros. Al analizar los factores asociados a la recurrencia de EHGNA en postrasplantados, estos son exactamente los mismos283 (fig. 2).
Otros factores descritos en la recurrencia de la EHGNA son la presencia del alelo PNPLA3 c44G (en el donador [genotipo G]: OR1.62)287 y los inmunosupresores, como los inhibidores de calcineurina, por mayores complicaciones metabólicas283,288. Los esteroides se asocian a mayor resistencia a la insulina, obesidad, hiperlipidemia e hipertensión, y los medicamentos diana de rapamicina en células de mamífero (mTOR) aumentan la resistencia a la insulina y la hipertrigliceridemia283.
En EHNA de novo con progresión de EHGNA a EHNA es poco común. Se produce en el 5 al 8% y se asocia con mayor frecuencia a SMet284.
53. La recurrencia de la EHGNA después del trasplante hepático incrementa el riesgo de desarrollo de fibrosis y cirrosis a 5años.
Nivel de la evidencia y fuerza de la recomendación: GRADE B1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 97.05%; parcialmente de acuerdo, 2.94%.
Los desenlaces posteriores al trasplante generalmente son buenos, similares a otras etiologías a 1, 3 y 5años, con una sobrevida del 88, del 82 y del 77%, respectivamente283. La recurrencia a 5años de la EHGNA no se asocia a mortalidad o pérdida del injerto289. La esteatosis mayor de grado2 (34-66% por biopsia) se puede observar hasta en un 60% de los receptores al segundo año del trasplante. De estos, del 20 al 50% progresan a inflamación, superior a otras indicaciones del trasplante no EHGNA290. La EHNA con fibrosis progresiva con formación de fibrosis septal en puente o cirrosis (METAVIR>2) ocurre en el 5% de los receptores al quinto año del trasplante291,292. Un estudio reciente reportó una mayor incidencia de fibrosis avanzada (>27%), aunque el tamaño de la muestra fue pequeño con sesgo de selección290. Dado el incremento en la prevalencia, la posibilidad de un re-trasplante asociado a esta etiología está presente; sin embargo, la experiencia es limitada289. La sobrevida para re-THO por EHNA a 1 y 5años es del 65 y del 52%, respectivamente.
54. La principal causa de muerte en pacientes trasplantados por EHGNA son las enfermedades cardiovasculares.
Nivel de la evidencia y fuerza de la recomendación: GRADE A1, fuerte a favor del enunciado.
Nivel de acuerdo: totalmente de acuerdo, 100%.
La causa de morbimortalidad en el trasplante hepático no es por complicaciones del injerto; en general, es por complicaciones cardiovasculares.
Después del trasplante pueden ocurrir complicaciones metabólicas como SMet (50%), hipertensión (60-70%) e hiperlipidemia (50-70%)280,283,288. En algunas series se ha reportado un incremento del IMC de 24.8 a 28.1kg/m2 en un lapso de dos años283. Por lo tanto, los pacientes con EHNA tienen un mayor riesgo de desarrollar DM2 postrasplante. La inmunosupresión contribuye al desarrollo de estas alteraciones metabólicas; además, la edad del receptor es un riesgo de aterosclerosis283. Estas alteraciones metabólicas son un factor importante para el desarrollo de complicaciones cardiovasculares. Numerosos estudios demuestran una mayor morbimortalidad después del trasplante a 5años que va del 13.5% hasta el 32%, dependiendo de la serie analizada293-295.
FinanciaciónPara la realización de la votación presencial de este Consenso se contó con el apoyo logístico y el financiamiento del Laboratorio MEDIX.
Conflicto de interesesDr. René Male Velázquez: conferencista e integrante del Advisory Board de Abbvie, MSD, y conferencista de Gileard, asesor de los Laboratorios Bayer, Bristol, Falk y Roche.
Dr. Ramón I. Carmona Sánchez: miembro del consejo asesor de Asofarma, ponente para Mayoly-Spindler, Asofarma y Chinoin.
Dra. María Saraí González Huezo: ponente de Bayer, Janssen, Abbvie, Roche, Falk, Asofarma, Ferring y Gileard.
Dr. Juan Francisco Sánchez Ávila: ha participado en investigaciones para Abbvie Farmacéuticos, Gileard Sciences y Galmed Pharmaceuticals y ponente de Bayer,
Dra. Laura Cisneros Garza: consejero y asesor para Bayer, Abbvie, Roche, Bristol y Falk.
El resto de los participantes no declararon conflicto de intereses.