El uso de los probióticos es común en la práctica clínica. Existe un número significativo de estudios que apoyan la eficacia de los probióticos en algunos trastornos digestivos. Sin embargo, el desconocimiento de la evidencia científica y las diferentes presentaciones y composiciones microbianas de los probióticos disponibles dificultan su prescripción.
ObjetivoProveer al clínico de una revisión consensuada sobre los probióticos y recomendaciones de su uso en gastroenterología.
Material y métodosSe seleccionaron los ensayos clínicos controlados, metaanálisis y revisiones sistemáticas publicados hasta 2015, usando los términos MESH: probiotics, gastrointestinal diseases, humans, adults and children. Se utilizó la metodología Delphi. Diecisiete gastroenterólogos de adultos y 12 de niños elaboraron enunciados los cuales fueron votados hasta obtener acuerdo>70%. Para cada enunciado se evaluó el nivel de evidencia basado en el sistema GRADE.
Resultados y conclusionesSe generaron 11 enunciados sobre conceptos generales de probióticos y 27 enunciados sobre uso de probióticos en enfermedades gastrointestinales tanto en niños como en adultos. El grupo de consenso recomienda el uso de probióticos en las siguientes condiciones clínicas: prevención de la diarrea asociada a antibióticos, tratamiento de la diarrea aguda infecciosa, prevención de infección por Clostridium difficile y enterocolitis necrosante, para disminuir los eventos adversos de la terapia de erradicación del Helicobacter pylori, el alivio de los síntomas del síndrome de intestino irritable, en el estreñimiento funcional del adulto, para inducir y mantener la remisión en pacientes con colitis ulcerosa crónica idiopática y pouchitis, y en la encefalopatía hepática oculta y manifiesta.
Probiotics are frequently prescribed in clinical practice. Their efficacy in treating gastrointestinal disorders is supported by a significant number of clinical trials. However, the correct prescription of these agents is hampered due to a lack of knowledge of the scientific evidence and to the different presentations and microbial compositions of the probiotics that are currently available.
AimTo provide the clinician with a consensus review of probiotics and recommendations for their use in gastroenterology.
Materials and methodsControlled clinical trials, meta-analyses, and systematic reviews published up to 2015 were selected, using the MESH terms: probiotics, gastrointestinal diseases, humans, adults, AND children. The Delphi method was employed. Eighteen gastroenterologists treating adult patients and 14 pediatric gastroenterologists formulated statements that were voted on until agreement>70% was reached. The level of evidence based on the GRADE system was evaluated for each statement.
Results and conclusionsEleven statements on the general concepts of probiotics and 27 statements on the use of probiotics in gastrointestinal diseases in both adults and children were formulated. The consensus group recommends the use of probiotics under the following clinical conditions: the prevention of diarrhea associated with antibiotics, the treatment of acute infectious diarrhea, the prevention of Clostridium difficile infection and necrotizing enterocolitis, the reduction of adverse events from Helicobacter pylori eradication therapy, relief from irritable bowel syndrome symptoms, the treatment of functional constipation in the adult, and the induction and maintenance of remission in patients with ulcerative colitis and pouchitis, and the treatment of covert and overt hepatic encephalopathy.
Los probióticos, considerados como microorganismos vivos que benefician la salud, son usados con frecuencia en la práctica clínica. Existen evidencias consistentes de que el uso de probióticos puede prevenir o ser útil en el tratamiento de diversas enfermedades, particularmente en trastornos gastrointestinales, tanto en adultos como en niños1–3. La mayoría de los gastroenterólogos en México y a nivel mundial recomienda el uso de probióticos. Sin embargo, en la práctica clínica el médico se enfrenta a una amplia variedad de productos comerciales con diferentes presentaciones (cápsulas, tabletas, sobres, ampolletas, alimentos, suplementos, fórmulas lácteas, etc.) con dosis y composiciones microbianas variables que hacen difícil la elección de un probiótico. Aunque se han publicado diversas guías sobre el uso de probióticos1,2,4, estas son poco conocidas por el especialista en México5.
ObjetivoEl propósito del Consenso mexicano sobre probióticos de la Asociación Mexicana de Gastroenterología es el de proveer un documento sobre los conocimientos generales de los probióticos y recomendaciones del uso de estos productos en el tratamiento de enfermedades gastrointestinales en niños y en adultos. Estas recomendaciones están basadas en una extensa revisión de la literatura y en la opinión consensuada de especialistas.
MétodosSe utilizó el proceso Delphi6 para el desarrollo del consenso. Los pasos principales de este proceso fueron los siguientes: a) selección del grupo de consenso; b) identificación de áreas de importancia clínica; c) revisión sistemática de la literatura para identificar la evidencia de apoyo a los enunciados; d) elaboración de enunciados; e) rondas de votación anónima por vía electrónica con discusión y análisis de resultados, corrección y modificación de enunciados.
Se elaboraron 2 grupos de enunciados: los relativos a conceptos generales de los probióticos y los enunciados específicos sobre el uso de probióticos en enfermedades gastrointestinales. Estos últimos incluyeron enunciados relativos al uso de probióticos en gastroenterología en pacientes adultos y en edad pediátrica.
Para los enunciados específicos sobre el uso de probióticos en gastroenterología se realizó una búsqueda exhaustiva en las siguientes bases de datos: The Cochrane Central Register of Controlled Trials (CENTRAL), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, BioMed Central y World Health Organization International Clinical Trials Registry Platform (ICTRP). La estrategia de búsqueda incluyó un filtro validado para la identificación de ensayos clínicos, revisiones sistemáticas y guías de práctica clínica utilizando los siguientes términos MeSH: (“probiotics” [MeSH Terms] OR “probiotics” [All Fields]) AND (“gastrointestinal diseases” [MeSH Terms] OR (“gastrointestinal” [All Fields] AND “diseases” [All Fields]) OR “gastrointestinal diseases” [All Fields]) AND (Randomized Controlled Trial [ptyp] OR systematic [sb]) AND (“humans” [MeSH Terms] AND “adult” [MeSH Terms]) AND Clinical Trial [ptyp] OR Controlled Clinical Trial [ptyp] OR Randomized Controlled Trial [ptyp] OR systematic [sb] OR Meta-Analysis [ptyp] OR Practice Guideline [ptyp]”. Se incluyeron todas aquellas guías de práctica clínica, revisiones sistemáticas y ensayos clínicos que analizaron la administración de probióticos en comparación con placebo o cualquier otro probiótico, para el tratamiento de enfermedades gastrointestinales en población adulta y pediátrica publicados hasta el año 2015. No fueron elegibles aquellos estudios con diseño abierto, cruzado, cuasiexperimental, observacional, narrativos y reporte de casos. Solamente se evaluaron las publicaciones en idioma español e inglés.
Mediante 2 revisores independientes, se llevó a cabo la evaluación del riesgo de sesgo de los estudios incluidos utilizando los criterios de la Colaboración Cochrane para los ensayos clínicos, AMSTAR para las revisiones sistemáticas y AGREE II para las guías de práctica clínica7–9.
El grupo de trabajo formado por MAV, EM, ATA y SH elaboraron los enunciados generales. Dieciocho gastroenterólogos de adultos y 14 gastroenterólogos de niños participaron en la elaboración de los enunciados específicos en gastroenterología. Cada enunciado fue votado en forma anónima mediante un sistema de votación electrónica por todos los miembros del grupo de consenso de acuerdo a las siguientes opciones: totalmente de acuerdo, parcialmente de acuerdo, incierto, parcialmente en desacuerdo y totalmente en desacuerdo. Cada una de estas votaciones se presentaron ante los miembros del grupo de consenso y se analizaron los resultados después de descartar las respuestas indiferentes mediante prueba de ji cuadrada de tendencia para determinar el grado de acuerdo; las rondas se suspendieron cuando existió más del 70% de acuerdo con una significación estadística (p<0.05). Una de las votaciones fue realizada en una reunión presencial.
Por cada enunciado específico, se evaluó el nivel de evidencia (muy alto, alto, moderado o bajo) basado en el sistema GRADE10 el cual contempla: A) limitaciones en el diseño y riesgo de sesgo de los estudios, B) inconsistencia de los resultados basada en la heterogeneidad de los estudios; se consideró substancial cuando fue mayor del 30% (I2>30%), C) ausencia de evidencia directa dependiendo de las intervenciones y desenlaces evaluados en los estudios, D) imprecisión en los resultados analizando los intervalos de confianza de los resultados reportados y E) sesgo de publicación utilizando gráficos de embudo. Para los grados de recomendación se utilizó la palabra «recomendamos» para un grado de recomendación fuerte y «sugerimos» para un grado de recomendación débil.
Posteriormente, utilizando las respuestas del panel Delphi, se generaron las recomendaciones basadas en 4 criterios para determinar su fuerza y dirección: A) balance entre beneficios y riesgos, B) confianza en la magnitud de las estimaciones, C) valores y preferencias de los pacientes y D) uso de recursos y costos2.
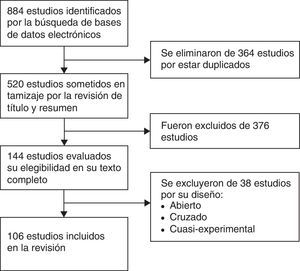
ResultadosEn la figura 1 se presenta un diagrama de flujo con los resultados de la búsqueda en la literatura y el proceso de selección de los estudios. La búsqueda inicial identificó 884 estudios. Se retiraron 364 estudios duplicados y se excluyeron 376 por título y resumen que no cumplían con los criterios de selección. Treinta y ocho estudios fueron eliminados por tratarse de estudios cruzados, abiertos o cuasiexperimentales, quedando un total de 106 estudios para la revisión final.
El grupo de consenso elaboró 10 enunciados sobre conceptos generales de los probióticos y 27 enunciados sobre el uso de probióticos en enfermedades gastrointestinales. En 8 de estos 27 enunciados se analizó la evidencia tanto en adultos como en niños y se presentan como incisos del enunciado principal.
Enunciados generales sobre probióticos1. Los probióticos son microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped.
Acuerdo total: 96.3%; acuerdo parcial: 3.7%.
La definición original de probióticos surgió de una consulta a expertos internacionales convocados por la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO por sus siglas en inglés) y la Organización Mundial de la Salud (OMS) en 200111. Desde entonces ha sido la definición más utilizada a nivel mundial. Recientemente la Asociación Científica Internacional para Prebióticos y Probióticos (ISAPP por sus siglas en inglés)12 publicó un documento de consenso para el uso apropiado del término probiótico en el cual se mantiene la definición propuesta de la FAO/OMS con mínimos cambios gramaticales y esta es la que decidió adoptar el grupo mexicano de consenso sobre probióticos.
Esta definición enfatiza 3 características de los probióticos: la viabilidad de los microorganismos, el número o cantidad de los mismos y los efectos beneficiosos demostrados en la salud del hospedero.
2. Los prebióticos son compuestos no digeribles, fermentables que resultan en la estimulación selectiva del crecimiento y actividad de un número de especies/géneros bacterianos de la microbiota que confieren beneficios para la salud del huésped.
Acuerdo total: 96.3%; acuerdo parcial: 3.7%.
La definición de prebióticos ha cambiado a través del tiempo. Gibson y Roberfroid13 inicialmente propusieron el concepto de «ingrediente alimentario no digerible que beneficia al huésped al estimular selectivamente el crecimiento y/o actividad de uno o un limitado número de especies bacterianas en el colon, y que por lo tanto mejora la salud». En 2004 los autores revisan esta definición y proponen que los prebióticos son «ingredientes que al ser fermentados selectivamente dan lugar a cambios específicos en la composición y/o actividad de la microbiota intestinal confiriendo beneficios tanto para la salud como para el bienestar del individuo». Recientemente la Organización Mundial de Gastroenterología (WGO por sus siglas en inglés)1 ha definido los prebióticos como «sustancias de la dieta (fundamentalmente polisacáridos no amiláceos y oligosacáridos no digeribles por enzimas humanas) que nutren a grupos seleccionados de microorganismos que habitan en el intestino, favoreciendo el crecimiento de bacterias beneficiosas sobre las nocivas». Un prebiótico debe tener 3 características: 1) Ser no digerible, resistente al ácido gástrico y enzimas proteolíticas y no ser absorbido en el tubo digestivo proximal; 2) Ser fermentado por la microbiota intestinal y promotor del crecimiento de bacterias beneficiosas y 3) Ser capaz de producir efectos benéficos para la salud14. Los prebióticos más estudiados y con mayor evidencia científica son la inulina, los fructooligosacáridos, los galactooligosacáridos, la lactulosa y los oligosacáridos de la leche materna14.
Los prebióticos estimulan el incremento del número de bifidobacterias en el colon, aumento de la absorción de calcio y del peso de la materia fecal, reducción del tránsito gastrointestinal y posiblemente, de niveles de lípidos en sangre15.
3. Los simbióticos son productos que contienen probióticos y prebióticos.
Acuerdo total: 96.3%; acuerdo parcial: 3.7%.
El simbiótico al tener en forma combinada probióticos y prebióticos puede actuar modulando la microbiota intestinal16. Tiene como objetivo que al llegar al intestino los probióticos lo hagan acompañados de aquellas sustancias prebióticas, que ayuden a su crecimiento y colonización. Un ejemplo de simbiótico es la leche materna, ya que contiene tanto bacterias lácticas (lactobacilos y bifidobacterias) como fructooligosacáridos y nucleótidos los cuales son nutrimentos que favorecen su desarrollo.
4. La cepa de un probiótico se identifica con el género, especie y la designación alfanumérica. Por ejemplo, Lactobacillus casei (L. casei) DN-114-001.
Acuerdo total: 100%.
Existe un acuerdo en que los probióticos deben denominarse de acuerdo al Código Internacional de Nomenclatura y la clasificación de los organismos procariotas17. La identificación de un probiótico debe incluir:
- 1.
Género: se refiere a un grupo de especies de microorganismos con cualidades similares como características físicas, productos o requerimientos metabólicos
- 2.
Especie: es un grupo de cepas que comparten numerosas propiedades estables
- 3.
Cepa: es una poblacio¿n de microorganismos que descienden de una u¿nica célula o de un aislamiento en cultivo puro
La importancia de conocer la nomenclatura de una cepa probiótica radica en que los beneficios para la salud de los probióticos son específicos para cada especie.
5. Los productos farmacéuticos, alimentos, suplementos, fórmulas infantiles o consorcios bacterianos que definen el contenido microbiano de cepas específicas pueden ser considerados como probióticos. Los alimentos fermentados que no definen el contenido microbiano y el consorcio bacteriano del trasplante de microbiota fecal no son considerados como probióticos.
Acuerdo total: 96.3%; incierto: 3.7%.
La ISAPP12 en el consenso publicado sobre el uso del término probiótico hace las siguientes consideraciones:
Establece que si un alimento cuenta con un nivel de 1×109unidades formadoras de colonias (UFC) por porción de bacterias reconocidas como probióticos, se puede considerar como que «contiene probióticos». En cambio, establece que alimentos y suplementos alimenticos que contienen microbios potencialmente benéficos, que no cubren este requisito, deben considerarse como alimentos que «contienen cultivos de bacterias vivas y activas», pero no deben llamarse probióticos.
El yogur es un producto lácteo fermentado que contiene la suma de Streptococcus thermophilus (S. thermophilus) y Lactobacillus delbrueckii (L. delbrueckii) subespecie bulgaricus. Existe evidencia suficiente del efecto benéfico del yogur para la salud del huésped. Por lo tanto, los yogures son probióticos18.
El consorcio bacteriano del trasplante de microbiota fecal no debe ser considerado como probiótico, ya que incluye un número desconocido de bacterias no clasificadas, hongos, parásitos y virus. Asimismo, no se conocen cuáles son los microorganismos responsables del beneficio terapéutico y los efectos a largo plazo de los mismos se desconocen12.
6. Los mecanismos de acción de los probióticos son múltiples y se han descrito con relación al género, especie y cepa. Los mecanismos de acción generales y comunes en los probióticos son: aumentar la resistencia a la colonización, normalizar la microbiota intestinal alterada, promover la exclusión competitiva de patógenos, aumentar la producción de ácidos grasos de cadena corta, regular el tránsito intestinal e incrementar el recambio de los enterocitos.
Acuerdo total: 92.59%; acuerdo parcial: 7.41%.
Las investigaciones sobre los probióticos sugieren que proporcionan una amplia gama de posibles beneficios a la salud. Sin embargo, los efectos descritos solo se pueden atribuir a la cepa o las cepas estudiadas, y no a la especie o a todo el grupo de bacterias.
En general todos los probióticos afectan al ecosistema intestinal estimulando los mecanismos inmunitarios y no inmunitarios de la mucosa a través de antagonismo y competencia con patógenos potenciales12.
La relación que se mantiene entre intestino, microbiota e inmunidad es muy compleja, y los efectos de los probióticos dentro de este sistema pueden depender de la cepa del probiótico o de la susceptibilidad del mismo individuo12.
7. Los efectos benéficos para la salud del huésped de los probióticos deben haberse demostrado en humanos en ensayos clínicos controlados.
Acuerdo total: 96.3%; acuerdo parcial: 3.7%.
El ensayo clínico controlado (ECC) es el estándar de oro entre los diferentes tipos de estudios de investigación para generar la mejor evidencia científica relativa a una intervención médica por un fármaco, alimento o producto biológico19. Los efectos de cualquiera de estos deben ser ensayados en individuos de la misma especie. Por ello, la eficacia de los probióticos en la salud humana debe investigarse mediante ECC en humanos. Cualquier efecto de los probióticos demostrado en animales no puede extrapolarse al ser humano.
8. Los efectos benéficos demostrados de los probióticos son solo aplicables a la cepa y a la condición clínica específicas evaluadas en los ECC y revisiones sistemáticas y no puede extrapolarse a otras cepas de la misma especie o a diferentes situaciones clínicas.
Acuerdo total: 100%.
Este enunciado enfatiza que las cepas bacterianas de una misma especie de probióticos pueden tener acciones, propiedades, características y efectos terapéuticos significativamente diferentes. Estas cualidades se engloban en el concepto de especificidad de cepa. Asimismo, los desenlaces terapéuticos con el uso de una cepa probiótica son específicos para la entidad clínica en la cual se ha ensayado dicho probiótico. Así por ejemplo: el Lactobacillus plantarum (L. plantarum) cepa 299v20,21 ha mostrado que mejora los síntomas del síndrome de intestino irritable (SII), mientras que L. plantarum MF1298 empeora los síntomas en pacientes con SII22. De la misma manera, Lactobacillus rhamnosus (L. rhamnosus) GG (LGG) es efectivo para prevenir la diarrea asociada a antibióticos (DAA)23 pero no lo es para la prevención de infección urinaria24. El desconocimiento del concepto de especificidad de cepa por el médico o consumidor de probióticos puede ocasionar una interpretación o extrapolación erróneas de la investigación científica y resultar en una mala indicación o ineficacia de un probiótico.
9. Los efectos benéficos de una cepa probiótica observados en un grupo de población específico (por ejemplo, población pediátrica) no pueden extrapolarse a otros grupos poblacionales (población adulta) o condiciones fisiológicas (embarazo).
Acuerdo total: 100%.
Los efectos sobre la salud deben documentarse considerando la cepa específica que se administra en un producto. Las diferentes cepas probióticas que se han usado deben contar con evidencias de efectos clínicos en por lo menos un ensayo clínico bien diseñado y con poder estadístico suficiente, que avale que la administración oral de una cepa probiótica específica es eficaz y benéfica para la salud o como tratamiento de alguna enfermedad. Por ello, no se pueden extrapolar los resultados de efectos benéficos de población adulta a pediátrica o viceversa o a mujeres embarazadas25.
10. En general, los probióticos son seguros y no representan riesgos para la salud.
Acuerdo total: 88.89%; acuerdo parcial: 11.11%.
Los probióticos que se han ensayado en ECC han sido bien tolerados en humanos y solo se han reportado algunos efectos adversos menores como: cólico abdominal y flatulencia, entre otros. Los microorganismos que no se han ensayado en ECC no deben recibir el apelativo de probiótico y no hay evidencia sobre su seguridad.
En la literatura existen reportes de bacteriemia y fungemia asociadas al uso de probióticos en neonatos y en pacientes con inmunodeficiencias. Asimismo la presencia de un catéter central se considera un factor de riesgo para la translocación del probiótico a la sangre. Sin embargo los reportes son escasos26.
Enunciados específicos en enfermedades digestivasDiarrea asociada a antibióticosLa DAA se define como la aparición de diarrea inexplicable asociada temporalmente al uso de antibióticos. Puede ocurrir tempranamente a los 2-7 días del inicio del antibiótico o tardíamente, de 2-8 semanas después. Es una entidad frecuente en el paciente ambulatorio y hospitalizado con una prevalencia estimada del 5-30% en población pediátrica27 y del 5-70% en adultos28. El espectro clínico de la DAA puede variar de una diarrea leve a una colitis grave.
En adultos11. La administración de cepas específicas de probióticos reduce significativamente el riesgo de DAA.
Acuerdo total: 100%.
En la revisión sistemática y metaanálisis de Hempel et al.29 se incluyeron 52 de 82 ECC, con 11,811 pacientes. Los probióticos primariamente usados fueron Lactobacillus solos o combinados con otros géneros como Bifidobacterias, Saccharomyces boulardii (S. boulardii) CNCM I-745 (cerevisiae) o Saccharomyces Hansen CBS 5926 como probiótico único y cepas de Streptococcus, Enterococcus y/o Bacillus. El riesgo relativo acumulado de los ECC en los cuales se precisó el número de pacientes mostró una asociación estadísticamente significativa de la administración de probióticos con la reducción de la DAA (RR=0.58; IC 95%: 0.50-0.68; p=0.001; I2=54%) con un número necesario a tratar (NNT)=13. Cuarenta y tres EEC reportaron la definición y desenlaces de la diarrea con resultados a favor del uso de probióticos (RR=0.56; IC 95%: 0.47-0.68; p=0.001; I2=57%) y un NNT=10. La metarregresión de los ECC del efecto de probióticos entre niños hasta 17 años, adultos hasta 65 años y adultos mayores de 65 años no mostraron diferencias significativas.
En el metaanálisis de Videlock y Cremonini23, se evaluaron 34 ECC con 2,921 participantes, del uso de probióticos en DAA, 24 en adultos y 10 en población pediátrica. Los resultados acumulados de los estudios en niños y en adultos mostraron un efecto a favor del uso de probióticos (RR=0.53; IC 95%: 0.43-0.66; p=0.0001; I2=44%) y un NNT=8. Los lactobacilos fueron las especies probióticas más usadas en 24 estudios, 8 de los cuales evaluaron el efecto de Lactobacillus GG. S. boulardii fue evaluado en 7 estudios y en 10 estudios se usaron bifidobacterias en combinación. Este metaanálisis en particular muestra el efecto preventivo del probiótico añadido como suplemento en la incidencia de DAA, siendo relativamente consistente en las diferentes especies y cepas probióticas utilizadas en diversos regímenes de antibióticos.
El metaanálisis de Sazawal et al.30 incluyó 34 ECC que evaluaron la eficacia de los probióticos en diarrea aguda, 19 de estos en DAA, de los cuales 13 fueron en adultos. Los resultados mostraron una reducción significativa de la DAA con el uso de probióticos en un 52% (RR=0.48; IC 95%: 0.35-0.65; I2=53%).
Las guías de la WGO del 20111 otorgan un nivel de evidencia 1b a distintas cepas probióticas para la prevención de DAA que incluyen Enterococcus faecium LAB SF 68, S. boulardii cepa de cerevisiae (CNCM I-745), LGG, L. casei DN 114-001 en fermento lácteo, Bacillus clausii O/C, N/R, T y SIN y Lactobacillus acidophilus (L. acidophilus) CL 1285+L. casei LBC 80R.
En niños11a. En niños, los probióticos son eficaces y seguros para la prevención de la DAA.
Acuerdo total: 100%.
El metaanálisis de Szajewska et al.31 evaluó 6 estudios controlados aleatorizados en 766 niños. Los autores concluyeron que el tratamiento con probióticos comparado con placebo redujo el riesgo de DAA del 28.5% al 11.9% (RR=0.44; IC 95%: 0.25-0.77; p=0.004; I2=69.9%). El análisis de un subgrupo mostró que la reducción del riesgo de DAA estuvo asociado al uso de S. boulardii y LGG.
Johnston et al.32, en un metaanálisis de 15 estudios controlados aleatorizados que incluyeron 2,874 niños, mostraron que la incidencia de DAA en el grupo de niños tratado con probióticos fue del 9% comparado con el 18% en el grupo control (RR=0.52; IC 95%: 0.38-0.72; I2=56%). Estos estudios incluyeron tratamiento con Bacillus spp., Bifidobacterium spp., Lactobacilli spp., Lactococcus spp., Leuconostoc cremoris, Saccharomyces spp., Streptococcus spp., ya sea solos o en combinación.
En el metaanálisis de Videlock y Cremonini23 los 10 ECC evaluados en edad pediátrica mostraron una menor incidencia de DAA en el grupo tratado con probióticos con un RR=0.48 (IC 95%: 0.35-0.65; p<0.000; I2=36%), similar al observado en los estudios en adultos. Los probióticos utilizados fueron LGG, L. acidophilus, L. casei, S. boulardii, Lactobacillus reuteri (L. reuteri), Bifidobacterium lactis (B. lactis), S. termophilus entre otros, solos o en combinación.
Diarrea aguda infecciosaLa diarrea es definida por la OMS como la presencia de 3 o más evacuaciones sueltas o líquidas e incremento en el número de evacuaciones en un período de 24h. Se considera diarrea aguda si la duración es menor de 14 días.
La diarrea aguda continúa siendo un problema de salud pública mundial especialmente en los países en desarrollo. La etiología más común es la infecciosa por diferentes microorganismos. La mayoría de los episodios son autolimitados y no requieren de la investigación del agente causal. La complicación más frecuente es la deshidratación y el manejo inicial está orientado a mejorar y mantener la hidratación. Sin embargo la rehidratación oral no reduce el volumen de las evacuaciones y no acorta la duración de los episodios de diarrea33. Por ello diversas modalidades de tratamiento se han empleado asociadas a la rehidratación oral o intravenosa y una de ellas incluye a los probióticos34,35.
En adultos12. Los probióticos reducen la duración y el número de evacuaciones en la diarrea aguda infecciosa.
Acuerdo total: 93.75%; acuerdo parcial: 6.25%.
En la revisión sistemática de Cochrane de Allen et al.36 sobre probióticos en diarrea aguda infecciosa se evaluaron 63 estudios, 56 en niños y 7 en adultos con un total de 8,014 participantes. El efecto de los probióticos en adultos con diarrea infecciosa no pudo ser evaluado por los autores debido a la heterogeneidad en la definición de desenlaces y en la duración de la diarrea. Los resultados globales y en el paciente pediátrico se comentan más adelante.
En el metaanálisis de Sazawal et al.30 se evaluaron 21 estudios hechos en pacientes adultos para medir el efecto de los probióticos en la prevención de diarrea aguda. Los autores concluyeron que los probióticos reducen el riesgo de diarrea aguda en esta población en un 26% (RR=0.74; IC 95%: 0.59-0.93; p=0.011; I2=42%). Este resultado incluye los estudios en diarrea aguda infecciosa, del viajero y DAA. No se observó diferencia significativa entre las cepas utilizadas que incluyeron S. boulardii, Lactobacillus GG, L. acidophilus, Lactobacillus bulgaricus (L. bulgaricus) solas o en combinación con 2 o más cepas. Solo 2 estudios evaluaron el efecto en diarrea aguda infecciosa en adultos, uno en diarrea por Escherichia coli (E. coli) en 48 adultos tratados con L. acidophilus combinado con L. bulgaricus en gránulos, con una reducción cercana al 30% sin significación estadística con p=0.275; y un segundo estudio en la comunidad en 502 adultos tratados con L. casei en yogur, del cual no se tienen datos. Los autores estimaron en este metaanálisis que el NNT fue de 4.
En niños12a. S. boulardii así como Lactobacillus GG, L. casei, L. acidophilus, L. bulgaricus, Bifidobacterium longum (B. longum), solos o en combinación reducen la duración de la diarrea aguda aproximadamente un día y disminuyen la frecuencia de las evacuaciones al segundo día de su consumo.
Acuerdo total: 83.33%; acuerdo parcial: 8.33%; desacuerdo total: 8.33%.
El metaanálisis de Szajewska et al.37 incluyó 5 ECC en 619 niños sanos entre 2 meses y 12 años los cuales recibieron S. boulardii en dosis de 250-750mg diarios durante 5-6 días. Los resultados mostraron una reducción de la diarrea de 1.1 días en 4 estudios (diferencia media estándar [DME]=−1.1; IC 95%: −1.3 a −0.83; p=0.000; I2=0%) y en otro se reportó una disminución en el riesgo de la duración de diarrea por más de 7 días. En los estudios no se precisó si se incluyeron pacientes hospitalizados, ambulatorios o ambos.
En la revisión sistemática Cochrane de Allen et al.36 se incluyeron 63 estudios de los cuales 56 correspondieron a 6,489 pacientes pediátricos. Cuarenta y seis estudios evaluaron solo un organismo y 17 evaluaron combinaciones de 2 a 8 organismos. El L. casei GG fue el más evaluado (13 estudios) seguido del S. boulardii (10 estudios). Se reporta una amplia variación en dosis y duración de los tratamientos. Quince estudios utilizaron dosis altas de organismos (≥109UFC/día) y 26 estudios usaron dosis bajas (≤1010UFC/día). Los resultados mostraron que los probióticos redujeron el promedio de la duración de la diarrea a 24.76h (IC 95%: −33.61 a −15.91; p<0.000; I2=97%), así como la frecuencia de evacuaciones al día 2 (DME: −0.80; IC 95%: −1.14 a −0.45; p<0.000; I2=71%).
L. casei GG y S. boulardii en forma aislada así como la combinación de L. delbrueckii, L. acidophilus, S. thermophilus, Bacillus bifidum y S. boulardii o la combinación de L. acidophilus, L. rhamnosus, B. longum y S. boulardii fueron los probióticos que redujeron significativamente la duración de la diarrea.
En la revisión sistemática de Applegate et al.38 se evaluaron 8 ECC en los cuales se utilizaron diversas combinaciones de probióticos: a) L. bulgaricus con S. thermophilus; b) L. acidophilus, L. bulgaricus, S. thermophilus y Bifidobacterium bifidum (B. bifidum); c) L. acidophilus y Bifidobacterium infantis (B. infantis); d) Lactobacillus GG, L. acidophilus, L. casei, L. plantarum y B. infantis. Las cepas de Lactobacillus GG, S. boulardii, L. acidophilus, Bacillus clausii y Enterococcus faecium se usaron en forma individual. Los resultados mostraron que algunas de las combinaciones de probióticos y Lactobacillus GG mostraron una reducción en la duración promedio de la diarrea en un 14% (IC 95%: −24.2 a −3.8%; p=0.73; I2=0%) y la frecuencia de evacuaciones al día 2 de tratamiento en un 13.1% (IC 95%: −25.3 a −0.8%; p=0.73; I2=0%).
En 2014 se publicó una revisión por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición (ESPGHAN por sus siglas en inglés)39 sobre el uso de probióticos en gastroenteritis aguda, en la que se establece que los probióticos logran reducir la duración de la diarrea en aproximadamente un día. La eficacia y seguridad de los probióticos depende de la cepa y de la dosis a la que se administren. Los probióticos con mayor nivel de evidencia y mayor grado de recomendación son Lactobacillus GG y S. boulardii. Con menor grado de recomendación por evidencia escasa son L. reuteri DSM 17938 y L. acidophilus LB. El resto de los probióticos no pueden ser recomendados.
12b. La administración preventiva de Lactobacillus GG, S. boulardii, L. acidophilus, L. bulgaricus y Bifidobacterium solos o combinados a niños hospitalizados disminuye la incidencia de diarrea aguda hospitalaria de diversa etiología incluyendo rotavirus.
Acuerdo total: 91.67%; incierto: 8.33%.
En el metaanálisis de Sazawal et al.30 se incluyeron 34 ensayos clínicos aleatorizados, 12 de ellos realizados en niños hospitalizados. Los resultados mostraron que la administración de S. boulardii, LGG, L. acidophilus, L. bulgaricus y Bifidobacterium solos o combinados disminuye la incidencia de diarrea aguda de diversa etiología en comparación con el grupo control (RR=0.43; IC 95%: 0.29-0.65; p<0.001; I2=65%).
Wanke40 evaluó 6 ECC en 1,343 niños hospitalizados. El autor demostró que la administración de LGG disminuye la incidencia de diarrea hospitalaria aguda incluyendo la de etiología por rotavirus al compararse con el grupo control (RR=0.37; IC 95%: 0.23-0.59; p<0.000; I2=21%).
Diarrea del viajeroLa diarrea aguda es un problema de salud entre los viajeros. La incidencia estimada es del 10-40% dependiendo del destino del viaje41. El uso de probióticos en la prevención de la diarrea del viajero es aún controversial.
En adultos13. La evidencia es insuficiente para recomendar el uso de probióticos en la prevención de la diarrea del viajero.
Acuerdo total: 100%.
Un revisión sistemática42 que evaluó 12 estudios aleatorizados, controlados y cegados mostró que en 6 de estos los probióticos previnieron la diarrea del viajero, uno indicó una tendencia a favor del uso de probióticos y 5 estudios no mostraron diferencia significativa entre el grupo tratado con probióticos y los controles. Cuando se analizaron los 12 estudios en conjunto, se observó un efecto benéfico a favor del uso de probióticos (RR=0.85; IC 95%: 0.79-0.91; p<0.001). S. boulardii y combinaciones como la mezcla de L. acidophilus y B. bifidum fueron las cepas de probióticos con eficacia para la prevención de la diarrea del viajero. Los resultados contradictorios de los ensayos clínicos pueden deberse a diferencias en la población y destinos estudiados, tipo de probiótico, dosis y duración del tratamiento. Se requiere de una mayor investigación con control de estas variables para conocer el papel de los probióticos en la prevención de la diarrea del viajero.
En niños13a. La evidencia para el empleo de probio¿ticos en el tratamiento de diarrea persistente y diarrea del viajero en niños es limitada.
Acuerdo total: 100%.
La revisión sistemática de Bernaola Aponte et al.43 que incluyeron 4 ensayos clínicos con un total 464 pacientes, mostró que los datos no son suficientes para llegar a una conclusión sobre el uso de probióticos en diarrea persistente. En las revisiones sistemáticas actuales no se mencionan estudios que puedan apoyar el uso de probióticos en diarrea del viajero en niños36,38,39.
Infección por Clostridium difficileLa infección por Clostridium difficile (ICD) ha sido reconocida como la causa más común de diarrea asociada a los cuidados de la salud. La incidencia de ICD se ha incrementado significativamente a partir del año 2000 y con mayor morbimortalidad. La edad avanzada, la hospitalización, el uso de antibióticos, la inmunosupresión, la cirugía gastrointestinal y el uso de inhibidores de bomba de protones son los principales factores de riesgo para el desarrollo de ICD44. Los probióticos han sido evaluados para el tratamiento y la prevención de la ICD.
En adultos14. No hay evidencia de que los probióticos sean útiles en el tratamiento de la ICD
Acuerdo total: 81.25%; acuerdo parcial: 18.75%.
Una revisión sistemática reciente45 incluyó 4 estudios que examinaron el uso de probióticos combinados con antibióticos, 3 con S. boulardii y uno con L. plantarum, para el tratamiento de un episodio inicial o recurrencia de ICD en adultos. Los estudios incluyeron muestras pequeñas y con algunos problemas metodológicos. Solo uno de los trabajos con S. boulardii mostró diferencia significativa a favor de este probiótico, el cual disminuyó la duración de la diarrea (RR=1.33; IC 95%: 1.02-1.74) y la recidiva de la misma tras suspender el tratamiento (RR=0.59; IC 95%: 0.35-0.98).
Los otros 3 estudios no demostraron superioridad de la combinación de probióticos con antibiótico versus antibiótico solo en términos de duración o intensidad de diarrea, recurrencia, curación por análisis de toxina fecal, o eventos adversos.
15. Algunas cepas probióticas son útiles en la prevención de la recurrencia de ICD.
Acuerdo total: 87.50%; acuerdo parcial: 12.50%.
Se han publicado varias revisiones sistemáticas y metaanálisis en los últimos años que evaluaron el papel de los probióticos en la prevención primaria23,32,45–47 y secundaria de ICD45,48,49. La primera incluyó 11 estudios en adultos que recibieron probiótico o placebo y cuyo desenlace primario fue prevención primaria de ICD. Los resultados mostraron que S. boulardii (4 estudios) y la combinación de L. acidophilus, L. casei y L. rhamnosus (3 estudios) tuvo un efecto a favor de los probióticos (RR=0.39; IC 95%: 0.19-0.179; p<0.05; I2=44%). Un subanálisis mostró que la combinación de lactobacilos se asoció con un riesgo de infección significativamente menor que con placebo, y que S. boulardii también tuvo un efecto protector, aunque no significativo47. El metaanálisis de Johnston et al.32, a diferencia del de Johnson et al.47, incluyó también población pediátrica y algunos trabajos publicados en resumen, y encontraron reducciones significativas del riesgo de ICD tanto con S. boulardii como con la combinación de L. acidophilus, L. casei y L. rhamnosus, pero no con LGG.
Tres revisiones sistemáticas y metaanálisis han evaluado el uso de probióticos en ICD recurrente45,48,49. Pillai y Nelson45 demostraron que la administración de S. boulardii se asoció a menor recurrencia de ICD (RR=0.59; IC 95%: 0.35-0.98). O’Horo et al.49 incluyeron 8 ensayos clínicos, 4 con S. boulardii, 3 con Lactobacillus spp., y uno con cepa no toxigénica de Clostridium difficile (C. difficile). La mejor evidencia se obtuvo con S. boulardii, que mostró beneficio en 2 de 4 estudios, aunque en uno de ellos no se controló para uso de antibióticos previos, y el segundo observó beneficio solo cuando se asoció a uso de vancomicina. La evidencia con Lactobacillus spp. y C. difficile no toxigénica proviene de series y reportes de casos respectivamente. En la revisión y metaanálisis publicada por Evans y Johnson48, se incluyeron 4 estudios controlados aleatorizados: el primero de ellos mostró que la combinación de antibióticos y S. boulardii fue más efectiva para prevenir un segundo episodio de ICD al comparar con solamente el uso de antibióticos (RR=0.43; IC 95%: 0.20-0.97), el segundo estudio controló tipo y dosis de antibiótico, y no mostró beneficio al agregar S. boulardii, aunque un subanálisis reportó beneficio al combinarse con dosis altas de vancomicina. El cuarto trabajo sorteó L. plantarum 299v por 38 días o placebo al tratamiento con metronidazol por C. difficile recurrente, y el grado de recurrencia fue menor con el probiótico (36 vs. 67%), aunque la diferencia no fue estadísticamente significativa.
En niños15a. El empleo preventivo de probio¿ticos disminuye la incidencia de diarrea asociada a C. difficile por antibióticos.
Acuerdo total: 100%.
El metaanálisis de Johnston et al.50 incluyó 20 ensayos clínicos realizados en 3,810 pacientes tratados con antibióticos, de los cuales 636 eran niños. Se administró L. acidophilus, L. casei, L. rhamnosus, S. boulardi y otros probióticos solos y combinados, se investigó la ocurrencia de diarrea asociada a ICD, demostrando que la incidencia de esta complicación fue menor en el grupo tratado con probióticos (RR=0.4; IC 95%: 0.17-0.96) con relación al grupo control.
En la revisión de Goldenberg et al.46 se incluyeron 4,213 pacientes niños y adultos tratados con antibióticos, se administró L. acidophilus, L. casei, L. rhamnosus solos o combinados. Se investigó la presencia de diarrea asociada a infección por C. difficile, demostrando que la incidencia de diarrea asociada a C. difficile fue menor en el grupo tratado con probióticos (RR=0.36; IC 95%: 0.26-0.51; I2=0%). El análisis de subgrupos demostró que la eficacia de prevención se mantuvo al comparar niños y adultos.
Infección por Helicobacter pyloriSe ha estimado que la infección por Helicobacter pylori (H. pylori) afecta aproximadamente a la mitad de la población mundial51. Diversas condiciones se han asociado a la infección por H. pylori e incluyen úlcera péptica, MALToma y carcinoma gástrico52. Por ello, la erradicación de H. pylori es necesaria en estas condiciones y requiere del uso de antibióticos con esquemas triple, secuencial o cuádruple. Sin embargo, debido a la resistencia a los antibióticos, la falta de apego y los eventos adversos asociados al tratamiento, las fallas en los esquemas de erradicación pueden ser frecuentes. Por ello, se ha propuesto el uso de probióticos como terapia suplementaria al uso de antibióticos para mejorar las tasas de erradicación de la infección y disminuir los efectos colaterales del tratamiento.
En adultos16. Existe evidencia limitada de que la terapia suplementaria con cepas probióticas específicas pueden incrementar las tasas de erradicación de H. pylori.
Acuerdo total: 93.75%; acuerdo parcial: 6.25%.
Se analizaron 6 metaanálisis que evaluaron el efecto de los probióticos combinados con antibióticos en la tasa de erradicación de la infección por H. pylori. Los resultados mostraron aumento en las tasas de erradicación en el análisis con intención de tratar (RR=1.122; IC 95%: 1.086-1.159 a RR=2.066; IC 95%: 1.3-3) Sin embargo, estos resultados se aplican a cepas específicas de lactobacilos53–56, de S. boulardii57 y bifidobacterias53. La mayoría de los estudios que se incluyeron en los metaanálisis son asiáticos, italianos y del medio oriente, pocos del resto de Europa y solo un argentino y un brasileño. No hay estudios publicados en población mexicana. Dang et al.53 hacen una consideración interesante al señalar que sus resultados sugieren que el suplemento con probióticos es solamente útil cuando la terapia con antibióticos es menos efectiva (rangos de erradicación<80%).
17. Los probióticos son útiles en la prevención y reducción de los eventos adversos gastrointestinales asociados a la terapia de erradicación del H. pylori y mejoran el apego al tratamiento.
Acuerdo total: 87.50%; acuerdo parcial: 6.25%; incierto: 6.25%.
Una de las principales desventajas de la terapia de erradicación para el H. pylori es la presencia de efectos adversos (diarrea, náuseas, vómito, dolor en epigastrio y disgeusia), que pueden presentarse en un 5-30%57, y que pueden contribuir a un mal apego al tratamiento y por lo tanto a menores rangos de erradicación.
Se identificaron 6 metaanálisis que analizaron, además de la erradicación, el efecto de los probióticos en la prevención y reducción de los efectos adversos. Aparentemente, algunos tienen conclusiones opuestas; Zheng et al.55 y Zou et al.56 reportan que no encuentran reducciones significativas de los efectos colaterales en general. Sin embargo, la reducción de los eventos colaterales es del 30.84% (IC 95%: 24.82-36.86%) y del 42.24% (IC 95%: 35.89-48.59%) con placebo y probióticos, respectivamente (RM: 0.49; IC 95%: 0.24-1.02; p=0.06; I2=62%). El grupo tratado con lactobacilos tuvo menos diarrea, meteorismo y alteraciones del gusto. Zhu et al.58 y Szajewska et al.57 también encontraron que la diarrea es el efecto adverso que menos se presenta con el uso de probióticos (RM: 0.21; IC 95%: 0.06-0.74; p=0.000; I2=91%)6. Por otro lado, Wang et al.54 reportaron que la incidencia de efectos colaterales fue significativamente menor en el grupo tratado con probióticos (RM: 0.30; IC 95%: 0.12-0.79; p=0.000; I2=72%). Dang et al.53 incluyeron en su metaanálisis 20 estudios que evaluaron los efectos adversos del tratamiento de erradicación. Sus resultados mostraron que los probióticos tienen tendencia a reducir la incidencia general de efectos colaterales (RR=0.735; IC 95%: 0.598-0.902). No se encontraron metaanálisis o revisiones sistemáticas que proporcionen evidencia para sustentar que los probióticos mejoran el apego al tratamiento de erradicación.
En niños17a. Existe evidencia limitada acerca del uso de probio¿ticos para incrementar las tasas de erradicacio¿n de H. pylori.
Acuerdo total: 100%.
Li et al.59, en un metaanálisis de 7 ensayos clínicos aleatorizados que incluyeron 508 pacientes pediátricos encontraron que la suplementación con probióticos de la terapia triple de erradicación de H. pylori tiene beneficios, principalmente sobre los efectos adversos de los antibióticos, como es la diarrea (RR=1.96; IC 95%: 1.28-3.02).
En la revisión sistemática y metaanálisis de Szajewska et al.60 que evaluaron 11 ensayos clínicos, se concluye que agregar S. boulardii a la terapia de erradicación de H. pylori incrementa marginalmente la tasa de erradicación, sin embargo disminuye los efectos adversos secundarios al esquema triple de erradicación.
Dispepsia funcionalLa dispepsia funcional (DF) es un trastorno funcional digestivo que afecta al 11-29% de la población mundial61. Es definida, de acuerdo a Roma III, como llenura posprandial, saciedad temprana, dolor y ardor epigástrico en ausencia de enfermedad orgánica que explique los síntomas. El tratamiento incluye el uso de inhibidores de bomba de protones, procinéticos, moduladores del dolor visceral y medicina alternativa y complementaria62. Los probióticos han sido usados en el manejo del dolor abdominal asociado a este trastorno en población pediátrica.
18. El uso de probio¿ticos no ha demostrado ser de utilidad en niños con DF o dolor abdominal funcional (DAF)
Acuerdo total: 100%.
En la revisión sistemática de Korterink et al.63, que evaluaron 5 ECC en niños y adolescentes con dolor abdominal asociado a SII, DF y DAF, solamente se encontró un efecto benéfico de los probióticos en el dolor abdominal asociado a SII. Horvath et al.64 en un metaanálisis evaluaron 3 ECC en 290 niños con trastornos funcionales digestivos (SII, DAF y DF) según criterios de Roma II. Dos de estos ECC fueron realizados en 103 pacientes con DAF y uno en 20 pacientes con DF. Los resultados mostraron que los suplementos con LGG no mejoraron el dolor abdominal en niños con DAF y DF (RR=1.08, IC 95%: 0.77-1.50, p<0.05, I2=57%; y RR=0.83, IC 95%: 0.37-1.85, p<0.05, I2=35%, respectivamente).
Síndrome de intestino irritableEl SII es un trastorno funcional digestivo frecuente de fisiopatología compleja y con manifestaciones clínicas de difícil control. En su manejo se han utilizado diversos tipos de fármacos con respuestas variables e incluyen antiespasmódicos, antidiarreicos, fibra dietética, antagonistas 5HT3, agonistas 5HT4, agonistas de guanilatociclasa 2 y de canales de cloro tipo 2, y antidepresivos, entre otros65. Existen evidencias de que las alteraciones en la composición microbiana de la microbiota intestinal pueden desempeñar un papel importante en la fisiopatología del SII66. Por ello se ha propuesto el uso de antibióticos y probióticos en el manejo del mencionado síndrome.
En adultos19. La administración de probióticos específicos mejora la percepción global de síntomas en pacientes con SII.
Acuerdo total: 100%.
Se identificaron 6 revisiones sistemáticas y metaanálisis que evaluaron el efecto de los probióticos en el SII. Ford et al.67 hicieron la revisión más completa e incluyeron en su análisis 35 ECC que evaluaron la eficacia de los probióticos versus placebo en 3,452 pacientes con SII. La persistencia de síntomas o la ausencia de mejoría sintomática como desenlaces primarios fueron investigadas en 23 ECC con resultados a favor del uso de probióticos versus placebo (55.8 vs. 73.1%, respectivamente; con RR=0.79, IC 95%: 0.70-0.89) y un NNT con probióticos de 7. El uso de combinaciones de probióticos mantuvo el efecto benéfico sobre el placebo (RR=0.82; IC 95%: 0.69-0.98), con NNT=8. Algunas especies y cepas específicas también mostraron un efecto positivo sobre el placebo como los L. plantarum (RR=0.67; IC 95%: 0.51-0.87), Escherichia (RR: 0.86; IC 95%: 0.79-0.93) y S. faecium (RR=0.72; IC 95%: 0.53-0.99).
Nikfar et al.68 en un metaanálisis de 8 ECC en 1,011 pacientes con SII informaron una mejoría clínica a favor de los probióticos del 53 vs. 44.9% con placebo con un RR=1.22 (IC 95%: 1.07-1.4, p=0.0042).
Moayyedi et al.69 en una revisión sistemática de 19 ECC en 1,650 pacientes con SII mostraron que los probióticos fueron significativamente más eficaces que el placebo con un NNT=4.
Hoveyda et al.70 evaluaron 14 ECC, encontrando que los probióticos producen una mejoría global de los síntomas superior al placebo con un RM:1.6 (IC 95%: 1.2-2.2; p=0.0007; I2=27%).
McFarland y Dublin71 evaluaron 20 ECC en 1,404 pacientes con SII y sus resultados mostraron que los probióticos mejoran la percepción global de los síntomas en comparación con el placebo con un RR=0.77, IC 95%: 0.62-0.92 y con un NNT=7.3.
20. Algunas cepas específicas de probióticos mejoran el dolor, la distensión abdominal y la flatulencia en pacientes con SII.
Acuerdo total: 100%.
Las revisiones sistemáticas y metaanálisis de McFarland y Dublin71, Hoveyda et al.70, Moayyedi et al.69 y Ortiz-Lucas et al.72 mostraron que los probióticos son significativamente mejores que el placebo para el alivio del dolor abdominal, la distensión y las flatulencias pero no mejoran el pujo o la sensación de urgencia para defecar en pacientes con SII.
Por ejemplo, los probióticos en combinación o que contienen Bifidobacterium breve (B. breve), B. longum o L. acidophilus mejoran los puntajes del dolor abdominal. La distensión mejora con las cepas de B. infantis, L. casei o L. plantarum. Por otra parte, las cepas de B. breve, B. infantis, L. casei, L. plantarum, B. longum, L. acidophilus, L. bulgaricus y Streptococcus salivarius (S. salivarius) spp. thermophilus reducen los puntajes de flatulencias.
En la revisión sistemática y metaanálisis de Ford et al.67 los autores evaluaron el efecto de los probióticos en dolor abdominal en 24 ECC en 2,011 pacientes con SII. Los resultados mostraron que los probióticos reducen significativamente el dolor abdominal (DME=0.25; IC 95%:−0.36 a −0.14). Las cepas de Lactobacillus en 6 ECC no mostraron mejorar el dolor abdominal y 2 ECC con Bifidobacterium mostraron tendencia a la mejoría del dolor abdominal con probióticos (DME=−0.33; IC 95%: −0.90 a −0.24). La combinación de probióticos, en la evaluación de 15 ECC en 1,038 pacientes con SII, mejoró significativamente el dolor abdominal sobre el placebo (DME=−0.24; IC 95%: −0.37 a −0.12). En esta misma revisión, los probióticos resultaron ser significativamente superiores al placebo en la reducción de la distensión abdominal en 17 ECC (DME=−0.15; IC 95%: −0.27 a −0.03). Asimismo, los probióticos redujeron significativamente las flatulencias en 10 ECC en 741 pacientes con SII en comparación con el placebo (DME=−0.23; IC 95%: −0.38 a −0.07).
En niños20a. La administracio¿n de probio¿ticos es más efectiva que el placebo en el tratamiento del dolor abdominal asociado al SII.
Acuerdo total: 100%.
Korterink et al.63 evaluaron 5 estudios en 464 pacientes en los cuales se utilizaron diferentes cepas de probióticos que incluyeron Lactobacillus GG, L. reuteri DSM 17 938 y VSL#3 en pacientes con SII, DAF y DF. Horvath et al.64 analizaron 3 estudios para dolor abdominal crónico con un total de 290 niños y 3 en SII en 167 niños. En ambos metaanálisis se comprobó que los probióticos son más efectivos que el placebo en el tratamiento del dolor abdominal en niños con SII.
En adultos21. La administración de probióticos no mejora la consistencia de las heces ni la calidad de vida de los pacientes con SII.
Acuerdo total: 100%.
El metaanálisis de Ortiz-Lucas et al.72 incluyó 16 estudios que evaluaron el efecto de los probióticos sobre la consistencia de las heces en pacientes con SII. Los resultados mostraron que los probióticos que contienen B. breve, B. infantis, B. longum, L. acidophilus, L. bulgaricus, L. casei, L. plantarum, o especies de S. salivarius spp. thermophilus no mejoran la consistencia de las heces.
La mejoría en la calidad de vida tras la administración de probióticos en pacientes con SII no es un parámetro que se haya evaluado de forma consistente en los estudios. Así pues, solo en 2 revisiones70,72 se realizó una evaluación del efecto de los probióticos sobre la calidad de vida. En el estudio de Hoveyda et al. se incluyeron 4 estudios y aunque se encontró que los pacientes que recibieron probióticos tuvieron menores puntuaciones en las escalas utilizadas (cuestionarios IBS QoL, HAD, FDD QoL o RAND de 36 preguntas) comparados con los que recibieron placebo, esta diferencia no fue estadísticamente significativa. Ortiz-Lucas et al.72 informaron que de 12 estudios que evaluaron el efecto de los probióticos en la calidad de vida en pacientes con SII, en 7 no encontraron mejoría significativa en esta variable.
Estreñimiento crónicoEl estreñimiento crónico funcional es un trastorno digestivo frecuente que afecta aproximadamente al 14% de la población mundial. A pesar del uso de fibra dietética, laxantes, procinéticos u otros agentes, aproximadamente el 47% de los pacientes estreñidos no están satisfechos con estas modalidades de tratamiento73. Los probióticos por su efecto en la microbiota intestinal y la función motora del tubo digestivo han sido propuestos en el manejo del estreñimiento crónico funcional.
En adultos22. La administración de probióticos específicos en pacientes con estreñimiento crónico acelera el tránsito intestinal y aumenta la frecuencia de evacuaciones.
Acuerdo total: 94%; parcial: 6%.
Se identificaron 3 metaanálisis, el primero que incluyó 14 estudios aleatorizados y controlados con un total de 1,182 pacientes74, el segundo con 11 estudios y un total de 464 pacientes 75 y el tercero que analizó el SII con estreñimiento y el estreñimiento crónico, con un total de 245 pacientes67, además de una revisión sistemática que incluyó 5 ensayos clínicos en 266 adultos76.
En el primer metaanálisis se incluyeron 10 estudios donde se evaluó la frecuencia de las evacuaciones como objetivo primario de la intervención con probióticos y se demostró que, en comparación con los grupos controles, la administración de cepas específicas de probióticos incrementan en 1.3 (IC 95%: 0.7-1.9; p<0.0001; I2=90%) la frecuencia de evacuaciones por semana (p=0.00001) siendo la cepa de B. lactis la que favoreció un mayor incremento, de 1.5 (IC 95%: 0.7-2.3; p=0.0003). La consistencia de las evacuaciones se evaluó en 11 estudios con base en la escala de Bristol y se observó un cambio en la consistencia de heces de duras a heces blandas (RR=0.55; IC 95%: 0.27-0.82; p=0.0001; I2=80%). En el análisis por subgrupos, B. lactis mejoró en mayor medida la consistencia de las evacuaciones. En el metaanálisis de Dimidi et al.74 y Miller y Ouwehand75 se evaluó de manera objetiva el tránsito colónico con marcadores radioopacos y se observó que la administración de probióticos disminuyó el tiempo de tránsito en un promedio de 12.4h (IC 95%: −2.5 a −22.3; p=0.01; I2=23%). También, B. lactis fue el probiótico que favoreció una mayor reducción del tiempo de tránsito, sobre todo a nivel de rectosigmoides y no así en el colon derecho o izquierdo74,75.
Las cepas específicas que presentaron efectos favorables en el tránsito intestinal en sujetos con estreñimiento fueron B. lactis HN019 (2 ensayos) y B. lactis DN-173 010 (3 ensayos). Por otra parte, el efecto solo se demostró en participantes mayores de 40 años74.
En el metaanálisis de Ford et al.67 se incluyó un número limitado de ensayos clínicos en sujetos con estreñimiento crónico y se concluyó que el uso de probióticos, prebióticos y simbióticos tiene un valor incierto en estreñimiento crónico. La revisión sistemática de Chmielewska y Szajewska76 mostró un efecto favorable en adultos estreñidos del tratamiento con B. lactis DN-173 010, L. casei Shirota, y E. coli Nissle 1917 en la frecuencia y consistencia de las evacuaciones.
En niños22a. No existe evidencia de la eficacia de los probióticos en el tratamiento del estreñimiento funcional.
Acuerdo total: 100%.
La revisión sistemática de Korterink et al.63 incluyó 4 ECC en 282 pacientes pediátricos estreñidos. Los probióticos utilizados fueron LGG, L. casei DN 114 001, B. lactis DN-173 010 o B. longum con una duración de 3 a 12 semanas. Se concluyó que no existe evidencia que muestre que los probióticos sean más efectivos que el placebo respecto a la respuesta al tratamiento o incremento en la frecuencia de la defecación en niños estreñidos. Chmielewska y Szajewska76 tampoco encontraron un efecto benéfico de los probióticos en niños estreñidos.
Cólico infantil23. La evidencia es insuficiente para recomendar el uso de probióticos en el manejo del cólico infantil.
Acuerdo total: 50%; parcial: 30%. Desacuerdo parcial: 10%; total: 10%.
La revisión sistemática de Anabrees et al.77 evaluó 3 ECC en 209 lactantes alimentados con leche materna. El probiótico utilizado fue L. reuteri DSM 17938 por 21-28 días. Dos de los estudios fueron financiados por la industria. Los resultados mostraron que la suplementación con probióticos comparada con simeticona o placebo disminuyó significativa y progresivamente los períodos de llanto a 7 días logrando una meseta a las 3 semanas después del inicio del tratamiento (DME: −56.03min; IC 95%: −59.92 a −52.15). También los probióticos comparados con el placebo aumentaron el éxito terapéutico en el cólico infantil con un RR=0.06 (IC 95%: 0.01-0.25) y un NNT=2. En contraste, en un ECC reciente, con un tamaño de muestra significativamente mayor que en los estudios previos (n=167), Sung78 mostró que al mes de tratamiento los lactantes alimentados al seno materno o con fórmula, suplementados con L. reuteri DSM 17938 tuvieron un tiempo de duración diaria de llanto o queja continua (desenlace primario) 49min (IC 95%: 8-90min; p=0.02) más que el grupo tratado con placebo, especialmente en aquellos alimentados con fórmula. No hubo diferencias entre el probiótico y el placebo en los desenlaces secundarios como duración del llanto o queja continua, número de episodios de llanto o queja, duración del sueño, salud materna, funcionamiento familiar o del lactante, ni en la microbiota de los pacientes tratados.
Intolerancia a la lactosaLa absorción deficiente de lactosa es un trastorno frecuente que ocurre por la disminución de la actividad de la lactasa intestinal. La intolerancia a la lactosa se caracteriza por la presencia de síntomas abdominales como distensión, dolor, diarrea, meteorismo y flatulencia después de la ingesta de productos lácteos. El desarrollo de estos síntomas tiene relación con la dosis de lactosa, la expresión de lactasa, la microbiota intestinal y la sensibilidad del tubo digestivo. El manejo incluye la restricción en la ingesta de lácteos y uso de lactasa. Los probióticos han sido propuestos como agentes que mejoran los síntomas asociados al consumo de lactosa.
24. Algunas cepas específicas de probióticos mejoran los síntomas en pacientes intolerantes a la lactosa.
Acuerdo total: 93.75%; parcial: 6.25%.
Se identificaron 2 revisiones sistemáticas y un panel de expertos. Levri et al.79 en su revisión sistemática incluyeron 10 estudios con probióticos para analizar si la adición de probióticos a productos lácteos no fermentados disminuye la intolerancia a la lactosa. La mayoría de los estudios emplearon L. acidophilus. Los autores concluyen que los probióticos en general no reducen la intolerancia a la lactosa, aunque algunas concentraciones específicas podrían ser útiles. Shaukat et al.80 en su revisión sistemática sobre el tratamiento de individuos sintomáticos con intolerancia a la lactosa, incluyeron 7 estudios con 105 pacientes tratados con probióticos. Los autores concluyeron que no hay suficiente evidencia para determinar la efectividad del yogur o los probióticos para mejorar los síntomas de la intolerancia a la lactosa.
El Panel sobre Productos Dietéticos, Nutrición y Alergias de la Autoridad Europea de Seguridad Alimentaria (EFSA)81 evaluó si los cultivos vivos del yogur conteniendo L. delbrueckii subespecie bulgaricus y el S. thermophilus ayudan a la digestión de lactosa en individuos con absorción deficiente de lactosa. Con base en 14 estudios de intervención en humanos, el Panel concluyó que existe una relación causa efecto entre el consumo de yogur y la mejoría en la digestión de la lactosa en individuos con mala digestión de lactosa.
Enfermedad inflamatoria intestinalLa enfermedad inflamatoria intestinal comprende la enfermedad de Crohn y la colitis ulcerosa crónica idiopática (CUCI). Es un trastorno inflamatorio del aparato digestivo de fisiopatología compleja en donde participa una respuesta inmune anormal a la microbiota intestinal en un sujeto genéticamente susceptible82. El tratamiento estándar incluye antiinflamatorios, esteroides, inmunomoduladores y agentes biológicos. El interés reciente en la disbiosis asociada a la enfermedad inflamatoria intestinal ha fomentado el uso de probióticos asociados a la terapia estándar en el manejo de esta enfermedad.
En adultos25. El uso de probióticos no ha mostrado efectos benéficos consistentes en la inducción o mantenimiento de la remisión ni en la prevención de la recurrencia de la enfermedad de Crohn.
Acuerdo total: 100%.
En la revisión sistemática de Cochrane83 se incluyeron 7 estudios que evaluaron varias cepas de probióticos en pacientes con enfermedad de Crohn. Los resultados mostraron que la administración de E. coli Nissle no es útil para inducir la remisión (RR=0.83; IC 95%: 0.25-2.80; p=0.77) ni en la prevención de recaída posquirúrgica (RR=0.43; IC 95%: 0.15-1.20). La administración de Lactobacillus GG no mostró inducción a la remisión (RR=1.58; IC 95%: 0.30-8.40) ni la prevención de recurrencia de enfermedad de Crohn (RR=0.67; IC 95%: 0.13-3.30). Por otro lado, la administración de S. boulardii no fue efectiva para el mantenimiento de la remisión en pacientes con enfermedad de Crohn (RR=0.17; IC 95%: 0.02-1.23).
En otras 2 revisiones sistemáticas los resultados mostraron que el uso de probióticos no fue eficaz en la inducción a la remisión (RM=0.80; IC 95%: 0.04-17.20) así como tampoco en el mantenimiento en la remisión (RR=0.43; IC 95%: 0.15-1.20) en pacientes con enfermedad de Crohn83,84.
Recientemente se publicó un ensayo clínico, doble ciego y controlado con placebo que empleó una mezcla de 8 diferentes especies de probióticos llamado VSL#3 (4 cepas de Lactobacillus, 3 cepas de Bifidobacterium, y una cepa de S. salivarius subespecie thermophilus) en el que solo se observó una tendencia a la significación para reducir la recurrencia posquirúrgica de enfermedad Crohn en el 20.5% del grupo VSL#3 iniciado inmediatamente después de la cirugía comparado con el 42.1% del grupo VSL#3 iniciado un año después de la cirugía (p<0.05)85.
En adultos26. Algunas cepas específicas de probióticos son útiles para inducir y mantener la remisión en pacientes con CUCI con actividad leve o moderada.
Acuerdo total: 93.7%; incierto: 6.3%.
En un metaanálisis de 20 estudios clínicos controlados en los que utilizaron diversas cepas de probióticos, en especial el VSL#3, se mostró una respuesta clínica favorable con RR=1.72 (IC 95%: 1.35-2.20; p=0.43; I2=0%) y en el mantenimiento de la remisión (RR=1.56; IC 95%: 0.95-2.56; p=0.047; I2=58%) en pacientes con CUCI86.
En otro metaanálisis que incluyó 13 estudios clínicos controlados que utilizaron diversas cepas de probióticos en pacientes con CUCI, en 7 de estos se demostró que la tasa de inducción a la remisión en el grupo de probióticos tuvo un RR=2 (IC 95%: 1.35-2.96). En 8 estudios que evaluaron el mantenimiento de la remisión en pacientes con CUCI que recibieron tratamiento durante al menos 12 meses con probióticos se reportó un RR=1.36 (IC 95%: 1.07-1.73; I2=62%). En especial la administración de B. bifidum disminuyó la tasa de recaída con RR=0.25 (IC 95%: 0.12-0.50)87.
Finalmente, en el último metaanálisis publicado que analizó 23 estudios clínicos controlados con un total de 1,763 pacientes con CUCI se documentó aumento significativo en las tasas de inducción a la remisión (RR=1.51; IC 95%: 1.10-2.06; p=0.01). El mantenimiento de la remisión fue significativamente superior en el grupo de probióticos (RR=1.80; IC 95%: 1.36-2.39; p=0.0001; I2=4%). En el análisis por subgrupos por cepas de probióticos, solo se confirmó que el VSL#3 tuvo incremento significativo en las tasas de remisión comparado con el grupo control (RR=1.74; IC 95%: 1.19-2.55; p=0.004; I2=60%), así como también en el mantenimiento de la remisión o reducción de las recaídas (RR=0.18; IC 95%: 0.10-0.34; p<0.001)88.
27. Algunas cepas específicas de probióticos son efectivas para el mantenimiento de la remisión de la pouchitis después del tratamiento con antibióticos.
Acuerdo total: 93.75%; parcial: 6.25%.
En la revisión sistemática de Cochrane89 de 13 estudios que incluyeron 517 pacientes, se demostró que la administración de VSL#3 fue efectiva en el 85% de los pacientes comparado con el 3% del grupo placebo, para el mantenimiento de la remisión de la pouchitis crónica de 9-12 meses en pacientes con proctocolectomía y reservorio ileal (RR=20.24; IC 95%: 4.28-95.8).
Por otro lado, 2 estudios doble ciego, controlados con placebo demostraron la eficacia de VSL#3 a dosis de 450,000 millones de bacterias para mantener la remisión en pacientes con pouchitis crónica. En uno de ellos, 40 pacientes que presentaron la remisión clínica y endoscópica después de un mes de tratamiento de antibiótico combinado (rifaximina 2g/día+ciprofloxacina 1g/día), fueron aleatorizados para recibir VSL#3, 6g/día (18×1,011bacterias/día) o placebo durante 9 meses90. Todos los pacientes que recibieron placebo sufrieron alguna recaída, mientras que solo el 85% (17/20) fueron tratados con VSL#3 y se mantuvieron en remisión clínica y endoscópica al final del estudio comparado con el grupo placebo (p<0.001). En el otro estudio, 36 pacientes con pouchitis refractaria crónica que alcanzaron la remisión (índice de actividad de pouchitis=0) después de un mes de tratamiento de antibiótico combinado (metronidazol+ciprofloxacina) recibieron 6g/día de VSL#3 o placebo durante un año. La tasa de remisión fue del 85% a un año en el grupo tratado con VSL#3 comparado con el 6% del grupo placebo (p<0.001)91.
En niños27a. La evidencia para el uso de probióticos en la inducción de la remisión o mantenimiento de la enfermedad de Crohn, CUCI y pouchitis en pacientes pediátricos es insuficiente.
Acuerdo total: 90%; parcial: 10%.
El metaanálisis de Li et al.59 valuó 13 estudios de alta calidad metodológica, considerando pacientes adultos y niños, y concluyó que el uso de probióticos no generó un beneficio adicional en la terapia de inducción a la remisión en la colitis ulcerosa. Sin embargo, se menciona que los probióticos en el tratamiento de mantenimiento de colitis ulcerosa fueron mejores en comparación con placebo.
Shen et al.88 en su revisión sistemática concluyeron, con base en la evaluación de 23 estudios aleatorizados con un total de 1,763 participantes, que hubo una mayor tasa de remisión en los pacientes con pouchitis y colitis ulcerosa tratadas con la mezcla de probióticos VSL#3, al igual que una menor tasa de recurrencia de la enfermedad.
Ambos metaanálisis tienen población muy heterogénea por lo que en niños no puede establecerse ninguna recomendación en el manejo de la enfermedad inflamatoria intestinal.
Enfermedad diverticular del colonEl espectro de la enfermedad diverticular del colon incluye la diverticulosis asintomática, la diverticulitis aguda y la enfermedad diverticular sintomática no complicada. Diversas modalidades terapéuticas han sido ensayadas para prevenir los episodios de diverticulititis aguda y mejorar los síntomas en la enfermedad diverticular sintomática no complicada e incluyen fibra dietética, antiinflamatorios, antibióticos y probióticos92.
28. No existe evidencia suficiente para recomendar el uso de probióticos como monoterapia en la enfermedad diverticular sintomática no complicada ni en la prevención de la diverticulitis aguda.
Acuerdo total: 93.75%; parcial: 6.25%.
No hay ECC de calidad que evalúen el efecto de los probióticos en la enfermedad diverticular. Maconi et al.93 en una revisión sistemática de 31 estudios clínicos encontraron que en solo 4 de estos estudios se utilizaron probióticos para tratamiento o profilaxis en pacientes con enfermedad diverticular del colon. Estos 4 estudios abiertos, sin grupo placebo, que incluyeron un total de 235 pacientes demostraron un beneficio de la terapia combinada con mesalazina o balsalazida con un probiótico (L. casei o VSL#3) con ausencia de síntomas a 12 meses en el 90.5% de los pacientes; comparado con el 84.9% de los que recibieron mesalazina o balsalazida solas y el 75% de los que recibieron probióticos solos.
Estos mismos 4 estudios no mostraron diferencias significativas entre los diferentes tratamientos para prevenir episodios de diverticulitis aguda.
Enteritis por radiación29. La evidencia actual no apoya el uso el probióticos en la prevención y tratamiento de la enteritis por radiación.
Acuerdo total: 93.75%; parcial 6.25%.
En la revisión sistemática de Fuccio et al.94 evaluaron 3 ECC en 632 pacientes con enteritis postradioterapia. Los resultados no mostraron diferencias significativas en el manejo de la diarrea entre el grupo tratado con probióticos y los controles (RM=0.47; IC 95%: 0.13-1.67). Suadoni95 evaluó 4 ECC en 1,457 pacientes, predominantemente mujeres. Tres de estos estudios mostraron un efecto a favor de los probióticos en el manejo de la diarrea por radiación y uno de ellos no mostró beneficio con el uso de probióticos. Los estudios incluidos mostraron gran heterogeneidad con diferencias en la indicación de la radiación y los desenlaces terapéuticos.
La revisión sistemática y metaanálisis de Hamad et al.96 evaluó 10 estudios en 1,449 pacientes con enteritis por radiación. En 8 se comparó el uso de probióticos contra placebo o ningún tratamiento, y en 2 se compararon 2 tratamientos con probióticos. Los resultados agrupados de 6 de los 10 estudios mostraron beneficio a favor del uso de probióticos en el manejo de la diarrea (RM=0.44; IC 95%: 0.21-0.92; p=0.03; I2=77%) aunque con heterogeneidad significativa en estos estudios. No hubo diferencias significativas en la disminución del uso de loperamida (RM=0.29; IC 95%: 0.01-6.80; p=0.44; I2=93%) ni en la incidencia de evacuaciones líquidas (RM=0.36; IC 95%: 0.05-2.81; p=0.33; I2=84%) con el uso de probióticos.
Enterocolitis necrosante30. Independientemente de la edad gestacional y el estadio de la enterocolitis necrosante (ECN), el uso de probióticos podría reducir significativamente el riesgo de ECN en recién nacidos prematuros.
Acuerdo total: 100%.
Wang et al.97 en un metaanálisis evaluaron 20 ensayos clínicos, con un total de 3,861 prematuros. Los resultados mostraron una disminución del riesgo de presentar ECN en el grupo suplementado con probióticos (RR=0.33; IC 95%: 0.24-0.46; p<0.00001; I2=0%). Bernardo et al.98 en una revisión sistemática concluyen que los probióticos pueden prevenir la ECN en prematuros. En la revisión de Cochrane realizada por Alfaleh y Anabrees99 se incluyeron 19 ensayos clínicos con un total de 1,650 prematuros. Los autores concluyeron que la suplementación con probióticos previene la presentación de enterocolitis en prematuros. Yang et al.100 en el metaanálisis incluyeron a 6,655 niños pretérmino, concluyendo que independientemente de la edad gestacional, la suplementación con probióticos reduce el riesgo de ECN, sin que se presenten diferencias en la presencia de sepsis como efecto adverso. Dilli et al.101 realizaron un estudio en pacientes de muy bajo peso al nacimiento, concluyendo que B. lactis puede disminuir la presencia de ECN.
Alergia alimentaria31. La evidencia para recomendar el uso preventivo de probióticos en niños para enfermedades alérgicas o hipersensibilidad a alimentos es insuficiente.
Acuerdo total: 100%.
La revisión Cochrane de Osborn y Sinn102 incluyó 12 estudios, de los cuales 6 se evaluaron para desenlace de hipersensibilidad alimentaria, con un total de 2,080 lactantes, y reporte de evolución en 1,549 lactantes. El metaanálisis de 5 estudios que reportaron la evolución de 1,477 lactantes mostró una reducción significativa de eczema infantil (RR=0.82; IC 95%: 0.70-0.95), con heterogeneidad importante entre los estudios. Al restringir el análisis a los estudios que valoraron eczema atópico (confirmado con pruebas cutáneas de hipersensibilidad inmediata o IgE específica) los hallazgos ya no fueron significativos (RR=0.80; IC 95%: 0.21-1.02). Un metaanálisis103, que incluyó 29 estudios de probióticos suplementados a mujeres embarazadas, con lactancia materna y lactantes, mostró que los probióticos redujeron el riesgo de eczema, pero no encontraron evidencias de efectos en otras alergias.
32. La administración prenatal o posnatal de probióticos no previene la alergia alimentaria
Acuerdo total: 100%.
En un metaanálisis de 10 ECC que incluyeron 2,701 casos Kong et al.104 mostraron que el efecto preventivo de la suplementación prenatal o posnatal de probióticos en la prevención de alergias alimentarias no fue significativo, con un RR=0.88 (IC 95%: 0.76-1.03; p=0.11; I2=33%).
En el metaanálisis de Zuccotti et al.105 se encontró un efecto de reducción de frecuencia de eczema en lactantes tratados con probióticos, pero no hubo diferencias en términos de prevención de asma (RR=0.99; IC 95%: 0.77-1.27; p=0.95) sibilancias (RR=1.02; IC 95%: 0.89-1.17; p=0.76) o rinoconjuntivitis (RR=0.91; IC 95%: 0.67-1.23; p=0.53).
Pancreatitis agudaLa pancreatitis aguda origina un estado catabólico y promueve la aparición de respuesta inflamatoria sistémica y deterioro nutricional, por lo que el aporte de nutrientes es una maniobra terapéutica importante. Se sabe que los casos graves se benefician de recibir apoyo nutricioenteral. Este reduce significativamente la mortalidad, falla orgánica, infecciones y necesidad de intervenciones comparado con el apoyo parenteral, por lo que debe considerarse su uso en todos los casos de pancreatitis aguda grave que requieran apoyo nutricio106.
Existen diferentes fórmulas enterales, algunas de ellas adicionan componentes inmunomoduladores, incluso probióticos.
33. El uso de la alimentación enteral enriquecida con probióticos no ha demostrado utilidad en la pancreatitis aguda.
Acuerdo total: 93.7%; acuerdo parcial: 6.25%.
Una revisión Cochrane107 que evaluó diferentes fórmulas de nutrición enteral en pancreatitis aguda encontró resultados inconsistentes y contrarios entre los estudio evaluados, especialmente en relación con la ocurrencia de eventos adversos y complicaciones lo que pone en duda su seguridad. Los desenlaces evaluados fueron: a) Mortalidad (n=666; 6 estudios: RR=1.13; IC 95%: 0.66-1.91), b) Respuesta inflamatoria sistémica (n=223; 3 estudios: RR=1.07; IC 95%: 0.9-1.27), c) Falla orgánica (n=644; 5 estudios: RR=0.84; IC 95%: 0.67-1.04) y d) Eventos adversos (n=133; 2 estudios: RR=1.18; IC 95%: 0.33-4.2).
Un subgrupo de 9 pacientes que recibieron probióticos fallecieron debido a isquemia intestinal en comparación con ninguno del grupo control (n=298; un estudio de muy baja calidad).
Estos hallazgos no apoyan la administración o el uso de formulas de nutrición enteral enriquecidas con probióticos en pacientes con pancreatitis aguda que requieran de apoyo nutricio.
Enfermedades hepáticasHígado graso y esteatohepatitis no alcohólicaSe considera que el desarrollo de esteatohepatitis no alcohólica requiere de 2 eventos, primero la presencia de resistencia a la insulina que produce esteatosis hepática; y segundo, un evento que produzca estrés oxidativo y que desencadene y amplifique la cascada inflamatoria hepática. Existe evidencia tanto en modelos animales como en individuos con obesidad y esteatosis de que estos presentan frecuentemente sobrepoblación bacteriana intestinal; y que está estrechamente ligada al hígado graso no alcohólico108,109. El mecanismo involucra la producción de etanol, incremento en la permeabilidad intestinal a otras bacterias y ciertos lipopolisacáridos los cuales son inductores de la cascada inflamatoria mencionada. Además se ha documentado que el uso de antibióticos como metronidazol o tetraciclina disminuye el daño hepático inducido por la sobrepoblación bacteriana en animales y en individuos sometidos a derivación gastroyeyunal por obesidad mórbida110,111. La administración de probióticos en estos individuos, con el objetivo de lograr una inhibición competitiva de las cepas patógenas, buscaría disminuir el daño ocasionado por estas, así como una disminución en la permeabilidad intestinal anómala.
34. El uso de probióticos específicos mejora la inflamación hepática en esteatohepatitis no alcohólica y tiende a reducir los niveles de colesterol y la resistencia a la insulina en pacientes con hígado graso y esteatohepatitis no alcohólica.
Acuerdo total: 100%.
Se identificó un metaanálisis112 de 4 ECC que evaluó el efecto del uso de probióticos en hígado graso no alcohólico con diferentes cepas probióticas en 134 pacientes. Fue posible observar que hubo una disminución significativa en los parámetros indirectos de inflamación hepática tales como ALT (IC 95%: −33.46 a −13.95; p<0.00001), AST (IC 95%: −32.55 a −7; p=0.002), además de disminución en los niveles de factor de necrosis tumoral alfa (IC 95%: −0.48 a −0.17; p<0.0001) y colesterol total (IC 95%: −0.55 a −0.01; p=0.04), además de una disminución en el índice de resistencia a la insulina HOMA-IR (IC 95%: −0.73 a −0.19; p=0.0008). Cabe destacar que 3 de los 4 estudios tuvieron documentación histológica basal, pero solo uno posterior al tratamiento. Los probióticos utilizados fueron lactobacilos, bifidobacterium y estreptococos (L. bulgaricus, S. thermophilus, Lactobacillus GG, B. longum) y en 2 de ellos se agregaron fructooligosacáridos. La duración de la administración varió desde algunas semanas hasta algunos meses y uno de los 4 estudios fue realizado en población pediátrica. Finalmente cabe mencionarse que el tamaño de la muestra de pacientes fue pequeño.
35. Los probióticos mejoran las formas ocultas de encefalopatía hepática, la calidad de vida y reducen las concentraciones de amonio.
Acuerdo total: 100%.
Se identificaron 8 estudios metodológicamente adecuados113–120. Los probióticos se asociaron con mejora en las formas ocultas de encefalopatía hepática y profilaxis a formas manifiestas de encefalopatía (RR= 1.52%; IC 95%: 1-2.33).
Los estudios con probióticos mostraron disminución en los niveles de amonio (DME=−0.32; IC 95%: −0.54 a −0.11).
Los probióticos mejoraron el perfil psicosocial, la actividad física y la calidad de vida (DME= −3.13; IC 95%: −4.1 a −2.17).
36. Algunas cepas específicas de probióticos mejoran y previenen el desarrollo de la encefalopatía hepática manifiesta, pero no influyen sobre la mortalidad asociada a la enfermedad hepática.
Acuerdo total: 100%.
Se identificaron 5 estudios clínicos aleatorizados con diferentes cepas de probióticos. Dhiman et al.121 estudiaron en pacientes con episodio previo de encefalopatía hepática manifiesta el uso de probióticos: VSL#3 mostró una recaída menor a un cuadro nuevo de encefalopatía hepática (34.8% con probióticos vs. 51.6% con placebo) (RR=0.65; IC 95%: 0.38-1.11; p=0.12); menor número de hospitalizaciones por encefalopatía hepática (19.7 vs. 42.2%, respectivamente) (RR=0.45; IC 95%: 0.23-0.87; p=0.02) o complicaciones de cirrosis (24.2 vs. 45.3%) (RR=0.52; IC 95%: 0.28-0.95; p=0.034)10.
Liu et al.113 estudiaron a 55 cirróticos con EHO confirmada por pruebas neuropsicológicas y potenciales auditivos. Se administró un tratamiento simbiótico por 30 días consistente en Pediococcus pentosaceus, Leuconostoc mesenteroides, Lactobacillus paracasei subspecies paracasei 19 y L. plantarum 2592, a dosis de 1010UFC combinado con 10g de fibra fermentable (beta glucan, 2.5g; inulina, 2.5g; pectina, 2.5g; y fibra fermentable 2.5g). Los pacientes cirróticos con encefalopatía presentaron mejoría substancial en la microbiota intestinal, manifestado por descenso en cepas de E. coli y Staphylococcus. El tratamiento simbiótico incrementó el contenido fecal de especies de Lactobacillus no productores de ureasa. Hubo una reducción en los niveles de amonio y corrección de las formas ocultas de encefalopatía hepática en el 50% de los casos. Además, hubo una reducción significativa en los niveles circulantes de endotoxinas y mejoría en el estadio Child-Pugh en la mitad de los casos tratados con simbióticos. No se observaron cambios significativos en estas variables en el grupo de tratamiento con fibra fermentable y grupo placebo.
Bajaj et al.114 en un estudio de 25 pacientes asignando 17 a tratamiento con yogur y a 8 con placebo por 60 días en pacientes con cirrosis compensada Child A y EHO. Los pacientes en tratamiento con yogur mejoraron la EHO (71 vs. 0%; p=0.003), con mejora en las pruebas neuropsicológicas. Durante el seguimiento el 25 vs. 0% de los pacientes presentaron encefalopatía clínicamente evidente. La adherencia al tratamiento fue del 80%11. Sharma et al.115 estudiaron a 105 pacientes cirróticos con EHO, el 37.4% Child A, el 37.9% Child B y el 24.7% Child C. Aleatoriamente recibieron lactulosa (grupo A) vs. probióticos (una cápsula 3 veces al día, la cual contenía Streptococcus faecalis 60 millones, Clostridium butyricum 4 millones, Bacillus mesentericus 2 millones, bacilos ácido láctico 100 millones (grupo B), y un tercer grupo de lactulosa más probióticos (grupo C). El tratamiento se administró por 30 días. La normalización en las pruebas psicométricas y en los potenciales evocados fue evidente en el grupo tratado con probióticos.
Sharma et al.119 evaluaron a 206 pacientes cirróticos, 124 (60.19%) con EHO. Entre los pacientes con EHO (87), el 70.16% tenían frecuencia crítica de parpadeo (conocida como flicker en inglés)<39Hz, 112 (90.32%) tenían pruebas neuropsicológicas alteradas y 75 (60.48%) ambas pruebas alteradas. Se administró tratamiento con rifaximina al grupo A, probióticos al grupo B, L ornitina L aspartato al grupo C, y placebo al grupo D.
El grupo en tratamiento con probióticos recibió cápsulas con L. acidophilus, L. rhamnosus, L. plantarum, L. casei, B. longum, B. infantis, B. breve, S. boulardii y S. thermophilus. El tratamiento se administró por 2 meses y se evidenció mejoría del 50% (16/32), con p<0.05 cuando se comparó con el grupo placebo9.
Nutrición infantil37. Los datos científicos disponibles sugieren que la administración de probióticos en fórmulas infantiles no plantea preocupaciones de seguridad con respecto a efectos adversos. Sin embargo, en la actualidad, hay datos insuficientes para recomendar el uso rutinario de fórmulas infantiles suplementadas con probióticos.
Acuerdo total: 100%.
Una revisión sistemática de Mugambi et al.122 incluyó 3 estudios con simbióticos (n=475), 10 estudios con probióticos (n=933) y 12 estudios con prebióticos (n=1,563). Los probióticos en fórmulas infantiles no tuvieron un efecto significativo en el crecimiento, frecuencia y consistencia de evacuaciones y no redujeron la incidencia de diarrea, cólico, regurgitaciones, llanto, inquietud o vómito, por lo que concluyen que la suplementación de las fórmulas infantiles con probióticos para recién nacidos y lactantes de término no se asocia a un incremento en el crecimiento o a efectos clínicos favorables.
Otra revisión sistemática de Mugambi et al.123, sobre uso de fórmulas infantiles para lactantes pretérmino o de bajo peso al nacimiento, incluyó 4 estudios con probióticos (n=2,112) y 4 con prebióticos(n=126). En el grupo suplementado con probióticos no se encontraron diferencias significativas en el incremento de peso (DME=1.96; IC 95%: −2.64 a 6.56), alimentación enteral máxima (DME=35.20; IC 95%: −7.61 a 78.02) y el número de evacuaciones por día aumentó significativamente (DME=1.60; IC 95%: 1.20-2).
La ESPGHAN publicó en 2011124 una revisión sistemática en la que concluye que los datos científicos disponibles indican que: a) la suplementación de probióticos en fórmulas infantiles para niños sanos no plantea preocupaciones de seguridad con respecto al crecimiento y los efectos adversos, b) la administración de probióticos en fórmulas infantiles en lactantes pequeños (≤4 meses de edad) no tiene efectos clínicos claros, y c) aunque algunos probióticos adicionados a fórmulas infantiles en forma aislada o en combinación pueden tener efectos clínicos benéficos, no se recomienda el uso rutinario de fórmulas suplementadas con probióticos para lactantes.
38. El uso de probióticos en mujeres embarazadas que amamantan a sus bebés puede reducir el riesgo de eczema en los niños. Sin embargo, la evidencia es insuficiente.
Acuerdo total: 91%; acuerdo parcial: 8.33%; incierto 8.33%.
El metaanálisis de Cuello-Garcia et al.103 incluyó 29 estudios de probióticos suplementados a mujeres embarazadas, con lactancia materna y en lactantes. Los probióticos redujeron el riesgo de eczema cuando fueron usados en el tercer trimestre del embarazo (RR=0.71; IC 95%: 0.60-0.84), en madres que amamantaban a sus pequeños (RR=0.57; IC 95%: 0.47-0.69) o cuando se administraron a lactantes (RR=0.80; IC 95%:0.47-0.69). No se encontraron evidencias de efectos en otras alergias, estado nutricional o incidencia de efectos adversos.
Otro metaanálisis105 incluyó 17 estudios y reportó datos de 4,755 niños (2,381 en el grupo probiótico y 2,374 en el grupo control). Los lactantes tratados con probióticos tuvieron un RR significativamente más bajo para eczema comparado con los controles (RR=0.78; IC 95%: 0.69-0.8; p=0.0003). No hubo diferencias en términos de prevención de asma (RR=0.99; IC 95%: 0.77-1.27; p=0.95), sibilancias (RR=1.02; IC 95%: 0.89-1.17; p=0.76), o rinoconjuntivitis (RR=0.9; IC 95%: 0.67-1.23; p=0.53). Los resultados del metaanálisis muestran que la suplementación de probióticos previene el eczema infantil.
La Organización Mundial de Alergias (WAO por sus siglas en inglés) publicó en 2015125 una guía del uso de probióticos en la prevención de enfermedad alérgica en la que sugiere: a) usar probióticos en mujeres embarazadas con alto riesgo de tener un hijo alérgico, b) usar probióticos en mujeres que amamantan a niños con alto riesgo de desarrollar alergia, y c) usar probióticos en lactantes con alto riesgo de desarrollar alergia.
ConclusionesLos probióticos, por sus múltiples mecanismos de acción, han demostrado ser efectivos en la prevención de enfermedades infecciosas, inflamatorias y funcionales del aparato digestivo. La especificidad de cepa y la indicación en la entidad clínica precisa evaluada en los ECC son determinantes para el uso adecuado de los probióticos. El grupo de consenso mexicano sobre probióticos recomienda su uso en los siguientes trastornos gastrointestinales: en la prevención de la DAA, en el tratamiento de la diarrea aguda infecciosa, en la prevención de ICD y ECN, para disminuir los eventos adversos de la terapia de erradicación del H. pylori, para el alivio de los síntomas del SII, en el estreñimiento funcional del adulto, para inducir y mantener la remisión en pacientes con CUCI y pouchitis del adulto y en el tratamiento de la EHO y manifiesta.
FinanciaciónAgradecemos al Instituto Danone el apoyo económico para la realización de la reunión inicial de los integrantes del consenso. Esta organización no influyó en el diseño y conducción del consenso, ni en la recopilación, manejo, análisis, o interpretación de los resultados, tampoco en la preparación y redacción del documento para publicación.
Conflicto de interesesMiguel A. Valdovinos es miembro del Consejo Asesor de Biocodex, Mayoly-Spindler, Takeda y Commonwealth. Es conferencista para Takeda, Ferrer, Mayoly-Spindler, Danone, Columbia, Biocodex. Ha recibido apoyo para el desarrollo académico de Takeda, Alfa Wassermann, Danone.
Ericka Montijo es conferencista para Mead Johnson, Danone y Biocodex.
Ana Teresa Abreu y Abreu es miembro del Consejo Asesor de laboratorios Sanofi, Takeda, Mayoly-Spindler, Almirall. Conferencista para Takeda, Sanofi, Mayoly-Spindler, Alfa Wassermann, Almirall, Carnot, Biocodex. Ha recibido apoyo para el desarrollo académico de Takeda, Sanofi, Asofarma, Biocodex, Danone.
Sollange Heller es miembro del Consejo Asesor de Mayoly-Spindler, conferencista de Mead Johnson Nutricionales, Novamil (Bayer), Mayoly-Splinder, Biocodex.
María Victoria Bielsa Fernández es conferencista para Alfa-Wassermann y Almirall. Miembro de Consejo Asesor de Alfa-Wassermann.
Francisco Bosques-Padilla es miembro del Consejo Asesor de Laboratorios Takeda y ponente para laboratorios Abvie, Janssen y Bristol-Myers Squibb México
Ramón Carmona-Sánchez es miembro del Consejo Asesor de Mayoly-Spindler. Ponente para Mayoly-Spindler y Asofarma.
Alejandra Consuelo es miembro del Consejo Asesor de Laboratorios Sanofi y conferencista de Sanofi y Mead Johnson Nutrition.
Enrique Coss-Adame es ponente de Laboratorios Takeda de México. Ha sido consultante y colabora con Laboratorios Asofarma de México.
José Antonio Chávez Barrera es miembro del Consejo Asesor de Mayoly-Splinder, Nestlé, Mead Johnson, Aspen, Sanfer, Carnot, Italmex y Takeda. Conferencista para laboratorios Nestlé, Aspen, Mead Johnson, Bayer, Sanfer, Astra Zeneca, Carnot, Italmex, Mayoly-Splinder y Takeda.
Mauricio de Ariño es conferencista para Takeda.
Octavio Gómez Escudero es miembro del Consejo Asesor de Laboratorios Almirall y conferencista para laboratorios Takeda, Astra-Zéneca, Almirall, Asofarma, Alfa-Wassermann.
María Sarai González-Huezo es miembro del Consejo Asesor de Bayer, Bristol, Roche y Janssen Cilag. Es conferencista para Bayer, Roche, Janssen, Merck.
María Eugenia Icaza Chávez es miembro del Consejo Asesor de Mayoly-Spindler. Conferencista para Mayoly-Spindler y Asofarma.
Miguel Morales Arámbula es conferencista para Takeda y Almirall.
Jaime Ramírez-Mayans es conferencista para Biocodex.
José María Remes-Troche es miembro del Consejo Asesor de Takeda Pharmaceuticals, Alfa-Wassermann y Almirall. Ponente para Takeda, Asofarma, Alfa-Wassermann, Almirall y Astra-Zeneca.
Eric Toro es conferencista para Sanofi y Mead Johnson Nutricionales.
Aldo Torre Delgadillo es conferencista de Merz Pharma y recibe apoyo para la investigación de Medix.
Rodrigo Vázquez Frías es conferencista y ha recibido apoyo para la investigación de Alexión, Mayoly-Spindler, Nestlé y Sanofi
Jesús Kazuo Yamamoto Furusho es miembro del Consejo Asesor de Takeda, Abbvie, Schering, MSD, Ferring, Pfizer, Janssen y Hospira. Es conferencista para Takeda, Abbvie, Schering, MSD, Janssen, Danone, Farmasa, Ferring, Novartis, Astra. Ha sido investigador y recibido fondos para la investigación por los laboratorios Bristol, Icon y Pfizer.
Francisco Guarner es miembro del Comité Científico del Instituto Danone en España y miembro del Consejo Asesor de Biocodex y Clasado. Ha participado en eventos educacionales financiados por Danone, Biocodex, Sanofi, Stada, Casen-Recordati, Ferring y Abbvie.
Alejandro González Garay, Dante Bacarreza, María del Carmen Bojórquez-Ramos, Ana I. Burguete-García, Judith Flores-Calderón, Alfredo Larrosa Haro, Chiharu Murata, Mario Peláez Luna, Martha Eugenia Urquidi Rivera declaran no tener conflicto de intereses.